
účinne odstraňuje z plazmy hemodialýzou (po 4-hodinovej hemodialýze klesnú plazmatické koncentrácie pregabalínu asi o 50%). Vzhľadom na to, že eliminácia obličkami je hlavným spôsobom eliminácie, je potrebné zníženie dávky u pacientov s poruchou funkcie obličiek a doplnková dávka po hemodialýze (pozri časť 4.2 tabuľka 1).
Porucha funkciepečene
Neboli vykonané žiadne špecifické farmakokinetické štúdie u pacientov s poruchou funkcie pečene. Keďže pregabalín nepodlieha signifikantnému metabolizmu a vylučuje sa prednostne v nezmenenej forme močom, neočakáva sa, že by poškodenie funkcie pečene signifikantne menilo plazmatické koncentrácie pregabalínu.
Pediatrická populácia
Farmakokinetika pregabalínu bola vyhodnocovaná u pediatrických pacientov s epilepsiou (vekové
skupiny: 1 až 23 mesiacov, 2 až 6 rokov, 7 až 11 rokov a 12 až 16 rokov) pri hladinách dávky 2,5; 5;
10 a 15 mg/kg/deň vo farmakokinetickej štúdii a štúdii znášanlivosti.
Po perorálnom podaní pregabalínu u pediatrických pacientov nalačno, bol čas do dosiahnutia maximálnej plazmatickej koncentrácie vo všeobecnosti podobný v rámci všetkých vekových skupín a dosiahol sa 0,5 hodiny až 2 hodiny po podaní dávky.
Parametre Cmax a AUC pregabalínu sa zvyšovali priamo úmerne so zvyšujúcou sa dávkou v rámci každej vekovej skupiny. AUC bola nižšia o 30 % u pediatrických pacientov s telesnou hmotnosťou menej ako 30 kg z dôvodu klírensu upraveného na základe telesnej hmotnosti zvýšeného o 43 %
u týchto pacientov v porovnaní s pacientmi s telesnou hmotnosťou ≥ 30 kg.
Terminálny polčas pregabalínu sa pohyboval v priemere od 3 do 4 hodín u pediatrických pacientov vo veku do 6 rokov a od 4 do 6 hodín u tých, ktorí boli vo veku 7 rokov a starší.
Analýza populačnej farmakokinetiky preukázala, že klírens kreatinínu bol významným vedľajším parametrom klírensu pregabalínu po perorálnom podaní, telesná hmotnosť bola významným vedľajším parametrom zdanlivého distribučného objemu pregabalínu po perorálnom podaní a tieto vzťahy boli podobné u pediatrických a dospelých pacientov.
Farmakokinetika pregabalínu u pacientov mladších ako 3 mesiace nebola skúmaná (pozri časti 4.2,
4.8 a 5.1).
Staršieosoby(vo veku nad 65 rokov)
Klírens pregabalínu má tendenciu klesať so stúpajúcim vekom. Tento pokles klírensu pregabalínu je v súlade s poklesom klírensu kreatinínu, ktorý je podmienený stúpajúcim vekom. Zníženie dávky pregabalínu sa môže vyžadovať u pacientov pri vekom podmienenej poruche funkcie obličiek (pozri časť 4.2 tabuľka 1).
Dojčiacematky
Farmakokinetika 150 mg pregabalínu podávaných každých 12 hodín (300 mg denná dávka) bola vyhodnocovaná u 10 žien počas laktácie, ktoré boli aspoň 12 týždňov po pôrode. Laktácia mala malý až žiadny vplyv na farmakokinetiku pregabalínu. Pregabalín sa vylučoval do materského mlieka
s priemernými koncentráciami v ustálenom stave približne 76% z plazmatických koncentrácií
u matiek. Odhadovaná dávka u dojčaťa z materského mlieka (za predpokladu priemernej konzumácie
mlieka 150 ml/kg/deň) žien užívajúcich 300 mg/deň by bola 0,31 mg/kg/deň alebo 0,62 mg/kg/deň
u žien užívajúcich maximálnu dávku 600 mg/deň. Tieto odhadované dávky predstavujú približne 7%
celkovej dennej dávky u matky v mg/kg.
5.3 Predklinické údaje o bezpečnosti
V obvyklých farmakologických štúdiách bezpečnosti u zvierat bol pregabalín dobre tolerovaný
v klinicky relevantných dávkach. V štúdiách toxicity po opakovanom podávaní u potkanov a opíc sa pozorovali účinky na CNS vrátane hypoaktivity, hyperaktivity a ataxie. Zvýšená incidencia atrofie retiny, bežne pozorovaná u starnúcich potkaních albínov, sa zistila po dlhodobej expozícii pregabalínu v dávkach ≥ 5-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke.
Pregabalín nebol teratogénny u myší, potkanov ani u králikov. Fetálna toxicita u potkanov a králikov
sa vyskytla iba pri dávkach dostatočne prevyšujúcich dávku pre človeka.
V prenatálnych/postnatálnych štúdiách toxicity pregabalín vyvolával vývojovú toxicitu u potomkov potkanov v dávkach > 2-krát vyšších, než je odporúčaná maximálna dávka pre človeka.
Nežiaduce účinky na fertilitu u samčekov a samičiek potkanov sa pozorovali iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia. Nežiaduce účinky na samčie reprodukčné orgány a parametre spermií boli reverzibilné a vyskytli sa iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia, alebo boli spojené so spontánnymi degeneratívnymi procesmi na samčích reprodukčných orgánoch u potkana. Preto sa týmto účinkom pripisuje malý alebo žiadny klinický význam.
Na základe výsledkov mnohých in vitro a in vivo skúšok možno prehlásiť, že pregabalín nie je
genotoxický.
Dvojročné štúdie karcinogenicity s pregabalínom boli vykonané na potkanoch a myšiach. Nepozorovali sa žiadne nádory u potkanov v dávkach až do 24-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke 600 mg/deň. U myší sa nezistil zvýšený výskyt nádorov v dávkach podobných priemernej dávke u človeka, ale zvýšený výskyt hemangiosarkómov sa pozoroval pri vyšších dávkach. Negenotoxický mechanizmus tvorby pregabalínom indukovaných nádorov u myší zahrňuje zmeny krvných doštičiek a súvisiacu proliferáciu endoteliálnych buniek. Tieto zmeny krvných doštičiek neboli prítomné u potkanov alebo u ľudí na základe krátkodobých
a limitovaných dlhodobých klinických údajov. Neexistuje dôkaz, ktorý by naznačoval súvisiace riziko
u ľudí.
U mladých potkanov sa druhy toxicity kvantitatívne nelíšili od tých, ktoré sa pozorovali u dospelých potkanov. Avšak mladé potkany sú oveľa senzitívnejšie. Pri terapeutických dávkach sa dokázali klinické príznaky hyperaktivity CNS a bruxizmus a niektoré zmeny v raste (prechodné potlačenie prírastku telesnej hmotnosti). Účinky na pohlavný cyklus sa pozorovali pri 5-násobku terapeutickej dávky u človeka. Znížená odpoveď na akustický podnet sa pozorovala u mladých potkanov 1 –
2 týždne po expozícii pri > 2-násobku terapeutickej dávky u človeka. Deväť týždňov po expozícii sa už tento účinok viac nepozoroval.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsúl hydroxypropylcelulóza, kukuričný škrob, mastenec
O
bal kapsúl
žltý oxid železitý (E172), oxid titaničitý (E171), erytrozín (E127),
želatína,
nátriumlaurylsulfát
Atrament
šelak,
čierny oxid železitý (E172),
makrogol,
roztok amoniaku, koncentrovaný, hydroxid draselný
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC/Al blistre obsahujúce 14, 21, 56, 84 alebo 100 tvrdých kapsúl.
PVC/PVDC/Al blistre s perforáciou obsahujúce 56 x 1, 84 x 1 alebo 100 x 1 tvrdú kapsulu,
umožňujúce oddelenie jednotlivej dávky.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Generics [UK] Limited
Station Close Potters Bar Hertfordshire EN6 1TL Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/15/997/001
EU/1/15/997/002
EU/1/15/997/003
EU/1/15/997/004
EU/1/15/997/005
EU/1/15/997/006
EU/1/15/997/007
EU/1/15/997/008
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/
1. NÁZOV LIEKU
Pregabalin Mylan 50 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jedna tvrdá kapsula obsahuje 50 mg pregabalínu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá kapsula
Nepriesvitné želatínové kapsuly veľkosti 3 s tvrdým obalom, s bielym telom a viečkom tmavobroskyňovej farby, obsahujúce biely až takmer biely prášok. Na viečku a tele kapsuly je pozdĺž jej osi čiernym atramentom vytlačený nápis MYLAN a pod ním označenie PB50.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Epilepsia
Pregabalin Mylan je indikovaný ako prídavná liečba u dospelých s parciálnymi záchvatmi so sekundárnou generalizáciou alebo bez sekundárnej generalizácie.
Generalizovaná úzkostná porucha
Pregabalin Mylan je indikovaný na liečbu generalizovanej úzkostnej poruchy (GAD = Generalised
Anxiety Disorder) u dospelých.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Rozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
Epilepsia
Liečbu pregabalínom možno začať dávkou 150 mg denne, ktorá sa podáva rozdelená v dvoch alebo troch dávkach. Podľa individuálnej odpovede pacienta a tolerancie možno dávku po 1 týždni zvýšiť na
300 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Generalizovaná úzkostná porucha
Rozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach. Potreba liečby sa musí pravidelne opakovane posúdiť.
Liečbu pregabalínom možno začať dávkou 150 mg denne. Podľa individuálnej odpovede pacienta
a tolerancie možno dávku po 1 týždni zvýšiť na 300 mg denne. Po ďalšom týždni možno dávku zvýšiť
na 450 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Ukonč eni e l i eč by pr egabal í nom
V súlade so súčasnou klinickou praxou, ak sa musí liečba pregabalínom ukončiť, odporúča sa, aby sa to urobilo postupne počas minimálne 1 týždňa bez ohľadu na indikáciu (pozri časti 4.4 a 4.8).
O
sobitné populácie
 Pacienti s poruchou f unkc i e obl i či ek
Pacienti s poruchou f unkc i e obl i či ek
Pregabalín sa zo systémovej cirkulácie primárne eliminuje v nezmenenej forme renálnou exkréciou. Keďže klírens pregabalínu je priamo úmerný klírensu kreatinínu (pozri časť 5.2), dávka u pacientov s poruchou funkcie obličiek sa musí znižovať individuálne podľa klírensu kreatinínu (CLcr), ako je uvedené v tabuľke 1 použitím nasledovného vzorca:
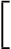
CLcr(ml/min) =
1,23 × [140 – vek (roky)] × hmotnoť (kg)
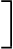
kreatinín v sére (µmol/l)
(× 0,85 u žien)
Pregabalín možno efektívne odstrániť z plazmy hemodialýzou (50% lieku počas 4 hodín).
U hemodialyzovaných pacientov sa denná dávka pregabalínu musí upraviť podľa funkcie obličiek. K dennej dávke treba pridať doplnkovú dávku okamžite po každej 4-hodinovej hemodialýze (pozri tabuľku 1).
Tabuľka 1 Úprava dávky pregabalínu podľa funkcie obličiek
Klírens kreatinínu
(CLcr) (ml/min)
|
Celková denná dávka pregabalínu *
|
Dávkovací režim
|
| Začiatočná dávka
(mg/deň)
| Maximálna dávka
(mg/deň)
|
|
≥ 60
| 150
| 600
| BID alebo TID
|
≥ 30 – < 60
| 75
| 300
| BID alebo TID
|
≥ 15 – < 30
| 25 – 50
| 150
| Jedenkrát denne alebo BID
|
< 15
| 25
| 75
| Jedenkrát denne
|
Doplnkové dávkovanie po hemodialýze (mg)
|
| 25
| 100
| Jednorazová dávka+
|
TID = tri rozdelené dávky
BID = dve rozdelené dávky
* Celková denná dávka (mg/deň) sa má rozdeliť podľa dávkovacieho režimu a vyjadriť v mg/dávka
+ Doplnková dávka je jedna dodatočná dávka
Pacienti s poruchou f unkc i e pe če ne Nevyžaduje sa žiadna úprava dávky u pacientov s poruchou funkcie pečene (pozri časť 5.2).
Pediatrická populáciaBezpečnosť a účinnosť Pregabalinu Mylan u detí mladších ako 12 rokov a u dospievajúcich (vo veku
12 – 17 rokov) neboli stanovené. Údaje dostupné v súčasnosti sú uvedené v časti 4.8, 5.1 a 5.2, ale nie
je možné vykonať odporúčanie týkajúce sa dávkovania.
St arš ie osoby (vo veku nad 65 rokov)Starší pacienti môžu vyžadovať zníženie dávky pregabalínu z dôvodu zníženej renálnej funkcie (pozri
pacienti s poruchou funkcie obličiek).
Spôsob podávaniaPregabalin Mylan sa môže užívať s jedlom alebo bez jedla. Pregabalin Mylan je určený iba na perorálne použitie.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Diabetickí pacienti
Podľa súčasnej klinickej praxe u niektorých diabetických pacientov s prírastkom hmotnosti počas liečby pregabalínom môže byť potrebné upraviť hypoglykemickú liečbu.
Reakcie z precitlivenosti
Po uvedení lieku na trh boli zaznamenané hlásenia o rekciách z precitlivenosti vrátane prípadov angioedému. Liečba pregabalínom sa musí okamžite ukončiť, ak sa vyskytnú príznaky angioedému, ako sú faciálny, periorálny opuch alebo opuch horných dýchacích ciest.
Závrat, somnolencia, strata vedomia, zmätenosť a ment ál ne poš kode ni e
Liečba pregabalínom sa dáva do súvisu so závratom a somnolenciou, ktoré mohli zvýšiť výskyt náhodných zranení (pádov) u staršej populácie. Existujú tiež hlásenia po uvedení lieku na trh o strate vedomia, zmätenosti a mentálnom poškodení. Preto pacientom sa má poradiť, aby boli opatrní, pokým sa neoboznámia s možnými účinkami lieku.
Úči nky spoj ené s videním
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní dávkovania. V klinických štúdiách, v ktorých bolo zahrnuté aj oftalmologické vyšetrenie, bol výskyt zníženia zrakovej ostrosti a zmien zorného poľa väčší u pacientov liečených pregabalínom ako
u pacientov liečených placebom; výskyt zmien na očnom pozadí bol väčší u pacientov liečených
placebom (pozri časť 5.1).
Po uvedení lieku na trh boli tiež hlásené nežiaduce reakcie na zrak, vrátane straty zraku, rozmazaného videnia alebo iných zmien zrakovej ostrosti, z ktorých mnohé boli prechodné. Prerušenie liečby pregabalínom môže viesť k vymiznutiu alebo zlepšeniu týchto zrakových príznakov.
Renálne zlyhávanie
Boli hlásené prípady renálneho zlyhávania a v niektorých prípadoch prerušenie liečby pregabalínom
viedlo k reverzibilite tejto nežiaducej reakcie.
Vysade ni e s účas ne podáv anýc h ant i epi l ept í k
Nie sú dostatočné údaje týkajúce sa vysadenia súčasne podávaných antiepileptík, akonáhle sa po
pridaní pregabalínu dosiahne kontrola záchvatu tak, aby bolo možné podávať pregabalín
v monoterapii.
Príznaky z vysadenia
Po ukončení krátkodobej a dlhodobej liečby pregabalínom boli u niektorých pacientov pozorované príznaky z vysadenia. Uvádzajú sa nasledujúce účinky: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, nervozita, depresia, bolesť, kŕče, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tom informovaný na začiatku liečby.
Počas užívania pregabalínu alebo krátko po ukončení liečby pregabalínom sa môžu vyskytnúť kŕče
vrátane epileptických záchvatov a záchvatov typu grand mal.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
K
ongestívne srdcové zlyhávanie
Po uvedení lieku na trh boli hlásené prípady kongestívneho srdcového zlyhávania u niektorých pacientov dostávajúcich pregabalín. Tieto reakcie sú najčastejšie pozorované u starších pacientov
s kardiovaskulárnymi ochoreniami počas liečby pregabalínom na neuropatickú indikáciu. Pregabalín
sa má u týchto pacientov podávať s opatrnosťou. Ukončenie podávania pregabalínu môže viesť
k odozneniu reakcie.
Než i aduce re akc i e u pac i ent ov s porane ní m mi ec hy
Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy. Možno to pripísať aditívnemu účinku v dôsledku súbežnej liečby inými liekmi (napr. liekmi proti spasticite), ktoré je potrebné užívať pri tomto ochorení.
Samovr aže dné myšl i enk y a správanie
Samovražedné myšlienky a správanie boli hlásené u pacientov liečených antiepileptikami pri niekoľkých indikáciách. Meta-analýza randomizovaných placebom kontrolovaných štúdií antiepileptík tiež ukázala málo zvýšené riziko samovražedných myšlienok a správania. Mechanizmus tohto rizika
nie je známy a dostupné údaje nevylučujú možnosť zvýšeného rizika u pregabalínu.
Pacienti majú byť preto sledovaní kvôli prejavom samovražedných myšlienok a správania a má sa u nich zvážiť vhodná liečba. Pacienti (a ich opatrovatelia) majú byť upozornení, aby vyhľadali lekársku pomoc, ak sa prejavy samovražedných myšlienok alebo správania objavia.
Zhorše ná funkcia dolného tráviaceho traktu
Po uvedení lieku na trh boli hlásené prípady týkajúce sa zhoršenej funkcie dolného tráviaceho traktu (napr. intestinálna obštrukcia, paralytický ileus, obstipácia), keď sa pregabalín podával spolu s liekmi, ktoré môžu spôsobovať obstipáciu, ako sú napr. opioidné analgetiká. Keď sa bude pregabalín užívať
v kombinácii s opioidmi, môžu sa zvážiť opatrenia na predchádzanie obstipácii (zvlášť u žien
a starších pacientov).
Zneuži t i e , sklon k nadmer nému uží vani u l i ek ov al ebo z ávi sl osť
Boli hlásené prípady zneužitia, nadmerného užívania liekov a závislosti. Treba byť opatrný
u pacientov s anamnézou nadmerného užívania návykových látok a u takýchto pacientov majú byť sledované príznaky zneužitia pregabalínu, nadmerného užívania alebo závislosti (boli hlásené rozvoj tolerancie, zvyšovanie dávky, správanie vedúce k užitiu lieku).
Encefalopatia
Boli hlásené prípady encefalopatie, hlavne u pacientov s pridruženými stavmi, ktoré môžu vyvolať
encefalopatiu.
4.5 Liekové a iné interakcie
Pretože pregabalín sa vylučuje prevažne v nezmenenej forme močom, podlieha zanedbateľnému metabolizmu u ľudí (< 2% dávky zachytenej v moči vo forme metabolitov), neinhibuje liekový metabolizmus in vitro a neviaže sa na plazmatické proteíny, je nepravdepodobné, že by spôsobil alebo bol sám subjektom farmakokinetických interakcií.
I n vi vo š t údi e a popul ačná f armakoki net i ck á anal ýz a
Podobne, v in vivo štúdiách sa nepozorovali žiadne klinicky relevantné farmakokinetické interakcie medzi pregabalínom a fenytoínom, karbamazepínom, kyselinou valproovou, lamotrigínom, gabapentínom, lorazepamom, oxykodónom alebo etanolom. Populačná farmakokinetická analýza ukázala, že perorálne antidiabetiká, diuretiká, inzulín, fenobarbital, tiagabín a topiramát nemali klinicky významný účinok na klírens pregabalínu.
Perorálne kontraceptíva, noretisterón a/alebo etinylestradiol
Súbežné podávanie pregabalínu s perorálnymi kontraceptívami noretisterónom a/alebo etinylestradiolom nemá vplyv na farmakokinetiku v rovnovážnom stave žiadnej z týchto látok.
Lieky ovpl yv ňuj úce centrálny nervový systém
Pregabalín môže zosilňovať účinky etanolu a lorazepamu. Opakované perorálne dávky pregabalínu podávané súbežne s oxykodónom, lorazepamom alebo etanolom v kontrolovaných klinických štúdiách neviedli ku klinicky významným účinkom na dýchanie. Po uvedení lieku na trh existujú hlásenia
o respiračnom zlyhaní a kóme u pacientov užívajúcich pregabalín a iné lieky utlmujúce centrálny nervový systém (CNS). Ukazuje sa, že pregabalín má aditívny efekt pri poškodení kognitívnej
a hrubej motorickej funkcie spôsobenej oxykodónom.
Interakcie a st arš i e os oby
Žiadne špecifické štúdie farmakodynamických interakcií sa nevykonali u starších dobrovoľníkov. Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženy v re produk čnom veku/ Anti konc epc i a u mužov a ži en
Keďže potenciálne riziko pre ľudí nie je známe, ženy vo fertilnom veku musia používať účinnú
antikoncepciu.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití pregabalínu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí.
Pregabalin Mylan sa má užívať počas gravidity iba v nevyhnutných prípadoch (ak prínos pre matku
jednoznačne preváži potenciálne riziko pre plod).
Laktácia
Pregabalín sa vylučuje do materského mlieka u ľudí (pozri časť 5.2). Účinok pregabalínu na novorodencov/dojčatá nie je známy. Rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu pregabalínom, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii klinické údaje o účinkoch pregabalínu na ženskú fertilitu.
V klinickom skúšaní hodnotiacom účinok pregabalínu na pohyblivosť spermií boli zdraví muži vystavení pregabalínu v dávke 600 mg/deň. Po 3 mesiacoch liečby sa nezistili žiadne účinky na pohyblivosť spermií.
Štúdia fertility na samičkách potkanov preukázala nežiaduce účinky na reprodukciu. Štúdie fertility na samčekoch potkanov preukázali nežiaduce účinky na reprodukciu a vývin. Klinický význam týchto zistení nie je známy (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pregabalin Mylan môže mať malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pregabalin Mylan môže vyvolať závraty a ospalosť, a preto môže ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Pacientom treba poradiť, aby neviedli vozidlá, neobsluhovali zložité stroje alebo sa nezapájali do iných potenciálne nebezpečných činností, pokiaľ nie je isté, či tento liek neovplyvňuje ich schopnosť vykonávať uvedené činnosti.
4.8 Nežiaduce účinky
Prehľad bezpečnostnéhoprofiluKlinický program s pregabalínom zahrňoval viac ako 8 900 pacientov užívajúcich pregabalín,
z ktorých viac ako 5 600 bolo zaradených v dvojito-zaslepených placebom kontrolovaných štúdiách. Najčastejšie hlásenými nežiaducimi reakciami boli závraty a somnolencia. Nežiaduce reakcie boli zvyčajne ľahkej až strednej intenzity. Vo všetkých kontrolovaných štúdiách boli nežiaduce reakcie príčinou ukončenia liečby u 12% pacientov užívajúcich pregabalín a u 5% pacientov užívajúcich placebo. Najčastejšími nežiaducimi reakciami vedúcimi k ukončeniu liečby v skupinách
s pregabalínom boli závraty a somnolencia.
Tabuľkový zoznam nežiaducich reakcií
V tabuľke 2 nižšie sú všetky nežiaduce reakcie, ktoré sa vyskytli častejšie než pri placebe a viac než
u jedného pacienta, zoradené podľa triedy a frekvencie (veľmi časté (≥ 1/10); časté (≥ 1/100 až
< 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥1/10 000 až < 1/1 000)); veľmi zriedkavé (< 1/10 000), neznáme (nedá sa odhadnúť z dostupných údajov)). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Uvedené nežiaduce reakcie môžu tiež súvisieť so základným ochorením a/alebo sprievodnou liečbou. Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä
somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy (pozri
časť 4.4).
Ďalšie reakcie hlásené na základe skúseností po uvedení lieku na trh sú zaradené v zozname nižšie
kurzívou.
Tabuľka 2 Nežiaduce liekové reakcie pregabalínuTrieda orgánových
systémov Nežiaduce reakcie na liek
|
Infekcie a nákazy
Časté nazofaryngitída
|
Poruchy krvi a lymfatického systému
Menej časté neutropénia
|
Poruchy imunitného systému
Menej časté hypersenzitivita
Zriedkavé angioedém, alergická reakcia
|
Poruchy metabolizmu a výživy
Časté zvýšená chuť do jedla
Menej časté anorexia, hypoglykémia
|
Psychické poruchy
Časté euforická nálada, zmätenosť, iritabilita, dezorientácia, insomnia,
pokles libida
Menej časté halucinácie, panický atak, nepokoj, agitovanosť, depresia, depresívna nálada, povznášajúca nálada, agresivita, kolísanie nálady, depersonalizácia, ťažkosti s vyhľadávaním slov, abnormálne sny, vzostup libida, anorgazmia, apatia
Zriedkavé strata zábran
|
T
rieda orgánových
systémov
N
ežiaduce reakcie na liek
|
P
oruchy nervového systému
Veľmi časté závraty, somnolencia, bolesť hlavy
Časté ataxia, porucha koordinácie, tremor, dyzartria, amnézia, poruchy pamäti, porucha koncentrácie, parestézia, hypestézia, sedácia, porucha rovnováhy, letargia
Menej časté synkopa, stupor, myoklonus, strata vedomia, psychomotorická hyperaktivita, dyskinéza, posturálne závraty, intenčný tremor, nystagmus, kognitívne poruchy, mentálne poškodenie, porucha reči, hyporeflexia, hyperestézia, pocit pálenia, strata chuti, nevoľnosť
Zriedkavé kŕče, parosmia, hypokinéza, dysgrafia
|
P
oruchy oka
Časté zahmlené videnie, diplopia
Menej časté strata periférneho videnia, poruchy videnia, opuch očí, defekty
v zornom poli, zníženie zrakovej ostrosti, bolesti oka, astenopia, fotopsia, suché oči, zvýšená lakrimácia, podráždenie očí
Zriedkavé strata zraku, keratitída, oscilopsia, porušené hĺbkové videnie, mydriáza, strabizmus, porušená zraková ostrosť
|
P
oruchy ucha a labyrintu
Časté vertigo
Menej časté hyperakúzia
|
P
oruchy srdca a srdcovej činnosti
Menej časté tachykardia, AV blokáda 1. stupňa, sínusová bradykardia,
kongestívne srdcové zlyhávanie
Zriedkavé predĺženie QT, sínusová tachykardia, sínusová arytmia
|
P
oruchy ciev
Menej časté hypotenzia, hypertenzia, návaly horúčavy, sčervenanie, periférny pocit chladu
|
P
oruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, epistaxa, kašeľ, upchatie nosa, rinitída, chrápanie, suchý
nos
Zriedkavé pľúcny edém, zovreté hrdlo
|
P
oruchy gastrointestinálneho traktu
Časté vracanie, nauzea, obstipácia, hnačka, flatulencia, abdominálna distenzia, sucho v ústach
Menej časté gastroezofageálna refluxová choroba, zvýšená salivácia, znížená citlivosť v ústach
Zriedkavé ascites, pankreatitída, opuchnutý jazyk, dysfágia
|
P
oruchy kože a podkožného tkaniva
Menej časté papulózny exantém, žihľavka, hyperhidróza, pruritus
Zriedkavé Stevensov-Johnsonov syndróm, studený pot
,
|
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté svalové kŕče, artralgia, bolesti chrbta, bolesti v končatinách,
cervikálny spazmus
Menej časté opuch kĺbov, myalgia, svalové zášklby, bolesť šije, svalová
stuhnutosť
Zriedkavé rabdomyolýza
|
P
oruchy obličiek a močových ciest
Menej časté močová inkontinencia, dyzúria
Zriedkavé renálne zlyhanie, oligúria, retencia moču
|
T
rieda orgánových
systémov
N
ežiaduce reakcie na liek
|
P
oruchy reprodukčného systému a prsníkov
Časté erektilná dysfunkcia
Menej časté sexuálna dysfunkcia, oneskorená ejakulácia, dysmenorea, bolesť
prsníkov
Zriedkavé amenorea, výtok z prsníkov, zväčšenie prsníkov, gynekomastia
|
C
elkové poruchy a reakcie v mieste podania
Časté periférny edém, edém, abnormálna chôdza, padanie, pocit opitosti, abnormálny pocit, únava
Menej časté generalizovaný edém, edém tváre, pocit napätia na hrudníku,
bolesť, pyrexia, smäd, triaška, asténia
|
L
aboratórne a funkčné vyšetrenia
Časté zvýšená hmotnosť
Menej časté zvýšená kreatínfosfokináza v krvi, zvýšená alanínaminotransferáza, zvýšená aspartátaminotransferáza, zvýšená glukóza v krvi, znížený počet trombocytov, zvýšený kreatinín v krvi, znížený draslík v krvi, znížená hmotnosť
Zriedkavé znížený počet leukocytov v krvi
|
Po ukončení krátkodobej a dlhodobej liečby pregabalínom sa u niektorých pacientov pozorovali
príznaky z vysadenia. Uvádzajú sa nasledujúce reakcie: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, kŕče, nervozita, depresia, bolesť
, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tejto skutočnosti informovaný na začiatku liečby.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
Pediatrická populáciaBezpečnostný profil pregabalínu pozorovaný v dvoch pediatrických štúdiách (farmakokinetická štúdia a štúdia bezpečnosti, n = 65; 1-ročná otvorená kontrolná štúdia bezpečnosti, n = 54) bol podobný bezpečnostnému profilu, ktorý sa pozoroval v štúdiách u dospelých (pozri časti 4.2, 5.1 a 5.2).
Hlásenie podozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePríznakyPo uvedení lieku na trh najčastejšie hlásené nežiaduce reakcie pozorované po predávkovaní
pregabalínom zahŕňali ospalosť, stavy zmätenosti, agitovanosť a nepokoj. V zriedkavých prípadoch bola hlásená kóma.
Postup pri predávkovaníLiečba predávkovania pregabalínom musí zahrňovať štandardné podporné opatrenia a môže zahrňovať podľa potreby aj hemodialýzu (pozri časť 4.2 tabuľka 1).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiepileptiká, iné antiepileptiká, ATC kód: N03AX16
Liečivo pregabalín je analógom gamaaminomaslovej kyseliny [(S)-3-(aminometyl)-5-metylhexánová kyselina].
Mechanizmus účinku
Pregabalín sa viaže na auxiliárne podjednotky (a2-d proteíny) napäťovo ovládaných kalciových
kanálov v centrálnom nervovom systéme.
Klinická účinnosťabezpečnosť
Epilepsia
Prídavná liečba
Pregabalín sa študoval v 3 kontrolovaných klinických skúšaniach v trvaní 12 týždňov s dávkovaním BID alebo TID. Celkové profily bezpečnosti a účinnosti pri BID a TID dávkovacích režimoch boli podobné.
Zníženie frekvencie epileptických záchvatov sa pozorovalo v 1. týždni.
Pediatrická populácia
Účinnosť a bezpečnosť pregabalínu ako doplnkovej liečby pri epilepsii u pediatrických pacientov mladších ako 12 rokov a dospievajúcich nebola stanovená. Nežiaduce udalosti pozorované vo farmakokinetickej štúdii a štúdii znášanlivosti, do ktorých boli zaradení pacienti vo veku od
3 mesiacov do 16 rokov (n = 65), boli podobné tým, ktoré sa pozorovali u dospelých. Výsledky
1-ročnej otvorenej štúdie bezpečnosti u 54 pediatrických pacientov vo veku od 3 mesiacov do
16 rokov s epilepsiou naznačujú, že nežiaduce udalosti pyrexie a infekcií horných dýchacích ciest sa
pozorovali častejšie ako v štúdiách u dospelých (pozri časti 4.2, 4.8 a 5.2).
Monoterapia (novodiagnostikovaní pacienti)
Pregabalín sa študoval v 1 kontrolovanom klinickom skúšaní v trvaní 56 týždňov s dávkovaním BID. Pregabalín nebol horší oproti lamotrigínu, čo sa týka dosiahnutia 6-mesačného obdobia bez záchvatov na konci sledovania. Pregabalín a lamotrigín boli podobne bezpečné a dobre tolerované.
Generalizovaná úzkostná porucha
Pregabalín sa študoval v 6 kontrolovaných klinických skúšaniach v trvaní 4 – 6 týždňov, v štúdii so staršími osobami v trvaní 8 týždňov a v dlhodobej štúdii zameranej na prevenciu relapsu s dvojito zaslepenou fázou zameranou na prevenciu relapsu v trvaní 6 mesiacov.
Ústup príznakov GAD vyjadrených Hamiltonovou škálou úzkosti (Hamilton Anxiety Rating
Scale = HAM-A) sa pozoroval v 1. týždni.
V kontrolovaných klinických skúšaniach (v trvaní 4 – 8 týždňov) 52% pacientov liečených pregabalínom a 38% pacientov v skupine s placebom malo aspoň 50% zlepšenie celkového HAM-A skóre od začiatku až po koniec sledovania.
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní v dávkovaní. Oftalmologické vyšetrenie (vrátane vyšetrenia zrakovej ostrosti, formálneho vyšetrenia zorného poľa a vyšetrenia očného pozadia pri rozšírených zreniciach) sa vykonalo u viac ako
3 600 pacientov v rámci kontrolovaných klinických skúšaní. U týchto pacientov bola zraková ostrosť
znížená u 6,5% pacientov liečených pregabalínom a 4,8% pacientov liečených placebom. Zmeny zrakového poľa sa zistili u 12,4% pacientov liečených pregabalínom a 11,7% pacientov liečených placebom. Zmeny na očnom pozadí sa pozorovali u 1,7% pacientov liečených pregabalínom a 2,1% pacientov liečených placebom.
5.2 Farmakokinetické vlastnosti
Farmakokinetika pregabalínu v rovnovážnom stave je podobná u zdravých dobrovoľníkov, pacientov s epilepsiou užívajúcich antiepileptiká a pacientov s chronickou bolesťou.
Absorpcia
Pregabalín sa pri podaní nalačno rýchlo vstrebáva, maximálne plazmatické koncentrácie sa dosiahnu do 1 hodiny po podaní jednorazovej aj viacnásobnej dávky. Biologická dostupnosť pregabalínu po perorálnom podaní sa odhaduje na ≥ 90% a je nezávislá na dávke. Po opakovanom podaní sa rovnovážny stav dosiahne počas 24 až 48 hodín. Rýchlosť absorpcie pregabalínu sa zníži, keď sa podáva s jedlom, čo sa prejaví poklesom Cmax približne o 25 – 30% a predĺžením tmax na približne
2,5 hodiny. Avšak podávanie pregabalínu s jedlom nemá klinicky signifikantný účinok na mieru
absorpcie pregabalínu.
Distribúcia
V predklinických štúdiách sa potvrdil prienik pregabalínu cez hematoencefalickú bariéru u myší,
potkanov a opíc. Bolo dokázané, že pregabalín prechádza cez placentu u potkanov a nachádza sa
v mlieku laktujúcich potkanov. U človeka je zdanlivý distribučný objem pregabalínu po perorálnom
podaní približne 0,56 l/kg. Pregabalín sa neviaže na plazmatické proteíny.
Biotransformácia
Pregabalín u človeka podlieha zanedbateľnému metabolizmu. Po podaní dávky rádionuklidom značeného pregabalínu približne 98% rádioaktivity stanovenej v moči predstavoval nezmenený pregabalín. N-metylovaný derivát pregabalínu, hlavný metabolit pregabalínu v moči, predstavoval
0,9%. V predklinických štúdiách sa nezistila racemizácia S-enancioméru pregabalínu na
R-enanciomér.
Eliminácia
Pregabalín sa eliminuje zo systémovej cirkulácie primárne renálnou exkréciou v nezmenenej forme. Priemerný eliminačný polčas je 6,3 hodiny. Plazmatický klírens a renálny klírens pregabalínu sú priamo úmerné klírensu kreatinínu (pozri časť 5.2 Porucha funkcie obličiek).
Je potrebné upraviť dávku u pacientov so zníženými renálnymi funkciami alebo u hemodialyzovaných
pacientov (pozri časť 4.2 Tabuľka 1).
Linearita/nelinearita
Farmakokinetika pregabalínu je lineárna v odporúčanom rozsahu denných dávok. Interindivuduálna farmakokinetická variabilita pregabalínu je nízka (< 20%). Farmakokinetiku pri opakovaných dávkach možno predpovedať z údajov pri jednorazovej dávke. Preto nie je potrebné bežné monitorovanie plazmatických koncentrácií pregabalínu.
Pohlavie
Klinické skúšania potvrdili, že pohlavie nemá klinicky signifikantný vplyv na plazmatické
koncentrácie pregabalínu.
Porucha funkcieobličiek
Klírens pregabalínu je priamo úmerný klírensu kreatinínu. Okrem toho sa pregabalín účinne odstraňuje z plazmy hemodialýzou (po 4-hodinovej hemodialýze klesnú plazmatické koncentrácie pregabalínu asi o 50%). Vzhľadom na to, že eliminácia obličkami je hlavným spôsobom eliminácie, je
potrebné zníženie dávky u pacientov s poruchou funkcie obličiek a doplnková dávka po hemodialýze
(pozri časť 4.2 tabuľka 1).
Porucha funkciepečene
Neboli vykonané žiadne špecifické farmakokinetické štúdie u pacientov s poruchou funkcie pečene. Keďže pregabalín nepodlieha signifikantnému metabolizmu a vylučuje sa prednostne v nezmenenej forme močom, neočakáva sa, že by poškodenie funkcie pečene signifikantne menilo plazmatické koncentrácie pregabalínu.
Pediatrická populácia
Farmakokinetika pregabalínu bola vyhodnocovaná u pediatrických pacientov s epilepsiou (vekové
skupiny: 1 až 23 mesiacov, 2 až 6 rokov, 7 až 11 rokov a 12 až 16 rokov) pri hladinách dávky 2,5; 5;
10 a 15 mg/kg/deň vo farmakokinetickej štúdii a štúdii znášanlivosti.
Po perorálnom podaní pregabalínu u pediatrických pacientov nalačno, bol čas do dosiahnutia maximálnej plazmatickej koncentrácie vo všeobecnosti podobný v rámci všetkých vekových skupín a dosiahol sa 0,5 hodiny až 2 hodiny po podaní dávky.
Parametre Cmax a AUC pregabalínu sa zvyšovali priamo úmerne so zvyšujúcou sa dávkou v rámci každej vekovej skupiny. AUC bola nižšia o 30 % u pediatrických pacientov s telesnou hmotnosťou menej ako 30 kg z dôvodu klírensu upraveného na základe telesnej hmotnosti zvýšeného o 43 %
u týchto pacientov v porovnaní s pacientmi s telesnou hmotnosťou ≥ 30 kg.
Terminálny polčas pregabalínu sa pohyboval v priemere od 3 do 4 hodín u pediatrických pacientov vo
veku do 6 rokov a od 4 do 6 hodín u tých, ktorí boli vo veku 7 rokov a starší.
Analýza populačnej farmakokinetiky preukázala, že klírens kreatinínu bol významným vedľajším parametrom klírensu pregabalínu po perorálnom podaní, telesná hmotnosť bola významným vedľajším parametrom zdanlivého distribučného objemu pregabalínu po perorálnom podaní a tieto vzťahy boli podobné u pediatrických a dospelých pacientov.
Farmakokinetika pregabalínu u pacientov mladších ako 3 mesiace nebola skúmaná (pozri časti 4.2,
4.8 a 5.1).
Staršieosoby(vo veku nad 65 rokov)
Klírens pregabalínu má tendenciu klesať so stúpajúcim vekom. Tento pokles klírensu pregabalínu je v súlade s poklesom klírensu kreatinínu, ktorý je podmienený stúpajúcim vekom. Zníženie dávky pregabalínu sa môže vyžadovať u pacientov pri vekom podmienenej poruche funkcie obličiek (pozri časť 4.2 tabuľka 1).
Dojčiacematky
Farmakokinetika 150 mg pregabalínu podávaných každých 12 hodín (300 mg denná dávka) bola vyhodnocovaná u 10 žien počas laktácie, ktoré boli aspoň 12 týždňov po pôrode. Laktácia mala malý až žiadny vplyv na farmakokinetiku pregabalínu. Pregabalín sa vylučoval do materského mlieka
s priemernými koncentráciami v ustálenom stave približne 76% z plazmatických koncentrácií
u matiek. Odhadovaná dávka u dojčaťa z materského mlieka (za predpokladu priemernej konzumácie
mlieka 150 ml/kg/deň) žien užívajúcich 300 mg/deň by bola 0,31 mg/kg/deň alebo 0,62 mg/kg/deň
u žien užívajúcich maximálnu dávku 600 mg/deň. Tieto odhadované dávky predstavujú približne 7%
celkovej dennej dávky u matky v mg/kg.
5.3 Predklinické údaje o bezpečnosti
V obvyklých farmakologických štúdiách bezpečnosti u zvierat bol pregabalín dobre tolerovaný
v klinicky relevantných dávkach. V štúdiách toxicity po opakovanom podávaní u potkanov a opíc sa
pozorovali účinky na CNS vrátane hypoaktivity, hyperaktivity a ataxie. Zvýšená incidencia atrofie retiny, bežne pozorovaná u starnúcich potkaních albínov, sa zistila po dlhodobej expozícii pregabalínu v dávkach ≥ 5-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke.
Pregabalín nebol teratogénny u myší, potkanov ani u králikov. Fetálna toxicita u potkanov a králikov sa vyskytla iba pri dávkach dostatočne prevyšujúcich dávku pre človeka.
V prenatálnych/postnatálnych štúdiách toxicity pregabalín vyvolával vývojovú toxicitu u potomkov potkanov v dávkach > 2-krát vyšších, než je odporúčaná maximálna dávka pre človeka.
Nežiaduce účinky na fertilitu u samčekov a samičiek potkanov sa pozorovali iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia. Nežiaduce účinky na samčie reprodukčné orgány a parametre spermií boli reverzibilné a vyskytli sa iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia, alebo boli spojené so spontánnymi degeneratívnymi procesmi na samčích reprodukčných orgánoch u potkana. Preto sa týmto účinkom pripisuje malý alebo žiadny klinický význam.
Na základe výsledkov mnohých in vitro a in vivo skúšok možno prehlásiť, že pregabalín nie je
genotoxický.
Dvojročné štúdie karcinogenicity s pregabalínom boli vykonané na potkanoch a myšiach. Nepozorovali sa žiadne nádory u potkanov v dávkach až do 24-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke 600 mg/deň. U myší sa nezistil zvýšený výskyt nádorov v dávkach podobných priemernej dávke u človeka, ale zvýšený výskyt hemangiosarkómov sa pozoroval pri vyšších dávkach. Negenotoxický mechanizmus tvorby pregabalínom indukovaných nádorov u myší zahrňuje zmeny krvných doštičiek a súvisiacu proliferáciu endoteliálnych buniek. Tieto zmeny krvných doštičiek neboli prítomné u potkanov alebo u ľudí na základe krátkodobých
a limitovaných dlhodobých klinických údajov. Neexistuje dôkaz, ktorý by naznačoval súvisiace riziko
u ľudí.
U mladých potkanov sa druhy toxicity kvantitatívne nelíšili od tých, ktoré sa pozorovali u dospelých potkanov. Avšak mladé potkany sú oveľa senzitívnejšie. Pri terapeutických dávkach sa dokázali klinické príznaky hyperaktivity CNS a bruxizmus a niektoré zmeny v raste (prechodné potlačenie prírastku telesnej hmotnosti). Účinky na pohlavný cyklus sa pozorovali pri 5-násobku terapeutickej dávky u človeka. Znížená odpoveď na akustický podnet sa pozorovala u mladých potkanov 1 –
2 týždne po expozícii pri > 2-násobku terapeutickej dávky u človeka. Deväť týždňov po expozícii sa už tento účinok viac nepozoroval.
6 FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsúl hydroxypropylcelulóza, kukuričný škrob, mastenec
Obal kapsúl
žltý oxid železitý (E172), oxid titaničitý (E171), erytrozín (E127),
želatína,
nátriumlaurylsulfát
A
tr
ament
šelak,
čierny oxid železitý (E172),
makrogol,
roztok amoniaku, koncentrovaný, hydroxid draselný
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC/Al blistre obsahujúce 14, 21, 56, 84 alebo 100 tvrdých kapsúl.
PVC/PVDC/Al blistre s perforáciou obsahujúce 84 x 1 alebo 100 x 1 tvrdú kapsulu, umožňujúce
oddelenie jednotlivej dávky.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Generics [UK] Limited
Station Close Potters Bar Hertfordshire EN6 1TL Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/15/997/009
EU/1/15/997/010
EU/1/15/997/011
EU/1/15/997/012
EU/1/15/997/013
EU/1/15/997/014
EU/1/15/997/015
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
1. NÁZOV LIEKU
Pregabalin Mylan 75 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jedna tvrdá kapsula obsahuje 75 mg pregabalínu. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá kapsula
Nepriesvitné želatínové kapsuly veľkosti 4 s tvrdým obalom, s telom a viečkom svetlobroskyňovej farby, obsahujúce biely až takmer biely prášok. Na viečku a tele kapsuly je pozdĺž jej osi čiernym atramentom vytlačený nápis MYLAN a pod ním označenie PB75.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Epilepsia
Pregabalin Mylan je indikovaný ako prídavná liečba u dospelých s parciálnymi záchvatmi so sekundárnou generalizáciou alebo bez sekundárnej generalizácie.
Generalizovaná úzkostná porucha
Pregabalin Mylan je indikovaný na liečbu generalizovanej úzkostnej poruchy (GAD = Generalised
Anxiety Disorder) u dospelých.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Rozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
Epilepsia
Liečbu pregabalínom možno začať dávkou 150 mg denne, ktorá sa podáva rozdelená v dvoch alebo troch dávkach. Podľa individuálnej odpovede pacienta a tolerancie možno dávku po 1 týždni zvýšiť na
300 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Generalizovaná úzkostná porucha
Rozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
Potreba liečby sa musí pravidelne opakovane posúdiť.
Liečbu pregabalínom možno začať dávkou 150 mg denne. Podľa individuálnej odpovede pacienta
a tolerancie možno dávku po 1 týždni zvýšiť na 300 mg denne. Po ďalšom týždni možno dávku zvýšiť
na 450 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Ukonč eni e l i eč by pregabalínom
V súlade so súčasnou klinickou praxou, ak sa musí liečba pregabalínom ukončiť, odporúča sa, aby sa
to urobilo postupne počas minimálne 1 týždňa bez ohľadu na indikáciu (pozri časti 4.4 a 4.8).
O
sobitné populácie
 Pacienti s poruchou funkcie obl i či ek
Pacienti s poruchou funkcie obl i či ek
Pregabalín sa zo systémovej cirkulácie primárne eliminuje v nezmenenej forme renálnou exkréciou. Keďže klírens pregabalínu je priamo úmerný klírensu kreatinínu (pozri časť 5.2), dávka u pacientov s poruchou funkcie obličiek sa musí znižovať individuálne podľa klírensu kreatinínu (CLcr), ako je uvedené v tabuľke 1 použitím nasledovného vzorca:
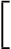
CLcr(ml/min) =
1,23 × [140 – vek (roky)] × hmotnoť (kg)
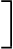
kreatinín v sére (µmol/l)
(× 0,85 u žien)
Pregabalín možno efektívne odstrániť z plazmy hemodialýzou (50% lieku počas 4 hodín).
U hemodialyzovaných pacientov sa denná dávka pregabalínu musí upraviť podľa funkcie obličiek. K dennej dávke treba pridať doplnkovú dávku okamžite po každej 4-hodinovej hemodialýze (pozri tabuľku 1).
Tabuľka 1 Úprava dávky pregabalínu podľa funkcie obličiek
Klírens kreatinínu
(CLcr) (ml/min)
|
Celková denná dávka pregabalínu *
|
Dávkovací režim
|
| Začiatočná dávka
(mg/deň)
| Maximálna dávka
(mg/deň)
|
|
≥ 60
| 150
| 600
| BID alebo TID
|
≥ 30 – < 60
| 75
| 300
| BID alebo TID
|
≥ 15 – < 30
| 25 – 50
| 150
| Jedenkrát denne alebo BID
|
< 15
| 25
| 75
| Jedenkrát denne
|
Doplnkové dávkovanie po hemodialýze (mg)
|
| 25
| 100
| Jednorazová dávka+
|
TID = tri rozdelené dávky
BID = dve rozdelené dávky
* Celková denná dávka (mg/deň) sa má rozdeliť podľa dávkovacieho režimu a vyjadriť v mg/dávka
+ Doplnková dávka je jedna dodatočná dávka
Pacienti s poruchou f unkc i e pe če ne Nevyžaduje sa žiadna úprava dávky u pacientov s poruchou funkcie pečene (pozri časť 5.2).
Pediatrická populáciaBezpečnosť a účinnosť Pregabalinu Mylan u detí mladších ako 12 rokov a u dospievajúcich (vo veku
12 – 17 rokov) neboli stanovené. Údaje dostupné v súčasnosti sú uvedené v časti 4.8, 5.1 a 5.2, ale nie
je možné vykonať odporúčanie týkajúce sa dávkovania.
St arš ie osoby (vo veku nad 65 rokov)Starší pacienti môžu vyžadovať zníženie dávky pregabalínu z dôvodu zníženej renálnej funkcie (pozri pacienti s poruchou funkcie obličiek).
Spôsob podávaniaPregabalin Mylan sa môže užívať s jedlom alebo bez jedla. Pregabalin Mylan je určený iba na perorálne použitie.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Diabetickí pacienti
Podľa súčasnej klinickej praxe u niektorých diabetických pacientov s prírastkom hmotnosti počas liečby pregabalínom môže byť potrebné upraviť hypoglykemickú liečbu.
Reakcie z precitlivenosti
Po uvedení lieku na trh boli zaznamenané hlásenia o rekciách z precitlivenosti vrátane prípadov angioedému. Liečba pregabalínom sa musí okamžite ukončiť, ak sa vyskytnú príznaky angioedému, ako sú faciálny, periorálny opuch alebo opuch horných dýchacích ciest.
Závrat , somnole nci a, st rat a ve domi a, zmäte nosť a ment ál ne poš kode ni e
Liečba pregabalínom sa dáva do súvisu so závratom a somnolenciou, ktoré mohli zvýšiť výskyt náhodných zranení (pádov) u staršej populácie. Existujú tiež hlásenia po uvedení lieku na trh o strate vedomia, zmätenosti a mentálnom poškodení. Preto pacientom sa má poradiť, aby boli opatrní, pokým sa neoboznámia s možnými účinkami lieku.
Úči nky spoj ené s videním
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní dávkovania. V klinických štúdiách, v ktorých bolo zahrnuté aj oftalmologické vyšetrenie, bol výskyt zníženia zrakovej ostrosti a zmien zorného poľa väčší u pacientov liečených pregabalínom ako
u pacientov liečených placebom; výskyt zmien na očnom pozadí bol väčší u pacientov liečených
placebom (pozri časť 5.1).
Po uvedení lieku na trh boli tiež hlásené nežiaduce reakcie na zrak, vrátane straty zraku, rozmazaného videnia alebo iných zmien zrakovej ostrosti, z ktorých mnohé boli prechodné. Prerušenie liečby pregabalínom môže viesť k vymiznutiu alebo zlepšeniu týchto zrakových príznakov.
Renálne zlyhávanie
Boli hlásené prípady renálneho zlyhávania a v niektorých prípadoch prerušenie liečby pregabalínom
viedlo k reverzibilite tejto nežiaducej reakcie.
Vysadeni e s účas ne podáv anýc h ant i epi l ept í k
Nie sú dostatočné údaje týkajúce sa vysadenia súčasne podávaných antiepileptík, akonáhle sa po pridaní pregabalínu dosiahne kontrola záchvatu tak, aby bolo možné podávať pregabalín
v monoterapii.
Príznaky z vysadenia
Po ukončení krátkodobej a dlhodobej liečby pregabalínom boli u niektorých pacientov pozorované príznaky z vysadenia. Uvádzajú sa nasledujúce účinky: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, nervozita, depresia, bolesť, kŕče, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tom informovaný na začiatku liečby.
Počas užívania pregabalínu alebo krátko po ukončení liečby pregabalínom sa môžu vyskytnúť kŕče
vrátane epileptických záchvatov a záchvatov typu grand mal.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
K
ongestívne srdcové zlyhávanie
Po uvedení lieku na trh boli hlásené prípady kongestívneho srdcového zlyhávania u niektorých pacientov dostávajúcich pregabalín. Tieto reakcie sú najčastejšie pozorované u starších pacientov
s kardiovaskulárnymi ochoreniami počas liečby pregabalínom na neuropatickú indikáciu. Pregabalín
sa má u týchto pacientov podávať s opatrnosťou. Ukončenie podávania pregabalínu môže viesť
k odozneniu reakcie.
Než i aduce re akc i e u pac i ent ov s porane ní m mi ec hy
Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy. Možno to pripísať aditívnemu účinku v dôsledku súbežnej liečby inými liekmi (napr. liekmi proti spasticite), ktoré je potrebné užívať pri tomto ochorení.
Samovr až edné myš l i enk y a správanie
Samovražedné myšlienky a správanie boli hlásené u pacientov liečených antiepileptikami pri niekoľkých indikáciách. Meta-analýza randomizovaných placebom kontrolovaných štúdií antiepileptík tiež ukázala málo zvýšené riziko samovražedných myšlienok a správania. Mechanizmus tohto rizika
nie je známy a dostupné údaje nevylučujú možnosť zvýšeného rizika u pregabalínu.
Pacienti majú byť preto sledovaní kvôli prejavom samovražedných myšlienok a správania a má sa u nich zvážiť vhodná liečba. Pacienti (a ich opatrovatelia) majú byť upozornení, aby vyhľadali lekársku pomoc, ak sa prejavy samovražedných myšlienok alebo správania objavia.
Zhorše ná f unkc i a dol ného t ráv i ace ho t rak t u
Po uvedení lieku na trh boli hlásené prípady týkajúce sa zhoršenej funkcie dolného tráviaceho traktu (napr. intestinálna obštrukcia, paralytický ileus, obstipácia), keď sa pregabalín podával spolu s liekmi, ktoré môžu spôsobovať obstipáciu, ako sú napr. opioidné analgetiká. Keď sa bude pregabalín užívať
v kombinácii s opioidmi, môžu sa zvážiť opatrenia na predchádzanie obstipácii (zvlášť u žien
a starších pacientov).
Zneuži t i e, s klon k nadmer nému uží vani u l i ek ov al ebo z ávi sl osť
Boli hlásené prípady zneužitia, nadmerného užívania liekov a závislosti. Treba byť opatrný
u pacientov s anamnézou nadmerného užívania návykových látok a u takýchto pacientov majú byť sledované príznaky zneužitia pregabalínu, nadmerného užívania alebo závislosti (boli hlásené rozvoj tolerancie, zvyšovanie dávky, správanie vedúce k užitiu lieku).
Encefalopatia
Boli hlásené prípady encefalopatie, hlavne u pacientov s pridruženými stavmi, ktoré môžu vyvolať
encefalopatiu.
4.5 Liekové a iné interakcie
Pretože pregabalín sa vylučuje prevažne v nezmenenej forme močom, podlieha zanedbateľnému metabolizmu u ľudí (< 2% dávky zachytenej v moči vo forme metabolitov), neinhibuje liekový metabolizmus in vitro a neviaže sa na plazmatické proteíny, je nepravdepodobné, že by spôsobil alebo bol sám subjektom farmakokinetických interakcií.
I n vi vo š t údi e a popul ačná f armakoki net i ck á anal ýz a
Podobne, v in vivo štúdiách sa nepozorovali žiadne klinicky relevantné farmakokinetické interakcie medzi pregabalínom a fenytoínom, karbamazepínom, kyselinou valproovou, lamotrigínom, gabapentínom, lorazepamom, oxykodónom alebo etanolom. Populačná farmakokinetická analýza ukázala, že perorálne antidiabetiká, diuretiká, inzulín, fenobarbital, tiagabín a topiramát nemali klinicky významný účinok na klírens pregabalínu.
Perorálne kontraceptíva, noretisterón a/alebo etinylestradiol
Súbežné podávanie pregabalínu s perorálnymi kontraceptívami noretisterónom a/alebo etinylestradiolom nemá vplyv na farmakokinetiku v rovnovážnom stave žiadnej z týchto látok.
Lie ky ovpl yv ňuj úce centrálny nervový systém
Pregabalín môže zosilňovať účinky etanolu a lorazepamu. Opakované perorálne dávky pregabalínu podávané súbežne s oxykodónom, lorazepamom alebo etanolom v kontrolovaných klinických štúdiách neviedli ku klinicky významným účinkom na dýchanie. Po uvedení lieku na trh existujú hlásenia
o respiračnom zlyhaní a kóme u pacientov užívajúcich pregabalín a iné lieky utlmujúce centrálny nervový systém (CNS). Ukazuje sa, že pregabalín má aditívny efekt pri poškodení kognitívnej
a hrubej motorickej funkcie spôsobenej oxykodónom.
Interakcie a st arš i e osoby
Žiadne špecifické štúdie farmakodynamických interakcií sa nevykonali u starších dobrovoľníkov. Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženy v re produk čnom veku/ Anti konc epc i a u mužov a ži en
Keďže potenciálne riziko pre ľudí nie je známe, ženy vo fertilnom veku musia používať účinnú
antikoncepciu.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití pregabalínu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí.
Pregabalin Mylan sa má užívať počas gravidity iba v nevyhnutných prípadoch (ak prínos pre matku
jednoznačne preváži potenciálne riziko pre plod).
Laktácia
Pregabalín sa vylučuje do materského mlieka u ľudí (pozri časť 5.2). Účinok pregabalínu na novorodencov/dojčatá nie je známy. Rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu pregabalínom, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii klinické údaje o účinkoch pregabalínu na ženskú fertilitu.
V klinickom skúšaní hodnotiacom účinok pregabalínu na pohyblivosť spermií boli zdraví muži vystavení pregabalínu v dávke 600 mg/deň. Po 3 mesiacoch liečby sa nezistili žiadne účinky na pohyblivosť spermií.
Štúdia fertility na samičkách potkanov preukázala nežiaduce účinky na reprodukciu. Štúdie fertility na samčekoch potkanov preukázali nežiaduce účinky na reprodukciu a vývin. Klinický význam týchto zistení nie je známy (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pregabalin Mylan môže mať malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pregabalin Mylan môže vyvolať závraty a ospalosť, a preto môže ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Pacientom treba poradiť, aby neviedli vozidlá, neobsluhovali zložité stroje alebo sa nezapájali do iných potenciálne nebezpečných činností, pokiaľ nie je isté, či tento liek neovplyvňuje ich schopnosť vykonávať uvedené činnosti.
4.8 Nežiaduce účinky
Prehľad bezpečnostného profiluKlinický program s pregabalínom zahrňoval viac ako 8 900 pacientov užívajúcich pregabalín,
z ktorých viac ako 5 600 bolo zaradených v dvojito-zaslepených placebom kontrolovaných štúdiách. Najčastejšie hlásenými nežiaducimi reakciami boli závraty a somnolencia. Nežiaduce reakcie boli zvyčajne ľahkej až strednej intenzity. Vo všetkých kontrolovaných štúdiách boli nežiaduce reakcie príčinou ukončenia liečby u 12% pacientov užívajúcich pregabalín a u 5% pacientov užívajúcich placebo. Najčastejšími nežiaducimi reakciami vedúcimi k ukončeniu liečby v skupinách
s pregabalínom boli závraty a somnolencia.
Tabuľkový zoznam nežiaducich reakcií
V tabuľke 2 nižšie sú všetky nežiaduce reakcie, ktoré sa vyskytli častejšie než pri placebe a viac než
u jedného pacienta, zoradené podľa triedy a frekvencie (veľmi časté (≥ 1/10); časté (≥ 1/100 až
< 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000), neznáme (nedá sa odhadnúť z dostupných údajov)). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Uvedené nežiaduce reakcie môžu tiež súvisieť so základným ochorením a/alebo sprievodnou liečbou.
Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy (pozri časť 4.4).
Ďalšie reakcie hlásené na základe skúseností po uvedení lieku na trh sú zaradené v zozname nižšie
kurzívou.
Tabuľka 2 Nežiaduce liekové reakcie pregabalínuTrieda orgánových
systémov Nežiaduce reakcie na liek
|
Infekcie a nákazy
Časté nazofaryngitída
|
Poruchy krvi a lymfatického systému
Menej časté neutropénia
|
Poruchy imunitného systému
Menej časté hypersenzitivita
Zriedkavé angioedém, alergická reakcia
|
Poruchy metabolizmu a výživy
Časté zvýšená chuť do jedla
Menej časté anorexia, hypoglykémia
|
Psychické poruchy
Časté euforická nálada, zmätenosť, iritabilita, dezorientácia, insomnia,
pokles libida
Menej časté halucinácie, panický atak, nepokoj, agitovanosť, depresia, depresívna nálada, povznášajúca nálada, agresivita, kolísanie nálady, depersonalizácia, ťažkosti s vyhľadávaním slov, abnormálne sny, vzostup libida, anorgazmia, apatia
Zriedkavé strata zábran
|
T
rieda orgánových
systémov
N
ežiaduce reakcie na liek
|
P
oruchy nervového systému
Veľmi časté závraty, somnolencia, bolesť hlavy
Časté ataxia, porucha koordinácie, tremor, dyzartria, amnézia, poruchy pamäti, porucha koncentrácie, parestézia, hypestézia, sedácia, porucha rovnováhy, letargia
Menej časté synkopa, stupor, myoklonus, strata vedomia, psychomotorická hyperaktivita, dyskinéza, posturálne závraty, intenčný tremor, nystagmus, kognitívne poruchy, mentálne poškodenie, porucha reči, hyporeflexia, hyperestézia, pocit pálenia, strata chuti, nevoľnosť
Zriedkavé kŕče, parosmia, hypokinéza, dysgrafia
|
P
oruchy oka
Časté zahmlené videnie, diplopia
Menej časté strata periférneho videnia, poruchy videnia, opuch očí, defekty
v zornom poli, zníženie zrakovej ostrosti, bolesti oka, astenopia, fotopsia, suché oči, zvýšená lakrimácia, podráždenie očí
Zriedkavé strata zraku, keratitída, oscilopsia, porušené hĺbkové videnie,
mydriáza, strabizmus, porušená zraková ostrosť
|
P
oruchy ucha a labyrintu
Časté vertigo
Menej časté hyperakúzia
|
P
oruchy srdca a srdcovej činnosti
Menej časté tachykardia, AV blokáda 1. stupňa, sínusová bradykardia,
kongestívne srdcové zlyhávanie
Zriedkavé predĺženie QT, sínusová tachykardia, sínusová arytmia
|
P
oruchy ciev
Menej časté hypotenzia, hypertenzia, návaly horúčavy, sčervenanie, periférny pocit chladu
|
P
oruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, epistaxa, kašeľ, upchatie nosa, rinitída, chrápanie, suchý
nos
Zriedkavé pľúcny edém, zovreté hrdlo
|
P
oruchy gastrointestinálneho traktu
Časté vracanie, nauzea, obstipácia, hnačka, flatulencia, abdominálna distenzia, sucho v ústach
Menej časté gastroezofageálna refluxová choroba, zvýšená salivácia, znížená citlivosť v ústach
Zriedkavé ascites, pankreatitída, opuchnutý jazyk, dysfágia
|
P
oruchy kože a podkožného tkaniva
Menej časté papulózny exantém, žihľavka, hyperhidróza, pruritus
Zriedkavé Stevensov-Johnsonov syndróm, studený pot
,
|
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté svalové kŕče, artralgia, bolesti chrbta, bolesti v končatinách,
cervikálny spazmus
Menej časté opuch kĺbov, myalgia, svalové zášklby, bolesť šije, svalová stuhnutosť
Zriedkavé rabdomyolýza
|
P
oruchy obličiek a močových ciest
Menej časté močová inkontinencia, dyzúria
Zriedkavé renálne zlyhanie, oligúria, retencia moču
|
T
rieda orgánových
systémov
N
ežiaduce reakcie na liek
|
P
oruchy reprodukčného systému a prsníkov
Časté erektilná dysfunkcia
Menej časté sexuálna dysfunkcia, oneskorená ejakulácia, dysmenorea, bolesť
prsníkov
Zriedkavé amenorea, výtok z prsníkov, zväčšenie prsníkov, gynekomastia
|
C
elkové poruchy a reakcie v mieste podania
Časté periférny edém, edém, abnormálna chôdza, padanie, pocit opitosti, abnormálny pocit, únava
Menej časté generalizovaný edém, edém tváre, pocit napätia na hrudníku,
bolesť, pyrexia, smäd, triaška, asténia
|
L
aboratórne a funkčné vyšetrenia
Časté zvýšená hmotnosť
Menej časté zvýšená kreatínfosfokináza v krvi, zvýšená alanínaminotransferáza, zvýšená aspartátaminotransferáza, zvýšená glukóza v krvi, znížený počet trombocytov, zvýšený kreatinín v krvi, znížený draslík v krvi, znížená hmotnosť
Zriedkavé znížený počet leukocytov v krvi
|
Po ukončení krátkodobej a dlhodobej liečby pregabalínom sa u niektorých pacientov pozorovali
abstinenčné príznaky. Uvádzajú sa nasledujúce reakcie: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, kŕče, nervozita, depresia, bolesť
, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tejto skutočnosti informovaný na začiatku liečby.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť abstinenčných príznakov môžu byť závislé od dávky.
Pediatrická populáciaBezpečnostný profil pregabalínu pozorovaný v dvoch pediatrických štúdiách (farmakokinetická štúdia a štúdia bezpečnosti, n = 65; 1-ročná otvorená kontrolná štúdia bezpečnosti, n = 54) bol podobný bezpečnostnému profilu, ktorý sa pozoroval v štúdiách u dospelých (pozri časti 4.2, 5.1 a 5.2).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePríznakyPo uvedení lieku na trh najčastejšie hlásené nežiaduce reakcie pozorované po predávkovaní
pregabalínom zahŕňali ospalosť, stavy zmätenosti, agitovanosť a nepokoj. V zriedkavých prípadoch bola hlásená kóma.
Postup pri predávkovaníLiečba predávkovania pregabalínom musí zahrňovať štandardné podporné opatrenia a môže zahrňovať podľa potreby aj hemodialýzu (pozri časť 4.2 tabuľka 1).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiepileptiká, iné antiepileptiká, ATC kód: N03AX16
Liečivo pregabalín je analógom gamaaminomaslovej kyseliny [(S)-3-(aminometyl)-5-metylhexánová kyselina].
Mechanizmus účinku
Pregabalín sa viaže na auxiliárne podjednotky (a2-d proteíny) napäťovo ovládaných kalciových
kanálov v centrálnom nervovom systéme.
Klinická účinnosťabezpečnosť
Epilepsia
Prídavná liečba
Pregabalín sa študoval v 3 kontrolovaných klinických skúšaniach v trvaní 12 týždňov s dávkovaním BID alebo dávkovaním TID. Celkové profily bezpečnosti a účinnosti pri BID a TID dávkovacích režimoch boli podobné.
Zníženie frekvencie epileptických záchvatov sa pozorovalo v 1. týždni.
Pediatrická populácia
Účinnosť a bezpečnosť pregabalínu ako doplnkovej liečby pri epilepsii u pediatrických pacientov mladších ako 12 rokov a dospievajúcich nebola stanovená. Nežiaduce udalosti pozorované vo farmakokinetickej štúdii a štúdii znášanlivosti, do ktorých boli zaradení pacienti vo veku od
3 mesiacov do 16 rokov (n = 65), boli podobné tým, ktoré sa pozorovali u dospelých. Výsledky
1-ročnej otvorenej štúdie bezpečnosti u 54 pediatrických pacientov vo veku od 3 mesiacov do
16 rokov s epilepsiou naznačujú, že nežiaduce udalosti pyrexie a infekcií horných dýchacích ciest sa
pozorovali častejšie ako v štúdiách u dospelých (pozri časti 4.2, 4.8 a 5.2).
Monoterapia (novodiagnostikovaní pacienti)
Pregabalín sa študoval v 1 kontrolovanom klinickom skúšaní v trvaní 56 týždňov s dávkovaním BID. Pregabalín nebol horší oproti lamotrigínu, čo sa týka dosiahnutia 6-mesačného obdobia bez záchvatov na konci sledovania. Pregabalín a lamotrigín boli podobne bezpečné a dobre tolerované.
Generalizovaná úzkostná porucha
Pregabalín sa študoval v 6 kontrolovaných klinických skúšaniach v trvaní 4 – 6 týždňov, v štúdii so staršími osobami v trvaní 8 týždňov a v dlhodobej štúdii zameranej na prevenciu relapsu s dvojito zaslepenou fázou zameranou na prevenciu relapsu v trvaní 6 mesiacov.
Ústup príznakov GAD vyjadrených Hamiltonovou škálou úzkosti (Hamilton Anxiety Rating
Scale = HAM-A) sa pozoroval v 1. týždni.
V kontrolovaných klinických skúšaniach (v trvaní 4 – 8 týždňov) 52% pacientov liečených pregabalínom a 38% pacientov v skupine s placebom malo aspoň 50% zlepšenie celkového HAM-A skóre od začiatku až po koniec sledovania.
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní v dávkovaní. Oftalmologické vyšetrenie (vrátane vyšetrenia zrakovej ostrosti, formálneho vyšetrenia zorného poľa a vyšetrenia očného pozadia pri rozšírených zreniciach) sa vykonalo u viac ako
3 600 pacientov v rámci kontrolovaných klinických skúšaní. U týchto pacientov bola zraková ostrosť
znížená u 6,5% pacientov liečených pregabalínom a 4,8% pacientov liečených placebom. Zmeny zrakového poľa sa zistili u 12,4% pacientov liečených pregabalínom a 11,7% pacientov liečených placebom. Zmeny na očnom pozadí sa pozorovali u 1,7% pacientov liečených pregabalínom a 2,1% pacientov liečených placebom.
5.2 Farmakokinetické vlastnosti
Farmakokinetika pregabalínu v rovnovážnom stave je podobná u zdravých dobrovoľníkov, pacientov s epilepsiou užívajúcich antiepileptiká a pacientov s chronickou bolesťou.
Absorpcia
Pregabalín sa pri podaní nalačno rýchlo vstrebáva, maximálne plazmatické koncentrácie sa dosiahnu do 1 hodiny po podaní jednorazovej aj viacnásobnej dávky. Biologická dostupnosť pregabalínu po perorálnom podaní sa odhaduje na ≥ 90% a je nezávislá na dávke. Po opakovanom podaní sa rovnovážny stav dosiahne počas 24 až 48 hodín. Rýchlosť absorpcie pregabalínu sa zníži, keď sa podáva s jedlom, čo sa prejaví poklesom Cmax približne o 25 – 30% a predĺžením tmax na približne
2,5 hodiny. Avšak podávanie pregabalínu s jedlom nemá klinicky signifikantný účinok na mieru
absorpcie pregabalínu.
Distribúcia
V predklinických štúdiách sa potvrdil prienik pregabalínu cez hematoencefalickú bariéru u myší,
potkanov a opíc. Bolo dokázané, že pregabalín prechádza cez placentu u potkanov a nachádza sa
v mlieku laktujúcich potkanov. U človeka je zdanlivý distribučný objem pregabalínu po perorálnom podaní približne 0,56 l/kg. Pregabalín sa neviaže na plazmatické proteíny.
Biotransformácia
Pregabalín u človeka podlieha zanedbateľnému metabolizmu. Po podaní dávky rádionuklidom značeného pregabalínu približne 98% rádioaktivity stanovenej v moči predstavoval nezmenený pregabalín. N-metylovaný derivát pregabalínu, hlavný metabolit pregabalínu v moči, predstavoval
0,9%. V predklinických štúdiách sa nezistila racemizácia S-enancioméru pregabalínu na
R-enanciomér.
Eliminácia
Pregabalín sa eliminuje zo systémovej cirkulácie primárne renálnou exkréciou v nezmenenej forme. Priemerný eliminačný polčas je 6,3 hodiny. Plazmatický klírens a renálny klírens pregabalínu sú priamo úmerné klírensu kreatinínu (pozri časť 5.2 Porucha funkcie obličiek).
Je potrebné upraviť dávku u pacientov so zníženými renálnymi funkciami alebo u hemodialyzovaných
pacientov (pozri časť 4.2 Tabuľka 1).
Linearita/nelinearita
Farmakokinetika pregabalínu je lineárna v odporúčanom rozsahu denných dávok. Interindivuduálna farmakokinetická variabilita pregabalínu je nízka (< 20%). Farmakokinetiku pri opakovaných dávkach možno predpovedať z údajov pri jednorazovej dávke. Preto nie je potrebné bežné monitorovanie plazmatických koncentrácií pregabalínu.
Pohlavie
Klinické skúšania potvrdili, že pohlavie nemá klinicky signifikantný vplyv na plazmatické
koncentrácie pregabalínu.
Porucha funkcieobličiek
Klírens pregabalínu je priamo úmerný klírensu kreatinínu. Okrem toho sa pregabalín účinne odstraňuje z plazmy hemodialýzou (po 4-hodinovej hemodialýze klesnú plazmatické koncentrácie pregabalínu asi o 50%). Vzhľadom na to, že eliminácia obličkami je hlavným spôsobom eliminácie, je
potrebné zníženie dávky u pacientov s poruchou funkcie obličiek a doplnková dávka po hemodialýze
(pozri časť 4.2 tabuľka 1).
Porucha funkciepečene
Neboli vykonané žiadne špecifické farmakokinetické štúdie u pacientov s poruchou funkcie pečene. Keďže pregabalín nepodlieha signifikantnému metabolizmu a vylučuje sa prednostne v nezmenenej forme močom, neočakáva sa, že by poškodenie funkcie pečene signifikantne menilo plazmatické koncentrácie pregabalínu.
Pediatrická populácia
Farmakokinetika pregabalínu bola vyhodnocovaná u pediatrických pacientov s epilepsiou (vekové
skupiny: 1 až 23 mesiacov, 2 až 6 rokov, 7 až 11 rokov a 12 až 16 rokov) pri hladinách dávky 2,5; 5;
10 a 15 mg/kg/deň vo farmakokinetickej štúdii a štúdii znášanlivosti.
Po perorálnom podaní pregabalínu u pediatrických pacientov nalačno, bol čas do dosiahnutia maximálnej plazmatickej koncentrácie vo všeobecnosti podobný v rámci všetkých vekových skupín a dosiahol sa 0,5 hodiny až 2 hodiny po podaní dávky.
Parametre Cmax a AUC pregabalínu sa zvyšovali priamo úmerne so zvyšujúcou sa dávkou v rámci každej vekovej skupiny. AUC bola nižšia o 30 % u pediatrických pacientov s telesnou hmotnosťou menej ako 30 kg z dôvodu klírensu upraveného na základe telesnej hmotnosti zvýšeného o 43 %
u týchto pacientov v porovnaní s pacientmi s telesnou hmotnosťou ≥ 30 kg.
Terminálny polčas pregabalínu sa pohyboval v priemere od 3 do 4 hodín u pediatrických pacientov vo veku do 6 rokov a od 4 do 6 hodín u tých, ktorí boli vo veku 7 rokov a starší.
Analýza populačnej farmakokinetiky preukázala, že klírens kreatinínu bol významným vedľajším parametrom klírensu pregabalínu po perorálnom podaní, telesná hmotnosť bola významným vedľajším parametrom zdanlivého distribučného objemu pregabalínu po perorálnom podaní a tieto vzťahy boli podobné u pediatrických a dospelých pacientov.
Farmakokinetika pregabalínu u pacientov mladších ako 3 mesiace nebola skúmaná (pozri časti 4.2,
4.8 a 5.1).
Staršieosoby(vo veku nad 65 rokov)
Klírens pregabalínu má tendenciu klesať so stúpajúcim vekom. Tento pokles klírensu pregabalínu je v súlade s poklesom klírensu kreatinínu, ktorý je podmienený stúpajúcim vekom. Zníženie dávky pregabalínu sa môže vyžadovať u pacientov pri vekom podmienenej poruche funkcie obličiek (pozri časť 4.2 tabuľka 1).
Dojčiacematky
Farmakokinetika 150 mg pregabalínu podávaných každých 12 hodín (300 mg denná dávka) bola vyhodnocovaná u 10 žien počas laktácie, ktoré boli aspoň 12 týždňov po pôrode. Laktácia mala malý až žiadny vplyv na farmakokinetiku pregabalínu. Pregabalín sa vylučoval do materského mlieka
s priemernými koncentráciami v ustálenom stave približne 76% z plazmatických koncentrácií
u matiek. Odhadovaná dávka u dojčaťa z materského mlieka (za predpokladu priemernej konzumácie
mlieka 150 ml/kg/deň) žien užívajúcich 300 mg/deň by bola 0,31 mg/kg/deň alebo 0,62 mg/kg/deň
u žien užívajúcich maximálnu dávku 600 mg/deň. Tieto odhadované dávky predstavujú približne 7%
celkovej dennej dávky u matky v mg/kg.
5.3 Predklinické údaje o bezpečnosti
V obvyklých farmakologických štúdiách bezpečnosti u zvierat bol pregabalín dobre tolerovaný
v klinicky relevantných dávkach. V štúdiách toxicity po opakovanom podávaní u potkanov a opíc sa pozorovali účinky na CNS vrátane hypoaktivity, hyperaktivity a ataxie. Zvýšená incidencia atrofie retiny, bežne pozorovaná u starnúcich potkaních albínov, sa zistila po dlhodobej expozícii pregabalínu v dávkach ≥ 5-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke.
Pregabalín nebol teratogénny u myší, potkanov ani u králikov. Fetálna toxicita u potkanov a králikov
sa vyskytla iba pri dávkach dostatočne prevyšujúcich dávku pre človeka.
V prenatálnych/postnatálnych štúdiách toxicity pregabalín vyvolával vývojovú toxicitu u potomkov potkanov v dávkach > 2-krát vyšších, než je odporúčaná maximálna dávka pre človeka.
Nežiaduce účinky na fertilitu u samčekov a samičiek potkanov sa pozorovali iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia. Nežiaduce účinky na samčie reprodukčné orgány a parametre spermií boli reverzibilné a vyskytli sa iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia, alebo boli spojené so spontánnymi degeneratívnymi procesmi na samčích reprodukčných orgánoch u potkana. Preto sa týmto účinkom pripisuje malý alebo žiadny klinický význam.
Na základe výsledkov mnohých in vitro a in vivo skúšok možno prehlásiť, že pregabalín nie je
genotoxický.
Dvojročné štúdie karcinogenicity s pregabalínom boli vykonané na potkanoch a myšiach. Nepozorovali sa žiadne nádory u potkanov v dávkach až do 24-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke 600 mg/deň. U myší sa nezistil zvýšený výskyt nádorov v dávkach podobných priemernej dávke u človeka, ale zvýšený výskyt hemangiosarkómov sa pozoroval pri vyšších dávkach. Negenotoxický mechanizmus tvorby pregabalínom indukovaných nádorov u myší zahrňuje zmeny krvných doštičiek a súvisiacu proliferáciu endoteliálnych buniek. Tieto zmeny krvných doštičiek neboli prítomné u potkanov alebo u ľudí na základe krátkodobých
a limitovaných dlhodobých klinických údajov. Neexistuje dôkaz, ktorý by naznačoval súvisiace riziko
u ľudí.
U mladých potkanov sa druhy toxicity kvantitatívne nelíšili od tých, ktoré sa pozorovali u dospelých potkanov. Avšak mladé potkany sú oveľa senzitívnejšie. Pri terapeutických dávkach sa dokázali klinické príznaky hyperaktivity CNS a bruxizmus a niektoré zmeny v raste (prechodné potlačenie prírastku telesnej hmotnosti). Účinky na pohlavný cyklus sa pozorovali pri 5-násobku terapeutickej dávky u človeka. Znížená odpoveď na akustický podnet sa pozorovala u mladých potkanov 1 –
2 týždne po expozícii pri > 2-násobku terapeutickej dávky u človeka. Deväť týždňov po expozícii sa už tento účinok viac nepozoroval.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsúl hydroxypropylcelulóza, kukuričný škrob, mastenec
Obal kapsúl
žltý oxid železitý (E172), oxid titaničitý (E171),
erytrozín (E127), želatína, nátriumlaurylsulfát
Atrament
šelak,
čierny oxid železitý (E172),
makrogol,
roztok amoniaku, koncentrovaný, hydroxid draselný
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Blister: Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Fľaška: Fľašku uchovávajte pevne uzatvorenú na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC/Al blistre obsahujúce 14, 56 alebo 100 tvrdých kapsúl.
PVC/PVDC/Al blistre s perforáciou obsahujúce 14 x 1, 56 x 1 alebo 100 x 1 tvrdú kapsulu,
umožňujúce oddelenie jednotlivej dávky.
Fľaška z polyetylénu s vysokou hustotou (HDPE) obsahujúca 200 tvrdých kapsúl.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Generics [UK] Limited
Station Close Potters Bar Hertfordshire EN6 1TL Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/15/997/016
EU/1/15/997/017
EU/1/15/997/018
EU/1/15/997/019
EU/1/15/997/020
EU/1/15/997/021
EU/1/15/997/022
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.1. NÁZOV LIEKUPregabalin Mylan 100 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEJedna tvrdá kapsula obsahuje 100 mg pregabalínu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATvrdá kapsula
Nepriesvitné želatínové kapsuly veľkosti 3 s tvrdým obalom, s telom a viečkom tmavobroskyňovej farby, obsahujúce biely až takmer biely prášok. Na viečku a tele kapsuly je pozdĺž jej osi čiernym atramentom vytlačený nápis
MYLAN a pod ním označenie
PB100.4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieEpilepsiaPregabalin Mylan je indikovaný ako prídavná liečba u dospelých s parciálnymi záchvatmi so sekundárnou generalizáciou alebo bez sekundárnej generalizácie.
Generalizovaná úzkostná poruchaPregabalin Mylan je indikovaný na liečbu generalizovanej úzkostnej poruchy (GAD = Generalised
Anxiety Disorder) u dospelých.
4.2 Dávkovanie a spôsob podávaniaDávkovanieRozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
EpilepsiaLiečbu pregabalínom možno začať dávkou 150 mg denne, ktorá sa podáva rozdelená v dvoch alebo troch dávkach. Podľa individuálnej odpovede pacienta a tolerancie možno dávku po 1 týždni zvýšiť na
300 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Generalizovaná úzkostná poruchaRozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
Potreba liečby sa musí pravidelne opakovane posúdiť.
Liečbu pregabalínom možno začať dávkou 150 mg denne. Podľa individuálnej odpovede pacienta
a tolerancie možno dávku po 1 týždni zvýšiť na 300 mg denne. Po ďalšom týždni možno dávku zvýšiť
na 450 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Ukonč eni e l i eč by pr egabal í nom V súlade so súčasnou klinickou praxou, ak sa musí liečba pregabalínom ukončiť, odporúča sa, aby sa to urobilo postupne počas minimálne 1 týždňa bez ohľadu na indikáciu (pozri časti 4.4 a 4.8).
Osobitné populácie Pacienti s poruchou f unkc i e obl i či ek
Pacienti s poruchou f unkc i e obl i či ek Pregabalín sa zo systémovej cirkulácie primárne eliminuje v nezmenenej forme renálnou exkréciou. Keďže klírens pregabalínu je priamo úmerný klírensu kreatinínu (pozri časť 5.2), dávka u pacientov s poruchou funkcie obličiek sa musí znižovať individuálne podľa klírensu kreatinínu (CLcr), ako je uvedené v tabuľke 1 použitím nasledovného vzorca:
CLcr(ml/min) =
1,23 × [140 – vek (roky)] × hmotnoť (kg)
kreatinín v sére (µmol/l)
(× 0,85 u žien)
Pregabalín možno efektívne odstrániť z plazmy hemodialýzou (50% lieku počas 4 hodín).
U hemodialyzovaných pacientov sa denná dávka pregabalínu musí upraviť podľa funkcie obličiek. K dennej dávke treba pridať doplnkovú dávku okamžite po každej 4-hodinovej hemodialýze (pozri tabuľku 1).
Tabuľka 1 Úprava dávky pregabalínu podľa funkcie obličiek
Klírens kreatinínu
(CLcr) (ml/min)
|
Celková denná dávka pregabalínu *
|
Dávkovací režim
|
| Začiatočná dávka
(mg/deň)
| Maximálna dávka
(mg/deň)
|
|
≥ 60
| 150
| 600
| BID alebo TID
|
≥ 30 – < 60
| 75
| 300
| BID alebo TID
|
≥ 15 – < 30
| 25 – 50
| 150
| Jedenkrát denne alebo BID
|
< 15
| 25
| 75
| Jedenkrát denne
|
Doplnkové dávkovanie po hemodialýze (mg)
|
| 25
| 100
| Jednorazová dávka+
|
TID = tri rozdelené dávky
BID = dve rozdelené dávky
* Celková denná dávka (mg/deň) sa má rozdeliť podľa dávkovacieho režimu a vyjadriť v mg/dávka
+ Doplnková dávka je jedna dodatočná dávka
Pacienti s poruchou f unkc i e pe če ne Nevyžaduje sa žiadna úprava dávky u pacientov s poruchou funkcie pečene (pozri časť 5.2).
Pediatrická populáciaBezpečnosť a účinnosť Pregabalinu Mylan u detí mladších ako 12 rokov a u dospievajúcich (vo veku
12 – 17 rokov) neboli stanovené. Údaje dostupné v súčasnosti sú uvedené v časti 4.8, 5.1 a 5.2, ale nie
je možné vykonať odporúčanie týkajúce sa dávkovania.
St arš i e os oby (vo veku nad 65 rokov)Starší pacienti môžu vyžadovať zníženie dávky pregabalínu z dôvodu zníženej renálnej funkcie (pozri pacienti s poruchou funkcie obličiek).
Spôsob podávaniaPregabalin Mylan sa môže užívať s jedlom alebo bez jedla. Pregabalin Mylan je určený iba na perorálne použitie.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníDiabetickí pacientiPodľa súčasnej klinickej praxe u niektorých diabetických pacientov s prírastkom hmotnosti počas liečby pregabalínom môže byť potrebné upraviť hypoglykemickú liečbu.
Reakcie z precitlivenostiPo uvedení lieku na trh boli zaznamenané hlásenia o rekciách z precitlivenosti vrátane prípadov angioedému. Liečba pregabalínom sa musí okamžite ukončiť, ak sa vyskytnú príznaky angioedému, ako sú faciálny, periorálny opuch alebo opuch horných dýchacích ciest.
Závrat , somnole nci a, st rat a ve domi a, zmäte nosť a ment ál ne poš kode ni e Liečba pregabalínom sa dáva do súvisu so závratom a somnolenciou, ktoré mohli zvýšiť výskyt náhodných zranení (pádov) u staršej populácie. Existujú tiež hlásenia po uvedení lieku na trh o strate vedomia, zmätenosti a mentálnom poškodení. Preto pacientom sa má poradiť, aby boli opatrní, pokým sa neoboznámia s možnými účinkami lieku.
Úči nky spoj ené s videnímV kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní dávkovania. V klinických štúdiách, v ktorých bolo zahrnuté aj oftalmologické vyšetrenie, bol výskyt zníženia zrakovej ostrosti a zmien zorného poľa väčší u pacientov liečených pregabalínom ako
u pacientov liečených placebom; výskyt zmien na očnom pozadí bol väčší u pacientov liečených
placebom (pozri časť 5.1).
Po uvedení lieku na trh boli tiež hlásené nežiaduce reakcie na zrak, vrátane straty zraku, rozmazaného videnia alebo iných zmien zrakovej ostrosti, z ktorých mnohé boli prechodné. Prerušenie liečby pregabalínom môže viesť k vymiznutiu alebo zlepšeniu týchto zrakových príznakov.
Renálne zlyhávanieBoli hlásené prípady renálneho zlyhávania a v niektorých prípadoch prerušenie liečby pregabalínom
viedlo k reverzibilite tejto nežiaducej reakcie.
Vysade ni e s účas ne podá vaných antiepileptíkNie sú dostatočné údaje týkajúce sa vysadenia súčasne podávaných antiepileptík, akonáhle sa po
pridaní pregabalínu dosiahne kontrola záchvatu tak, aby bolo možné podávať pregabalín
v monoterapii.
Príznaky z vysadeniaPo ukončení krátkodobej a dlhodobej liečby pregabalínom boli u niektorých pacientov pozorované príznaky z vysadenia. Uvádzajú sa nasledujúce účinky: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, nervozita, depresia, bolesť, kŕče, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tom informovaný na začiatku liečby.
Počas užívania pregabalínu alebo krátko po ukončení liečby pregabalínom sa môžu vyskytnúť kŕče
vrátane epileptických záchvatov a záchvatov typu grand mal.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
Kongestívne srdcové zlyhávaniePo uvedení lieku na trh boli hlásené prípady kongestívneho srdcového zlyhávania u niektorých pacientov dostávajúcich pregabalín. Tieto reakcie sú najčastejšie pozorované u starších pacientov
s kardiovaskulárnymi ochoreniami počas liečby pregabalínom na neuropatickú indikáciu. Pregabalín
sa má u týchto pacientov podávať s opatrnosťou. Ukončenie podávania pregabalínu môže viesť
k odozneniu reakcie.
Než i aduce re akc i e u pac i ent ov s porane ní m mi ec hy Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy. Možno to pripísať aditívnemu účinku v dôsledku súbežnej liečby inými liekmi (napr. liekmi proti spasticite), ktoré je potrebné užívať pri tomto ochorení.
Samovr aže dné myšl i enk y a správanieSamovražedné myšlienky a správanie boli hlásené u pacientov liečených antiepileptikami pri niekoľkých indikáciách. Meta-analýza randomizovaných placebom kontrolovaných štúdií antiepileptík tiež ukázala málo zvýšené riziko samovražedných myšlienok a správania. Mechanizmus tohto rizika
nie je známy a dostupné údaje nevylučujú možnosť zvýšeného rizika u pregabalínu.
Pacienti majú byť preto sledovaní kvôli prejavom samovražedných myšlienok a správania a má sa u nich zvážiť vhodná liečba. Pacienti (a ich opatrovatelia) majú byť upozornení, aby vyhľadali lekársku pomoc, ak sa prejavy samovražedných myšlienok alebo správania objavia.
Zhorše ná f unkc i a dol ného t ráv i ace ho t rak t u Po uvedení lieku na trh boli hlásené prípady týkajúce sa zhoršenej funkcie dolného tráviaceho traktu (napr. intestinálna obštrukcia, paralytický ileus, obstipácia), keď sa pregabalín podával spolu s liekmi, ktoré môžu spôsobovať obstipáciu, ako sú napr. opioidné analgetiká. Keď sa bude pregabalín užívať
v kombinácii s opioidmi, môžu sa zvážiť opatrenia na predchádzanie obstipácii (zvlášť u žien
a starších pacientov).
Zneuži t i e, s klon k nadmer nému uží vani u l i ek ov al ebo z ávi sl osť Boli hlásené prípady zneužitia, nadmerného užívania liekov a závislosti. Treba byť opatrný
u pacientov s anamnézou nadmerného užívania návykových látok a u takýchto pacientov majú byť sledované príznaky zneužitia pregabalínu, nadmerného užívania alebo závislosti (boli hlásené rozvoj tolerancie, zvyšovanie dávky, správanie vedúce k užitiu lieku).
EncefalopatiaBoli hlásené prípady encefalopatie, hlavne u pacientov s pridruženými stavmi, ktoré môžu vyvolať
encefalopatiu.
4.5 Liekové a iné interakciePretože pregabalín sa vylučuje prevažne v nezmenenej forme močom, podlieha zanedbateľnému metabolizmu u ľudí (< 2% dávky zachytenej v moči vo forme metabolitov), neinhibuje liekový metabolizmus
in vitro a neviaže sa na plazmatické proteíny, je nepravdepodobné, že by spôsobil alebo bol sám subjektom farmakokinetických interakcií.
I n vi vo š t údi e a popul ačná f armakoki ne tická analýzaPodobne, v
in vivo štúdiách sa nepozorovali žiadne klinicky relevantné farmakokinetické interakcie medzi pregabalínom a fenytoínom, karbamazepínom, kyselinou valproovou, lamotrigínom, gabapentínom, lorazepamom, oxykodónom alebo etanolom. Populačná farmakokinetická analýza ukázala, že perorálne antidiabetiká, diuretiká, inzulín, fenobarbital, tiagabín a topiramát nemali klinicky významný účinok na klírens pregabalínu.
Perorálne kontraceptíva, noretisterón a/alebo etinylestradiolSúbežné podávanie pregabalínu s perorálnymi kontraceptívami noretisterónom a/alebo
etinylestradiolom nemá vplyv na farmakokinetiku v rovnovážnom stave žiadnej z týchto látok.
Lie ky ovpl yv ňuj úce centrálny nervový systémPregabalín môže zosilňovať účinky etanolu a lorazepamu. Opakované perorálne dávky pregabalínu podávané súbežne s oxykodónom, lorazepamom alebo etanolom v kontrolovaných klinických štúdiách neviedli ku klinicky významným účinkom na dýchanie. Po uvedení lieku na trh existujú hlásenia
o respiračnom zlyhaní a kóme u pacientov užívajúcich pregabalín a iné lieky utlmujúce centrálny nervový systém (CNS). Ukazuje sa, že pregabalín má aditívny efekt pri poškodení kognitívnej
a hrubej motorickej funkcie spôsobenej oxykodónom.
Interakcie a st arš i e os oby Žiadne špecifické štúdie farmakodynamických interakcií sa nevykonali u starších dobrovoľníkov.
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia Ženy v re produk čnom veku/ Anti konc epc i a u mužov a ži en Keďže potenciálne riziko pre ľudí nie je známe, ženy vo fertilnom veku musia používať účinnú
antikoncepciu.
GraviditaNie sú k dispozícii dostatočné údaje o použití pregabalínu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí.
Pregabalin Mylan sa má užívať počas gravidity iba v nevyhnutných prípadoch (ak prínos pre matku
jednoznačne preváži potenciálne riziko pre plod).
LaktáciaPregabalín sa vylučuje do materského mlieka u ľudí (pozri časť 5.2). Účinok pregabalínu na novorodencov/dojčatá nie je známy. Rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu pregabalínom, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
FertilitaNie sú k dispozícii klinické údaje o účinkoch pregabalínu na ženskú fertilitu.
V klinickom skúšaní hodnotiacom účinok pregabalínu na pohyblivosť spermií boli zdraví muži vystavení pregabalínu v dávke 600 mg/deň. Po 3 mesiacoch liečby sa nezistili žiadne účinky na pohyblivosť spermií.
Štúdia fertility na samičkách potkanov preukázala nežiaduce účinky na reprodukciu. Štúdie fertility na samčekoch potkanov preukázali nežiaduce účinky na reprodukciu a vývin. Klinický význam týchto zistení nie je známy (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojePregabalin Mylan môže mať malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pregabalin Mylan môže vyvolať závraty a ospalosť, a preto môže ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Pacientom treba poradiť, aby neviedli vozidlá, neobsluhovali zložité stroje alebo sa nezapájali do iných potenciálne nebezpečných činností, pokiaľ nie je isté, či tento liek neovplyvňuje ich schopnosť vykonávať uvedené činnosti.
4.8 Nežiaduce účinkyPrehľadbezpečnostnéhoprofiluKlinický program s pregabalínom zahrňoval viac ako 8 900 pacientov užívajúcich pregabalín,
z ktorých viac ako 5 600 bolo zaradených v dvojito-zaslepených placebom kontrolovaných štúdiách. Najčastejšie hlásenými nežiaducimi reakciami boli závraty a somnolencia. Nežiaduce reakcie boli zvyčajne ľahkej až strednej intenzity. Vo všetkých kontrolovaných štúdiách boli nežiaduce reakcie príčinou ukončenia liečby u 12% pacientov užívajúcich pregabalín a u 5% pacientov užívajúcich placebo. Najčastejšími nežiaducimi reakciami vedúcimi k ukončeniu liečby v skupinách
s pregabalínom boli závraty a somnolencia.
Tabuľkový zoznam nežiaducich reakcií
V tabuľke 2 nižšie sú všetky nežiaduce reakcie, ktoré sa vyskytli častejšie než pri placebe a viac než
u jedného pacienta, zoradené podľa triedy a frekvencie (veľmi časté (≥ 1/10); časté (≥ 1/100 až
< 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé
(< 1/10 000), neznáme (nedá sa odhadnúť z dostupných údajov)).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej
závažnosti.
Uvedené nežiaduce reakcie môžu tiež súvisieť so základným ochorením a/alebo sprievodnou liečbou. Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä
somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy (pozri
časť 4.4).
Ďalšie reakcie hlásené na základe skúseností po uvedení lieku na trh sú zaradené v zozname nižšie
kurzívou.
Tabuľka 2 Nežiaduce liekové reakcie pregabalínuTrieda orgánových
systémov Nežiaduce reakcie na liek
|
Infekcie a nákazy
Časté nazofaryngitída
|
Poruchy krvi a lymfatického systému
Menej časté neutropénia
|
Poruchy imunitného systému
Menej časté hypersenzitivita
Zriedkavé angioedém, alergická reakcia
|
Poruchy metabolizmu a výživy
Časté zvýšená chuť do jedla
Menej časté anorexia, hypoglykémia
|
Psychické poruchy
Časté euforická nálada, zmätenosť, iritabilita, dezorientácia, insomnia,
pokles libida
|
Trieda orgánových
systémov Nežiaduce reakcie na liek
|
Menej časté halucinácie, panický atak, nepokoj, agitovanosť, depresia, depresívna nálada, povznášajúca nálada, agresivita, kolísanie nálady, depersonalizácia, ťažkosti s vyhľadávaním slov, abnormálne sny, vzostup libida, anorgazmia, apatia
Zriedkavé strata zábran
|
Poruchy nervového systému
Veľmi časté závraty, somnolencia, bolesť hlavy
Časté ataxia, porucha koordinácie, tremor, dyzartria, amnézia, poruchy pamäti, porucha koncentrácie, parestézia, hypestézia, sedácia, porucha rovnováhy, letargia
Menej časté synkopa, stupor, myoklonus, strata vedomia, psychomotorická hyperaktivita, dyskinéza, posturálne závraty, intenčný tremor, nystagmus, kognitívne poruchy, mentálne poškodenie, porucha reči, hyporeflexia, hyperestézia, pocit pálenia, strata chuti, nevoľnosť
Zriedkavé kŕče, parosmia, hypokinéza, dysgrafia
|
Poruchy oka
Časté zahmlené videnie, diplopia
Menej časté strata periférneho videnia, poruchy videnia, opuch očí, defekty
v zornom poli, zníženie zrakovej ostrosti, bolesti oka, astenopia, fotopsia, suché oči, zvýšená lakrimácia, podráždenie očí
Zriedkavé strata zraku, keratitída, oscilopsia, porušené hĺbkové videnie, mydriáza, strabizmus, porušená zraková ostrosť
|
Poruchy ucha a labyrintu
Časté vertigo
Menej časté hyperakúzia
|
Poruchy srdca a srdcovej činnosti
Menej časté tachykardia, AV blokáda 1. stupňa, sínusová bradykardia,
kongestívne srdcové zlyhávanie
Zriedkavé predĺženie QT, sínusová tachykardia, sínusová arytmia
|
Poruchy ciev
Menej časté hypotenzia, hypertenzia, návaly horúčavy, sčervenanie, periférny pocit chladu
|
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, epistaxa, kašeľ, upchatie nosa, rinitída, chrápanie, suchý
nos
Zriedkavé pľúcny edém, zovreté hrdlo
|
Poruchy gastrointestinálneho traktu
Časté vracanie, nauzea, obstipácia, hnačka, flatulencia, abdominálna distenzia, sucho v ústach
Menej časté gastroezofageálna refluxová choroba, zvýšená salivácia, znížená citlivosť v ústach
Zriedkavé ascites, pankreatitída, opuchnutý jazyk, dysfágia
|
Poruchy kože a podkožného tkaniva
Menej časté papulózny exantém, žihľavka, hyperhidróza, pruritus
Zriedkavé Stevensov-Johnsonov syndróm, studený pot
,
|
Trieda orgánových
systémov Nežiaduce reakcie na liek
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté svalové kŕče, artralgia, bolesti chrbta, bolesti v končatinách, cervikálny spazmus
Menej časté opuch kĺbov, myalgia, svalové zášklby, bolesť šije, svalová
stuhnutosť
Zriedkavé rabdomyolýza
|
Poruchy obličiek a močových ciest
Menej časté močová inkontinencia, dyzúria
Zriedkavé renálne zlyhanie, oligúria, retencia moču
|
Poruchy reprodukčného systému a prsníkov
Časté erektilná dysfunkcia
Menej časté sexuálna dysfunkcia, oneskorená ejakulácia, dysmenorea, bolesť
prsníkov
Zriedkavé amenorea, výtok z prsníkov, zväčšenie prsníkov, gynekomastia
|
Celkové poruchy a reakcie v mieste podania
Časté periférny edém, edém, abnormálna chôdza, padanie, pocit opitosti, abnormálny pocit, únava
Menej časté generalizovaný edém, edém tváre, pocit napätia na hrudníku,
bolesť, pyrexia, smäd, triaška, asténia
|
Laboratórne a funkčné vyšetrenia
Časté zvýšená hmotnosť
Menej časté zvýšená kreatínfosfokináza v krvi, zvýšená alanínaminotransferáza, zvýšená aspartátaminotransferáza, zvýšená glukóza v krvi, znížený počet trombocytov, zvýšený kreatinín v krvi, znížený draslík v krvi, znížená hmotnosť
Zriedkavé znížený počet leukocytov v krvi
|
Po ukončení krátkodobej a dlhodobej liečby pregabalínom sa u niektorých pacientov pozorovali
príznaky z vysadenia. Uvádzajú sa nasledujúce reakcie: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, kŕče, nervozita, depresia, bolesť
, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tejto skutočnosti informovaný na začiatku liečby.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
Pediatrická populáciaBezpečnostný profil pregabalínu pozorovaný v dvoch pediatrických štúdiách (farmakokinetická štúdia a štúdia bezpečnosti, n = 65; 1-ročná otvorená kontrolná štúdia bezpečnosti, n = 54) bol podobný bezpečnostnému profilu, ktorý sa pozoroval v štúdiách u dospelých (pozri časti 4.2, 5.1 a 5.2).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePríznakyPo uvedení lieku na trh najčastejšie hlásené nežiaduce reakcie pozorované po predávkovaní
pregabalínom zahŕňali ospalosť, stavy zmätenosti, agitovanosť a nepokoj.
V zriedkavých prípadoch bola hlásená kóma.
Postup pri predávkovaní
Liečba predávkovania pregabalínom musí zahrňovať štandardné podporné opatrenia a môže zahrňovať podľa potreby aj hemodialýzu (pozri časť 4.2 tabuľka 1).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiepileptiká, iné antiepileptiká, ATC kód: N03AX16
Liečivo pregabalín je analógom gamaaminomaslovej kyseliny [(S)-3-(aminometyl)-5-metylhexánová kyselina].
Mechanizmus účinku
Pregabalín sa viaže na auxiliárne podjednotky (a2-d proteíny) napäťovo ovládaných kalciových
kanálov v centrálnom nervovom systéme.
Klinická účinnosťabezpečnosť
Epilepsia
Prídavná liečba
Pregabalín sa študoval v 3 kontrolovaných klinických skúšaniach v trvaní 12 týždňov s dávkovaním BID alebo dávkovaním TID. Celkové profily bezpečnosti a účinnosti pri BID a TID dávkovacích režimoch boli podobné.
Zníženie frekvencie epileptických záchvatov sa pozorovalo v 1. týždni.
Pediatrická populácia
Účinnosť a bezpečnosť pregabalínu ako doplnkovej liečby pri epilepsii u pediatrických pacientov mladších ako 12 rokov a dospievajúcich nebola stanovená. Nežiaduce udalosti pozorované vo farmakokinetickej štúdii a štúdii znášanlivosti, do ktorých boli zaradení pacienti vo veku od
3 mesiacov do 16 rokov (n = 65), boli podobné tým, ktoré sa pozorovali u dospelých. Výsledky
1-ročnej otvorenej štúdie bezpečnosti u 54 pediatrických pacientov vo veku od 3 mesiacov do
16 rokov s epilepsiou naznačujú, že nežiaduce udalosti pyrexie a infekcií horných dýchacích ciest sa
pozorovali častejšie ako v štúdiách u dospelých (pozri časti 4.2, 4.8 a 5.2).
Monoterapia (novodiagnostikovaní pacienti)
Pregabalín sa študoval v 1 kontrolovanom klinickom skúšaní v trvaní 56 týždňov s dávkovaním BID. Pregabalín nebol horší oproti lamotrigínu, čo sa týka dosiahnutia 6-mesačného obdobia bez záchvatov na konci sledovania. Pregabalín a lamotrigín boli podobne bezpečné a dobre tolerované.
Generalizovaná úzkostná porucha
Pregabalín sa študoval v 6 kontrolovaných klinických skúšaniach v trvaní 4 – 6 týždňov, v štúdii so staršími osobami v trvaní 8 týždňov a v dlhodobej štúdii zameranej na prevenciu relapsu s dvojito zaslepenou fázou zameranou na prevenciu relapsu v trvaní 6 mesiacov.
Ústup príznakov GAD vyjadrených Hamiltonovou škálou úzkosti (Hamilton Anxiety Rating
Scale = HAM-A) sa pozoroval v 1. týždni.
V kontrolovaných klinických skúšaniach (v trvaní 4 – 8 týždňov) 52% pacientov liečených pregabalínom a 38% pacientov v skupine s placebom malo aspoň 50% zlepšenie celkového HAM-A skóre od začiatku až po koniec sledovania.
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní v dávkovaní. Oftalmologické vyšetrenie (vrátane vyšetrenia zrakovej ostrosti, formálneho vyšetrenia zorného poľa a vyšetrenia očného pozadia pri rozšírených zreniciach) sa vykonalo u viac ako
3 600 pacientov v rámci kontrolovaných klinických skúšaní. U týchto pacientov bola zraková ostrosť znížená u 6,5% pacientov liečených pregabalínom a 4,8% pacientov liečených placebom. Zmeny zrakového poľa sa zistili u 12,4% pacientov liečených pregabalínom a 11,7% pacientov liečených placebom. Zmeny na očnom pozadí sa pozorovali u 1,7% pacientov liečených pregabalínom a 2,1% pacientov liečených placebom.
5.2 Farmakokinetické vlastnosti
Farmakokinetika pregabalínu v rovnovážnom stave je podobná u zdravých dobrovoľníkov, pacientov s epilepsiou užívajúcich antiepileptiká a pacientov s chronickou bolesťou.
Absorpcia
Pregabalín sa pri podaní nalačno rýchlo vstrebáva, maximálne plazmatické koncentrácie sa dosiahnu do 1 hodiny po podaní jednorazovej aj viacnásobnej dávky. Biologická dostupnosť pregabalínu po perorálnom podaní sa odhaduje na ≥ 90% a je nezávislá na dávke. Po opakovanom podaní sa rovnovážny stav dosiahne počas 24 až 48 hodín. Rýchlosť absorpcie pregabalínu sa zníži, keď sa podáva s jedlom, čo sa prejaví poklesom Cmax približne o 25 – 30% a predĺžením tmax na približne
2,5 hodiny. Avšak podávanie pregabalínu s jedlom nemá klinicky signifikantný účinok na mieru
absorpcie pregabalínu.
Distribúcia
V predklinických štúdiách sa potvrdil prienik pregabalínu cez hematoencefalickú bariéru u myší,
potkanov a opíc. Bolo dokázané, že pregabalín prechádza cez placentu u potkanov a nachádza sa
v mlieku laktujúcich potkanov. U človeka je zdanlivý distribučný objem pregabalínu po perorálnom podaní približne 0,56 l/kg. Pregabalín sa neviaže na plazmatické proteíny.
Biotransformácia
Pregabalín u človeka podlieha zanedbateľnému metabolizmu. Po podaní dávky rádionuklidom značeného pregabalínu približne 98% rádioaktivity stanovenej v moči predstavoval nezmenený pregabalín. N-metylovaný derivát pregabalínu, hlavný metabolit pregabalínu v moči, predstavoval
0,9%. V predklinických štúdiách sa nezistila racemizácia S-enancioméru pregabalínu na
R-enanciomér.
Eliminácia
Pregabalín sa eliminuje zo systémovej cirkulácie primárne renálnou exkréciou v nezmenenej forme. Priemerný eliminačný polčas je 6,3 hodiny. Plazmatický klírens a renálny klírens pregabalínu sú priamo úmerné klírensu kreatinínu (pozri časť 5.2 Porucha funkcie obličiek).
Je potrebné upraviť dávku u pacientov so zníženými renálnymi funkciami alebo u hemodialyzovaných
pacientov (pozri časť 4.2 tabuľka 1).
Linearita/nelinearita
Farmakokinetika pregabalínu je lineárna v odporúčanom rozsahu denných dávok. Interindivuduálna farmakokinetická variabilita pregabalínu je nízka (< 20%). Farmakokinetiku pri opakovaných dávkach možno predpovedať z údajov pri jednorazovej dávke. Preto nie je potrebné bežné monitorovanie plazmatických koncentrácií pregabalínu.
Pohlavie
Klinické skúšania potvrdili, že pohlavie nemá klinicky signifikantný vplyv na plazmatické koncentrácie pregabalínu.
Porucha funkcieobličiek
Klírens pregabalínu je priamo úmerný klírensu kreatinínu. Okrem toho sa pregabalín účinne odstraňuje z plazmy hemodialýzou (po 4-hodinovej hemodialýze klesnú plazmatické koncentrácie pregabalínu asi o 50%). Vzhľadom na to, že eliminácia obličkami je hlavným spôsobom eliminácie, je potrebné zníženie dávky u pacientov s poruchou funkcie obličiek a doplnková dávka po hemodialýze (pozri časť 4.2 tabuľka 1).
Porucha funkciepečene
Neboli vykonané žiadne špecifické farmakokinetické štúdie u pacientov s poruchou funkcie pečene. Keďže pregabalín nepodlieha signifikantnému metabolizmu a vylučuje sa prednostne v nezmenenej forme močom, neočakáva sa, že by poškodenie funkcie pečene signifikantne menilo plazmatické koncentrácie pregabalínu.
Pediatrická populácia
Farmakokinetika pregabalínu bola vyhodnocovaná u pediatrických pacientov s epilepsiou (vekové
skupiny: 1 až 23 mesiacov, 2 až 6 rokov, 7 až 11 rokov a 12 až 16 rokov) pri hladinách dávky 2,5; 5;
10 a 15 mg/kg/deň vo farmakokinetickej štúdii a štúdii znášanlivosti.
Po perorálnom podaní pregabalínu u pediatrických pacientov nalačno, bol čas do dosiahnutia maximálnej plazmatickej koncentrácie vo všeobecnosti podobný v rámci všetkých vekových skupín a dosiahol sa 0,5 hodiny až 2 hodiny po podaní dávky.
Parametre Cmax a AUC pregabalínu sa zvyšovali priamo úmerne so zvyšujúcou sa dávkou v rámci každej vekovej skupiny. AUC bola nižšia o 30 % u pediatrických pacientov s telesnou hmotnosťou menej ako 30 kg z dôvodu klírensu upraveného na základe telesnej hmotnosti zvýšeného o 43 %
u týchto pacientov v porovnaní s pacientmi s telesnou hmotnosťou ≥ 30 kg.
Terminálny polčas pregabalínu sa pohyboval v priemere od 3 do 4 hodín u pediatrických pacientov vo
veku do 6 rokov a od 4 do 6 hodín u tých, ktorí boli vo veku 7 rokov a starší.
Analýza populačnej farmakokinetiky preukázala, že klírens kreatinínu bol významným vedľajším parametrom klírensu pregabalínu po perorálnom podaní, telesná hmotnosť bola významným vedľajším parametrom zdanlivého distribučného objemu pregabalínu po perorálnom podaní a tieto vzťahy boli podobné u pediatrických a dospelých pacientov.
Farmakokinetika pregabalínu u pacientov mladších ako 3 mesiace nebola skúmaná (pozri časti 4.2,
4.8 a 5.1).
Staršieosoby(vo veku nad 65 rokov)
Klírens pregabalínu má tendenciu klesať so stúpajúcim vekom. Tento pokles klírensu pregabalínu je v súlade s poklesom klírensu kreatinínu, ktorý je podmienený stúpajúcim vekom. Zníženie dávky pregabalínu sa môže vyžadovať u pacientov pri vekom podmienenej poruche funkcie obličiek (pozri časť 4.2 tabuľka 1).
Dojčiacematky
Farmakokinetika 150 mg pregabalínu podávaných každých 12 hodín (300 mg denná dávka) bola vyhodnocovaná u 10 žien počas laktácie, ktoré boli aspoň 12 týždňov po pôrode. Laktácia mala malý až žiadny vplyv na farmakokinetiku pregabalínu. Pregabalín sa vylučoval do materského mlieka
s priemernými koncentráciami v ustálenom stave približne 76% z plazmatických koncentrácií
u matiek. Odhadovaná dávka u dojčaťa z materského mlieka (za predpokladu priemernej konzumácie
mlieka 150 ml/kg/deň) žien užívajúcich 300 mg/deň by bola 0,31 mg/kg/deň alebo 0,62 mg/kg/deň
u žien užívajúcich maximálnu dávku 600 mg/deň. Tieto odhadované dávky predstavujú približne 7%
celkovej dennej dávky u matky v mg/kg.
5.3 Predklinické údaje o bezpečnosti
V obvyklých farmakologických štúdiách bezpečnosti u zvierat bol pregabalín dobre tolerovaný
v klinicky relevantných dávkach. V štúdiách toxicity po opakovanom podávaní u potkanov a opíc sa pozorovali účinky na CNS vrátane hypoaktivity, hyperaktivity a ataxie. Zvýšená incidencia atrofie retiny, bežne pozorovaná u starnúcich potkaních albínov, sa zistila po dlhodobej expozícii pregabalínu v dávkach ≥ 5-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke.
Pregabalín nebol teratogénny u myší, potkanov ani u králikov. Fetálna toxicita u potkanov a králikov
sa vyskytla iba pri dávkach dostatočne prevyšujúcich dávku pre človeka.
V prenatálnych/postnatálnych štúdiách toxicity pregabalín vyvolával vývojovú toxicitu u potomkov potkanov v dávkach > 2-krát vyšších, než je odporúčaná maximálna dávka pre človeka.
Nežiaduce účinky na fertilitu u samčekov a samičiek potkanov sa pozorovali iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia. Nežiaduce účinky na samčie reprodukčné orgány a parametre spermií boli reverzibilné a vyskytli sa iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia, alebo boli spojené so spontánnymi degeneratívnymi procesmi na samčích reprodukčných orgánoch u potkana. Preto sa týmto účinkom pripisuje malý alebo žiadny klinický význam.
Na základe výsledkov mnohých in vitro a in vivo skúšok možno prehlásiť, že pregabalín nie je
genotoxický.
Dvojročné štúdie karcinogenicity s pregabalínom boli vykonané na potkanoch a myšiach. Nepozorovali sa žiadne nádory u potkanov v dávkach až do 24-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke 600 mg/deň. U myší sa nezistil zvýšený výskyt nádorov v dávkach podobných priemernej dávke u človeka, ale zvýšený výskyt hemangiosarkómov sa pozoroval pri vyšších dávkach. Negenotoxický mechanizmus tvorby pregabalínom indukovaných nádorov u myší zahrňuje zmeny krvných doštičiek a súvisiacu proliferáciu endoteliálnych buniek. Tieto zmeny krvných doštičiek neboli prítomné u potkanov alebo u ľudí na základe krátkodobých
a limitovaných dlhodobých klinických údajov. Neexistuje dôkaz, ktorý by naznačoval súvisiace riziko u ľudí.
U mladých potkanov sa druhy toxicity kvantitatívne nelíšili od tých, ktoré sa pozorovali u dospelých potkanov. Avšak mladé potkany sú oveľa senzitívnejšie. Pri terapeutických dávkach sa dokázali klinické príznaky hyperaktivity CNS a bruxizmus a niektoré zmeny v raste (prechodné potlačenie prírastku telesnej hmotnosti). Účinky na pohlavný cyklus sa pozorovali pri 5-násobku terapeutickej dávky u človeka. Znížená odpoveď na akustický podnet sa pozorovala u mladých potkanov 1 –
2 týždne po expozícii pri > 2-násobku terapeutickej dávky u človeka. Deväť týždňov po expozícii sa už tento účinok viac nepozoroval.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsúl hydroxypropylcelulóza, kukuričný škrob,
mastenec
Obal kapsúl
žltý oxid železitý (E172), oxid titaničitý (E171), erytrozín (E127),
želatína,
nátriumlaurylsulfát
Atrament
šelak,
čierny oxid železitý (E172),
makrogol,
roztok amoniaku, koncentrovaný, hydroxid draselný
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC/Al blistre obsahujúce 21, 84 alebo 100 tvrdých kapsúl.
PVC/PVDC/Al blistre s perforáciou obsahujúce 84 x 1 alebo 100 x 1 tvrdú kapsulu, umožňujúce
oddelenie jednotlivej dávky.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Generics [UK] Limited
Station Close Potters Bar Hertfordshire EN6 1TL Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/15/997/023
EU/1/15/997/024
EU/1/15/997/025
EU/1/15/997/026
EU/1/15/997/027
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
1. NÁZOV LIEKU
Pregabalin Mylan 150 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jedna tvrdá kapsula obsahuje 150 mg pregabalínu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá kapsula
Nepriesvitné želatínové kapsuly veľkosti 2 s tvrdým obalom, s bielym telom a viečkom svetlobroskyňovej farby, obsahujúce biely až takmer biely prášok. Na viečku a tele kapsuly je pozdĺž jej osi čiernym atramentom vytlačený nápis MYLAN a pod ním označenie PB150.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Epilepsia
Pregabalin Mylan je indikovaný ako prídavná liečba u dospelých s parciálnymi záchvatmi so sekundárnou generalizáciou alebo bez sekundárnej generalizácie.
Generalizovaná úzkostná porucha
Pregabalin Mylan je indikovaný na liečbu generalizovanej úzkostnej poruchy (GAD = Generalised
Anxiety Disorder) u dospelých.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Rozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
Epilepsia
Liečbu pregabalínom možno začať dávkou 150 mg denne, ktorá sa podáva rozdelená v dvoch alebo troch dávkach. Podľa individuálnej odpovede pacienta a tolerancie možno dávku po 1 týždni zvýšiť na
300 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Generalizovaná úzkostná porucha
Rozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
Potreba liečby sa musí pravidelne opakovane posúdiť.
Liečbu pregabalínom možno začať dávkou 150 mg denne. Podľa individuálnej odpovede pacienta
a tolerancie možno dávku po 1 týždni zvýšiť na 300 mg denne. Po ďalšom týždni možno dávku zvýšiť
na 450 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Ukonč eni e l i eč by pr egabal í nom
V súlade so súčasnou klinickou praxou, ak sa musí liečba pregabalínom ukončiť, odporúča sa, aby sa
to urobilo postupne počas minimálne 1 týždňa bez ohľadu na indikáciu (pozri časti 4.4 a 4.8).
Osobitné populácie Pacienti s poruchou f unkc i e obl i či ek
Pacienti s poruchou f unkc i e obl i či ek Pregabalín sa zo systémovej cirkulácie primárne eliminuje v nezmenenej forme renálnou exkréciou. Keďže klírens pregabalínu je priamo úmerný klírensu kreatinínu (pozri časť 5.2), dávka u pacientov s poruchou funkcie obličiek sa musí znižovať individuálne podľa klírensu kreatinínu (CLcr), ako je uvedené v tabuľke 1 použitím nasledovného vzorca:
CLcr(ml/min) =
1,23 × [140 – vek (roky)] × hmotnoť (kg)
kreatinín v sére (µmol/l)
(× 0,85 u žien)
Pregabalín možno efektívne odstrániť z plazmy hemodialýzou (50% lieku počas 4 hodín).
U hemodialyzovaných pacientov sa denná dávka pregabalínu musí upraviť podľa funkcie obličiek. K dennej dávke treba pridať doplnkovú dávku okamžite po každej 4-hodinovej hemodialýze (pozri tabuľku 1).
Tabuľka 1 Úprava dávky pregabalínu podľa funkcie obličiek
Klírens kreatinínu
(CLcr) (ml/min)
|
Celková denná dávka pregabalínu *
|
Dávkovací režim
|
| Začiatočná dávka
(mg/deň)
| Maximálna dávka
(mg/deň)
|
|
≥ 60
| 150
| 600
| BID alebo TID
|
≥ 30 – < 60
| 75
| 300
| BID alebo TID
|
≥ 15 – < 30
| 25 – 50
| 150
| Jedenkrát denne alebo BID
|
< 15
| 25
| 75
| Jedenkrát denne
|
Doplnkové dávkovanie po hemodialýze (mg)
|
| 25
| 100
| Jednorazová dávka+
|
TID = tri rozdelené dávky
BID = dve rozdelené dávky
* Celková denná dávka (mg/deň) sa má rozdeliť podľa dávkovacieho režimu a vyjadriť v mg/dávka
+ Doplnková dávka je jedna dodatočná dávka
Pacienti s poruchou f unkc i e pe če ne Nevyžaduje sa žiadna úprava dávky u pacientov s poruchou funkcie pečene (pozri časť 5.2).
Pediatrická populáciaBezpečnosť a účinnosť Pregabalinu Mylan u detí mladších ako 12 rokov a u dospievajúcich (vo veku
12 – 17 rokov) neboli stanovené. Údaje dostupné v súčasnosti sú uvedené v časti 4.8, 5.1 a 5.2, ale nie
je možné vykonať odporúčanie týkajúce sa dávkovania.
St arš i e os oby (vo veku nad 65 rokov)Starší pacienti môžu vyžadovať zníženie dávky pregabalínu z dôvodu zníženej renálnej funkcie (pozri pacienti s poruchou funkcie obličiek).
Spôsob podávania
Pregabalin Mylan sa môže užívať s jedlom alebo bez jedla. Pregabalin Mylan je určený iba na perorálne použitie.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Diabetickí pacienti
Podľa súčasnej klinickej praxe u niektorých diabetických pacientov s prírastkom hmotnosti počas liečby pregabalínom môže byť potrebné upraviť hypoglykemickú liečbu.
Reakcie z precitlivenosti
Po uvedení lieku na trh boli zaznamenané hlásenia o rekciách z precitlivenosti vrátane prípadov angioedému. Liečba pregabalínom sa musí okamžite ukončiť, ak sa vyskytnú príznaky angioedému, ako sú faciálny, periorálny opuch alebo opuch horných dýchacích ciest.
Závrat , somnole nci a, st rat a ve domi a, zmäte nosť a ment ál ne poš kode ni e
Liečba pregabalínom sa dáva do súvisu so závratom a somnolenciou, ktoré mohli zvýšiť výskyt náhodných zranení (pádov) u staršej populácie. Existujú tiež hlásenia po uvedení lieku na trh o strate vedomia, zmätenosti a mentálnom poškodení. Preto pacientom sa má poradiť, aby boli opatrní, pokým sa neoboznámia s možnými účinkami lieku.
Úči nky spoj ené s videním
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní dávkovania. V klinických štúdiách, v ktorých bolo zahrnuté aj oftalmologické vyšetrenie, bol výskyt zníženia zrakovej ostrosti a zmien zorného poľa väčší u pacientov liečených pregabalínom ako
u pacientov liečených placebom; výskyt zmien na očnom pozadí bol väčší u pacientov liečených
placebom (pozri časť 5.1).
Po uvedení lieku na trh boli tiež hlásené nežiaduce reakcie na zrak, vrátane straty zraku, rozmazaného videnia alebo iných zmien zrakovej ostrosti, z ktorých mnohé boli prechodné. Prerušenie liečby pregabalínom môže viesť k vymiznutiu alebo zlepšeniu týchto zrakových príznakov.
Renálne zlyhávanie
Boli hlásené prípady renálneho zlyhávania a v niektorých prípadoch prerušenie liečby pregabalínom
viedlo k reverzibilite tejto nežiaducej reakcie.
Vysade ni e s účas ne podáv anýc h ant i epi l ept í k
Nie sú dostatočné údaje týkajúce sa vysadenia súčasne podávaných antiepileptík, akonáhle sa po pridaní pregabalínu dosiahne kontrola záchvatu tak, aby bolo možné podávať pregabalín
v monoterapii.
Príznakyz vysadenia
Po ukončení krátkodobej a dlhodobej liečby pregabalínom boli u niektorých pacientov pozorované príznaky z vysadenia. Uvádzajú sa nasledujúce účinky: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, nervozita, depresia, bolesť, kŕče, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tom informovaný na začiatku liečby.
Počas užívania pregabalínu alebo krátko po ukončení liečby pregabalínom sa môžu vyskytnúť kŕče
vrátane epileptických záchvatov a záchvatov typu grand mal.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
Kongestívne srdcové zlyhávanie
Po uvedení lieku na trh boli hlásené prípady kongestívneho srdcového zlyhávania u niektorých pacientov dostávajúcich pregabalín. Tieto reakcie sú najčastejšie pozorované u starších pacientov
s kardiovaskulárnymi ochoreniami počas liečby pregabalínom na neuropatickú indikáciu. Pregabalín
sa má u týchto pacientov podávať s opatrnosťou. Ukončenie podávania pregabalínu môže viesť
k odozneniu reakcie.
Než i aduce re akc i e u pac i ent ov s porane ní m mi ec hy
Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy. Možno to pripísať aditívnemu účinku v dôsledku súbežnej liečby inými liekmi (napr. liekmi proti spasticite), ktoré je potrebné užívať pri tomto ochorení.
Samovr aže dné myšl i enk y a správanie
Samovražedné myšlienky a správanie boli hlásené u pacientov liečených antiepileptikami pri niekoľkých indikáciách. Meta-analýza randomizovaných placebom kontrolovaných štúdií antiepileptík tiež ukázala málo zvýšené riziko samovražedných myšlienok a správania. Mechanizmus tohto rizika
nie je známy a dostupné údaje nevylučujú možnosť zvýšeného rizika u pregabalínu.
Pacienti majú byť preto sledovaní kvôli prejavom samovražedných myšlienok a správania a má sa u nich zvážiť vhodná liečba. Pacienti (a ich opatrovatelia) majú byť upozornení, aby vyhľadali lekársku pomoc, ak sa prejavy samovražedných myšlienok alebo správania objavia.
Zhorše ná f unkc i a dol ného t ráv i ace ho t rak t u
Po uvedení lieku na trh boli hlásené prípady týkajúce sa zhoršenej funkcie dolného tráviaceho traktu (napr. intestinálna obštrukcia, paralytický ileus, obstipácia), keď sa pregabalín podával spolu s liekmi, ktoré môžu spôsobovať obstipáciu, ako sú napr. opioidné analgetiká. Keď sa bude pregabalín užívať
v kombinácii s opioidmi, môžu sa zvážiť opatrenia na predchádzanie obstipácii (zvlášť u žien a starších pacientov).
Zneuži t i e, s klon k nadmer nému uží vani u l i ek ov al ebo z ávi sl osť
Boli hlásené prípady zneužitia, nadmerného užívania liekov a závislosti. Treba byť opatrný
u pacientov s anamnézou nadmerného užívania návykových látok a u takýchto pacientov majú byť sledované príznaky zneužitia pregabalínu, nadmerného užívania alebo závislosti (boli hlásené rozvoj tolerancie, zvyšovanie dávky, správanie vedúce k užitiu lieku).
Encefalopatia
Boli hlásené prípady encefalopatie, hlavne u pacientov s pridruženými stavmi, ktoré môžu vyvolať
encefalopatiu.
4.5 Liekové a iné interakcie
Pretože pregabalín sa vylučuje prevažne v nezmenenej forme močom, podlieha zanedbateľnému metabolizmu u ľudí (< 2% dávky zachytenej v moči vo forme metabolitov), neinhibuje liekový metabolizmus in vitro a neviaže sa na plazmatické proteíny, je nepravdepodobné, že by spôsobil alebo bol sám subjektom farmakokinetických interakcií.
I n vi vo š t údi e a popul ačná f armakoki net i ck á anal ýz a
Podobne, v in vivo štúdiách sa nepozorovali žiadne klinicky relevantné farmakokinetické interakcie medzi pregabalínom a fenytoínom, karbamazepínom, kyselinou valproovou, lamotrigínom,
gabapentínom, lorazepamom, oxykodónom alebo etanolom. Populačná farmakokinetická analýza ukázala, že perorálne antidiabetiká, diuretiká, inzulín, fenobarbital, tiagabín a topiramát nemali klinicky významný účinok na klírens pregabalínu.
Perorálne kontraceptíva, noretisterón a/alebo etinylestradiol
Súbežné podávanie pregabalínu s perorálnymi kontraceptívami noretisterónom a/alebo etinylestradiolom nemá vplyv na farmakokinetiku v rovnovážnom stave žiadnej z týchto látok.
Lie ky ovpl yv ňuj úce centrálny nervový systém
Pregabalín môže zosilňovať účinky etanolu a lorazepamu. Opakované perorálne dávky pregabalínu podávané súbežne s oxykodónom, lorazepamom alebo etanolom v kontrolovaných klinických štúdiách neviedli ku klinicky významným účinkom na dýchanie. Po uvedení lieku na trh existujú hlásenia
o respiračnom zlyhaní a kóme u pacientov užívajúcich pregabalín a iné lieky utlmujúce centrálny nervový systém (CNS). Ukazuje sa, že pregabalín má aditívny efekt pri poškodení kognitívnej
a hrubej motorickej funkcie spôsobenej oxykodónom.
Interakcie a st arš i e os oby
Žiadne špecifické štúdie farmakodynamických interakcií sa nevykonali u starších dobrovoľníkov.
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženy v re produk čnom veku/ Anti konc epc i a u mužov a ži en
Keďže potenciálne riziko pre ľudí nie je známe, ženy vo fertilnom veku musia používať účinnú
antikoncepciu.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití pregabalínu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí.
Pregabalin Mylan sa má užívať počas gravidity iba v nevyhnutných prípadoch (ak prínos pre matku
jednoznačne preváži potenciálne riziko pre plod).
Laktácia
Pregabalín sa vylučuje do materského mlieka u ľudí (pozri časť 5.2). Účinok pregabalínu na novorodencov/dojčatá nie je známy. Rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu pregabalínom, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii klinické údaje o účinkoch pregabalínu na ženskú fertilitu.
V klinickom skúšaní hodnotiacom účinok pregabalínu na pohyblivosť spermií boli zdraví muži vystavení pregabalínu v dávke 600 mg/deň. Po 3 mesiacoch liečby sa nezistili žiadne účinky na pohyblivosť spermií.
Štúdia fertility na samičkách potkanov preukázala nežiaduce účinky na reprodukciu. Štúdie fertility na samčekoch potkanov preukázali nežiaduce účinky na reprodukciu a vývin. Klinický význam týchto zistení nie je známy (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pregabalin Mylan môže mať malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pregabalin Mylan môže vyvolať závraty a ospalosť, a preto môže ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Pacientom treba poradiť, aby neviedli vozidlá, neobsluhovali zložité stroje
alebo sa nezapájali do iných potenciálne nebezpečných činností, pokiaľ nie je isté, či tento liek neovplyvňuje ich schopnosť vykonávať uvedené činnosti.
4.8 Nežiaduce účinkyPrehľad bezpečnostnéhoprofiluKlinický program s pregabalínom zahrňoval viac ako 8 900 pacientov užívajúcich pregabalín,
z ktorých viac ako 5 600 bolo zaradených v dvojito-zaslepených placebom kontrolovaných štúdiách. Najčastejšie hlásenými nežiaducimi reakciami boli závraty a somnolencia. Nežiaduce reakcie boli zvyčajne ľahkej až strednej intenzity. Vo všetkých kontrolovaných štúdiách boli nežiaduce reakcie príčinou ukončenia liečby u 12% pacientov užívajúcich pregabalín a u 5% pacientov užívajúcich placebo. Najčastejšími nežiaducimi reakciami vedúcimi k ukončeniu liečby v skupinách
s pregabalínom boli závraty a somnolencia.
Tabuľkový zoznam nežiaducich reakciíV tabuľke 2 nižšie sú všetky nežiaduce reakcie, ktoré sa vyskytli častejšie než pri placebe a viac než
u jedného pacienta, zoradené podľa triedy a frekvencie (veľmi časté (≥ 1/10); časté (≥ 1/100 až
< 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé
(<1/10 000), neznáme (nedá sa odhadnúť z dostupných údajov)).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej
závažnosti.
Uvedené nežiaduce reakcie môžu tiež súvisieť so základným ochorením a/alebo sprievodnou liečbou.
Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy (pozri časť 4.4).
Ďalšie reakcie hlásené na základe skúseností po uvedení lieku na trh sú zaradené v zozname nižšie
kurzívou.
Tabuľka 2 Nežiaduce liekové reakcie pregabalínuTrieda orgánových
systémov Nežiaduce reakcie na liek
|
Infekcie a nákazy
Časté nazofaryngitída
|
Poruchy krvi a lymfatického systému
Menej časté neutropénia
|
Poruchy imunitného systému
Menej časté hypersenzitivita
Zriedkavé angioedém, alergická reakcia
|
Poruchy metabolizmu a výživy
Časté zvýšená chuť do jedla
Menej časté anorexia, hypoglykémia
|
Psychické poruchy
Časté euforická nálada, zmätenosť, iritabilita, dezorientácia, insomnia,
pokles libida
|
T
rieda orgánových
systémov
N
ežiaduce reakcie na liek
|
Menej časté halucinácie, panický atak, nepokoj, agitovanosť, depresia, depresívna nálada, povznášajúca nálada, agresivita, kolísanie nálady, depersonalizácia, ťažkosti s vyhľadávaním slov, abnormálne sny, vzostup libida, anorgazmia, apatia
Zriedkavé strata zábran
|
P
oruchy nervového systému
Veľmi časté závraty, somnolencia, bolesť hlavy
Časté ataxia, porucha koordinácie, tremor, dyzartria, amnézia, poruchy pamäti, porucha koncentrácie, parestézia, hypestézia, sedácia, porucha rovnováhy, letargia
Menej časté synkopa, stupor, myoklonus, strata vedomia, psychomotorická hyperaktivita, dyskinéza, posturálne závraty, intenčný tremor, nystagmus, kognitívne poruchy, mentálne poškodenie, porucha reči, hyporeflexia, hyperestézia, pocit pálenia, strata chuti, nevoľnosť
Zriedkavé kŕče, parosmia, hypokinéza, dysgrafia
|
P
oruchy oka
Časté zahmlené videnie, diplopia
Menej časté strata periférneho videnia, poruchy videnia, opuch očí, defekty
v zornom poli, zníženie zrakovej ostrosti, bolesti oka, astenopia, fotopsia, suché oči, zvýšená lakrimácia, podráždenie očí
Zriedkavé strata zraku, keratitída, oscilopsia, porušené hĺbkové videnie, mydriáza, strabizmus, porušená zraková ostrosť
|
P
oruchy ucha a labyrintu
Časté vertigo
Menej časté hyperakúzia
|
P
oruchy srdca a srdcovej činnosti
Menej časté tachykardia, AV blokáda 1. stupňa, sínusová bradykardia,
kongestívne srdcové zlyhávanie
Zriedkavé predĺženie QT, sínusová tachykardia, sínusová arytmia
|
P
oruchy ciev
Menej časté hypotenzia, hypertenzia, návaly horúčavy, sčervenanie, periférny pocit chladu
|
P
oruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, epistaxa, kašeľ, upchatie nosa, rinitída, chrápanie, suchý
nos
Zriedkavé pľúcny edém, zovreté hrdlo
|
P
oruchy gastrointestinálneho traktu
Časté vracanie, nauzea, obstipácia, hnačka, flatulencia, abdominálna distenzia, sucho v ústach
Menej časté gastroezofageálna refluxová choroba, zvýšená salivácia, znížená citlivosť v ústach
Zriedkavé ascites, pankreatitída, opuchnutý jazyk, dysfágia
|
P
oruchy kože a podkožného tkaniva
Menej časté papulózny exantém, žihľavka, hyperhidróza, pruritus
Zriedkavé Stevensov-Johnsonov syndróm, studený pot
,
|
T
rieda orgánových
systémov
N
ežiaduce reakcie na liek
|
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté svalové kŕče, artralgia, bolesti chrbta, bolesti v končatinách,
cervikálny spazmus
Menej časté opuch kĺbov, myalgia, svalové zášklby, bolesť šije, svalová
stuhnutosť
Zriedkavé rabdomyolýza
|
P
oruchy obličiek a močových ciest
Menej časté močová inkontinencia, dyzúria
Zriedkavé renálne zlyhanie, oligúria, retencia moču
|
P
oruchy reprodukčného systému a prsníkov
Časté erektilná dysfunkcia
Menej časté sexuálna dysfunkcia, oneskorená ejakulácia, dysmenorea, bolesť
prsníkov
Zriedkavé amenorea, výtok z prsníkov, zväčšenie prsníkov, gynekomastia
|
C
elkové poruchy a reakcie v mieste podania
Časté periférny edém, edém, abnormálna chôdza, padanie, pocit opitosti, abnormálny pocit, únava
Menej časté generalizovaný edém, edém tváre, pocit napätia na hrudníku,
bolesť, pyrexia, smäd, triaška, asténia
|
L
aboratórne a funkčné vyšetrenia
Časté zvýšená hmotnosť
Menej časté zvýšená kreatínfosfokináza v krvi, zvýšená alanínaminotransferáza, zvýšená aspartátaminotransferáza, zvýšená glukóza v krvi, znížený počet trombocytov, zvýšený kreatinín v krvi, znížený draslík v krvi, znížená hmotnosť
Zriedkavé znížený počet leukocytov v krvi
|
Po ukončení krátkodobej a dlhodobej liečby pregabalínom sa u niektorých pacientov pozorovali
príznaky z vysadenia. Uvádzajú sa nasledujúce reakcie: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, kŕče, nervozita, depresia, bolesť
, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tejto skutočnosti informovaný na začiatku liečby.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
Pediatrická populáciaBezpečnostný profil pregabalínu pozorovaný v dvoch pediatrických štúdiách (farmakokinetická štúdia a štúdia bezpečnosti, n = 65; 1-ročná otvorená kontrolná štúdia bezpečnosti, n = 54) bol podobný bezpečnostnému profilu, ktorý sa pozoroval v štúdiách u dospelých (pozri časti 4.2, 5.1 a 5.2).
Hláseniepodozrenínanežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePríznakyPo uvedení lieku na trh najčastejšie hlásené nežiaduce reakcie pozorované po predávkovaní
pregabalínom zahŕňali ospalosť, stavy zmätenosti, agitovanosť a nepokoj.
V zriedkavých prípadoch bola hlásená kóma. Postup pri predávkovaní
Liečba predávkovania pregabalínom musí zahrňovať štandardné podporné opatrenia a môže zahrňovať podľa potreby aj hemodialýzu (pozri časť 4.2 tabuľka 1).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiepileptiká, iné antiepileptiká, ATC kód: N03AX16
Liečivo pregabalín je analógom gamaaminomaslovej kyseliny [(S)-3-(aminometyl)-5-metylhexánová kyselina].
Mechanizmus účinku
Pregabalín sa viaže na auxiliárne podjednotky (a2-d proteíny) napäťovo ovládaných kalciových
kanálov v centrálnom nervovom systéme.
Klinická účinnosťabezpečnosť
Epilepsia
Prídavná liečba
Pregabalín sa študoval v 3 kontrolovaných klinických skúšaniach v trvaní 12 týždňov s dávkovaním BID alebo dávkovaním TID. Celkové profily bezpečnosti a účinnosti pri BID a TID dávkovacích režimoch boli podobné.
Zníženie frekvencie epileptických záchvatov sa pozorovalo v 1. týždni.
Pediatrická populácia
Účinnosť a bezpečnosť pregabalínu ako doplnkovej liečby pri epilepsii u pediatrických pacientov mladších ako 12 rokov a dospievajúcich nebola stanovená. Nežiaduce udalosti pozorované vo farmakokinetickej štúdii a štúdii znášanlivosti, do ktorých boli zaradení pacienti vo veku od
3 mesiacov do 16 rokov (n = 65), boli podobné tým, ktoré sa pozorovali u dospelých. Výsledky
1-ročnej otvorenej štúdie bezpečnosti u 54 pediatrických pacientov vo veku od 3 mesiacov do
16 rokov s epilepsiou naznačujú, že nežiaduce udalosti pyrexie a infekcií horných dýchacích ciest sa
pozorovali častejšie ako v štúdiách u dospelých (pozri časti 4.2, 4.8 a 5.2).
Monoterapia (novodiagnostikovaní pacienti)
Pregabalín sa študoval v 1 kontrolovanom klinickom skúšaní v trvaní 56 týždňov s dávkovaním BID. Pregabalín nebol horší oproti lamotrigínu, čo sa týka dosiahnutia 6-mesačného obdobia bez záchvatov na konci sledovania. Pregabalín a lamotrigín boli podobne bezpečné a dobre tolerované.
Generalizovaná úzkostná porucha
Pregabalín sa študoval v 6 kontrolovaných klinických skúšaniach v trvaní 4 – 6 týždňov, v štúdii so staršími osobami v trvaní 8 týždňov a v dlhodobej štúdii zameranej na prevenciu relapsu s dvojito zaslepenou fázou zameranou na prevenciu relapsu v trvaní 6 mesiacov.
Ústup príznakov GAD vyjadrených Hamiltonovou škálou úzkosti (Hamilton Anxiety Rating
Scale = HAM-A) sa pozoroval v 1. týždni.
V kontrolovaných klinických skúšaniach (v trvaní 4 – 8 týždňov) 52% pacientov liečených pregabalínom a 38% pacientov v skupine s placebom malo aspoň 50% zlepšenie celkového HAM-A skóre od začiatku až po koniec sledovania.
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní v dávkovaní. Oftalmologické vyšetrenie (vrátane vyšetrenia zrakovej ostrosti, formálneho vyšetrenia zorného poľa a vyšetrenia očného pozadia pri rozšírených zreniciach) sa vykonalo u viac ako
3 600 pacientov v rámci kontrolovaných klinických skúšaní. U týchto pacientov bola zraková ostrosť znížená u 6,5% pacientov liečených pregabalínom a 4,8% pacientov liečených placebom. Zmeny zrakového poľa sa zistili u 12,4% pacientov liečených pregabalínom a 11,7% pacientov liečených placebom. Zmeny na očnom pozadí sa pozorovali u 1,7% pacientov liečených pregabalínom a 2,1% pacientov liečených placebom.
5.2 Farmakokinetické vlastnosti
Farmakokinetika pregabalínu v rovnovážnom stave je podobná u zdravých dobrovoľníkov, pacientov s epilepsiou užívajúcich antiepileptiká a pacientov s chronickou bolesťou.
Absorpcia
Pregabalín sa pri podaní nalačno rýchlo vstrebáva, maximálne plazmatické koncentrácie sa dosiahnu do 1 hodiny po podaní jednorazovej aj viacnásobnej dávky. Biologická dostupnosť pregabalínu po perorálnom podaní sa odhaduje na ≥ 90% a je nezávislá na dávke. Po opakovanom podaní sa rovnovážny stav dosiahne počas 24 až 48 hodín. Rýchlosť absorpcie pregabalínu sa zníži, keď sa podáva s jedlom, čo sa prejaví poklesom Cmax približne o 25 – 30% a predĺžením tmax na približne
2,5 hodiny. Avšak podávanie pregabalínu s jedlom nemá klinicky signifikantný účinok na mieru
absorpcie pregabalínu.
Distribúcia
V predklinických štúdiách sa potvrdil prienik pregabalínu cez hematoencefalickú bariéru u myší,
potkanov a opíc. Bolo dokázané, že pregabalín prechádza cez placentu u potkanov a nachádza sa
v mlieku laktujúcich potkanov. U človeka je zdanlivý distribučný objem pregabalínu po perorálnom
podaní približne 0,56 l/kg. Pregabalín sa neviaže na plazmatické proteíny.
Biotransformácia
Pregabalín u človeka podlieha zanedbateľnému metabolizmu. Po podaní dávky rádionuklidom značeného pregabalínu približne 98% rádioaktivity stanovenej v moči predstavoval nezmenený pregabalín. N-metylovaný derivát pregabalínu, hlavný metabolit pregabalínu v moči, predstavoval
0,9%. V predklinických štúdiách sa nezistila racemizácia S-enancioméru pregabalínu na
R-enanciomér.
Eliminácia
Pregabalín sa eliminuje zo systémovej cirkulácie primárne renálnou exkréciou v nezmenenej forme. Priemerný eliminačný polčas je 6,3 hodiny. Plazmatický klírens a renálny klírens pregabalínu sú priamo úmerné klírensu kreatinínu (pozri časť 5.2 Porucha funkcie obličiek).
Je potrebné upraviť dávku u pacientov so zníženými renálnymi funkciami alebo u hemodialyzovaných
pacientov (pozri časť 4.2 tabuľka 1).
Linearita/nelinearita
Farmakokinetika pregabalínu je lineárna v odporúčanom rozsahu denných dávok. Interindivuduálna farmakokinetická variabilita pregabalínu je nízka (< 20%). Farmakokinetiku pri opakovaných dávkach možno predpovedať z údajov pri jednorazovej dávke. Preto nie je potrebné bežné monitorovanie plazmatických koncentrácií pregabalínu.
Pohlavie
Klinické skúšania potvrdili, že pohlavie nemá klinicky signifikantný vplyv na plazmatické
koncentrácie pregabalínu.
Porucha funkcie
obličiek
Klírens pregabalínu je priamo úmerný klírensu kreatinínu. Okrem toho sa pregabalín účinne odstraňuje z plazmy hemodialýzou (po 4-hodinovej hemodialýze klesnú plazmatické koncentrácie pregabalínu asi o 50%). Vzhľadom na to, že eliminácia obličkami je hlavným spôsobom eliminácie, je potrebné zníženie dávky u pacientov s poruchou funkcie obličiek a doplnková dávka po hemodialýze (pozri časť 4.2 tabuľka 1).
Porucha funkciepečene
Neboli vykonané žiadne špecifické farmakokinetické štúdie u pacientov s poruchou funkcie pečene. Keďže pregabalín nepodlieha signifikantnému metabolizmu a vylučuje sa prednostne v nezmenenej forme močom, neočakáva sa, že by poškodenie funkcie pečene signifikantne menilo plazmatické koncentrácie pregabalínu.
Pediatrická populácia
Farmakokinetika pregabalínu bola vyhodnocovaná u pediatrických pacientov s epilepsiou (vekové
skupiny: 1 až 23 mesiacov, 2 až 6 rokov, 7 až 11 rokov a 12 až 16 rokov) pri hladinách dávky 2,5; 5;
10 a 15 mg/kg/deň vo farmakokinetickej štúdii a štúdii znášanlivosti.
Po perorálnom podaní pregabalínu u pediatrických pacientov nalačno, bol čas do dosiahnutia maximálnej plazmatickej koncentrácie vo všeobecnosti podobný v rámci všetkých vekových skupín a dosiahol sa 0,5 hodiny až 2 hodiny po podaní dávky.
Parametre Cmax a AUC pregabalínu sa zvyšovali priamo úmerne so zvyšujúcou sa dávkou v rámci každej vekovej skupiny. AUC bola nižšia o 30 % u pediatrických pacientov s telesnou hmotnosťou menej ako 30 kg z dôvodu klírensu upraveného na základe telesnej hmotnosti zvýšeného o 43 %
u týchto pacientov v porovnaní s pacientmi s telesnou hmotnosťou ≥ 30 kg.
Terminálny polčas pregabalínu sa pohyboval v priemere od 3 do 4 hodín u pediatrických pacientov vo
veku do 6 rokov a od 4 do 6 hodín u tých, ktorí boli vo veku 7 rokov a starší.
Analýza populačnej farmakokinetiky preukázala, že klírens kreatinínu bol významným vedľajším parametrom klírensu pregabalínu po perorálnom podaní, telesná hmotnosť bola významným vedľajším parametrom zdanlivého distribučného objemu pregabalínu po perorálnom podaní a tieto vzťahy boli podobné u pediatrických a dospelých pacientov.
Farmakokinetika pregabalínu u pacientov mladších ako 3 mesiace nebola skúmaná (pozri časti 4.2,
4.8 a 5.1).
Staršieosoby(vo veku nad 65 rokov)
Klírens pregabalínu má tendenciu klesať so stúpajúcim vekom. Tento pokles klírensu pregabalínu je v súlade s poklesom klírensu kreatinínu, ktorý je podmienený stúpajúcim vekom. Zníženie dávky pregabalínu sa môže vyžadovať u pacientov pri vekom podmienenej poruche funkcie obličiek (pozri časť 4.2 tabuľka 1).
Dojčiacematky
Farmakokinetika 150 mg pregabalínu podávaných každých 12 hodín (300 mg denná dávka) bola vyhodnocovaná u 10 žien počas laktácie, ktoré boli aspoň 12 týždňov po pôrode. Laktácia mala malý až žiadny vplyv na farmakokinetiku pregabalínu. Pregabalín sa vylučoval do materského mlieka
s priemernými koncentráciami v ustálenom stave približne 76% z plazmatických koncentrácií
u matiek. Odhadovaná dávka u dojčaťa z materského mlieka (za predpokladu priemernej konzumácie
mlieka 150 ml/kg/deň) žien užívajúcich 300 mg/deň by bola 0,31 mg/kg/deň alebo 0,62 mg/kg/deň
u žien užívajúcich maximálnu dávku 600 mg/deň. Tieto odhadované dávky predstavujú približne 7%
celkovej dennej dávky u matky v mg/kg.
5.3 Predklinické údaje o bezpečnosti
V obvyklých farmakologických štúdiách bezpečnosti u zvierat bol pregabalín dobre tolerovaný
v klinicky relevantných dávkach. V štúdiách toxicity po opakovanom podávaní u potkanov a opíc sa pozorovali účinky na CNS vrátane hypoaktivity, hyperaktivity a ataxie. Zvýšená incidencia atrofie retiny, bežne pozorovaná u starnúcich potkaních albínov, sa zistila po dlhodobej expozícii pregabalínu v dávkach ≥ 5-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke.
Pregabalín nebol teratogénny u myší, potkanov ani u králikov. Fetálna toxicita u potkanov a králikov sa vyskytla iba pri dávkach dostatočne prevyšujúcich dávku pre človeka.
V prenatálnych/postnatálnych štúdiách toxicity pregabalín vyvolával vývojovú toxicitu u potomkov potkanov v dávkach > 2-krát vyšších, než je odporúčaná maximálna dávka pre človeka.
Nežiaduce účinky na fertilitu u samčekov a samičiek potkanov sa pozorovali iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia. Nežiaduce účinky na samčie reprodukčné orgány a parametre spermií boli reverzibilné a vyskytli sa iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia, alebo boli spojené so spontánnymi degeneratívnymi procesmi na samčích reprodukčných orgánoch u potkana. Preto sa týmto účinkom pripisuje malý alebo žiadny klinický význam.
Na základe výsledkov mnohých in vitro a in vivo skúšok možno prehlásiť, že pregabalín nie je
genotoxický.
Dvojročné štúdie karcinogenicity s pregabalínom boli vykonané na potkanoch a myšiach. Nepozorovali sa žiadne nádory u potkanov v dávkach až do 24-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke 600 mg/deň. U myší sa nezistil zvýšený výskyt nádorov v dávkach podobných priemernej dávke u človeka, ale zvýšený výskyt hemangiosarkómov sa pozoroval pri vyšších dávkach. Negenotoxický mechanizmus tvorby pregabalínom indukovaných nádorov u myší zahrňuje zmeny krvných doštičiek a súvisiacu proliferáciu endoteliálnych buniek. Tieto zmeny krvných doštičiek neboli prítomné u potkanov alebo u ľudí na základe krátkodobých
a limitovaných dlhodobých klinických údajov. Neexistuje dôkaz, ktorý by naznačoval súvisiace riziko u ľudí.
U mladých potkanov sa druhy toxicity kvantitatívne nelíšili od tých, ktoré sa pozorovali u dospelých potkanov. Avšak mladé potkany sú oveľa senzitívnejšie. Pri terapeutických dávkach sa dokázali klinické príznaky hyperaktivity CNS a bruxizmus a niektoré zmeny v raste (prechodné potlačenie prírastku telesnej hmotnosti). Účinky na pohlavný cyklus sa pozorovali pri 5-násobku terapeutickej dávky u človeka. Znížená odpoveď na akustický podnet sa pozorovala u mladých potkanov 1 –
2 týždne po expozícii pri > 2-násobku terapeutickej dávky u človeka. Deväť týždňov po expozícii sa už tento účinok viac nepozoroval.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsúl hydroxypropylcelulóza, kukuričný škrob, mastenec
Obal kapsúl
žltý oxid železitý (E172),
oxid titaničitý (E171), erytrozín (E127), želatína, nátriumlaurylsulfát
Atrament
šelak,
čierny oxid železitý (E172),
makrogol,
roztok amoniaku, koncentrovaný, hydroxid draselný
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Blister: Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Fľaška: Fľašku uchovávajte pevne uzatvorenú na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC/Al blistre obsahujúce 14, 56 alebo 100 tvrdých kapsúl.
PVC/PVDC/Al blistre s perforáciou obsahujúce 14 x 1, 56 x 1 alebo 100 x 1 tvrdú kapsulu, umožňujúce oddelenie jednotlivej dávky. Fľaška z polyetylénu s vysokou hustotou (HDPE) obsahujúca 200 tvrdých kapsúl.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Generics [UK] Limited
Station Close Potters Bar Hertfordshire EN6 1TL Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/15/997/028
EU/1/15/997/029
EU/1/15/997/030
EU/1/15/997/031
EU/1/15/997/032
EU/1/15/997/033
EU/1/15/997/034
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
1. NÁZOV LIEKU
Pregabalin Mylan 200 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jedna tvrdá kapsula obsahuje 200 mg pregabalínu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá kapsula
Nepriesvitné želatínové kapsuly veľkosti 1 s tvrdým obalom, s telom a viečkom svetlobroskyňovej farby, obsahujúce biely až takmer biely prášok. Na viečku a tele kapsuly je pozdĺž jej osi čiernym atramentom vytlačený nápis MYLAN a pod ním označenie PB200.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Epilepsia
Pregabalin Mylan je indikovaný ako prídavná liečba u dospelých s parciálnymi záchvatmi so sekundárnou generalizáciou alebo bez sekundárnej generalizácie.
Generalizovaná úzkostná porucha
Pregabalin Mylan je indikovaný na liečbu generalizovanej úzkostnej poruchy (GAD = Generalised
Anxiety Disorder) u dospelých.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Rozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
Epilepsia
Liečbu pregabalínom možno začať dávkou 150 mg denne, ktorá sa podáva rozdelená v dvoch alebo troch dávkach. Podľa individuálnej odpovede pacienta a tolerancie možno dávku po 1 týždni zvýšiť na
300 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Generalizovaná úzkostná porucha
Rozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
Potreba liečby sa musí pravidelne opakovane posúdiť.
Liečbu pregabalínom možno začať dávkou 150 mg denne. Podľa individuálnej odpovede pacienta
a tolerancie možno dávku po 1 týždni zvýšiť na 300 mg denne. Po ďalšom týždni možno dávku zvýšiť
na 450 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Ukonč eni e l i eč by pr egabal í nom
V súlade so súčasnou klinickou praxou, ak sa musí liečba pregabalínom ukončiť, odporúča sa, aby sa to urobilo postupne počas minimálne 1 týždňa bez ohľadu na indikáciu (pozri časti 4.4 a 4.8).
O
sobitné populácie
 Pacienti s poruchou f unkc i e obl i či ek
Pacienti s poruchou f unkc i e obl i či ek
Pregabalín sa zo systémovej cirkulácie primárne eliminuje v nezmenenej forme renálnou exkréciou. Keďže klírens pregabalínu je priamo úmerný klírensu kreatinínu (pozri časť 5.2), dávka u pacientov s poruchou funkcie obličiek sa musí znižovať individuálne podľa klírensu kreatinínu (CLcr), ako je uvedené v tabuľke 1 použitím nasledovného vzorca:
CLcr(ml/min) =
1,23 × [140 – vek (roky)] × hmotnoť (kg)
kreatinín v sére (µmol/l)
(× 0,85 u žien)
Pregabalín možno efektívne odstrániť z plazmy hemodialýzou (50% lieku počas 4 hodín).
U hemodialyzovaných pacientov sa denná dávka pregabalínu musí upraviť podľa funkcie obličiek. K dennej dávke treba pridať doplnkovú dávku okamžite po každej 4-hodinovej hemodialýze (pozri tabuľku 1).
Tabuľka 1 Úprava dávky pregabalínu podľa funkcie obličiek
Klírens kreatinínu
(CLcr) (ml/min)
|
Celková denná dávka pregabalínu *
|
Dávkovací režim
|
| Začiatočná dávka
(mg/deň)
| Maximálna dávka
(mg/deň)
|
|
≥ 60
| 150
| 600
| BID alebo TID
|
≥ 30 – < 60
| 75
| 300
| BID alebo TID
|
≥ 15 – < 30
| 25 – 50
| 150
| Jedenkrát denne alebo BID
|
< 15
| 25
| 75
| Jedenkrát denne
|
Doplnkové dávkovanie po hemodialýze (mg)
|
| 25
| 100
| Jednorazová dávka+
|
TID = tri rozdelené dávky
BID = dve rozdelené dávky
* Celková denná dávka (mg/deň) sa má rozdeliť podľa dávkovacieho režimu a vyjadriť v mg/dávka
+ Doplnková dávka je jedna dodatočná dávka
Pacienti s poruchou funkc i e pe če ne Nevyžaduje sa žiadna úprava dávky u pacientov s poruchou funkcie pečene (pozri časť 5.2).
Pediatrická populáciaBezpečnosť a účinnosť Pregabalinu Mylan u detí mladších ako 12 rokov a u dospievajúcich (vo veku
12 – 17 rokov) neboli stanovené. Údaje dostupné v súčasnosti sú uvedené v časti 4.8, 5.1 a 5.2, ale nie
je možné vykonať odporúčanie týkajúce sa dávkovania.
St arš i e os oby (vo veku nad 65 rokov)Starší pacienti môžu vyžadovať zníženie dávky pregabalínu z dôvodu zníženej renálnej funkcie (pozri pacienti s poruchou funkcie obličiek).
Spôsob podávaniaPregabalin Mylan sa môže užívať s jedlom alebo bez jedla. Pregabalin Mylan je určený iba na perorálne použitie.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Diabetickí pacienti
Podľa súčasnej klinickej praxe u niektorých diabetických pacientov s prírastkom hmotnosti počas liečby pregabalínom môže byť potrebné upraviť hypoglykemickú liečbu.
Reakcie z precitlivenosti
Po uvedení lieku na trh boli zaznamenané hlásenia o rekciách z precitlivenosti vrátane prípadov angioedému. Liečba pregabalínom sa musí okamžite ukončiť, ak sa vyskytnú príznaky angioedému, ako sú faciálny, periorálny opuch alebo opuch horných dýchacích ciest.
Závrat , somnole nci a, st rat a ve domi a, zmäte nosť a ment ál ne poš kode ni e
Liečba pregabalínom sa dáva do súvisu so závratom a somnolenciou, ktoré mohli zvýšiť výskyt náhodných zranení (pádov) u staršej populácie. Existujú tiež hlásenia po uvedení lieku na trh o strate vedomia, zmätenosti a mentálnom poškodení. Preto pacientom sa má poradiť, aby boli opatrní, pokým sa neoboznámia s možnými účinkami lieku.
Úči nky spoj ené s videním
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní dávkovania. V klinických štúdiách, v ktorých bolo zahrnuté aj oftalmologické vyšetrenie, bol výskyt zníženia zrakovej ostrosti a zmien zorného poľa väčší u pacientov liečených pregabalínom ako
u pacientov liečených placebom; výskyt zmien na očnom pozadí bol väčší u pacientov liečených placebom (pozri časť 5.1).
Po uvedení lieku na trh boli tiež hlásené nežiaduce reakcie na zrak, vrátane straty zraku, rozmazaného videnia alebo iných zmien zrakovej ostrosti, z ktorých mnohé boli prechodné. Prerušenie liečby pregabalínom môže viesť k vymiznutiu alebo zlepšeniu týchto zrakových príznakov.
Renálne zlyhávanie
Boli hlásené prípady renálneho zlyhávania a v niektorých prípadoch prerušenie liečby pregabalínom
viedlo k reverzibilite tejto nežiaducej reakcie.
Vysade ni e s účas ne podáv anýc h ant i epi l ept í k
Nie sú dostatočné údaje týkajúce sa vysadenia súčasne podávaných antiepileptík, akonáhle sa po
pridaní pregabalínu dosiahne kontrola záchvatu tak, aby bolo možné podávať pregabalín
v monoterapii.
Príznakyz vysadenia
Po ukončení krátkodobej a dlhodobej liečby pregabalínom boli u niektorých pacientov pozorované príznaky z vysadenia. Uvádzajú sa nasledujúce účinky: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, nervozita, depresia, bolesť, kŕče, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tom informovaný na začiatku liečby.
Počas užívania pregabalínu alebo krátko po ukončení liečby pregabalínom sa môžu vyskytnúť kŕče
vrátane epileptických záchvatov a záchvatov typu grand mal.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
K
ongestívne srdcové zlyhávanie
Po uvedení lieku na trh boli hlásené prípady kongestívneho srdcového zlyhávania u niektorých pacientov dostávajúcich pregabalín. Tieto reakcie sú najčastejšie pozorované u starších pacientov
s kardiovaskulárnymi ochoreniami počas liečby pregabalínom na neuropatickú indikáciu. Pregabalín
sa má u týchto pacientov podávať s opatrnosťou. Ukončenie podávania pregabalínu môže viesť
k odozneniu reakcie.
Než i aduce re akc i e u pac i ent ov s porane ní m mi ec hy
Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy. Možno to pripísať aditívnemu účinku v dôsledku súbežnej liečby inými liekmi (napr. liekmi proti spasticite), ktoré je potrebné užívať pri tomto ochorení.
Samovr aže dné myšl i enk y a správanie
Samovražedné myšlienky a správanie boli hlásené u pacientov liečených antiepileptikami pri niekoľkých indikáciách. Meta-analýza randomizovaných placebom kontrolovaných štúdií antiepileptík tiež ukázala málo zvýšené riziko samovražedných myšlienok a správania. Mechanizmus tohto rizika
nie je známy a dostupné údaje nevylučujú možnosť zvýšeného rizika u pregabalínu.
Pacienti majú byť preto sledovaní kvôli prejavom samovražedných myšlienok a správania a má sa u nich zvážiť vhodná liečba. Pacienti (a ich opatrovatelia) majú byť upozornení, aby vyhľadali lekársku pomoc, ak sa prejavy samovražedných myšlienok alebo správania objavia.
Zhorše ná f unkc i a dol ného t ráv i ace ho t rak t u
Po uvedení lieku na trh boli hlásené prípady týkajúce sa zhoršenej funkcie dolného tráviaceho traktu (napr. intestinálna obštrukcia, paralytický ileus, obstipácia), keď sa pregabalín podával spolu s liekmi, ktoré môžu spôsobovať obstipáciu, ako sú napr. opioidné analgetiká. Keď sa bude pregabalín užívať
v kombinácii s opioidmi, môžu sa zvážiť opatrenia na predchádzanie obstipácii (zvlášť u žien
a starších pacientov).
Zneuži t i e, s klon k nadmer nému uží vani u l i ek ov al ebo z ávi sl osť
Boli hlásené prípady zneužitia, nadmerného užívania liekov a závislosti. Treba byť opatrný
u pacientov s anamnézou nadmerného užívania návykových látok a u takýchto pacientov majú byť sledované príznaky zneužitia pregabalínu, nadmerného užívania alebo závislosti (boli hlásené rozvoj tolerancie, zvyšovanie dávky, správanie vedúce k užitiu lieku).
Encefalopatia
Boli hlásené prípady encefalopatie, hlavne u pacientov s pridruženými stavmi, ktoré môžu vyvolať
encefalopatiu.
4.5 Liekové a iné interakcie
Pretože pregabalín sa vylučuje prevažne v nezmenenej forme močom, podlieha zanedbateľnému metabolizmu u ľudí (< 2% dávky zachytenej v moči vo forme metabolitov), neinhibuje liekový metabolizmus in vitro a neviaže sa na plazmatické proteíny, je nepravdepodobné, že by spôsobil alebo bol sám subjektom farmakokinetických interakcií.
I n vi vo š t údi e a popul ačná f armakoki net i ck á anal ýz a
Podobne, v in vivo štúdiách sa nepozorovali žiadne klinicky relevantné farmakokinetické interakcie medzi pregabalínom a fenytoínom, karbamazepínom, kyselinou valproovou, lamotrigínom, gabapentínom, lorazepamom, oxykodónom alebo etanolom. Populačná farmakokinetická analýza ukázala, že perorálne antidiabetiká, diuretiká, inzulín, fenobarbital, tiagabín a topiramát nemali klinicky významný účinok na klírens pregabalínu.
Perorálne kontraceptíva, noretisterón a/alebo etinylestradiol
Súbežné podávanie pregabalínu s perorálnymi kontraceptívami noretisterónom a/alebo
etinylestradiolom nemá vplyv na farmakokinetiku v rovnovážnom stave žiadnej z týchto látok.
Lie ky ovpl yv ňuj úce centrálny nervový systém
Pregabalín môže zosilňovať účinky etanolu a lorazepamu. Opakované perorálne dávky pregabalínu podávané súbežne s oxykodónom, lorazepamom alebo etanolom v kontrolovaných klinických štúdiách neviedli ku klinicky významným účinkom na dýchanie. Po uvedení lieku na trh existujú hlásenia
o respiračnom zlyhaní a kóme u pacientov užívajúcich pregabalín a iné lieky utlmujúce centrálny nervový systém (CNS). Ukazuje sa, že pregabalín má aditívny efekt pri poškodení kognitívnej
a hrubej motorickej funkcie spôsobenej oxykodónom.
Interakcie a st arš i e os oby
Žiadne špecifické štúdie farmakodynamických interakcií sa nevykonali u starších dobrovoľníkov.
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženy v re produk čnom veku/ Anti konc epc i a u mužov a ži en
Keďže potenciálne riziko pre ľudí nie je známe, ženy vo fertilnom veku musia používať účinnú
antikoncepciu.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití pregabalínu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí.
Pregabalin Mylan sa má užívať počas gravidity iba v nevyhnutných prípadoch (ak prínos pre matku
jednoznačne preváži potenciálne riziko pre plod).
Laktácia
Pregabalín sa vylučuje do materského mlieka u ľudí (pozri časť 5.2). Účinok pregabalínu na novorodencov/dojčatá nie je známy. Rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu pregabalínom, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii klinické údaje o účinkoch pregabalínu na ženskú fertilitu.
V klinickom skúšaní hodnotiacom účinok pregabalínu na pohyblivosť spermií boli zdraví muži vystavení pregabalínu v dávke 600 mg/deň. Po 3 mesiacoch liečby sa nezistili žiadne účinky na pohyblivosť spermií.
Štúdia fertility na samičkách potkanov preukázala nežiaduce účinky na reprodukciu. Štúdie fertility na samčekoch potkanov preukázali nežiaduce účinky na reprodukciu a vývin. Klinický význam týchto zistení nie je známy (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pregabalin Mylan môže mať malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pregabalin Mylan môže vyvolať závraty a ospalosť, a preto môže ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Pacientom treba poradiť, aby neviedli vozidlá, neobsluhovali zložité stroje alebo sa nezapájali do iných potenciálne nebezpečných činností, pokiaľ nie je isté, či tento liek neovplyvňuje ich schopnosť vykonávať uvedené činnosti.
4.8 Nežiaduce účinky
Prehľad bezpečnostnéhoprofiluKlinický program s pregabalínom zahrňoval viac ako 8 900 pacientov užívajúcich pregabalín,
z ktorých viac ako 5 600 bolo zaradených v dvojito-zaslepených placebom kontrolovaných štúdiách. Najčastejšie hlásenými nežiaducimi reakciami boli závraty a somnolencia. Nežiaduce reakcie boli zvyčajne ľahkej až strednej intenzity. Vo všetkých kontrolovaných štúdiách boli nežiaduce reakcie príčinou ukončenia liečby u 12% pacientov užívajúcich pregabalín a u 5% pacientov užívajúcich placebo. Najčastejšími nežiaducimi reakciami vedúcimi k ukončeniu liečby v skupinách
s pregabalínom boli závraty a somnolencia.
Tabuľkový zoznam nežiaducich reakciíV tabuľke 2 nižšie sú všetky nežiaduce reakcie, ktoré sa vyskytli častejšie než pri placebe a viac než
u jedného pacienta, zoradené podľa triedy a frekvencie (veľmi časté (≥ 1/10); časté (≥ 1/100 až
< 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé
(< 1/10 000), neznáme (nedá sa odhadnúť z dostupných údajov)).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej
závažnosti.
Uvedené nežiaduce reakcie môžu tiež súvisieť so základným ochorením a/alebo sprievodnou liečbou.
Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy (pozri časť 4.4).
Ďalšie reakcie hlásené na základe skúseností po uvedení lieku na trh sú zaradené v zozname nižšie
kurzívou.
Tabuľka 2 Nežiaduce liekové reakcie pregabalínuTrieda orgánových
systémov Nežiaduce reakcie na liek
|
Infekcie a nákazy
Časté nazofaryngitída
|
Poruchy krvi a lymfatického systému
Menej časté neutropénia
|
Poruchy imunitného systému
Menej časté hypersenzitivita
Zriedkavé angioedém, alergická reakcia
|
Poruchy metabolizmu a výživy
Časté zvýšená chuť do jedla
Menej časté anorexia, hypoglykémia
|
Psychické poruchy
Časté euforická nálada, zmätenosť, iritabilita, dezorientácia, insomnia,
pokles libida
Menej časté halucinácie, panický atak, nepokoj, agitovanosť, depresia, depresívna nálada, povznášajúca nálada, agresivita, kolísanie nálady, depersonalizácia, ťažkosti s vyhľadávaním slov, abnormálne sny, vzostup libida, anorgazmia, apatia
Zriedkavé strata zábran
|
T
rieda orgánových
systémov
N
ežiaduce reakcie na liek
|
P
oruchy nervového systému
Veľmi časté závraty, somnolencia, bolesť hlavy
Časté ataxia, porucha koordinácie, tremor, dyzartria, amnézia, poruchy pamäti, porucha koncentrácie, parestézia, hypestézia, sedácia, porucha rovnováhy, letargia
Menej časté synkopa, stupor, myoklonus, strata vedomia, psychomotorická hyperaktivita, dyskinéza, posturálne závraty, intenčný tremor, nystagmus, kognitívne poruchy, mentálne poškodenie, porucha reči, hyporeflexia, hyperestézia, pocit pálenia, strata chuti, nevoľnosť
Zriedkavé kŕče, parosmia, hypokinéza, dysgrafia
|
P
oruchy oka
Časté zahmlené videnie, diplopia
Menej časté strata periférneho videnia, poruchy videnia, opuch očí, defekty
v zornom poli, zníženie zrakovej ostrosti, bolesti oka, astenopia, fotopsia, suché oči, zvýšená lakrimácia, podráždenie očí
Zriedkavé strata zraku, keratitída, oscilopsia, porušené hĺbkové videnie, mydriáza, strabizmus, porušená zraková ostrosť
|
P
oruchy ucha a labyrintu
Časté vertigo
Menej časté hyperakúzia
|
P
oruchy srdca a srdcovej činnosti
Menej časté tachykardia, AV blokáda 1. stupňa, sínusová bradykardia,
kongestívne srdcové zlyhávanie
Zriedkavé predĺženie QT, sínusová tachykardia, sínusová arytmia
|
P
oruchy ciev
Menej časté hypotenzia, hypertenzia, návaly horúčavy, sčervenanie, periférny pocit chladu
|
P
oruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, epistaxa, kašeľ, upchatie nosa, rinitída, chrápanie, suchý
nos
Zriedkavé pľúcny edém, zovreté hrdlo
|
P
oruchy gastrointestinálneho traktu
Časté vracanie, nauzea, obstipácia, hnačka, flatulencia, abdominálna distenzia, sucho v ústach
Menej časté gastroezofageálna refluxová choroba, zvýšená salivácia, znížená citlivosť v ústach
Zriedkavé ascites, pankreatitída, opuchnutý jazyk, dysfágia
|
P
oruchy kože a podkožného tkaniva
Menej časté papulózny exantém, žihľavka, hyperhidróza, pruritus
Zriedkavé Stevensov-Johnsonov syndróm, studený pot
,
|
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté svalové kŕče, artralgia, bolesti chrbta, bolesti v končatinách,
cervikálny spazmus
Menej časté opuch kĺbov, myalgia, svalové zášklby, bolesť šije, svalová
stuhnutosť
Zriedkavé rabdomyolýza
|
P
oruchy obličiek a močových ciest
Menej časté močová inkontinencia, dyzúria
Zriedkavé renálne zlyhanie, oligúria, retencia moču
|
T
rieda orgánových
systémov
N
ežiaduce reakcie na liek
|
P
oruchy reprodukčného systému a prsníkov
Časté erektilná dysfunkcia
Menej časté sexuálna dysfunkcia, oneskorená ejakulácia, dysmenorea, bolesť
prsníkov
Zriedkavé amenorea, výtok z prsníkov, zväčšenie prsníkov, gynekomastia
|
C
elkové poruchy a reakcie v mieste podania
Časté periférny edém, edém, abnormálna chôdza, padanie, pocit opitosti, abnormálny pocit, únava
Menej časté generalizovaný edém, edém tváre, pocit napätia na hrudníku,
bolesť, pyrexia, smäd, triaška, asténia
|
L
aboratórne a funkčné vyšetrenia
Časté zvýšená hmotnosť
Menej časté zvýšená kreatínfosfokináza v krvi, zvýšená alanínaminotransferáza, zvýšená aspartátaminotransferáza, zvýšená glukóza v krvi, znížený počet trombocytov, zvýšený kreatinín v krvi, znížený draslík v krvi, znížená hmotnosť
Zriedkavé znížený počet leukocytov v krvi
|
Po ukončení krátkodobej a dlhodobej liečby pregabalínom sa u niektorých pacientov pozorovali
príznaky z vysadenia. Uvádzajú sa nasledujúce reakcie: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, kŕče, nervozita, depresia, bolesť
, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tejto skutočnosti informovaný na začiatku liečby.'
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
Pediatrická populáciaBezpečnostný profil pregabalínu pozorovaný v dvoch pediatrických štúdiách (farmakokinetická štúdia a štúdia bezpečnosti, n = 65; 1-ročná otvorená kontrolná štúdia bezpečnosti, n = 54) bol podobný bezpečnostnému profilu, ktorý sa pozoroval v štúdiách u dospelých (pozri časti 4.2, 5.1 a 5.2).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePríznakyPo uvedení lieku na trh najčastejšie hlásené nežiaduce reakcie pozorované po predávkovaní
pregabalínom zahŕňali ospalosť, stavy zmätenosti, agitovanosť a nepokoj. V zriedkavých prípadoch bola hlásená kóma.
Postup pri predávkovaníLiečba predávkovania pregabalínom musí zahrňovať štandardné podporné opatrenia a môže zahrňovať podľa potreby aj hemodialýzu (pozri časť 4.2 tabuľka 1).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiepileptiká, iné antiepileptiká, ATC kód: N03AX16
Liečivo pregabalín je analógom gamaaminomaslovej kyseliny [(S)-3-(aminometyl)-5-metylhexánová kyselina].
Mechanizmus účinku
Pregabalín sa viaže na auxiliárne podjednotky (a2-d proteíny) napäťovo ovládaných kalciových
kanálov v centrálnom nervovom systéme.
Klinická účinnosťabezpečnosť
Epilepsia
Prídavná liečba
Pregabalín sa študoval v 3 kontrolovaných klinických skúšaniach v trvaní 12 týždňov s dávkovaním BID alebo dávkovaním TID. Celkové profily bezpečnosti a účinnosti pri BID a TID dávkovacích režimoch boli podobné.
Zníženie frekvencie epileptických záchvatov sa pozorovalo v 1. týždni.
Pediatrická populácia
Účinnosť a bezpečnosť pregabalínu ako doplnkovej liečby pri epilepsii u pediatrických pacientov mladších ako 12 rokov a dospievajúcich nebola stanovená. Nežiaduce udalosti pozorované vo farmakokinetickej štúdii a štúdii znášanlivosti, do ktorých boli zaradení pacienti vo veku od
3 mesiacov do 16 rokov (n = 65), boli podobné tým, ktoré sa pozorovali u dospelých. Výsledky
1-ročnej otvorenej štúdie bezpečnosti u 54 pediatrických pacientov vo veku od 3 mesiacov do
16 rokov s epilepsiou naznačujú, že nežiaduce udalosti pyrexie a infekcií horných dýchacích ciest sa
pozorovali častejšie ako v štúdiách u dospelých (pozri časti 4.2, 4.8 a 5.2).
Monoterapia (novodiagnostikovaní pacienti)
Pregabalín sa študoval v 1 kontrolovanom klinickom skúšaní v trvaní 56 týždňov s dávkovaním BID. Pregabalín nebol horší oproti lamotrigínu, čo sa týka dosiahnutia 6-mesačného obdobia bez záchvatov na konci sledovania. Pregabalín a lamotrigín boli podobne bezpečné a dobre tolerované.
Generalizovaná úzkostná porucha
Pregabalín sa študoval v 6 kontrolovaných klinických skúšaniach v trvaní 4 – 6 týždňov, v štúdii so staršími osobami v trvaní 8 týždňov a v dlhodobej štúdii zameranej na prevenciu relapsu s dvojito zaslepenou fázou zameranou na prevenciu relapsu v trvaní 6 mesiacov.
Ústup príznakov GAD vyjadrených Hamiltonovou škálou úzkosti (Hamilton Anxiety Rating
Scale = HAM-A) sa pozoroval v 1. týždni.
V kontrolovaných klinických skúšaniach (v trvaní 4 – 8 týždňov) 52% pacientov liečených pregabalínom a 38% pacientov v skupine s placebom malo aspoň 50% zlepšenie celkového HAM-A skóre od začiatku až po koniec sledovania.
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní v dávkovaní. Oftalmologické vyšetrenie (vrátane vyšetrenia zrakovej ostrosti, formálneho vyšetrenia zorného poľa a vyšetrenia očného pozadia pri rozšírených zreniciach) sa vykonalo u viac ako
3 600 pacientov v rámci kontrolovaných klinických skúšaní. U týchto pacientov bola zraková ostrosť
znížená u 6,5% pacientov liečených pregabalínom a 4,8% pacientov liečených placebom. Zmeny zrakového poľa sa zistili u 12,4% pacientov liečených pregabalínom a 11,7% pacientov liečených placebom. Zmeny na očnom pozadí sa pozorovali u 1,7% pacientov liečených pregabalínom a 2,1% pacientov liečených placebom.
5.2 Farmakokinetické vlastnosti
Farmakokinetika pregabalínu v rovnovážnom stave je podobná u zdravých dobrovoľníkov, pacientov s epilepsiou užívajúcich antiepileptiká a pacientov s chronickou bolesťou.
Absorpcia
Pregabalín sa pri podaní nalačno rýchlo vstrebáva, maximálne plazmatické koncentrácie sa dosiahnu do 1 hodiny po podaní jednorazovej aj viacnásobnej dávky. Biologická dostupnosť pregabalínu po perorálnom podaní sa odhaduje na ≥ 90% a je nezávislá na dávke. Po opakovanom podaní sa rovnovážny stav dosiahne počas 24 až 48 hodín. Rýchlosť absorpcie pregabalínu sa zníži, keď sa podáva s jedlom, čo sa prejaví poklesom Cmax približne o 25 – 30% a predĺžením tmax na približne
2,5 hodiny. Avšak podávanie pregabalínu s jedlom nemá klinicky signifikantný účinok na mieru
absorpcie pregabalínu.
Distribúcia
V predklinických štúdiách sa potvrdil prienik pregabalínu cez hematoencefalickú bariéru u myší,
potkanov a opíc. Bolo dokázané, že pregabalín prechádza cez placentu u potkanov a nachádza sa
v mlieku laktujúcich potkanov. U človeka je zdanlivý distribučný objem pregabalínu po perorálnom
podaní približne 0,56 l/kg. Pregabalín sa neviaže na plazmatické proteíny.
Biotransformácia
Pregabalín u človeka podlieha zanedbateľnému metabolizmu. Po podaní dávky rádionuklidom značeného pregabalínu približne 98% rádioaktivity stanovenej v moči predstavoval nezmenený pregabalín. N-metylovaný derivát pregabalínu, hlavný metabolit pregabalínu v moči, predstavoval
0,9%. V predklinických štúdiách sa nezistila racemizácia S-enancioméru pregabalínu na
R-enanciomér.
Eliminácia
Pregabalín sa eliminuje zo systémovej cirkulácie primárne renálnou exkréciou v nezmenenej forme. Priemerný eliminačný polčas je 6,3 hodiny. Plazmatický klírens a renálny klírens pregabalínu sú priamo úmerné klírensu kreatinínu (pozri časť 5.2 Porucha funkcie obličiek).
Je potrebné upraviť dávku u pacientov so zníženými renálnymi funkciami alebo u hemodialyzovaných
pacientov (pozri časť 4.2 Tabuľka 1).
Linearita/nelinearita
Farmakokinetika pregabalínu je lineárna v odporúčanom rozsahu denných dávok. Interindivuduálna farmakokinetická variabilita pregabalínu je nízka (< 20%). Farmakokinetiku pri opakovaných dávkach možno predpovedať z údajov pri jednorazovej dávke. Preto nie je potrebné bežné monitorovanie plazmatických koncentrácií pregabalínu.
Pohlavie
Klinické skúšania potvrdili, že pohlavie nemá klinicky signifikantný vplyv na plazmatické
koncentrácie pregabalínu.
Porucha funkcieobličiek
Klírens pregabalínu je priamo úmerný klírensu kreatinínu. Okrem toho sa pregabalín účinne odstraňuje z plazmy hemodialýzou (po 4-hodinovej hemodialýze klesnú plazmatické koncentrácie pregabalínu asi o 50%). Vzhľadom na to, že eliminácia obličkami je hlavným spôsobom eliminácie, je
potrebné zníženie dávky u pacientov s poruchou funkcie obličiek a doplnková dávka po hemodialýze
(pozri časť 4.2 tabuľka 1).
Porucha funkciepečene
Neboli vykonané žiadne špecifické farmakokinetické štúdie u pacientov s poruchou funkcie pečene. Keďže pregabalín nepodlieha signifikantnému metabolizmu a vylučuje sa prednostne v nezmenenej forme močom, neočakáva sa, že by poškodenie funkcie pečene signifikantne menilo plazmatické koncentrácie pregabalínu.
Pediatrická populácia
Farmakokinetika pregabalínu bola vyhodnocovaná u pediatrických pacientov s epilepsiou (vekové
skupiny: 1 až 23 mesiacov, 2 až 6 rokov, 7 až 11 rokov a 12 až 16 rokov) pri hladinách dávky 2,5; 5;
10 a 15 mg/kg/deň vo farmakokinetickej štúdii a štúdii znášanlivosti.
Po perorálnom podaní pregabalínu u pediatrických pacientov nalačno, bol čas do dosiahnutia maximálnej plazmatickej koncentrácie vo všeobecnosti podobný v rámci všetkých vekových skupín a dosiahol sa 0,5 hodiny až 2 hodiny po podaní dávky.
Parametre Cmax a AUC pregabalínu sa zvyšovali priamo úmerne so zvyšujúcou sa dávkou v rámci každej vekovej skupiny. AUC bola nižšia o 30 % u pediatrických pacientov s telesnou hmotnosťou menej ako 30 kg z dôvodu klírensu upraveného na základe telesnej hmotnosti zvýšeného o 43 %
u týchto pacientov v porovnaní s pacientmi s telesnou hmotnosťou ≥ 30 kg.
Terminálny polčas pregabalínu sa pohyboval v priemere od 3 do 4 hodín u pediatrických pacientov vo
veku do 6 rokov a od 4 do 6 hodín u tých, ktorí boli vo veku 7 rokov a starší.
Analýza populačnej farmakokinetiky preukázala, že klírens kreatinínu bol významným vedľajším parametrom klírensu pregabalínu po perorálnom podaní, telesná hmotnosť bola významným vedľajším parametrom zdanlivého distribučného objemu pregabalínu po perorálnom podaní a tieto vzťahy boli podobné u pediatrických a dospelých pacientov.
Farmakokinetika pregabalínu u pacientov mladších ako 3 mesiace nebola skúmaná (pozri časti 4.2,
4.8 a 5.1).
Staršieosoby(vo veku nad 65 rokov)
Klírens pregabalínu má tendenciu klesať so stúpajúcim vekom. Tento pokles klírensu pregabalínu je v súlade s poklesom klírensu kreatinínu, ktorý je podmienený stúpajúcim vekom. Zníženie dávky pregabalínu sa môže vyžadovať u pacientov pri vekom podmienenej poruche funkcie obličiek (pozri časť 4.2 tabuľka 1).
Dojčiacematky
Farmakokinetika 150 mg pregabalínu podávaných každých 12 hodín (300 mg denná dávka) bola vyhodnocovaná u 10 žien počas laktácie, ktoré boli aspoň 12 týždňov po pôrode. Laktácia mala malý až žiadny vplyv na farmakokinetiku pregabalínu. Pregabalín sa vylučoval do materského mlieka
s priemernými koncentráciami v ustálenom stave približne 76% z plazmatických koncentrácií
u matiek. Odhadovaná dávka u dojčaťa z materského mlieka (za predpokladu priemernej konzumácie
mlieka 150 ml/kg/deň) žien užívajúcich 300 mg/deň by bola 0,31 mg/kg/deň alebo 0,62 mg/kg/deň
u žien užívajúcich maximálnu dávku 600 mg/deň. Tieto odhadované dávky predstavujú približne 7%
celkovej dennej dávky u matky v mg/kg.
5.3 Predklinické údaje o bezpečnosti
V obvyklých farmakologických štúdiách bezpečnosti u zvierat bol pregabalín dobre tolerovaný
v klinicky relevantných dávkach. V štúdiách toxicity po opakovanom podávaní u potkanov a opíc sa pozorovali účinky na CNS vrátane hypoaktivity, hyperaktivity a ataxie. Zvýšená incidencia atrofie retiny, bežne pozorovaná u starnúcich potkaních albínov, sa zistila po dlhodobej expozícii pregabalínu v dávkach ≥ 5-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke.
Pregabalín nebol teratogénny u myší, potkanov ani u králikov. Fetálna toxicita u potkanov a králikov
sa vyskytla iba pri dávkach dostatočne prevyšujúcich dávku pre človeka.
V prenatálnych/postnatálnych štúdiách toxicity pregabalín vyvolával vývojovú toxicitu u potomkov potkanov v dávkach > 2-krát vyšších, než je odporúčaná maximálna dávka pre človeka.
Nežiaduce účinky na fertilitu u samčekov a samičiek potkanov sa pozorovali iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia. Nežiaduce účinky na samčie reprodukčné orgány a parametre spermií boli reverzibilné a vyskytli sa iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia, alebo boli spojené so spontánnymi degeneratívnymi procesmi na samčích reprodukčných orgánoch u potkana. Preto sa týmto účinkom pripisuje malý alebo žiadny klinický význam.
Na základe výsledkov mnohých in vitro a in vivo skúšok možno prehlásiť, že pregabalín nie je
genotoxický.
Dvojročné štúdie karcinogenicity s pregabalínom boli vykonané na potkanoch a myšiach. Nepozorovali sa žiadne nádory u potkanov v dávkach až do 24-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke 600 mg/deň. U myší sa nezistil zvýšený výskyt nádorov v dávkach podobných priemernej dávke u človeka, ale zvýšený výskyt hemangiosarkómov sa pozoroval pri vyšších dávkach. Negenotoxický mechanizmus tvorby pregabalínom indukovaných nádorov u myší zahrňuje zmeny krvných doštičiek a súvisiacu proliferáciu endoteliálnych buniek. Tieto zmeny krvných doštičiek neboli prítomné u potkanov alebo u ľudí na základe krátkodobých
a limitovaných dlhodobých klinických údajov. Neexistuje dôkaz, ktorý by naznačoval súvisiace riziko u ľudí.
U mladých potkanov sa druhy toxicity kvantitatívne nelíšili od tých, ktoré sa pozorovali u dospelých potkanov. Avšak mladé potkany sú oveľa senzitívnejšie. Pri terapeutických dávkach sa dokázali klinické príznaky hyperaktivity CNS a bruxizmus a niektoré zmeny v raste (prechodné potlačenie prírastku telesnej hmotnosti). Účinky na pohlavný cyklus sa pozorovali pri 5-násobku terapeutickej dávky u človeka. Znížená odpoveď na akustický podnet sa pozorovala u mladých potkanov 1 –
2 týždne po expozícii pri > 2-násobku terapeutickej dávky u človeka. Deväť týždňov po expozícii sa už tento účinok viac nepozoroval.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsúl hydroxypropylcelulóza, kukuričný škrob, mastenec
Obal kapsúl
žltý oxid železitý (E172), oxid titaničitý (E171),
erytrozín (E127), želatína, nátriumlaurylsulfát
Atrament
šelak,
čierny oxid železitý (E172),
makrogol,
roztok amoniaku, koncentrovaný, hydroxid draselný
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC/Al blistre obsahujúce 21, 84 alebo 100 tvrdých kapsúl.
PVC/PVDC/Al blistre s perforáciou obsahujúce 84 x 1 alebo 100 x 1 tvrdú kapsulu, umožňujúce
oddelenie jednotlivej dávky.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Generics [UK] Limited
Station Close Potters Bar Hertfordshire EN6 1TL Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/15/997/035
EU/1/15/997/036
EU/1/15/997/037
EU/1/15/997/038
EU/1/15/997/039
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
1. NÁZOV LIEKU
Pregabalin Mylan 225 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jedna tvrdá kapsula obsahuje 225 mg pregabalínu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá kapsula
Nepriesvitné želatínové kapsuly veľkosti 1 s tvrdým obalom, s telom a viečkom tmavobroskyňovej farby, obsahujúce biely až takmer biely prášok. Na tele a viečku kapsuly je pozdĺž jej osi čiernym atramentom vytlačený nápis MYLAN a pod ním označenie PB225.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Epilepsia
Pregabalin Mylan je indikovaný ako prídavná liečba u dospelých s parciálnymi záchvatmi so sekundárnou generalizáciou alebo bez sekundárnej generalizácie.
Generalizovaná úzkostná porucha
Pregabalin Mylan je indikovaný na liečbu generalizovanej úzkostnej poruchy (GAD = Generalised
Anxiety Disorder) u dospelých.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Rozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
Epilepsia
Liečbu pregabalínom možno začať dávkou 150 mg denne, ktorá sa podáva rozdelená v dvoch alebo troch dávkach. Podľa individuálnej odpovede pacienta a tolerancie možno dávku po 1 týždni zvýšiť na
300 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Generalizovaná úzkostná porucha
Rozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
Potreba liečby sa musí pravidelne opakovane posúdiť.
Liečbu pregabalínom možno začať dávkou 150 mg denne. Podľa individuálnej odpovede pacienta
a tolerancie možno dávku po 1 týždni zvýšiť na 300 mg denne. Po ďalšom týždni možno dávku zvýšiť
na 450 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Ukonč eni e l i eč by pr egabal í nom
V súlade so súčasnou klinickou praxou, ak sa musí liečba pregabalínom ukončiť, odporúča sa, aby sa
to urobilo postupne počas minimálne 1 týždňa bez ohľadu na indikáciu (pozri časti 4.4 a 4.8).
O
sobitné populácie
 Pacienti s poruchou f unkc i e obl i či ek
Pacienti s poruchou f unkc i e obl i či ek
Pregabalín sa zo systémovej cirkulácie primárne eliminuje v nezmenenej forme renálnou exkréciou. Keďže klírens pregabalínu je priamo úmerný klírensu kreatinínu (pozri časť 5.2), dávka u pacientov s poruchou funkcie obličiek sa musí znižovať individuálne podľa klírensu kreatinínu (CLcr), ako je uvedené v tabuľke 1 použitím nasledovného vzorca:
CLcr(ml/min) =
1,23 × [140 – vek (roky)] × hmotnoť (kg)
kreatinín v sére (µmol/l)
(× 0,85 u žien)
Pregabalín možno efektívne odstrániť z plazmy hemodialýzou (50% lieku počas 4 hodín).
U hemodialyzovaných pacientov sa denná dávka pregabalínu musí upraviť podľa funkcie obličiek. K dennej dávke treba pridať doplnkovú dávku okamžite po každej 4-hodinovej hemodialýze (pozri tabuľku 1).
Tabuľka 1 Úprava dávky pregabalínu podľa funkcie obličiek
Klírens kreatinínu
(CLcr) (ml/min)
|
Celková denná dávka pregabalínu *
|
Dávkovací režim
|
| Začiatočná dávka
(mg/deň)
| Maximálna dávka
(mg/deň)
|
|
≥ 60
| 150
| 600
| BID alebo TID
|
≥ 30 – < 60
| 75
| 300
| BID alebo TID
|
≥ 15 – < 30
| 25 – 50
| 150
| Jedenkrát denne alebo BID
|
< 15
| 25
| 75
| Jedenkrát denne
|
Doplnkové dávkovanie po hemodialýze (mg)
|
| 25
| 100
| Jednorazová dávka+
|
TID = tri rozdelené dávky
BID = dve rozdelené dávky
* Celková denná dávka (mg/deň) sa má rozdeliť podľa dávkovacieho režimu a vyjadriť v mg/dávka
+ Doplnková dávka je jedna dodatočná dávka
Pacienti s poruchou f unkc i e pe če ne Nevyžaduje sa žiadna úprava dávky u pacientov s poruchou funkcie pečene (pozri časť 5.2).
Pediatrická populáciaBezpečnosť a účinnosť Pregabalinu Mylan u detí mladších ako 12 rokov a u dospievajúcich (vo veku
12 – 17 rokov) neboli stanovené. Údaje dostupné v súčasnosti sú uvedené v časti 4.8, 5.1 a 5.2, ale nie
je možné vykonať odporúčanie týkajúce sa dávkovania.
St arš i e os oby (vo veku nad 65 rokov)Starší pacienti môžu vyžadovať zníženie dávky pregabalínu z dôvodu zníženej renálnej funkcie (pozri pacienti s poruchou funkcie obličiek).
Spôsob podávaniaPregabalin Mylan sa môže užívať s jedlom alebo bez jedla. Pregabalin Mylan je určený iba na perorálne použitie.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Diabetickí pacienti
Podľa súčasnej klinickej praxe u niektorých diabetických pacientov s prírastkom hmotnosti počas liečby pregabalínom môže byť potrebné upraviť hypoglykemickú liečbu.
Reakcie z precitlivenosti
Po uvedení lieku na trh boli zaznamenané hlásenia o rekciách z precitlivenosti vrátane prípadov angioedému. Liečba pregabalínom sa musí okamžite ukončiť, ak sa vyskytnú príznaky angioedému, ako sú faciálny, periorálny opuch alebo opuch horných dýchacích ciest.
Závrat , somnole nci a, st rat a ve domi a, zmäte nosť a mentálne poškodenie
Liečba pregabalínom sa dáva do súvisu so závratom a somnolenciou, ktoré mohli zvýšiť výskyt náhodných zranení (pádov) u staršej populácie. Existujú tiež hlásenia po uvedení lieku na trh o strate vedomia, zmätenosti a mentálnom poškodení. Preto pacientom sa má poradiť, aby boli opatrní, pokým sa neoboznámia s možnými účinkami lieku.
Úči nky spoj ené s videním
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní dávkovania. V klinických štúdiách, v ktorých bolo zahrnuté aj oftalmologické vyšetrenie, bol výskyt zníženia zrakovej ostrosti a zmien zorného poľa väčší u pacientov liečených pregabalínom ako
u pacientov liečených placebom; výskyt zmien na očnom pozadí bol väčší u pacientov liečených
placebom (pozri časť 5.1).
Po uvedení lieku na trh boli tiež hlásené nežiaduce reakcie na zrak, vrátane straty zraku, rozmazaného videnia alebo iných zmien zrakovej ostrosti, z ktorých mnohé boli prechodné. Prerušenie liečby pregabalínom môže viesť k vymiznutiu alebo zlepšeniu týchto zrakových príznakov.
Renálne zlyhávanie
Boli hlásené prípady renálneho zlyhávania a v niektorých prípadoch prerušenie liečby pregabalínom
viedlo k reverzibilite tejto nežiaducej reakcie.
Vysade ni e s účas ne pod ávaných antiepileptík
Nie sú dostatočné údaje týkajúce sa vysadenia súčasne podávaných antiepileptík, akonáhle sa po
pridaní pregabalínu dosiahne kontrola záchvatu tak, aby bolo možné podávať pregabalín
v monoterapii.
Príznakyz vysadenia
Po ukončení krátkodobej a dlhodobej liečby pregabalínom boli u niektorých pacientov pozorované príznaky z vysadenia. Uvádzajú sa nasledujúce účinky: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, nervozita, depresia, bolesť, kŕče, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tom informovaný na začiatku liečby.
Počas užívania pregabalínu alebo krátko po ukončení liečby pregabalínom sa môžu vyskytnúť kŕče
vrátane epileptických záchvatov a záchvatov typu grand mal.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
K
ongestívne srdcové zlyhávanie
Po uvedení lieku na trh boli hlásené prípady kongestívneho srdcového zlyhávania u niektorých pacientov dostávajúcich pregabalín. Tieto reakcie sú najčastejšie pozorované u starších pacientov
s kardiovaskulárnymi ochoreniami počas liečby pregabalínom na neuropatickú indikáciu. Pregabalín
sa má u týchto pacientov podávať s opatrnosťou. Ukončenie podávania pregabalínu môže viesť
k odozneniu reakcie.
Než i aduce re akc i e u pac i ent ov s porane ní m mi ec hy
Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy. Možno to pripísať aditívnemu účinku v dôsledku súbežnej liečby inými liekmi (napr. liekmi proti spasticite), ktoré je potrebné užívať pri tomto ochorení.
Samovr aže dné myšl i enk y a správanie
Samovražedné myšlienky a správanie boli hlásené u pacientov liečených antiepileptikami pri niekoľkých indikáciách. Meta-analýza randomizovaných placebom kontrolovaných štúdií antiepileptík tiež ukázala málo zvýšené riziko samovražedných myšlienok a správania. Mechanizmus tohto rizika
nie je známy a dostupné údaje nevylučujú možnosť zvýšeného rizika u pregabalínu.
Pacienti majú byť preto sledovaní kvôli prejavom samovražedných myšlienok a správania a má sa u nich zvážiť vhodná liečba. Pacienti (a ich opatrovatelia) majú byť upozornení, aby vyhľadali lekársku pomoc, ak sa prejavy samovražedných myšlienok alebo správania objavia.
Zhorše ná f unkc i a dol ného t ráv i ace ho t rak t u
Po uvedení lieku na trh boli hlásené prípady týkajúce sa zhoršenej funkcie dolného tráviaceho traktu (napr. intestinálna obštrukcia, paralytický ileus, obstipácia), keď sa pregabalín podával spolu s liekmi, ktoré môžu spôsobovať obstipáciu, ako sú napr. opioidné analgetiká. Keď sa bude pregabalín užívať
v kombinácii s opioidmi, môžu sa zvážiť opatrenia na predchádzanie obstipácii (zvlášť u žien
a starších pacientov).
Zneuži t i e, s klon k nadmer nému uží vani u l i ek ov al ebo z ávi sl osť
Boli hlásené prípady zneužitia, nadmerného užívania liekov a závislosti. Treba byť opatrný
u pacientov s anamnézou nadmerného užívania návykových látok a u takýchto pacientov majú byť sledované príznaky zneužitia pregabalínu, nadmerného užívania alebo závislosti (boli hlásené rozvoj tolerancie, zvyšovanie dávky, správanie vedúce k užitiu lieku).
Encefalopatia
Boli hlásené prípady encefalopatie, hlavne u pacientov s pridruženými stavmi, ktoré môžu vyvolať
encefalopatiu.
4.5 Liekové a iné interakcie
Pretože pregabalín sa vylučuje prevažne v nezmenenej forme močom, podlieha zanedbateľnému metabolizmu u ľudí (< 2% dávky zachytenej v moči vo forme metabolitov), neinhibuje liekový metabolizmus in vitro a neviaže sa na plazmatické proteíny, je nepravdepodobné, že by spôsobil alebo bol sám subjektom farmakokinetických interakcií.
I n vi vo š t údi e a popul ačná f armakok inetická analýza
Podobne, v in vivo štúdiách sa nepozorovali žiadne klinicky relevantné farmakokinetické interakcie medzi pregabalínom a fenytoínom, karbamazepínom, kyselinou valproovou, lamotrigínom, gabapentínom, lorazepamom, oxykodónom alebo etanolom. Populačná farmakokinetická analýza ukázala, že perorálne antidiabetiká, diuretiká, inzulín, fenobarbital, tiagabín a topiramát nemali klinicky významný účinok na klírens pregabalínu.
Perorálne kontraceptíva, noretisterón a/alebo etinylestradiol
Súbežné podávanie pregabalínu s perorálnymi kontraceptívami noretisterónom a/alebo etinylestradiolom nemá vplyv na farmakokinetiku v rovnovážnom stave žiadnej z týchto látok.
Lie ky ovpl yv ňuj úce centrálny nervový systém
Pregabalín môže zosilňovať účinky etanolu a lorazepamu. Opakované perorálne dávky pregabalínu podávané súbežne s oxykodónom, lorazepamom alebo etanolom v kontrolovaných klinických štúdiách neviedli ku klinicky významným účinkom na dýchanie. Po uvedení lieku na trh existujú hlásenia
o respiračnom zlyhaní a kóme u pacientov užívajúcich pregabalín a iné lieky utlmujúce centrálny nervový systém (CNS). Ukazuje sa, že pregabalín má aditívny efekt pri poškodení kognitívnej
a hrubej motorickej funkcie spôsobenej oxykodónom.
Interakcie a st arš i e os oby
Žiadne špecifické štúdie farmakodynamických interakcií sa nevykonali u starších dobrovoľníkov.
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženy v re produk čnom veku/ Anti konc epc i a u mužov a ži en
Keďže potenciálne riziko pre ľudí nie je známe, ženy vo fertilnom veku musia používať účinnú
antikoncepciu.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití pregabalínu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí.
Pregabalin Mylan sa má užívať počas gravidity iba v nevyhnutných prípadoch (ak prínos pre matku
jednoznačne preváži potenciálne riziko pre plod).
Laktácia
Pregabalín sa vylučuje do materského mlieka u ľudí (pozri časť 5.2). Účinok pregabalínu na novorodencov/dojčatá nie je známy. Rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu pregabalínom, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii klinické údaje o účinkoch pregabalínu na ženskú fertilitu.
V klinickom skúšaní hodnotiacom účinok pregabalínu na pohyblivosť spermií boli zdraví muži vystavení pregabalínu v dávke 600 mg/deň. Po 3 mesiacoch liečby sa nezistili žiadne účinky na pohyblivosť spermií.
Štúdia fertility na samičkách potkanov preukázala nežiaduce účinky na reprodukciu. Štúdie fertility na samčekoch potkanov preukázali nežiaduce účinky na reprodukciu a vývin. Klinický význam týchto zistení nie je známy (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pregabalin Mylan môže mať malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pregabalin Mylan môže vyvolať závraty a ospalosť, a preto môže ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Pacientom treba poradiť, aby neviedli vozidlá, neobsluhovali zložité stroje alebo sa nezapájali do iných potenciálne nebezpečných činností, pokiaľ nie je isté, či tento liek neovplyvňuje ich schopnosť vykonávať uvedené činnosti.
4.8 Nežiaduce účinky
Prehľad bezpečnostného profiluKlinický program s pregabalínom zahrňoval viac ako 8 900 pacientov užívajúcich pregabalín,
z ktorých viac ako 5 600 bolo zaradených v dvojito-zaslepených placebom kontrolovaných štúdiách. Najčastejšie hlásenými nežiaducimi reakciami boli závraty a somnolencia. Nežiaduce reakcie boli zvyčajne ľahkej až strednej intenzity. Vo všetkých kontrolovaných štúdiách boli nežiaduce reakcie príčinou ukončenia liečby u 12% pacientov užívajúcich pregabalín a u 5% pacientov užívajúcich placebo. Najčastejšími nežiaducimi reakciami vedúcimi k ukončeniu liečby v skupinách
s pregabalínom boli závraty a somnolencia.
Tabuľkový zoznam nežiaducich reakciíV tabuľke 2 nižšie sú všetky nežiaduce reakcie, ktoré sa vyskytli častejšie než pri placebe a viac než
u jedného pacienta, zoradené podľa triedy a frekvencie (veľmi časté (≥ 1/10); časté (≥ 1/100 až
< 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé
(< 1/10 000), neznáme (nedá sa odhadnúť z dostupných údajov)).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej
závažnosti.
Uvedené nežiaduce reakcie môžu tiež súvisieť so základným ochorením a/alebo sprievodnou liečbou. Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä
somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy (pozri
časť 4.4).
Ďalšie reakcie hlásené na základe skúseností po uvedení lieku na trh sú zaradené v zozname nižšie
kurzívou.
Tabuľka 2 Nežiaduce liekové reakcie pregabalínuTrieda orgánových
systémov Nežiaduce reakcie na liek
|
Infekcie a nákazy
Časté nazofaryngitída
|
Poruchy krvi a lymfatického systému
Menej časté neutropénia
|
Poruchy imunitného systému
Menej časté hypersenzitivita
Zriedkavé angioedém, alergická reakcia
|
Poruchy metabolizmu a výživy
Časté zvýšená chuť do jedla
Menej časté anorexia, hypoglykémia
|
Psychické poruchy
Časté euforická nálada, zmätenosť, iritabilita, dezorientácia, insomnia,
pokles libida
Menej časté halucinácie, panický atak, nepokoj, agitovanosť, depresia, depresívna nálada, povznášajúca nálada, agresivita, kolísanie nálady, depersonalizácia, ťažkosti s vyhľadávaním slov, abnormálne sny, vzostup libida, anorgazmia, apatia
Zriedkavé strata zábran
|
T
rieda orgánových
systémov
N
ežiaduce reakcie na liek
|
P
oruchy nervového systému
Veľmi časté závraty, somnolencia, bolesť hlavy
Časté ataxia, porucha koordinácie, tremor, dyzartria, amnézia, poruchy pamäti, porucha koncentrácie, parestézia, hypestézia, sedácia, porucha rovnováhy, letargia
Menej časté synkopa, stupor, myoklonus, strata vedomia, psychomotorická hyperaktivita, dyskinéza, posturálne závraty, intenčný tremor, nystagmus, kognitívne poruchy, mentálne poškodenie, porucha reči, hyporeflexia, hyperestézia, pocit pálenia, strata chuti, nevoľnosť
Zriedkavé kŕče, parosmia, hypokinéza, dysgrafia
|
P
oruchy oka
Časté zahmlené videnie, diplopia
Menej časté strata periférneho videnia, poruchy videnia, opuch očí, defekty
v zornom poli, zníženie zrakovej ostrosti, bolesti oka, astenopia, fotopsia, suché oči, zvýšená lakrimácia, podráždenie očí
Zriedkavé strata zraku, keratitída, oscilopsia, porušené hĺbkové videnie,
mydriáza, strabizmus, porušená zraková ostrosť
|
P
oruchy ucha a labyrintu
Časté vertigo
Menej časté hyperakúzia
|
P
oruchy srdca a srdcovej činnosti
Menej časté tachykardia, AV blokáda 1. stupňa, sínusová bradykardia,
kongestívne srdcové zlyhávanie
Zriedkavé predĺženie QT, sínusová tachykardia, sínusová arytmia
|
P
oruchy ciev
Menej časté hypotenzia, hypertenzia, návaly horúčavy, sčervenanie, periférny pocit chladu
|
P
oruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, epistaxa, kašeľ, upchatie nosa, rinitída, chrápanie, suchý nos
Zriedkavé pľúcny edém, zovreté hrdlo
|
P
oruchy gastrointestinálneho traktu
Časté vracanie, nauzea, obstipácia, hnačka, flatulencia, abdominálna distenzia, sucho v ústach
Menej časté gastroezofageálna refluxová choroba, zvýšená salivácia, znížená citlivosť v ústach
Zriedkavé ascites, pankreatitída, opuchnutý jazyk, dysfágia
|
P
oruchy kože a podkožného tkaniva
Menej časté papulózny exantém, žihľavka, hyperhidróza, pruritus
Zriedkavé Stevensov-Johnsonov syndróm, studený pot
,
|
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté svalové kŕče, artralgia, bolesti chrbta, bolesti v končatinách,
cervikálny spazmus
Menej časté opuch kĺbov, myalgia, svalové zášklby, bolesť šije, svalová
stuhnutosť
Zriedkavé rabdomyolýza
|
P
oruchy obličiek a močových ciest
Menej časté močová inkontinencia, dyzúria
Zriedkavé renálne zlyhanie, oligúria, retencia moču
|
T
rieda orgánových
systémov
N
ežiaduce reakcie na liek
|
P
oruchy reprodukčného systému a prsníkov
Časté erektilná dysfunkcia
Menej časté sexuálna dysfunkcia, oneskorená ejakulácia, dysmenorea, bolesť
prsníkov
Zriedkavé amenorea, výtok z prsníkov, zväčšenie prsníkov, gynekomastia
|
C
elkové poruchy a reakcie v mieste podania
Časté periférny edém, edém, abnormálna chôdza, padanie, pocit opitosti, abnormálny pocit, únava
Menej časté generalizovaný edém, edém tváre, pocit napätia na hrudníku,
bolesť, pyrexia, smäd, triaška, asténia
|
L
aboratórne a funkčné vyšetrenia
Časté zvýšená hmotnosť
Menej časté zvýšená kreatínfosfokináza v krvi, zvýšená alanínaminotransferáza, zvýšená aspartátaminotransferáza, zvýšená glukóza v krvi, znížený počet trombocytov, zvýšený kreatinín v krvi, znížený draslík v krvi, znížená hmotnosť
Zriedkavé znížený počet leukocytov v krvi
|
Po ukončení krátkodobej a dlhodobej liečby pregabalínom sa u niektorých pacientov pozorovali
príznaky z vysadenia. Uvádzajú sa nasledujúce reakcie: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, kŕče, nervozita, depresia, bolesť
, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tejto skutočnosti informovaný na začiatku liečby.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
Pediatrická populáciaBezpečnostný profil pregabalínu pozorovaný v dvoch pediatrických štúdiách (farmakokinetická štúdia a štúdia bezpečnosti, n = 65; 1-ročná otvorená kontrolná štúdia bezpečnosti, n = 54) bol podobný bezpečnostnému profilu, ktorý sa pozoroval v štúdiách u dospelých (pozri časti 4.2, 5.1 a 5.2).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePríznakyPo uvedení lieku na trh najčastejšie hlásené nežiaduce reakcie pozorované po predávkovaní
pregabalínom zahŕňali ospalosť, stavy zmätenosti, agitovanosť a nepokoj. V zriedkavých prípadoch bola hlásená kóma.
Postup pri predávkovaníLiečba predávkovania pregabalínom musí zahrňovať štandardné podporné opatrenia a môže zahrňovať podľa potreby aj hemodialýzu (pozri časť 4.2 tabuľka 1).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiepileptiká, iné antiepileptiká, ATC kód: N03AX16
Liečivo pregabalín je analógom gamaaminomaslovej kyseliny ((S)-3-(aminometyl)-5-metylhexánová kyselina).
Mechanizmus účinku
Pregabalín sa viaže na auxiliárne podjednotky (a2-d proteíny) napäťovo ovládaných kalciových
kanálov v centrálnom nervovom systéme.
Klinická účinnosťabezpečnosť
Epilepsia
Prídavná liečba
Pregabalín sa študoval v 3 kontrolovaných klinických skúšaniach v trvaní 12 týždňov s dávkovaním BID alebo dávkovaním TID. Celkové profily bezpečnosti a účinnosti pri BID a TID dávkovacích režimoch boli podobné.
Zníženie frekvencie epileptických záchvatov sa pozorovalo v 1. týždni.
Pediatrická populácia
Účinnosť a bezpečnosť pregabalínu ako doplnkovej liečby pri epilepsii u pediatrických pacientov mladších ako 12 rokov a dospievajúcich nebola stanovená. Nežiaduce udalosti pozorované vo farmakokinetickej štúdii a štúdii znášanlivosti, do ktorých boli zaradení pacienti vo veku od
3 mesiacov do 16 rokov (n = 65), boli podobné tým, ktoré sa pozorovali u dospelých. Výsledky
1-ročnej otvorenej štúdie bezpečnosti u 54 pediatrických pacientov vo veku od 3 mesiacov do
16 rokov s epilepsiou naznačujú, že nežiaduce udalosti pyrexie a infekcií horných dýchacích ciest sa
pozorovali častejšie ako v štúdiách u dospelých (pozri časti 4.2, 4.8 a 5.2).
Monoterapia (novodiagnostikovaní pacienti)
Pregabalín sa študoval v 1 kontrolovanom klinickom skúšaní v trvaní 56 týždňov s dávkovaním BID. Pregabalín nebol horší oproti lamotrigínu, čo sa týka dosiahnutia 6-mesačného obdobia bez záchvatov na konci sledovania. Pregabalín a lamotrigín boli podobne bezpečné a dobre tolerované.
Generalizovaná úzkostná porucha
Pregabalín sa študoval v 6 kontrolovaných klinických skúšaniach v trvaní 4 – 6 týždňov, v štúdii so staršími osobami v trvaní 8 týždňov a v dlhodobej štúdii zameranej na prevenciu relapsu s dvojito zaslepenou fázou zameranou na prevenciu relapsu v trvaní 6 mesiacov.
Ústup príznakov GAD vyjadrených Hamiltonovou škálou úzkosti (Hamilton Anxiety Rating
Scale = HAM-A) sa pozoroval v 1. týždni.
V kontrolovaných klinických skúšaniach (v trvaní 4 – 8 týždňov) 52% pacientov liečených pregabalínom a 38% pacientov v skupine s placebom malo aspoň 50% zlepšenie celkového HAM-A skóre od začiatku až po koniec sledovania.
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní v dávkovaní. Oftalmologické vyšetrenie (vrátane vyšetrenia zrakovej ostrosti, formálneho vyšetrenia zorného poľa a vyšetrenia očného pozadia pri rozšírených zreniciach) sa vykonalo u viac ako
3 600 pacientov v rámci kontrolovaných klinických skúšaní. U týchto pacientov bola zraková ostrosť
znížená u 6,5% pacientov liečených pregabalínom a 4,8% pacientov liečených placebom. Zmeny zrakového poľa sa zistili u 12,4% pacientov liečených pregabalínom a 11,7% pacientov liečených placebom. Zmeny na očnom pozadí sa pozorovali u 1,7% pacientov liečených pregabalínom a 2,1% pacientov liečených placebom.
5.2 Farmakokinetické vlastnosti
Farmakokinetika pregabalínu v rovnovážnom stave je podobná u zdravých dobrovoľníkov, pacientov s epilepsiou užívajúcich antiepileptiká a pacientov s chronickou bolesťou.
.
Absorpcia
Pregabalín sa pri podaní nalačno rýchlo vstrebáva, maximálne plazmatické koncentrácie sa dosiahnu do 1 hodiny po podaní jednorazovej aj viacnásobnej dávky. Biologická dostupnosť pregabalínu po perorálnom podaní sa odhaduje na ≥ 90% a je nezávislá na dávke. Po opakovanom podaní sa rovnovážny stav dosiahne počas 24 až 48 hodín. Rýchlosť absorpcie pregabalínu sa zníži, keď sa podáva s jedlom, čo sa prejaví poklesom Cmax približne o 25 – 30% a predĺžením tmax na približne
2,5 hodiny. Avšak podávanie pregabalínu s jedlom nemá klinicky signifikantný účinok na mieru
absorpcie pregabalínu.
Distribúcia
V predklinických štúdiách sa potvrdil prienik pregabalínu cez hematoencefalickú bariéru u myší,
potkanov a opíc. Bolo dokázané, že pregabalín prechádza cez placentu u potkanov a nachádza sa
v mlieku laktujúcich potkanov. U človeka je zdanlivý distribučný objem pregabalínu po perorálnom podaní približne 0,56 l/kg. Pregabalín sa neviaže na plazmatické proteíny.
Biotransformácia
Pregabalín u človeka podlieha zanedbateľnému metabolizmu. Po podaní dávky rádionuklidom značeného pregabalínu približne 98% rádioaktivity stanovenej v moči predstavoval nezmenený pregabalín. N-metylovaný derivát pregabalínu, hlavný metabolit pregabalínu v moči, predstavoval
0,9%. V predklinických štúdiách sa nezistila racemizácia S-enancioméru pregabalínu na
R-enanciomér.
Eliminácia
Pregabalín sa eliminuje zo systémovej cirkulácie primárne renálnou exkréciou v nezmenenej forme. Priemerný eliminačný polčas je 6,3 hodiny. Plazmatický klírens a renálny klírens pregabalínu sú priamo úmerné klírensu kreatinínu (pozri časť 5.2 Porucha funkcie obličiek).
Je potrebné upraviť dávku u pacientov so zníženými renálnymi funkciami alebo u hemodialyzovaných
pacientov (pozri časť 4.2 Tabuľka 1).
Linearita/nelinearita
Farmakokinetika pregabalínu je lineárna v odporúčanom rozsahu denných dávok. Interindivuduálna farmakokinetická variabilita pregabalínu je nízka (< 20%). Farmakokinetiku pri opakovaných dávkach možno predpovedať z údajov pri jednorazovej dávke. Preto nie je potrebné bežné monitorovanie plazmatických koncentrácií pregabalínu.
Pohlavie
Klinické skúšania potvrdili, že pohlavie nemá klinicky signifikantný vplyv na plazmatické
koncentrácie pregabalínu.
Porucha funkcieobličiek
Klírens pregabalínu je priamo úmerný klírensu kreatinínu. Okrem toho sa pregabalín účinne odstraňuje z plazmy hemodialýzou (po 4-hodinovej hemodialýze klesnú plazmatické koncentrácie pregabalínu asi o 50%). Vzhľadom na to, že eliminácia obličkami je hlavným spôsobom eliminácie, je
potrebné zníženie dávky u pacientov s poruchou funkcie obličiek a doplnková dávka po hemodialýze
(pozri časť 4.2 tabuľka 1).
Porucha funkciepečene
Neboli vykonané žiadne špecifické farmakokinetické štúdie u pacientov s poruchou funkcie pečene. Keďže pregabalín nepodlieha signifikantnému metabolizmu a vylučuje sa prednostne v nezmenenej forme močom, neočakáva sa, že by poškodenie funkcie pečene signifikantne menilo plazmatické koncentrácie pregabalínu.
Pediatrická populácia
Farmakokinetika pregabalínu bola vyhodnocovaná u pediatrických pacientov s epilepsiou (vekové
skupiny: 1 až 23 mesiacov, 2 až 6 rokov, 7 až 11 rokov a 12 až 16 rokov) pri hladinách dávky 2,5; 5;
10 a 15 mg/kg/deň vo farmakokinetickej štúdii a štúdii znášanlivosti.
Po perorálnom podaní pregabalínu u pediatrických pacientov nalačno, bol čas do dosiahnutia maximálnej plazmatickej koncentrácie vo všeobecnosti podobný v rámci všetkých vekových skupín a dosiahol sa 0,5 hodiny až 2 hodiny po podaní dávky.
Parametre Cmax a AUC pregabalínu sa zvyšovali priamo úmerne so zvyšujúcou sa dávkou v rámci každej vekovej skupiny. AUC bola nižšia o 30 % u pediatrických pacientov s telesnou hmotnosťou menej ako 30 kg z dôvodu klírensu upraveného na základe telesnej hmotnosti zvýšeného o 43 %
u týchto pacientov v porovnaní s pacientmi s telesnou hmotnosťou ≥ 30 kg.
Terminálny polčas pregabalínu sa pohyboval v priemere od 3 do 4 hodín u pediatrických pacientov vo veku do 6 rokov a od 4 do 6 hodín u tých, ktorí boli vo veku 7 rokov a starší.
Analýza populačnej farmakokinetiky preukázala, že klírens kreatinínu bol významným vedľajším parametrom klírensu pregabalínu po perorálnom podaní, telesná hmotnosť bola významným vedľajším parametrom zdanlivého distribučného objemu pregabalínu po perorálnom podaní a tieto vzťahy boli podobné u pediatrických a dospelých pacientov.
Farmakokinetika pregabalínu u pacientov mladších ako 3 mesiace nebola skúmaná (pozri časti 4.2,
4.8 a 5.1).
Staršieosoby(vo veku nad 65 rokov)
Klírens pregabalínu má tendenciu klesať so stúpajúcim vekom. Tento pokles klírensu pregabalínu je v súlade s poklesom klírensu kreatinínu, ktorý je podmienený stúpajúcim vekom. Zníženie dávky pregabalínu sa môže vyžadovať u pacientov pri vekom podmienenej poruche funkcie obličiek (pozri časť 4.2 tabuľka 1).
Dojčiacematky
Farmakokinetika 150 mg pregabalínu podávaných každých 12 hodín (300 mg denná dávka) bola vyhodnocovaná u 10 žien počas laktácie, ktoré boli aspoň 12 týždňov po pôrode. Laktácia mala malý až žiadny vplyv na farmakokinetiku pregabalínu. Pregabalín sa vylučoval do materského mlieka
s priemernými koncentráciami v ustálenom stave približne 76% z plazmatických koncentrácií
u matiek. Odhadovaná dávka u dojčaťa z materského mlieka (za predpokladu priemernej konzumácie
mlieka 150 ml/kg/deň) žien užívajúcich 300 mg/deň by bola 0,31 mg/kg/deň alebo 0,62 mg/kg/deň
u žien užívajúcich maximálnu dávku 600 mg/deň. Tieto odhadované dávky predstavujú približne 7%
celkovej dennej dávky u matky v mg/kg.
5.3 Predklinické údaje o bezpečnosti
V obvyklých farmakologických štúdiách bezpečnosti u zvierat bol pregabalín dobre tolerovaný
v klinicky relevantných dávkach. V štúdiách toxicity po opakovanom podávaní u potkanov a opíc sa pozorovali účinky na CNS vrátane hypoaktivity, hyperaktivity a ataxie. Zvýšená incidencia atrofie retiny, bežne pozorovaná u starnúcich potkaních albínov, sa zistila po dlhodobej expozícii pregabalínu v dávkach ≥ 5-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke.
Pregabalín nebol teratogénny u myší, potkanov ani u králikov. Fetálna toxicita u potkanov a králikov
sa vyskytla iba pri dávkach dostatočne prevyšujúcich dávku pre človeka.
V prenatálnych/postnatálnych štúdiách toxicity pregabalín vyvolával vývojovú toxicitu u potomkov potkanov v dávkach > 2-krát vyšších, než je odporúčaná maximálna dávka pre človeka.
Nežiaduce účinky na fertilitu u samčekov a samičiek potkanov sa pozorovali iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia. Nežiaduce účinky na samčie reprodukčné orgány a parametre spermií boli reverzibilné a vyskytli sa iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia, alebo boli spojené so spontánnymi degeneratívnymi procesmi na samčích reprodukčných orgánoch u potkana. Preto sa týmto účinkom pripisuje malý alebo žiadny klinický význam.
Na základe výsledkov mnohých in vitro a in vivo skúšok možno prehlásiť, že pregabalín nie je
genotoxický.
Dvojročné štúdie karcinogenicity s pregabalínom boli vykonané na potkanoch a myšiach. Nepozorovali sa žiadne nádory u potkanov v dávkach až do 24-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke 600 mg/deň. U myší sa nezistil zvýšený výskyt nádorov v dávkach podobných priemernej dávke u človeka, ale zvýšený výskyt hemangiosarkómov sa pozoroval pri vyšších dávkach. Negenotoxický mechanizmus tvorby pregabalínom indukovaných nádorov u myší zahrňuje zmeny krvných doštičiek a súvisiacu proliferáciu endoteliálnych buniek. Tieto zmeny krvných doštičiek neboli prítomné u potkanov alebo u ľudí na základe krátkodobých
a limitovaných dlhodobých klinických údajov. Neexistuje dôkaz, ktorý by naznačoval súvisiace riziko
u ľudí.
U mladých potkanov sa druhy toxicity kvantitatívne nelíšili od tých, ktoré sa pozorovali u dospelých potkanov. Avšak mladé potkany sú oveľa senzitívnejšie. Pri terapeutických dávkach sa dokázali klinické príznaky hyperaktivity CNS a bruxizmus a niektoré zmeny v raste (prechodné potlačenie prírastku telesnej hmotnosti). Účinky na pohlavný cyklus sa pozorovali pri 5-násobku terapeutickej dávky u človeka. Znížená odpoveď na akustický podnet sa pozorovala u mladých potkanov 1 –
2 týždne po expozícii pri > 2-násobku terapeutickej dávky u človeka. Deväť týždňov po expozícii sa už tento účinok viac nepozoroval.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly hydroxypropylcelulóza, kukuričný škrob, mastenec
Obal kapsuly
žltý oxid železitý (E172), oxid titaničitý (E171),
erytrozín (E127), želatína, nátriumlaurylsulfát
Atrament
šelak,
čierny oxid železitý (E172),
makrogol,
roztok amoniaku, koncentrovaný, hydroxid draselný
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC/Al blistre obsahujúce 14, 56 alebo 100 tvrdých kapsúl.
PVC/PVDC/Al blistre s perforáciou obsahujúce 56 x 1 alebo 100 x 1 tvrdú kapsulu, umožňujúce
oddelenie jednotlivej dávky.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Generics [UK] Limited
Station Close Potters Bar Hertfordshire EN6 1TL Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/15/997/040
EU/1/15/997/041
EU/1/15/997/042
EU/1/15/997/043
EU/1/15/997/044
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
1. NÁZOV LIEKU
Pregabalin Mylan 300 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jedna tvrdá kapsula obsahuje 300 mg pregabalínu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Tvrdá kapsula
Nepriesvitné želatínové kapsuly veľkosti 0 s tvrdým obalom, s bielym telom a viečkom svetlobroskyňovej farby, obsahujúce biely až takmer biely prášok. Na viečku a tele kapsuly je pozdĺž jej osi čiernym atramentom vytlačený nápis MYLAN a pod ním označenie PB300.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Epilepsia
Pregabalin Mylan je indikovaný ako prídavná liečba u dospelých s parciálnymi záchvatmi so sekundárnou generalizáciou alebo bez sekundárnej generalizácie.
Generalizovaná úzkostná porucha
Pregabalin Mylan je indikovaný na liečbu generalizovanej úzkostnej poruchy (GAD = Generalised
Anxiety Disorder) u dospelých.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Rozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
Epilepsia
Liečbu pregabalínom možno začať dávkou 150 mg denne, ktorá sa podáva rozdelená v dvoch alebo troch dávkach. Podľa individuálnej odpovede pacienta a tolerancie možno dávku po 1 týždni zvýšiť na
300 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Generalizovaná úzkostná porucha
Rozsah dávkovania je 150 až 600 mg denne, podáva sa rozdelene v dvoch alebo troch dávkach.
Potreba liečby sa musí pravidelne opakovane posúdiť.
Liečbu pregabalínom možno začať dávkou 150 mg denne. Podľa individuálnej odpovede pacienta
a tolerancie možno dávku po 1 týždni zvýšiť na 300 mg denne. Po ďalšom týždni možno dávku zvýšiť
na 450 mg denne. Maximálnu dennú dávku 600 mg možno dosiahnuť po ďalšom týždni.
Ukonč eni e l i eč by pr egabal í nom
V súlade so súčasnou klinickou praxou, ak sa musí liečba pregabalínom ukončiť, odporúča sa, aby sa to urobilo postupne počas minimálne 1 týždňa bez ohľadu na indikáciu (pozri časti 4.4 a 4.8).
O
sobitné populácie
 Pacienti s poruchou f unkc i e obl i či ek
Pacienti s poruchou f unkc i e obl i či ek
Pregabalín sa zo systémovej cirkulácie primárne eliminuje v nezmenenej forme renálnou exkréciou. Keďže klírens pregabalínu je priamo úmerný klírensu kreatinínu (pozri časť 5.2), dávka u pacientov s poruchou funkcie obličiek sa musí znižovať individuálne podľa klírensu kreatinínu (CLcr), ako je uvedené v tabuľke 1 použitím nasledovného vzorca:
CLcr(ml/min) =
1,23 × [140 – vek (roky)] × hmotnoť (kg)
kreatinín v sére (µmol/l)
(× 0,85 u žien)
Pregabalín možno efektívne odstrániť z plazmy hemodialýzou (50% lieku počas 4 hodín).
U hemodialyzovaných pacientov sa denná dávka pregabalínu musí upraviť podľa funkcie obličiek. K dennej dávke treba pridať doplnkovú dávku okamžite po každej 4-hodinovej hemodialýze (pozri tabuľku 1).
Tabuľka 1 Úprava dávky pregabalínu podľa funkcie obličiek
Klírens kreatinínu
(CLcr) (ml/min)
|
Celková denná dávka pregabalínu *
|
Dávkovací režim
|
| Začiatočná dávka
(mg/deň)
| Maximálna dávka
(mg/deň)
|
|
≥ 60
| 150
| 600
| BID alebo TID
|
≥ 30 – < 60
| 75
| 300
| BID alebo TID
|
≥ 15 – < 30
| 25 – 50
| 150
| Jedenkrát denne alebo BID
|
< 15
| 25
| 75
| Jedenkrát denne
|
Doplnkové dávkovanie po hemodialýze (mg)
|
| 25
| 100
| Jednorazová dávka+
|
TID = tri rozdelené dávky
BID = dve rozdelené dávky
* Celková denná dávka (mg/deň) sa má rozdeliť podľa dávkovacieho režimu a vyjadriť v mg/dávka
+ Doplnková dávka je jedna dodatočná dávka
Pacienti s poruchou f unkc i e pe če ne Nevyžaduje sa žiadna úprava dávky u pacientov s poruchou funkcie pečene (pozri časť 5.2).
Pediatrická populáciaBezpečnosť a účinnosť Pregabalinu Mylan u detí mladších ako 12 rokov a u dospievajúcich (vo veku
12 – 17 rokov) neboli stanovené. Údaje dostupné v súčasnosti sú uvedené v časti 4.8, 5.1 a 5.2, ale nie
je možné vykonať odporúčanie týkajúce sa dávkovania.
St arš i e os oby (vo veku nad 65 rokov)Starší pacienti môžu vyžadovať zníženie dávky pregabalínu z dôvodu zníženej renálnej funkcie (pozri pacienti s poruchou funkcie obličiek).
Spôsob podávaniaPregabalin Mylan sa môže užívať s jedlom alebo bez jedla. Pregabalin Mylan je určený iba na perorálne použitie.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Diabetickí pacienti
Podľa súčasnej klinickej praxe u niektorých diabetických pacientov s prírastkom hmotnosti počas liečby pregabalínom môže byť potrebné upraviť hypoglykemickú liečbu.
Reakcie z precitlivenosti
Po uvedení lieku na trh boli zaznamenané hlásenia o rekciách z precitlivenosti vrátane prípadov angioedému. Liečba pregabalínom sa musí okamžite ukončiť, ak sa vyskytnú príznaky angioedému, ako sú faciálny, periorálny opuch alebo opuch horných dýchacích ciest.
Závrat , somnole nci a, st rat a ve domi a, zmäte nosť a ment ál ne poš k odenie
Liečba pregabalínom sa dáva do súvisu so závratom a somnolenciou, ktoré mohli zvýšiť výskyt náhodných zranení (pádov) u staršej populácie. Existujú tiež hlásenia po uvedení lieku na trh o strate vedomia, zmätenosti a mentálnom poškodení. Preto pacientom sa má poradiť, aby boli opatrní, pokým sa neoboznámia s možnými účinkami lieku.
Úči nky spoj ené s videním
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní dávkovania. V klinických štúdiách, v ktorých bolo zahrnuté aj oftalmologické vyšetrenie, bol výskyt zníženia zrakovej ostrosti a zmien zorného poľa väčší u pacientov liečených pregabalínom ako
u pacientov liečených placebom; výskyt zmien na očnom pozadí bol väčší u pacientov liečených
placebom (pozri časť 5.1).
Po uvedení lieku na trh boli tiež hlásené nežiaduce reakcie na zrak, vrátane straty zraku, rozmazaného videnia alebo iných zmien zrakovej ostrosti, z ktorých mnohé boli prechodné. Prerušenie liečby pregabalínom môže viesť k vymiznutiu alebo zlepšeniu týchto zrakových príznakov.
Renálne zlyhávanie
Boli hlásené prípady renálneho zlyhávania a v niektorých prípadoch prerušenie liečby pregabalínom
viedlo k reverzibilite tejto nežiaducej reakcie.
Vysade ni e s účas ne podáv anýc h ant i epi l ept í k
Nie sú dostatočné údaje týkajúce sa vysadenia súčasne podávaných antiepileptík, akonáhle sa po
pridaní pregabalínu dosiahne kontrola záchvatu tak, aby bolo možné podávať pregabalín
v monoterapii.
Príznaky z vysadenia
Po ukončení krátkodobej a dlhodobej liečby pregabalínom boli u niektorých pacientov pozorované príznaky z vysadenia. Uvádzajú sa nasledujúce účinky: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, nervozita, depresia, bolesť, kŕče, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tom informovaný na začiatku liečby.
Počas užívania pregabalínu alebo krátko po ukončení liečby pregabalínom sa môžu vyskytnúť kŕče
vrátane epileptických záchvatov a záchvatov typu grand mal.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
K
ongestívne srdcové zlyhávanie
Po uvedení lieku na trh boli hlásené prípady kongestívneho srdcového zlyhávania u niektorých pacientov dostávajúcich pregabalín. Tieto reakcie sú najčastejšie pozorované u starších pacientov
s kardiovaskulárnymi ochoreniami počas liečby pregabalínom na neuropatickú indikáciu. Pregabalín sa má u týchto pacientov podávať s opatrnosťou. Ukončenie podávania pregabalínu môže viesť
k odozneniu reakcie.
Než i aduce re akc i e u pac i ent ov s porane ní m mi ec hy
Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy. Možno to pripísať aditívnemu účinku v dôsledku súbežnej liečby inými liekmi (napr. liekmi proti spasticite), ktoré je potrebné užívať pri tomto ochorení.
Samovr aže dné myšl i enk y a správanie
Samovražedné myšlienky a správanie boli hlásené u pacientov liečených antiepileptikami pri niekoľkých indikáciách. Meta-analýza randomizovaných placebom kontrolovaných štúdií antiepileptík tiež ukázala málo zvýšené riziko samovražedných myšlienok a správania. Mechanizmus tohto rizika
nie je známy a dostupné údaje nevylučujú možnosť zvýšeného rizika u pregabalínu.
Pacienti majú byť preto sledovaní kvôli prejavom samovražedných myšlienok a správania a má sa u nich zvážiť vhodná liečba. Pacienti (a ich opatrovatelia) majú byť upozornení, aby vyhľadali lekársku pomoc, ak sa prejavy samovražedných myšlienok alebo správania objavia.
Zhorše ná f unkc i a dol ného t ráv i ace ho t rak t u
Po uvedení lieku na trh boli hlásené prípady týkajúce sa zhoršenej funkcie dolného tráviaceho traktu (napr. intestinálna obštrukcia, paralytický ileus, obstipácia), keď sa pregabalín podával spolu s liekmi, ktoré môžu spôsobovať obstipáciu, ako sú napr. opioidné analgetiká. Keď sa bude pregabalín užívať
v kombinácii s opioidmi, môžu sa zvážiť opatrenia na predchádzanie obstipácii (zvlášť u žien
a starších pacientov).
Zneuži t i e, s klon k nadmer nému uží vani u l i ek ov al ebo z ávi sl osť
Boli hlásené prípady zneužitia, nadmerného užívania liekov a závislosti. Treba byť opatrný
u pacientov s anamnézou nadmerného užívania návykových látok a u takýchto pacientov majú byť sledované príznaky zneužitia pregabalínu, nadmerného užívania alebo závislosti (boli hlásené rozvoj tolerancie, zvyšovanie dávky, správanie vedúce k užitiu lieku).
Encefalopatia
Boli hlásené prípady encefalopatie, hlavne u pacientov s pridruženými stavmi, ktoré môžu vyvolať
encefalopatiu.
4.5 Liekové a iné interakcie
Pretože pregabalín sa vylučuje prevažne v nezmenenej forme močom, podlieha zanedbateľnému metabolizmu u ľudí (< 2% dávky zachytenej v moči vo forme metabolitov), neinhibuje liekový metabolizmus in vitro a neviaže sa na plazmatické proteíny, je nepravdepodobné, že by spôsobil alebo bol sám subjektom farmakokinetických interakcií.
I n vi vo š t údi e a popul ačná f armakoki net i ck á anal ýz a
Podobne, v in vivo štúdiách sa nepozorovali žiadne klinicky relevantné farmakokinetické interakcie medzi pregabalínom a fenytoínom, karbamazepínom, kyselinou valproovou, lamotrigínom, gabapentínom, lorazepamom, oxykodónom alebo etanolom. Populačná farmakokinetická analýza ukázala, že perorálne antidiabetiká, diuretiká, inzulín, fenobarbital, tiagabín a topiramát nemali klinicky významný účinok na klírens pregabalínu.
Perorálne kontraceptíva, noretisterón a/alebo etinylestradiol
Súbežné podávanie pregabalínu s perorálnymi kontraceptívami noretisterónom a/alebo
etinylestradiolom nemá vplyv na farmakokinetiku v rovnovážnom stave žiadnej z týchto látok.
Lie ky ovpl yv ňuj úc e centrálny nervový systém
Pregabalín môže zosilňovať účinky etanolu a lorazepamu. Opakované perorálne dávky pregabalínu podávané súbežne s oxykodónom, lorazepamom alebo etanolom v kontrolovaných klinických štúdiách neviedli ku klinicky významným účinkom na dýchanie. Po uvedení lieku na trh existujú hlásenia
o respiračnom zlyhaní a kóme u pacientov užívajúcich pregabalín a iné lieky utlmujúce centrálny nervový systém (CNS). Ukazuje sa, že pregabalín má aditívny efekt pri poškodení kognitívnej
a hrubej motorickej funkcie spôsobenej oxykodónom.
Interakcie a st arš i e os oby
Žiadne špecifické štúdie farmakodynamických interakcií sa nevykonali u starších dobrovoľníkov. Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Ženy v reprodukč nom ve ku/ Anti konc epc i a u mužov a ži en
Keďže potenciálne riziko pre ľudí nie je známe, ženy vo fertilnom veku musia používať účinnú
antikoncepciu.
Gravidita
Nie sú k dispozícii dostatočné údaje o použití pregabalínu u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Nie je známe potenciálne riziko pre ľudí.
Pregabalin Mylan sa má užívať počas gravidity iba v nevyhnutných prípadoch (ak prínos pre matku
jednoznačne preváži potenciálne riziko pre plod).
Laktácia
Pregabalín sa vylučuje do materského mlieka u ľudí (pozri časť 5.2). Účinok pregabalínu na novorodencov/dojčatá nie je známy. Rozhodnutie, či ukončiť dojčenie alebo ukončiť liečbu pregabalínom, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Nie sú k dispozícii klinické údaje o účinkoch pregabalínu na ženskú fertilitu.
V klinickom skúšaní hodnotiacom účinok pregabalínu na pohyblivosť spermií boli zdraví muži vystavení pregabalínu v dávke 600 mg/deň. Po 3 mesiacoch liečby sa nezistili žiadne účinky na pohyblivosť spermií.
Štúdia fertility na samičkách potkanov preukázala nežiaduce účinky na reprodukciu. Štúdie fertility na samčekoch potkanov preukázali nežiaduce účinky na reprodukciu a vývin. Klinický význam týchto zistení nie je známy (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pregabalin Mylan môže mať malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pregabalin Mylan môže vyvolať závraty a ospalosť, a preto môže ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje. Pacientom treba poradiť, aby neviedli vozidlá, neobsluhovali zložité stroje alebo sa nezapájali do iných potenciálne nebezpečných činností, pokiaľ nie je isté, či tento liek neovplyvňuje ich schopnosť vykonávať uvedené činnosti.
4.8 Nežiaduce účinky
Prehľad bezpečnostnéhoprofiluKlinický program s pregabalínom zahrňoval viac ako 8 900 pacientov užívajúcich pregabalín,
z ktorých viac ako 5 600 bolo zaradených v dvojito-zaslepených placebom kontrolovaných štúdiách. Najčastejšie hlásenými nežiaducimi reakciami boli závraty a somnolencia. Nežiaduce reakcie boli zvyčajne ľahkej až strednej intenzity. Vo všetkých kontrolovaných štúdiách boli nežiaduce reakcie príčinou ukončenia liečby u 12% pacientov užívajúcich pregabalín a u 5% pacientov užívajúcich placebo. Najčastejšími nežiaducimi reakciami vedúcimi k ukončeniu liečby v skupinách
s pregabalínom boli závraty a somnolencia.
Tabuľkový zoznam nežiaducich reakciíV tabuľke 2 nižšie sú všetky nežiaduce reakcie, ktoré sa vyskytli častejšie než pri placebe a viac než
u jedného pacienta, zoradené podľa triedy a frekvencie (veľmi časté (≥ 1/10); časté (≥ 1/100 až
< 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥1/10 000 až < 1/1 000); veľmi zriedkavé
(<1/10 000), neznáme (nedá sa odhadnúť z dostupných údajov)).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej
závažnosti.
Uvedené nežiaduce reakcie môžu tiež súvisieť so základným ochorením a/alebo sprievodnou liečbou. Výskyt všeobecných nežiaducich reakcií a nežiaducich reakcií centrálnej nervovej sústavy, najmä
somnolencie, sa zvýšil pri liečbe centrálnej neuropatickej bolesti spôsobenej poranením miechy (pozri
časť 4.4).
Ďalšie reakcie hlásené na základe skúseností po uvedení lieku na trh sú zaradené v zozname nižšie
kurzívou.
Tabuľka 2 Nežiaduce liekové reakcie pregabalínuTrieda orgánových
systémov Nežiaduce reakcie na liek
|
Infekcie a nákazy
Časté nazofaryngitída
|
Poruchy krvi a lymfatického systému
Menej časté neutropénia
|
Poruchy imunitného systému
Menej časté hypersenzitivita
Zriedkavé angioedém, alergická reakcia
|
Poruchy metabolizmu a výživy
Časté zvýšená chuť do jedla
Menej časté anorexia, hypoglykémia
|
Psychické poruchy
Časté euforická nálada, zmätenosť, iritabilita, dezorientácia, insomnia,
pokles libida
Menej časté halucinácie, panický atak, nepokoj, agitovanosť, depresia, depresívna nálada, povznášajúca nálada, agresivita, kolísanie nálady, depersonalizácia, ťažkosti s vyhľadávaním slov, abnormálne sny, vzostup libida, anorgazmia, apatia
Zriedkavé strata zábran
|
T
rieda orgánových
systémov
N
ežiaduce reakcie na liek
|
P
oruchy nervového systému
Veľmi časté závraty, somnolencia, bolesť hlavy
Časté ataxia, porucha koordinácie, tremor, dyzartria, amnézia, poruchy pamäti, porucha koncentrácie, parestézia, hypestézia, sedácia, porucha rovnováhy, letargia
Menej časté synkopa, stupor, myoklonus, strata vedomia, psychomotorická hyperaktivita, dyskinéza, posturálne závraty, intenčný tremor, nystagmus, kognitívne poruchy, mentálne poškodenie, porucha reči, hyporeflexia, hyperestézia, pocit pálenia, strata chuti, nevoľnosť
Zriedkavé kŕče, parosmia, hypokinéza, dysgrafia
|
P
oruchy oka
Časté zahmlené videnie, diplopia
Menej časté strata periférneho videnia, poruchy videnia, opuch očí, defekty
v zornom poli, zníženie zrakovej ostrosti, bolesti oka, astenopia, fotopsia, suché oči, zvýšená lakrimácia, podráždenie očí
Zriedkavé strata zraku, keratitída, oscilopsia, porušené hĺbkové videnie, mydriáza, strabizmus, porušená zraková ostrosť
|
P
oruchy ucha a labyrintu
Časté vertigo
Menej časté hyperakúzia
|
P
oruchy srdca a srdcovej činnosti
Menej časté tachykardia, AV blokáda 1. stupňa, sínusová bradykardia,
kongestívne srdcové zlyhávanie
Zriedkavé predĺženie QT, sínusová tachykardia, sínusová arytmia
|
P
oruchy ciev
Menej časté hypotenzia, hypertenzia, návaly horúčavy, sčervenanie, periférny pocit chladu
|
P
oruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dyspnoe, epistaxa, kašeľ, upchatie nosa, rinitída, chrápanie, suchý
nos
Zriedkavé pľúcny edém, zovreté hrdlo
|
P
oruchy gastrointestinálneho traktu
Časté vracanie, nauzea, obstipácia, hnačka, flatulencia, abdominálna distenzia, sucho v ústach
Menej časté gastroezofageálna refluxová choroba, zvýšená salivácia, znížená citlivosť v ústach
Zriedkavé ascites, pankreatitída, opuchnutý jazyk, dysfágia
|
P
oruchy kože a podkožného tkaniva
Menej časté papulózny exantém, žihľavka, hyperhidróza, pruritus
Zriedkavé Stevensov-Johnsonov syndróm, studený pot
,
|
P
oruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté svalové kŕče, artralgia, bolesti chrbta, bolesti v končatinách,
cervikálny spazmus
Menej časté opuch kĺbov, myalgia, svalové zášklby, bolesť šije, svalová
stuhnutosť
Zriedkavé rabdomyolýza
|
P
oruchy obličiek a močových ciest
Menej časté močová inkontinencia, dyzúria
Zriedkavé renálne zlyhanie, oligúria, retencia moču
|
T
rieda orgánových
systémov
N
ežiaduce reakcie na liek
|
P
oruchy reprodukčného systému a prsníkov
Časté erektilná dysfunkcia
Menej časté sexuálna dysfunkcia, oneskorená ejakulácia, dysmenorea, bolesť
prsníkov
Zriedkavé amenorea, výtok z prsníkov, zväčšenie prsníkov, gynekomastia
|
C
elkové poruchy a reakcie v mieste podania
Časté periférny edém, edém, abnormálna chôdza, padanie, pocit opitosti, abnormálny pocit, únava
Menej časté generalizovaný edém, edém tváre, pocit napätia na hrudníku,
bolesť, pyrexia, smäd, triaška, asténia
|
L
aboratórne a funkčné vyšetrenia
Časté zvýšená hmotnosť
Menej časté zvýšená kreatínfosfokináza v krvi, zvýšená alanínaminotransferáza, zvýšená aspartátaminotransferáza, zvýšená glukóza v krvi, znížený počet trombocytov, zvýšený kreatinín v krvi, znížený draslík v krvi, znížená hmotnosť
Zriedkavé znížený počet leukocytov v krvi
|
Po ukončení krátkodobej a dlhodobej liečby pregabalínom sa u niektorých pacientov pozorovali
príznaky z vysadenia. Uvádzajú sa nasledujúce reakcie: insomnia, bolesť hlavy, nauzea, úzkosť, hnačka, chrípkový syndróm, kŕče, nervozita, depresia, bolesť
, hyperhidróza a závrat, naznačujúce fyzickú závislosť. Pacient má byť o tejto skutočnosti informovaný na začiatku liečby.
Čo sa týka ukončenia dlhodobej liečby pregabalínom, údaje naznačujú, že výskyt a závažnosť
príznakov z vysadenia môžu byť závislé od dávky.
Pediatrická populáciaBezpečnostný profil pregabalínu pozorovaný v dvoch pediatrických štúdiách (farmakokinetická štúdia a štúdia bezpečnosti, n = 65; 1-ročná otvorená kontrolná štúdia bezpečnosti, n = 54) bol podobný bezpečnostnému profilu, ktorý sa pozoroval v štúdiách u dospelých (pozri časti 4.2, 5.1 a 5.2).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePríznakyPo uvedení lieku na trh najčastejšie hlásené nežiaduce reakcie pozorované po predávkovaní
pregabalínom zahŕňali ospalosť, stavy zmätenosti, agitovanosť a nepokoj. V zriedkavých prípadoch bola hlásená kóma.
Postup pri predávkovaní
Liečba predávkovania pregabalínom musí zahrňovať štandardné podporné opatrenia a môže zahrňovať podľa potreby aj hemodialýzu (pozri časť 4.2 tabuľka 1).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiepileptiká, iné antiepileptiká, ATC kód: N03AX16
Liečivo pregabalín je analógom gamaaminomaslovej kyseliny [(S)-3-(aminometyl)-5-metylhexánová kyselina].
Mechanizmus účinku
Pregabalín sa viaže na auxiliárne podjednotky (a2-d proteíny) napäťovo ovládaných kalciových
kanálov v centrálnom nervovom systéme.
Klinická účinnosťabezpečnosť
Epilepsia
Prídavná liečba
Pregabalín sa študoval v 3 kontrolovaných klinických skúšaniach v trvaní 12 týždňov s dávkovaním BID alebo dávkovaním TID. Celkové profily bezpečnosti a účinnosti pri BID a TID dávkovacích režimoch boli podobné.
Zníženie frekvencie epileptických záchvatov sa pozorovalo v 1. týždni.
Pediatrická populácia
Účinnosť a bezpečnosť pregabalínu ako doplnkovej liečby pri epilepsii u pediatrických pacientov mladších ako 12 rokov a dospievajúcich nebola stanovená. Nežiaduce udalosti pozorované vo farmakokinetickej štúdii a štúdii znášanlivosti, do ktorých boli zaradení pacienti vo veku od
3 mesiacov do 16 rokov (n = 65), boli podobné tým, ktoré sa pozorovali u dospelých. Výsledky
1-ročnej otvorenej štúdie bezpečnosti u 54 pediatrických pacientov vo veku od 3 mesiacov do
16 rokov s epilepsiou naznačujú, že nežiaduce udalosti pyrexie a infekcií horných dýchacích ciest sa
pozorovali častejšie ako v štúdiách u dospelých (pozri časti 4.2, 4.8 a 5.2).
Monoterapia (novodiagnostikovaní pacienti)
Pregabalín sa študoval v 1 kontrolovanom klinickom skúšaní v trvaní 56 týždňov s dávkovaním BID. Pregabalín nebol horší oproti lamotrigínu, čo sa týka dosiahnutia 6-mesačného obdobia bez záchvatov na konci sledovania. Pregabalín a lamotrigín boli podobne bezpečné a dobre tolerované.
Generalizovaná úzkostná porucha
Pregabalín sa študoval v 6 kontrolovaných klinických skúšaniach v trvaní 4 – 6 týždňov, v štúdii so staršími osobami v trvaní 8 týždňov a v dlhodobej štúdii zameranej na prevenciu relapsu s dvojito zaslepenou fázou zameranou na prevenciu relapsu v trvaní 6 mesiacov.
Ústup príznakov GAD vyjadrených Hamiltonovou škálou úzkosti (Hamilton Anxiety Rating
Scale = HAM-A) sa pozoroval v 1. týždni.
V kontrolovaných klinických skúšaniach (v trvaní 4 – 8 týždňov) 52% pacientov liečených pregabalínom a 38% pacientov v skupine s placebom malo aspoň 50% zlepšenie celkového HAM-A skóre od začiatku až po koniec sledovania.
V kontrolovaných klinických skúšaniach hlásila väčšia časť pacientov liečených pregabalínom ako pacientov liečených placebom rozmazané videnie, ktoré vo väčšine prípadov ustúpilo pri pokračovaní v dávkovaní. Oftalmologické vyšetrenie (vrátane vyšetrenia zrakovej ostrosti, formálneho vyšetrenia zorného poľa a vyšetrenia očného pozadia pri rozšírených zreniciach) sa vykonalo u viac ako
3 600 pacientov v rámci kontrolovaných klinických skúšaní. U týchto pacientov bola zraková ostrosť
znížená u 6,5% pacientov liečených pregabalínom a 4,8% pacientov liečených placebom. Zmeny zrakového poľa sa zistili u 12,4% pacientov liečených pregabalínom a 11,7% pacientov liečených placebom. Zmeny na očnom pozadí sa pozorovali u 1,7% pacientov liečených pregabalínom a 2,1% pacientov liečených placebom.
5.2 Farmakokinetické vlastnosti
Farmakokinetika pregabalínu v rovnovážnom stave je podobná u zdravých dobrovoľníkov, pacientov s epilepsiou užívajúcich antiepileptiká a pacientov s chronickou bolesťou.
Absorpcia
Pregabalín sa pri podaní nalačno rýchlo vstrebáva, maximálne plazmatické koncentrácie sa dosiahnu do 1 hodiny po podaní jednorazovej aj viacnásobnej dávky. Biologická dostupnosť pregabalínu po perorálnom podaní sa odhaduje na ≥ 90% a je nezávislá na dávke. Po opakovanom podaní sa rovnovážny stav dosiahne počas 24 až 48 hodín. Rýchlosť absorpcie pregabalínu sa zníži, keď sa podáva s jedlom, čo sa prejaví poklesom Cmax približne o 25 – 30% a predĺžením tmax na približne
2,5 hodiny. Avšak podávanie pregabalínu s jedlom nemá klinicky signifikantný účinok na mieru
absorpcie pregabalínu.
Distribúcia
V predklinických štúdiách sa potvrdil prienik pregabalínu cez hematoencefalickú bariéru u myší,
potkanov a opíc. Bolo dokázané, že pregabalín prechádza cez placentu u potkanov a nachádza sa
v mlieku laktujúcich potkanov. U človeka je zdanlivý distribučný objem pregabalínu po perorálnom
podaní približne 0,56 l/kg. Pregabalín sa neviaže na plazmatické proteíny.
Biotransformácia
Pregabalín u človeka podlieha zanedbateľnému metabolizmu. Po podaní dávky rádionuklidom značeného pregabalínu približne 98% rádioaktivity stanovenej v moči predstavoval nezmenený pregabalín. N-metylovaný derivát pregabalínu, hlavný metabolit pregabalínu v moči, predstavoval
0,9%. V predklinických štúdiách sa nezistila racemizácia S-enancioméru pregabalínu na
R-enanciomér.
Eliminácia
Pregabalín sa eliminuje zo systémovej cirkulácie primárne renálnou exkréciou v nezmenenej forme. Priemerný eliminačný polčas je 6,3 hodiny. Plazmatický klírens a renálny klírens pregabalínu sú priamo úmerné klírensu kreatinínu (pozri časť 5.2 Porucha funkcie obličiek).
Je potrebné upraviť dávku u pacientov so zníženými renálnymi funkciami alebo u hemodialyzovaných
pacientov (pozri časť 4.2 Tabuľka 1).
Linearita/nelinearita
Farmakokinetika pregabalínu je lineárna v odporúčanom rozsahu denných dávok. Interindivuduálna farmakokinetická variabilita pregabalínu je nízka (< 20%). Farmakokinetiku pri opakovaných dávkach možno predpovedať z údajov pri jednorazovej dávke. Preto nie je potrebné bežné monitorovanie plazmatických koncentrácií pregabalínu.
Pohlavie
Klinické skúšania potvrdili, že pohlavie nemá klinicky signifikantný vplyv na plazmatické
koncentrácie pregabalínu.
Porucha funkcie
obličiek
Klírens pregabalínu je priamo úmerný klírensu kreatinínu. Okrem toho sa pregabalín účinne odstraňuje z plazmy hemodialýzou (po 4-hodinovej hemodialýze klesnú plazmatické koncentrácie pregabalínu asi o 50%). Vzhľadom na to, že eliminácia obličkami je hlavným spôsobom eliminácie, je potrebné zníženie dávky u pacientov s poruchou funkcie obličiek a doplnková dávka po hemodialýze (pozri časť 4.2 tabuľka 1).
Porucha funkciepečene
Neboli vykonané žiadne špecifické farmakokinetické štúdie u pacientov s poruchou funkcie pečene. Keďže pregabalín nepodlieha signifikantnému metabolizmu a vylučuje sa prednostne v nezmenenej forme močom, neočakáva sa, že by poškodenie funkcie pečene signifikantne menilo plazmatické koncentrácie pregabalínu.
Pediatrická populácia
Farmakokinetika pregabalínu bola vyhodnocovaná u pediatrických pacientov s epilepsiou (vekové
skupiny: 1 až 23 mesiacov, 2 až 6 rokov, 7 až 11 rokov a 12 až 16 rokov) pri hladinách dávky 2,5; 5;
10 a 15 mg/kg/deň vo farmakokinetickej štúdii a štúdii znášanlivosti.
Po perorálnom podaní pregabalínu u pediatrických pacientov nalačno, bol čas do dosiahnutia maximálnej plazmatickej koncentrácie vo všeobecnosti podobný v rámci všetkých vekových skupín a dosiahol sa 0,5 hodiny až 2 hodiny po podaní dávky.
Parametre Cmax a AUC pregabalínu sa zvyšovali priamo úmerne so zvyšujúcou sa dávkou v rámci každej vekovej skupiny. AUC bola nižšia o 30 % u pediatrických pacientov s telesnou hmotnosťou menej ako 30 kg z dôvodu klírensu upraveného na základe telesnej hmotnosti zvýšeného o 43 %
u týchto pacientov v porovnaní s pacientmi s telesnou hmotnosťou ≥ 30 kg.
Terminálny polčas pregabalínu sa pohyboval v priemere od 3 do 4 hodín u pediatrických pacientov vo
veku do 6 rokov a od 4 do 6 hodín u tých, ktorí boli vo veku 7 rokov a starší.
Analýza populačnej farmakokinetiky preukázala, že klírens kreatinínu bol významným vedľajším parametrom klírensu pregabalínu po perorálnom podaní, telesná hmotnosť bola významným vedľajším parametrom zdanlivého distribučného objemu pregabalínu po perorálnom podaní a tieto vzťahy boli podobné u pediatrických a dospelých pacientov.
Farmakokinetika pregabalínu u pacientov mladších ako 3 mesiace nebola skúmaná (pozri časti 4.2,
4.8 a 5.1).
Staršieosoby(vo veku nad 65 rokov)
Klírens pregabalínu má tendenciu klesať so stúpajúcim vekom. Tento pokles klírensu pregabalínu je v súlade s poklesom klírensu kreatinínu, ktorý je podmienený stúpajúcim vekom. Zníženie dávky pregabalínu sa môže vyžadovať u pacientov pri vekom podmienenej poruche funkcie obličiek (pozri časť 4.2 tabuľka 1).
Dojčiacematky
Farmakokinetika 150 mg pregabalínu podávaných každých 12 hodín (300 mg denná dávka) bola vyhodnocovaná u 10 žien počas laktácie, ktoré boli aspoň 12 týždňov po pôrode. Laktácia mala malý až žiadny vplyv na farmakokinetiku pregabalínu. Pregabalín sa vylučoval do materského mlieka
s priemernými koncentráciami v ustálenom stave približne 76% z plazmatických koncentrácií
u matiek. Odhadovaná dávka u dojčaťa z materského mlieka (za predpokladu priemernej konzumácie
mlieka 150 ml/kg/deň) žien užívajúcich 300 mg/deň by bola 0,31 mg/kg/deň alebo 0,62 mg/kg/deň
u žien užívajúcich maximálnu dávku 600 mg/deň. Tieto odhadované dávky predstavujú približne 7%
celkovej dennej dávky u matky v mg/kg.
5.3 Predklinické údaje o bezpečnosti
V obvyklých farmakologických štúdiách bezpečnosti u zvierat bol pregabalín dobre tolerovaný
v klinicky relevantných dávkach. V štúdiách toxicity po opakovanom podávaní u potkanov a opíc sa pozorovali účinky na CNS vrátane hypoaktivity, hyperaktivity a ataxie. Zvýšená incidencia atrofie retiny, bežne pozorovaná u starnúcich potkaních albínov, sa zistila po dlhodobej expozícii pregabalínu v dávkach ≥ 5-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke.
Pregabalín nebol teratogénny u myší, potkanov ani u králikov. Fetálna toxicita u potkanov a králikov sa vyskytla iba pri dávkach dostatočne prevyšujúcich dávku pre človeka.
V prenatálnych/postnatálnych štúdiách toxicity pregabalín vyvolával vývojovú toxicitu u potomkov potkanov v dávkach > 2-krát vyšších, než je odporúčaná maximálna dávka pre človeka.
Nežiaduce účinky na fertilitu u samčekov a samičiek potkanov sa pozorovali iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia. Nežiaduce účinky na samčie reprodukčné orgány a parametre spermií boli reverzibilné a vyskytli sa iba pri expozíciách dostatočne vyšších, než je terapeutická expozícia, alebo boli spojené so spontánnymi degeneratívnymi procesmi na samčích reprodukčných orgánoch u potkana. Preto sa týmto účinkom pripisuje malý alebo žiadny klinický význam.
Na základe výsledkov mnohých in vitro a in vivo skúšok možno prehlásiť, že pregabalín nie je
genotoxický.
Dvojročné štúdie karcinogenicity s pregabalínom boli vykonané na potkanoch a myšiach. Nepozorovali sa žiadne nádory u potkanov v dávkach až do 24-násobku priemernej dávky u človeka pri maximálnej odporúčanej klinickej dávke 600 mg/deň. U myší sa nezistil zvýšený výskyt nádorov v dávkach podobných priemernej dávke u človeka, ale zvýšený výskyt hemangiosarkómov sa pozoroval pri vyšších dávkach. Negenotoxický mechanizmus tvorby pregabalínom indukovaných nádorov u myší zahrňuje zmeny krvných doštičiek a súvisiacu proliferáciu endoteliálnych buniek. Tieto zmeny krvných doštičiek neboli prítomné u potkanov alebo u ľudí na základe krátkodobých
a limitovaných dlhodobých klinických údajov. Neexistuje dôkaz, ktorý by naznačoval súvisiace riziko
u ľudí.
U mladých potkanov sa druhy toxicity kvantitatívne nelíšili od tých, ktoré sa pozorovali u dospelých potkanov. Avšak mladé potkany sú oveľa senzitívnejšie. Pri terapeutických dávkach sa dokázali klinické príznaky hyperaktivity CNS a bruxizmus a niektoré zmeny v raste (prechodné potlačenie prírastku telesnej hmotnosti). Účinky na pohlavný cyklus sa pozorovali pri 5-násobku terapeutickej dávky u človeka. Znížená odpoveď na akustický podnet sa pozorovala u mladých potkanov 1 –
2 týždne po expozícii pri > 2-násobku terapeutickej dávky u človeka. Deväť týždňov po expozícii sa už tento účinok viac nepozoroval.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsúl hydroxypropylcelulóza, kukuričný škrob, mastenec
Obal kapsúl
žltý oxid železitý (E172), oxid titaničitý (E171),
erytrozín (E127), želatína, nátriumlaurylsulfát
Atrament
šelak,
čierny oxid železitý (E172),
makrogol,
roztok amoniaku, koncentrovaný, hydroxid draselný
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Blister: Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou. Fľaška: Fľašku uchovávajte pevne uzatvorenú na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PVDC/Al blistre obsahujúce 14, 56 alebo 100 tvrdých kapsúl.
PVC/PVDC/Al blistre s perforáciou obsahujúce 56 x 1 alebo 100 x 1 tvrdú kapsulu, umožňujúce
oddelenie jednotlivej dávky.
HDPE fľašky obsahujúce 200 tvrdých kapsúl.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Generics [UK] Limited
Station Close Potters Bar Hertfordshire EN6 1TL Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/15/997/045
EU/1/15/997/046
EU/1/15/997/047
EU/1/15/997/048
EU/1/15/997/049
EU/1/15/997/050
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.