
bítormi HMG-CoA reduktázy simvastatínom, lovastatínom a atorvastatínom (pozri
časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Precitlivenosť
Neexistujú informácie týkajúce sa skríženej citlivosti medzi posakonazolom a inými azolovými
antimykotikami. Pri predpisovaní lieku Posaconazole Accord pacientom s precitlivenosťou na iné azoly
sa musí postupovať opatrne.
Hepatálna toxicita
Počas liečby posakonazolom sa hlásili hepatálne reakcie (napr. mierne až stredne závažné zvýšenia ALT,
AST, alkalickej fosfatázy, celkového bilirubínu a/alebo klinická hepatitída). Zvýšené hodnoty výsledkov vyšetrení funkcie pečene boli všeobecne po ukončení liečby reverzibilné a v niektorých prípadoch sa tieto výsledky vyšetrení normalizovali aj bez prerušenia liečby. Zriedkavo sa hlásili závažnejšie hepatálne reakcie s fatálnymi následkami.
Posakonazol sa má používať opatrne u pacientov s poruchou funkcie pečene z dôvodu obmedzených klinických skúseností a možnosti, že plazmatické hladiny posakonazolu môžu byť u týchto pacientov vyššie (pozri časti 4.2 a 5.2).
Sledovanie funkcie pečene
Na začiatku liečby a počas liečby posakonazolom sa majú vyhodnocovať výsledky vyšetrenia funkcie pečene.
Pacienti, u ktorých sa počas liečby liekom Posaconazole Accord objavia abnormálne hodnoty výsledkov vyšetrení funkcie pečene, musia byť pravidelne sledovaní kvôli vzniku závažnejšieho poškodenia pečene. Starostlivosť o pacienta musí zahŕňať laboratórne vyšetrenie funkcie pečene (zvlášť vyšetrenia funkcie pečene
a bilirubín). Ak klinické prejavy a príznaky zodpovedajú vznikajúcemu ochoreniu pečene, má sa zvážiť
ukončenie liečby liekom Posaconazole Accord.
Predĺženie QTc intervalu
Liečba niektorými azolmi sa spája s predĺžením QTc intervalu. Posaconazole Accord sa nesmie podávať s
liekmi, ktoré sú substrátmi CYP3A4 a je o nich známe, že predlžujú QTc interval (pozri časti 4.3 a 4.5).
Posaconazole Accord sa má podávať opatrne pacientom s proarytmickými stavmi, ako sú:
- vrodené alebo získané predĺženie QTc intervalu;
- kardiomyopatia, zvlášť v spojení so zlyhávaním srdca;
- sínusová bradykardia;
- existujúce symptomatické arytmie;
- súbežné užívanie s liekmi, o ktorých je známe, že predlžujú QTc interval (iné, ako sú uvedené v
časti 4.3).
Poruchy elektrolytov, zvlášť tie, ktoré sa týkajú hladín draslíka, horčíka alebo vápnika, sa majú sledovať a
podľa potreby upraviť pred a počas liečby posakonazolom.
Liekové interakcie
Posakonazol je inhibítorom CYP3A4 a počas liečby inými liekmi, ktoré sa metabolizujú
prostredníctvom CYP3A4, sa má používať len za osobitných okolností (pozri časť 4.5).
Midazolam a iné benzodiazepíny
Vzhľadom na riziko predĺženého sedatívneho účinku a možnej respiračnej depresie sa má súbežné podávanie
posakonazolu s akýmikoľvek benzodiazepínmi, ktoré sa metabolizujú prostredníctvom CYP3A4 (napr. midazolam, triazolam, alprazolam), zvážiť len v prípade, keď je to jednoznačne nutné. Má sa zvážiť úprava dávky benzodiazepínov metabolizovaných prostredníctvom CYP3A4 (pozri časť 4.5).
Toxicita vinkristínu
Súbežné podávanie azolových antimykotík, vrátane posakonazolu, s vinkristínom sa spája
s neurotoxicitou a ďalšími závažnými nežiaducimi reakciami, vrátane záchvatov kŕčov, periférnej neuropatie, syndrómu neprimeranej sekrécie antidiuretického hormónu a paralytického ilea. Použitie azolových antimykotík, vrátane posakonazolu, vyhraďte pre pacientov dostávajúcich alkaloid z rodu Vinca, vrátane vinkristínu, u ktorých nie je žiadna alternatívna možnosť antimykotickej liečby (pozri časť 4.5).
Rifamycínové antibiotiká (rifampicín, rifabutín), niektoré antikonvulzíva (fenytoín, karbamazepín,fenobarbital, primidón) a efavirenz
V kombinácii s nimi sa môžu koncentrácie posakonazolu významne znížiť; preto je potrebné vyhnúť sa ich
súbežnému použitiu s posakonazolom, pokiaľ prínos pre pacienta nepreváži riziko (pozri časť 4.5).
Plazmatická expozícia
Plazmatické koncentrácie posakonazolu po podaní posakonazolu vo forme tabliet sú vo všeobecnosti vyššie
ako koncentrácie dosiahnuté pri perorálnej suspenzii posakonazolu. U niektorých pacientov sa môžu plazmatické koncentrácie posakonazolu po podaní posakonazolu vo forme tabliet v priebehu času zvýšiť (pozri časť 5.2). Údaje o bezpečnosti pri vyšších hladinách expozície dosiahnutých pri posakonazole vo forme tabliet sú v súčasnosti obmedzené.
Dysfunkcia gastrointestinálneho traktu
U pacientov so závažnou gastrointestinálnou dysfunkciou (ako je silná hnačka) sú obmedzené
farmakokinetické údaje. Pacientov, ktorí majú silnú hnačku alebo vracanie, je potrebné starostlivo sledovať
kvôli vzniku prielomových mykotických infekcií.
Pomocné látky
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej tablete, t.j. v podstate zanedbateľné množstvo
sodíka.
4.5 Liekové a iné interakcie
Vplyv iných liekov na posakonazol
Posakonazol je metabolizovaný prostredníctvom UDP glukuronidácie (enzýmy fázy 2) a in vitro je substrátom
pre eflux sprostredkovaný p-glykoproteínom (P-gp). Inhibítory (napr. verapamil, cyklosporín, chinidín, klaritromycín, erytromycín atď.) týchto klírensových ciest môžu preto zvyšovať koncentrácie posakonazolu v plazme a induktory (napr. rifampicín, rifabutín, niektoré antikonvulzíva atď.) týchto ciest ich môžu znižovať.
Rifabutín
Rifabutín (300 mg jedenkrát denne) znížil Cmax (maximálna plazmatická koncentrácia) posakonazolu na 57
% a AUC (plocha pod krivkou plazmatickej koncentrácie podľa času) na 51 %. Je potrebné vyhnúť sa súbežnému použitiu posakonazolu a rifabutínu a podobných induktorov (napr. rifampicín), pokiaľ prínos pre pacienta nepreváži riziko. Pozri aj nižšie uvedené informácie o účinku posakonazolu na plazmatické hladiny rifabutínu.
Efavirenz
Efavirenz (400 mg jedenkrát denne) znížil Cmax posakonazolu o 45 % a AUC o 50 %. Je potrebné vyhnúť sa
súbežnému použitiu posakonazolu a efavirenzu, pokiaľ prínos pre pacienta nepreváži riziko.
Fosamprenavir
Kombinovanie fosamprenaviru s posakonazolom môže viesť k zníženiu plazmatických koncentrácií posakonazolu. Ak je súbežné podávanie nevyhnutné, odporúča sa starostlivé sledovanie kvôli vzniku prielomových mykotických infekcií. Podávanie opakovaných dávok fosamprenaviru (700 mg dvakrát denne počas 10 dní) znížilo Cmax posakonazolu vo forme perorálnej suspenzie (prvý deň 200 mg jedenkrát denne, druhý deň 200 mg dvakrát denne, potom 400 mg dvakrát denne počas 8 dní) o 21 % a AUC o 23 %. Nie je známy účinok posakonazolu na hladiny fosamprenaviru, keď sa fosamprenavir podáva s ritonavirom.
Fenytoín
Fenytoín (200 mg jedenkrát denne) znížil Cmax posakonazolu o 41 % a AUC o 50 %. Je potrebné
vyhnúť sa súbežnému použitiu posakonazolu a fenytoínu a podobných induktorov (napr. karbamazepín,
fenobarbital, primidón), pokiaľ prínos pre pacienta nepreváži riziko.
Antagonisty H2-receptorov a inhibítory protónovej pumpy
Pri súbežnom užívaní posakonazolu vo forme tabliet s antacidami, antagonistami H2-receptorov
a inhibítormi protónovej pumpy sa nepozorovali žiadne klinicky významné účinky. Pri súbežnom užívaní
posakonazolu vo forme tabliet s antacidami, antagonistami H2-receptorov a inhibítormi protónovej pumpy sa
nevyžaduje žiadna úprava dávkovania.
Vplyv posakonazolu na iné lieky
Posakonazol je silným inhibítorom CYP3A4. Súbežné podávanie posakonazolu so substrátmi CYP3A4
môže viesť k výraznému zvýšeniu expozícií substrátom CYP3A4, ako to ďalej dokazujú účinky na takrolimus, sirolimus, atazanavir a midazolam. Počas súbežného podávania posakonazolu a intravenózne podávaných substrátov CYP3A4 sa odporúča postupovať opatrne a dávku substrátu CYP3A4 bude možno treba znížiť. Ak sa posakonazol používa súbežne so substrátmi CYP3A4 podávanými perorálne, ktorých
zvýšené plazmatické koncentrácie môžu byť spojené s neprijateľnými nežiaducimi reakciami, je potrebné
starostlivo sledovať plazmatické koncentrácie substrátu CYP3A4 a/alebo nežiaduce reakcie a podľa potreby
upraviť dávku. Niektoré interakčné štúdie sa uskutočnili u zdravých dobrovoľníkov, u ktorých sa pozorovala vyššia expozícia posakonazolu v porovnaní s pacientmi, ktorým sa podávala rovnaká dávka. Účinok posakonazolu na substráty CYP3A4 by u pacientov mohol byť trochu nižší, ako účinok pozorovaný u zdravých dobrovoľníkov, pričom sa očakáva, že medzi jednotlivými pacientmi sa bude líšiť v dôsledku variabilnej expozície posakonazolu u pacientov. Účinok súbežného podávania posakonazolu na
plazmatické hladiny substrátov CYP3A4 sa tiež môže líšiť u jednotlivého pacienta.
Terfenadín, astemizol, cisaprid, pimozid, halofantrín a chinidín (substráty CYP3A4)
Súbežné podávanie posakonazolu a terfenadínu, astemizolu, cisapridu, pimozidu, halofantrínu alebo chinidínu je kontraindikované. Súbežné podávanie môže viesť k zvýšeniu plazmatických koncentrácií týchto liekov, vedúcemu k predĺženiu QTc intervalu a k zriedkavým prípadom torsades de pointes (pozri časť 4.3).
Námeľové alkaloidy
Posakonazol môže zvýšiť plazmatickú koncentráciu námeľových alkaloidov (ergotamín
a dihydroergotamín), čo môže viesť k ergotizmu. Súbežné podávanie posakonazolu a námeľových alkaloidov
je kontraindikované (pozri časť 4.3).
Inhibítory HMG-CoA reduktázy metabolizované prostredníctvom CYP3A4 (napr. simvastatín, lovastatín a atorvastatín)
Posakonazol môže podstatne zvýšiť plazmatické hladiny inhibítorov HMG-CoA reduktázy, ktoré sú metabolizované prostredníctvom CYP3A4. Počas liečby posakonazolom sa musí liečba týmito inhibítormi HMG-CoA reduktázy ukončiť, pretože zvýšené hladiny sa spájali s rabdomyolýzou (pozri časť 4.3).
Alkaloidy z rodu Vinca
Väčšina alkaloidov z rodu Vinca (napr. vinkristín a vinblastín) sú substrátmi CYP3A4. Súbežné podávanie azolových antimykotík, vrátane posakonazolu, s vinkristínom sa spája so závažnými nežiaducimi reakciami (pozri časť 4.4). Posakonazol môže zvýšiť plazmatické koncentrácie alkaloidov z rodu Vinca, čo môže viesť k neurotoxicite a ďalším závažným nežiaducim reakciám. Použitie azolových antimykotík, vrátane posakonazolu, preto vyhraďte pre pacientov dostávajúcich alkaloid z rodu Vinca, vrátane vinkristínu, u
ktorých nie je žiadna alternatívna možnosť antimykotickej liečby.
Rifabutín
Posakonazol zvýšil Cmax rifabutínu o 31 % a AUC o 72 %. Je potrebné vyhnúť sa súbežnému použitiu posakonazolu a rifabutínu, pokiaľ prínos pre pacienta nepreváži riziko (pozri aj vyššie uvedené informácie o účinku rifabutínu na plazmatické hladiny posakonazolu). Ak sa tieto lieky podávajú súbežne, odporúča sa starostlivé sledovanie kompletného krvného obrazu a nežiaducich reakcií súvisiacich so zvýšenými hladinami rifabutínu (napr. uveitída).
Sirolimus
Podávanie opakovaných dávok posakonazolu vo forme perorálnej suspenzie (400 mg dvakrát denne počas
16 dní) zdravým osobám zvýšilo Cmax sirolimu (jednorazová dávka 2 mg) priemerne 6,7- násobne a AUC
8,9-násobne (rozsah 3,1 až 17,5-násobok). Účinok posakonazolu na sirolimus
u pacientov nie je známy, ale očakáva sa, že bude variabilný v dôsledku variabilnej expozície posakonazolu u pacientov. Súbežné podávanie posakonazolu so sirolimom sa neodporúča a treba sa mu vyhnúť vždy, keď je to možné. Ak sa súbežné podávanie považuje za nevyhnutné, potom sa odporúča dávku sirolimu na začiatku liečby posakonazolom značne znížiť a veľmi často sledovať minimálne koncentrácie sirolimu v plnej krvi.
Koncentrácie sirolimu sa majú merať na začiatku, počas súbežného podávania a po ukončení liečby posakonazolom, pričom treba primerane upraviť dávky sirolimu. Je potrebné si uvedomiť, že počas súbežného podávania s posakonazolom sa mení vzťah medzi minimálnou koncentráciou a AUC sirolimu. V dôsledku toho môžu minimálne koncentrácie sirolimu, ktoré spadajú do zvyčajného terapeutického rozmedzia, vyústiť do subterapeutických hladín. Preto je potrebné docieliť, aby sa minimálne koncentrácie sirolimu nachádzali
v hornej časti zvyčajného terapeutického rozmedzia a má sa venovať zvýšená pozornosť klinickým prejavom a príznakom, laboratórnym hodnotám a biopsiám tkanív.
Cyklosporín
U pacientov po transplantácii srdca na stabilnej dávke cyklosporínu, 200 mg posakonazolu vo forme perorálnej suspenzie jedenkrát denne zvýšilo koncentrácie cyklosporínu, čo vyžadovalo zníženie dávky. V štúdiách klinickej účinnosti sa hlásili prípady zvýšenia hladín cyklosporínu vedúce
k závažným nežiaducim reakciám, vrátane nefrotoxicity a jedného fatálneho prípadu leukoencefalopatie. Keď sa s liečbou posakonazolom začína u pacientov, ktorí už dostávajú cyklosporín, dávka cyklosporínu sa má znížiť (napr. na asi tri štvrtiny súčasnej dávky). Následne je potrebné starostlivo sledovať hladiny cyklosporínu v krvi, a to počas súbežného podávania a po ukončení liečby posakonazolom, a dávku cyklosporínu upraviť podľa potreby.
Takrolimus
Posakonazol zvýšil Cmax takrolimu (jednorazová dávka 0,05 mg/kg telesnej hmotnosti) o 121 %
a AUC o 358 %. V štúdiách klinickej účinnosti sa hlásili klinicky významné interakcie, ktoré viedli k
hospitalizácii a/alebo ukončeniu liečby posakonazolom. Keď sa s liečbou posakonazolom začína u
pacientov, ktorí už dostávajú takrolimus, dávka takrolimu sa má znížiť (napr. na asi jednu tretinu súčasnej dávky). Následne je potrebné starostlivo sledovať hladiny takrolimu v krvi, a to počas súbežného podávania a po ukončení liečby posakonazolom, a dávku takrolimu upraviť podľa potreby.
Inhibítory HIV proteázy
Keďže inhibítory HIV proteázy sú substrátmi CYP3A4, predpokladá sa, že posakonazol bude zvyšovať plazmatické hladiny týchto antiretrovírusových liečiv. V dôsledku súbežného podávania posakonazolu vo forme perorálnej suspenzie (400 mg dvakrát denne) s atazanavirom (300 mg jedenkrát denne) počas 7 dní sa Cmax atazanaviru u zdravých osôb zvýšila priemerne 2,6-násobne
a AUC 3,7-násobne (rozsah 1,2 až 26-násobok). V dôsledku súbežného podávania posakonazolu vo forme perorálnej suspenzie (400 mg dvakrát denne) s atazanavirom a ritonavirom (300/100 mg jedenkrát denne) počas 7 dní sa Cmax atazanaviru u zdravých osôb zvýšila priemerne 1,5-násobne
a AUC 2,5-násobne (rozsah 0,9 až 4,1-násobok). Pridanie posakonazolu k liečbe atazanavirom alebo atazanavirom plus ritonavirom sa spájalo so zvýšením plazmatických hladín bilirubínu. Počas súbežného podávania s posakonazolom sa odporúča často sledovať nežiaduce reakcie a toxicitu spojenú s antiretrovírusovými liečivami, ktoré sú substrátmi CYP3A4.
Midazolam a iné benzodiazepíny metabolizované prostredníctvom CYP3A4
V štúdii u zdravých dobrovoľníkov zvýšil posakonazol vo forme perorálnej suspenzie (200 mg jedenkrát denne počas 10 dní) expozíciu (AUC) intravenózneho midazolamu (0,05 mg/kg) o 83 %. V ďalšej štúdii u zdravých dobrovoľníkov zvýšilo podávanie opakovanej dávky posakonazolu vo forme perorálnej suspenzie (200 mg dvakrát denne počas 7 dní) Cmax intravenózneho midazolamu
(jednorazová dávka 0,4 mg) priemerne 1,3-násobne a AUC 4,6-násobne (rozsah 1,7 až 6,4-násobok).
Posakonazol vo forme perorálnej suspenzie v dávke 400 mg dvakrát denne počas 7 dní zvýšil Cmax intravenózneho midazolamu 1,6-násobne a AUC 6,2-násobne (rozsah 1,6 až 7,6-násobok). Obe dávky posakonazolu zvýšili Cmax perorálneho midazolamu (jednorazová perorálna dávka 2 mg) 2,2-násobne a AUC
4,5-násobne. Posakonazol vo forme perorálnej suspenzie (200 mg alebo 400 mg) počas súbežného podávania
okrem toho predĺžil priemerný terminálny polčas midazolamu z približne 3–4 hodín na 8–10 hodín.
Vzhľadom na riziko predĺženého sedatívneho účinku sa odporúča zvážiť úpravu dávky, keď sa posakonazol podáva súbežne s akýmkoľvek benzodiazepínom, ktorý sa metabolizuje prostredníctvom CYP3A4 (napr. midazolam, triazolam, alprazolam) (pozri časť 4.4).
Blokátory kalciového kanála metabolizované prostredníctvom CYP3A4 (napr. diltiazem, verapamil, nifedipín, nizoldipín)
Počas súbežného podávania s posakonazolom sa odporúča časté sledovanie nežiaducich reakcií
a toxicity súvisiacich s blokátormi kalciového kanála. Môže byť potrebná úprava dávky blokátorov kalciového kanála.
Digoxín
Podávanie iných azolov sa spájalo so zvýšením hladín digoxínu. Posakonazol preto môže zvýšiť plazmatickú koncentráciu digoxínu, a je potrebné sledovať hladiny digoxínu, keď sa začína alebo ukončuje liečba
posakonazolom.
Deriváty sulfonylmočoviny
Pri súbežnom podaní glipizidu s posakonazolom sa u niektorých zdravých dobrovoľníkov znížili
koncentrácie glukózy. U diabetických pacientov sa odporúča sledovať koncentrácie glukózy.
Pediatrická populácia
Interakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktácia
Gravidita
Neexistujú dostatočné informácie o použití posakonazolu u gravidných žien. Štúdie na zvieratách preukázali
reprodukčnú toxicitu (pozri časť 5.3). Možné riziko u ľudí nie je známe.
Ženy vo fertilnom veku musia počas liečby používať účinnú antikoncepciu. Posakonazol sa nesmie užívať počas gravidity, pokiaľ prínos pre matku jednoznačne nepreváži možné riziko pre plod.
Dojčenie
Posakonazol sa vylučuje do mlieka dojčiacich potkanov (pozri časť 5.3). Vylučovanie posakonazolu do
materského mlieka u ľudí sa neskúmalo. Dojčenie sa musí na začiatku liečby posakonazolom zastaviť.
Fertilita
Posakonazol nemal žiadny vplyv na fertilitu samcov potkanov pri dávkach až do 180 mg/kg (3,4- násobok
dávkovania 300 mg tablety na základe plazmatických koncentrácií v rovnovážnom stave
u pacientov) ani samíc potkanov pri dávke až do 45 mg/kg (2,6-násobok dávkovania 300 mg tablety na základe plazmatických koncentrácií v rovnovážnom stave u pacientov). K dispozícii nie je žiadna klinická skúsenosť, ktorá by stanovila vplyv posakonazolu na fertilitu ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Keďže sa pri používaní posakonazolu hlásili niektoré nežiaduce reakcie (napr. závrat, somnolencia atď.),
ktoré môžu potenciálne ovplyvniť vedenie vozidiel/obsluhu strojov, je potrebná opatrnosť.
4.8 Nežiaduce účinky
Údaje o bezpečnosti sa získali najmä v štúdiách s perorálnou suspenziou.
Lieková forma tablety sa skúmala iba u pacientov s AML a MDS a u tých pacientov po HSCT, ktorí mali alebo boli vysoko rizikoví z hľadiska GVHD. Maximálne trvanie expozície liekovej forme tablety bolo kratšie ako pri perorálnej suspenzii. Plazmatická expozícia, ktorá sa navodila liekovou formou tablety, bola vyššia ako plazmatická expozícia pozorovaná pri perorálnej suspenzii. Nie je možné vylúčiť vyšší výskyt nežiaducich reakcií.
Súhrn bezpečnostného profilu
Posakonazol vo forme tabliet
Bezpečnosť posakonazolu vo forme tabliet sa hodnotila u 230 pacientov zaradených v pivotnej klinickej štúdii. Pacienti sa zaradili do nekomparatívneho skúšania farmakokinetiky a bezpečnosti posakonazolu vo forme tabliet pri ich podávaní ako antimykotickej profylaxie. Pacienti mali oslabený imunitný systém so základnými ochoreniami zahŕňajúcimi hematologické malignity, neutropéniu po chemoterapii, GVHD a stav po HSCT. Liečba posakonazolom sa podávala počas mediánu trvania 28 dní. Dvadsať pacientov dostávalo
200 mg dennú dávku a 210 pacientov dostávalo 300 mg dennú dávku (po dávkovaní dvakrát denne v 1. deň
v každej skupine).
Bezpečnosť posakonazolu vo forme tabliet a perorálnej suspenzie
Bezpečnosť posakonazolu vo forme perorálnej suspenzie sa hodnotila u > 2 400 pacientov a zdravých dobrovoľníkov zaradených do klinických skúšaní a zo skúseností po uvedení lieku na trh. Najčastejšie hlásené závažné nežiaduce reakcie súvisiace s liekom zahŕňali nauzeu, vracanie, hnačku, horúčku a zvýšený bilirubín.
Bezpečnosť posakonazolu vo forme tabliet sa hodnotila u 336 pacientov a zdravých dobrovoľníkov zaradených do klinických skúšaní. Bezpečnostný profil tabliet bol podobný bezpečnostnému profilu perorálnej suspenzie.
Tabuľkovýzoznamnežiaducichreakcií
V rámci tried orgánových systémov sú nežiaduce reakcie uvedené pod nadpisom frekvencie
s použitím nasledujúcich kategórií: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté
(≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme.
Tabuľka 2. Nežiaduce reakcie rozdelené podľa orgánových systémov a frekvencie*
Poruchy krvi a lymfatického systému
Časté:
Menej časté:
Zriedkavé:
Poruchy imunitného systému
Menej časté:
Zriedkavé:
Poruchy endokrinného systému
neutropénia
trombocytopénia, leukopénia, anémia, eozinofília, lymfadenopatia, infarkt sleziny
hemolyticko-uremický syndróm, trombotická
trombocytopenická purpura, pancytopénia, koagulopatia, hemorágia
alergická reakcia
reakcia z precitlivenosti
Zriedkavé: insuficiencia nadobličiek, pokles gonadotropínu v krvi
Poruchy metabolizmu a výživy
Časté:
Menej časté:
Psychické poruchy Menej časté: Zriedkavé:
Poruchy nervového systémuČasté:
Menej časté:
Zriedkavé:
Poruchy oka Menej časté: Zriedkavé:
Poruchy ucha a labyrintunerovnováha elektrolytov, anorexia, znížená chuť do jedla,
hypokaliémia, hypomagneziémia hyperglykémia, hypoglykémia
abnormálne sny, stav zmätenosti, porucha spánku psychotická porucha, depresia
parestézia, závrat, somnolencia, bolesť hlavy, dysgeúzia konvulzie, neuropatia, hypestézia, tremor, afázia, insomnia cerebrovaskulárna príhoda, encefalopatia, periférna neuropatia, synkopa
rozmazané videnie, fotofóbia, znížená zraková ostrosť
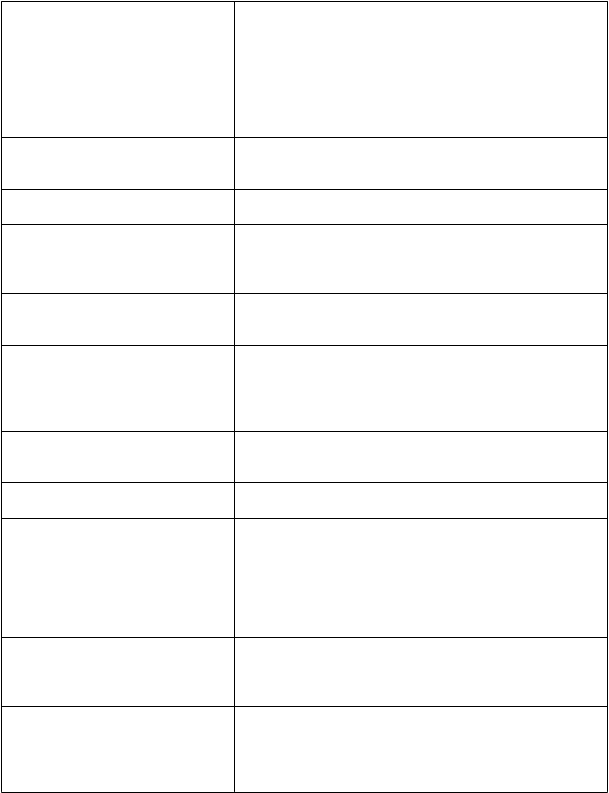
dvojité videnie, skotóm
Zriedkavé: porucha sluchu
Poruchy srdca a srdcovej činnosti
Menej časté:
Zriedkavé:
Poruchy ciev
Časté:
Menej časté:
Zriedkavé:
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté:
Zriedkavé:
syndróm dlhého QT intervalu§, abnormálny elektrokardiogram§, palpitácie, bradykardia, supraventrikulárne extrasystoly, tachykardia
torsade de pointes, náhla smrť, komorová tachykardia, kardiorespiračné zastavenie, zlyhávanie srdca, infarkt
hypertenzia
hypotenzia, vaskulitída
pľúcna embólia, trombóza hĺbkových žíl
kašeľ, epistaxa, štikútanie, nazálna kongescia, pleuritická
bolesť, tachypnoe
pľúcna hypertenzia, intersticiálna pneumónia, pneumonitída
P
o
ruchy gastrointestinálneho traktu
Veľmi časté:
Časté:
Menej časté:
Zriedkavé:
Poruchy pečene a žlčových ciest
Časté:
Menej časté:
Zriedkavé:
Poruchy kože a podkožného tkaniva
Časté:
Menej časté:
Zriedkavé:
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
nauzea
vracanie, bolesť brucha, hnačka, dyspepsia, sucho v ústach, flatulencia, zápcha, anorektálny diskomfort
pankreatitída, abdominálna distenzia, enteritída, diskomfort
v epigastriu, eruktácia, gastroezofágová refluxová choroba, opuch úst
gastrointestinálne krvácanie, ileus
zvýšené hodnoty výsledkov vyšetrení funkcie pečene (zvýšená ALT, zvýšená AST, zvýšený bilirubín, zvýšená alkalická fosfatáza, zvýšená GGT)
hepatocelulárne poškodenie, hepatitída, žltačka,
hepatomegália, cholestáza, hepatálna toxicita, abnormálna
funkcia pečene
zlyhávanie pečene, cholestatická hepatitída, hepatosplenomegália, citlivosť pečene, asterixis
vyrážka, pruritus
ulcerácia v ústach, alopécia, dermatitída, erytém, petechie
Stevensov-Johnsonov syndróm, vezikulárna vyrážka
Menej časté: bolesť chrbta, bolesť krku, muskuloskeletálna bolesť, bolesť
v končatine
P
o
ruchy obličiek a močových ciest
Menej časté:
Zriedkavé:
Poruchy reprodukčného systému a prsníkov
Menej časté:
Zriedkavé:
Celkové poruchy a reakcie v mieste podania
Časté:
Menej časté:
Zriedkavé:
Laboratórne a funkčné vyšetrenia
akútne zlyhanie obličiek, zlyhanie obličiek, zvýšená hladina
kreatinínu v krvi
renálna tubulárna acidóza, intersticiálna nefritída
porucha menštruácie
bolesť prsníka
pyrexia (horúčka), asténia, únava
edém, bolesť, triaška, nevoľnosť, diskomfort v hrudníku,
neznášanlivosť liečiva, pocit nervozity, zápal sliznice
edém jazyka, edém tváre
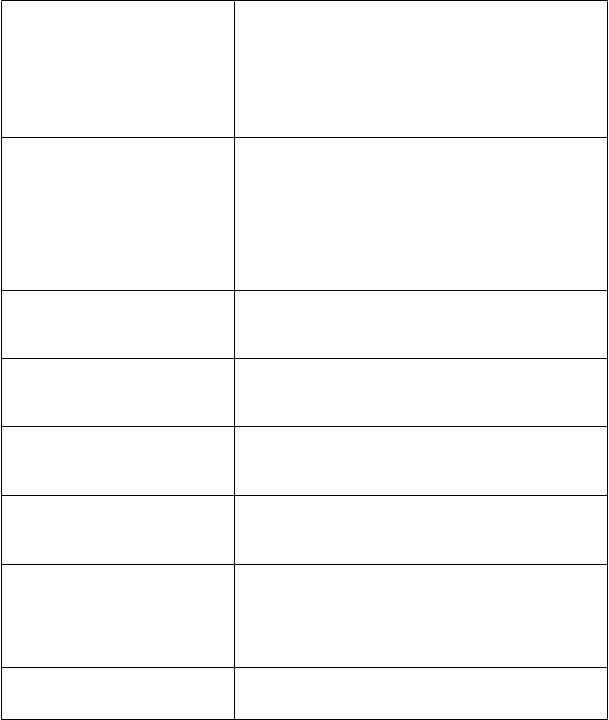
Menej časté: zmeny hladín lieku, zníženie hladiny fosforu v krvi, abnormálna röntgenová snímka hrudníka
* Na základe nežiaducich reakcií pozorovaných pri perorálnej suspenzii, gastrorezistentných tabletách a infúznom koncentráte.
§ Pozri časť 4.4.
Popis vybraných nežiaducich reakciíPoruchy pečene a žlčových ciestPočas sledovania po uvedení posakonazolu vo forme perorálnej suspenzie na trh sa hlásilo závažné
poškodenie pečene s fatálnym následkom (pozri časť 4.4).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie
pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia

na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 Predávkovanie
Neexistujú žiadne skúsenosti s predávkovaním posakonazolom vo forme tabliet.
V klinických skúšaniach sa u pacientov, ktorí dostávali posakonazol vo forme perorálnej suspenzie v dávkach až do 1 600 mg/deň, nevyskytli žiadne iné nežiaduce reakcie ako tie, ktoré sa hlásili
u pacientov dostávajúcich nižšie dávky. Náhodné predávkovanie sa zaznamenalo u jedného pacienta, ktorý užíval 1 200 mg posakonazolu vo forme perorálnej suspenzie dvakrát denne počas 3 dní.
Skúšajúci nepozoroval žiadne nežiaduce reakcie.
Posakonazol sa neodstraňuje hemodialýzou. V prípade predávkovania posakonazolom nie je k
dispozícii žiadna špeciálna liečba. Môže sa zvážiť podporná starostlivosť.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antimykotiká na systémové použitie, triazolové deriváty, ATC kód: J02AC04.
Mechanizmus účinku
Posakonazol inhibuje enzým lanosterol 14α-demetylázu (CYP51), ktorý katalyzuje podstatný krok biosyntézy
ergosterolu.
Mikrobiológia
Preukázalo sa, že posakonazol je in vitro účinný proti nasledujúcim mikroorganizmom: druhy Aspergillus
(Aspergillus fumigatus, A. flavus, A. terreus, A. nidulans, A. niger, A. ustus), druhy Candida (Candida albicans, C. glabrata, C. krusei, C. parapsilosis, C. tropicalis, C. dubliniensis,
C. famata, C. inconspicua, C. lipolytica, C. norvegensis, C. pseudotropicalis), Coccidioides immitis, Fonsecaea pedrosoi a druhy Fusarium, Rhizomucor, Mucor a Rhizopus. Mikrobiologické údaje naznačujú, že posakonazol je účinný proti druhom Rhizomucor, Mucor a Rhizopus; klinické údaje
v súčasnosti sú však príliš obmedzené na to, aby sa dala posúdiť účinnosť posakonazolu proti týmto
vyvolávajúcim druhom.
Rezistencia
Identifikovali sa klinické izoláty so zníženou citlivosťou na posakonazol. Základný mechanizmus rezistencie
je získanie substitúcií v cieľovom proteíne, CYP51.
Epidemiologické kritické (Epidemiological Cut-off, ECOFF) hodnoty pre druhy AspergillusECOFF hodnoty pre posakonazol, ktoré odlišujú populáciu divokého typu od izolátov so získanou rezistenciou, sa určili metódami EUCAST.
EUCAST ECOFF hodnoty:
- Aspergillus flavus: 0,5 mg/l
- Aspergillus fumigatus: 0,25 mg/l
- Aspergillus nidulans: 0,5 mg/l
- Aspergillus niger: 0,5 mg/l
- Aspergillus terreus: 0,25 mg/l
V súčasnosti sú údaje na stanovenie klinických hraničných hodnôt pre druhy Aspergillus nedostatočné.
Hodnoty ECOFF nie sú totožné s klinickými hraničnými hodnotami.
Hraničné hodnoty
Hraničné hodnoty MIC pre posakonazol podľa EUCAST [citlivý (C); rezistentný (R)]:
- Candida albicans: C ≤ 0,06 mg/l, R > 0,06 mg/l
- Candida tropicalis: C ≤ 0,06 mg/l, R > 0,06 mg/l
- Candida parapsilosis: C ≤ 0,06 mg/l, R > 0,06 mg/l
V súčasnosti sú údaje na stanovenie klinických hraničných hodnôt pre iné druhy Candida
nedostatočné.
Kombinácia s inými antimykotickýmiliečivami
Používanie kombinovanej antimykotickej liečby by nemalo znížiť účinnosť posakonazolu ani inej liečby; v
súčasnosti však neexistujú žiadne klinické dôkazy, že kombinovaná liečba poskytuje zvýšený prínos.
Klinická skúsenosť
Súhrn premosťujúcej štúdie posakonazolu vo forme tabliet
Štúdia 5 615 bola nekomparatívna multicentrická štúdia vykonaná na zhodnotenie farmakokinetických
vlastností, bezpečnosti a znášanlivosti posakonazolu vo forme tabliet. Štúdia 5 615 sa vykonala
v podobnej populácii pacientov, ako bola populácia, ktorá sa v minulosti skúmala v rámci pivotného klinického programu s posakonazolom vo forme perorálnej suspenzie. Údaje týkajúce sa farmakokinetiky a bezpečnosti zo štúdie 5 615 sa premostili na existujúce údaje (vrátane údajov týkajúcich sa účinnosti) pri perorálnej suspenzii.
Populácia pacientov zahŕňala: 1) pacientov s AML alebo MDS, ktorí v nedávnej minulosti dostávali chemoterapiu a vyvinula sa u nich alebo sa očakávalo, že sa u nich vyvinie významná neutropénia, alebo 2) pacientov, ktorí podstúpili HSCT a dostávali imunosupresívnu liečbu na predchádzanie alebo liečbu GVHD. Vyhodnocovali sa dve rozdielne skupiny dávkovania: 200 mg dvakrát denne v 1. deň, po ktorých nasledovalo
200 mg jedenkrát denne (časť 1A) a 300 mg dvakrát denne v 1. deň, po ktorých nasledovalo 300 mg jedenkrát
denne (časť 1B a časť 2).
U všetkých osôb v časti 1 a u osôb v podskupine časti 2 sa v 1. deň a v rovnovážnom stave v 8. deň odobrali sériové FK vzorky. Okrem toho, pri väčšej časti populácie pacientov sa v niekoľkých dňoch počas rovnovážneho stavu pred ďalšou dávkou (Cmin) odobrali občasné FK vzorky (sparse sampling). Na základe priemerných koncentrácií Cmin sa mohla vypočítať predpokladaná priemerná koncentrácia (Cav) u 186 osôb, ktorým sa podávala dávka 300 mg. Analýzou FK u pacientov s Cav sa zistilo, že 81 % osôb liečených
300 mg dávkou jedenkrát denne dosiahlo predpokladanú Cav v rovnovážnom stave v rozmedzí 500 – 2 500
ng/ml. Jedna osoba (< 1 %) mala predpokladanú Cav pod 500 ng/ml
a 19 % osôb malo predpokladanú Cav nad 2 500 ng/ml. Priemerná predpokladaná Cav v rovnovážnom stave, ktorú dosiahli pacienti, bola 1 970 ng/ml.
V tabuľke 3 je uvedené porovnanie expozície (Cav) po podaní posakonazolu vo forme tabliet
a posakonazolu vo forme perorálnej suspenzie v terapeutických dávkach u pacientov znázornené ako kvartilová analýza. Expozície po podaní tablety sú vo všeobecnosti vyššie, ale prekrývajúce sa
s expozíciami po podaní posakonazolu vo forme perorálnej suspenzie.
Tabuľka 3. Kvartilové analýzy Cav u pacientov v pivotných štúdiách s posakonazolom vo forme tabliet a perorálnej suspenzie
P
o
s
a
konazol vo forme tabliet
P
o
s
a
konazol vo forme perorálnej suspenzie
P
ro
f
y
l
axia pri AML a HSCT štúdia 5 615
P
ro
f
y
l
axia pri GVHD štúdia 316
P
ro
f
y
l
axia pri neutropénii štúdia 1 899
L
i
ečba - invazívna aspergilóza štúdia 0041
300 mg jedenkrát
denne (300 mg dvakrát denne v 1. deň)*
K
vartil Rozsah pCav
(
n
g
/
m
l)
200 mg
tr
i
k
rát denne
R
ozsah Cav
(
n
g
/
m
l)
200 mg
tr
i
k
rát denne
R
ozsah Cav
(
n
g
/
m
l)
200 mg štyrikrát
denne
(
u hospitalizovaných), potom 400 mg dvakrát denne
R
ozsah Cav
(
n
g
/
m
l)
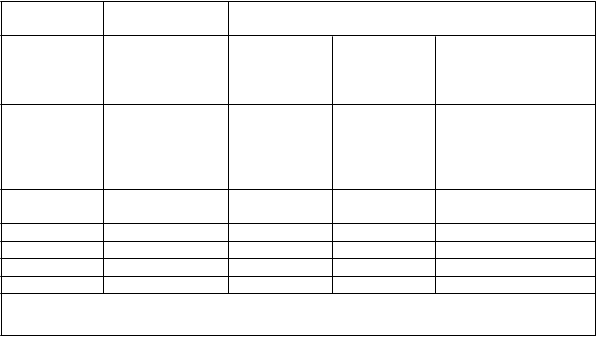 Q
1
Q
1 442–1 223 22–557 90–322 55–277
Q2 1 240–1 710 557–915 322–490 290–544
Q3 1 719–2 291 915–1 563 490–734 550–861
Q4 2 304–9 523 1 563–3 650 734–2 200 877–2 010
pCav: predpokladaná Cav
Cav = priemerná koncentrácia pri meraní v rovnovážnom stave
*20 pacientov dostávalo 200 mg jedenkrát denne (200 mg dvakrát denne v 1. deň)
S
ú
h
r
n štúdií posakonazolu vo forme perorálnej suspenzie
I
n
v
a
z
ívna aspergilóza
V nekomparatívnom skúšaní záchrannej liečby (štúdia 0041) sa hodnotila perorálna suspenzia posakonazolu
800 mg/deň v rozdelených dávkach v liečbe invazívnej aspergilózy u pacientov
s ochorením refraktérnym na amfotericín B (vrátane lipozomálnych formulácií) alebo itrakonazol alebo u pacientov, ktorí tieto lieky neznášali. Klinické výsledky sa porovnávali s výsledkami
z externej kontrolnej skupiny, získanými retrospektívnou revíziou zdravotných záznamov. Externá kontrolná skupina zahŕňala 86 pacientov liečených dostupnou liečbou (ako je uvedené vyššie) väčšinou v rovnakom čase a na rovnakých miestach, ako pacienti liečení posakonazolom. Väčšina prípadov aspergilózy sa považovala za refraktérne voči predchádzajúcej liečbe ako v skupine
s posakonazolom (88 %), tak aj v externej kontrolnej skupine (79 %).
Ako je uvedené v tabuľke 4, úspešná odpoveď (úplná alebo čiastočná) na konci liečby sa pozorovala u 42
% pacientov liečených posakonazolom v porovnaní s 26 % v externej skupine. Toto však nebola prospektívna, randomizovaná, kontrolovaná štúdia, a preto sa na všetky porovnania s externou kontrolnou skupinou treba pozerať obozretne.
Tabuľka 4. Celková účinnosť posakonazolu vo forme perorálnej suspenzie na konci liečby invazívnej
aspergilózy v porovnaní s externou kontrolnou skupinou
Posakonazol vo forme perorálnej suspenzie
Externá kontrolná skupina
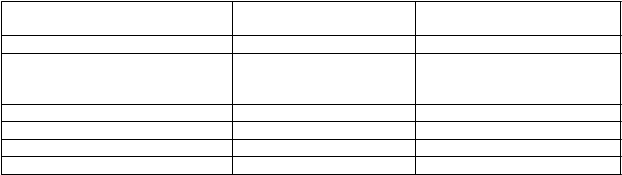
Celková odpoveď 45/107 (42 %) 22/86 (26 %)
Úspešnosť podľa druhuVšetky mykologicky potvrdené
druhy
Aspergillus1 34/76 (45 %) 19/74 (26 %)
A. fumigatus 12/29 (41 %) 12/34 (35 %)
A. flavus 10/19 (53 %) 3/16 (19 %)
A. terreus 4/14 (29 %) 2/13 (15 %)
A. niger 3/5 (60 %) 2/7 (29 %)
1 Zahŕňa iné, menej časté druhy alebo neznáme druhy
Druhy
Fusarium11 z 24 pacientov s dokázanou alebo predpokladanou fuzariózou sa úspešne liečilo posakonazolom vo forme perorálnej suspenzie 800 mg/deň v rozdelených dávkach s mediánom podávania 124 dní a až do 212 dní. Zo skupiny osemnástich pacientov, ktorí neznášali liečbu amfotericínom B alebo itrakonazolom alebo mali infekcie refraktérne na tieto lieky, sa sedem pacientov klasifikovalo ako pacienti odpovedajúci na liečbu.'
Chromoblastomykóza/mycetóm9 z 11 pacientov sa úspešne liečilo posakonazolom vo forme perorálnej suspenzie 800 mg/deň
v rozdelených dávkach s mediánom podávania 268 dní a až do 377 dní. Piati z týchto pacientov mali chromoblastomykózu spôsobenú
Fonsecaea pedrosoi a 4 mali mycetóm, väčšinou spôsobený druhmi
Madurella.Kokcidioidomykóza11 zo 16 pacientov sa úspešne liečilo (na konci liečby úplné alebo čiastočné vymiznutie prejavov
a príznakov prítomných na začiatku liečby) posakonazolom vo forme perorálnej suspenzie 800 mg/deň v rozdelených dávkach s mediánom podávania 296 dní a až do 460 dní.
Profylaxia invazívnych mykotických infekcií (IFI) (štúdie 316 a 1 899)U pacientov s vysokým rizikom vývoja invazívnych mykotických infekcií sa vykonali dve randomizované, kontrolované štúdie profylaxie.
Štúdia 316 bola randomizované, dvojito zaslepené skúšanie posakonazolu vo forme perorálnej suspenzie (200 mg trikrát denne) v porovnaní s flukonazolom vo forme kapsúl (400 mg jedenkrát denne) u príjemcov alogénneho transplantátu hematopoetických kmeňových buniek s reakciou transplantátu proti príjemcovi (graft-versus-host disease, GVHD). Primárnym ukazovateľom účinnosti bola incidencia dokázaných/predpokladaných IFI v 16. týždni po randomizácii stanovená nezávislou, zaslepenou, externou odbornou komisiou. Kľúčovým sekundárnym ukazovateľom bola incidencia dokázaných/predpokladaných
IFI počas obdobia liečby (od prvej dávky po poslednú dávku skúšaného lieku + 7 dní). Väčšina (377/600,
[63 %]) zaradených pacientov mala na začiatku štúdie akútnu GVHD stupňa 2 alebo 3 alebo chronickú extenzívnu GVHD (195/600, [32,5 %]). Priemerné trvanie liečby bolo 80 dní pre posakonazol a 77 dní pre flukonazol.
Štúdia 1 899 bola randomizovaná štúdia so zaslepeným hodnotením posakonazolu vo forme perorálnej suspenzie (200 mg trikrát denne) oproti flukonazolu vo forme suspenzie (400 mg jedenkrát denne) alebo itrakonazolu vo forme perorálneho roztoku (200 mg dvakrát denne) u neutropenických pacientov, ktorí dostávali cytotoxickú chemoterapiu na liečbu akútnej myeloblastovej leukémie alebo myelodysplastických syndrómov. Primárnym ukazovateľom účinnosti bola incidencia dokázaných/predpokladaných IFI stanovená nezávislou, zaslepenou, externou odbornou komisiou počas obdobia liečby. Kľúčovým sekundárnym ukazovateľom bola incidencia dokázaných/predpokladaných IFI 100 dní po randomizácii. Najčastejším základným ochorením bola novodiagnostikovaná akútna myeloblastová leukémia (435/602,
[72 %]). Priemerné trvanie liečby bolo 29 dní pre posakonazol a 25 dní pre flukonazol/itrakonazol.
V oboch štúdiách profylaxie bola najčastejšou prielomovou infekciou aspergilóza. Výsledky z oboch štúdií pozri v tabuľke 5 a 6. Prielomové infekcie spôsobené druhom Aspergillus boli menej časté u pacientov, ktorí dostávali profylaktickú liečbu posakonazolom, v porovnaní s pacientmi v kontrolnej skupine.
Tabuľka 5. Výsledky klinických štúdií profylaxie invazívnych mykotických infekcií
Štúdia Posakonazol vo forme perorálnej suspenzie
K
ontrola
a
H
odnota p
P
odiel (%) pacientov s dokázanou/predpokladanou IFI
O
bdobie počas liečby
b
1 899d 7/304 (2) 25/298 (8) 0,0009
316e 7/291 (2) 22/288 (8) 0,0038
Fixné obdobiec
1 899d 14/304 (5) 33/298 (11) 0,0031
316d 16/301 (5) 27/299 (9) 0,0740
FLU = flukonazol; ITZ = itrakonazol; POS = posakonazol. a: FLU/ITZ (1 899); FLU (316)
b: V štúdii 1 899 to bola doba od randomizácie po poslednú dávku skúšaného lieku plus 7 dní; v štúdii 316 to bola doba od prvej dávky po poslednú dávku skúšaného lieku plus 7 dní.
c: V štúdii 1 899 to bola doba od randomizácie po 100. deň od randomizácie; v štúdii 316 to bola doba od východiskového dňa po 111. deň od východiskového dňa.
d: Všetci randomizovaní pacienti e: Všetci liečení pacienti
T
a
buľka 6. Výsledky klinických štúdií profylaxie invazívnych mykotických infekcií
Štúdia Posakonazol vo forme perorálnej suspenzie
Kontrolaa

 P
odiel (%) pacientov s dokázanou/predpokladanou aspergilózou
O
bdobie počas liečby
b
P
odiel (%) pacientov s dokázanou/predpokladanou aspergilózou
O
bdobie počas liečby
b
1 899
d 2/304 (1) 20/298 (7)
316
e 3/291 (1) 17/288 (6)
Fixné obdobiec1 899
d 4/304 (1) 26/298 (9)
316
d 7/301 (2) 21/299 (7)
FLU = flukonazol; ITZ = itrakonazol; POS = posakonazol. a: FLU/ITZ (1 899); FLU (316)
b: V štúdii 1 899 to bola doba od randomizácie po poslednú dávku skúšaného lieku plus 7 dní; v štúdii 316 to bola doba od prvej dávky po poslednú dávku skúšaného lieku plus 7 dní.
c: V štúdii 1 899 to bola doba od randomizácie po 100. deň od randomizácie; v štúdii 316 to bola doba od východiskového dňa po 111. deň od východiskového dňa.
d: Všetci randomizovaní pacienti e: Všetci liečení pacienti
V štúdii 1 899 sa pozoroval významný pokles úmrtnosti zo všetkých príčin v prospech posakonazolu [POS
49/304 (16 %) oproti FLU/ITZ 67/298 (22 %); p = 0,048]. Na základe odhadov podľa Kaplana- Meiera bola pravdepodobnosť prežívania do 100. dňa od randomizácie významne vyššia u pacientov liečených posakonazolom; toto zlepšenie prežívania sa preukázalo, keď sa do analýzy zahrnuli všetky príčiny smrti (p =
0,0354) ako aj úmrtia súvisiace s IFI (p = 0,0209).
V štúdii 316 bola celková úmrtnosť podobná (POS 25 %; FLU 28 %); podiel úmrtí súvisiacich s IFI bol však významne nižší v skupine s POS (4/301) v porovnaní so skupinou s FLU (12/299;
p = 0,0413).
Pediatrická populácia
Nie sú k dispozícii žiadne skúsenosti s posakonazolom vo forme tabliet v pediatrickej populácii.
Šestnásť pacientov vo veku 8–17 rokov sa liečilo posakonazolom vo forme perorálnej suspenzie
800 mg/deň v štúdii invazívnych mykotických infekcií. Na základe dostupných údajov od 16 z týchto
pediatrických pacientov sa bezpečnostný profil zdá byť podobný ako u pacientov vo veku ≥ 18 rokov.
Navyše, dvanásť pacientov vo veku 13–17 rokov dostávalo posakonazol vo forme perorálnej suspenzie 600 mg/deň ako profylaxiu invazívnych mykotických infekcií (štúdie 316 a 1 899). Bezpečnostný profil u týchto pacientov vo veku < 18 rokov sa zdá byť podobný bezpečnostnému profilu pozorovanému u dospelých. Na základe farmakokinetických údajov získaných od 10 z týchto pediatrických pacientov sa farmakokinetický profil zdá byť podobný ako u pacientov vo veku ≥ 18 rokov.
Bezpečnosť a účinnosť u pediatrických pacientov vo veku menej ako 18 rokov neboli stanovené. Hodnotenie
elektrokardiogramu
Viacnásobné, časovo zodpovedajúce EKG zozbierané počas 12-hodinového obdobia pred podaním posakonazolu vo forme perorálnej suspenzie a v priebehu jeho podávania (400 mg dvakrát denne
s jedlom s vysokým obsahom tuku) sa získali od 173 zdravých dobrovoľníkov, mužov a žien, vo veku od 18 do 85 rokov. Nepozorovali sa žiadne klinicky relevantné zmeny priemerného QTc (Fridericia) intervalu oproti východiskovým meraniam.
5.2 Farmakokinetické vlastnosti
Farmakokinetický/farmakodynamický vzťah
Pozorovala sa korelácia medzi celkovou expozíciou lieku v pomere s MIC (AUC/MIC) a klinickým
výsledkom. U osôb s infekciami spôsobenými druhmi Aspergillus bol kritický pomer ~ 200. Je zvlášť dôležité pokúsiť sa zabezpečiť, aby sa u pacientov infikovaných druhmi Aspergillus dosiahli maximálne plazmatické hladiny (odporúčané dávkovacie režimy, pozri časti 4.2 a 5.2).
Absorpcia
Posakonazol vo forme tabliet sa absorbuje s mediánom Tmax 4 až 5 hodín a po jednorazovom a
opakovanom dávkovaní až do 300 mg vykazuje dávke úmernú farmakokinetiku.
Po podaní tabliet posakonazolu v jednorazovej dávke 300 mg po jedle s vysokým obsahom tuku
u zdravých dobrovoľníkov bola AUC0-72 hodín a Cmax vyššia v porovnaní s podaním nalačno (51 % pre
AUC0-72 hodín a 16 % pre Cmax).
Plazmatické koncentrácie posakonazolu po podaní posakonazolu vo forme tabliet sa môžu
u niektorých pacientov v priebehu času zvýšiť. Príčina tejto časovej závislosti nie je úplne známa.
Distribúcia
Priemerný zdanlivý distribučný objem posakonazolu po podaní tablety je 394 l (42 %), pohybujúci sa v
rozmedzí 294–583 l v rámci štúdií u zdravých dobrovoľníkov.
Posakonazol sa vo vysokej miere viaže na bielkoviny (> 98 %), predovšetkým na sérový albumín. Biotransformácia
Posakonazol nemá žiadne významné cirkulujúce metabolity a nie je pravdepodobné, že by inhibítory
enzýmov CYP450 ovplyvňovali jeho koncentrácie. Z cirkulujúcich metabolitov väčšinu tvoria glukuronidové konjugáty posakonazolu s len malým pozorovaným množstvom oxidačných metabolitov (sprostredkovaných CYP450). Metabolity vylúčené močom a stolicou predstavujú približne 17 % podanej rádioaktívne značenej dávky.
Eliminácia
Posakonazol sa po podaní tabliet eliminuje pomaly s priemerným polčasom (t½) 29 hodín (rozsah 26 až 31
hodín) a s priemerným zdanlivým klírensom v rozmedzí od 7,5 do 11 l/hod. Po podaní 14C- posakonazolu sa
rádioaktívne značená dávka zachytila predovšetkým v stolici (77 % rádioaktívne značenej dávky), pričom
hlavnou zložkou bola materská látka (66 % rádioaktívne značenej dávky).
Vylučovanie obličkami je menej významnou cestou eliminácie, pričom 14 % rádioaktívne značenej dávky sa
vylúčilo do moču (< 0,2 % rádioaktívne značenej dávky je materská látka). Plazmatické koncentrácie rovnovážneho stavu sa dosiahnu v 6. deň pri dávke 300 mg (jedenkrát denne po nárazovej dávke dvakrát denne v 1. deň).
Farmakokinetika v osobitných skupinách pacientov
Deti (< 18 rokov)
Pre posakonazol vo forme tabliet neexistujú žiadne skúsenosti u pediatrických pacientov.
U pediatrických pacientov sa hodnotila farmakokinetika posakonazolu vo forme perorálnej suspenzie. Po podaní posakonazolu vo forme perorálnej suspenzie 800 mg denne v rozdelených dávkach na liečbu invazívnych mykotických infekcií boli priemerné minimálne plazmatické koncentrácie u 12 pacientov vo veku 8–17 rokov (776 ng/ml) podobné koncentráciám u 194 pacientov vo veku 18 – 64 rokov (817 ng/ml). K dispozícii nie sú žiadne farmakokinetické údaje u pediatrických pacientov vo veku menej ako 8 rokov. Podobne v štúdiách profylaxie bola priemerná koncentrácia (average concentration, Cav) posakonazolu v rovnovážnom stave u desiatich dospievajúcich (vo veku 13–17 rokov) porovnateľná s Cav dosiahnutou u dospelých (≥ 18 rokov).
Pohlavie
Farmakokinetika posakonazolu vo forme tabliet je porovnateľná u mužov a žien.
Staršie osoby
Farmakokinetika posakonazolu vo forme tabliet je porovnateľná u mladých a starších osôb. Medzi mladšími a geriatrickými pacientmi sa nepozorovali žiadne celkové rozdiely v bezpečnosti; pre geriatrických pacientov sa preto neodporúča žiadna úprava dávkovania.
Rasa
K dispozícii nie sú dostatočné údaje týkajúce sa posakonazolu vo forme tabliet a rozdielov medzi rasami.
V porovnaní s osobami bielej rasy bol u osôb čiernej rasy mierny pokles (16 %) AUC a Cmax posakonazolu vo forme perorálnej suspenzie. Bezpečnostný profil posakonazolu u osôb čiernej a bielej rasy bol však podobný.
Hmotnosť
Farmakokinetické modelovanie s liekovou formou perorálnych tabliet naznačuje, že u pacientov
s telesnou hmotnosťou viac ako 120 kg môže byť expozícia posakonazolu nižšia. Pacientov s telesnou hmotnosťou viac ako 120 kg sa preto odporúča pozorne sledovať na výskyt prielomových mykotických infekcií.
U pacientov s nízkou telesnou hmotnosťou (< 60 kg), najmä u tých, ktorí dostávajú posakonazol po HSCT, je vyššia pravdepodobnosť výskytu vyšších plazmatických koncentrácií posakonazolu a títo pacienti majú byť pozorne sledovaní na výskyt nežiaducich udalostí.
Porucha funkcie obličiek
Po podaní jednorazovej dávky posakonazolu vo forme perorálnej suspenzie sa nepozoroval žiadny vplyv
miernej a stredne ťažkej poruchy funkcie obličiek (n = 18, Clcr ≥ 20 ml/min/1,73 2 na farmakokinetiku m )
posakonazolu; preto nie je potrebná žiadna úprava dávky. U osôb s ťažkou poruchou funkcie obličiek (n = 6,
Clcr < 20 ml/min/1,73 2 bola AUC posakonazolu veľmi variabilná [CV > 96 % (variačný koeficient)] v m )
porovnaní s inými renálnymi skupinami [CV < 40 %]. Keďže sa však posakonazol významne nevylučuje
obličkami, neočakáva sa vplyv ťažkej poruchy funkcie obličiek na farmakokinetiku posakonazolu a
neodporúča sa žiadna úprava dávky. Posakonazol sa neodstraňuje hemodialýzou.
Podobné odporúčania sa vzťahujú na posakonazol vo forme tabliet; pre posakonazol vo forme tabliet sa však nevykonala špecifická štúdia.
Porucha funkcie pečene
Po podaní jednorazovej perorálnej dávky 400 mg posakonazolu vo forme perorálnej suspenzie pacientom s miernou (Childovo-Pughovo skóre A), stredne ťažkou (Childovo-Pughovo skóre B) alebo ťažkou (Childovo- Pughovo skóre C) poruchou funkcie pečene (skupiny po šiestich pacientoch) bola priemerná AUC 1,3- až 1,6- násobne väčšia v porovnaní s AUC u zodpovedajúcich kontrolných osôb s normálnou funkciou pečene. Koncentrácie neviazaného liečiva sa nestanovili a nemožno vylúčiť, že dochádza k väčšiemu nárastu
expozície neviazanému posakonazolu než pozorovaný 60% nárast celkovej AUC. Polčas eliminácie (t½) sa v príslušných skupinách predĺžil z približne 27 hodín až na ~ 43 hodín. U pacientov s miernou až ťažkou poruchou funkcie pečene sa neodporúča žiadna úprava dávky, potrebná je však opatrnosť z dôvodu možnej vyššej plazmatickej expozície.
Podobné odporúčania sa vzťahujú na posakonazol vo forme tabliet; pre posakonazol vo forme tabliet sa však nevykonala špecifická štúdia.
5.3 Predklinické údaje o bezpečnosti
Rovnako ako pri iných azolových antimykotikách, v štúdiách toxicity po opakovanom podávaní posakonazolu sa pozorovali účinky súvisiace s inhibíciou syntézy steroidných hormónov. Tlmivé účinky na nadobličky sa pozorovali v štúdiách toxicity u potkanov a psov pri rovnakých alebo vyšších expozíciách, ako sa dosahujú po terapeutických dávkach u ľudí.
U psov, ktorým sa podávala po dobu 3 mesiacov dávka vedúca k nižším systémovým expozíciám, ako sa dosahujú po terapeutických dávkach u ľudí, sa objavila neuronálna fosfolipidóza. Tento nález sa nepozoroval u opíc, ktorým sa posakonazol podával jeden rok. V dvanásťmesačných štúdiách neurotoxicity u psov a opíc sa nepozorovali žiadne funkčné účinky na centrálny alebo periférny nervový systém pri systémových expozíciách vyšších, ako sa dosahujú po terapeutických dávkach.
V 2-ročnej štúdii u potkanov sa pozorovala pľúcna fosfolipidóza vedúca k dilatácii a obštrukcii alveol. Tieto nálezy nie sú nevyhnutne ukazovateľom možných funkčných zmien u ľudí.
Vo farmakologickej štúdii bezpečnosti po opakovanom podávaní u opíc pri maximálnych plazmatických koncentráciách 8,5-násobne vyšších, ako sú koncentrácie, ktoré sa dosahujú po terapeutických dávkach u ľudí, sa nepozorovali žiadne účinky na elektrokardiogram, vrátane QT a QTc intervalov. Vo farmakologickej štúdii bezpečnosti po opakovanom podávaní u potkanov pri systémových expozíciách 2,1-násobne vyšších, ako sa dosahujú po terapeutických dávkach, echokardiografia neodhalila žiadny náznak srdcovej dekompenzácie. Zvýšený systolický a arteriálny krvný tlak (až do 29 mmHg) sa pozoroval u potkanov pri systémových expozíciách 2,1-násobne vyšších, ako sa dosahujú po terapeutických dávkach u ľudí, a u opíc pri systémových expozíciách 8,5- násobne vyšších.
Vykonali sa reprodukčné štúdie a štúdie perinatálneho a postnatálneho vývinu u potkanov. Pri expozíciách nižších, ako sa dosahujú po terapeutických dávkach u ľudí, spôsobil posakonazol kostrové zmeny a malformácie, dystokiu, predĺženie gestácie a zníženie priemerného počtu potomkov a postnatálnej životaschopnosti. U králikov bol posakonazol embryotoxický pri expozíciách vyšších, ako sa dosahujú po terapeutických dávkach. Rovnako ako pri iných azolových antimykotikách, sa tieto účinky na reprodukciu považujú za spôsobené účinkom na steroidogenézu, ktorý súvisí s liečbou.
Posakonazol nebol v in vitro a in vivo štúdiách genotoxický. Štúdie karcinogenity neodhalili žiadne osobitné
riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
kopolymér kyseliny metakrylovej a etylakrylátu (1:1)
trietylcitrát (E1505)
xylitol (E967) hydroxypropylcelulóza (E463) propylgalát (E310) mikrokryštalická celulóza (E460) koloidný bezvodý oxid kremičitý sodná soľ kroskarmelózy
sodná soľ stearylfumarátu
Obal tabletyčiastočne hydrolyzovaný polyvinylalkohol
oxid titaničitý (E171)
makrogol mastenec (E553b)
žltý oxid železitý (E172)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaTrojitý (PVC/PE/PVdC) biely nepriehľadný hliníkový blister alebo perforovaný jednodávkový blister v
škatuliach po 24 nebo 96 tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky .
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare S.L.U.
World Trade Center, Moll de Barcelona s/n, Edifici Est, 6a planta, Barcelona,
08039 Barcelona, Španielsko
8. REGISTRAČNÉ ČÍSLAEU/1/19/1379/001-004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.