
>
4.4 Osobitné upozornenia a opatrenia pri používaní
Pacientov treba poučiť, aby sa spojili lekárom:
• pri neočakávanom znížení telesnej hmotnosti, anémii, gastrointestinálnom krvácaní, dysfágii, pretrvávajúcom vracaní alebo vracaní krvi, pretože sa môžu poltačiť príznaky a oneskoriť diagnóza závažného ochorenia. V takomto prípade sa musí vylúčiť malígne ochorenie.
• ak majú v anamnéze žalúdočné vredy alebo sa podrobili gastrointestinálnej operácii.
• ak si nepretržite symptomaticky liečia poruchy trávenia alebo pálenia záhy dlhšie ako 4
týždne.
• pri žltačke, poškodení pečene alebo ochorení pečene.
• pri akomkoľvek závažnom ochorení, ktoré ovplyvňuje celkový pocit zdravia.
• u pacientov starších ako 55 rokov s novo vzniknutými alebo nedávno zmenenými príznakmi.
Pacienti s dlhodobými rekurentnými príznakmi zažívacích ťažkostí a pálenia záhy musia navštevovať svojho lekára v pravidelných intervaloch. Zvlášť pacienti starší ako 55 rokov, ktorí denne užívajú liek ovplyvňujúci zažívacie ťažkosti a pálenie záhy, ktorý nie je na predpis, musia informovať svojho lekárnika alebo lekára.
Pacienti nesmú užívať súbežne žiaden iný inhibítor protónovej pumpy alebo liek zo skupiny
H2 antagonistov.
Pacienti sa musia poradiť so svojím lekárom pred užitím tohto lieku, ak sa majú podrobiť
endoskopickému vyšetreniu alebo absolvovať ureázový dychový test.
Pacientov treba poučiť, že tabletami sa nedosiahne okamžitý ústup problémov. Ústup príznakov môžu pacienti začať pociťovať približne po jednom dni liečby pantoprazolom, ale na dosiahnutie úplnej kontroly pálenia záhy môže byť potrebné užívať liek 7 dní. Pacienti nesmú užívať pantoprazol ako preventívny liek.
Zníženie kyslosti žalúdka akýmkoľvek spôsobom – vrátane inhibítorov protónovej pumpy – zvyšuje počet batérií, ktoré sú normálne prítomné v gastrointestinálnom trakte. Liečba liekmi, ktoré znižujú kyslosť, vedie k mierne zvýšenému riziku gastrointestinálnych infekcií, ako sú infekcie spôsobené Salmonellou, Campylobacterom alebo C. diffcile.
4.5 Liekové a iné interakcie
PANTOZOL Control môže znížiť absorpciu liečiv, ktorých biologická dostupnosť závisí od pH v žalúdku (napr. ketokonazol).
Preukázalo sa, že súbežné podanie 300 mg atazanaviru/100 mg ritonaviru s omeprazolom (40 mg 1x denne) alebo 400 mg atazanaviru s lanzoprazolom (60 mg jednorázová dávka) zdravým dobrovoľníkom malo za následok významné zníženie biologickej dostupnosti atazanaviru. Absorpcia atazanaviru je závislá od pH. Pantoprazol sa preto nesmie podávať súbežne s atazanavirom (pozri časť 4.3).
Pantoprazol sa metabolizuje v pečeni enzýmovým systémom cytochrómu P450. Interakciu pantoprazolu s inými látkami, ktoré sa metabolizujú tým istým enzýmovým systémom nie je možné vylúčiť. V cielených testoch s karbamazepínom, kofeínom, diazepamom, diklofenakom, digoxínom, etanolom, glibenklamidom, metoprololom, naproxenom, nifedipínom, fenytoínom, piroxikamom, teofylínom a perorálnymi kontraceptívami obsahujúcimi levonorgestrel a etinylestradiol, sa však nezistili žiadne klinicky významné interakcie.
Aj keď sa v klinických farmakokinetických štúdiách nepozorovali interakcie pri súbežnom podávaní fenoprokumónu alebo warfarínu, v postmarketingovom období sa v ojedinelých prípadoch zaznamenali zmeny v International Normalised Ratio (INR). Na základe toho sa odporúča u pacientov, ktorí dostávajú liečbu antikoagulanciami kumarínového typu (fenoprokumon alebo warfarín), sledovať protrombínový čas /INR po začatí, ukončení liečby, alebo pri nepravidelnom užívaní pantoprazolu.
Pri súbežnom podávaní antacíd nedochádza k žiadnym interakciám.
4.6 Gravidita a laktácia
Gravidita
Nie sú k dispozícii dostatočné údaje o použití pantoprazolu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu. V predklnických štúdiách sa nezískal žiaden dôkaz o poškodení fertility alebo teratogénnych účinkoch (pozri 5.3). Nie je známe potenciálne riziko u ľudí. Tento liek sa nesmie používať počas gravidity.
Laktácia
Nie je známe, či sa pantoprazol vylučuje do materského mlieka u ľudí. V štúdiách na zvieratách sa preukázalo vylučovanie pantoprazolu do materského mlieka. Tento liek sa nesmie používať počas laktácie.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Môžu sa vyskytnúť nežiaduce účinky ako závraty a poruchy videnia (pozri časť 4.8). Títo pacienti nesmú viesť vozidlá ani obsluhovať stroje.
4.8 Nežiaduce účinky
Približne u 5 % pacientov sa môžu vyskytnúť nežiaduce účinky. Väčšina bežne zaznamenaných nežiaducich účinkov je hnačka, bolesť hlavy, obidva sa vyskytujú približne u 1 % pacientov. Počas liečby pantoprazolom sa zaznamenali nasledujúce nežiaduce účinky.
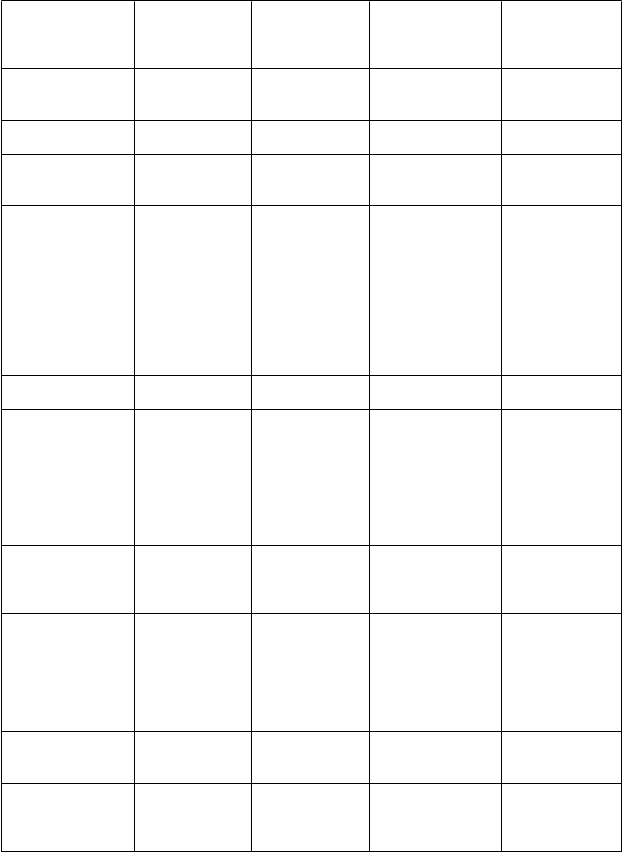
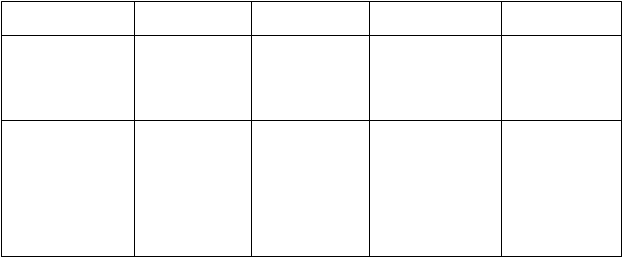
V nasledujúcej tabuľke sú nežiaduce účinky usporiadané podľa nasledujúcej klasifikácie frekvencie výskytu:
Veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1,000 až ≤1/100); zriedkavé
(≥1/10,000 až ≤1/1,000); veľmi zriedkavé (≤1/10,000), neznáme (z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti
Tab
uľka1. Nežiaduce účinky pantoprazolu z klinických štúdií a postmarketingových skúseností
Frekvencia
Orgánový systém Poruchy krvi
a lymfatického
systému
Poruchy nervového systému
Menej časté Zriedkavé Veľmi zriedkavé Neznáme
trombocytopénia;
leukopénia
bolesť hlavy;
závraty
Poruchy oka poruchy videnia/ rozmazané videnie
Poruchy gastrointestinálneho traktu
Poruchy obličiek a močových ciest Poruchy kože
a podkožného
tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového
tkaniva Poruchy metabolizmu a výživy
Celkové poruchy
a reakcie v mieste podania
Poruchy imunitného systému
hnačka; nauzea/vracanie; abdominálna distenzia
a nadúvanie;
zápcha;
sucho v ústach; abdominálna bolesť a diskomfort
vyrážka, exantém, erupcie; pruritus
asténia, únava, malátnosť
žihľavka;
angioedém
bolesť kĺbov;
bolesť svalov
hyperlipidémia a zvýšenie lipidov (triglyceridy, cholesterol); zmeny telesnej hmotnosti zvýšenie telesnej teploty;
periférny edém
precitlivenosť (vrátane anafylaktickej reakcie a
intersticiálna nefritída Stevensov- Johnsonov syndróm; Leyellov syndróm; multiformný erytém; fotosenzitivita
hyponatrémia
Poruchy pečene a žlčových ciest
zvýšenie pečeňových enzýmov (transamináz, γ-GT)
anafylaktického šoku)
zvýšenie bilirubínu
hepatocelulárne poškodenie; žltačka; hepatocelulárne zlyhanie
Psychické poruchy poruchy spánku depresie (a všetky druhy zhoršenia)
dezorientácia (a všetky druhy zhoršenia)
Halucinácie; zmätenosť (zvlášť
u predisponovaný ch pacientov ale
aj zhoršenie týchto príznakov ak už existovali)
 4.9 Predávkovanie
4.9 Predávkovanie
Príznaky predávkovania u ľudí nie sú známe.
Dávky až do 240 mg aplikované i. v. dlhšie ako 2 minúty boli dobre tolerované. Pantoprazol sa vo veľkej miere viaže na bielkovimy, preto nie je ľahko dialyzovateľný.
Pri predávkovaní s klinickými príznakmi intoxikácie sa postupuje spôsobom obvyklým pri liečbe intoxikácií, nie sú odporučené žiadne špecifické terapeutické postupy.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Inhibítory protónovej pumpy
ATC kód: A02BC02
Mechanizmus účinkuPantoprazol je substituovaný benzimidazol, ktorý v žalúdku inhibuje sekréciu kyseliny chlorovodíkovej špecifickým blokovaním protónovej pumpy parietálnych buniek.
Pantoprazol sa konvertuje na aktívnu formu, cyklický sulfenamid, v kyslom prostredí parietálnych buniek, kde inhibuje enzým H+, K+-ATP-ázu, t. j posledný stupeň produkcie kyseliny chlorovodíkovej v žalúdku.
Inhibícia závisí od dávky a pôsobí na bazálnu aj stimulovanú sekréciu. U väčšiny pacientov pálenie záhy a príznaky refluxu vymiznú do 1 týždňa. Pantoprazol znižuje kyslosť v žalúdku, dôsledkom čoho sa úmerne k znižovaniu kyslosti zvyšuje gastrín. Zvýšenie gastrínu je
reverzibilné. Pretože pantoprazol sa viaže na enzým distálne k úrovni bunkového receptora,
môže inhibovať sekréciu kyseliny chlorovodíkovej nezávisle od stimulácie inými látkami (acetylcholín, histamín, gastrín). Účinok je rovnaký pri podávaní lieku perorálne alebo intravenózne.
Hladiny gastrínu na lačno sa po aplikácii pantoprazolu zvyšujú. Pri krátkodobom užívaní väčšinou neprekračujú normálnu hornú hranicu. Počas dlhodobej liečby sa hladina gastrínu väčšinou zdvojnásobuje. Nadmerné zvýšenie sa však vyskytuje iba v ojedinelých prípadoch. Dôsledkom toho možno zaznamenať mierne až stredné zvýšenie počtu špecifických endokrinných buniek (ECL) v žalúdku u menšieho počtu pacientov počas dlhodobej liečby (jednoduchá adenomatoidná hyperplázia). Avšak podľa doteraz vykonaných dlhodobých
štúdií sa tvorba karcinoidných prekurzorov (atypická hyperplázia) alebo gastrických karcinoidov, ktoré sú popísané v štúdiách na zvieratách sa u ľudí nezistila (časť 5.3).
Klinická účinnosť
V retrospoektívnej analýze 17 štúdií s 5960 pacientmi s gastro-ezofageálnou refluxnou
chorobou (GORD), ktorí boli liečení 20 mg pantoprazolu v monoterapii, sa hodnotili symptómy spojené s refluxom kyseliny napr. pálenie záhy a regurgitácia kyseliny štandardizovanou metodikou. Vo vybraných štúdiách musel byť zaznamenaný aspoň jeden symptóm refluxu kyseliny počas 2 týždňov. V týchto štúdiách sa GORD diagnostikoval na základe endoskopického vyšetrenia s výnimkou jednej štúdie, ktorej sa zúčastnili pacienti len na základe symptomatológie.
V týchto štúdiách bolo percento pacientov s úplným ústupom pálenia záhy v patoprazolovej skupine medzi 54,0 % až 80,6 % po 7 dňoch. Po 14 a 28 dňoch sa úplný ústup pálenia záhy zaznamenal u 62,9 % až 88,6 %, resp. 68,1 % až 92,3 % pacientov.
Podobne ako pri pálení záhy, úplný ústup symptómov sa dosiahol aj pri regurgitácii kyseliny. Po 7 dňoch bolo percento pacientov s úplným ústupom regurgitácie kyseliny medzi 61,5 % až
84,4 %, po 14 dňoch medzi 67,7 % až 90,4 % a po 28 dňoch medzi 75,2 %až 94,5 %.
Preukázalo sa, že pantoprazol je jednoznačne účinnejší v porovnaní s placebom a s H2RA a nebol horší ako iné PPI. Miera ústupu symptómov refluxu kyseliny väčšinou nezávisela od pôvodného štádia GORD-u.
5.2 Farmakokinetické vlastnosti
Farmakokinetika sa nemení po jednorazovom alebo opakovanom podaní. Pri rozpätí dávky od
10 do 80 mg zostáva kinetika pantoprazolu v plazme lineárna po perorálnom aj po intravenóznom podaní.'
Absorpcia
Pantoprazol sa po perorálnom podaní úplne a rýchlo absorbuje. Preukázalo sa, že absolútna biologická dostupnosť z tablety je približne 77 %. Priemerne po 2 – 2,5 hodinách po podaní (tmax) jednej perorálnej dávky 20 mg sa dosiahla maximálna koncentrácia v sére (Cmax) približne 1-1,5 μg/ml a tieto hodnoty zostávali konštantné aj po opakovanom podaní. Súbežný príjem potravy nemal vplyv na biologickú dostupnosť (AUC or Cmax), ale zvyšoval variabilitu lag-time (tlag).
Distribúcia
Distribučný objem je okolo 0,15 l/kg a väzba na bielkoviny v sére je približne 98 %.
Metabolizmus a vylučovanie
Klírens je približne 0,1 l/h/kg telesnej hmotnosti a terminálny polčas (t ½) je približne 1 hod. Popísaných je niekoľko prípadov subjektov s oneskorenou elimináciou. Vzhľadom na špecifickú väzbu pantoprazolu na protónovú pumpu parietálnych buniek, polčas jeho eliminácie nie je v korelácii s dlhším trvaním účinku (inhibícia sekrécie kyseliny).
Pantoprazol sa takmer úplne metabolizuje v pečeni. Hlavnou cestou vylučovania metabolitov pantoprazolu sú obličky (okolo 80 %); zvyšok sa vylúči stolicou. Hlavným metabolitom
v sére aj v moči je desmetylpantoprazol konjugovaný so síranom. Polčas vylučovania hlavného metabolitu (približne 1,5 h) nie je oveľa dlhší ako u pantoprazolu.
Osobitné skupiny pacientov
Poškodenie obličiek
U pacientov so zníženou funkciou obličiek nie je potrebné zníženie dávkovania (vrátane dialyzovaných pacientov, dialýza odstráni len zanedbateľné množstvo pantoprazolu). Rovnako ako u zdravých pacientov je polčas pantoprazolu krátky. Hoci má hlavný metabolit dlhší polčas (2-3 hod), vylučovanie je stále rýchle, preto nedochádza ku kumulácii.
Poškodenie pečene
Po podaní pantoprazolu pacientom s poškodenou pečeňou (triedy A, B a C podľa Childa- Pugha) sa polčas zvyšuje v rozmedzí 3 až 7 hodín a hodnoty AUC sa zvyšujú faktorom 3 – 6, ale Cmax sa zvýši iba nepatrne faktorom 1,3 v porovnaní so zdravými jedincami.
Starší
Mierne zvýšenie AUC a Cmax u starších dobrovoľníkov v porovnaní s mladšími nie je klinicky významné.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxixity po opakovanom podaní a genotoxicity neodhalili žiadne osobitné riziko pre ľudí.
V 2-ročných štúdiách karcinogenity na potkanoch sa zistili neuroendokrinologické neoplazmy. Okrem toho boli v jednej štúdii u potkanov zaznamenané skvamózne bunkové papilómy v oblasti ústia pažeráka. Po dôkladnom preskúmaní mechanizmu vedúcemu
k tvorbe gastrických karcinoidov pri substitúcii benzimidazolmi sa prišlo k záveru,
že sa jedná o sekundárnu reakciu na veľmi vysoké zvýšenie hladín gastrínu v sére, ktoré sa vyskytovali u potkanov počas dlhodobej liečby vysokými dávkami.
V 2-ročných štúdiách na hlodavcoch sa pozoroval zvýšený počet nádorov pečene u potkanov (iba v jednej štúdii na potkanoch) a u myších samičiek, čo sa interpretovalo ako dôsledok vysokej rýchlosti metabolizmu pantoprazolu v pečeni. Mierne zvýšenie neoplastických zmien štítnej žľazy sa zaznamenalo v skupine potkanov, ktorí dostávali najvyššie dávky (200 mg/kg telesnej hmotnosti) v jednej 2-ročnej štúdii. Výskyt týchto neoplaziem súvisí so zmenami
pri odbúravaní tyroxínu v pečeni potkanov, ktoré vyvolal pantoprazol. Vzhľadom na to, že terapeutická dávka u človeka je nízka, neočakávajú sa žiadne vedľajšie účinky na štítnu žľazu.
V štúdiách na zvieratách (potkany) s dávkou 5mg/kg telesnej hmotnosti sa nepozorovali žiadne známky embryotoxicity (NOAEL, No Observed Adverse Effect Level). Štúdie nepreukázali dôkaz o poškodení plodnosti alebo o teratogénych účinkoch. U potkanov sa skúmala penetrácia pantoprazolu placentou, pričom sa zistilo, že sa zvyšuje pri pokročilej gestácii. V dôsledku toho je koncentrácia pantoprazolu v plode krátko pred pôrodom zvýšená.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro
Bezvodý uhličitan sodný Manitol (E421) Krospovidón
Povidón K90
Kalcium stearát
Obal
Hypromelóza
Povidón K25
Oxid titaničitý (E171) Žltý oxid železitý (E172) Propylénglykol
Kopolymér kyseliny metakrylovej a etylakrylátu (1:1) Laurylsulfát sodný
Polysorbát 80
Trietyl citrát
Potlačový atrament
Šelak
Červený oxid železitý (E172) Čierny oxid železitý (E172) Žltý oxid železitý (E172) Sójový lecitín
Oxid titaničitý (E171) Protipenivá emulzia DC 1510
6.2 Inkompatibility
Neaplikovateľné
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávať v pôvodnom balení na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
Alu/Alu blistre s obahom 7 alebo 14 gastrorezistentných tabliet alebo
Alu/Alu blistre v spevnenom obale s obahom 7 alebo 14 gastrorezistentných tabliet
Nie všetky veľkosti balenia musia byť uvedené na trh.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Nycomed GmbH Byk-Gulden-Str. 2
D-78467 Konstanz
Nemecko
tel: +49-(0)7531-84-0
fax: +49-(0)7531-84-2474
8. REGISTRAČNÉ ČÍSLO
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry (EMEA)
http://www.emea.europa.eu/.>