
ie a dohľad.
K dispozícii nie sú žiadne údaje týkajúce sa Pandemic influenza vaccine H5N1 MedImmune u detí
a dospievajúcich mladších ako 18 rokov liečených salicylátmi. V prípade pandémie majú lekári zvážiť možné riziká a možné prínosy podania očkovacej látky z dôvodu súvislosti salicylátov a infekcie divým typom vírusu chrípky s Reyeovým syndrómom (pozri časť 4.5).
Imunitná odpoveď u pacientov s endogénnou alebo iatrogénnou imunosupresiou môže byť nedostatočná.
K dispozícii nie sú žiadne údaje u osôb s významnou klinickou imunodeficienciou. V prípade pandémie majú lekári zvážiť možné prínosy, alternatívy a riziká podania očkovacej látky deťom a dospievajúcim s významnou klinickou imunodeficienciou z dôvodu ochorení alebo
imunosupresívnej liečby ako sú: akútna a chronická leukémia, lymfóm, symptomatická infekcia HIV, nedostatočná bunková imunita a vysoké dávky kortikosteroidov.
Bezpečnosť sezónnej živej atenuovanej očkovacej látky proti chrípke (LAIV) u detí s ťažkou astmou a aktívnym sipotom sa primerane neskúmala. Lekári majú zvážiť prínosy a možné riziká podania Pandemic influenza vaccine H5N1 MedImmune týmto osobám.
V štúdii so sezónnou trivalentnou živou atenuovanou očkovacou látkou proti chrípke (T/LAIV) sa pozoroval zvýšený výskyt medicínsky významného sipotu u detí vo veku 12-23 mesiacov (pozri časť
4.8).
Osoby dostávajúce očkovaciu látku majú byť informované, že Pandemic influenza vaccine H5N1
MedImmune je atenuovaná živá vírusová očkovacia látka s možnosťou nákazy pri kontakte
s imunokompromitovanými osobami. Osoby dostávajúce očkovaciu látku sa majú 1 – 2 týždne po očkovaní, vždy keď je to možné, vyhýbať blízkemu kontaktu s ťažko imunokompromitovanými
osobami (napr. osobami po transplantácii kostnej drene vyžadujúcimi izoláciu). Nákazlivosť vírusom
H5N1 očkovacej látky u dospelých bola výrazne obmedzená. V klinickýh štúdiách s Pandemic influenza vaccine H5N1 MedImmune bol najvyšší výskyt zotavenia sa z vírusu očkovacej látky zaznamenaný 1 – 2 dni po vakcinácii. V podmienkach, keď kontaktu s ťažko imunokompromitovanými osobami nemožno zabrániť, sa má zvážiť možné riziko prenosu vírusu očkovacej látky proti chrípke oproti riziku nákazy a prenosu divého typu vírusu chrípky.
Osoby dostávajúce očkovaciu látku liečené antivirotikami proti chrípke nemajú dostať Pandemic influenza vaccine H5N1 MedImmune skôr, ako 48 hodín po ukončení antivirotickej liečby proti chrípke.
K dispozícii nie sú žiadne údaje týkajúce sa bezpečnosti intranazálneho podávania Pandemic influenza vaccine H5N1 MedImmune u detí s nekorigovanými kraniofaciálnymi malformáciami.
4.5 Liekové a iné interakcie
Je potrebné sa vyhnúť podávaniu Pandemic influenza vaccine H5N1 MedImmune u detí
a dospievajúcich mladších ako 18 rokov podstupujúcich liečbu salicylátmi (pozri časť 4.4). Je potrebné sa vyhnúť použitiu salicylátov u detí a dospievajúcich po dobu 4 týždňov po očkovaní,
pokiaľ nie sú lekársky indikované, pretože po použití salicylátov počas infekcie divým typom chrípky sa hlásil Reyeov syndróm.
Súbežné podávanie Pandemic influenza vaccine H5N1 MedImmune s inaktivovanými očkovacími látkami alebo sezónnou očkovacou látkou Fluenz Tetra sa neskúmalo.
K dispozícii sú údaje týkajúce sa súbežného podávania sezónnej trivalentnej živej intranazálnej očkovacej látky proti chrípke (T/LAIV) so živými atenuovanými očkovacími látkami (očkovacia látka proti osýpkam, mumpsu a ružienke (MMR); očkovacia látka proti ovčím kiahňam a perorálne podávaná očkovacia látka proti poliovírusu), ktoré naznačujú, že súbežné podávanie Pandemic influenza vaccine H5N1 MedImmune s týmito živými vakcínami je prípustné.
Na základe možnosti zníženia účinnosti Pandemic influenza vaccine H5N1 MedImmune vplyvom antivirotík proti chrípke sa odporúča nepodávať očkovaciu látku skôr, ako 48 hodín po ukončení antivirotickej liečby proti chrípke. Podávanie antivirotík proti chrípke v priebehu dvoch týždňov po očkovaní môže ovplyvniť odpoveď na očkovaciu látku.
Pri súbežnom podávaní antivirotík proti chrípke a Pandemic influenza vaccine H5N1 MedImmune sa má na základe klinického posúdenia zvážiť časový rámec a potreba opätovného očkovania.
4.6 Fertilita, gravidita a laktácia
Gravidita
K dispozícii nie sú žiadne údaje o použití Pandemic influenza vaccine H5N1 MedImmune u gravidných žien.
K dispozícii je obmedzené množstvo údajov o použití T/LAIV a sezónnej očkovacej látky Fluenz Tetra u gravidných žien. Neexistujú žiadne dôkazy o významných nežiaducich účinkoch u 138 gravidných žien, ktoré mali v databáze platiteľov zdravotnej starostlivosti v USA záznam o podaní sezónnej očkovacej látky T/LAIV. V 27 prípadoch podania T/LAIV gravidným ženám zo systému hlásenia nežiaducich udalostí po podaní očkovacích látok v USA (VAERS) sa nezaznamenali žiadne nezvyčajné typy komplikácií gravidity alebo účinky na plod. Na základe VAERS sa podobne v 113 prípadoch podania intranazálnej monovalentnej živej očkovacej látky (H1N1) spoločnosti
MedImmune z roku 2009 gravidným ženám nezaznamenali žiadne nezvyčajné typy komplikácií gravidity alebo účinky na plod.
Štúdie vývinovej toxicity u zvierat vykonané s T/LAIV a Fluenzom Tetra nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity. Údaje o náhodnom neúmyselnom podaní sezónnych očkovacích látok počas gestácie z obdobia po uvedení očkovacej látky na trh ponúkajú určité uistenie.
Lekári majú zvážiť prínos a možné riziká podania Pandemic influenza vaccine H5N1 MedImmune gravidným ženám.
Dojčenie
Nie je známe, či sa Pandemic influenza vaccine H5N1 MedImmune vylučuje do ľudského mlieka. Keďže niektoré vírusy sa vylučujú do ľudského mlieka, očkovacia látka sa nemá používať počas
dojčenia.
Fertilita
Neexistujú žiadne údaje týkajúce sa možných účinkov Pandemic influenza vaccine H5N1
MedImmune na fertilitu u mužov a žien.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Pandemic influenza vaccine H5N1 MedImmune nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Hodnotenie bezpečnostného profilu Pandemic influenza vaccine H5N1 MedImmune je založené na obmedzenom počte dospelých osôb.
V klinických štúdiách bol bezpečnostný profil Pandemic influenza vaccine H5N1 MedImmune porovnateľný s bezpečnostným profilom sezónnych očkovacích látok T/LAIV a Fluenzu Tetra (pre viac informácií, pozri časť 5.1).
Klinické štúdie hodnotili výskyt nežiaducich reakcií u 59 dospelých vo veku 18 až 49 rokov, ktorí dostali aspoň jednu dávku Pandemic influenza vaccine H5N1 MedImmune. Ďalšie údaje pochádzajú od 289 dospelých zaradených v štúdiách kandidátov na očkovacie látky s ďalšími 7 podtypmi chrípky a od 240 dospelých a 259 detí zaradených v štúdiách monovalentnej pandemickej očkovacej látky H1N1 z roku 2009.
Najčastejšími nežiaducimi reakciami pozorovanými v klinických štúdiách vykonaných s Pandemic influenza vaccine H5N1 MedImmune u zdravých dospelých boli bolesť hlavy (25,4 %) a infekcia horných dýchacích ciest (10,2 %).
Pediatrická populácia
Zoznamnežiaducichreakcií
V klinických štúdiách a sledovaní po uvedení očkovacej látky T/LAIV a Fluenz Tetra na trh sa u viac ako 110 000 detí a dospievajúcich vo veku 2 až 17 rokov hlásili nasledovné frekvencie výskytu
nežiaducich reakcií:
veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10),
menej časté (≥ 1/1 000 až < 1/100),
zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000).
Poruchy imunitného systému
Menej časté: reakcie z precitlivenosti (vrátane opuchu tváre, žihľavky a veľmi zriedkavých anafylaktických reakcií).
Poruchy metabolizmu a výživy
Veľmi časté: znížená chuť do jedla.
Poruchy nervového systému
Veľmi časté: bolesť hlavy.
Poruchy dýchacej sústavy, hrudníka a mediastína
Veľmi časté: upchatý nos/rinorea. Menej časté: krvácanie z nosa.
Poruchy kože a podkožného tkaniva
Menej časté: vyrážka.
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté: bolesť svalov.
Celkové poruchy a reakcie v mieste podania Veľmi časté: celkový pocit nevoľnosti. Časté: horúčka.
Popis vybranýchnežiaducichreakcií
Deti vo veku menej ako 12 mesiacov
Pandemic influenza vaccine H5N1 MedImmune nie je indikovaná na použitie u dojčiat mladších ako
12 mesiacov (pozri časť 4.2). Bezpečnosť a účinnosť očkovacej látky v tejto populácii neboli stanovené. K dispozícii nie sú žiadne údaje.
V aktívne kontrolovanej klinickej štúdii (MI-CP111) vykonanej s T/LAIV v porovanní s injekčnou trivalentnou očkovacou látkou proti chrípke sa počas 180 dní po podaní poslednej dávky očkovacej
látky pozoroval zvýšený počet hospitalizácií (z rôznych príčin) u dojčiat vo veku 6 – 11 mesiacov (6,1 %
pri T/LAIV oproti 2,6 % pri použití injekčnej očkovacej látky proti chrípke). Dôvodom väčšiny hospitalizácií boli infekcie gastrointestinálneho a dýchacieho traktu a vyskytovali sa viac ako 6
týždňov po očkovaní. Počet hospitalizácií u osôb vo veku 12 mesiacov a starších dostávajúcich
T/LAIV nebol zvýšený a miery výskytu u dojčiat a batoliat vo veku 12 – 23 mesiacov boli 3,2 % pri
T/LAIV oproti 3,5 % pri injekčnej očkovacej látke proti chrípke.
Sipot u detí mladších ako 24 mesiacov
V rovnakej štúdii sa počas 42 dní pozoroval zvýšený výskyt sipotu u dojčiat a batoliat vo veku 6 – 23
mesiacov (5,9 % pri T/LAIV oproti 3,8 % pri injekčnej očkovacej látke proti chrípke). Príslušné miery výskytu u dojčiat a batoliat vo veku 12 – 23 mesiacov boli 5,4 % pri T/LAIV oproti 3,6 % pri
injekčnej očkovacej látke proti chrípke. Celkovo 20 osôb (12 pri T/LAIV, 0,3 %; 8 pri injekčnej
očkovacej látke proti chrípke, 0,2 %) bolo hospitalizovaných v súvislosti so zdravotne významným sipotom. Tieto udalosti neviedli k smrti a žiadne z hospitalizovaných detí nevyžadovalo mechanickú ventiláciu alebo príjem na jednotke intenzívnej starostlivosti.Výskyt sipotu nebol zvýšený u osôb vo veku 24 mesiacov a starších dostávajúcich T/LAIV.
Chronické ochorenia
Napriek tomu, že bezpečnosť T/LAIV sa potvrdila u detí a dospievajúcich s miernou až stredne ťažkou astmou, údaje u detí s inými pľúcnymi ochoreniami alebo s chronickými kardiovaskulárnymi,
metabolickými alebo renálnymi ochoreniami sú obmedzené.
V štúdii (D153-P515) u detí vo veku 6 až 17 rokov s astmou (sezónna T/LAIV: n = 1 114, sezónna injekčná očkovacia látka proti chrípke: n = 1 115) sa medzi liečebnými skupinami nepozorovali žiadne
významné rozdiely vo výskyte exacerbácií astmy, priemernej vrcholovej výdychovej rýchlosti, skóre príznakov astmy alebo skóre nočného budenia sa. Výskyt sipotu v priebehu 15 dní po očkovaní bol nižší u osôb dostávajúcich T/LAIV v porovnaní s osobami dostávajúcimi sezónnu inaktivovanú očkovaciu látku (19,5 % oproti 23,8 %, P = 0,02).
V štúdii (AV010) u detí a dospievajúcich vo veku 9 až 17 rokov so stredne ťažkou až ťažkou astmou (sezónna T/LAIV: n = 24, placebo: n = 24) sa primárne bezpečnostné kritérium, percentuálna zmena predpokladaného úsilného expiračného objemu vydýchnutého za 1 sekundu (FEV1) meraná pred a po očkovaní, nelíšilo medzi liečebnými skupinami.
Ďalšie špeciálnepopulácie:Imunokompromitované osobyCelkovo bol bezpečnostný profil T/LAIV u obmedzeného počtu osôb s mierne až stredne ťažko oslabenou funkciou imunitného systému nesúvisiacou s HIV, asymptomatickou alebo mierne symptomatickou infekciou HIV alebo s rakovinou (solídne nádory a hematologické malignity) porovnateľný profilu u zdravých osôb a nenaznačuje žiadny nežiaduci účinok. K dispozícii nie sú žiadne údaje u osôb s ťažkou imunosupresiou (pozri časť 4.4). V prípade pandémie možno použitie Pandemic influenza vaccine H5N1 MedImmune zvážiť u osôb s miernou až stredne ťažkou imunosupresiou po zvážení očakávaných prínosov oproti možným rizikám pre konkrétnu osobu.
Skúsenosti so sezónnou T/LAIV po uvedení očkovacej látky na trhPozorovali sa tiež veľmi zriedkavé hlásenia Guillainovho-Barrého syndrómu a exacerbácií príznakov
Leighovho syndrómu (mitochondriálna encefalopatia).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovaniePo uvedení očkovacej látky na trh sa hlásili podania dvojnásobného množstva odporúčanej dávky sezónnej očkovacej látky Fluenz Tetra a sezónnej trivalentnej živej intranazálnej očkovacej látky proti chrípke (T/LAIV). Hlásené nežiaduce reakcie boli podobné tým, ktoré sa pozorovali pri odporúčanej jednorazovej dávke T/LAIV a Fluenzu Tetra.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: očkovacie látky proti chrípke, živé atenuované; ATC kód: J07BB03
Kmeň vírusu chrípky v Pandemic influenza vaccine H5N1 MedImmune je (a)
prispôsobený chladu (cold-adapted, ca); (b)
citlivý na teplotu (temperature-sensitive, ts) a (c)
atenuovaný (attenuated, att). Pre navodenie ochrannej imunity musí vírus infikovať a množiť sa v bunkách sliznice nosohltana osoby dostávajúcej vakcínu.
KlinickéštúdieTáto časť popisuje klinické skúsenosti pozorované v troch pivotných štúdiách vykonaných
u dospelých s Pandemic influenza vaccine H5N1 MedImmune. Za relevantné sa navyše považujú aj štúdie vykonané s očkovacou látkou LAIV proti pandémii H1N1 spoločnosti MedImmune z roku 2009 a sezónnou očkovacou látkou T/LAIV, pretože všetky tieto očkovacie látky sú vyrábané rovnakým postupom, podávané rovnakou cestou a skúmané predovšetkým u predtým neočkovaných osôb.
Pediatrické štúdie
O
čkovacia látkaLAIV protipandémii H1N1udetívoveku2až17rokov
V klinickej štúdii MI-CP217 sa bezpečnosť a deskriptívna imunogenita živej atenuovanej
monovalentnej očkovacej látky proti vírusu chrípky (odvodená z kmeňa A/Kalifornia/7/2009) vyvinutej pre pandémiu H1N1 z roku 2009 hodnotili u celkovo 326 randomizovaných osôb (259 osôb s monovalentnou očkovacou látkou; 65 osôb s placebom) a 324 osôb dostalo jednu dávku skúšanej
očkovacej látky. 319 z týchto osôb dostalo druhú dávku (256 osôb s monovalentnou vakcínou; 63 osôb s placebom).
U detí boli miery séroodpovede po podaní monovalentnej očkovacej látky, bez ohľadu na východiskový sérostatus, v 15. deň 7,8 %, v 29. deň 11,1 %, a v 57. deň 32,0 %. U osôb dostávajúcich placebo boli miery séroodpovede, bez ohľadu na východiskový sérostatus, v 15. a 29. deň 6,3 % a v 57. deň 14,5 %. Miery séroodpovede boli mierne vyššie u východiskovo séronegatívnych osôb.
V pozorovacej štúdii vykonanej inštitúciou CDC v Spojených štátoch (Griffin, et al., 2011) sa účinnosť očkovacej látky LAIV proti pandémii H1N1 u detí vo veku 2 až 9 rokov odhadla na 81,9 % (95 % IS: 13,6; 96,2).
Účinnosť T/LAIV
Údaje o účinnosti T/LAIV v pediatrickej populácii pozostávajú z 9 kontrolovaných štúdií zahŕňajúcich
vyše 20 000 dojčiat a batoliat, detí a dospievajúcich, vykonaných v priebehu 7 chrípkových sezón. Štyri placebom kontrolované štúdie zahŕňali opätovné očkovanie v druhej chrípkovej sezóne. T/LAIV
preukázala lepšie výsledky v 3 aktívne kontrolovaných štúdiách s injekčnou očkovacou látkou proti
chrípke. Zhrnutie výsledkov účinnosti v pediatrickej populácii je uvedené v tabuľkách 1 a 2.
Tabuľka 1: Účinnosť T/LAIV v placebom kontrolovaných pediatrických štúdiách
Číslo
štúdie
Región
Veková
skupina
a
Po
čet
účast- níkov štúdie
b
Chrípková sezóna
Účinnosť
(9
5 % IS)
c
zhodujúce sa kmene
Účinnosť
(9
5 % IS)
c
v
šetky
kmene bez ohľadu na zhodu
D153-P502 Európa 6 až 35 M
1 616 2000 –
2001
1 090 2001 –
2002
85,4 % (74,3; 92,2)
88,7 % (82,0; 93,2)
85,9 % (76,3; 92,0)
85,8 % (78,6; 90,9)
D153-P504
Afrika, Latinská Amerika
6 až 35 M
1 886 2001 73,5 % (63,6; 81,0)
680 2002 73,6 %
72,0 %
d (61,9; 79,8)d
46,6 %
(33,3; 91,2)
D153-P513 Ázia/Oceánia 6 až 35 M 1 041 2002 62,2 % (43,6; 75,2)
(14,9; 67,2)
48,6 % (28,8; 63,3)
D153-P522
Európa, Ázia/Oceánia, Latinská Amerika
11 až
24 M 1 150
2002 –
2003
78,4 % (50,9; 91,3)
63,8 % (36,2; 79,8)
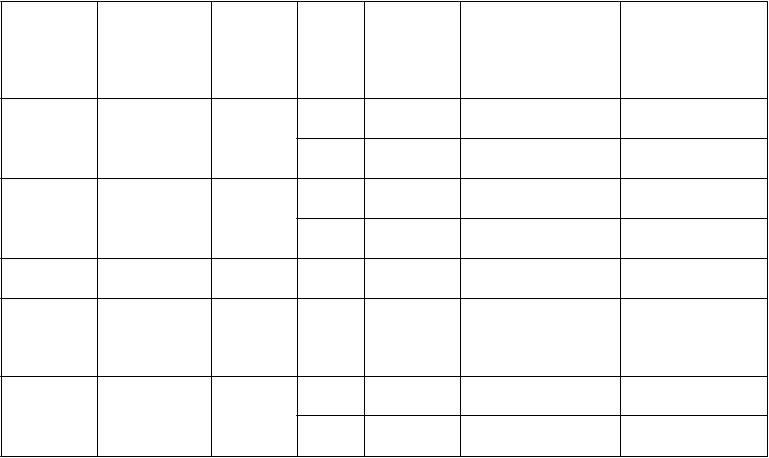
D153-P501 Ázia/Oceánia 12 až
35 M
2 764 2000 –
2001
1 265 2001 –
2002
72,9 % (62,8; 80,5)
84,3 % (70,1; 92,4)
e70,1 % (60,9; 77,3)
64,2 % (44,2; 77,3)
e
Číslo
štúdie
Región
Veková
skupina
a
Po
čet účast- níkov štúdie
b
Chrípková sezóna
Účinnosť (95 % IS)
c
zhodujúce sa kmene
Účinnosť
(9
5 % IS)
c
v
šetky
kmene bez ohľadu na zhodu
AV006 USA 15 až
71 M
aM = mesiace
1 259 1996 –
1997
1 358 1997 –
1998
93,4 % (87,5; 96,5)
100 % (63,1; 100)
93,4 % (87,5; 96,5)
87,1 % (77,7; 92,6)f
bPočet účastníkov štúdie v1. alebo 2. roku primárnej analýzy účinnosti.
cZníženie výskytu kultivačne potvrdeného chrípkového ochorenia v porovnaní s placebom.
dÚdaje uvedené pre klinické skúšanie D153-P504 sa týkajú účastníkov štúdie, ktorým boli podané dve dávky skúšanej očkovacej látky alebo placeba. U účastníkov štúdie, ktorí neboli predtým očkovaní a ktorí dostali jednu dávku v 1. roku bola účinnosť voči zhodujúcim sa kmeňom 57,7 % (95 % IS: 44,7; 67,9) a účinnosť voči všetkým kmeňom bez ohľadu na zhodu bola 56,3 % (95 % IS: 43,1; 66,7), čo potvrdilo potrebu dvoch dávok očkovacej látky u predtým neočkovaných detí.
eU účastníkov štúdie, ktorí dostali 2 dávky v 1. roku a placebo v 2. roku bola v rámci štúdie D153-P501
účinnosť voči zhodujúcim sa kmeňom v 2. roku 56,2 % (95 % IS: 30,5; 72,7) a účinnosť voči všetkým kmeňom bez ohľadu na zhodu bola v 2. roku 44,8 % (95 % IS: 18,2; 62,9), čo potvrdilo potrebu opätovného očkovania
v druhej chrípkovej sezóne.
fHlavný cirkulujúci kmeň mal v porovaní s kmeňom H3N2 zastúpeným v očkovacej látke odlišné antigény;
účinnosť voči nezhodujúcemu sa kmeňu A/H3N2 bola 85,9 % (95 % IS: 75,3; 91,9).
Tabuľka 2: Relatívna účinnosť T/LAIV v aktívne kontrolovaných pediatrických štúdiách so
sezónnou injekčnou očkovacou látkou proti chrípke
Číslo
štúdie
Región
USA,
Veková skupinaa
Počet
účast- níkov štúdie
Chrípková sezóna
Zvýšená účinnosť (95 % IS)b zhodujúce sa kmene
44,5 % (22,4; 60,6)
Zvýšená účinnosť
(95 % IS)b
všetky kmene bez ohľadu na zhodu
54,9 % (45,4; 62,9)c
MI-CP111
Európa, Ázia/Oceánia
6 až
59 M
7 852 2004 –
2005
menej prípadov ako pri injekčnej
očkovacej látke
52,7 % (21,6; 72,2)
menej prípadov ako pri injekčnej
očkovacej látke
52,4 % (24,6; 70,5)d
D153-P514 Európa 6 až
71 M
2 085 2002 –
2003
menej prípadov ako pri injekčnej očkovacej látke
34,7 % (3,9; 56,0)
menej prípadov ako pri injekčnej očkovacej látke
31,9 % (1,1; 53,5)
D153-P515 Európa 6 až 17 R 2 211 2002 –
2003
menej prípadov ako pri injekčnej očkovacej látke
menej prípadov ako pri injekčnej očkovacej látke

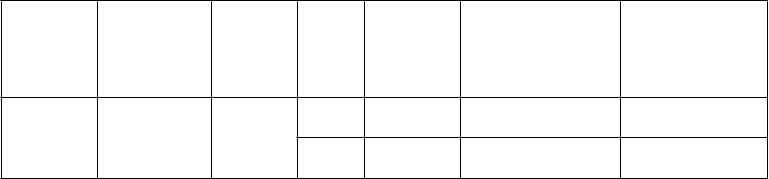
aM = mesiace. R = roky. Vekové skupiny uvedené v protokole štúdie.
bZníženie výskytu kultivačne potvrdeného chrípkového ochorenia v porovnaní s injekčnou očkovacou látkou proti chrípke.
cT/LAIV preukázala o 55,7 % (39,9; 67,6) menej prípadov ako injekčná očkovacia látka proti chrípke u 3 686
dojčiat a batoliat vo veku 6 – 23 mesiacov a o 54,4 % (41,8; 64,5) menej prípadov u 4 166 detí vo veku 24 – 59
mesiacov.
dT/LAIV preukázala o 64,4 % (1,4; 88,8) menej prípadov ako injekčná očkovacia látka proti chrípke u 476 dojčiat a batoliat vo veku 6 – 23 mesiacov a o 48,2 % (12,7; 70,0) menej prípadov u 1 609 detí vo veku 24 – 71 mesiacov.
OčkovacialátkaP/LAIVH5N1Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Pandemic
influenza vaccine H5N1 MedImmune v jednej alebo vo viacerých podskupinách pediatrickej populácie v prevencii infekcie chrípky (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Tento liek bol registrovaný s tzv. podmienkou. To znamená, že sa očakávajú ďalšie údaje o tomto lieku. Európska agentúra pre lieky najmenej raz ročne posúdi nové informácie o tomto lieku a tento súhrn charakteristických vlastností lieku bude podľa potreby aktualizovať.
Štúdie u dospelých
Dospelí voveku18až49rokov
V klinickej štúdii CIR 217 sa bezpečnosť, infekčnosť a imunogenita živej atenuovanej očkovacej látky
odvodenej z chrípkového izolátu A/Vietnam/1203/2004 (H5N1) hodnotili u 21 osôb, ktoré dostali jednu dávku predstavujúcu 106,7 TCID50 (50 % infekčnej dávky pre tkanivovú kultúru) a z ktorých 18 osôb dostalo po 4 – 8 týždňoch neskôr druhú dávku. 21 ďalších osôb dostalo jednu dávku vírusu očkovacej látky predstavujúcu 107,5 TCID50, z ktorých 19 osôb dostalo po 4 – 8 týždňoch neskôr druhú dávku. Po 1 alebo 2 dávkach zodpovedajúcich 106,7 TCID50 očkovacej látky sa séroodpovede inhibície hemaglutinácie (HAI) a séroodpovede IgA zistili u 10 % osôb a odpovede IgA v nazálnom výplachu'
u 24 % osôb. Po 1 alebo 2 dávkach zodpovedajúcich 107,5 TCID50 očkovacej látky sa séroodpovede
HAI zistili u 10 % osôb, séroodpovede IgA u 52 % osôb a odpovede IgA v nazálnom výplachu u 19 %
osôb.
V klinickej štúdii CIR 239 sa bezpečnosť, infekčnosť a imunogenita živej atenuovanej očkovacej látky odvodenej z chrípkového izolátu A/Hong Kong/213/2003 (H5N1) hodnotili u 17 osôb, ktoré dostali jednu dávku predstavujúcu 107,5 TCID50 očkovacej látky intranazálne v izolácii a z ktorých 16 osôb dostalo po 4 – 8 týždňoch neskôr druhú dávku. Po prvej alebo druhej dávke očkovacej látky sa odpovede HAI nezistili u žiadnej z osôb. Séroodpoveď IgA a odpoveď IgA v nazálnom výplachu sa zistili u 18 % osôb.
Dospelí voveku22až54rokov
Klinická štúdia CIR 277 hodnotila, či osoby, ktoré predtým dostali živé atenuované očkovacie látky
proti pandémii chrípky H5N1, boli imunizované alebo si vytvorili dlhotrvajúcu imunitu, ktorá bola detekovateľná po následnom podaní inaktivovanej očkovacej látky H5N1. Štúdia zahŕňala 69 osôb v rámci 5 skupín: skupina 1 zahŕňala 11 osôb, ktoré predtým dostali 2 dávky živej atenuovanej
očkovacej látky proti pandémii chrípky (P/LAIV) kmeňa H5N1 A/Vietnam/1203/2004 v rokoch 2006
– 2007; skupina 2 zahŕňala 10 osôb, ktoré predtým dostali 2 dávky P/LAIV kmeňa H5N1 A/Hong
Kong/213/2003 v roku 2007; skupina 3 zahŕňala 8 osôb, ktoré predtým dostali 2 dávky P/LAIV kmeňa H7N3 A/Britská Kolumbia/CN-6/2004 v roku 2010 (ako kontrolná skupina P/LAIV); skupiny 4 a 5 zahŕňali po 20 osôb, ktoré predtým neboli očkované LAIV a nemali predtým chrípku H5. Osoby
v skupinách 1 až 4 dostali jednorazovú 45 µg dávku inaktivovanej očkovacej látky proti pandémii chrípky (P/IIV) kmeňa A/Vietnam/1203/2004, zatiaľ čo osoby v skupine 5 dostali dve dávky
s odstupom približne 28 dní.
U osôb očkovaných P/LAIV H5N1 sa po následnej expozícii inaktivovanej očkovacej látke H5N1 vyvinula mohutná protilátková odpoveď na divý typ vírusu H5N1, hoci takéto protilátkové odpovede neboli detekovateľné u väčšiny osôb po prvých 2 dávkach. Osoby, ktoré boli očkované buď P/LAIV kmeňa A/Vietnam/1203/2004 alebo P/LAIV kmeňa A/Hong Kong/213/2003, mali významne lepšiu odpoveď na jednorazovú dávku inaktivovanej očkovacej látky H5N1 ako osoby predtým neočkované P/LAIV. Protilátková odpoveď u osôb očkovaných P/LAIV kmeňa A/Vietnam/1203/2004 prekonala aj odpoveď pozorovanú po 2 dávkach inaktivovanej očkovacej látky u osôb predtým neočkovaných P/LAIV (pozri tabuľku 3).
Tabuľka 3: Protilátkové odpovede mikroneutralizácie (MN) v sére v 28. a 57. deň po podaní inaktivovanej očkovacej látky H5N1
Skupina
Očkovacia
Počet dávok inaktivovanej
Počet
28 dní po podaní
inaktivovane
j očkovacej látky
a
Osoby so 4- násobným
56 dní po podaní
inaktivovanej očkovacej látky
a
Osoby so 4- násobným
štúdie
dávka
P/LAIV
očkovacej
látky kmeňa
Vietna
m 2004
osôb
Geometrický priemer titrov
nárastom
hladiny protilátok (percentá)
b
Geometrický
priemer titrov
nárastom
hladiny protilátok (percentá)
b
H5N1
1 Vietnam
2004
H5N1
2 Hong
Kong 2003
MN HAI MN HAI MN HAI MN HAI
1 11 48 87 73 73 25 66 55 82
1 10 31 29 60 50 22 21 60 40

3 žiadna 1 20 7 8 10 10 4 8 10 10
4 žiadna 2 20c 11 15 30 40 19 21 56 50
Údaje pre skupinu 3, osoby, ktoré boli pôvodne očkované P/LAIV H7N3, nie sú uvedené.
aDni sa počítajú vzhľadom na jedinú dávku P/IIV pre skupiny 1 – 4 a vzhľadom na prvú z 2 dávok P/IIV pre skupinu
5.
bSérologická odpoveď definovaná ako ≥ 4-násobný nárast titru protilátok (≥ 1:20).
cVzorky séra boli k dispozícii od 7 osôb v skupine 3 v 28. deň a od 18 osôb v skupine 5 v 56. deň.
U osôb očkovaných P/LAIV H5N1 sa protilátková odpoveď vyvinula rýchlo. U siedmich z 11 (64 %)
osôb v skupine 1 (ca A/Vietnam/1204/2004 [H5N1]) bol nárast titru protilátok HAI v 7. deň po podaní inaktivovanej očkovacej látky ≥ 4-násobný, s geometrickým priemerom titrov (GMT) 165 a rozsahom titrov 20 až 1280 u osôb s odpoveďou. V rámci osôb predtým neočkovaných P/LAIV bol nárast v 7. deň ≥ 4-násobný len u 10 % osôb. U osôb očkovaných P/LAIV H5N1 boli protilátkové odpovede tiež širšie. U osôb očkovaných P/LAIV H5N1 sa vyvinuli protilátkové odpovede, ktoré zneutralizovali 2 alebo viac vetiev vírusov H5N1 línie H5N1 A/husia/Guangdong/1996, zatiaľ čo u niekoľkých osôb dokonca v skupine s 2 dávkami inaktivovanej očkovacej látky H5N1 sa vyvinuli protilátky so skríženou neutralizačnou schopnosťou medzi vetvami. Afinita protilátok proti doméne HA1 hemaglutinínu (HA) H5 v skupinách očkovaných P/LAIV H5N1 bola významne vyššia ako v skupine
s 2 dávkami inaktivovanej očkovacej látky, čo súviselo so skríženou neutralizáciou vetiev H5N1.
Podobné odpovede sa pozorovali u osôb očkovaných P/LAIV H7N7 a P/LAIV H7N9, u ktorých sa vyvinuli mohutné protilátkové odpovede na príslušné divé typy vírusov po následnej expozícii inaktivovanej očkovacej látky rovnakého podtypu. Pre P/LAIV H7N7 sa prostredníctvom MN aj HAI zistili silné protilátkové odpovede v sére u 9 z 13 osôb, s maximálnymi titrami dosiahnutými v 14. deň. Pre P/LAIV H7N9 sa silné protilátkové odpovede vyvinuli u 8 zo 14 osôb, ktoré dostali jednorazovú dávku očkovacej látky a u 13 zo 16 osôb, ktoré dostali dve dávky očkovacej látky; maximálne titre sa opäť pozorovali v 14. deň.
5.2 Farmakokinetické vlastnostiNeaplikovateľné.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých predklinických štúdií toxicity po opakovanom podávaní, reprodukčnej toxicity a vývinovej toxicity, lokálnej znášanlivosti a neurovirulencie
s Pandemic influenza vaccine H5N1 MedImmune a sezónnymi očkovacími látkami T/LAIV a Fluenz
Tetra neodhalili žiadne osobitné riziko pre ľudí
.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
sacharóza hydrogenfosforečnan draselný dihydrogenfosforečnan draselný želatína (bravčová, typ A) arginíniumchlorid
monohydrát glutamanu sodného voda na injekciu
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti18 týždňov.
6.4 Špeciálne upozornenia na uchovávanie Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Nosový aplikátor uchovávajte vo vonkajšej škatuli na ochranu pred svetlom.
Pred použitím možno očkovaciu látku vybrať a uchovávať mimo chladničky maximálne 12 hodín pri teplote neprevyšujúcej 25 °C. Ak sa očkovacia látka po týchto 12 hodinách nepoužije, musí sa zlikvidovať.
6.5 Druh obalu a obsah baleniaPandemic influenza vaccine H5N1 MedImmune sa dodáva ako 0,2 ml suspenzia v jednorazovom nosovom aplikátore (sklo typu 1) s dýzou (polypropylén s polyetylénovým prietokovým ventilom), ochranným krytom špičky dýzy (syntetická guma), piestom, zátkou piestu (butylová guma) a svorkou na rozdelenie dávky.
Veľkosť balenia po 10 kusov.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPodávaniePandemic influenza vaccine H5N1 MedImmune JE LEN NA NAZÁLNE POUŽITIE.
· NEPOUŽÍVAŤ S INJEKČNOU IHLOU. Nepodávať injekčne.
· Nepoužívajte Pandemic influenza vaccine H5N1 MedImmune po uplynutí dátumu exspirácie alebo ak sa vám zdá, že striekačka je poškodená, napríklad ak je piest uvoľnený alebo vychýlený zo striekačky, alebo v prípade akýchkoľvek náznakov vytekania očkovacej látky.
· Pandemic influenza vaccine H5N1 MedImmune sa podáva ako rozdelená dávka do oboch nosových dierok.
· Po podaní polovice dávky do jednej nosovej dierky, podajte druhú polovicu dávky do druhej nosovej dierky hneď alebo krátko potom.
· Pacient môže počas podávania očkovacej látky normálne dýchať, nie je potrebné ju aktívne vdychovať alebo vťahovať nosom.
· Podrobné pokyny na podávanie nájdete v schéme na podávanie Pandemic influenza vaccine
H5N1 MedImmune (obrázok 1).
Obrázok 1. Podávanie Pandemic influenza vaccine H5N1 MedImmune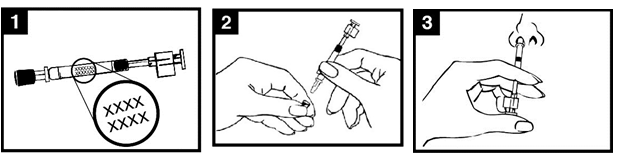
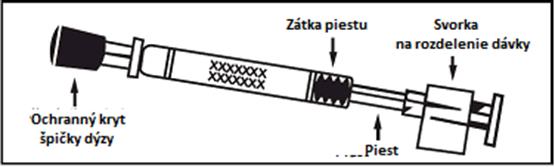
Skontrolujte dátum
exspirácie
Očkovacia látka sa musí
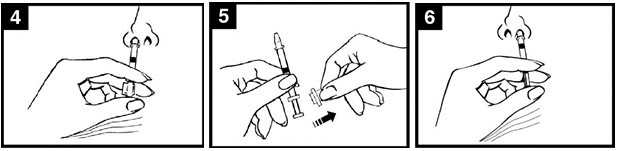
použiť pred uplynutím dátumu uvedeného na štítku aplikátora.
Pripravte aplikátorOdstráňte gumený
ochranný kryt špičky. Svorku na rozdelenie
dávky na opačnom konci
aplikátora neodstraňujte.
Nastavte polohuaplikátoraS pacientom vo
vzpriamenej polohe vsuňte len špičku aplikátora do nosovej dierky tak, aby sa zaistilo podanie Pandemic influenza vaccine H5N1
MedImmune do nosa.
Stlačte piest
Jediným pohybom stlačte piest čo najrýchlejšie
potiaľ, pokiaľ vám to svorka na rozdelenie dávky dovolí.
Odstráňte svorku na
rozdelenie dávky
Pred podaním do druhej
nosovej dierky prstami uchopte a odstráňte
z piestu svorku na
rozdelenie dávky.
Vstreknite do druhej
nosovej dierky Vsuňte len špičku aplikátora do druhej nosovej dierky
a jediným pohybom
stlačte piest
čo najrýchlejšie pre podanie zvyšku
očkovacej látky.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
MedImmune, LLC Lagelandseweg 78
6545 CG Nijmegen
Holandsko
(Tel.) +31 24 371 7310
8. REGISTRAČNÉ ČÍSLOEU/1/16/1089/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.