
b>
< 8 hodín alebo neznámy ≥ 8 hodín
Rivaroxaban ≤ 10 mg nízka dávka
> 10 mg/
neznáma vysoká dávka
nízka dávka

 O
pätovné
z
ačatie
antitrombotickej
l
i
e
čby
O
pätovné
z
ačatie
antitrombotickej
l
i
e
čby
Po podaní lieku Ondexxya a zastavení veľkého krvácania sa má zvážiť opätovné podanie antikoagulancií na zabránenie trombotických príhod spôsobených pacientovým základným ochorením. Antitrombotická liečba sa môže opäť začať akonáhle je klinicky indikovaná, po liečbe, ak je pacient klinicky stabilný a dosiahla sa primeraná hemostáza. Lekárskym posúdením sa majú zvážiť prínosy antikoagulačnej liečby oproti rizikám opätovného krvácania (pozri časť 4.4).
O
s
obitné
s
kupiny
pacientov
Starší pacienti (vo veku 65 rokov a starší): U starších pacientov nie je potrebná žiadna úprava dávky
(pozri časť 5.2).
Porucha funkcie obličiek: Účinok poruchy funkcie obličiek na hladiny expozície andexanetu alfa sa nevyhodnocoval. Na základe existujúcich údajov týkajúcich sa klírensu sa neodporúča žiadna úprava dávky.
Porucha funkcie pečene: Na základe existujúcich údajov týkajúcich sa klírensu andexanetu alfa sa neodporúča žiadna úprava dávky. Bezpečnosť a účinnosť sa u pacientov s poruchou funkcie pečene neskúmali (pozri časť 5.2).
Pediatrická populácia: Bezpečnosť a účinnosť andexanetu alfa u detí a dospievajúcich neboli stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávania
Intravenóznepoužitie
Po rekonštitúcii príslušného počtu injekčných liekoviek lieku Ondexxya sa rekonštituovaný roztok
(10 mg/ml) bez ďalšieho zriedenia prenesie do vhodného, prázdneho intravenózneho vaku
z polyolefínového (PO) alebo polyvynilchloridového (PVC) materiálu (pozri časť 6.6) predtým, ako sa podá i.v. infúziou použitím 0,2 alebo 0,22 mikrónového in-line filtra z polyétersulfónu (PES) alebo zodpovedajúceho filtra s nízkou väzbou proteínov.
Liek Ondexxya sa podáva i.v. bolusom s cieľovou rýchlosťou približne 30 mg/min. počas 15 až
30 minút, s následným podaním kontinuálnej infúzie 4 mg (nízka dávka) alebo 8 mg (vysoká dávka)
za minútu po dobu 120 minút (pozri tabuľku 1).
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z ďalších zložiek uvedených v časti 6.1. Známa alergická reakcie na škrečie proteíny.
4.4 Osobitné upozornenia a opatrenia pri používaní
Obmedzeniapoužitia
Klinická účinnosť sa zakladá na zvrátení anti-FXa aktivity u zdravých dobrovoľníkov, ktorým sa podával apixaban a rivaroxaban. Andexanet alfa nie je vhodný na predoperačnú liečbu pri núdzových chirurgických zákrokoch. Používanie na zvrátenie účinku edoxabanu alebo enoxaparinu sa z dôvodu chýbajúcich údajov neodporúča. Andexanet alfa nezvráti účinky iných ako FXa inhibítorov (pozri časť 5.1).
Aj keď sa v núdzových situáciách stále častejšie odporúča stanovenie anti-FXa aktivity, nie sú
k dispozícii žiadne odporúčania úpravy dávkovania andexanetu alfa. Preto sa má sledovanie liečby zakladať hlavne na klinických parametroch naznačujúcich príslušnú odpoveď (t.j. dosiahnutie hemostázy), chýbajúcu účinnosť (t.j. opätovné krvácanie) a nežiaduce účinky (t.j. tromboembolické príhody).
Odporúčanie dávkovania sa zakladá na modelových údajoch u zdravých dobrovoľníkov. Validácia doteraz nebola úspešná. Údaje u krvácajúcich pacientov sú obmedzené. Predbežné údaje naznačujú vyššie riziko vzniku trombózy u pacientov dostávajúcich vyššiu dávku andexanetu, u pacientov
s predchádzajúcou nižšou dávkou inhibítora anti-FXa a u pacientov užívajúcich rivaroxaban.
Do štúdie ANNEXA-4 boli zahrnutí pacienti s intrakraniálnym krvácaním (ICH) (GCS > 7 a objem
hematómu < 60 ml). Liečba pacientov so závažnejším ICH andexanetom alfa sa neskúmala.
Tromboticképríhody
Po liečbe andexanetom alfa sa hlásili trombotické príhody (pozri časti 4.8 a 5.1). Pacienti liečení inhibítorom FXa majú základné ochorenia, ktoré ich predisponujú k trombotickým príhodám.
Zvrátenie liečby inhibítormi FXa vystavuje pacientov trombotickému riziku ich základného ochorenia. Okrem toho sa nemôže vylúčiť protrombotický účinok andexanetu alfa. Trvanie tohto účinku
u krvácajúcich pacientov nie je známe. Laboratórne parametre ako je anti-FXa aktivita, endogénny
trombotický potenciál (ETP) alebo markery trombózy nemusia byť ako ukazovatele pre riadenie liečby spoľahlivé. Na zníženie rizika sa má po ukončení liečby zvážiť obnovenie antikoagulačnej liečby tak skoro, ako je to medicínsky vhodné.
U zdravých dobrovoľníkov sa po podaní andexanetu alfa pozorovali zvýšenia koagulačných markerov F1+2, TAT a D-diméru závislých na dávke, nepozorovali sa avšak žiadne tromboembolické príhody. Tieto markery sa nemerali u pacientov zaradených do štúdie ANNEXA-4, pozorovali sa však tromboembolické príhody (pozri časť 5.1). Dôrazne sa preto odporúča sledovanie prejavov
a príznakov trombózy.
Použitieandexanetualfaspolusinýmipodpornýmiopatreniami
Andexanet alfa sa môže používať spolu so štandardnými hemostatickými podpornými opatreniami, ktoré sa považujú za medicínsky vhodné.
Bezpečnosť andexanetu alfa sa nehodnotila u pacientov, ktorí dostali koncentráty protrombínového komplexu, rekombinantný faktor VIIa alebo plnú krv do siedmych dní pred krvácavou príhodou, pretože títo pacienti boli z klinických skúšaní vylúčení. Treba sa vyhnúť liečbam prokoagulačnými faktormi (napr. 3. alebo 4.faktor koncentrátu protrombínového komplexu (PCC)/aktivovaný PCC, rekombinantný faktor VIIa, čerstvá zamrazená plazma) a plnou krvou, ak to nie je absolútne potrebné, kvôli chýbajúcim údajom o kombináciách s týmito liečbami.
Reakciesúvisiacesinfúziou
V prípade miernych alebo stredne závažných reakcií súvisiacich s infúziou môže byť dostatočné dôkladné sledovanie. Pri stredne závažných príznakoch sa môže zvážiť krátkodobé prerušenie alebo spomalenie infúzie s obnovením infúzie po ustúpení príznakov. Môže sa podať difenhydramín.
4.5 Liekové a iné interakcie
S andexanetom alfa sa neuskutočnili žiadne interakčné štúdie.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití andexanetu alfa u gravidných žien. Štúdie na zvieratách sú nedostatočné z hľadiska reprodukčnej toxicity (pozri časť 5.3). Andexanet alfa sa neodporúča používať počas gravidity alebo u žien vo fertilnom veku, ktoré nepoužívajú antikoncepciu.
Dojčenie
Nie je známe, či sa andexanet alfa vylučuje do materského mlieka. Riziko u novorodencov/dojčiat nemôže byť vylúčené. Dojčenie sa má počas liečby andexanetom alfa ukončiť.
Fertilita
Nie sú k dispozícii žiadne údaje o účinkoch andexanetu alfa na fertilitu u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Andexanet alfa nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Zhrnutiebezpečnostnéhoprofilu
Bezpečnosť lieku sa vyhodnocovala v klinických skúšaniach zahŕňajúcich 247 zdravých osôb, ktorým sa podával inhibítor FXa, ako aj 352 pacientov v skúšaní fázy IIIb/IV (ANNEXA-4), ktorí mali akútne veľké krvácanie a boli liečení inhibítorom FXa (najčastejšie apixabanom a rivaroxabanom).
V klinických skúšaniach u zdravých osôb, ktorým sa podával inhibítor FXa a ktorí potom dostali andexanet alfa, sa nehlásili žiadne závažné ani ťažké nežiaduce reakcie. Najčastejšie pozorovanými nežiaducimi reakciami boli mierne alebo stredne závažné reakcie súvisiace s infúziou (pozri
tabuľku 4), zahŕňajúce príznaky ako sú sčervenanie, pocit tepla, kašeľ, dysgeúzia a dýchavičnosť,
ktoré sa vyskytli do niekoľkých minút až niekoľkých hodín po infúzii. U zdravých osôb sa u žien vyskytlo viac nežiaducich reakcií (hlavne reakcií súvisiacich s infúziou), ako u mužov.
V skúšaniach u zdravých osôb sa často pozorovali > 2 x ULN zvýšenia hladín D-diméru
a protrombínových fragmentov F1+2. Tieto zvýšenia sa udržali niekoľko hodín až niekoľko dní po podaní, nehlásili sa však žiadne trombotické príhody. Klinický význam u cieľovej populácie (pacienti
s nekontrolovaným alebo život ohrozujúcim krvácaním, ktorým bola podaná antikoagulačná liečba
kvôli veľmi vysokému riziku trombózy) nie je známy.
Tabuľkovýzoznamnežiaducichreakcií
Tabuľka 4 uvádza zoznam nežiaducich reakcií z klinických štúdií u zdravých osôb, ktorým sa podával andexanet alfa. Druhý stĺpec udáva zoznam nežiaducich reakcií z predbežných výsledkov štúdie
fázy IIIb/IV ANNEXA-4, zahŕňajúcej 352 pacientov s akútnym veľkým krvácaním liečených andexanetom alfa. Nežiaduce reakcie sú klasifikované podľa triedy orgánových systémov
a frekvencie, použitím nasledujúcej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej
časté (≥ 1/1000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1000), veľmi zriedkavé (< 1/10 000) alebo neznáme (z dostupných údajov).
Tabuľka 4: Zoznam nežiaducich reakcií vyskytujúcich sa u zdravých osôb a pacientov s krvácaním
T
rieda orgánových systémov/
preferovaný výraz
P
oruchy imunitného systému
F
r
ekvencia
u zdravých dobrovoľníkov
F
r
ekvencia
u pacientov s krvácaním

Urtikária časté
Poruchy nervového systémuMozgový infarkt menej časté Cerebrovaskulárna príhoda menej časté Posturálne závraty časté
Bolesť hlavy časté
Ischemická mŕtvica časté Prechodný ischemický atak menej časté
Poruchy srdca a srdcovej činnostiAkútny infarkt myokardu menej časté
T
rieda orgánových systémov/
preferovaný výraz
F
r
ekvencia u zdravých dobrovoľníkov
F
r
ekvencia u pacientov
s krvácaním

Srdcová zástava menej časté Infarkt myokardu menej časté Palpitácie časté
Poruchy cievHlboká žilová trombóza menej časté Oklúzia iliakálnej artérie menej časté
Poruchy dýchacej sústavy, hrudníka a mediastínaKašeľ časté
Dýchavičnosť časté
Pľúcna embólia menej časté
Poruchy gastrointestinálneho traktuAbdominálny diskomfort časté Bolesť brucha časté Sucho v ústach časté Dysgeúzia časté Nevoľnosť časté
Poruchy kože a podkožného tkanivaPruritus časté
Generalizovaný pruritus časté
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaBolesť chrbta časté Svalové kŕče časté
Celkové poruchy a reakcie v mieste podaniaSčervenanie veľmi časté
Pocit tepla veľmi časté Diskomfort v hrudníku časté Hyperhidróza časté Periférny pocit chladu časté
Pyrexia časté
Laboratórne a funkčné vyšetreniaPrechodné zvýšenia hladín D-diméru a fragmentov F1+2 veľmi časté
PopisvybranýchnežiaducichreakciíNa základe údajov od 352 pacientov zo štúdie fázy IIIb/IV ANNEXA-4 liečených inhibítorom FXa, u ktorých sa vyskytla epizóda akútneho veľkého krvácania, sa u jedného pacienta vyskytla závažná alebo ťažká reakcia súvisiaca s infúziou. U 36 z 352 pacientov s kompletným 30-dňovým sledovaním bezpečnosti (10,3 %) sa vyskytli trombotické príhody, vrátane venóznej tromboembólie (VTE), infarktu myokardu (IM) a mŕtvice. U 10 z 36 (27,8 %) pacientov sa v čase príhody opätovne začala
antitrombotická liečba a všetkým 36 pacientom sa podala antikoagulačná liečba z dôvodu VTE a/alebo atriálnej fibrilácie v anamnéze v čase, keď dostávali andexanet alfa (pozri časti 4.4 a 5.1).
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNeexistujú žiadne klinické skúsenosti s predávkovaním andexanetom alfa. Počas klinických skúšaní sa nepozorovali žiadne toxicity limitujúce dávku.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Všetky ostatné liečivá, antidotá. ATC kód: V03AB38
MechanizmusúčinkuAndexanet alfa je rekombinantnou formou ľudského proteínu FXa, ktorý bol modifikovaný tak, aby nemal enzymatickú aktivitu FXa. Serín na aktívnej pozícii sa substituoval za alanín, čím sa zmenila molekula tak, že nie je schopná rozštiepiť a aktivovať protrombín, a odstránila sa doména kyseliny gamakarboxyglutamovej (Gla) na znemožnenie schopnosti proteínu spojiť sa do protrombinázového komplexu, takže sa tým odstránili antikoagulačné účinky.
Andexanet alfa je špecifická látka na zvrátenie účinku inhibítorov FXa. Hlavným mechanizmom účinku je väzba a odstraňovanie inhibítora FXa, aj keď môže existovať menej významný účinok
z inhibície inhibítora cesty tkanivového faktora (
Tissue Factor Pathway Inhibitor, TFPI). Interakcia medzi andexanetom alfa a TFPI sa úplne necharakterizovala. Andexanet alfa priamo a s vysokou afinitou viaže inhibítory FXa, čím zabraňuje ich antikoagulačným účinkom.
FarmakodynamickéúčinkyÚčinky andexanetu alfa sa je možné merať farmakodynamickými markermi, vrátane anti-FXa aktivity a voľnej frakcie dostupného inhibítora FXa ako aj cez obnovenie vytvárania trombínu.
Anti-FXa aktivita málo koreluje s klinickou účinnosťou a bezpečnosťou, čím je nevhodná na použitie pre odporúčania dávkovania (pozri časti 4.4 a 5.1).
V prospektívnej, randomizovanej, placebom kontrolovanej štúdii s určovaním rozsahu dávok
u zdravých osôb sa stanovili dávky a dávkovacie režimy andexanetu alfa potrebné na zvrátenie anti-FXa aktivity a obnovenie tvorby trombínu pre inhibítory FXa (apixaban alebo rivaroxaban).
Maximálne zvrátenie anti-FXa aktivity sa dosiahlo do dvoch minút od ukončenia podávania bolusu. Po podaní andexanetu alfa vo forme bolusu nasledovala kontinuálna infúzia vedúca k trvalému zníženiu anti-FXa aktivity. Anti-FXa aktivita sa vrátila na placebo hodnoty a vyššie približne dve hodiny po ukončení podávania bolusu alebo infúzie, v závislosti od dávkovania.
Keď sa andexanet alfa podával ako bolus, po ktorom nasledovala kontinuálna infúzia, bolo maximálne zníženie hladín nenaviazaných inhibítorov FXa rýchle (do dvoch minút od ukončenia podávania bolusu) a udržalo sa počas priebehu infúzie a potom sa časom postupne zvyšovalo, s dosiahnutím maximálnej hodnoty približne dve hodiny po ukončení podávania infúzie.
Obnovenie tvorby trombínu po podaní bolo závislé od dávky a dávkovacieho režimu a nekorelovalo s anti-FXa aktivitou po približne štyroch hodinách (pozri nižšie „Obnovenie tvorby trombínu“).
Preukázalo sa, že aktivita plazmatického TFPI sa inhibuje 10 až 20 hodín po podaní andexanetu alfa. Klinický význam tejto interakcie s ohľadom na udržanie tvorby trombínu a potenciálu protrombotického účinku sa úplne neobjasnil.
Farmakokinetický/farmakodynamickýmodel
Sily bolusu andexanetu alfa potrebné na dosiahnutie priemerných koncentrácií nenaviazaného apixabanu (400 mg bolus) a nenaviazaného rivaroxabanu (800 mg bolus) pod očakávanou príslušnou hraničnou hodnotou nepreukazujúcou žiadny antikoagulačný účinok boli dvakrát vyššie pre rivaroxaban (20 mg q.d.) v porovnaní s apixabanom (5 mg b.i.d) kvôli diferenciálnym farmakokinetickým charakteristikám a hladinám dávky príslušných inhibítorov Fxa.
Klinickáúčinnosťabezpečnosť
Účinnosť a bezpečnosť andexanetu alfa sa hodnotili v nasledujúcich: 1) randomizované, placebom kontrolované skúšanie fázy II s určovaním rozsahu dávky u zdravých dobrovoľníkov, ktorým sa
podávali inhibítory FXa na určenie dávok pre zvrátenie účinku, 2) dve štúdie fázy III, jedna
s apixabanom a druhá s rivaroxabanom na potvrdenie účinnosti režimov s vysokou a s nízkou dávkou a 3) globálna, multicentrická, prospektívne definovaná, tvorená štúdia fázy IIIb/IV (ANNEXA-4)
u pacientov s epizódou akútneho veľkého krvácania vyžadujúceho bezodkladné zvrátenie
antikoagulačného účinku na FXa.
Zvrátenieantikoagulačnéhoúčinkuuzdravýchosôbvoveku50- 75rokov(štúdie14-503a14-504)V prospektívnej, randomizovanej, placebom kontrolovanej štúdii dostávali zdravé osoby s mediánom veku 56,5 rokov užívajúce 5 mg apixabanu dvakrát denne andexanet alfa (n = 24) podávaný ako
400 mg i.v. bolus, po ktorom okamžite nasledovala i.v. infúzia s rýchlosťou 4 mg za minútu po dobu
120 minút (480 mg) alebo placebo (n = 8).
V podobnej štúdii dostávali osoby s mediánom veku 57 rokov užívajúce 20 mg rivaroxabanu denne andexanet alfa (n = 26) podávaný ako 800 mg i.v. bolus, po ktorom okamžite nasledovala i.v. infúzia s rýchlosťou 8 mg za minútu po dobu 120 minút (960 mg) alebo placebo (n = 13).
Zníženieanti-FXaaktivity
Primárnym koncovým ukazovateľom štúdie 14-503 (apixaban) aj štúdie 14-504 (rivaroxaban) bola percentuálna zmena anti-FXa aktivity od počiatočného stavu do najnižšej hodnoty (nadir) po infúzii.
U osôb, ktoré dostávali apixaban v štúdii 14-503, bola percentuálna zmena anti-FXa aktivity -92,34 % (± 2,809 %) pre skupinu s andexanetom alfa a -32,70 % (± 5,578 %) pre skupinu s placebom
(p < 0,0001), pričom táto zmena odzrkadľovala prirodzený klírens antikoagulancia.
U osôb, ktoré dostávali rivaroxaban v štúdii 14-504, bola percentuálna zmena anti-FXa
aktivity -96,72 % (± -1,838 %) pre skupinu s andexanetom alfa a -44,75 % (± 11,749 %) pre skupinu s placebom (p < 0,0001), pričom táto zmena odzrkadľovala prirodzený klírens antikoagulancia.
Časové priebehy anti-FXa aktivity pred a po podaní andexanetu alfa sú ukázané na obrázku 1.
Zníženie anti-FXa aktivity koreluje s obnovením tvorby trombínu. Hraničné hodnoty anti-FXa aktivity pre normalizáciu tvorby trombínu (definované priemernou hodnotou ETP a štandardnými odchýlkami) sa stanovili na 44,2 ng/ml (v rámci štandardnej odchýlky normálnej hodnoty ETP) na základe súhrnných údajov zo štúdií 14-503 a 14-504, ako je označené na obrázku.
Obrázok 1: Zmena anti-FXa aktivity (ng/ml) u zdravých osôb, u ktorých bol antikoagulačný účinok vyvolaný apixabanom (A) a rivaroxabanom (B)

Koniec bolusu
Koniec infúzie
Placebo bolus + 2 h infúzie (n = 8)
ONDEXXYA 400 mg bolus + 480 mg x 2 h infúzie
(n = 23)
Čas po podaní bolusu (h)
(A)
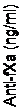
Koniec bolusu
Koniec infúzie


Placebo bolus + 2 h infúzie (n = 13)
ONDEXXYA 800 mg bolus + 960 mg x 2 h infúzoie (n = 26)
Čas po podaní bolusu (h)
(B)ObnovenietvorbytrombínuV štúdii 14-503 aj v štúdii 14-504 viedlo podanie andexanetu alfa aj ku štatisticky významnému zvýšeniu tvorby trombínu u zdravých osôb, u ktorých bol antikoagulačný účinok vyvolaný apixabanom alebo rivaroxabanom, oproti placebu (p < 0,0001). U osôb užívajúcich apixaban sa
obnovenie tvorby trombínu na hodnoty v rámci normálneho rozsahu (definované ako jedna štandardná odchýlka od počiatočných hladín) do dvoch minút a udržanie po dobu 20 hodín dosiahlo podaním bolusu samotného a bolusu s infúziou nízkej dávky andexanetu alfa. U osôb užívajúcich rivaroxaban viedla vysoká dávka andexanetu alfa (bolus s infúziou) k zvýšenej tvorbe trombínu nad dve štandardné
odchýlky. V týchto štúdiách sa nevykonalo klinické hodnotenie osôb užívajúcich apixaban s vysokou dávkou andexanetu alfa ani osôb užívajúcich rivaroxaban s nízkou dávkou andexanetu alfa.
ZmenaodpočiatočnejhodnotykoncentráciívoľnéhoinhibítoraFXaoprotinajnižšejhodnote(nadir)
Priemerné koncentrácie nenaviazaného apixabanu a rivaroxabanu boli < 3,5 ng/ml a 4 ng/ml,
v uvedenom poradí, po podaní bolusu andexanetu alfa, a udržali sa po dobu podávania kontinuálnej infúzie. Tieto hladiny neviazaného inhibítora FXa majú len nízky alebo žiadny antikoagulačný účinok.
ZvrátenieantikoagulačnéhoúčinkuinhibítorovFXaupacientovsakútnymveľkýmkrvácanímV medzinárodnej, prospektívnej, otvorenej štúdii fázy IIIb/IV s jednou liečebnou skupinou sa andexanet alfa podával pacientom užívajúcim inhibítory FXa, u ktorých došlo k akútnemu veľkému krvácaniu. Dva primárne koncové ukazovatele boli: a) percentuálna zmena anti-FXa aktivity od počiatočného stavu po najnižšiu hodnotu (nadir) dosiahnutú medzi 5 minútami po ukončení bolusu
a ukončením podávania infúzie a b) miera dobrej alebo veľmi dobrej (v porovnaní so slabou alebo
žiadnou) hemostatickej účinnosti do 12 hodín po infúzii, hodnotená nezávislou komisiou posudzujúcou koncové ukazovatele (Independent Endpoint Adjudication Committee).
V priebežnej analýze štúdie sa vyhodnocovalo 352 pacientov.
Približne polovica pacientov boli muži a priemerný vek bol 77,4 rokov. Väčšina pacientov predtým dostávalo buď apixaban (194/352; 55,1 %) alebo rivaroxaban (128/352; 36,4 %). Vo všeobecnosti sa u väčšiny pacientov vyskytlo buď ICH (230/352; 65,3 %) alebo gastrointestinálne (GI) krvácanie (94/352; 26,7 %). Zostávajúcich 28 pacientov malo krvácanie na iných miestach.
Z 352 zaradených pacientov bola u 167 vyhodnotiteľná účinnosť, definovaná ako splnenie vstupných kritérií krvácania, anti-FXa aktivita v predšpecifikovanej počiatočnej hodnote ≥ 75 ng/ml anti-FXa aktivity, anti-FXa aktivita po počiatočnom stave a výsledky hemostatickej účinnosti. Pre populáciu účinnosti bom medián zníženia anti-FXa aktivity z počiatočného stavu na najnižšiu hodnotu (nadir) pozorovaný pre rivaroxaban -92,0 % (95 % IS -94,1 %, -88,0%) a pre apixaban -93,1 %
(95 % IS -94,2 %, -91,6%). Zo 167 pacientov s vyhodnotiteľnou účinnosťou bolo 159 pacientov
vyhodnotiteľných ohľadne hemostatickej účinnosti, z čoho 133 pacientov (83,6 %) sa vyhodnotilo ako majúci veľmi dobrú (113 pacientov) alebo dobrú (20 pacientov) hemostázu podľa hodnotenia komisie posudzujúcej koncové ukazovatele. Zostávajúci pacienti boli posúdení ako majúci nevyhodnotiteľnú
[n = 6] alebo zatiaľ neurčenú [n = 2] hemostatickú účinnosť). Ak sa nevyhodnotiteľné prípady považujú sa slabú/žiadnu hemostatickú účinnosť, miera účinnej hemostázy je 133/165 (80,6 %). Miery hemostatickej účinnosti boli podobné u pacientov užívajúcich apixaban a rivaroxaban a u pacientov
s GI krvácaním alebo ICH. Hemostáza bola účinná u 80,4 % pacientov vo veku > 75 rokov (74/92)
v porovnaní s 88,1 % pacientov vo veku ≤ 75 rokov (59/67).
Korelácia medzi anti-FXa aktivitou a hemostatickou účinnosťou nebola stanovená. Úmrtia
V štúdii ANNEXA-4 study z pacientov v bezpečnostnej populácii, ktorí dokončili 30-dňové sledovanie (N = 351), 54 pacientov (15,4 %) umrelo. 30-dňové miery úmrtia boli 16,2 % (37/229)
u pacientov s ICH, 12,8 % (12/94) pri GI krvácaní a 17,9 % (5/28) pri iných. 30-dňové miery úmrtia boli 20,1 % (44/219) u pacientov vo veku > 75 rokov a 7,6 % (10/132) u pacientov vo veku
≤ 75 rokov. Podľa regiónu boli miery úmrtia 22,1 % (31/140) u pacientov zaradených do štúdie
v Európskej únii a 10,9 % (23/211) u pacientov zaradených do štúdie v severnej Amerike.
V porovnaní s pacientami zaradenými v severnej Amerike boli pacienti v EÚ výrazne starší
(79,0 rokov oproti 76,3 rokom), mali častejšie zaznamenanú udalosť ICH (72,9 % oproti 59,0 %)'
a viacej ICH bolo intraparenchymálnych (54,9 % oproti 34,4 %). Kardiovaskulárne príčiny úmrtia (n = 27) zahŕňali: hemoragickú mŕtvicu (n = 6), ischemickú mŕtvicu (n = 5), náhle srdcové úmrtie (vrátane príhod bez svedkov) (n = 5), kardiomechanické zlyhanie/zlyhanie pumpy (n = 4), infarkt myokardu (n = 2), krvácanie iné ako hemoragická mŕtvica (n = 1) a iné kardiovaskulárne príčiny
(n = 4). Iné ako kardiovaskulárne úmrtia (n = 27) zahŕňali: zlyhanie dýchania (n = 5), infekcia/sepsa
(n = 5), úraz/trauma (n = 2), nádorové ochorenia (n = 1) a ďalšie iné ako kardiovaskulárne príčiny
(n = 14).
Tromboembolicképríhody
V štúdii ANNEXA-4 36 (10,3 %) sa u pacientov vyskytlo celkom 42 tromboembolických príhod: cerebrovaskulárna príhoda (CVA) (15/42; 35,7 %), hlboká žilová trombóza (13/42; 33,1 %), akútny infarkt myokardu (8/42; 19,0 %), pľúcna embólia (5/42; 11,9 %) a prechodný ischemický atak (1/42;
2,4 %). Medián času do výskytu príhody bol deväť dní. U celkovo 33,3 % pacientov
s tromboembolickými príhodami (12/36) sa tromboembolické príhody vyskytli počas prvých troch dní. Z 209 pacientov, ktorým sa pred výskytom trombotickej príhody opätovne podala antikoagulačná liečba, sa u 10 (4,8 %) pacientov vyskytla tromboembolická príhoda. V čase výskytu príhody užívalo
10/36 (27,8 %) pacientov antitrombotickú liečbu. Výskyt tromboembolických príhod bol vo
všeobecnosti porovnateľný medzi pacientami vo veku > 75 rokov (11,0 %: 24/219) a vo veku
≤ 75 rokov (9,1 %: 12/132).
U 223 zdravých dobrovoľníkov, ktorí dostávali inhibítory FXa a boli liečení andexanetom alfa, sa nepozorovali žiadne tromboembolické príhody. Pozorovali sa zvýšenia koagulačných markerov F1+2, TAT a D-dimérov závislé od dávky, tieto markery sa však nemerali u pacientov zahrnutých do štúdie ANNEXA-4 a ich význam u krvácajúcich pacientov nie je známy.
Imunogenita
345 zdravých osôb, ktorým sa podával andexanet alfa, sa testovalo na prítomnosť protilátok krížovo účinkujúcich s andexanetom alfa a protilátok proti faktoru X a FXa. U približne 10 % (35%345) sa zistili neneutralizujúce protilátky proti andexanetu alfa, ktoré vznikli počas liečby. Tieto protilátky mali vo všeobecnosti nízky titer a nepozorovali sa žiadne klinické následky. Nezistili sa žiadne neutralizujúce protilátky ani protilátky proti faktoru X alebo FXa. Do dnešného dňa bol výskyt pozitívnych neneutralizujúcich protilátok proti andexanetu alfa po liečbe u pacientov v štúdii ANNEXA-4 (8,5 % alebo 20/236 pacientov) podobný ako u zdravých osôb.
Pediatrickápopulácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s andexanetom alfa v jednej alebo vo viacerých podskupinách pediatrickej populácie pre liečbu a prevenciu krvácania spojeného s inhibítormi FXa (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Podmienečné schválenie
Tento liek bol registrovaný s tzv. podmienkou. To znamená, že sa očakávajú ďalšie údaje o tomto lieku. Európska agentúra pre lieky najmenej raz ročne posúdi nové informácie o tomto lieku a tento súhrn charakteristických vlastností lieku bude podľa potreby aktualizovať.
5.2 Farmakokinetické vlastnosti
Štúdie fázy II s andexanetom alfa v prítomnosti priamych inhibítorov FXa preukázali rovnaké farmakokinetické vlastnosti závislé od dávky v rámci cieleného terapeutického rozsahu dávok pre obe hodnoty Cmax aj plochu pod krivkou (AUC) s účinným polčasom približne jednej hodiny. Distribučný objem v ustálenom stave (Vdss) a distribučný objem (Vd) pri subterapeutických hladinách sa znižuje
s dávkou, čo je v súlade s nasýtením časti s vysokou afinitou a pravdepodobne odzrkadľuje väzbu na
TFPI naviazaný na endotelové bunky, jedinú endogénnu molekulu so známou väzbou na andexanet alfa. Inhibítory FXa nemali pri terapeutických hladinách žiadny účinok na farmakokinetické vlastnosti andexanetu alfa.
Všetky farmakokinetické štúdie boli vykonané použitím predchádzajúcej generácie látky lieku. Farmakokinetická porovnateľnosť s andexanetom alfa v lieku Ondexxya (2. generácia) nebola doteraz dokázaná.
Distribúcia
Vd andexanetu alfa je 5,3 ± 2,6 l, čo približne zodpovedá objemu krvi.
E
li
m
i
nácia
Klírens (l/h) andexanetu alfa je 4,4 ± 1,2 l/h s nízkym podielom eliminácie obličkami. Polčas eliminácie je v rozsahu od štyroch do siedmich hodín. Na základe poznatkov o dispozičnej kinetike prirodzeného FXa je pre andexanet alfa pravdepodobné, že sa rýchlo rozkladá v plazme prostredníctvom endogénnych proteáz, čo je v súlade s jeho relatívne krátkym účinným polčasom (jedna hodina).
Farmakokinetika v osobitných skupináchpacientov
Staršieosoby
V štúdii porovnávajúcej farmakokinetické vlastnosti andexanetu alfa u starších (65 - 69 rokov)
a mladších (26 - 42 rokov) zdravých osôb, ktorí dostávali apixaban, neboli farmakokinetické vlastnosti andexanetu alfa u starších osôb v porovnaní s mladšími osobami štatisticky rozdielne.
Poruchafunkcieobličiek
Nevykonali sa žiadne skúšania na preskúmanie farmakokinetických vlastností andexanetu alfa
u pacientov s poruchou funkcie obličiek. Na základe dostupných farmakokinetických údajov má andexanet alfa malý alebo žiadny renálny klírens a preto sa u pacientov s poruchou funkcie obličiek nevyžaduje žiadna úprava dávky.
Poruchafunkciepečene
Nevykonali sa žiadne skúšania na preskúmanie farmakokinetických vlastností andexanetu alfa
u pacientov s poruchou funkcie pečene. Eliminácia terapeutických proteínov žlčou a/alebo stolicou nie je známou cestou eliminácie proteínov. Preto sa úprava dávky u pacientov s poruchou funkcie pečene
nepovažuje sa potrebnú.
Pohlavie
Na základe populačnej farmakokinetickej analýzy nemá pohlavie žiadny klinicky významný účinok na farmakokinetické vlastnosti andexanetu alfa.
Pediatrickápopulácia
Farmakokinetické vlastnosti andexanetu alfa sa neskúmali u pediatrických pacientov.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti a toxicity po opakovanom podávaní na potkanoch a opiciach trvajúcich až dva týždne neodhalili žiadne osobitné riziko pre ľudí.
Nevykonali sa štúdie na vyhodnotenie mutagénneho a karcinogénneho potenciálu andexanetu alfa. Na základe mechanizmu účinku a charakteristík proteínov sa neočakávajú žiadne karcinogénne ani genotoxické účinky.
S andexanetom alfa sa nevykonali žiadne reprodukčné a vývojové štúdie na zvieratách.
6. FARMACEUTICKÉ ÚDAJE
6.1 Zoznam pomocných látok
Tris, báza
Tris, hydrochlorid
L- arginíniumchlorid sacharóza
manitol
polysorbát 80
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
Injekčnáliekovka(neotvorená)
Dva roky, uchovávaná pri teplote 2 °C až 8 °C.
Rekonštituovanýliek
Chemická a fyzikálna stabilita počas používania bola preukázaná počas 16 hodín pri teplote 2 °C až
8 °C v primárnom balení injekčnej liekovky. Ak je to potrebné, rekonštituovaný roztok sa môže po prenesení do i.v. vaku uchovávať ďalších osem hodín pri izbovej teplote. Z mikrobiologického hľadiska sa má liek po rekonštitúcii použiť okamžite. Ak sa liek nepoužije okamžite, časy skladovania a podmienky pred použitím sú v zodpovednosti používateľa.
6.4 Špeciálne upozornenia na uchovávanie Uchovávajte v chladničke pri teplote (2 °C - 8 °C). Neuchovávajte v mrazničke.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Prášok v 20 ml injekčnej liekovke (sklo typu I) so zátkou (butylová guma). Veľkosť balenia štyri injekčné liekovky
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Rekonštitúcia
Pred začatím rekonštitúcie sú potrebné nasledujúce pomôcky:
• Vypočítané množstvo injekčných liekoviek (pozri časť 4.2).
• Rovnaký počet 20 ml (alebo väčších) striekačiek na rozpúšťadlo s ihlou veľkosti 20 gauge
(alebo väčšou).
• Alkoholové tampóny.
• Veľké (60 ml alebo väčšie) sterilné striekačky. Pri podávaní pomocou striekačkovej pumpy sa má na dosiahnutie konečného objemu rekonštituovaného lieku použiť niekoľko striekačiek.
• Intravenózny PO alebo PVC vak (150 ml alebo väčší) na konečný objem rekonštituovaného lieku (pri podávaní pomocou i.v. vaku).
• Voda na injekcie.
Andexanet alfa sa pred rekonštitúciou alebo podaním pacientov nemusí zohriať na izbovú teplotu. Pri rekonštitúcii sa má používať sterilný postup.
Každá injekčná liekovka sa má rekonštituovať podľa nasledujúcich pokynov:
1. Z injekčnej liekovky odstráňte odklápacie viečko.
2. Utrite gumovú zátku každej injekčnej liekovky alkoholovým tampónom.
3. Použitím 20 ml (alebo väčšej) striekačky a ihly veľkosti 20 gauge (alebo väčšej) odoberte
20 ml vody na injekcie.
4. Zasuňte ihlu striekačky cez stred gumovej zátky.
5. Stlačte piest nadol a pomaly vstreknite 20 ml vody na injekcie do injekčnej liekovky, pričom prúd nasmerujte na stranu steny injekčnej liekovky, aby sa minimalizovala tvorba peny.
6. Jemne krúžte každou injekčnou liekovkou, až kým sa prášok úplne nerozpustí. Injekčnými
liekovkami NETRASTE, pretože to môže spôsobiť spenenie. Čas rozpustenia je pre každú injekčnú liekovku približne tri až päť minút.
7. Rekonštituovaný roztok sa má pred podaním skontrolovať, či neobsahuje pevné častice
a/alebo nie je sfarbený. Nepoužívajte ho, ak sú prítomné nepriehľadné častice alebo sfarbenie.
8. Na najúčinnejšiu rekonštitúciu potrebnej dávky a minimalizovanie chýb vstreknite do každej potrebnej injekčnej liekovky 20 ml vody na injekcie predtým, ako budete pokračovať ďalším
krokom.
9. Pri uchovávaní pri izbovej teplote použite do ôsmich hodín po rekonštitúcii.
Podávanie pomocou striekačkovejpumpy
1. Keď sú všetky potrebné injekčné liekovky rekonštituované, rekonštituovaný roztok sa
z každej injekčnej liekovky vytiahne použitím striekačky s veľkým objemom (60 ml alebo väčšej) s ihlou veľkosti 20 gauge (alebo väčšej).
2. Bolus a infúzia sa pripravia v oddelených striekačkách s veľkým objemom.
3. Kvôli dodatočnému objemu sa musia bolus a infúzia vysokej dávky ďalej rozdeliť do dodatočných striekačiek (dve striekačky pre bolus a infúziu).
4. Aby sa zabránilo neúmyselnému prenosu vzduchu, dbajte na to, aby ste držali ihlu striekačky smerom nahor a striekačku medzi viacerými odbermi z injekčných liekoviek nepoložili.
5. Pripojte pomocné zariadenie (t.j. predlžovaciu hadičku, vzduchové filtre, striekačkovú pumpu)
na prípravu podania.
6. Podajte rekonštituovaný roztok primeranou rýchlosťou.
7. Zlikvidujte všetky striekačky, ihly a injekčné liekovky, vrátane všetkých nepoužitých častí rekonštituovaného roztoku.
Podávanie pomocou intravenóznehovaku
1. Keď sú všetky potrebné injekčné liekovky rekonštituované, odoberte rekonštituovaný roztok
z každej injekčnej liekovky použitím striekačky s veľkým objemom (60 ml alebo väčšej)
s ihlou veľkosti 20 gauge (alebo väčšou).
2. Preneste rekonštituovaný roztok zo striekačky do vhodného intravenózneho vaku.
3. Podľa potreby zopakujte kroky 1 a 2, aby ste preniesli celý objem bolusu a infúzie do i.v. vaku.
4. Aj keď je povolené kombinovať bolus a infúziu v jednom i.v. vaku, odporúča sa, aby sa bolus
a infúzia rozdelili do dvoch oddelených vakov na zabezpečenie správnej rýchlosti podávania.
5. Pripojte pomocné zariadenie (t.j. predlžovaciu hadičku, vzduchové filtre, i.v. pumpu) na prípravu podania.
6. Podajte rekonštituovaný roztok primeranou rýchlosťou.
Likvidácia
Všetky použité striekačky, ihly a injekčné liekovky, vrátane všetkých častí nepoužitého rekonštituovaného roztoku, sa majú zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Portola Netherlands B.V. Prins Bernhardplein 200
1097 JB Amsterdam
Holandsko
8. REGISTRAČNÉ ČÍSLO
EU/1/18/1345/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 26 Apríl 2019
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.