mg pomalou intravenóznou injekciou alebo ako krátkodobá intravenózna infúzia počas 15 minút bezprostredne pred chemoterapiou, po ktorej nasledujú ďalšie dve intravenózne dávky 8 mg s odstupom dve až štyri hodiny, alebo trvalá infúzia 1 mg/hodinu po dobu až 24 hodín.
· Jediná dávka 32 mg prípravku zriedeného 50-100 ml roztoku chloridu sodného 9 mg/ml (0.9 % w/v) alebo iná kompatibilná kvapalná infúzia (pozri kompatibilitu s roztokmi používanými na infúziu v časti 6.6) podaná počas nie menej ako 15 minút bezprostredne pred chemoterapiou.
Dávky ondansetronu väčšie než 8 mg až do 32 mg sa môžu podávať iba intravenóznou infúziou po dobu minimálne 15 minút.
Dávkovacia schéma sa má určovať podľa stupňa schopnosti konkrétnych liečiv vyvolávať dávenie.
Účinnosť ondansetronu pri chemoterapii, ktorá vyvoláva dávenie , sa môže zvýšiť pridaním jednej intravenóznej 20 mg dávky dexametazónu fosforečnanu sodného podanej pred chemoterapiou.
Na ochranu proti oneskorenému alebo dlhodobému dáveniu po liečebnej kúre má liečba prípravkom ondansetron pokračovať tak, že sa bude podávať inak než intravenózne.
Pediatrická populáciaCINV u detí vo veku ≥ 6 mesiacov a adolescentov
Dávka u CINV môže byť vypočítaná podľa telesného povrchu (BSA) alebo telesnej hmotnosti; viď nižšie. Dávky odvodené od hmotnosti vedú k vyšším celkovým denným dávkam v porovnaní s dávkami odvedenými od povrchu tela. (bod 4.4 a 5.1)
Injekcie ondansetronu sa majú riediť 5% glukózou alebo 0,9% NaCl alebo iným kompatibilným infúznym roztokom (viď bod 6.6) a majú byť podané intravenózne po dobu minimálne 15 minút. Nie sú k dispozícii žiadne údaje kontrolovaných klinických skúšok o použití prípravku ondansetron v prevencii oneskoreného alebo dlhotrvajceho CINV. Nie sú k dipozícii žiadne údaje z klinických skúšaní použitia prípravku ondansetron pri CINV u detí.
Dávkovanie podľa veľkosti povrchu tela (BSA)
Ondansetron sa podáva ako jednotlivá intravenózna dávka 5mg/m² bezprostredne pred chemoterapiou. Intravenózna dávka nesmie prekročiť 8mg.
Perorálne dávkovanie može začať po 12 hodinách a môže pokračovať až 5 dní.(tab. 1)
Celková denná dávka nesmie prekročit dávku pre dospelých tj. 32 mg
Tab.1: Dávkovanie pri chemoterapii odvodené od povrchu tela – pre deti vo veku ≥ 6 mesiacov a adolescentov.
BSA
| Deň 1(a,b)
| Dni 2-6(b)
|
< 0.6 m2
| 5 mg/m2 i.v. + 2 mg perorálneho roztoku po 12 hod
| 2 mg perorálneho roztoku každých 12 hod
|
≥ 0.6 m2
| 5 mg/m2 i.v. + 4 mg perorálneho roztoku alebo tabliet po 12 hod
| 4 mg perorálneho roztoku alebo tabliet každých 12 hod
|
a) Intravenózna dávka nesmie prekročiť 8 mg
a)b) Celková denná dávka nesmie prekročiť dávku pre dospelých tj. 32 mg
Dávkovanie podľa telesnej hmotnosti
Dávkovanie odvodené od telesnej hmotnosti vedie k vyšším denním dávkam v porovnaní s dávkovaním odvodeným od BSA (viď bod 4.4 a 5.1)
Ondansetron sa podáva ako jednotlivá intravenózna dávka 0,15mg/kg bezprostredne pred chemoterapiou. Intravenózna dávka nesmie prekročiť 8mg. Dve ďaľšie intravenózne dávky majú byť podané v 4 hodinových intervaloch. Celková denná dávka nesmie prekročiť maximálnu dávku pre dospelých tj. 32 mg.
Perorálne dávkovanie môže začať po 12 hodinách a môže pokračovať až 5 dní. (tab. 2)
Tab.2: Dávkovanie pri chemoterapii odvodené od telesnej hmotnosti - pre deti vo veku ≥ 6 mesiacov a adolescentov.
Telesná hmotnosť
| Den 1 (a,b)
| Dny 2-6(b)
|
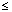 10 kg 10 kg
| až 3 dávky 0.15 mg/kg každé
4 hodiny
| 2 mg perorálneho roztoku každých 12 hod
|
> 10 kg
| až 3 dávky 0.15 mg/kg každé
4 hodiny
| 4 mg perorálneho roztoku nebo tabliet každých 12 hod
|
a) Intravenózna dávka nesmie prekročiť 8 mg
a)b) Celková denná dávka nesmie prekročiť dávku pre dospelých tj. 32 mg
Starší pacientiPacienti vo veku nad 65 rokov ondansetron znášajú dobre a nie je potrebná žiadna úprava dávkovania, frekvencie podávania alebo spôsobu podávania.
Pozrite sa prosím v časti “Špecifické populácie”.
Pooperačná nauzea a dávenie (POND)Prevencia PONDDospelí: Akoprevenciu POND sa môže ondansetron podávať intravenóznou injekciou alebo v inej forme.
Ondansetron sa môže aplikovať ako jediná dávka 4 mg podávaná pomalou intravenóznou injekciou pri zavádzaní anestézie.
Liečba už rozvinutej PONDNa liečbu už rozvinutej POND sa odporúča jediná 4 mg dávka podávaná pomalou intravenóznou injekciou.
Pediatrická populáciaPOND u detí vo veku ≥ 1 mesiac a adolescentiK prevencii POND u detí, ktoré podstupujú chirurgický výkon v celkovej anestézii, sa podáva jednotlivá dávka ondansetronu pomalou intravenóznou injekciou (nejmenej po dobu 30 sekúnd) v dávke 0,1 mg/kg až do maxima 4mg, buď pred, počas alebo po zavedení anestézie.
K liečbe POND u detí ktoré podstúpili operáciu v celkovej anestézii sa podáva po operácii jednotlivá dávka ondansetronu pomalou intravenóznou injekciou (nejmenej po dobu 30 sekúnd) v dávke 0,1 mg/kg až do maxima 4mg. O používaní lieku ondansetron k liečbe POND u detí do 2 rokov nie sú žiadne údaje.
Starší pacientiK dispozícii sú iba obmedzené údaje týkajúce sa použitia ondansetronu pri prevencii a liečbe pooperačnej nauzey a dávenia (POND) u starších pacientov, hoci pacienti vo veku nad 65 rokov, ktorí dostávajú chemoterapiu, znášajú ondansetron dobre.
Pozrite sa v časti “Špecifické populácie”.
Špecifické populácie Pacienti s poškodenými obličkamiNie je potrebná žiadna úprava dávkovania, frekvencie podávania alebo spôsobu aplikácie.
Pacienti s poškodením pečeneU pacientov so stredne ťažkým alebo ťažkým poškodením pečene je odbúravanie ondansetronu výrazne znížené a polčas odbúravania séra výrazne predĺžený. U takýchto pacientov nemá celková denná dávka prekročiť 8 mg.
Pacienti s nedostatočným metabolizmom sparteínu/debrizochínu Polčas odbúravania ondansetronu sa u pacientov s nedostatočným metabolizmom sparteínu
/debrizochínu nemení. Preto u takýchto pacientov opakované dávkovanie spôsobuje rovnaký prejav lieku ako u celkovej populácie. Nie je potrebná žiadna úprava dennej dávky alebo frekvencie podávania.
4.3 KontraindikáciePrecitlivenosť na ondansetron alebo na iných selektívnych antagonistov 5-HT3-receptorov (napr. granisetron, dolasetron), alebo na akékoľvek pomocné látky.
4.4 Osobitné upozornenia a opatrenia pri používaníPrecitlivelé reakcie sa zaznamenali u pacientov, ktorí boli precitlivelí na iných selektívnych antagonistov 5-HT3-receptorov.
Keďže je známe, že Ondansetron zvyšuje trávenie potravy hrubým črevom, pacientov s príznakmi subakútnej črevnej zápchy je treba po jeho podaní sledovať.
Keďže doteraz je málo skúseností s používaním Ondanstronu u pacientov s ochorením srdca, je potrebná opatrnosť pri podávaní Ondansetronu spolu s anestetikami u pacientov s arytmiou alebo s poruchami vodivého systému srdca alebo u pacientov, ktorí boli liečení na srdcovú arytmiu alebo beta-blokátormi.
Veľmi zriedkavo a hlavne pri intravenóznom podávaní Ondansetronu boli hlásené dočasné zmeny EKG, vrátane predĺženia QT intervalu. Doporučuje sa opatrnosť, ak pacienti dostali kardiotoxické prípravky a u pacientov s anamnézou alebo rodinnou anamnézou predĺženia QT intervalu.
U pacientov po chirurgickom vybratí mandlí, u ktorých sa podáva ondansetron ako prevencia proti nauzey a dávenia, môže zakrývať skryté krvácanie. Preto majú byť takýto pacienti po podaní Ondansetronu pozorne sledovaní.
Pediatrická populáciaDeti, ktoré dostávajú ondansetron spolu s hepatotoxicky pôsobiacimi chemoterapeutikami, je treba dôsledne sledovať, či nedochádza k poškodeniu pečeňových funkcií.
CINV
Keď sa vypočítava dávka v mg/kg telesnej hmotnosti a dávky sa podávajú v 4-hodinových intervaloch, celková denná dávka bude vyššia ako pri podaní jednotlivej dávky 5mg/m² s následnou perorálnou dávkou. Zrovnanie účinnosti týchto dvoch dávkovacích režimov nebolo predmetom klinického skúšania. Porovnaním prevedených klinických skúšaní sa ukazuje podobná účinnosť oboch režimov. (viď bod 5.1)
Tento liek obsahuje 2.3 mmol (alebo 53.5 mg) sodíka v 32 mg dávke lieku. To je treba brať do úvahy u pacientov, ktorí musia dodržiavať diétu s kontrolovaným príjmom sodíka.
4.5 Liekové a iné interakcieÚčinky prípravku Ondansetron na iné lieky Neexistuje dôkaz, že by Ondansetron indukoval alebo inhiboval metabolizmus iných liekov, ktoré sa bežne podávajú spolu s ním. Interakčné štúdie ukázali, že Ondansetron a alkohol, Temazepam, Furosemid, Alfentanil, Propofol a lieky typu tiopentadov sa vzájomne neovplyvňujú .
TramadolÚdaje získané zo štúdií naznačujú, že Ondansetron by mohol znižovať analgetický účinok Tramadolu.
Účinky iných liekov na OndansetronOndansetron sa metabolizuje za pomoci početných pečeňových enzýmov - cytochrómov P-450: CYP3A4, CYP2D6 a CYP1A2. Vďaka početnosti metabolických enzýmov schopných metabolizovať Ondansetron sa inhibícia alebo znížená aktivita jedného enzýmu (napr. geneticky podmienený nedostatok enzýmu CYP2D6) za normálnych okolností kompenzuje inými enzýmami a spôsobuje málo významnú alebo úplne bezvýznamnú zmenu v celkovom odbúravaní Ondansetronu alebo v požiadavkách na dávkovanie.
Fenytoín, Karbamazepín a Rifampicín: U pacientov liečených liekmi, ktoré silne indukujú CYP3A4 (napr. Fenytoín, Karbamazepín a Rifampicín) bolo zistené zvýšené perorálne odbúravanie Ondansetronu a znížená koncentrácia Ondansetronu v krvi.
4.6 Gravidita a laktácia Tehotenstvo:Nie sú k dispozícii dostatočné údaje o použití Ondansetronu u gravídnych žien.
Štúdie na zvieratách nepreukázali priame alebo nepriame údaje o škodlivých účinkoch na vývoj embrya alebo plodu, priebeh gravidity a perinatálny a postnatálny vývin.
Štúdie na zvieratách neposkytujú dostatok údajov na ľudský organizmus. Používanie lieku Ondansetron v tehotenstve sa preto nedoporučuje.
Testy ukázali, že Ondansetron prechádza do materského mlieka zvierat v laktácii (pozri časť 5.3). Preto sa odporúča, aby matky, ktoré dostávajú Ondansetron svoje deti nedojčili.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje Ondansetron v dávke 2 mg/ml nemá žiadny alebo iba zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
veľmi časté: ≥1/10;
časté: ≥1/100, <1/10;
menej časté: ≥1/1,000, <1/100;
zriedkavé: ≥1/10,000, <1/1,000;
veľmi zriedkavé: <1/10,000 a neznáme ( z dostupných údajov)
Poruchy funkcie imunitného systémuZriedkavé: Okamžité precitlivelé reakcie, niekedy vážne, vrátane anafylaxie. Anafylaxia môže byť smrteľná.
Precitlivelé reakcie boli pozorované u pacientov, ktorí boli citliví na iných selektívnych antagonistov 5-HT3-receptorov.
Poruchy funkcie nervového systému Veľmi časté: Bolesti hlavy
Menej časté: Vyskytli sa poruchy koordinácie pohybov ako napríklad extrapyramidálne reakcie, napr. okulogýrna kríza/dystonické reakcie a dyskinéza bez definitívneho dôkazu trvalých klinických následkov a záchvatov (napr. epileptických kŕčov), hoci na základe žiadnych známych farmakologických mechanizmov nemožno považovať za príčinu týchto účinkov Ondansetron.
Zriedkavé: Závraty počas rýchleho intravenózneho podávania.
Veľmi zriedkavé: Depresia.
Oftalmické poruchyZriedkavé: Dočasné poruchy videnia (napr. rozostreté videnie) počas rýchleho intravenózneho podávania.
Veľmi zriedkavé: Vo zvláštnych prípadoch bola hlásená dočasná slepota u pacientov, ktorí dostávali chemoterapeutické prípravky obsahujúce cisplatin. Väčšina hlásených prípadov odznela počas 20 minút.
Poruchy činnosti srdcaMenej časté: Bolesť v hrudníku sprevádzaná poklesom ST alebo bez poklesu, srdcová arytmia a bradykardia. Bolesť v hrudníku a srdcová arytmia môžu byť v osobitných prípadoch smrteľné.
Veľmi zriedkavé: Dočasné zmeny elektrokardiogramu, vrátane predĺženia intervalu QT boli pozorované hlavne po intravenóznej aplikácii Ondansetronu.
Cievne poruchyČasté: Pocity horúčavy alebo tepla.
Menej časté: Hypotenzia.
Poruchy dýchania, poruchy v oblasti hrudníka a mediastína Menej časté: Štikútka.
Gastrointestinále poruchyČasté: Je známe, že Ondansetron zvyšuje čas prechodu potravy hrubým črevom a u niektorých pacientov môže spôsobiť zápchu.
Poruchy funkcie pečene a tvorby žlčeMenej časté: V testoch funkcie pečene bolo pozorované asymptomatické zvýšenie. Tieto reakcie boli často pozorované u pacientov na chemoterapii, ktorá obsahovala cisplatin.
Poruchy kože a podkožného tkaniva Menej časté: Môžu sa objaviť precitlivelé reakcie okolo miesta vpichu injekcie (napr. vyrážka, žihľavka, svrbenie), niekedy sa rozširujú pozdĺž žily, do ktorej sa aplikoval liek.
Celkové poruchy a stav miesta aplikácie Časté: Lokálne reakcie na mieste intravenóznej injekčnej aplikácie.
Pediatrická populácia
Profil nežiadúcich účinkov u detí a adolescentov je zrovnateľný s profilom u dospelých.
4.9 PredávkovanieO predávkovaní Ondansetronom vieme doteraz iba málo, iba málo pacientov však dostalo nadmerné dávky tohto lieku. Hlásené prejavy zahŕňali poruchy videnia, vážnu zápchu, hypotenziu a vazovagálnu príhodu s prechodným AV blokom druhého stupňa. Vo všetkých prípadoch príznaky úplne odzneli. Proti Ondansetronu neexistuje žiadna špecifická protilátka, preto sa má vo všetkých prípadoch, kde je podozrenie na predávkovanie, použiť primeraná symptomatická alebo podporná liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antiemetiká a lieky proti nauzey, antagonisti serotonínu (5HT
3)
ATC kód: A04AA01
Ondansetron je silný, vysoko selektívny antagonista 5HT
3 receptorov.
Presný mechanizmus jeho účinku pri kontrole nauzey a dávenia nie je známy. Chemoterapeutické prostriedky a rádioterapia môžu spôsobiť 5HT v tenkom čreve, čo vyvoláva dáviaci reflex tým, že aktivuje prenosy vzruchov blúdivým nervom cez 5HT
3 receptory. Ondansetron blokuje podnet, ktorý vyvoláva tento reflex. Aktivácia prenosu vzruchov blúdivým nervom môže spôsobiť aj uvoľnenie 5HT v časti mozgu area postrema (dno IV. mozgovej komory), ktorá sa nachádza na spodnej časti štvrtej mozgovej komory, čo môže centrálnym mechanizmom podnecovať dávenie. Teda účinok lieku Ondansetron pri liečbe nauzey a dávenia cytotoxickou chemoterapiou a rádioterapiou je pravdepodobne spôsobený antagonizmom 5HT
3 receptorov voči neurónom nachádzajúcim sa tak v periferálnom ako v centrálnom nervovom systéme. Mechanizmy účinku pri pooperatívnej nauzee a dávení nie sú známe, ale môžu mať spoločné dráhy s nauzeou a dávením, ktoré sú vyvolané cytotoxickými látkami.
Ondansetron nemení koncentráciu prolaktínu v krvnej plazme.
Úloha Ondansetronu pri dávení vyvolanom opiátmi ešte nie je preskúmaná.
Pediatrická populáciaCINV
Účinnosť ondansetronu na zvládnutie nauzey a dávenia vyvolaných protinádorovou chemoterapiou bola vyhodnotená v dvojito zaslepenom, randomizovanom klinickom skúšaní 415 pacientov vo veku od 1 do 18 rokov (S3AB3006). Počas dní chemoterapie pacienti dostali buď ondansetron 5mg/m² intravenózne + perorálne 4mg ondansetronu po 8-12 hodinách alebo ondansetron 0,45mg/kg intravenózne + placebo perorálne po 8-12 hodinách. Po skončení chemoterapie obidve skupiny dostali 4mg ondansetronu v perorálnom roztoku dva krát denne po tri dni. Počas najkritickejšieho dňa chemoterapie sa dávenie nevyskytlo u 49% (5mg/m² intravenózne + 4 mg ondansetronu perorálne) a u 41% (0,45mg/kg + placebo perorálne). Po skončení chemoterapie obidve skupiny dostali 4mg ondansetronu v perorálnom roztoku dva krát denne po tri dni.
Dvojito zaslepené, randomizované, placebom kontrolované klinické skúšanie (S3AB4003) u 438 pacientov vo veku od 1 do 17 rokov preukázalo kompletné potlačenie dávenia v najkritickejšom dni chemoterapie u
- 73% pacientov, ktorým bol ondansetron podaný intravenózne v dávke 5mg/m² spolu s 2-4 mg dexamethazónu perorálne.
- 71% pacientov, ktorým bol v dňoch chematerapie podaný odnansetron vo forme perorálneho roztoku v dávke 8 mg + 2-4mg dexamethazónu.
Po chemoterapii obe skupiny dostávali 4 mg perorálneho roztoku ondansetronu dva krát denne po dva dni.
Účinnosť ondansetronu u 75 detí vo veku 6-48 mesiacov bola skúmaná v otvorenom, neporovávacom klinickom skúšaní v jednej vetve (S3A40320). Všetky deti dostávali tri intravenózne dávky 0,15mg/kg podané 30 minút pred záhajením chemoterapie a následne za 4 a 8 hodín od prvej dávky.
Kompletná kontrola dávenia bola dosiahnutá u 56% pacientov.
Iné otvorené, neporovnávacie klinické skúšanie s jednou vetvou (S3A239) skúmalo účinnosť jednej intravenóznej dávky 0,15mg/kg ondansetronu, po ktorej nasledovali dve perorálne dávky ondasetronu 4 mg u detí vo veku < 12 rokov a 8 mg vo veku ≥ 12 rokov (celkový počet detí n=28). Kompletná kontrola dávenia bola dosiahnutá u 42% pacientov.
PONZ
Účinnost jednotlivej dávky v prevencii pooperačnej neuzey a zvracania bola sledovaná v randomizovanom, dvojito zaslepenom, placebom kontrolovanom klinickom skúšaní u 670 detí vo veku 1-24 mesiacov (vek teoretický ≥ 44 týždňov, hmotnosť ≥ 3 kg). Zahrňovalo pacientov s ASA ≤ III, u ktorých bola plánovaná operácia v celkovej narkóze. Jednotlivá dávka ondansetronu 0,1mg/kg bola podávaná po dobu 5 minút následne po úvode do anestézie. Podiel tých ktorý mali aspoň jednu epizódu zvracania počas 24 hodinového hodnoteného obdobia bol vyšší u tých, čo dostali placebo ako u tých, ktorým bol podaný ondansetron (28% vs. 11%, p < 0,0001).
Štyri dvojito zaslepené, placebom kontrolované klinické skúšania boli prevedené na 1469 pacientoch oboch pohlaví, ktorí sa podrobili celkovej anestézii (vo veku 2-12 rokov). Pacienti boli randomizovaný do skupín – buď s jednotlivou dávkou ondansetronu (0,1mg/kg pre pediatrických pacientov o hmotnosti ≤ 40kg, 4 mg pre pediatrických pacientov s hmotnosťou viac ako 40 kg, počet pacientov n=735) alebo s placebom (počet pacientov n=734). Hodnotené liečivo bolo podávané po dobu dlhšiu ako 30 sekúnd bezprostredne pred alebo po úvode do anestézie. V prevencii nauzey a dávenia bol ondansetron signifikantne účinnejší ako placebo. Prehľad výsledkov je uvedený v tabuľke 3.
Tab. 3: Prevencia a liečba PONZ u pediatrických pacientov – odpoveď na liečbu.
Štúdia
| Cielová hodnota
| Ondansetron %
| Placebo %
| p hodnota
|
S3A380
| CR
| 68
| 39
| 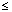 0,001 0,001
|
S3GT09
| CR
| 61
| 35
| 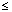 0,001' 0,001'
|
S3A381
| CR
| 53
| 17
| 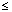 0,001 0,001
|
S3GT11
| žiadna nauzea
| 64
| 51
| 0,004
|
S3GT11
| žiadne dávenie
| 60
| 47
| 0,004
|
CR= žiadne epizódy dávenia, zotavenie alebo ukončenie
5.2 Farmakokinetické vlastnostiFarmakokinetické vlastnosti Ondansetronu sa pri opakovaných dávkach nemenia.
Nebola zistená priama korelácia koncentrácie v krvnej plazme a antiemetického účinku.
AbsorpciaPo perorálnom podávaní sa Ondansetron pasívne a kompletne absorbuje z gastrointestinálneho traktu a prechádza prvou metabolickou zmenou (jeho využiteľnosť pre organizmus je približne 60 %). Najvyššie koncentrácie v krvnej plazme – okolo 30 ng/ml - sa dosahuje približne 1,5 hodiny po podaní 8 mg dávky. Pri dávkach vyšších než 8 mg narastajú systémové prejavy Ondansetronu rýchlejšie než by bolo úmerné zvýšenému množstvu; môže to odrážať zníženie počas prvej metabolickej zmeny pri vyšších dávkach podávaných perorálne. Po perorálnom podaní sa jeho využiteľnosť pre organizmus mierne zlepšuje za prítomnosti potravy, ale antacidá ju neovplyvňujú.
Intravenózna infúzia 4 mg ondansetronu podaná počas 5 minút vedie k maximálnej plazmatickej koncentrácii 65 ng/ml. Po intramuskulárnom podaní ondansetronu je maximálna plazmatická koncentrácia 25 ng/ml, ktorá sa dosiahne v priebehu 10 minút po injekcii.
Distribúcia Stav Ondansetronu po perorálnej, intramuskulárnej (IM) a intravenóznej (IV) aplikácii je podobný ako pri ustálenom množstve – okolo 140 L. Rovnaký systémový prejav sa dosiahne po intramuskulárnom a intravenóznom podaní Ondansetronu.
Ondansetron nie je vo veľkej miere viazaný na proteín (70-76%).
MetabolizmusOndansetron sa odbúrava zo systémového obehu predovšetkým prostredníctvom pečene mnohými enzymatickými reakciami. Neprítomnosť enzýmu CYP2D6 (polymorfizmus
debrizochínu) neovplyvňuje farmakokinetiku Ondansetronu.
VylučovanieMenej než 5% absorbovanej dávky sa vylúči v nezmenenom stave močom. Konečný polčas rozpadu je približne 3 hodiny.
Špecifické skupinyDeti a adolescenti (vo veku 1 mesiac do 17 rokov)U pediatrických pacientov vo veku od 1 do 4 mesiace (n=19), ktorí sa podrobili chirurgickému výkonu bol klírens v pomere ku telesnej hmotnosti približne o 30% nižší ako u pacientov vo veku 5 do 24 mesiacov (n=22), ale zrovnateľný s pacientami vo veku 3-12 rokov. V populácii pacientov vo veku 1 až 4 mesiace bol nájdený premerný polčas 6,7 hodín v porovnaní s 2,9 hodinami u pacientov vo veku 5-24 mesiacov a v rozmedzí 3-12 rokov. Rozdiely vo faramkokinetických parametroch u populácie pacientov vo veku 1-4 mesiace môže byť čiastočne vysvetlený vyšším percentom vody v tele novorodencov a kojencov a vyšším distribučným objemom vo vode rozpustných liekov ako je ondansetron.U pediatrických pacientov vo veku 3 až 12 rokov, podstupujúcich plánovaný chirurgický výkon v celkovej anestézii, sú absolútne hodnoty klírensu a distribučného objemu ondansetronu znížené v porovnaní s hodnotami u dospelých jedincov. Obidva parametre sa lineárne zvyšujú s telesnou hmotnosťou a okolo 12-teho roku dosahujú hodnoty ako u mladých dospelých. V prípade že klírens a distribučný objem boli prepočítané na základe telesnej hmotnosti, dosahovali podobné hodnoty v rôznych vekových kategóriach. Dávkovanie stanovené na základe telesnej hmotnosti kompenzuje zmeny súvisiace s vekom a je u pedriatrických pacientov účinné v normalizácii systémovej expozície.Podľa parametrov populačnej farmakokinetiky by intravenózne podávanie 3 dávok 0,15 mg/kg Ondansetronu každé 4 hodiny u pacientov vo veku 1 až 48 mesiacov spôsobilo systémový prejav (AUC) porovnateľný s tým, ktorý pozorovali u pediatrických pacientov vo veku 5 až 24 mesiacov, ktorí sa podrobili chirurgickému zákroku a ktorý uvádzajú predchádzajúce pediatrické štúdie u pacientov s onkologickým ochorením (vo veku 4 až 18 rokov) a pacientov, ktorí sa podrobili chirurgickému zákroku (vo veku 3 až 12 rokov) pri aplikácii podobných dávok.
Farmakokinetická analýza populácie bola po intravenóznom podaní prevedená u 428 pacientov (onkologický pacienti, pacienti po operácii a zdravý dobrovoľníci) vo veku od 1 mesiaca do 44 rokov. Na základe tejto analýzy, systémová expozícia (AUC) ondansetronom po perorálnom alebo intravenóznom podaní u detí a adolescentov bola zrovnateľná s dospelými, s výnimkou kojencov od 1 do 4 mesiacov. Kvôli nízkemu počtu pacientov v tejto vekovej kategórii v klinickom skúšaní je náročné vyvodiť záver, či zníženie klírens bolo dané vekom dojčiat, alebo išlo o vrodenú variabilitu. Keďže pacienti vo veku do 6 mesiacov budú dostávať pri PONZ iba jednotlivú dávku, pokles klírens nebude klinicky relevantný.Staršie osobyŠtúdie vykonané na starších dobrovoľníkoch ukázali nepatrné (s vekom spojené) zvýšenie využiteľnosti pre organizmus pri perorálnom podávaní (65%) ako aj zvýšenie polčasu rozpadu (5 hodín).
Nedostatočná práca obličiekU pacientov s nedostatočnou prácou obličiek (odbúravanie kreatínínu15-60 ml/min) sa znižuje tak systemické odbúravanie ako aj objem distribúcie po intravenóznom podaní Ondansetronu, čo spôsobuje mierne, ale klinicky bezvýznamné zvýšenie polčasu odbúravania (5.4 h). Štúdia týkajúca sa pacientov s vážnou nedostatočnou prácou obličiek, ktorí potrebovali pravidelnú hemodialýzu (sledované medzi jednotlivými dialýzami) ukázala, že farmakokinetika Ondansetronu sa po intravenóznom podaní zásadne nemení.
Poruchy pečenePo perorálnom, intravenóznom alebo intramuskulárnom podávaní u pacientov s vážnou poruchou funkcie pečene sa systémové odbúravanie Ondansetronu výrazne znižuje a polčas odbúravania sa predlžuje (15-32 h). Využiteľnosť pre organizmus pri perorálnom podávaní sa zároveň približuje k hodnote 100% vďaka presystematickému metabolizmu.
Rozdiely podmienené pohlavímPri odbúravaní Ondansetronu boli zistené rozdiely podmienené pohlavím – ženy mali vyššiu mieru a rozsah absorpcie po perorálnej aplikácii a znížené systémové odbúravanie a objem distribúcie (určené podľa váhy).
5.3 Predklinické údaje o bezpečnosti Predklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
Ondansetron a jeho metabolity sa hromadili v materskom mlieku potkanov, pomer mlieko/plazma bol 5.2.
Štúdia vykonaná na naklonovaných ľudských bunkách srdcových kanálov na prenos iónov ukázali, že Ondansetron by mohol ovplyvňovať srdcovú repolarizáciu prostredníctvom zablokovania HERG kanálov draslíka. Klinická závažnosť je neistá.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokChlorid sodný
Dihydrát citranu sodného
Monohydrát kyseliny citrónovej
Voda na injekcie
6.2 InkompatibilitaTento liek sa nesmie miešať s inými liekmi, okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnostiPred prvým použitím2 roky
InjekciaPo prvom otvorení obalu sa má liek okamžite použiť
InfúziaDokázala sa chemická a fyzikálna stabilita pri používaní 48 hodín pri teplote 25°C s roztokmi uvedenými v časti 6.6.
Z mikrobiologického hľadiska sa má tento liek použiť okamžite po otvorení obalu. Ak sa nepoužije okamžite, za dobu a podmienky skladovania pred použitím je zodpovedný užívateľ a za bežných okolností by nemala prekročiť 24 hodín pri teplote 2 až 8°C, pokiaľ zriedenie prebehlo v kontrolovaných a schválených aseptických podmienkach.
Zriedené roztoky sa majú skladovať tak, aby neboli vystavené svetlu.
6.4 Špeciálne upozornenie na uchovávanie Uchovávajte vo vnútornom a vonkajšom obale na ochranu pred svetlom.
Podmienky skladovania zriedeného lieku sú uvedené v časti 6.3.
6.5 Druh obalu a obsah balenia- Typ I - ampule z čistého skla, objem 2 ml alebo 4 ml
Veľkosti balenia: 5 x 2 ml, 10 x 2 ml
5 x 4 ml, 10 x 4 ml
- Polyetylénové ampule (LDPE), objem 4 ml
Veľkosti balenia: 20 x 4 ml
Polyetylénové ampule sú špeciálne určené aby pasovali na Luer lock a Luer fit striekačky
Nie všetky veľkosti balenia musia byť uvedené do obehu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomPred použitím treba roztok vizuálne skontrolovať (tak isto po riedení). Majú sa používať iba číre roztoky bez zákalu.
Všetky nepoužité lieky alebo odpad vzniknutý z liekov majú byť zlikvidované v súlade s miestnymi požiadavkami.
Ondansetron v množstve 2 mg/ml sa môže riediť nasledujúcimi roztokmi určenými pre infúzie na koncentrácie Ondansetronu, ktoré sú uvedené v časti 4.2:
roztok chloridu sodného 9 mg/ml (0.9 % w/v)
roztok glukózy 50 mg/ml (5 % w/v)
roztok manitolu 100 mg/ml (10 % w/v)
Ringerov lactát
Uchovávajte zriedené roztoky chránené pred svetlom.
Poznámka:
Roztok pre injekčnú aplikáciu sa nemusí sterilizovať v autokláve!
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIB.Braun Melsungen AG
Carl-Braun-Strasse 1 Poštová adresa:
34212 Melsungen, Nemecko 34209 Melsungen, Nemecko
Tel.: +49/5661/71-0
Fax: +49/5661/71-4567
8. REGISTRAČNÉ ČÍSLO20/0255/07-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIE REGISTRÁCIE16.7.2007
10. DÁTUM REVÍZIE textU 11/2011