
iek Omidria sa musí pred použitím zriediť na 500 ml irigačného roztoku. Pokyny na riedenie, pozri časť 6.6.
Irigačný roztok obsahujúci liek Omidria je určený na použitie počas chirurgického postupu rovnakým spôsobom ako sa používa štandardný irigačný roztok.
4.3 Kontraindikácie
Precitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Pacienti s glaukómom s úzkym uhlom.
4.4 Osobitné upozornenia a opatrenia pri používaní
Tento liek sa musí pred intraokulárnym použitím zriediť.
Liek Omidria je indikovaný ako prídavok do irigačného roztoku, ktorý sa používa len počas vnútroočných postupov na náhradu šošovky.
Liek Omidria nie je indikovaný na nezriedené použitie, intravitreálnu injekciu, všeobecné lokálne očné
použitie alebo systémové použitie mimo oka.
Bezpečnosť a účinnosť lieku Omidria neboli hodnotené u pacientov s anamnézou uveitídy a traumy
dúhovky, alebo pri použití ako antagonista alfa-adrenergických receptorov.
Pri použití lieku Omidria je potrebné vziať na vedomie tieto upozornenia a opatrenia pri používaní týkajúce sa lokálneho očného použitia fenylefrínu a ketorolaku:
Kardiovaskulárne reakcie
U pacientov používajúcich fenylefrín do očí boli hlásené prípady závažných kardiovaskulárnych
reakcií vrátane arytmie srdcových komôr a infarktu myokardu. Tieto epizódy, v niektorých prípadoch
smrteľné, sa zvyčajne vyskytli u pacientov s existujúcim kardiovaskulárnym ochorením.
Po instilácii lokálneho fenylefrínu do oka bolo hlásené výrazné zvýšenie krvného tlaku. Predpokladaná systémová expozícia je minimálna a prechodná, je však potrebná obozretnosť pri liečbe pacientov
s nedostatočne kontrolovanou hypertenziou. Pacienti vyžadujúci dlhšiu operáciu môžu mať zvýšené
riziko zvýšenia krvného tlaku.
Pred operáciou sa musí vyriešiť hypertyreóza a nestabilné kardiovaskulárne ochorenie.
Skrížená citlivosť
Je možná skrížená citlivosť na kyselinu acetylsalicylovú, na deriváty kyseliny fenyloctovej a iné
nesteroidné protizápalové lieky (NSAID). Boli hlásené prípady bronchospazmu alebo exacerbácie
astmy súvisiace s použitím očného roztoku obsahujúceho ketorolak u pacientov so známou
precitlivenosťou na aspirín/lieky NSAID alebo s lekárskou anamnézou astmy v minulosti. Preto je potrebné používať liek Omidria obozretne u jedincov, ktorí boli v minulosti citliví na tieto účinné látky.
Použitie lieku Omidria počas operácie na náhradu vnútroočnej šošovky môže dočasne ovplyvniť zrak. (pozri časť 4.7).
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Vnútroočné metabolické interakcie nie sú pravdepodobné, pretože fenylefrín a ketorolak sa odstránia
z prednej očnej komory výplachom počas chirurgického postupu a normálnou cirkuláciou komorového moku po operácii. Rozsah mydriatického účinku lieku Omidria môže byť zmenený u pacientov, ktorí
súbežne užívajú lieky, ktoré môžu ovplyvniť veľkosť zrenice, ako sú opioidy (miotiká) alebo
antihistaminiká bez sedatívneho účinku (mydriatiká).
Súbežné použitie fenylefrínu a atropínu môže u niektorých pacientov zvýšiť účinok na krvný tlak a indukovať tachykardiu. Fenylefrín môže zvýšiť účinok niektorých inhalačných anestetických liekov utlmujúcich kardiovaskulárny systém. Vo farmakokinetickej štúdii hodnotiacej liek Omidria bola systémová expozícia fenylefrínu aj ketorolaku minimálna a prechodná. Preto sa nepredpokladá žiadna interakcia.
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku
Liek Omidria sa neodporúča používať u žien vo fertilnom veku, ktoré nepoužívajú antikoncepciu.
Gravidita
Nie sú k dispozícii žiadne údaje o použití lieku Omidria u gravidných žien. Liek Omidria sa
neodporúča používať počas gravidity.
Laktácia
Nie je známe, či sa fenylefrín vylučuje do ľudského mlieka. Ketorolak sa vylučuje do ľudského mlieka
po systémovom podaní. Riziko u dojčiat nemôže byť vylúčené. Liek Omidria nemá byť používaný počas laktácie.
Fertilita
Nie sú k dispozícii dostatočné údaje o vplyve fenylefríniumchloridu alebo ketorolak trometamolu na
fertilitu u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek Omidria môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Keďže po nahradení vnútroočných šošoviek môže byť zrak pacientov používajúcich liek Omidria dočasne ovplyvnený, pacientov treba informovať, aby neviedli vozidlo alebo neobsluhovali stroje, kým sa ich zrak neznormalizuje. Ďalšie informácie o možných poruchách zraku sú uvedené v časti 4.8.
4.8 Nežiaduce účinky
Z
hrnutie bezpečnostného profiluBezpečnostný profil lieku Omidria je založený na údajoch od 459 dospelých pacientov získaných
počas klinického vývoja v randomizovaných kontrolovaných skúšaniach. Nežiaduce reakcie hlásené
u pacientov dostávajúcich liek Omidria boli typické pooperačné reakcie, väčšinou boli mierne až stredne závažné a odzneli bez zásahu alebo zvyšných účinkov. Najčastejšie hlásené nežiaduce reakcie boli bolesť očí (4,8 %), zápal prednej očnej komory (3,9 %), hyperémia spojoviek (2,2 %), fotofóbia (1,7 %), edém rohovky (1,3 %) a zápal (1,3 %). Rovnaké reakcie boli hlásené v podobnej frekvencii u pacientov dostávajúcich placebo.
Tabuľkový zoznamnežiaducichreakciíFrekvencia nežiaducich reakcií je definovaná ako veľmi časté (≥1/10), časté (≥ 1/100 až <1/10), menej
časté (≥ 1/1 000 až <1/100), zriedkavé (≥ 1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a
neznáme (z dostupných údajov).
Trieda orgánových systémov
| Časté
| Menej časté
|
Poruchy nervového systému
|
| Bolesť hlavy
|
Poruchy oka
| Bolesť očí
Zápal prednej očnej
komory
Hyperémia spojoviek
Edém rohovky
Fotofóbia
| Očný dyskomfort
Zápal očí Podráždenie očí Edém spojoviek Porucha rohovky Mydriáza Rozmazané videnie
Znížená zraková ostrosť
Zákal sklovca
Očný pruritus
Bolesť očných viečok
Pocit cudzieho telieska v očiach
Uprený pohľad
Zvýšený vntroočný tlak
|
Poruchy gastrointestinálneho
traktu
|
| Nauzea
|
Celkové poruchy a reakcie v mieste podania
| Zápal
| Bolesť
|
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovanieV prípade náhodnej intrakamerálnej injekcie koncentrovaného roztoku má byť ihneď evakuovaná
predná očná komora a vypláchnutá štandardným očným irigačným roztokom.
Systémové predávkovanie fenylefrínom môže zapríčiniť rýchle zvýšenie krvného tlaku. Môže zapríčiniť tiež bolesť hlavy, úzkosť, nauzeu a vracanie a arytmie srdcových komôr. V prípade predávkovania fenylefrínom sa odporúča okamžite podať injekciu lieku blokujúceho alfa-adrenergické receptory s rýchlym účinkom, ako je fentolamín.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: {Zatiaľ nepridelený} ATC kód: {Zatiaľ nepridelený}
Mechanizmus účinku
Fenylefrín a ketorolak v lieku Omidria účinkujú prostredníctvom odlišných mechanizmov na
zachovanie peroperačnej mydriázy, prevenciu peroperačnej miózy a zmiernenie akútnej bolesti po
operácii. Fenylefrín je agonista α1-adrenergických receptorov a pôsobí ako mydriatický liek tak, že sťahuje radiálny sval dúhovky a rozširuje zrenicu s miernou cykloplégiou alebo bez nej. V spojivkovom obehu a iných očných cievach vzniká vazokonstrikcia v miere vystavenia lieku.
Ketorolak je liek NSAID, ktorý inhibuje cyklooxygenázové enzýmy (COX1 a COX2), čím sa zmierni bolesť a zápal tak, že v tkanive sa zníži koncentrácia prostaglandínov, ktoré sa vylučujú pri operačnej traume. K prevencii miózy indukovanej operáciou môže prispieť tiež ketorolak inhibíciou syntézy prostaglandínov po narušení oka operáciou, alebo priamou mechanickou stimuláciou dúhovky.
Klinická účinnosť abezpečnosť
Účinnosť a bezpečnosť lieku Omidria boli hodnotené v dvoch randomizovaných multicentrických
dvojito zaslepených klinických skúšaniach fázy 3 kontrolovaných placebom zahŕňajúcich 808 dospelých pacientov, ktorí podstúpili operáciu na náhradu vnútroočných šošoviek. Populácia v skúšaniach bola vo veku 26 až 90 rokov (59 % ženy, 41 % muži; 80 % belosi, 12 % černosi a 8 % iná rasa). V devätnástich percentách prípadov mala katarakta 2. alebo 3. stupeň podľa klasifikácie LOCS II. Päťdesiattri percent pacientov malo hnedú dúhovku, 28 % pacientov malo modrú dúhovku a 19 % pacientov malo dúhovku inej farby.
Pacienti boli randomizovaní buď na používanie lieku Omidria alebo placeba (1:1). Všetci pacienti boli pred operáciou liečení štandardizovanými lokálnymi mydriatickými a anestetickými liekmi. Počas chirurgického postupu bol zmeraný priemer zrenice. Pooperačná bolesť bola hodnotená pacientmi na vizuálnej analógovej stupnici (VAS) 0-100 mm.
Počas operácie sa vykonal štatistický Cochranov-Mantelov-Haenszelov (CMH) test zmeny priemeru
zrenice (mm) v porovnaní s východiskovou hodnotou, upravený podľa randomizovaných vrstiev. V
1. štúdii bol vážený priemerný rozdiel CMH (Omidria – placebo) v priemernej oblasti pod krivkou
(AUC) 0,58 mm [95 % interval spoľahlivosti: 0,48; 0,68] (p < 0,0001). V 2. štúdii bol vážený priemerný rozdiel CMH (Omidria – placebo) v priemernej AUC 0,59 mm [95 % interval spoľahlivosti:
0,49; 0,69] (p < 0,0001).
V skupinách liečených liekom Omidria sa mydriáza zachovala, zatiaľ čo v skupinách používajúcich placebo sa pozorovalo postupné zužovanie zrenice (pozri obrázok).
P
e
roperačná zmena priemeru zrenice (mm) v porovnaní s východiskovou hodnotou
1. štúdia

p < 0,001
Placebo
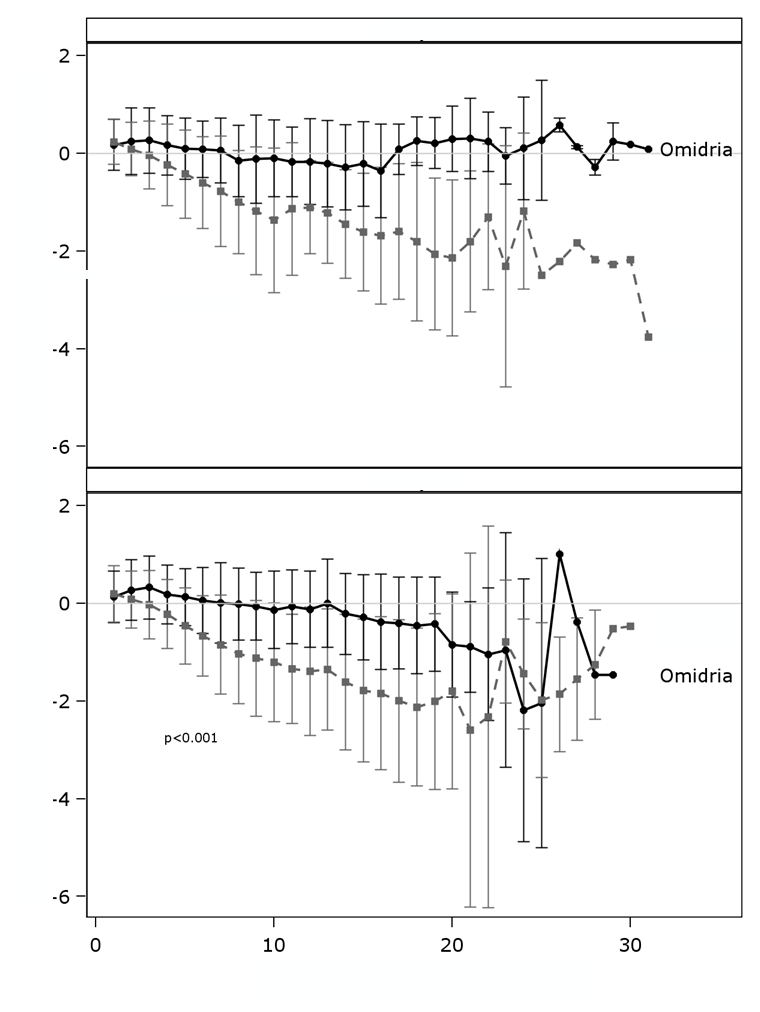
2. štúdia
Placebo
minúty od prvého operačného rezu
Prevencia miózy bola potvrdená v analýze kategorických údajov. V 1. štúdii malo priemer zrenice
< 6 mm v čase čistenia len 4 % pacientov v skupine používajúcej liek Omidria v porovnaní s 23 %
pacientmi v skupine používajúcej placebo, a priemer zrenice ≥ 2,5 mm malo 3 % pacientov v skupine používajúcej liek Omidria v porovnaní s 28 % pacientmi v skupine používajúcej placebo (p < 0,0001 v obidvoch prípadoch, chí-kvadrát test). V 2. štúdii malo priemer zrenice < 6 mm v čase čistenia len 4 % pacientov v skupine používajúcej liek Omidria v porovnaní s 23 % pacientmi v skupine používajúcej
placebo, a priemer zrenice ≥ 2,5 mm malo 1 % pacientov v skupine používajúcej liek Omidria v porovnaní s 27% pacientmi v skupine používajúcej placebo (p < 0,0001, chí-kvadrát test).
| Placebo
| Omidria
|
1. štúdia
Analyzovaný súbor (n)
| N=201 (n=180)
| N=201 (n=184)
|
AUC zmena priemeru zrenice (mm) počas operácie v porovnaní s východiskovou hodnotou (súbežný primárny parameter) [priemer(štandardná odchýlka, SD)]
| -0,5 (0,58)
| 0,1 (0,41)
|
Priemer < 6 mm v ktoromkoľvek čase
| 85 (47 %)
| 19 (10 %)
|
Priemer < 6 mm pri čistení
| 41 (23%)
| 7 (4%)
|
Zúženie zrenice ≥ 2,5 mm
| 50 (28%)
| 6 (3%)
|
2. štúdia
Analyzovaný súbor (n)
| N=204 (n=200)
| N=202 (n=195)
|
AUC zmena priemeru zrenice (mm) počas operácie v porovnaní s východiskovou hodnotou (súbežný primárny parameter) [priemer(SD)]
| -0,5 (0,57)
| 0,1 (0,43)
|
Priemer < 6 mm v ktoromkoľvek čase
| 76 (38%)
| 18 (9%)
|
Priemer < 6 mm pri čistení
| 46 (23%)
| 8 (4%)
|
Zúženie zrenice ≥ 2,5 mm
| 53 (27%)
| 2 (1%)
|
Preukázalo sa tiež výrazné zmiernenie bolesti očí počas prvých 10-12 hodín po operácii. Vykonali sa
štatistické CMH testy bolesti na základe testu VAS 100-mm, upravené podľa randomizačných vrstiev.'
V 1. štúdii bol vážený priemerný rozdiel CMH (Omidria – placebo) v priemernej AUC -5,20 mm
[95 % interval spoľahlivosti: -7,31; -3,09] (p < 0,001). V 2. štúdii bol vážený priemerný rozdiel CMH (Omidria – placebo) v priemernej AUC -4,58 mm [95 % interval spoľahlivosti: -6,92; -2,24]
(p < 0,001).
| Placebo
| Omidria
|
1. štúdia
Analyzovaný súbor (n)
| N=201 (n=201)
| N=201 (n=201)
|
VAS skóre bolesti očí po 12 hodinách pre AUC (súbežný primárny parameter) [priemer±SD]
| 9,2 ± 12,9
| 4,1 ± 8,07
|
Subjekty s VAS = 0 v ktoromkoľvek čase
| 28 (14%)
| 48 (24%)
|
Subjekty s VAS ≥ 40 v ktoromkoľvek čase
| 30 (15%)
| 13 (7%)
|
2. štúdia
Analyzovaný súbor (n)
| N=204 (n=202)
| N=202 (n=202)
|
VAS skóre bolesti očí po 12 hodinách pre AUC
(súbežný primárny parameter) [priemer±SD]
| 8,9 ± 15,19
| 4,3 ± 8,75
|
Subjekty s VAS = 0 v ktoromkoľvek čase
| 41 (20%)
| 56 (28%)
|
Subjekty s VAS ≥ 40 v ktoromkoľvek čase
| 27 (13%)
| 16 (8%)
|
Histologické vyšetrenie v neklinických toxikologických štúdiách nepreukázalo žiadne účinky na
rohovku súvisiace s liečbou a v klinických skúšaniach s liekom Omidria sa nepozorovali škodlivé účinky na najlepšie korigovanú zrakovú ostrosť (BCVA). Počas klinických štúdií sa nezisťoval počet
endoteliálnych buniek.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s liekom Omidria
v jednej alebo vo viacerých podskupinách pediatrickej populácie pri terapeutických postupoch na náhradu šošoviek (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Vo farmakokinetickej štúdii hodnotiacej liek Omidria bola systémová expozícia fenylefrínu aj ketorolaku minimálna a prechodná.
Detegovateľné plazmatické koncentrácie fenylefrínu sa pozorovali len u jedného zo 14 pacientov. Maximálna koncentrácia pozorovaná u tohto pacienta bola 1,7 ng/ml a vyskytla sa po instilácii lokálnych kvapiek obsahujúcich fenylefrín pred operáciou a pred expozíciou lieku Omidria.
Plazmatické koncentrácie ketorolaku sa zistili u 11 zo 14 pacientov. Maximálna pozorovaná koncentrácia ketorolaku bola 4,2 ng/ml.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje uvedené v literatúre pre jednotlivé zložky lieku Omidria a získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
U afrických opíc mačiakov zelených vystavených očným irigačným roztokom obsahujúcim kombináciu fenylefrínu a ketorolaku použitých počas operácie na náhradu očných šošoviek sa uskutočnila toxikologická štúdia skúmajúca jednu dávku. Pri použití kombinácií fenylefrínu a ketorolaku v irigačnom roztoku podávanom v koncentrácii až 7200 µM fenylefrínu a 900 µM ketorolaku sa nepozorovali žiadne nežiaduce udalosti súvisiace s liečbou ani patologické zistenia. Tieto koncentrácie sú viac ako 10-násobne vyššie než koncentrácia každého lieku podávaného v klinických podmienkach pacientom používajúcim liek Omidria.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Monohydrát kyseliny citrónovej, dihydrát citrátu sodného, hydroxid sodný (na úpravu pH),
kyselina chlorovodíková (na úpravu pH), voda na injekciu.
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorené: 18 mesiacov
Po otvorení sa má liek ihneď zriediť.
Po zriedení sa preukázala chemická a fyzikálna stabilita v trvaní 6 hodín pri teplote 25˚ C. Použitie do
6 hodín po zriedení. Z mikrobiologického hľadiska sa má liek použiť okamžite. Ak sa nepoužije
okamžite, za čas a podmienky uchovávania lieku pred použitím zodpovedá používateľ.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 °C.
Injekčnú liekovku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Po zriedení uchovávajte pri teplote do 25˚ C.
6.5 Druh obalu a obsah balenia5 ml injekčná liekovka z číreho skla typu I uzavretá butylovou gumenou zátkou a polypropylénovým odklápacím viečkom. Každá injekčná liekovka na jedno použitie je zabalená v papierovej škatuli.
Viacnásobné balenie obsahujúce 10 (1 balenie po 10) injekčných liekoviek na jedno použitie.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomNa prípravu lieku Omidria na vnútroočný výplach zrieďte 4,0 ml koncentrátu v 500 ml štandardného
očného irigačného roztoku.
Je potrebné dodržať nasledujúce pokyny:
− Injekčná liekovka sa musí vizuálne skontrolovať, či neobsahuje častice. Použiť sa môže iba číry bezfarebný až svetložltý roztok bez viditeľných častíc.
− Pomocou aseptickej metódy odoberte 4,0 ml koncentrovaného roztoku s použitím vhodnej sterilnej ihly.
− 4,0 ml koncentrovaného roztoku sa má injikovať do 500 ml vaku/fľašky s irigačným roztokom.
− Vak treba jemne prevrátiť, aby sa roztok zamiešal. Roztok sa má použiť do 6 hodín po príprave.
− Vak sa musí vizuálne skontrolovať, či neobsahuje častice. Použiť sa môže len číry bezfarebný roztok bez viditeľných častíc.
− Do pripraveného irigačného roztoku sa nemajú pridávať žiadne iné lieky.
Použitá injekčná liekovka a nepoužitý irigačný roztok sa musia po jednom použití zlikvidovať v súlade
s miestnymi požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIOmeros London Limited
Berkeley Square
London, W1J 6BD
Veľká Británia
Tel.: +44 (0) 20 7887 6296
Fax: +44 (0) 20 7887 6001
eMail:
regulatory@omeros.co.uk8. REGISTRAČNÉ ČÍSLOEU/1/15/1018/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: <
dátum rozhodnutia EÚ>