
ne a obl iči ek
Olopatadín vo forme očných kvapiek sa neskúmal u pacientov s renálnym alebo hepatálnym ochorením. Neočakáva sa však, že by bola potrebná akákoľvek úprava dávky pri hepatálnej alebo
renálnej funkčnej poruche (pozri časť 5.2).
Spôsob podávani a
Iba na podanie do oka.
Pokiaľ po odstránení uzáveru fľaštičky spozorujete, že je porušený poistný krúžok, odstráňte ho pred použitím lieku. Aby sa zabránilo kontaminácii špičky kvapkadla a roztoku, je potrebné dbať na to, aby ste sa hrotom kvapkadla fľaštičky nedotkli viečka, okolitých oblastí alebo iných povrchov. Uchovávajte fľaštičku pevne uzatvorenú, keď sa nepoužíva.
V prípade súbežnej liečby s inými topickými očnými liekmi, je potrebné medzi následnými aplikáciami dodržať interval päť minút. Očné masti sa majú aplikovať ako posledné.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Olopatadín je antialergický/antihistamínový liek a hoci sa podáva topicky, absorbuje sa systémovo. Ak sa vyskytnú závažné reakcie alebo precitlivenosť, prerušte túto liečbu.
Olopatadín obsahuje benzalkónium-chlorid, ktorý môže spôsobiť podráždenie očí.
Uvádza sa, že benzalkónium-chlorid tiež spôsobuje bodkovanú keratopatiu a/alebo toxickú ulceratívnu keratopatiu. Vyžaduje sa prísne monitorovanie pri častom alebo predĺženom používaní u pacientov so suchým okom, alebo pri stavoch, kedy je oslabená rohovka.
Kontaktné šoš ovky
O benzalkónium-chloride je známe, že odfarbuje mäkké kontaktné šošovky. Vyhnite sa kontaktu
s mäkkými kontaktnými šošovkami. Pacienti majú byť poučení, aby si pred podaním očných kvapiek vybrali kontaktné šošovky a počkali minimálne 15 minút po instilácii, predtým ako si opäť vložia
kontaktné šošovky.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s inými liekmi.
Štúdie in vitro ukázali, že olopatadín neinhibuje metabolické reakcie, ktoré zahŕňajú izoenzýmy 1A2,
2C8, 2C9, 2C19, 2D6, 2E1 a 3A4 cytochrómu P-450. Tieto výsledky naznačujú, že nie je pravdepodobné, že by olopatadín mal za následok metabolické interakcie s inými súčasne podávanými
účinnými látkami.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne alebo existujú iba obmedzené údaje o používaní očného olopatadínu
u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu po systémovom podávaní (pozri časť 5.3). Olopatadín sa neodporúča počas gravidity a u žien, ktoré môžu otehotnieť a nepoužívajú
antikoncepciu.
Doj če ni e
Dostupné údaje u zvierat preukázali vylučovanie olopatadínu do mlieka po perorálnom podaní
(podrobnosti pozri v časti 5.3).
Riziko pre novorodencov/dojčatá nemožno vylúčiť.
Olopatadín sa nemá používať počas dojčenia.
FertilitaNeboli vykonané štúdie na vyhodnotenie účinku pri lokálnom očnom podaní olopatadínu na ľudskú
fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeOlopatadín nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Tak ako pri akýchkoľvek iných kvapkách do očí, dočasné rozmazané videnie alebo iné zrakové
poruchy môžu ovplyvniť schopnosť viesť vozidlá a obsluhovať stroje. Ak sa po instilácii prejavuje
rozmazané videnie, pacient musí počkať, pokiaľ sa zrak vyjasní, predtým ako začne viesť vozidlo alebo obsluhovať stroje.
4.8 Nežiaduce účinky Súhrn bezpeč nost ného pr ofi l u V klinických štúdiách zahŕňajúcich 1680 pacientov sa olopatadín podával jedenkrát až štyrikrát denne do obidvoch očí počas až štyroch mesiacov ako monoterapia alebo ako prídavná terapia k 10 mg
loratadínu. Dá sa očakávať, že približne 4,5 % pacientov môže mať skúsenosť s nežiaducimi
reakciami; avšak len 1,6 % pacientov prerušilo klinické štúdie z dôvodu týchto nežiaducich reakcií
v súvislosti s olopatadínom. V klinických štúdiách sa nezaznamenali žiadne závažné oftalmologické alebo systémové nežiaduce reakcie v súvislosti s olopatadínom. Najčastejšie hlásenou nežiaducou
reakciou v súvislosti s liečbou bola očná bolesť, zaznamenaná s celkovým výskytom 0,7 %.
T abuľkový pr ehľad neži aduci ch r eakci í Nasledujúce nežiaduce reakcie boli hlásené počas klinických štúdií a post-marketingových dát a sú klasifikované podľa nasledujúceho zvyčajného hodnotenia: veľmi časté (≥ 1/10), časté (≥ 1/100 až
< 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (> 1/10 000 až < 1/1 000), veľmi zriedkavé
(< 1/10 000) alebo neznáme (nemožno vyhodnotiť z dostupných údajov). V rámci každého zoskupenia početnosti sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
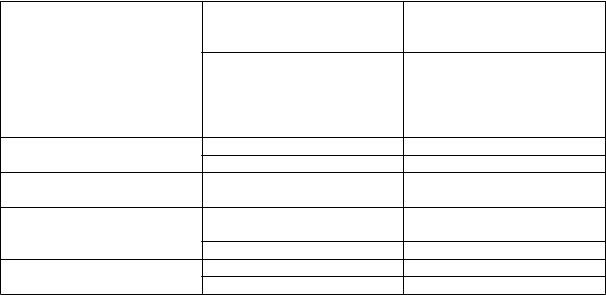
Trieda orgánových systémov
| Frekvencia
| Nežiaduce reakcie
|
Infekcie a nákazy
| Menej časté
| rinitída
|
Poruchy imunitného systému
| Neznáme
| hypersenzitivita, opuch tváre
|
Poruchy nervového systému
| Časté
| bolesť hlavy, dysgeúzia
|
| Menej časté
| závrat, znížená citlivosť
|
| Neznáme
| ospalosť
|
Poruchy oka
| Časté
| očná bolesť, podráždenie oka,
suché oko, abnormálny pocit
v očiach
|
| Menej časté
| erózia rohovky, poškodenie
epitelu rohovky, porušená funkcia epitelu rohovky, bodkovaná keratitída, keratitída, sfarbenie rohovky, očný sekrét, fotofóbia, rozmazané videnie, znížená zraková ostrosť, blefarospazmus, očný diskomfort, svrbenie oka, konjunktiválne folikuly, konjunktiválne poruchy, pocit cudzieho telieska v očiach,
zvýšené slzenie, erytém očných
|
Poruchy dýchacej sústavy, hrudníka a mediastína Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného
tkaniva
Celkové poruchy a reakcie v mieste podania
ochorenie očných viečok, očná hyperémia
Neznáme edém rohovky, očný edém, opuch oka, zápal spojiviek, rozšírenie zreníc, poruchy zraku, chrasta na okraji očného viečka
Časté nazálna suchosť Neznáme dýchavičnosť, sinusitída Neznáme nevoľnosť, vracanie
Menej časté kontaktná dermatitída, pocit pálenia pokožky, suchá koža
Neznáme dermatitída, erytém
Časté únava
Neznáme asténia, malátnosť
V súvislosti s používaním očných kvapiek obsahujúcich fosforečnany boli veľmi zriedkavo
u niektorých pacientov so závažne poškodenými rohovkami hlásené prípady kalcifikácie rohovky.
Hl ás eni e podozr ení na nežiaduc e r ea kcie 
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNie sú k dispozícii žiadne údaje u ľudí, pokiaľ ide o predávkovanie pri náhodnom alebo úmyselnom požití. Olopatadín má nízky stupeň akútnej toxicity u zvierat. Náhodné požitie celého obsahu fľaštičky olopatadínu by poskytlo maximálnu systémovú expozíciu 5 mg olopatadínu. Takáto expozícia by mala za následok konečnú dávku 0,5 mg/kg u dieťaťa s hmotnosťou 10 kg, pri predpokladanej 100 %-nej absorpcii.
Prolongácia QTc intervalu u psov sa pozorovala len pri expozíciách, ktoré sa považovali za expozície v dostatočne veľkom nadbytku nad maximálnu expozíciu pre človeka, čo naznačuje malú relevanciu pre klinické použitie. Perorálna dávka 5 mg sa podávala dvakrát denne počas 2,5 dňa 102 zdravým mladým a starším dobrovoľníkom mužského a ženského pohlavia bez signifikantnej prolongácie intervalu QTc v porovnaní s placebom. Rozsah maximálnych koncentrácií olopatadínu v plazme pri ustálenom stave (35 až 127 ng/ml) pozorovaný v tejto štúdii predstavuje najmenej 70-násobnú toleranciu pre topický olopatadín, pokiaľ ide o účinky na kardiálnu repolarizáciu.
V prípade predávkovania sa má zahájiť vhodný monitoring a liečba pacienta.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: oftalmologiká; dekongesčné liečivá a antialergiká; iné antialergiká. ATC kód: S01GX09
Olopatadín je účinným selektívnym antialergickým/antihistamínovým liečivom, ktoré pôsobí prostredníctvom viacerých odlišných mechanizmov účinku. Antagonizuje histamín (primárny mediátor alergickej odozvy u ľudí) a zabraňuje histamínom indukovanej zápalovej produkcii cytokínu epitelovými bunkami spojovky človeka. Údaje z
in vitro štúdií naznačujú, že môže pôsobiť na žírne bunky spojovky človeka tak, aby sa inhibovalo uvoľňovanie pro-zápalových mediátorov. U pacientov'
s priechodnými nosovoslznými kanálmi, topické očné podávanie olopatadínu poukazovalo na zníženie nosných príznakov a symptómov, ktoré sú často sprievodným znakom sezónnej alergickej konjunktivitídy. Nevytvára klinicky signifikantnú zmenu priemeru zrenice.
5.2 Farmakokinetické vlastnosti
Absorpcia
Olopatadín sa absorbuje systémovo, rovnako ako iné topicky podávané lieky. Avšak, systémová absorpcia topicky aplikovaného olopatadínu je minimálna pri koncentráciách v plazme v rozsahu od
hodnoty nižšej ako je limit kvantitatívneho stanovenia vzorky (< 0,5 ng/ml) až do 1,3 ng/ml. Tieto
koncentrácie sú 50- až 200-násobne nižšie ako koncentrácie po dobre tolerovateľných perorálnych dávkach.
Eli mi náci a
Podľa farmakokinetických štúdií po perorálnom podávaní, polčas olopatadínu v plazme predstavoval približne osem až dvanásť hodín a eliminácia sa uskutočňovala prevažne prostredníctvom renálnej
exkrécie. Približne 60 – 70 % dávky sa zachytilo v moči vo forme účinnej látky. Dva metabolity,
mono-desmetyl a N-oxid, sa detegovali v moči v nízkych koncentráciách.
Pretože olopatadín sa vylučuje do moču primárne v nezmenenej forme liečiva, zhoršenie renálnej funkcie mení farmakokinetiku olopatadínu pri maximálnych koncentráciách v plazme 2,3-násobne viac u pacientov so závažnou poruchou funkcie obličiek (priemerný klírens kreatinínu 13,0 ml/min) v porovnaní so zdravými dospelými osobami. Po 10 mg perorálnej dávke u pacientov, ktorí podstúpili hemodialýzu (bez urinárnej produkcie), koncentrácie olopatadínu v plazme boli signifikantne nižšie v deň hemodialýzy ako v deň, kedy nepodstúpili hemodialýzu, čo naznačuje, že olopatadín sa môže odstrániť hemodialýzou.
Štúdie porovnávajúce farmakokinetiku 10 mg perorálnych dávok olopatadínu u mladých osôb (priemerný vek 21 rokov) a starších osôb (priemerný vek 74 rokov) nepreukázali žiadne signifikantné rozdiely v plazmatických koncentráciách (AUC), viazaní proteínu alebo exkrécii nezmeneného pôvodného lieku a metabolitov močom.
Štúdia renálneho poškodenia po perorálnej dávke olopatadínu sa uskutočnila u pacientov so závažným renálnym poškodením. Výsledky naznačujú, že pre túto populáciu sa pri použití olopatadínu môžu očakávať o niečo vyššie koncentrácie v plazme. Pretože koncentrácie v plazme po topickom očnom podaní olopatadínu sú 50- až 200-násobne nižšie ako po dobre tolerovaných perorálnych dávkach, nepredpokladá sa, že by bolo potrebné prispôsobenie dávky u starších osôb alebo u populácie s renálnym poškodením. Metabolizmus v pečeni je menej významnou cestou eliminácie. Nepredpokladá sa, že by bolo potrebné prispôsobenie dávky pri hepatálnom poškodení.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí.
Štúdie na zvieratách preukázali znížený rast dojčených mláďat samíc, ktoré dostávali systémové dávky olopatadínu, značne presahujúce maximálnu hladinu odporúčanú na očné použitie u človeka. Olopatadín bol zistený v mlieku dojčiacich potkanov po perorálnom podaní.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
benzalkónium-chlorid
chlorid sodný
hydrogenfosforečnan sodný hydroxid sodný
kyselina chlorovodíková (37 %)
voda na injekcie
6.2 Inkompatibility
Nevykonali sa žiadne štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
3 roky
Zlikvidujte do 4 týždňov po prvom otvorení. Uchovávajte pri teplote do 25 °C po prvom otvorení.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie. Neuchovávajte v mrazničke.
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Jedna fľaštička s objemom 10 ml vyrobená z polyetylénu s nízkou hustotou (LDPE) a kvapkadlo z materiálu LDPE umiestnené na vrchu fľaštičky. Fľaštička je uzavretá skrutkovacím uzáverom z polyetylénu s vysokou hustotou (HDPE) a materiálu LDPE.
Jedno 5 ml balenie obsahuje približne 142 kvapiek. Papierové balenie obsahuje 1 alebo 3 fľaštičky.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Žiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Olikla s.r.o.
Náměstí Smiřických 42
281 63 Kostelec nad Černými lesy
Česká republika
8. REGISTRAČNÉ ČÍSLO
64/0031/23-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 27. januára 2023
10. DÁTUM REVÍZIE TEXTU
03/2023