a sa následne upraví na základe reakcie TSH a hormónov štítnej žľazy.
Použitie u pacientov s poruchou funkcie obličiekPorucha funkcie obličiek neovplyvnila celkovú expozíciu (AUC) oktreotidu, keď sa podal oktreotid s.c. Preto nie je potrebná úprava dávkovania Oktreotidu Teva.
Použitie u pacientov s poruchou funkcie pečeneV klinickom skúšaní s oktreotidom podávaným s.c. a i.v. sa zistilo, že eliminačná schopnosť sa môže znížiť u pacientov s cirhózou pečene, ale nie u pacientov so steatózou pečene. V určitých prípadoch môže byť u pacientov s poruchou funkcie pečene potrebné upraviť dávku.
Použitie u starších osôbV klinickom skúšaní s oktreotidom podávaným s.c. nebolo potrebné upraviť dávkovanie u 65-ročných a starších osôb. Preto nie je potrebná úprava dávkovania Oktreotidu Teva v tejto skupine pacientov.
Pediatrická populáciaSkúsenosti s použitím Oktreotidu Teva u detí sú obmedzené.
Spôsob podávaniaOktreotid Teva sa môže podať iba ako hlboká intramuskulárna injekcia. Miesto opakovaného podania intramuskulárnych injekcií sa má striedať medzi ľavým a pravým gluteálnym svalom (pozri časť 6.6).
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníVšeobecnéPretože nádory hypofýzy, ktoré vylučujú STH, sa môžu niekedy zväčšovať a spôsobiť vážne komplikácie (napr. poruchy zorného poľa), je dôležité, aby boli všetci pacienti starostlivo sledovaní. Ak sa objavia príznaky zväčšovania nádoru, majú sa zvážiť iné liečebné postupy.
Terapeutický prínos zníženia hladín rastového hormónu (STH) a normalizácie koncentrácie rastového faktora podobného inzulínu 1 (IGF-1) u pacientok s akromegáliou môže prípadne obnoviť plodnosť. Ak je to potrebné, má sa pacientkam, ktoré môžu otehotnieť, odporučiť počas liečby oktreotidom používanie vhodnej antikoncepcie (pozri časť 4.6).
Pri dlhodobej liečbe oktreotidom sa má u pacientov sledovať funkcia štítnej žľazy.
Počas liečby oktreotidom sa má sledovať funkcia pečene.
Kardiovaskulárne udalostiBoli hlásené časté prípady bradykardie. Môže byť potrebné upraviť dávky liekov ako sú betablokátory, blokátory kalciových kanálov alebo látok regulujúcich rovnováhu tekutín a elektrolytov (pozri časť 4.5).
Žlčník a súvisiace udalostiCholelitiáza je veľmi častou udalosťou vyskytujúcou sa počas liečby Oktreotidom Teva a môže byť spojená s cholecystitídou a dilatáciou žlčovodov (pozri časť 4.8).
Ultrazvukové vyšetrenie žlčníka sa odporúča vykonať pred liečbou a počas liečby Oktreotidom Teva v intervaloch asi 6 mesiacov.
Metabolizmus glukózyZ dôvodu tlmivého účinku na uvoľňovanie rastového hormónu, glukagónu a inzulínu, môže Oktreotid Teva ovplyvniť reguláciu glukózy. Môže sa zhoršiť postprandiálna tolerancia glukózy. Ako sa zaznamenalo u pacientov liečených s.c. oktreotidom, v niektorých prípadoch môže vzniknúť stav trvalej hyperglykémie ako následok dlhodobého podávania. Hlásená bola aj hypoglykémia.
U pacientov s diabetes mellitus (DM) 1. typu, Oktreotid Teva pravdepodobne ovplyvní reguláciu glukózy a môže sa znížiť potreba inzulínu. U nediabetikov alebo u pacientov s DM 2. typu s čiastočne zachovanými rezervami inzulínu môže mať podávanie s.c. oktreotidu za následok zvýšenie postprandiálnej glykémie. Preto sa odporúča sledovať glukózovú toleranciu a antidiabetickú liečbu.
U pacientov s inzulinómami môže oktreotid, vzhľadom na relatívne účinnejšie tlmenie sekrécie STH a glukagónu ako sekrécie inzulínu a vzhľadom na kratšie trvanie tlmivého účinku na inzulín, prehĺbiť hypoglykémiu a predĺžiť jej trvanie. Týchto pacientov je potrebné starostlivo sledovať.
VýživaOktreotid môže u niektorých pacientov ovplyvniť absorpciu tukov z potravy.
U niektorých pacientov liečených oktreotidom sa pozorovali znížené hladiny vitamínu B12 a abnormálne hodnoty Schillingových testov. U pacientov, ktorí majú v anamnéze nedostatok vitamínu B12, sa počas liečby Oktreotidom Teva odporúča sledovať hladiny vitamínu B12.
Obsah sodíkaOktreotid Teva obsahuje menej ako 1 mmol (23 mg) sodíka v jednej dávke, t.j. v podstate zanedbateľné množstvo sodíka.
4.5 Liekové a iné interakcieKeď sa Oktreotid Teva podáva súbežne s betablokátormi, blokátormi kalciového kanála, alebo látkami, ktoré regulujú rovnováhu tekutín a elektrolytov, môže byť potrebná úprava dávky týchto liekov (pozri časť 4.4).
Keď sa Oktreotid Teva podáva súbežne s inzulínom a antidiabetikami, môže byť potrebná úprava dávky týchto liekov (pozri časť 4.4).
Zistilo sa, že oktreotid znižuje črevnú absorpciu cyklosporínu a spomaľuje absorpciu cimetidínu.
Súbežné podanie oktreotidu a bromokriptínu zvyšuje biologickú dostupnosť bromokriptínu.
Malý počet publikovaných údajov naznačuje, že analógy somatostatínu môžu znížiť metabolický klírens zlúčenín, o ktorých je známe, že sa metabolizujú enzýmami cytochrómu P450, čo môže byť dôsledkom tlmenia rastového hormónu. Pretože sa nedá vylúčiť, že oktreotid môže mať tento účinok, je potrebné postupovať opatrne pri použití iných liečiv, ktoré sú metabolizované hlavne CYP3A4 a ktoré majú malý terapeutický index (napr. chinidín, terfenadín).
4.6 Fertilita, gravidita a laktáciaGraviditaK dispozícii je obmedzené množstvo údajov (menej ako 300 ukončených gravidít) o použití oktreotidu u gravidných žien a približne v tretine prípadov nie sú známe výsledky gravidity. Väčšina hlásení bola prijatá po uvedení oktreotidu na trh a viac ako 50 % gravidít vystavených oktreotidu bolo u pacientok s akromegáliou. Väčšina žien bola vystavená oktreotidu počas prvého trimestra gravidity v dávkach v rozpätí 100-1200 μg oktreotidu s.c./denne alebo ako injekcia s dlhodobým účinkom v dávke10-40 mg oktreotidu/mesačne. Vrodené anomálie sa zaznamenali v 4 % gravidít so známym výsledkom. V uvedených prípadoch nie je podozrenie na príčinnú súvislosť s oktreotidom.
Štúdie na zvieratách nepreukázali priame alebo nepriame účinky z hľadiska reprodukčnej toxicity (pozri časť 5.3).
Ako preventívne opatrenie sa odporúča vyhnúť sa používaniu Oktreotidu Teva počas gravidity (pozri časť 4.4).
DojčenieNie je známe, či sa oktreotid vylučuje do ľudského materského mlieka. Štúdie na zvieratách preukázali vylučovanie oktreotidu do materského mlieka. Pacientky počas liečby Oktreotidom Teva nemajú dojčiť.
FertilitaNie je známe, či má oktreotid vplyv na fertilitu u ľudí. U samčích mláďat, ktorých matkám bol počas tehotenstva a laktácie podávaný oktreotid, sa pozoroval oneskorený zostup semenníkov. U potkaních samcov a samíc však oktreotid nepoškodil fertilitu v dávkach do 1 mg/kg telesnej hmotnosti denne (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeOktreotid Teva nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacientov je potrebné upozorniť, aby boli pri vedení vozidiel a obsluhovaní strojov opatrní, ak budú počas liečby Oktreotidom Teva pociťovať závrat, asténiu/únavu alebo bolesť hlavy.
4.8 Nežiaduce účinkyZhrnutie profilu bezpečnostiNajčastejšie nežiaduce reakcie hlásené počas liečby oktreotidom zahŕňajú gastrointestinálne poruchy, poruchy nervového systému, pečene a žlčových ciest a poruchy metabolizmu a výživy.
Najčastejšie hlásené nežiaduce reakcie v klinických skúšaniach, v ktorých sa podával oktreotid, boli hnačka, bolesť brucha, nauzea, flatulencia, bolesť hlavy, vznik žlčových kameňov, hyperglykémia a zápcha. Ďalšie často hlásené nežiaduce reakcie boli závraty, lokalizovaná bolesť, žlčové blato, porucha funkcie štítnej žľazy (napr. pokles hladiny hormónu stimulujúceho štítnu žľazu [TSH], pokles celkového T4 a pokles voľného T4), riedka stolica, zhoršená glukózová tolerancia, vracanie, asténia a hypoglykémia.
Tabuľkový prehľad nežiaducich reakciíNasledujúce nežiaduce reakcie na liek, zhrnuté v Tabuľke 1, sa zozbierali z klinických štúdií s oktreotidom:
Nežiaduce reakcie na liek (Tabuľka 1) sú zoradené podľa frekvencie, najčastejšie sa vyskytujúce ako prvé, podľa nasledujúcej konvencie: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000) veľmi zriedkavé (<1/10 000), vrátane ojedinelých hlásení. V rámci každej skupiny frekvencie sú nežiaduce reakcie zoradené v poradí klesajúcej závažnosti.
Tabuľka 1: Nežiaduce reakcie na liek hlásené v klinických štúdiáchPoruchy gastrointestinálneho traktu
|
Veľmi časté:
| Hnačka, bolesť brucha, nauzea, zápcha, flatulencia.
|
Časté:
| Dyspepsia, vracanie, nadúvanie, steatorea, riedka stolica, zmena farby stolice.
|
Poruchy nervového systému
|
Veľmi časté:
| Bolesť hlavy.
|
Časté:
| Závraty.
|
Poruchy endokrinného systému
|
Časté:
| Hypotyreoidizmus, porucha štítnej žľazy (napr. pokles TSH, pokles celkového T4 a pokles voľného T4).
|
Poruchy pečene a žlčových ciest
|
Veľmi časté:
| Žlčové kamene.
|
Časté:
| Cholecystitída, žlčové blato, hyperbilirubinémia.
|
Poruchy metabolizmu a výživy
|
Veľmi časté:
| Hyperglykémia.
|
Časté:
| Hypoglykémia, zhoršená glukózová tolerancia, anorexia.
|
Menej časté:
| Dehydratácia.
|
Celkové poruchy a reakcie v mieste podania
|
Veľmi časté:
| Reakcie v mieste podania injekcie.
|
Časté:
| Asténia.
|
Laboratórne a funkčné vyšetrenia
|
Časté:
| Zvýšené hladiny aminotransferáz.
|
Poruchy kože a podkožného tkaniva
|
Časté:
| Pruritus, vyrážky, alopécia.
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
Časté:
| Dyspnoe.
|
Poruchy srdca a poruchy srdcovej činnosti
|
Časté:
| Bradykardia.
|
Menej časté:
| Tachykardia.
|
Po uvedení na trhSpontánne hlásené nežiaduce reakcie uvedené v Tabuľke 2 sú hlásené dobrovoľne a nie je pri nich vždy možné spoľahlivo stanoviť frekvenciu alebo príčinnú súvislosť s expozíciou lieku.
Tabuľka 2: Nežiaduce reakcie na liek pochádzajúce zo spontánnych hláseníPoruchy krvi a lymfatického systému
|
Trombocytopénia
|
Poruchy imunitného systému
|
Anafylaxia, alergické reakcie/reakcie z precitlivenosti.
|
Poruchy kože a podkožného tkaniva
|
Urtikária.
|
Poruchy pečene a žlčových ciest
|
Akútna pankreatitída, akútna hepatitída bez cholestázy, cholestatická hepatitída, cholestáza, žltačka, cholestatická žltačka.
|
Poruchy srdca a srdcovej činnosti
|
Arytmie.
|
Laboratórne a funkčné vyšetrenia
|
Zvýšené hladiny alkalickej fosfatázy, zvýšené hladiny gama-glutamyltransferázy.
|
Popis vybraných nežiaducich reakciíReakcie spojené so žlčníkomBolo preukázané, že somatostatínové analógy inhibujú kontraktilitu žlčníka a znižujú sekréciu žlče, čo môže viesť k žlčníkovým abnormalitám alebo kalu. Vznik žlčových kameňov bol hlásený u 15 až 30 % pacientov dlhodobo používajúcich subkutánnu formu oktreotidu. Incidencia v celkovej populácii (vo veku 40 až 60 rokov) je 5 až 20 %. Dlhodobá expozícia injekciám oktreotidu s predĺženým uvoľňovaním u pacientov s akromegáliou alebo gastroenteropankreatickými nádormi naznačuje, že liečba injekciami oktreotidu s predĺženým uvoľňovaním nezvyšuje v porovnaní so subkutánnou formou oktreotidu incidenciu vzniku žlčových kameňov. Ak dôjde k vzniku žlčových kameňov, zvyčajne sú asymptomatické; kamene spôsobujúce príznaky sa majú liečiť buď rozpúšťaním žlčovými kyselinami alebo chirurgicky.
Poruchy gastrointestinálneho traktu V zriedkavých prípadoch môžu gastrointestinálne účinky pripomínať akútnu nepriechodnosť čriev s postupujúcim rozpätím brucha, silnou bolesťou v epigastriu, citlivosťou brucha a s reflexným napínaním svalstva pri pohmate brucha. Frekvencia gastrointestinálnych nežiaducich udalostí sa pri pokračujúcej liečbe časom znižuje.
Reakcie z precitlivenosti a anafylaktické reakciePo uvedení lieku na trh boli hlásené reakcie z precitlivenosti a alergické reakcie. Ak dôjde k ich výskytu, najčastejšie postihujú kožu, zriedkavo ústa a dýchacie cesty. Hlásené boli aj ojedinelé prípady anafylaktického šoku.
Reakcie v mieste vpichuU pacientov, ktorí dostávali injekcie oktreotidu s predĺženým uvoľňovaním, boli často hlásené reakcie v mieste vpichu, vrátane bolesti, začervenania, krvácania, svrbenia, opuchu alebo stvrdnutia avšak vo väčšine prípadov tieto udalosti nevyžadovali klinickú intervenciu.
Poruchy metabolizmu a výživy Aj keď sa merané vylučovanie tukov v stolici môže zvýšiť, dosiaľ sa nedokázalo, že by dlhodobá liečba oktreotidom viedla k nedostatočnej výžive následkom nedostatočnej absorpcie.
Pankreatické enzýmyVo veľmi zriedkavých prípadoch sa zaznamenala počas prvých hodín alebo dní liečby s.c. oktreotidom akútna pankreatitída, ktorá ustúpila po vysadení lieku. Okrem toho sa u pacientov dlhodobo liečených oktreotidom s.c. zaznamenala pankreatitída spôsobená žlčovými kameňmi.
Poruchy srdca a srdcovej činnosti Bradykardia je pri somatostatínových analógoch častou nežiaducou reakciou. U pacientov s akromegáliou aj u pacientov s karcinoidovým syndrómom sa pozorovali zmeny na EKG, ako predĺženie QT intervalu, posuny osi, včasná repolarizácia, nízka voltáž, prechod R/S, včasná progresia kmitu R a nešpecifické zmeny ST-T vlny. Súvislosť medzi týmito udalosťami a oktreotidacetátom nie je preukázaná, pretože mnohí z týchto pacientov majú základné ochorenie srdca (pozri časť 4.4).
TrombocytopéniaPo uvedení lieku na trh bola hlásená trombocytopénia, najmä počas intravenóznej liečby injekciami oktreotidu s predĺženým uvoľňovaním (i.v.) u pacientov s cirhózou pečene a počas liečby injekciami oktreotidu s predĺženým uvoľňovaním. Táto porucha je po ukončení liečby reverzibilná.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 PredávkovanieZaznamenal sa obmedzený počet náhodných predávkovaní injekciami oktreotidu s predĺženým uvoľňovaním. Dávky oktreotidu vo forme injekcií s predĺženým uvoľňovaním boli v rozmedzí 100 mg až 163 mg/mesiac. Jedinou hlásenou nežiaducou udalosťou boli návaly horúčavy.
Boli hlásené správy o pacientoch s karcinómami, ktorí dostali injekcie oktreotidu s predĺženým uvoľňovaním v dávkach do 60 mg/mesiac a do 90 mg/2 týždne. Tieto dávky boli spravidla dobre znášané; zaznamenali sa však nasledujúce nežiaduce udalosti: časté močenie, únava, depresia, úzkosť a nedostatočná sústredenosť.
Liečba predávkovania je symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Hormóny hypofýzy a hypotalamu a analógy, Somatostatín a analógy, ATC kód: H01CB02
Mechanizmus účinkuOktreotid je syntetický oktapeptidový derivát prirodzene sa vyskytujúceho somatostatínu s podobnými farmakologickými účinkami, ale podstatne dlhším trvaním účinku. Tlmí patologicky zvýšenú sekréciu rastového hormónu (STH) a peptidov a serotonínu tvorených v gastroenteropankreatickom (GEP) endokrinnom systéme.
U zvierat je oktreotid v porovnaní so somatostatínom účinnejší inhibítor uvoľňovania STH, glukagónu a inzulínu a má vyššiu selektivitu pre tlmenie STH a glukagónu.
U zdravých osôb sa preukázalo, že oktreotid, tak ako somatostatín, tlmí:
· uvoľňovanie STH stimulované arginínom a hypoglykémiu vyvolanú záťažou a inzulínom,
· postprandiálne uvoľňovanie inzulínu, glukagónu, gastrínu a iných peptidov GEP endokrinného systému a arginínom stimulované uvoľňovanie inzulínu a glukagónu,
· uvoľňovanie TSH stimulované tyreoliberínom (TRH).
Na rozdiel od somatostatínu tlmí oktreotid sekréciu STH vo väčšej miere ako inzulínu a reakciou na jeho podanie nie je rebound sekrécia hormónov (t.j. STH u pacientov s akromegáliou).
U pacientov s akromegáliou Oktreotid Teva, lieková forma oktreotidu vhodná na opakované podávanie v intervale 4 týždňov, umožňuje dosiahnuť stále a terapeutické koncentrácie oktreotidu v sére, čím konzistentne znižuje STH a normalizuje sérové koncentrácie IGF-1 u väčšiny pacientov. U väčšiny pacientov injekcie oktreotidu s predĺženým uvoľňovaním výrazne potláčali klinické prejavy choroby, ako je bolesť hlavy, potenie, parestézie, únava, osteoartralgie a syndróm karpálneho tunela. U predtým neliečených pacientov s akromegáliou s adenómom hypofýzy vylučujúcim STH liečba injekciami oktreotidu s predĺženým uvoľňovaním vyvolala zmenšenie objemu nádorového tkaniva o >20 % u významného podielu (50 %) pacientov.
U individuálnych pacientov s adenómom hypofýzy vylučujúcim STH, injekcie oktreotidu s predĺženým uvoľňovaním podľa hlásení spôsobili zmenšenie nádoru (pred chirurgickým zákrokom). Avšak chirurgický zákrok sa nemá odďaľovať.
U pacientov s funkčnými gastroenteropankreatickými nádormi endokrinného systému umožňuje liečba Oktreotidom Teva nepretržitú kontrolu symptómov spojených so základným ochorením. Účinok oktreotidu na rôzne typy gastroenteropankreatických nádorov je nasledovný:
Karcinoidové nádoryPodávanie oktreotidu môže viesť k ústupu príznakov, hlavne návalov horúčavy a hnačky. V mnohých prípadoch súčasne dochádza k poklesu serotonínu v plazme a k zníženiu vylučovania kyseliny 5-hydroxyindoloctovej močom.
VIPómyBiochemickou vlastnosťou týchto nádorov je nadprodukcia vazoaktívneho intestinálneho peptidu (VIP). Vo väčšine prípadov podávanie oktreotidu vyvolá zmiernenie ťažkej, pre tento stav typickej sekretorickej hnačky, s následným zlepšením kvality života. Toto zároveň vedie aj k ústupu sprievodných porúch elektrolytov, napr. hypokalémie, čo umožňuje ukončiť enterálne aj parenterálne dopĺňanie tekutín a elektrolytov. U niektorých pacientov sa pri vyšetrení počítačovou tomografiou ukáže spomalenie alebo zastavenie rastu nádoru alebo dokonca zmenšovanie jeho objemu, hlavne metastáz v pečeni. Klinické zlepšenie zvyčajne sprevádza zníženie plazmatických hladín VIP, ktoré môžu klesnúť do normálneho referenčného rozmedzia.
GlukagonómyPodávanie oktreotidu vo väčšine prípadov vedie k podstatnému zmierneniu nekrolytického sťahovavého erytému, ktorý je charakteristický pre toto ochorenie. Účinok oktreotidu na mierny DM, ktorý sa často vyskytuje, nie je výrazný a vo všeobecnosti nemá za následok zníženie potreby inzulínu alebo perorálnych antidiabetík. U postihnutých pacientov oktreotid zmierňuje hnačku a tým spôsobuje nárast hmotnosti. Aj keď podávanie oktreotidu často vedie k okamžitému zníženiu plazmatických hladín glukagónu, tento pokles zvyčajne nepretrváva pri dlhodobom podávaní lieku, a to napriek pokračujúcemu zlepšovaniu príznakov.
Gastrinómy/Zollingerov-Ellisonov syndrómLiečba inhibítormi protónovej pumpy alebo blokátormi H2-receptorov vo všeobecnosti reguluje nadmernú sekréciu žalúdkovej kyseliny. Avšak hnačku, ktorá je tiež významným príznakom, nemusia inhibítory protónovej pumpy alebo blokátory H2 receptorov dostatočne zmierniť. Oktreotid Teva môže pomôcť ďalej znížiť nadmernú sekréciu žalúdkovej kyseliny a zlepšiť príznaky, vrátane hnačky, keďže u niektorých pacientov prináša potlačenie zvýšených hladín gastrínu.
InzulinómyPodávanie oktreotidu vyvoláva pokles cirkulujúceho imunoreaktívneho inzulínu. U pacientov s operabilnými nádormi môže oktreotid pomôcť obnoviť a udržať normoglykémiu pred operáciou. U pacientov s neoperabilnými benígnymi alebo malígnymi nádormi sa môže zlepšiť kontrola glykémie aj bez súčasného trvalého zníženia hladín cirkulujúceho inzulínu.
Pokročilé „midgut“ neuroendokrinné nádory alebo nádory s neznámou lokalizáciou primárneho nádoru, pri ktorých sa lokalizácia mimo „midgut“ vylúčilaRandomizované, dvojito zaslepené, placebom kontrolované klinické skúšanie fázy III (PROMID) preukázalo, že injekcie oktreotidu s predĺženým uvoľňovaním inhibujú rast nádoru u pacientov s pokročilými neuroendokrinnými nádormi čreva (midgut). 85 randomizovaných pacientov dostávalo 30 mg oktreotidu vo forme injekcií s predĺženým uvoľňovaním každé 4 týždne (n=42), alebo placebo (n=43) počas 18 mesiacov, alebo až do progresie nádoru alebo smrti.
Hlavné kritéria pre zaradenie do štúdie boli: neliečené, histologicky potvrdené, pre lokalizáciu neoperabilné alebo metastázujúce, dobre diferencované, funkčne aktívne alebo neaktívne neuroendokrinné nádory/karcinómy; s primárnym nádorom lokalizovaným v čreve (midgut), alebo neznámej lokalizácie pri predpoklade, že má pôvod v čreve (midgut), ak sa vylúčil primárny nádor pankreasu, hrudníka alebo inde.
Primárny cieľový ukazovateľ bol čas do progresie nádoru alebo do úmrtia súvisiaceho s nádorom (TTP).V analýze populácie podľa liečebného zámeru (ITT) (všetkých randomizovaných pacientov) sa zaznamenalo 26 prípadov progresie alebo úmrtia v súvislosti s nádorom v skupine oktreotidu vo forme injekcií s predĺženým uvoľňovaním a 41 v skupine placeba (HR=0,32; 95 % IS, 0,19 až 0,55; p=0,000015).
V konzervatívnej analýze populácie ITT (cITT), z ktorej boli 3 pacienti vylúčení po randomizácii, sa pozorovalo 26 prípadov progresie alebo úmrtia v súvislosti s nádorom v skupine oktreotidu vo forme injekcií s predĺženým uvoľňovaním a 40 v skupine placeba (HR=0,34; 95 % IS, 0,20 až 0,59; hodnota p=0,000072; Obrázok 1). Medián času do progresie nádoru bol 14,3 mesiaca (95 % IS, 11,0 až 28,8 mesiaca) v skupine oktreotidu vo forme injekcií s predĺženým uvoľňovaním a 6,0 mesiacov (95 % IS, 3,7 až 9,4 mesiaca) v skupine placeba.
V analýze populácie podľa protokolu (PP), z ktorej boli vylúčení ďalší pacienti na konci liečby v štúdii, sa pozorovala progresia nádoru alebo úmrtie súvisiace s nádorom u 19 pacientov liečených injekciami oktreotidu s predĺženým uvoľňovaním a u 38 pacientov, ktorí dostávali placebo (HR=0,24; 95 % IS, 0,13 až 0,45; hodnota p=0,0000036).
Obrázok 1 Odhad TTP podľa Kaplana-Meiera porovnávajúci injekcie oktreotidu s predĺženým uvoľňovaním s placebom (konzervatívna ITT populácia)
Logrank test stratifikovaný podľa funkčnej aktivity: p=0,000072, HR= 0,34 [95 % IS: 0,20-0,59]
|
|
Tabuľka 3 Výsledky TTP podľa analýzy populácií
| Udalosti TTP
| Medián TTP mesiace [95% IS]
| HR [95% IS]
p-hodnota *
|
Injekcie oktreotidu s predĺženým uvoľňovaním
| Placebo
| Injekie oktreotidu s predĺženým uvoľňovaním
| Placebo
|
ITT
| 26
| 41
| NR
| NR
| 0,32
[95% IS, 0,19 to 0,55] P=0,000015
|
cITT
| 26
| 40
| 14,3
[95% IS, 11,0 to 28,8]
| 6,0
[95% IS, 3,7 to 9,4]
| 0,34
[95% IS, 0,20 to 0,59] P=0,000072
|
PP
| 19
| 38
| NR
| NR
| 0,24
[95% IS, 0,13 to 0,45] P=0,0000036
|
NR=neuvádzaný (z angl.: not reported); HR=pomer rizika (z angl: hazard ratio); TTP= čas do progresie nádoru (z angl.: time to tumor progression; ITT=podľa liečebného zámeru (z angl. intention to treat); cITT=konzervatívna ITT (z angl.: conservative ITT); PP=podľa protokolu (z angl.:per protocol)
*Logrank test stratifikovaný podľa funkčnej aktivity
|
Účinok liečby bol podobný u pacientov s funkčne aktívnymi (HR=0,23; 95 % IS, 0,09 až 0,57) a neaktívnymi nádormi (HR=0,25; 95 % IS, 0,10 až 0,59).
Po 6 mesiacoch liečby sa pozorovala stabilizácia ochorenia u 67 % pacientov v skupine oktreotidu vo forme injekcií s predĺženým uvoľňovaním a u 37% pacientov v skupine placeba.
Vzhľadom na významný klinický prínos injekcií oktreotidu s predĺženým uvoľňovaním pozorovaný v tejto plánovanej predbežnej analýze bol nábor pacientov zastavený.
Bezpečnosť injekcií oktreotidu s predĺženým uvoľňovaním v tomto klinickom skúšaní sa zhodovala s jeho stanoveným bezpečnostným profilom.
Liečba adenómov hypofýzy vylučujúcich TSHPreukázalo sa, že podávanie jednej i.m. injekcie oktreotidu s predĺženým uvoľňovaním každé 4 týždne, znižuje zvýšené hladiny hormónov štítnej žľazy, normalizuje TSH a zlepšuje klinické prejavy a príznaky hypertyroidizmu u pacientov s adenómami vylučujúcimi TSH. Účinok liečby injekciami oktreotidu s predĺženým uvoľňovaním dosiahol hladinu štatistickej významnosti v porovnaní s východiskovými hodnotami po 28 dňoch a prínos liečby pokračoval až do 6 mesiacov.
5.2 Farmakokinetické vlastnostiAbsorpciaPo jednorazovej i.m. injekcii oktreotidu s predĺženým uvoľňovaním dosiahne koncentrácia oktreotidu v sére prechodné začiatočné maximum v priebehu 1 hodiny po podaní, po ktorom nasleduje progresívny pokles na nízku, nedokázateľnú hladinu oktreotidu v priebehu 24 hodín. Po tomto maxime v 1.deň zostáva oktreotid u väčšiny pacientov na subterapeutických hladinách počas nasledujúcich 7 dní. Potom sa koncentrácie oktreotidu opäť zvýšia, dosiahnu rovnovážny stav okolo 14.dňa a zostávajú pomerne stále počas nasledujúcich 3 až 4 týždňov. Najvyššia hladina počas 1.dňa je nižšia ako hladiny počas fázy rovnovážneho stavu, pričom počas 1.dňa nepresiahne uvoľnenie liečiva 0,5% z jeho celkovej hodnoty. Asi po 42. dni koncentrácia oktreotidu pomaly klesá, súčasne s fázou konečného rozkladu polymérového matrixu liekovej formy.
U pacientov s akromegáliou sú priemerné rovnovážne hodnoty koncentrácie oktreotidu po jednorazovej dávke injekcie oktreotidu s predĺženým uvoľňovaním 10 mg 358 ng/l, 20 mg 926 ng/l a 30 mg 1710 ng. Rovnovážne koncentrácie oktreotidu v sére, ktoré sa dosiahnu po 3 injekciách v 4-týždňových intervaloch, sú približne 1,6 až 1,8 násobne vyššie a predstavujú 1557 ng/l po opakovaných injekciách 20 mg a 2384 ng/l po opakovaných injekciách 30 mg oktreotidu s predĺženým uvoľňovaním. '
U pacientov s karcinoidovými nádormi sa priemerné (a mediánové) rovnovážne koncentrácie oktreotidu v sére po opakovaných injekciách 10 mg, 20 mg a 30 mg oktreotidu s predĺženým uvoľňovaním podávaných v 4-týždňových intervaloch tiež zvyšovali lineárne s dávkou a boli 1231 (894) ng/l, 2620 (2270) ng/l a 3928 (3010) ng/l.
Po podaní až 28 injekcií oktreotidu s predĺženým uvoľňovaním v mesačných intervaloch nedošlo k akumulácii oktreotidu nad hodnotu, ktorá sa očakáva kvôli prekrývaniu profilov uvoľňovania.
Distribúcia a biotransformáciaFarmakokinetický profil oktreotidu po aplikácii injekcie oktreotidu s predĺženým uvoľňovaním odráža profil uvoľňovania z polymérového matrixu a jeho biodegradáciu. Keď sa oktreotid uvoľní do systémového obehu, distribuuje sa v súlade s jeho známymi farmakokinetickými vlastnosťami, ako sa popísali pri s.c. podaní. Distribučný objem oktreotidu pri rovnovážnom stave je 0,27 l/kg a celkový telesný klírens je 160 ml/min. Väzba na bielkoviny plazmy dosahuje 65% a v podstate žiadne liečivo sa neviaže na krvinky.
Farmakokinetické údaje pochádzajúce z obmedzeného počtu krvných vzoriek od pediatrických pacientov s hypotalamovou obezitou, vo veku 7 – 17 rokov, liečených injekciami oktreotidu s predĺženým uvoľňovaním v dávke 40 mg raz mesačne preukázali priemerné minimálne hladiny oktreotidu v plazme v hodnote 1395 ng/l po prvej injekcii a 2973 ng/l v rovnovážnom stave. Zaznamenala sa vysoká interindividuálna variabilita.
Minimálne koncentrácie oktreotidu v rovnovážnom stave nekorelovali s vekom a s indexom telesnej hmotnosti a mierne korelovali s telesnou hmotnosťou (52,3 – 133 kg), pričom existoval významný rozdiel medzi pacientmi mužského a ženského pohlavia – u žien boli minimálne koncentrácie o 17% vyššie.
5.3 Predklinické údaje o bezpečnostiŠtúdie akútnej toxicity a toxicity pri opakovanom podávaní, genotoxicity, karcinogenity a reprodukčnej toxicity na zvieratách neodhalili žiadne špecifické bezpečnostné riziká pre ľudí.
Reprodukčné štúdie na zvieratách neodhalili žiadne dôkazy teratogénnych, embryo/fetálnych alebo iných reprodukčných účinkov v dôsledku oktreotidu pri dávkach u rodičov až do 1 mg/kg/deň. U potomkov potkanov sa zaznamenalo isté spomalenie fyziologického rastu, ktoré bolo prechodné a pripisovalo sa inhibícii STH spôsobenej prílišnou farmakodynamickou aktivitou (pozri časť 4.6).
Žiadne špecifické štúdie sa nerealizovali na mladých potkanoch. V štúdiách prenatálneho a postnatálneho vývinu sa pozoroval obmedzený rast a dozrievanie u F1 potomkov samíc, ktoré dostávali oktreotid počas celej gravidity a laktácie. U F1 samčieho potomstva sa pozoroval oneskorený zostup semenníkov, ale fertilita postihnutých F1 samčích mláďat ostala normálna. Vyššie uvedené pozorovania teda boli prechodné a považovali sa za dôsledok inhibície STH.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokPrášok (injekčná liekovka):
poly (D,L-laktid-ko-glykolid)
manitol (E421).
Rozpúšťadlo (naplnená injekčná striekačka):
karamelóza, sodná soľ
manitol (E421)
poloxamér
voda na injekcie
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti3 roky
Po rekonštitúcií okamžite použite.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v pôvodnom obale na ochranu pred svetlom.
Uchovávajte v chladničke (2°C - 8°C). Neuchovávajte v mrazničke.
Oktreotid Teva sa môže uchovávať pri teplote do 25°C v deň podania.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3
6.5 Druh obalu a obsah baleniaOktreotid Teva 10 mg: Každé balenie obsahuje jednu sklenenú injekčnú liekovku s gumenou zátkou (chlórbutylová guma) a hliníkovým uzáverom s plastovým vyklápacím viečkom tmavomodrej farby; liekovka obsahuje prášok na injekčnú suspenziu a jednu bezfarebnú naplnenú sklenenú striekačku s uzáverom a piestovou zátkou (brómbutylová guma); striekačka obsahuje 2 ml rozpúšťadla, spoločne zabalené v plastovom obale s jedným adaptérom injekčnej liekovky a jednou bezpečnostnou injekčnou ihlou.
Dostupné je balenie s jednou a tromi jednotkami.
Oktreotid Teva 20 mg: Každé balenie obsahuje jednu sklenenú injekčnú liekovku s gumenou zátkou (chlórbutylová guma) a hliníkovým uzáverom s plastovým vyklápacím viečkom oranžovej farby; liekovka obsahuje prášok na injekčnú suspenziu a jednu bezfarebnú naplnenú sklenenú striekačku s uzáverom a piestovou zátkou (brómbutylová guma); striekačka obsahuje 2 ml rozpúšťadla, spoločne zabalené v plastovom obale s jedným adaptérom injekčnej liekovky a jednou bezpečnostnou injekčnou ihlou.
Dostupné je balenie s jednou a tromi jednotkami.
Oktreotid Teva 30 mg: Každé balenie obsahuje jednu sklenenú injekčnú liekovku s gumenou zátkou (chlórbutylová guma) a hliníkovým uzáverom s plastovým vyklápacím viečkom tmavočervenej farby; liekovka obsahuje prášok na injekčnú suspenziu a jednu bezfarebnú naplnenú sklenenú striekačku s uzáverom a piestovou zátkou (brómbutylová guma); striekačka obsahuje 2 ml rozpúšťadla, spoločne zabalené v plastovom obale s jedným adaptérom injekčnej liekovky a jednou bezpečnostnou injekčnou ihlou.
Dostupné je balenie s jednou a tromi jednotkami.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Pokyny na prípravu a intramuskulárne podanie Oktreotidu Teva LEN NA PODANIE HLBOKOU INTRAMUSKULÁRNOU INJEKCIOU!
Injekčná súprava obsahuje:

a
| Jedna injekčná liekovka obsahujúca Oktreotid Teva vo forme prášku
|
b
| Jedna naplnená injekčná striekačka obsahujúca disperzné prostredie na rekonštitúciu (vehikulum)
|
c
| Jeden adaptér injekčnej liekovky na rekonštitúciu lieku
|
d
| Jedna bezpečnostná injekčná ihla
|
Dôsledne dodržujte pokyny nižšie, aby sa zabezpečila správna rekonštitúcia Oktreotidu Teva pred podaním hlbokej intramuskulárnej injekcie.
Pri rekonštitúcii Oktreotidu Teva treba dodržať tri zásadné kroky.
Ich nedodržiavanie môže viesť k chybám v správnom podaní lieku.
- Injekčná súprava musí dosiahnuť izbovú teplotu. Vyberte injekčnú súpravu z chladničky a nechajte ju prirodzene zohriať na izbovú teplotu minimálne 30 minút pred rekonštitúciou, ale neprekročte 24 hodín.
- Po pridaní roztoku na riedenie sa uistite, že prášok je plne nasýtený tým, že necháte injekčnú liekovku stáť 5 minút.
- Po nasýtení, mierne trepte liekovkou v horizontálnom smere minimálne 30 sekúnd pokiaľ sa nevytvorí homogénna suspenzia. Suspenzia Oktreotidu Teva sa musí pripraviť až bezprostredne pred podaním.
Oktreotid Teva má podať len školený zdravotnícky pracovník.
Krok č.1
· Vyberte Oktreotid Teva injekčnú súpravu z chladničky.
POZOR: Je nevyhnutné začať proces rekonštitúcie až keď injekčná súprava dosiahne izbovú teplotu. Nechajte injekčnú súpravu stáť pri izbovej teplote minimálne 30 minút pred rekonštitúciou ale neprekročte 24 hodín.
Poznámka: Ak je potrebné, injekčná súprava sa môže uložiť späť do chladničky.
|

|
Krok č.2
.
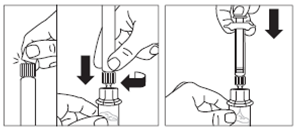
· Z injekčnej liekovky odstráňte plastový uzáver a očistite gumenú zátku injekčnej liekovky tampónom namočeným v alkohole.
· Odstráňte fóliu z obalu a vyberte adaptér injekčnej liekovky z obalu tak, že jednou rukou budete držať biely kužeľovitý obal a druhou okraj adaptéra. Nedotýkajte sa na žiadnom mieste špičky adaptéra, kam sa nasadí striekačka.
· Injekčnú liekovku položte na rovný povrch. Umiestnite adaptér hore na injekčnú liekovku a stlačte ho úplne nadol tak, aby zapadol na miesto, čo sa potvrdí počuteľným „cvaknutím“.
· Očistite špičku adaptéra na liekovku tampónom namočeným v alkohole.
|
|
|
|
Krok č.3
· Odstráňte biely kryt z injekčnej striekačky
naplnenej rozpúšťadlom a naskrutkujte injekčnú
striekačku na adaptér injekčnej liekovky.
|
|
· Pomaly zatlačte piest celkom na doraz, aby sa
všetko rozpúšťadlo presunulo do injekčnej liekovky.
|
|
Krok č.4
POZOR: Je nevyhnutné nechať injekčnú liekovku stáť 5 minút na zaistenie úplného nasýtenia roztoku práškom.
Poznámka: Je v poriadku, ak sa pre mierny pretlak v injekčnej liekovke piest striekačky posunie nahor.
· V tejto fáze pripravte pacienta na injekciu.
| 
|
Krok č.5
· Po dosiahnutí nasýtenia sa uistite, že je piest zatlačený celkom na doraz v injekčnej striekačke.
POZOR: Podržte piest stlačený a mierne traste injekčnou liekovkou vo vodorovnom smere najmenej 30 sekúnd, aby sa prášok úplne suspendoval (homogénna mliečnobiela suspenzia). Ak sa prášok úplne nerozptýli, ešte raz mierne traste asi 30 sekúnd.
| 
|
Krok č.6
· Obráťte injekčnú liekovku a injekčnú striekačku hore dnom, pomaly potiahnite piest späť a do injekčnej striekačky natiahnite celý obsah injekčnej liekovky.
|
|
· Odskrutkujte injekčnú striekačku z adaptéra injekčnej liekovky
| 
|
Krok č.7
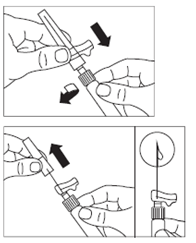
· Očistite miesto vpichu tampónom namočeným v alkohole.
· Naskrutkujte bezpečnostnú injekčnú ihlu na injekčnú striekačku.
· Ak sa podanie oneskorí, ešte raz mierne potraste injekčnú striekačku na zaistenie homogénnej mliečnobielej suspenzie.
· Odstráňte z ihly ochranný kryt.
· Jemne po striekačke poklepte aby ste odstránili akékoľvek viditeľné bubliny a vytlačte ich zo striekačky von.
· Pokračujte okamžite krokom 8 na podanie pacientovi. Akékoľvek oneskorenie môže spôsobiť sedimentáciu.
| 
|
|
|
Krok č.8
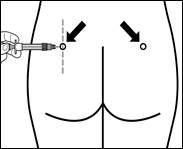
· Oktreotid Teva sa musí podať len hlbokou intramuskulárnou injekciou, NIKDY intravenózne.
· Zaveďte ihlu úplne do kože ľavého alebo pravého sedacieho svalu pod uhlom 90°.
· Pomaly potiahnite piest späť a ubezpečte sa, že ste neprepichli niektorú cievu (ak ste prepichli cievu, zaveďte ihlu do iného miesta).
· Pri stálom tlaku stláčajte piest, až kým sa injekčná striekačka nevyprázdni.
Vytiahnite ihlu z miesta vpichu a aktivujte bezpečnostný systém (podľa obrázku pri kroku č.9).
|
|
Krok č.9
· Bezpečnostný kryt ihly aktivujte jedným z týchto dvoch spôsobov:
- buď pritlačte odklápaciu časť bezpečnostného krytu na pevný povrch (obrázok A),
- alebo zatlačte odklápaciu časť prstom dopredu (obrázok B).
· Počuteľné „cvaknutie“ potvrdí správnu aktiváciu.
· Poznámka: Poznačte si miesto aplikácie do karty pacienta a miesto striedajte každý mesiac
· Injekčnú striekačku okamžite odhoďte (do nádoby na likvidáciu ostrých predmetov).
|

|
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIITeva B.V., Swensweg 5, 2031 GA Haarlem, Holandsko
8. REGISTRAČNÉ ČÍSLAOktreotid Teva 10 mg: 56/0156/19-S
Oktreotid Teva 20 mg: 56/0157/19-S
Oktreotid Teva 30 mg: 56/0158/19-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 28. mája 2019
10. DÁTUM REVÍZIE TEXTU11/2019