
odpovedi na liečbu rastovým faktorom bola spojená s prechodne pozitívnymi nálezmi v RTG kostí, a to je potrebné zvážiť pri interpretácii výsledkov RTG kostí.
Osobitnéupozorneniaprepacientovpodstupujúcichmobilizáciuprogenitorovýchbuniekvperiférnejkrvi
Mobilizácia
V rámci rovnakej populácie pacientov sa nevykonali žiadne perspektívne randomizované porovnávania dvoch odporúčaných mobilizačných metód (monoterapia filgrastímom alebo kombinácia s myelosupresívnou chemoterapiou). Rozdiely medzi jednotlivými pacientmi ako aj vo výsledkoch laboratórnych analýz CD34+ buniek značia, že priame porovnanie medzi odlišnými štúdiami je zložité. Z tohto dôvodu je ťažké odporučiť optimálnu metódu. Mobilizačná metóda sa má zvoliť podľa celkových cieľov liečby u jednotlivých pacientov.
Predchádzajúca expozícia cytotoxickými látkami
U pacientov, ktorí pred podaním filgrastímu na mobilizáciu PBPC podstúpili veľmi extenzívnu myelosupresívnu terapiu, sa nemusí prejaviť dostatočná mobilizácia PBPC na dosiahnutie odporučenej minimálnej výťažnosti (≥ 2,0 x 106 CD34+ buniek/kg) alebo urýchlenie obnovenia trombocytov na rovnakú úroveň.
Niektoré cytotoxické látky vykazujú špecifickú toxicitu voči zásobe krvotvorných progenitorov a môžu nepriaznivo ovplyvniť mobilizáciu progenitorov. Ak sa počas dlhého obdobia pred pokusmi o mobilizáciu progenitorov podávajú látky ako melfalan, karmustín (BCNU) a karboplatina, tieto môžu obmedziť výťažnosť progenitorov. Podávanie melfalanu, karboplatiny alebo BCNU spolu s filgrastímom sa však ukázalo ako účinné pri mobilizácii progenitorov. V prípade, že sa predpokladá transplantácia PBPC,
odporúča sa naplánovať mobilizáciu kmeňových buniek vo včasnej fáze liečby pacienta. Osobitná pozornosť sa má venovať počtu mobilizovaných progenitorov u takýchto pacientov pred podaním vysokých dávok chemoterapie. Ak sú výťažnosti neadekvátne vzhľadom na vyššie uvedené kritériá, majú sa zvážiť alternatívne formy liečby, ktoré nevyžadujú podporu progenitorov.
Zhodnotenie výťažností progenitorových buniek
Pri vyhodnocovaní počtu progenitorových buniek odobratých od pacientov liečených filgrastímom sa má venovať osobitná pozornosť metóde kvantifikácie. Výsledky prietokovej cytometrickej analýzy počtu CD34+ buniek sa líšia v závislosti od presnosti použitej metodológie, a preto odporúčania týkajúce sa počtov získaných na základe štúdií v iných laboratóriách je potrebné interpretovať opatrne.
Štatistická analýza vzťahu medzi počtom opätovne infundovaných CD34+ buniek a rýchlosťou obnovenia trombocytov po podaní vysokých dávok chemoterapie naznačuje zložitý, avšak kontinuálny vzťah.
Odporúčanie minimálnej výťažnosti ≥ 2,0 x 106 CD34+ buniek/kg sa zakladá na publikovaných skúsenostiach, vedúcich k primeranej hematologickej obnove. Výťažnosti prevyšujúce túto minimálnu výťažnosť korelujú s rýchlejším obnovením, výťažnosti nižšie ako táto hodnota korelujú s pomalším zotavením.
Osobitnéupozorneniaprenormálnychdarcovpodstupujúcichmobilizáciuprogenitorovýchbuniekvperiférnejkrvi
Mobilizácia PBPC nie je priamym klinickým prínosom pre normálnych darcov a má sa vziať do úvahy len
na účely alogénnej transplantácie kmeňových buniek.
Nad mobilizáciou PBPC sa má uvažovať len u darcov, ktorí spĺňajú normálne klinické a laboratórne kritériá vhodnosti pre darovanie kmeňových buniek s osobitnou pozornosťou na hematologických hodnotách a infekčných ochoreniach.
Bezpečnosť a účinnosť filgrastímu neboli stanovené u normálnych darcov mladších ako 16 rokov alebo starších ako 60 rokov.
Prechodná trombocytopénia (počet trombocytov < 100 x 109/l) po podaní filgrastímu a po leukaferéze sa pozorovala u 35 % skúmaných pacientov. V tejto skupine bol v dvoch prípadoch zaznamenaný počet trombocytov < 50 x 109/l v dôsledku leukaferézy.
Ak je potrebných viac leukaferéz, zvláštna pozornosť sa má venovať darcom s počtom trombocytov
< 100 x 109/l pred leukaferézou; vo všeobecnosti sa aferéza nemá vykonať, ak je počet trombocytov
< 75 x 109/l.
Leukaferéza sa nemá vykonať u darcov, ktorí sú liečení antikoagulanciami alebo ktorí majú poruchy hemostázy.
Ak počet leukocytov stúpne na 70 x 109/l, podávanie filgrastímu sa má ukončiť alebo sa má znížiť dávkovanie.
Darcovia, ktorí na mobilizáciu PBPC dostávajú G-CSF, majú byť monitorovaní, až pokiaľ sa hematologické ukazovatele nevrátia na normálnu úroveň.
U normálnych darcov sa po podaní G-CSF pozorovali prechodné cytogenetické modifikácie. Význam týchto zmien nie je známy.
Sledovanie dlhodobej bezpečnosti darcov pokračuje. Napriek tomu nemožno vylúčiť zvýšené riziko malígnych myeloidných klonov. Odporúča sa, aby stredisko aferézy podávalo systematickú správu a sledovalo darcov kmeňových buniek , čím sa zabezpečí monitorovanie dlhodobej bezpečnosti.
U normálnych darcov a pacientov boli po podaní G-CSF hlásené bežné, ale obvykle asymptomatické prípady splenomegálie a veľmi zriedkavo prípady ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne. Z tohto dôvodu sa má dôkladne monitorovať veľkosť sleziny (napr. klinickým vyšetrením, ultrazvukom). Diagnóza ruptúry sleziny sa má zvážiť u darcov a/alebo pacientov, ktorí uvádzajú bolesť v ľavej hornej abdominálnej oblasti alebo v hornej časti ramena.
U normálnych darcov boli veľmi zriedkavo hlásené pľúcne nežiaduce udalosti (hemoptýza, krvácanie do pľúc, pľúcne infiltráty, dyspnoe a hypoxia) po uvedení na trh s inými liekmi obsahujucími filgrastím. V prípade podozrenia na pľúcne nežiaduce udalosti alebo ich potvrdenia sa má zvážiť predčasné ukončenie liečby filgrastímom a poskytnúť vhodná lekárska starostlivosť.
Osobitné upozornenia pre príjemcov alogénnych progenitorových buniek v periférnej krvi mobilizovaných filgrastímom
Najnovšie údaje naznačujú, že imunologické interakcie medzi alogénnym štepom PBPC a príjemcom môžu byť spojené so zvýšeným rizikom výskytu akútnej a chronickej GvHD v porovnaní s transplantáciou kostnej drene.
Osobitnéupozorneniaprepacientovsozávažnouchronickouneutropéniou(SCN)
Počty krvných buniek
Počty trombocytov sa majú dôkladne monitorovať, najmä počas prvých pár týždňov liečby filgrastímom.
U pacientov, u ktorých sa rozvinie trombocytopénia, t. j. trvalý pokles počtu trombocytov pod 100 x 109/l, sa má zvážiť občasné prerušenie liečby alebo zníženie dávky filgrastímu.
Vyskytujú sa ďalšie zmeny počtu krvných buniek vrátane anémie a prechodného zvýšenia počtu myeloidných progenitorov, čo si vyžaduje dôkladné sledovanie počtu krvných buniek.
Transformácia na leukémiu alebo myelodysplastický syndróm
Osobitná pozornosť sa má venovať odlíšeniu diagnózy závažnej chronickej neutropénie od ostatných porúch krvotvorby, ako je aplastická anémia, myelodysplázia a myeloidná leukémia. Pred začatím liečby sa má vyšetriť kompletný krvný obraz s diferenciálnym a absolútnym počtom trombocytov a má sa vyhodnotiť morfológia kostnej drene a karyotyp.
V klinickej štúdii bol nízky výskyt (približne 3 %) myelodysplastických syndrómov (MDS) alebo leukémie u pacientov so závažnou chronickou neutropéniou liečených filgrastímom. Toto pozorovanie sa vykonalo
len u pacientov s kongenitálnou neutropéniou. MDS a leukémie sú prirodzené komplikácie tohto ochorenia a ich súvislosť s liečbou filgrastímom nie je jasná. U podskupiny približne 12 % pacientov s normálnymi cytogenetickými výsledkami vo východiskovom bode sa pri rutinnom opakovanom vyhodnotení postupne zistili poruchy vrátane monozómie 7. Ak sa u pacientov so závažnou chronickou neutropéniou vyvinú abnormality cytogenetiky, majú sa dôkladne zvážiť riziká a výhody pokračovania liečby filgrastímom; ak sa objaví MDS alebo leukémia, liečba filgrastímom sa musí ukončiť. V súčasnosti nie je jasné, či dlhotrvajúca liečba pacientov so závažnou chronickou neutropéniou predisponuje pacientov k cytogenetickým poruchám, MDS alebo leukemickej transformácii. U pacientov sa odporúča v pravidelných intervaloch vykonávať morfologické a cytogenetické vyšetrenie kostnej drene (približne každých 12 mesiacov).
Splenomegália
Po podaní filgrastímu boli hlásené menej časté prípady splenomegálie a ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne. U ľudí s bolesťami v oblasti ľavej hornej časti brušnej dutiny a/alebo hornej časti ramena a dostávajú filgrastím, treba sledovať zväčšenie sleziny alebo ruptúru sleziny.
Ďalšie osobitné upozornenia
Musia sa vylúčiť príčiny prechodnej neutropénie, ako sú vírusové infekcie.
Zväčšenie sleziny je priamym dôsledkom liečby filgrastímom. V štúdiách sa u 31 % pacientov zaznamenala hmatateľná splenomegália. Hneď na začiatku liečby filgrastímom sa rádiologicky zistilo zväčšenie objemu sleziny, ktoré sa postupne stabilizovalo. Zistilo sa, že zníženie dávok viedlo k spomaleniu alebo zastaveniu
zväčšovania sleziny a u 3 % pacientov bola nutná splenektómia. Veľkosť sleziny sa má pravidelne sledovať. Na zistenie abnormálneho zväčšenia objemu sleziny postačuje palpačné vyšetrenie brucha.
U malého počtu pacientov sa vyskytla hematúria/proteinúria. Na sledovanie tohto stavu sa má pravidelne vyšetrovať moč.
Bezpečnosť a účinnosť lieku u novorodencov a pacientov s autoimúnnou neutropéniou neboli stanovené. OsobitnéupozorneniaprepacientovsHIVinfekciou
Počty krvných buniek
Absolútny počet neutrofilov (ANC) sa má dôkladne monitorovať, najmä počas prvých pár týždňov liečby filgrastímom. Niektorí pacienti môžu veľmi rýchlo reagovať na prvú dávku filgrastímu výrazným zvýšením počtu neutrofilov. Počas prvých 2 až 3 dní podávania filgrastímu sa odporúča denne monitorovať ANC. Následne sa odporúča monitorovať ANC aspoň dvakrát týždenne počas prvých dvoch týždňov liečby a potom raz týždenne alebo každé dva týždne počas udržiavacej liečby. Počas prerušovaného dávkovania na úrovni 30 MU (300 mikrogramov)/deň filgrastímu sa môžu objaviť veľké výkyvy hodnôt ANC u pacientov. Na určenie dolnej hranice ANC u pacienta sa odporúča odobrať vzorky krvi na zistenie ANC bezprostredne pred akýmkoľvek plánovaným podaním filgrastímu.
Riziko spojené so zvýšenými dávkami myelosupresívnych liekov
Liečba samotným filgrastímom nevylučuje výskyt trombocytopénie a anémie v dôsledku myelosupresívnych terapií. Následkom možného prijatia vyšších dávok alebo väčšieho množstva týchto liekov spolu s liečbou filgrastímom sa u pacienta môže vyskytnúť zvýšené riziko rozvoja trombocytopénie a anémie. Odporúča sa pravidelné monitorovanie krvného obrazu (pozri vyššie).
Infekcie a malígne ochorenia spôsobujúce myelosupresiu
Neutropénia môže byť spôsobená infliltráciou kostnej drene oportúnnymi infekciami, ako je komplex Mycobacterium avium, alebo malígnymi ochoreniami, napríklad lymfómom. U pacientov so známou infiltráciou kostnej drene infekciami alebo malígnym ochorením sa má okrem podávania filgrastímu na liečbu neutropénie zvážiť aj vhodná liečba základného ochorenia. Účinky filgrastímu na neutropéniu zapríčinenú infiltráciou kostnej drene infekciou alebo malígnym ochorením neboli dostatočne preukázané.
Splenomegália
Po podaní filgrastímu boli hlásené menej časté prípady splenomegálie a ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne. U ľudí s bolesťami v oblasti ľavej hornej časti brušnej dutiny a/alebo hornej časti ramena a dostávajú filgrastím, treba sledovať zväčšenie sleziny alebo ruptúru sleziny.
Osobitnéupozorneniaprikosáčikovitejčrte(heterozygotnomhemoglobíneS)akosáčikovitejanémii
U pacientov s kosáčikovitou črtou alebo s kosáčikovitou anémiou sa zaznamenala po použití filgrastímu kríza kosáčikovitej anémie, v niektorých prípadoch fatálna. Lekári musia byť opatrní, keď zvažujú podávanie filgrastímu pacientom s kosáčikovitou črtou alebo s kosáčikovitou anémiou, a majú sa rozhodnúť až po starostlivom zvážení potenciálnych rizík a výhod.
Pomocnélátky
Nivestim obsahuje sorbitol. Pacienti so zriedkavými dedičnými problémami fruktózovej intolerancie nemajú používať tento liek. Tiež obsahuje menej ako 1 mmol sodíka (23 mg) v dávke, t.j.v podstate „bez sodíka“.
4.5 Liekové a iné interakcie
Bezpečnosť a účinnosť filgrastímu, ktorý sa podáva v rovnaký deň ako myelosupresívna cytotoxická chemoterapia, sa definitívne nestanovila. Filgrastím sa neodporúča podávať v období od 24 hodín pred chemoterapiou až do 24 hodín po chemoterapii vzhľadom na citlivosť rýchlo sa deliacich myeloidných buniek na myelosupresívnu cytotoxickú chemoterapiu. Predbežné dôkazy pozorované u malej skupiny pacientov liečených súbežne filgrastímom a 5-fluórouracilom naznačujú, že závažnosť neutropénie sa môže zhoršiť.
Možné interakcie s inými krvotvornými rastovými faktormi a cytokínmi sa doposiaľ v klinických štúdiách nepreskúmali.
Keďže lítium podporuje uvoľňovanie neutrofilov, pravdepodobne môže zvýšiť účinok filgrastímu. Hoci táto interakcia nebola formálne preskúmaná, neexistuje dôkaz, že takáto interakcia je škodlivá.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití u gravidných žien . Štúdie na zvieratách preukázali reprodukčnú toxicitu. Zvýšený výskyt potratov bol pozorovaný u králikov pri vysokých násobkoch klinickej expozície a v prítomnosti toxicity matky (pozri časť 5.3). Existujú literárne údaje popisujúce transplacentárny prechod filgrastímu u gravidných žien. Filgrastím sa neodporúča počas gravidity.
Laktácia
Nie je známe, či sa filgrastím vylučuje do ľudského mlieka, preto sa neodporúča používať filgrastím u dojčiacich žien. Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu flgrastímom sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Filgrastím neovplyvnil reprodukčnú schopnosť ani fertilitu samcov alebo samíc potkanov (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Filgrastím má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Ak pacient pociťuje únavu, odporúča sa zvýšiť pozornosť pri vedení vozidiel alebo obsluhe strojov.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Počas klinických štúdií sa Nivestim podával 183 pacientom s nádorovým ochorením a 96 zdravým
dobrovoľníkom.
V klinických štúdiách sa profil bezpečnosti filgrastímu zhodol s tým, ktorý bol hlásený pri referenčnom lieku použitom v týchto štúdiách.
V klinických skúšaniach u pacientov s nádorovým ochorením bola najčastejšou nežiaducou reakciou súvisiacou s filgrastímom pri odporúčanom dávkovaní muskuloskeletálna bolesť, ktorá bola mierna alebo stredne silná u 10 % pacientov a silná u 3 % pacientov.
Bola hlásená aj reakcia štepu proti hostiteľovi (Graft versus Host Disease, GvHD) (pozri nižšie). Pri mobilizácii PBPC u normálnych darcov bola najčastejšou hlásenou nežiaducou reakciou
muskuloskeletálna bolesť. U darcov sa pozorovala leukocytóza a po podaní filgrastímu a po
leukaferéze sa u darcov pozorovala aj prechodná trombocytopénia. Boli hlásené aj prípady splenomegálie a ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne.
U pacientov s SCN boli najčastejšími nežiaducimi reakciami spôsobenými filgrastímom bolesť kostí, celková muskuloskeletálna bolesť a splenomegália.
Syndróm kapilárneho presakovania, ktorý môže ohroziť život, ak sa oneskorí liečba, sa zaznamenal menej často (≥ 1/1 000 až < 1/100) po podaní faktorov stimulujúcich kolónie granulocytov u pacientov s rakovinou, ktorí podstupujú chemoterapiu a u normálnych darcov, podstupujúcich mobilizáciu
PBPC ( pozri nižšie a časť 4.4).
V klinických štúdiách u pacientov s HIV boli jedinými nežiaducimi reakciami, ktoré sa pripisovali podávaniu filgrastímu, muskuloskeletálna bolesť, bolesť kostí a myalgia. Výskyt týchto prípadov bol podobná ako u pacientov s nádorovým ochorením.
Súhrn nežiaducichreakciízoradenýchdotabuľky
Na základe publikovaných informácií sa počas liečby filgrastímom vyskytli nasledujúce nežiaduce reakcie
a ich frekvencie.
Zhodnotenie nežiaducich reakcií je založené na nasledujúcich frekvenciách výskytu: Veľmi časté: ≥ 1/10
Časté: ≥ 1/100 až < 1/10
Menej časté: ≥ 1/1 000 až < 1/100
Zriedkavé: ≥ 1/10 000 až < 1/1 000
Veľmi zriedkavé: < 1/10 000
Neznáme: častosť sa nedá sa odhadnúť z dostupných údajov
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané podľa klesajúcej závažnosti.
U pacientov s nádorovým ochorením
Trieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy metabolizmu a výživy Veľmi časté Zvýšené hodnoty alkalickej fosfatázy, laktátdehydrogenázy (LDH)
a kyseliny močovej
Poruchy nervového systému Časté Bolesť hlavy
Poruchy ciev Menej časté Syndrom zvýšené propustnosti kapilár
Zriedkavé Poruchy ciev, angiopatia
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Časté Kašeľ, bolesť hrdla Veľmi zriedkavé Pľúcne infiltráty Veľmi časté Nevoľnosť/vracanie
Časté Zápcha, anorexia, hnačka, mukozitída

Poruchy pečene a žlčových ciest Veľmi časté Zvýšené hodnoty gama-
glutamyltransferázy (GGT)
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Celkové poruchy a reakcie v mieste podania
Časté Alopécia, vyrážka
Veľmi zriedkavé Sweetov syndróm, kožná vaskulitída
Veľmi časté Bolesť hrude, muskuloskeletálna bolesť
Veľmi zriedkavé Zhoršenie symptómov reumatickej artritídy
Veľmi zriedkavé Abnormality močového systému
Časté Únava, všeobecná slabosť Menej časté Nešpecifikovaná bolesť Veľmi zriedkavé Alergická reakcia
U
normálnych
darcovpodstupujúcichPBPCmobilizáciu
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy krvi a lymfatického
systému
Veľmi časté Leukocytóza, trombocytopénia
Menej časté Porucha sleziny
Poruchy metabolizmu a výživy Časté Zvýšené hodnoty alkalickej fosfatázy a LDH
Menej časté Zvýšené hodnoty SGOT, nadbytok kyseliny močovej v krvi
Poruchy nervového systému Veľmi časté Bolesť hlavy
Poruchy ciev Menej časté Syndrom zvýšené propustnosti kapilár
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Celkové poruchy a reakcie v mieste podania
Veľmi časté Muskuloskeletálna bolesť
Menej časté Reumatická artritída a zhoršenie symptómov artritídy
Menej časté Závažná alergická reakcia
U
pacientov
s
o
závažnou
chronickou
neutropéniou
(SCN)
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy krvi a lymfatického systému
Veľmi časté Anémia, splenomegália Časté Trombocytopénia Menej časté Porucha sleziny
Poruchy metabolizmu a výživy Veľmi časté Znížené hodnoty glukózy v krvi, zvýšené hodnoty alkalickej fosfatázy, LDH, a nadbytok kyseliny močovej v krvi
Poruchy nervového systému Časté Bolesť hlavy
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Veľmi časté Epistaxa
Časté Hnačka
Poruchy pečene a žlčových ciest Časté Hepatomegália

Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Časté Alopécia, kožná vaskulitída, bolesť v mieste injekcie, výražka
Veľmi časté Muskuloskeletálna bolesť
Časté Osteoporóza
Menej časté Hematúra, proteinúia
U
pacientov
s
H
I
V
infekciou
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy krvi a lymfatického systému
Poruchy svalovej a kostrovej sústavy a spojivového tkaniva

Časté Poruchy sleziny
Veľmi časté Muskuloskeletálna bolesť
Popis
vy
braných
nežiaducich
reakcií
U pacientov, ktorí dostávali G-CSF po alogénnej transplantácii kostnej drene, boli hlásené reakcie
štepu proti hostiteľovi (Graft versus Host Disease, GvHD) a úmrtia (pozri časť 5.1).
Po uvedení faktora stimulujúceho kolónie granulocytov na trh sa zaznamenali prípady syndrómu kapilárneho presakovania. Zvyčajne sa vyskytovali u pacientov s pokročilým nádorovým ochorením, sepsou, u pacientov liečených kombinovanou chemoterapiou alebo podstupujúcich aferézu (pozri časť 4.4).
U pacientov s nádorovým ochorením
Muskuloskeletálna bolesť sa dá zvyčajne zvládnuť štandardnými analgetikami. Menej časté nežiaduce rekcie
zahŕňajú abnormality močového systému prevažne miernu až stredne silnú dyzúriu.
V randomizovaných, placebom kontrolovaných klinických skúšaniach filgrastím nezvýšil výskyt nežiaducich reakcií spojených s cytotoxickou chemoterapiou. Nežiaduce reakcie hlásené s rovnakou frekvenciou u pacientov liečených kombináciou filgrastím/chemoterapia a placebo/chemoterapia zahŕňajú nauzeu a vracanie, alopéciu, hnačku, únavu, anorexiu, mukozitídu, bolesť hlavy, kašeľ, kožnú vyrážku, bolesť v hrudi, celkovú slabosť, bolesť v hrdle, zápchu a nešpecifikovanú bolesť.
U približne 50 %, 35 %, 25 % a 10 % pacientov, jednotlivo u odporúčaných dávok, liečených filgrastímom sa vyskytli reverzibilné, závislé od dávky a zvyčajne mierne alebo stredne závažne zvýšené hodnoty laktátdehydrogenázy, alkalickej fosfatázy, kyseliny močovej a gamma-glutamyltransferázy.
Príležitostne boli hlásené prechodné zníženia krvného tlaku nevyžadujúce si klinickú liečbu.
U pacientov, ktorí dostávali vysoké dávky chemoterapie pred autológnou transplantáciou kostnej drene, boli hlásené cievne poruchy zahrňujúce veno-okluzívne ochorenie a poruchy objemu telesných tekutín. Príčinná súvislosť s liečbou filgrastímom nebola stanovená.
U pacientov liečených filgrastímom boli hlásené veľmi zriedkavé udalosti kožnej vaskulitídy. U pacientov liečených filgrastímom nie je známy mechanizmus vaskulitídy.
Výskyt Sweetovho syndrómu (akútna febrilná neutrofilná dermatóza) bol hlásený príležitostne. Nakoľko však významné percento týchto pacientov malo leukémiu, stav, ktorý je spojený so Sweetovým syndrómom, príčinná súvislosť s liečbou filgrastímom nebola stanovená.
V jednotlivých prípadoch bolo hlásené zhoršenie existujúcej reumatoidnej artritídy.
V niektorých prípadoch boli hlásené zriedkavé pľúcne nežiaduce udalosti, zahŕňajúce intersticiálnu pneumóniu, pľúcny edém a pľúcne infiltráty, vedúce k respiračnému zlyhaniu alebo syndrómu respiračnej tiesne dospelých (ARDS), ktoré môžu byť fatálne (pozri časť 4.4).
Alergické reakcie: U pacientov dostávajúcich filgrastím sa počas počiatočnej alebo následnej liečby vyskytli reakcie alergického typu vrátane anafylaxie, kožnej vyrážky, žihľavky, angioedému (bolestivý opuch tváre alebo hrdla), dyspnoe a nízkeho krvného tlaku. Celkovo boli hlásenia častejšie po intravenóznom podaní. V niektorých prípadoch sa symptómy vyskytli opätovne, takže sa predpokladá príčinný vzťah. Liečba filgrastímom sa musí natrvalo ukončiť u pacientov, u ktorých sa vyskytla závažná alergická reakcia.
U pacientov s bunkami s kosáčikovitou črtou (heterozygotnýmhemoglobínomS) alebo s kosáčikovitou anémiou sa vyskytli ojedinelé prípady kríz kosáčikovitej anémie (pozri časť 4.4). Z údajov z klinických skúšaní je odhadovaná frekvencia výskytu ako „menej časté“.
U pacientov s rakovinou liečených filgrastímom sa zaznamenala pseudodna.
U normálnych darcovpodstupujúcichPBPCmobilizáciu
Leukocytóza (biele krvinky WBC > 50 x 109/l) sa vyskytla u 41 % darcov a prechodná trombocytopénia
(krvné doštičky < 100 x 109/l) po podaní filgrastímu a po leukaferéze sa vyskytla u 35 % darcov.
U normálnych darcov, ktorí sa liečia filgrastímom, boli hlásené prechodné mierne zvýšené hodnoty alkalickej fosfatázy, laktátdehydrogenázy (LDH), SGOT a kyseliny močovej; bez klinickej súslednosti.
Veľmi zriedkavo bolo pozorované zhoršenie symptómov artritídy.
Veľmi zriedkavo boli hlásené príznaky pripomínajúce závažné alergické reakcie.
V štúdiách s PBPC darcami boli hlásené bolesti hlavy, pravdepodobne spôsobené podaním filgrastímu. U normálnych darcov a pacientov boli po podaní G-SCF hlásené bežné, ale obvykle asymptomatické
prípady splenomegálie a veľmi zriedkavo prípady ruptúry sleziny (pozri časť 4.4 ).
U normálnych darcov boli, po uvedení iných liekov obsahujúcich filgrastím na trh, veľmi zriedkavo hlásené pľúcne nežiaduce udalosti (hemoptýza, krvácanie do pľúc, pľúcne infiltráty, dyspnoe a hypoxia) (pozri časť
4.4).
U pacientov so závažnouchronickouneutropéniou(SCN)
U pacientov s SCN liečených filgrastímom boli hlásené nežiaduce reakcie a u niektorých pacientov sa ich
výskyt časom znižoval.
Medzi nežiaduce reakcie patria splenomegália, ktorá môže mať u malého počtu pacientov progresívny charakter a trombocytopénia. Krátko po začiatku liečby filgrastímom sa u menej ako 10 % pacientov vyskytli bolesť hlavy a hnačka. Tiež boli hlásené anémia a krvácanie z nosa.
Pozorovalo sa prechodné zvýšenie hladiny sériovej kyseliny močovej, laktátdehydrogenázy a alkalickej fosfatázy bez klinických prejavov, ako aj prechodný mierny pokles hladiny glukózy v krvi po požití potravy.
U < 2 % pacientov s SCN sa vyskytli nežiaduce reakcie pravdepodobne spojené s liečbou filgrastímom, a to bolesť v mieste podania, bolesť hlavy, hepatomegália, bolesť kĺbov, alopécia, osteoporóza a vyrážka.
U 2 % pacientov s SCN sa pri dlhodobej liečbe vyskytla kožná vaskulitída. V ojedinelých prípadoch sa vyskytla proteinúria alebo hematúria.
U pacientov s HIV infekciou
U menej ako 3 % pacientov liečených filgrastímom sa pozorovala splenomegália. Vo všetkých prípadoch
bola splenomegália mierna alebo stredne závažná a zistila sa palpačným vyšetrením. Klinický nález bol benígny; žiadny pacient nemal diagnózu hypersplenizmu a žiadny pacient nepodstúpil splenektómiu. Hoci
je splenomegália bežným nálezom u pacientov s infekciou HIV a vyskytuje sa v rôznych stupňoch závažnosti u väčšiny pacientov s AIDS, súvislosť s liečbou filgrastímom nie je jasná.
Pediatrická populáciaÚdaje z klinických štúdií u pediatrických pacientov poukazujú na to, že bezpečnosť a účinnosť
filgrastímu u dospelých a u detí liečených cytotoxickou chemoterapiou sú podobné, čo naznačuje, že neexistujú žiadne rozdiely vo farmakokinetických vlastnostiach filgrastímu súvisiace s vekom. Jediným konzistentne hláseným nežiaducim účinkom bola muskuloskeletálna bolesť‚ čo sa zhoduje so skúsenosťami u dospelej populácie.
Na ďalšie vyhodnotenie používania filgrastímu u pediatrických pacientov nie sú k dispozícii dostatočné informácie.
Ďalšie osobitnépopulácieGeriatricképoužitieMedzi pacientmi vo veku nad 65 rokov sa nepozorovali žiadne celkové rozdiely v bezpečnosti ani účinnosti v porovnaní s mladšími dospelými (vo veku > 18 rokov) pacientmi dostávajúcimi cytotoxickú chemoterapiu a klinické skúsenosti neodhalili žiadne rozdiely v odpovediach medzi staršími a mladšími dospelými pacientmi. Nie sú k dispozícii dostatočné údaje na vyhodnotenie používania filgrastímu u geriatrických pacientov pre ostatné schválené indikácie filgrastímu.
PediatrickípacientisSCNU pediatrických pacientov s ťažkou chronickou neutropéniou dostávajúcich chronickú liečbu filgrastímom boli hlásené prípady zníženej hustoty kostného tkaniva a osteoporózy. Frekvencia je odhadovaná z údajov získaných počas klinického skúšania ako „častá“.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v Prílohe V.
4.9 PredávkovanieÚčinky predávkovania filgrastímom neboli stanovené.
Prerušenie liečby filgrastímom zvyčajne vedie k 50 % zníženiu počtu neutrofilov v priebehu 1 až 2 dní s návratom počtu neutrofilov na normálne hodnoty v priebehu 1 až 7 dní.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Imunostimulanciá, faktory stimulujúce kolónie, ATC kód: L03AA02
Nivestim je biologicky podobný liek. Podrobné informácie sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.Ľudský G-CSF je glykoproteín, ktorý reguluje tvorbu a uvoľňovanie funkčných neutrofilov z kostnej drene. Filgrastím obsahujúci r-metHuG-CSF (filgrastím) spôsobuje výrazné zvýšenie počtu neutrofilov v periférnej krvi do 24 hodín s malým vzostupom počtu monocytov. U niektorých pacientov s SCN môže filgrastím indukovať aj mierne zvýšenie počtu cirkulujúcich eozinofilov a bazofilov oproti východiskovej hodnote; niektorí z týchto pacientov môžu mať eozinofíliu alebo bazofíliu už pred liečbou. Pri dodržaní odporúčaných dávok závisí zvýšenie počtu neutrofilov od veľkosti dávky. Neutrofily vytvorené ako odpoveď na liečbu filgrastímom vykazujú normálnu alebo zlepšenú funkciu, čo preukázali testy chemotaktickej a fagocytárnej
aktivity. Po ukončení liečby filgrastímom klesá počet cirkulujúcich neutrofilov o 50 % v priebehu 1 až 2 dní a normálne hodnoty sa dosiahnu v priebehu 1 až 7 dní.
Použitie filgrastímu u pacientov podstupujúcich cytotoxickú chemoterapiu vedie k významnému zníženiu výskytu, závažnosti a skráteniu trvania neutropénie a febrilnej neutropénie. Liečba filgrastímom významne skracuje trvanie febrilnej neutropénie, antibiotickej liečby a hospitalizácie po indukovanej chemoterapii pri akútnej myelogénnej leukémii alebo po myeloablatívnej liečbe pred transplantáciou kostnej drene. Výskyt horúčky a zaznamenaných infekcií nebol znížený v žiadnom z prípadov. U pacientov podstupujúcich myeloablatívnu terapiu pred transplantáciou kostnej drene nebolo trvanie horúčky kratšie.
Použitie filgrastímu, či už samotného alebo po chemoterapii, vedie k mobilizácii hematopoetických progenitorových buniek v periférnej krvi. Tieto autológne PBPC je možné odobrať a podať vo forme transfúzie po cytotoxickej terapii s vysokými dávkami, či už namiesto transplantácie kostnej drene alebo ako doplnok k nej. Infúzne podanie PBPC urýchľuje obnovu krvotvorby pri súčasnom znížení rizika hemoragických komplikácií a potreby transfúzií trombocytov.
U príjemcov alogénnych PBPC mobilizovaných filgrastímom došlo výrazne rýchlejšie k obnove hematologických parametrov, čo viedlo k významnému skráteniu času do obnovy počtu trombocytov bez podpornej liečby v porovnaní s alogénnou transplantáciou kostnej drene.
Jedna retrospektívna európska štúdia hodnotiaca použitie G-CSF po alogénnej transplantácii kostnej drene u pacientov s akútnou leukémiou naznačila zvýšené riziko GvHD, mortality spojenej s liečbou (TRM) a mortality v prípade podania G-CSF. V inej retrospektívnej medzinárodnej štúdii u pacientov s akútnou a chronickou myelogénnou leukémiou sa nezistil žiadny vplyv na riziko GvHD, TRM a mortality. Metaanalýzou štúdií s alogénnou transplantáciou vrátane výsledkov z deviatich perspektívnych randomizovaných skúšaní, ôsmych retrospektívnych štúdií a jednej štúdie s kontrolovanými prípadmi sa nezistil vplyv na riziko akútnej GvHD, chronickej GvHD ani mortality spojenej so skorou liečbou.
Relatívne riziko (95 % IS) GvHD a TRM
po liečbe s G-CSF po transplantácii kostnej drene
P
ublikácia Obdobie trvania štúdie
N Akútny II. – IV. stupeň GvHD
C
hronická
G
vHD
TRM
Metaanalýza
(2003)
Európska retrospektívna štúdia (2004)
1986 – 2001a 1198 1,08
(0,87; 1.33)
1992 – 2002b 1789 1,33
(1,08; 1,64)
1,02
(0,82; 1,26)
1,29
(1,02; 1,61)
0,70
(0,38; 1,31)
1,73
(1,30; 2,32)
Medzinárodná retrospektívna štúdia (2006)
1995 – 2000b 2110 1,11
(0,86; 1,42)
1,10
(0,86; 1,39)
1,26
(0,95; 1,67)


a Analýza zahŕňa štúdie s pacientmi po transplantácii kostnej drene počas tohto obdobia; niektoré štúdie použili GM-CSF
b Analýza zahŕňa pacientov, ktorí podstupujú transplantáciu kostnej drene počas tohto obdobia
Pred alogénnou transplantáciou PBPC sa použitie filgrastímu na mobilizáciu PBPC u normálnych darcov
umožňuje odber 4 x 106 CD34+ buniek/kg telesnej hmotnosti príjemcu, a to u väčšiny darcov po dvoch leukaferézach. Normálnym darcom sa podáva dávka 10 μg/kg/deň, podaná subkutánne v priebehu 4 až 5 po sebe nasledujúcich dňoch.
Použitie filgrastímu u detí alebo dospelých s SCN (závažná kongenitálna, cyklická a idiopatická neutropénia) spôsobuje pretrvávajúci nárast ACN v periférnej krvi a redukuje výskyt infekcií a s nimi súvisiacich príhod.
Použitie filgrastímu u pacientov s infekciou HIV vedie k udržaniu normálneho počtu neutrofilov, čo umožňuje plánované dávkovanie antivírusových a/alebo iných myelosupresívnych liekov. U pacientov s infekciou HIV liečených filgrastímom nebolo dokázané žiadne zvýšenie replikácie HIV.
Tak ako iné hematopoetické rastové faktory, G-CSF vykazuje in vitro stimulačné vlastnosti na ľudské endotelové bunky.
Bezpečnosť a účinnosť Nivestimu bola stanovená v randomizovanej, kontrolovanej štúdii III. fázy u pacientov s karcinómom prsníka. S ohľadom na trvanie závažnej neutropénie a výskyt febrilnej neutropénie neboli zistené rozdiely medzi Nivestimom a referenčným liekom.
5.2 Farmakokinetické vlastnosti
Randomizovaná, otvorená, jednodávková, komparátorom kontrolovaná, dvojito - prekrížená štúdia vykonaná u 46 zdravých dobrovoľníkov preukázali, že farmakokinetický profil Nivestimu bol porovnateľný s profilom referenčného lieku po subkutánnom a intravenóznom podaní. Ďalšia randomizovaná, dvojito zaslepená, viacdávková, komparátorom kontrolovaná, dvojito - prekrížená štúdia vykonaná u 50 zdravých dobrovoľníkov preukázali, že farmakokinetický profil Nivestimu bol porovnateľný s profilom referenčného lieku po subkutánnom podaní.
Klírens filgrastímu po subkutánnom a po intravenóznom podaní sa dá charakterizovať farmakokinetikou
1.rádu. Priemerný polčas eliminácie filgrastímu zo séra je približne 3,5 hod s hodnotou klírens približne
0,6 ml/min/kg. Kontinuálna infúzia filgrastímu pacientom, ktorí sa zotavili po autológnej transplantácii kostnej drene, trvajúca až do 28 dní neviedla k akumulácii lieku a polčas eliminácie mal porovnateľné hodnoty. Koncentrácia filgrastímu v sére je priamo úmerná dávke, či už podaného intravenózne alebo subkutánne. Po subkutánnom podaní lieku v odporúčaných dávkach sa v sére koncentrácie udržovali nad
10 µg/ml počas 8 až 16 hodín. Distribučný objem v krvi je približne 150 ml/kg
5.3 Predklinické údaje o bezpečnosti
Filgrastím sa skúmal v štúdiách toxicity po opakovanom podávaní počas 1 roka, ktoré odhalili zmeny, ktoré možno pripísať očakávaným farmakologickým účinkom, vrátane zvýšenia leukocytov, myeloidnej hyperplázie kostnej drene, extramedulárnej granulopoézy a zväčšenia sleziny. Všetky tieto zmeny ustúpili po prerušení liečby.
Účinky filgrastímu na prenatálny vývoj sa skúmali u potkanov a králikov. Intravenózne (80 µg/kg/deň) podávanie filgrastímu králikom počas organogenézy bolo toxické pre matku a pozorovala sa zvýšená frekvencia spontánnych potratov, postimplantačných strát a znížená priemerná veľkosť vrhu a hmotnosť plodu.
Na základe hlásených údajov od iných liekov obsahujúcich filgrastím sa pozorovali porovnateľné nálezy plus zvýšené malformácie plodu pri dávke 100 µg/kg/deň, čo je pre matku toxická dávka, ktorá zodpovedá systémovej expozícii približne 50-90-násobku expozícií pozorovaných u pacientov liečených klinickou dávkou 5 µg/kg/deň. Hladina bez pozorovaného nežiaduceho účinku embryo-fetálnej toxicity bola v tejto štúdii 10 µg/kg/deň, čo zodpovedá systémovej expozícii približne 3-5-násobku expozícií pozorovaných u pacientov liečených klinickou dávkou.
U gravidných potkanov sa nepozorovala maternálna ani fetálna toxicita pri dávkach až 575 µg/kg/deň. Potomkovia potkanov, ktorým sa podával filgrastím počas perinatálneho obdobia a laktácie, vykazovali oneskorenie vo vonkajšej diferenciácii a spomalenie rastu (≥ 20 µg/kg/deň) a mierne zníženú mieru prežívania (100 µg/kg/deň).
Filgrastím nemá žiadny pozorovaný vplyv na fertilitu samcov alebo samíc potkanov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Ľadová kyselina octová Hydroxid sodný Sorbitol (E420) Polysorbát 80
Voda na injekciu
6.2 Inkompatibility
Nivestim sa nesmie riediť s roztokmi chloridu sodného.
Zriedený filgrastím sa môže adsorbovať na sklenené alebo plastové materiály pokiaľ nie je zriedený v infúznom roztoku glukózy 50 mg/ml (5 %) (pozri časť 6.6).
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Naplnenáinjekčnástriekačka
30 mesiacov
Pozriedení: Chemická a fyzikálna stabilita pri používaní zriedeného roztoku na infúziu bola dokázaná počas
24 hodín pri teplote 2 °C až 8 °C. Z mikrobiologického hľadiska sa má liek použiť ihneď. Ak sa nepoužije hneď, za čas a podmienky uchovávania pred použitím je zodpovedný používateľ a obvykle by sa nemalo presiahnuť 24 hodín pri teplote 2 °C až 8 °C, pokiaľ zriedenie neprebehlo za kontrolovaných a schválených aseptických podmienok.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2 °C – 8 °C).
Neuchovávajte v mrazničke. Uchovávajte naplnenú injekčnú striekačku v vonkajšom obale na ochranu pred svetlom.
Náhodné vystavenie teplotám pod bodom mrazu do 24 hodín neovplyvní stabilitu Nivestimu.
Zmrazená injekčná liekovka môže byť rozmrazená a následne znovu schladená na ďalšie použitie. Ak je vystavenie dlhšie ako 24 hodín alebo došlo k zmrazeniu viac ako jedenkrát, Nivestim sa nemá použiť.
V rámci času použiteľnosti a na účely ambulantného použitia, môže pacient vybrať liek z chladničky
a uskladniť do pri izbovej teplote (neprevyšujúcej 25 °C) pre jednorazové použitie do 7 dní. Po tomto čase sa liek nemá uskladniť späť do chladničky, ale sa má zlikvidovať.
Podmienky na uchovávanie po riedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Naplnená injekčná striekačka (sklo typu I) s injekčnou ihlou (z nehrdzavejúcej ocele), s ochranným krytom ihly, obsahujúca 0,2 ml injekčného a infúzneho roztoku.
Veľkosti balenia 1, 5, 8 alebo 10 naplnených injekčných striekačiek. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Ak je to potrebné, Nivestim sa môže riediť v infúznom roztoku glukózy 50 mg/ml (5 %).
Riedenie na konečnú koncentráciu < 0,2 MU (2 mikrogramy)/ml sa v žiadnom prípade neodporúča. Pred použitím sa má roztok vizuálne skontrolovať. Majú sa použiť len číre roztoky bez častíc.
U pacientov liečených filgrastímom zriedeným na koncentrácie menej ako 1,5 MU (15 mikrogramov)/ml sa má ku konečnej koncentrácii 2 mg/ml pridať ľudský sérový albumín (HSA).
Príklad: V konečnom objeme 20 ml sa má k celkovej dávke filgrastímu nižšej ako 30 MU (300 mikrogramov) pridať 0,2 ml roztoku 20 %ľudského sérového albumínu.
Po zriedení v infúznom roztoku glukózy s koncentráciou 50 mg/ml (5 %) je filgrastím kompatibilný so sklom a rôznymi plastmi vrátane polyvinylchloridu (PVC), polyolefínu (kopolymér polypropylénu a polyetylénu) a polypropylénu.
Nivestim neobsahuje žiadne konzervačné látky: Z hľadiska možného rizika mikrobiologickej kontaminácie sú injekčné striekačky Nivestimu určené len na jednorazové použitie. Nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIHospira UK Limited
Horizon Honey Lane Hurley Maidenhead SL6 6RJ
Veľká Británia
Tel: + 44 (0) 1628 515500
Fax: + 44 (0) 1628 829827
8. REGISTRAČNÁ ČÍSLAEU/1/10/631/001
EU/1/10/631/002
EU/1/10/631/003
EU/1/10/631/010
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 08. júna 2010
Dátum posledného predĺženia registrácie: 27. máj 2015
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu/.
1. NÁZOV LIEKU
Nivestim 30 MU/ 0,5 ml injekčný a infúzny roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml injekčného a infúzneho roztoku obsahuje 60 miliónov jednotiek (MU) (600 mikrogramov)
filgrastímu*.
Každá naplnená injekčná striekačka obsahuje 30 miliónov jednotiek (MU) (300 mikrogramov) filgrastímu v
0,5 ml (0,6 mg/ml).
* rekombinovaný metionylový faktor stimulujúci kolónie granulocytov [G-CSF] produkovaný v Escherichia
Coli (BL21) technológiou rekombinantnej DNA.
Pomocnálátkasoznámymúčinkom:
Každý ml roztoku obsahuje 50 mg sorbitolu. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný a infúzny roztok (injekcia/infúzia). Číry, bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Filgrastím je indikovaný na skrátenie trvania neutropénie a zníženie výskytu febrilnej neutropénie u pacientov s nariadenou cytotoxickou chemoterapiou kvôli malígnemu nádorovému ochoreniu (s výnimkou chronickej myeloidnej leukémie a myelodysplastických syndrómov) a skrátenie trvania neutropénie u pacientov podstupujúcich myeloablatívnu terapiu pred transplantáciou kostnej drene, u ktorých sa predpokladá zvýšené riziko dlhotrvajúcej závažnej neutropénie.
U dospelých a detí, ktorí dostávajú cytotoxickú chemoterapiu je bezpečnosť a účinnosť filgrastímu podobná. Filgrastím je indikovaný na mobilizáciu progenitorových buniek v periférnej krvi (PBPC).
U pacientov, detí a dospelých, so závažnou kongenitálnou, cyklickou a idiopatickou neutropéniou
s absolútnym počtom neutrofilov (ANC) ≤ 0,5 x 109/l) a závažnými alebo opakujúcimi sa infekciami
v anamnéze je dlhodobé podávanie filgrastímu indikované na zvýšenie počtu neutrofilov a skrátenie trvania stavov súvisiaci s infekciou.
Filgrastím je indikovaný na liečbu perzistentnej neutropénie (ANC ≤ 1,0 x 109/l) u pacientov s pokročilou infekciou HIV na zníženie rizika výskytu bakteriálnych infekcií, keď nie sú vhodné iné terapeutické možnosti.
4.2 Dávkovanie a spôsob podávania
Liečba filgrastímom sa má podávať len v spolupráci s onkologickým centrom, ktoré má skúsenosti s liečbou
G-CSF a hematológiou a má potrebné diagnostické vybavenie. Postupy mobilizácie a aferézy sa majú
vykonávať v spolupráci s onkohematologickým centrom, ktoré má zodpovedajúce skúsenosti v tejto oblasti a v ktorom je možné správne vykonávať monitorovanie krvotvorných progenitorových buniek.
Dávkovanie
Nariadenácytotoxickáchemoterapia
Odporúčaná dávka filgrastímu je 0,5 MU (5 mikrogramov)/kg/deň. Prvá dávka filgrastímu sa má podať najmenej 24 hodín po cytotoxickej chemoterapii.
Podávanie dennej dávky filgrastímu má pokračovať pokiaľ neodznie očakávaný pokles počtu neutrofilov na minimum a ich počet sa nevráti na normálne hodnoty. Po nariadenej chemoterapii solídnych tumorov, lymfómov a pri lymfoidnej leukémii sa očakáva, že dĺžka liečby, ktorá spĺňa tieto kritériá, bude maximálne
14 dní. Po indukčnej a konsolidačnej terapii akútnej myeloidnej leukémie môže byť liečba podstatne dlhšia
(až 38 dní) v závislosti od typu, dávky a režimu použitej cytotoxickej chemoterapie.
U pacientov, ktorí dostávajú cytotoxickú chemoterapiu, sa zvyčajne 1 až 2 dni po začiatku liečby filgrastímom prejaví prechodné zvýšenie počtu neutrofilov. Z dôvodu dosiahnutia trvalej terapeutickej odpovede sa však liečba filgrastímom nemá prerušiť pred odznením očakávaného poklesu počtu neutrofilov na minimum a pokiaľ sa počet neutrofilov nevráti na normálne hodnoty. Predčasné ukončenie liečby filgrastímom pred odznením očakávaného poklesu počtu neutrofilov na minimum sa neodporúča.
U pacientov podstupujúcich myeloablatívnu terapiu, po ktorej nasleduje transplantácia kostnej drene
Odporúčaná dávka filgrastímu je 1,0 MU (10 mikrogramov)/kg/deň
Prvá dávka filgrastímu sa má podať najmenej 24 hodín po cytotoxickej chemoterapii a najmenej 24 hodín po infúzii kostnej drene.
Keď sa prekročí dolná hranica (nadir) počtu neutrofilov, denná dávka filgrastímu sa má titrovať v závislosti od zmeny počtu neutrofilov nasledovne:
Absolútny počet neutrofilov Úprava dávky Nivestimu
> 1,0 x 109/l počas 3 po sebe nasledujúcich dní Znížiť na 0,5 MU/kg/deň

Potom, ak ANC zostáva > 1,0 x 109/l počas ďalších 3 po sebe nasledujúcich dní
Prerušiť liečbu filgrastímom
Ak ANC klesne počas liečby na < 1,0 x 109/l, dávka filgrastímu sa má postupne zvyšovať podľa vyššie uvedených krokov.
Mobilizácia PBPC
Na mobilizáciu progenitorových buniek v periférnej krvi (PBPC) u pacientov podstupujúcich myelosupresívnu alebo myeloablatívnu terapiu, po ktorých nasleduje autológna transplantácia progenitorových buniek v periférnej krvi
Odporúčaná dávka filgrastímu na mobilizáciu PBPC v monoterapii je 1,0 MU (10 mikrogramov)/kg/deň počas 5 až 7 po sebe nasledujúcich dňoch. Načasovanie leukaferézy: 1 alebo 2 leukaferézy na 5. a 6. deň sú často postačujúce. Za iných okolností môžu byť potrebné ďalšie leukaferézy. Podávanie filgrastímu má pokračovať až do poslednej leukaferézy.
Odporúčaná dávka filgrastímu na mobilizáciu PBPC po myelosupresívnej chemoterapii je 0,5 MU
(5 mikrogramov)/kg/deň podávaná jedenkrát od prvého dňa po skončení chemoterapie, až pokiaľ neodznie očakávaný maximálny pokles počtu neutrofilov a kým sa počet neutrofilov nevráti na normálne hodnoty. Leukaferéza sa má vykonať v období, keď ANC stúpa z < 0,5 x 109/l na > 5,0 x 109/l. U pacientov, ktorí sa
nepodrobili extenzívnej chemoterapii, zvyčajne postačí jedna leukaferéza. V ostatných prípadoch sa odporúčajú ďalšie leukaferézy.
Na mobilizáciu progenitorových buniek v periférnej krvi (PBPC) u normálnych darcov pred alogénnou transplantáciou PBPC
V prípade mobilizácie PBPC u normálnych darcov sa má filgrastím podávať v dávke
10 mikrogramov/kg/deň subkutánnou injekciou počas 4 až 5 po sebe nasledujúcich dní. Leukaferéza sa má začať na 5. deň a ak je to potrebné, má pokračovať až do 6. dňa, aby sa získalo 4 x 106 CD34+ buniek/kg telesnej hmotnosti (BW) príjemcu.
Upacientovsozávažnouchronickouneutropéniou
Kongenitálna neutropénia: odporúčaná začiatočná dávka je 1,2 MU (12 mikrogramov)/kg/deň v jednej dávke alebo vo viacerých rozdelených dávkach.
Idiopatická alebo cyklická neutropénia: odporúčaná začiatočná dávka je 0,5 MU (5 mikrogramov)/kg/deň podaná subkutánne v jednej dávke alebo vo viacerých rozdelených dávkach.
Úprava dávkovania: Filgrastím sa má podávať jedenkrát denne, pokiaľ počet neutrofilov nedosiahne hodnotu 1,5 x 109/l a kým sa neudrží na ešte vyššej hodnote. Keď sa dosiahne odpoveď, má sa stanoviť minimálna účinná dávka na udržanie tejto hodnoty. Na udržanie adekvátneho počtu neutrofilov je potrebné dlhodobé každodenné podávanie lieku. Po 1 až 2 týždňoch liečby sa môže začiatočná dávka zdvojnásobiť alebo rozdeliť na polovicu v závislosti od odpovede pacienta. Potom sa dávka môže individuálne upravovať každé 1 až 2 týždne tak, aby sa priemerný počet neutrofilov udržal medzi hodnotami 1,5 x 109/l a 10 x 109/l. U pacientov so závažnými infekciami sa môže zvážiť rýchlejší režim zvyšovania dávky. V klinických štúdiách sa u 97 % pacientov, u ktorých sa dostavila odpoveď, dosiahla úplná odpoveď pri dávkach
≤ 24 mikrogramov/kg/deň. Dlhodobá bezpečnosť podávania filgrastímu v dávkach vyšších ako
24 mikrogramov/kg/deň u pacientov so závažnou chronickou neutropéniou nebola stanovená.
UpacientovsHIVinfekciou
Zvrat neutropénie
Odporúčaná začiatočná dávka filgrastímu je 0,1 MU (1 mikrogram)/kg/deň podávaná jedenkrát denne s titráciou až do maximálnej dávky 0,4 MU/kg/deň (4 mikrogramy/kg/deň), pokiaľ sa nedosiahne normálny počet neutrofilov a kým sa neudrží na tejto hodnote (ANC > 2,0 x 109/l). V klinických štúdiách odpovedalo na tieto dávky viac ako 90 % pacientov a zvrat neutropénie sa dosiahol v priemere po 2 dňoch.
U malého počtu pacientov (< 10 %) boli na dosiahnutie zvratu neutropénie potrebné dávky až 1,0 (10 mikrogramov)/kg/deň.
Na udržanie normálneho počtu neutrofilov
Po dosiahnutí zvratu neutropénie sa má stanoviť minimálna účinná dávka na udržanie normálneho počtu neutrofilov. Odporúča sa upraviť počiatočnú dávku tak, aby zodpovedala dennému dávkovaniu 30 MU (300 mikrogramov)/deň. Ďalšia úprava dávkovania môže byť potrebná, v závislosti od hodnôt ANC u pacienta, na udržanie počtu neutrofilov na hodnotách > 2,0 x 109/l. V klinických štúdiách bola potrebná
dávka 30 MU (300 mikrogramov)/deň počas 1 až 7 dní do týždňa, aby sa hodnota ANC udržala na hodnote
> 2,0 x 109/l, s priemernou frekvenciou dávky 3 dni do týždňa. Dlhodobé podávanie lieku môže byť nevyhnutné na udržanie hodnoty ANC > 2,0 x 109/l.
Osobitné skupiny pacientov
Starší pacienti
Do klinických skúšaní s filgrastímom bol zahrnutý malý počet starších pacientov, ale s touto populáciou pacientov sa neuskutočnili žiadne osobitné štúdie. Preto nie je možné u týchto pacientov stanoviť špecifické odporúčania týkajúce sa dávkovania.
Pacienti s poruchou funkcie obličiek alebo pečene
Štúdie filgrastímu u pacientov so závažnou poruchou funkcie obličiek alebo pečene preukázali, že filgrastím vykazuje podobný farmakokinetický a farmakodynamický profil ako u normálnych jedincov. Za týchto okolností nie je potrebná úprava dávkovania.
Pediatrickí pacienti so závažnou chronickou neutrópiou (SCN) a nádorových ochorením
V klinických štúdiách, ktoré zahŕňali pacientov s SCN, bolo 65 % pacientov mladších ako 18 rokov. V tejto vekovej skupine, ktorá prevažne zahŕňala pacientov s kongenitálnou neutropéniou, sa dokázala účinnosť liečby. U pediatrických pacientov liečených kvôli SCN sa nezaznamenali žiadne rozdiely v profile bezpečnosti v porovnaní s dospelými.
Údaje z klinických štúdií u pediatrických pacientov naznačujú, že bezpečnosť a účinnosť filgrastímu u dospelých aj detí liečených cytotoxickou chemoterapiou sú podobné.
Odporúčané dávkovania u pediatrických pacientov sú rovnaké ako u dospelých, ktorí dostávajú myelosupresívnu cytotoxickú chemoterapiu.
Spôsob podávania
Nariadenácytotoxickáchemoterapia
Filgrastím sa môže podávať ako denná subkutánna injekcia alebo ako denná intravenózna infúzia po zriedení v infúznom roztoku glukózy s koncentráciou 50 mg/ml (5 %) trvajúcej aspoň 30 minút (pozri časť 6.6
pokyny na nariedenie lieku).Vo väčšine prípadov sa uprednostňuje subkutánne podanie. V štúdii, v ktorej sa podávala jednorazová dávka, sa zistilo, že intravenózne podávanie môže skrátiť trvanie účinku. Klinický význam tohto zistenia pre viacnásobné podanie dávky nie je jasný. Voľba cesty podania lieku závisí od individuálnych klinických okolností. V randomizovaných klinických skúšaniach sa používala subkutánna dávka 230 mikrogramov/m2/deň) (4,0 až 8,4 mikrogramov/kg/deň).
Pacientipodstupujúcimyeloablatívnuterapiu,poktorejnasledujetransplantáciakostnejdreneFilgrastím sa podáva ako intravenózna infúzia počas 30 minút alebo ako intravenózna alebo kontinuálna subkutánna infúzia počas 24 hodín. Filgrastím sa má zriediť v 20 ml infúzneho roztoku glukózy 50 mg/ml (5 %) (pozri časť 6.6).
MobilizáciaPBPC
Na mobilizáciu PBPC u pacientov podstupujúcich myelosupresívnu alebo myeloablatívnu terapiu, po ktorých nasleduje autológna transplantácia PBPC, sa odporúčaná dávka filgrastímu môže podať aj ako 24- hodinová kontinuálna subkutánna infúzia alebo jedna denná subkutánna injekcia počas 5 až 7 po sebe nasledujúcich dní. Filgrastím sa má pred infúznym podaním zriediť v 20 ml infúzneho roztoku glukózy
50 mg/ml (5 %) ((pozri časť 6.6).
SCN/infekciaHIV
Subkutánna injekcia.
Pokyny na riedenie lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Osobitné upozornenia
Filgrastím sa nemá používať na zvýšenie dávky cytotoxickej chemoterapie nad stanovené dávkovacie režimy.
Filgrastím sa nemá podávať pacientom so závažnou kongenitálnou neutropéniou (Kostmannov syndróm) s cytogenetickými poruchami.
U pacientov liečených filgrastímom sa pri úvodnej alebo následnej liečbe zaznamenala precitlivenosť, vrátane anafylaktických reakcií. U pacientov s klinicky významnou precitlivenosťou trvalo ukončite liečbu filgrastímom. Filgrastím nepodávajte pacientom s precitlivenosťou na filgrastím alebo pegfilgrastím anamnéze.
Rovnako ako u všetkých terapeutických proteínov existuje možnosť imunogenicity Miera tvorby protilátok proti filgrastímu je vo všeobecnosti nízka. Väzba protilátok je podobná ako u všetkých biologických liekov; doposiaľ však neboli spájané s neutralizačnou aktivitou.
Rast malígnych buniek
GCSF môže podporovať rast myeloidných buniek in vitro a podobné prípady sa môžu vyskytnúť u niektorých nemyeloidných buniek in vitro.
Bezpečnosť a účinnosť podávania filgrastímu u pacientov s myelodysplastickým syndrómom alebo chronickou myelogénnou leukémiou neboli stanovené.
Filgrastím nie je indikovaný na použitie za týchto podmienok. Obzvlášť je potrebná pozornosť pri odlíšení diagnózy transformácie blastov pri chronickej myeloidnej leukémii od akútnej myeloidnej leukémie.
Vzhľadom na obmedzené údaje o bezpečnosti a účinnosti u pacientov so sekundárnou akútnou myeloidnou leukémiou (AML) sa má filgrastím podávať opatrne.
Bezpečnosť a účinnosť podávania Nivestimu u pacientov s de novo AML mladších ako 55 rokov s dobrými cytogenetickými parametrami [t(8;21), t(15;17) a inv(16)] nebola stanovená.
Ďalšie osobitné upozornenia
U pacientov s osteoporózou ako základným ochorením, ktorí podstupujú kontinuálnu liečbu s filgrastímom dlhšie ako 6 mesiacov, sa odporúča monitorovanie minerálnej denzity kostí.
Po podaní G-CSF boli zaznamenané zriedkavé (> 0,01 % a < 0,1 %) pľúcne nežiaduce udalosti, najmä intersticiálna pneumónia. U pacientov s výskytom pľúcnych infiltrátov alebo pneumóniou v nedávnej anamnéze môže byť riziko vyššie. Nástup pľúcnych príznakov, ako sú kašeľ, horúčka a dyspnoe, v spojení s rádiologicky zistenými príznakmi pľúcnych infiltrátov a zhoršením pľúcnych funkcií môžu byť počiatočnými príznakmi syndrómu respiračnej tiesne dospelých (ARDS). V týchto prípadoch sa má ukončiť liečba filgrastímom a má sa začať vhodná liečba.
Po podaní faktora stimulujúceho kolónie granulocytov sa zaznamenal syndróm kapilárneho presakovania, ktorý je charakterizovaný hypotenziou, hypoalbuminémiou, edémom a hemokoncentráciou. Pacienti,
u ktorých sa vyvinú príznaky syndrómu kapilárneho presakovania, sa majú starostlivo sledovať a majú dostať štandardnú symptomatickú liečbu, ktorá môže zahŕňať potrebu intenzívnej starostlivosti (pozri časť
4.8).
Osobitnéupozorneniaprepacientovsnádorovýmiochoreniami
Leukocytóza
U menej ako 5 % pacientov liečených filgrastímom v dávkach nad 0,3 MU (3 mikrogramy)/kg/deň bol pozorovaný počet bielych krviniek 100 x 109/l alebo vyšší. Neboli zaznamenané žiadne nežiaduce reakcie, ktoré by bolo možné priamo pripísať tomuto stupňu leukocytózy. Avšak vzhľadom na potenciálne riziká spojené so závažnou leukocytózou sa má počas liečby filgrastímom pravidelne kontrolovať počet bielych krviniek. Ak počet leukocytov prevýši 50 x 109/l po ich očakávanom poklese na minimum, liečba filgrastímom sa musí okamžite ukončiť. Ak sa však počas liečby filgrastímom z dôvodu mobilizácie PBPC zvýši počet leukocytov nad 70 x 109/l, má sa ukončiť liečba alebo znížiť dávkovanie.
R
i
ziká spojené so zvýšenými dávkami chemoterapie
Pri liečbe pacientov s vysokými dávkami chemoterapie je nutná mimoriadna opatrnosť, pretože sa nedokázalo zlepšenie stavu nádoru a zvýšené dávkovanie chemoterapeutík môže viesť k zvýšenej toxicite vrátane srdcových, pľúcnych, neurologických a dermatologických účinkov (pozri, prosím, súhrn charakteristických vlastností použitých špecifických chemoterapeutík).
Liečba samotným filgrastímom nevylučuje výskyt trombocytopénie a anémie v dôsledku myelosupresívnej chemoterapie. U pacienta môže byť vyššie riziko vzniku trombocytopénie a anémie z dôvodu možnej liečby vyššími dávkami chemoterapie (napr. plné dávky v predpísanom režime). Odporúča sa pravidelné monitorovanie počtu trombocytov a hematokritu. Počas podávania jedného chemoterapeutika alebo kombinácie chemoterapeutík, o ktorých je známe, že spôsobujú závažnú trombocytopéniu, sa musí zachovávať zvláštna opatrnosť.
Dokázalo sa, že použitie filgrastímom mobilizovaných PBPC znižuje stupeň a trvanie trombocytopénie po myelosupresívnej alebo myeloablatívnej chemoterapii.
Splenomegália
Po podaní filgrastímu boli hlásené menej časté prípady splenomegálie a ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne. U ľudí s bolesťami v oblasti ľavej hornej časti brušnej dutiny a/alebo hornej časti ramena a dostávajú filgrastím, treba sledovať zväčšenie sleziny alebo ruptúru sleziny.
Ďalšie osobitné opatrenia
Účinky filgrastímu sa neskúmali u pacientov s výrazne zníženými myeloidnými progenitormi. Filgrastím účinkuje primárne na prekurzory neutrofilov, kedy sa uplatňuje jeho účinok na zvýšenie počtu neutrofilov. Preto u pacientov so zníženým počtom prekurzorov môže byť odpoveď neutrofilov oslabená (napríklad u tých, ktorí sú liečení extenzívnou rádioterapiou alebo chemoterapiou, alebo u ktorých dochádza k infiltrácii kostnej drene tumorom).
U pacientov, ktorí dostávali G-CSF po alogénnej transplantácii kostnej drene, boli hlásené reakcie štepu proti hostiteľovi (Graft versus Host Disease – GvHD) a úmrtia (pozri časť 5.1).
Účinok filgrastímu na GvHD nebol stanovený.
Zvýšená hematopoetická aktivita kostnej drene v odpovedi na liečbu rastovým faktorom bola spojená s prechodne pozitívnymi nálezmi v RTG kostí, a to je potrebné zvážiť pri interpretácii výsledkov RTG kostí.
Osobitnéupozorneniaprepacientovpodstupujúcichmobilizáciuprogenitorovýchbuniekvperiférnejkrvi
Mobilizácia
V rámci rovnakej populácie pacientov sa nevykonali žiadne perspektívne randomizované porovnávania dvoch odporúčaných mobilizačných metód (monoterapia filgrastímom alebo kombinácia s myelosupresívnou chemoterapiou). Rozdiely medzi jednotlivými pacientmi ako aj vo výsledkoch laboratórnych analýz CD34+ buniek značia, že priame porovnanie medzi odlišnými štúdiami je zložité. Z tohto dôvodu je ťažké odporučiť optimálnu metódu. Mobilizačná metóda sa má zvoliť podľa celkových cieľov liečby u jednotlivých pacientov.
Predchádzajúca expozícia cytotoxickými látkami
U pacientov, ktorí pred podaním filgrastímu na mobilizáciu PBPC podstúpili veľmi extenzívnu myelosupresívnu terapiu, sa nemusí prejaviť dostatočná mobilizácia PBPC na dosiahnutie odporučenej minimálnej výťažnosti (≥ 2,0 x 106 CD34+ buniek/kg) alebo urýchlenie obnovenia trombocytov na rovnakú úroveň.
Niektoré cytotoxické látky vykazujú špecifickú toxicitu voči zásobe krvotvorných progenitorov a môžu nepriaznivo ovplyvniť mobilizáciu progenitorov. Ak sa počas dlhého obdobia pred pokusmi o mobilizáciu progenitorov podávajú látky ako melfalan, karmustín (BCNU) a karboplatina, tieto môžu obmedziť výťažnosť progenitorov. Podávanie melfalanu, karboplatiny alebo BCNU spolu s filgrastímom sa však ukázalo ako účinné pri mobilizácii progenitorov. V prípade, že sa predpokladá transplantácia PBPC,
odporúča sa naplánovať mobilizáciu kmeňových buniek vo včasnej fáze liečby pacienta. Osobitná pozornosť sa má venovať počtu mobilizovaných progenitorov u takýchto pacientov pred podaním vysokých dávok chemoterapie. Ak sú výťažnosti neadekvátne vzhľadom na vyššie uvedené kritériá, majú sa zvážiť alternatívne formy liečby, ktoré nevyžadujú podporu progenitorov.
Zhodnotenie výťažností progenitorových buniek
Pri vyhodnocovaní počtu progenitorových buniek odobratých od pacientov liečených filgrastímom sa má venovať osobitná pozornosť metóde kvantifikácie. Výsledky prietokovej cytometrickej analýzy počtu CD34+ buniek sa líšia v závislosti od presnosti použitej metodológie, a preto odporúčania týkajúce sa počtov získaných na základe štúdií v iných laboratóriách je potrebné interpretovať opatrne.
Štatistická analýza vzťahu medzi počtom opätovne infundovaných CD34+ buniek a rýchlosťou obnovenia trombocytov po podaní vysokých dávok chemoterapie naznačuje zložitý, avšak kontinuálny vzťah.
Odporúčanie minimálnej výťažnosti ≥ 2,0 x 106 CD34+ buniek/kg sa zakladá na publikovaných skúsenostiach, vedúcich k primeranej hematologickej obnove. Výťažnosti prevyšujúce túto minimálnu výťažnosť korelujú s rýchlejším obnovením, výťažnosti nižšie ako táto hodnota korelujú s pomalším zotavením.
Osobitnéupozorneniaprenormálnychdarcovpodstupujúcichmobilizáciuprogenitorovýchbuniekvperiférnejkrvi
Mobilizácia PBPC nie je priamym klinickým prínosom pre normálnych darcov a má sa vziať do úvahy len
na účely alogénnej transplantácie kmeňových buniek.
Nad mobilizáciou PBPC sa má uvažovať len u darcov, ktorí spĺňajú normálne klinické a laboratórne kritériá vhodnosti pre darovanie kmeňových buniek s osobitnou pozornosťou na hematologických hodnotách a infekčných ochoreniach.
Bezpečnosť a účinnosť filgrastímu neboli stanovené u normálnych darcov mladších ako 16 rokov alebo starších ako 60 rokov.
Prechodná trombocytopénia (počet trombocytov < 100 x 109/l) po podaní filgrastímu a po leukaferéze sa pozorovala u 35 % skúmaných pacientov. V tejto skupine bol v dvoch prípadoch zaznamenaný počet trombocytov < 50 x 109/l v dôsledku leukaferézy.
Ak je potrebných viac leukaferéz, zvláštna pozornosť sa má venovať darcom s počtom trombocytov
< 100 x 109/l pred leukaferézou; vo všeobecnosti sa aferéza nemá vykonať, ak je počet trombocytov
< 75 x 109/l.
Leukaferéza sa nemá vykonať u darcov, ktorí sú liečení antikoagulanciami alebo ktorí majú poruchy hemostázy.
Ak počet leukocytov stúpne na 70 x 109/l, podávanie filgrastímu sa má ukončiť alebo sa má znížiť dávkovanie.
Darcovia, ktorí na mobilizáciu PBPC dostávajú G-CSF, majú byť monitorovaní, až pokiaľ sa hematologické ukazovatele nevrátia na normálnu úroveň.
U normálnych darcov sa po podaní G-CSF pozorovali prechodné cytogenetické modifikácie. Význam týchto zmien nie je známy.
Sledovanie dlhodobej bezpečnosti darcov pokračuje. Napriek tomu nemožno vylúčiť zvýšené riziko malígnych myeloidných klonov. Odporúča sa, aby stredisko aferézy podávalo systematickú správu a sledovalo darcov kmeňových buniek , čím sa zabezpečí monitorovanie dlhodobej bezpečnosti.
U normálnych darcov a pacientov boli po podaní G-CSF hlásené bežné, ale obvykle asymptomatické prípady splenomegálie a veľmi zriedkavo prípady ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne. Z tohto dôvodu sa má dôkladne monitorovať veľkosť sleziny (napr. klinickým vyšetrením, ultrazvukom). Diagnóza ruptúry sleziny sa má zvážiť u darcov a/alebo pacientov, ktorí uvádzajú bolesť v ľavej hornej abdominálnej oblasti alebo v hornej časti ramena.
U normálnych darcov boli veľmi zriedkavo hlásené pľúcne nežiaduce udalosti (hemoptýza, krvácanie do pľúc, pľúcne infiltráty, dyspnoe a hypoxia) po uvedení na trh s inými liekmi obsahujucími filgrastím. V prípade podozrenia na pľúcne nežiaduce udalosti alebo ich potvrdenia sa má zvážiť predčasné ukončenie liečby filgrastímom a poskytnúť vhodná lekárska starostlivosť.
Osobitné upozornenia pre príjemcov alogénnych progenitorových buniek v periférnej krvi mobilizovaných filgrastímom
Najnovšie údaje naznačujú, že imunologické interakcie medzi alogénnym štepom PBPC a príjemcom môžu byť spojené so zvýšeným rizikom výskytu akútnej a chronickej GvHD v porovnaní s transplantáciou kostnej drene.
Osobitnéupozorneniaprepacientovsozávažnouchronickouneutropéniou(SCN)
Počty krvných buniek
Počty trombocytov sa majú dôkladne monitorovať, najmä počas prvých pár týždňov liečby filgrastímom.
U pacientov, u ktorých sa rozvinie trombocytopénia, t. j. trvalý pokles počtu trombocytov pod 100 x 109/l, sa má zvážiť občasné prerušenie liečby alebo zníženie dávky filgrastímu.
Vyskytujú sa ďalšie zmeny počtu krvných buniek vrátane anémie a prechodného zvýšenia počtu myeloidných progenitorov, čo si vyžaduje dôkladné sledovanie počtu krvných buniek.
Transformácia na leukémiu alebo myelodysplastický syndróm
Osobitná pozornosť sa má venovať odlíšeniu diagnózy závažnej chronickej neutropénie od ostatných porúch krvotvorby, ako je aplastická anémia, myelodysplázia a myeloidná leukémia. Pred začatím liečby sa má vyšetriť kompletný krvný obraz s diferenciálnym a absolútnym počtom trombocytov a má sa vyhodnotiť morfológia kostnej drene a karyotyp.
V klinickej štúdii bol nízky výskyt (približne 3 %) myelodysplastických syndrómov (MDS) alebo leukémie u pacientov so závažnou chronickou neutropéniou liečených filgrastímom. Toto pozorovanie sa vykonalo
len u pacientov s kongenitálnou neutropéniou. MDS a leukémie sú prirodzené komplikácie tohto ochorenia a ich súvislosť s liečbou filgrastímom nie je jasná. U podskupiny približne 12 % pacientov s normálnymi cytogenetickými výsledkami vo východiskovom bode sa pri rutinnom opakovanom vyhodnotení postupne zistili poruchy vrátane monozómie 7. Ak sa u pacientov so závažnou chronickou neutropéniou vyvinú abnormality cytogenetiky, majú sa dôkladne zvážiť riziká a výhody pokračovania liečby filgrastímom; ak sa objaví MDS alebo leukémia, liečba filgrastímom sa musí ukončiť. V súčasnosti nie je jasné, či dlhotrvajúca liečba pacientov so závažnou chronickou neutropéniou predisponuje pacientov k cytogenetickým poruchám, MDS alebo leukemickej transformácii. U pacientov sa odporúča v pravidelných intervaloch vykonávať morfologické a cytogenetické vyšetrenie kostnej drene (približne každých 12 mesiacov).
Splenomegália
Po podaní filgrastímu boli hlásené menej časté prípady splenomegálie a ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne. U ľudí s bolesťami v oblasti ľavej hornej časti brušnej dutiny a/alebo hornej časti ramena a dostávajú filgrastím, treba sledovať zväčšenie sleziny alebo ruptúru sleziny.
Ďalšie osobitné upozornenia
Musia sa vylúčiť príčiny prechodnej neutropénie, ako sú vírusové infekcie.
Zväčšenie sleziny je priamym dôsledkom liečby filgrastímom. V štúdiách sa u 31 % pacientov zaznamenala hmatateľná splenomegália. Hneď na začiatku liečby filgrastímom sa rádiologicky zistilo zväčšenie objemu sleziny, ktoré sa postupne stabilizovalo. Zistilo sa, že zníženie dávok viedlo k spomaleniu alebo zastaveniu
zväčšovania sleziny a u 3 % pacientov bola nutná splenektómia. Veľkosť sleziny sa má pravidelne sledovať. Na zistenie abnormálneho zväčšenia objemu sleziny postačuje palpačné vyšetrenie brucha.
U malého počtu pacientov sa vyskytla hematúria/proteinúria. Na sledovanie tohto stavu sa má pravidelne vyšetrovať moč.
Bezpečnosť a účinnosť lieku u novorodencov a pacientov s autoimúnnou neutropéniou neboli stanovené. OsobitnéupozorneniaprepacientovsHIVinfekciou
Počty krvných buniek
Absolútny počet neutrofilov (ANC) sa má dôkladne monitorovať, najmä počas prvých pár týždňov liečby filgrastímom. Niektorí pacienti môžu veľmi rýchlo reagovať na prvú dávku filgrastímu výrazným zvýšením počtu neutrofilov. Počas prvých 2 až 3 dní podávania filgrastímu sa odporúča denne monitorovať ANC. Následne sa odporúča monitorovať ANC aspoň dvakrát týždenne počas prvých dvoch týždňov liečby a potom raz týždenne alebo každé dva týždne počas udržiavacej liečby. Počas prerušovaného dávkovania na úrovni 30 MU (300 mikrogramov)/deň filgrastímu sa môžu objaviť veľké výkyvy hodnôt ANC u pacientov. Na určenie dolnej hranice ANC u pacienta sa odporúča odobrať vzorky krvi na zistenie ANC bezprostredne pred akýmkoľvek plánovaným podaním filgrastímu.
Riziko spojené so zvýšenými dávkami myelosupresívnych liekov
Liečba samotným filgrastímom nevylučuje výskyt trombocytopénie a anémie v dôsledku myelosupresívnych terapií. Následkom možného prijatia vyšších dávok alebo väčšieho množstva týchto liekov spolu s liečbou filgrastímom sa u pacienta môže vyskytnúť zvýšené riziko rozvoja trombocytopénie a anémie. Odporúča sa pravidelné monitorovanie krvného obrazu (pozri vyššie).
Infekcie a malígne ochorenia spôsobujúce myelosupresiu
Neutropénia môže byť spôsobená infliltráciou kostnej drene oportúnnymi infekciami, ako je komplex Mycobacterium avium, alebo malígnymi ochoreniami, napríklad lymfómom. U pacientov so známou infiltráciou kostnej drene infekciami alebo malígnym ochorením sa má okrem podávania filgrastímu na liečbu neutropénie zvážiť aj vhodná liečba základného ochorenia. Účinky filgrastímu na neutropéniu zapríčinenú infiltráciou kostnej drene infekciou alebo malígnym ochorením neboli dostatočne preukázané.
Splenomegália
Po podaní filgrastímu boli hlásené menej časté prípady splenomegálie a ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne. U ľudí s bolesťami v oblasti ľavej hornej časti brušnej dutiny a/alebo hornej časti ramena a dostávajú filgrastím, treba sledovať zväčšenie sleziny alebo ruptúru sleziny.
Osobitnéupozorneniaprikosáčikovitejčrte(heterozygotnomhemoglobíneS)akosáčikovitejanémii
U pacientov s kosáčikovitou črtou alebo s kosáčikovitou anémiou sa zaznamenala po použití filgrastímu kríza kosáčikovitej anémie, v niektorých prípadoch fatálna. Lekári musia byť opatrní, keď zvažujú podávanie filgrastímu pacientom s kosáčikovitou črtou alebo s kosáčikovitou anémiou, a majú sa rozhodnúť až po starostlivom zvážení potenciálnych rizík a výhod.
Pomocnélátky
Nivestim obsahuje sorbitol. Pacienti so zriedkavými dedičnými problémami fruktózovej intolerancie nemajú používať tento liek. Tiež obsahuje menej ako 1 mmol sodíka (23 mg) v dávke, t.j.v podstate „bez sodíka“.
4.5 Liekové a iné interakcie
Bezpečnosť a účinnosť filgrastímu, ktorý sa podáva v rovnaký deň ako myelosupresívna cytotoxická chemoterapia, sa definitívne nestanovila. Filgrastím sa neodporúča podávať v období od 24 hodín pred chemoterapiou až do 24 hodín po chemoterapii vzhľadom na citlivosť rýchlo sa deliacich myeloidných buniek na myelosupresívnu cytotoxickú chemoterapiu. Predbežné dôkazy pozorované u malej skupiny pacientov liečených súbežne filgrastímom a 5-fluórouracilom naznačujú, že závažnosť neutropénie sa môže zhoršiť.
Možné interakcie s inými krvotvornými rastovými faktormi a cytokínmi sa doposiaľ v klinických štúdiách nepreskúmali.
Keďže lítium podporuje uvoľňovanie neutrofilov, pravdepodobne môže zvýšiť účinok filgrastímu. Hoci táto interakcia nebola formálne preskúmaná, neexistuje dôkaz, že takáto interakcia je škodlivá.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití u gravidných žien . Štúdie na zvieratách preukázali reprodukčnú toxicitu. Zvýšený výskyt potratov bol pozorovaný u králikov pri vysokých násobkoch klinickej expozície a v prítomnosti toxicity matky (pozri časť 5.3). Existujú literárne údaje popisujúce transplacentárny prechod filgrastímu u gravidných žien. Filgrastím sa neodporúča počas gravidity.
Laktácia
Nie je známe, či sa filgrastím vylučuje do ľudského mlieka, preto sa neodporúča používať filgrastím u dojčiacich žien. Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu flgrastímom sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Filgrastím neovplyvnil reprodukčnú schopnosť ani fertilitu samcov alebo samíc potkanov (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Filgrastím má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Ak pacient pociťuje únavu, odporúča sa zvýšiť pozornosť vedení vozidiel alebo obsluhe strojov.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Počas klinických štúdií sa Nivestim podával 183 pacientom s nádorovým ochorením a 96 zdravým
dobrovoľníkom.
V klinických štúdiách sa profil bezpečnosti filgrastímu zhodol s tým, ktorý bol hlásený pri referenčnom lieku použitom v týchto štúdiách.
V klinických skúšaniach u pacientov s nádorovým ochorením bola najčastejšou nežiaducou reakciou súvisiacou s filgrastímom pri odporúčanom dávkovaní muskuloskeletálna bolesť, ktorá bola mierna alebo stredne silná u 10 % pacientov a silná u 3 % pacientov.
Bola hlásená aj reakcia štepu proti hostiteľovi (Graft versus Host Disease, GvHD) (pozri nižšie). Pri mobilizácii PBPC u normálnych darcov bola najčastejšou hlásenou nežiaducou reakciou
muskuloskeletálna bolesť. U darcov sa pozorovala leukocytóza a po podaní filgrastímu a po
leukaferéze sa u darcov pozorovala aj prechodná trombocytopénia. Boli hlásené aj prípady splenomegálie a ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne.
U pacientov s SCN boli najčastejšími nežiaducimi reakciami spôsobenými filgrastímom bolesť kostí, celková muskuloskeletálna bolesť a splenomegália.
Syndróm kapilárneho presakovania, ktorý môže ohroziť život, ak sa oneskorí liečba, sa zaznamenal menej často (≥ 1/1 000 až < 1/100) po podaní faktorov stimulujúcich kolónie granulocytov u pacientov s rakovinou, ktorí podstupujú chemoterapiu a u normálnych darcov, podstupujúcich mobilizáciu
PBPC (pozri nižšie a časť 4.4).
V klinických štúdiách u pacientov s HIV boli jedinými nežiaducimi reakciami, ktoré sa pripisovali podávaniu filgrastímu, muskuloskeletálna bolesť, bolesť kostí a myalgia. Výskyt týchto prípadov bol podobná ako u pacientov s nádorovým ochorením.
Súhrn nežiaducichreakciízoradenýchdotabuľky.
Na základe publikovaných informácií sa počas liečby filgrastímom vyskytli nasledujúce nežiaduce reakcie
a ich frekvencie.
Zhodnotenie nežiaducich reakcií je založené na nasledujúcich frekvenciách výskytu: Veľmi časté: ≥ 1/10
Časté: ≥ 1/100 až < 1/10
Menej časté: ≥ 1/1 000 až < 1/100
Zriedkavé: ≥ 1/10 000 až < 1/1 000
Veľmi zriedkavé: < 1/10 000
Neznáme: častosť sa nedá sa odhadnúť z dostupných údajov
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané podľa klesajúcej závažnosti.
U pacientov s nádorovým ochorením
T
rieda orgánových
systémov
Poruchy metabolizmu a výživy
Frekvencia Nežiaduca reakcia
Veľmi časté Zvýšené hodnoty alkalickej fosfatázy, laktátdehydrogenázy (LDH) a kyseliny močovej
Poruchy nervového systému Časté Bolesť hlavy
Poruchy ciev Menej časté Syndrom zvýšené propustnosti kapilár
Zriedkavé Poruchy ciev, angiopatia
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Celkové poruchy a reakcie v mieste podania
Časté Kašeľ, bolesť hrdla Veľmi zriedkavé Pľúcne infiltráty Veľmi časté Nevoľnosť/vracanie
Časté Zápcha, anorexia, hnačka, mukozitída
Veľmi časté Zvýšené hodnoty gama-glutamyltransferázy

(GGT)
Časté Alopécia, vyrážka
Veľmi zriedkavé Sweetov syndróm, kožná vaskulitída Veľmi časté Bolesť hrude, muskuloskeletálna bolesť Veľmi zriedkavé Zhoršenie symptómov reumatickej artritídy Veľmi zriedkavé Abnormality močového systému
Časté Únava, všeobecná slabosť Menej časté Nešpecifikovaná bolesť Veľmi zriedkavé Alergická reakcia
U
normálnych
darcov
podstupujúcich
PBPC
m
obilizáciu
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy krvi a lymfatického
systému
Veľmi časté Leukocytóza, trombocytopénia
Menej časté Porucha sleziny
Poruchy metabolizmu a výživy Časté Zvýšené hodnoty alkalickej fosfatázy a LDH
Menej časté Zvýšené hodnoty SGOT, nadbytok kyseliny močovej v krvi
Poruchy nervového systému Veľmi časté Bolesť hlavy
Poruchy ciev Menej časté Syndrom zvýšené propustnosti kapilár
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Celkové poruchy a reakcie v mieste podania
Veľmi časté Muskuloskeletálna bolesť
Menej časté Reumatická artritída a zhoršenie symptómov artritídy
Menej časté Závažná alergická reakcia
U
pacientov
s
o
závažnou
chronickou
neutrópiou
(SCN)
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy krvi a lymfatického systému
Veľmi časté Anémia, splenomegália Časté Trombocytopénia Menej časté Porucha sleziny
Poruchy metabolizmu a výživy Veľmi časté Znížené hodnoty glukózy v krvi, zvýšené hodnoty alkalickej fosfatázy, LDH, a nadbytok kyseliny močovej v krvi
Poruchy nervového systému Časté Bolesť hlavy
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Veľmi časté Epistaxa
Časté Hnačka
Poruchy pečene a žlčových ciest Časté Hepatomegália
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Časté Alopécia, kožná vaskulitída, bolesť v mieste injekcie, výražka
Veľmi časté Muskuloskeletálna bolesť
Časté Osteoporóza
Menej časté Hematúra, proteinúia

 U
pacientov
s
H
I
V
infekciou
U
pacientov
s
H
I
V
infekciou
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy krvi a lymfatického systému
Poruchy svalovej a kostrovej sústavy a spojivového tkaniva
Časté Poruchy sleziny
Veľmi časté Muskuloskeletálna bolesť
 Popis
vy
braných
nežiaducich
reakcií
Popis
vy
braných
nežiaducich
reakcií
U pacientov, ktorí dostávali G-CSF po alogénnej transplantácii kostnej drene, boli hlásené reakcie
štepu proti hostiteľovi (Graft versus Host Disease, GvHD) a úmrtia (pozri časť 5.1).
Po uvedení faktora stimulujúceho kolónie granulocytov na trh sa zaznamenali prípady syndrómu kapilárneho presakovania. Zvyčajne sa vyskytovali u pacientov s pokročilým nádorovým ochorením, sepsou, u pacientov liečených kombinovanou chemoterapiou alebo podstupujúcich aferézu (pozri časť 4.4).
U pacientov s nádorovým ochorenímMuskuloskeletálna bolesť sa dá zvyčajne zvládnuť štandardnými analgetikami. Menej časté nežiaduce rekcie
zahŕňajú abnormality močového systému prevažne miernu až stredne silnú dyzúriu.
V randomizovaných, placebom kontrolovaných klinických skúšaniach filgrastím nezvýšil výskyt nežiaducich reakcií spojených s cytotoxickou chemoterapiou. Nežiaduce reakcie hlásené s rovnakou frekvenciou u pacientov liečených kombináciou filgrastím/chemoterapia a placebo/chemoterapia zahŕňajú nauzeu a vracanie, alopéciu, hnačku, únavu, anorexiu, mukozitídu, bolesť hlavy, kašeľ, kožnú vyrážku, bolesť v hrudi, celkovú slabosť, bolesť v hrdle, zápchu a nešpecifikovanú bolesť.
U približne 50 %, 35 %, 25 % a 10 % pacientov, jednotlivo u odporúčaných dávok, liečených filgrastímom sa vyskytli reverzibilné, závislé od dávky a zvyčajne mierne alebo stredne závažne zvýšené hodnoty laktátdehydrogenázy, alkalickej fosfatázy, kyseliny močovej a gamma-glutamyltransferázy.
Príležitostne boli hlásené prechodné zníženia krvného tlaku nevyžadujúce si klinickú liečbu.
U pacientov, ktorí dostávali vysoké dávky chemoterapie pred autológnou transplantáciou kostnej drene, boli hlásené cievne poruchy zahrňujúce veno-okluzívne ochorenie a poruchy objemu telesných tekutín. Príčinná súvislosť s liečbou filgrastímom nebola stanovená.
U pacientov liečených filgrastímom boli hlásené veľmi zriedkavé udalosti vaskulitídy. U pacientov liečených filgrastímom nie je známy mechanizmus vaskulitídy.
Výskyt Sweetovho syndrómu (akútna febrilná neutrofilná dermatóza) bol hlásený príležitostne. Nakoľko však významné percento týchto pacientov malo leukémiu, stav, ktorý je spojený so Sweetovým syndrómom, príčinná súvislosť s liečbou filgrastímom nebola stanovená.
V jednotlivých prípadoch bolo hlásené zhoršenie existujúcej reumatoidnej artritídy.
V niektorých prípadoch boli hlásené zriedkavé pľúcne nežiaduce udalosti, zahŕňajúce intersticiálnu pneumóniu, pľúcny edém a pľúcne infiltráty, vedúce k respiračnému zlyhaniu alebo syndrómu respiračnej tiesne dospelých (ARDS), ktoré môžu byť fatálne (pozri časť 4.4).
Alergické reakcie: U pacientov dostávajúcich filgrastím sa počas počiatočnej alebo následnej liečby vyskytli reakcie alergického typu vrátane anafylaxie, kožnej vyrážky, žihľavky, angioedému (bolestivý opuch tváre alebo hrdla), dyspnoe a nízkeho krvného tlaku. Celkovo boli hlásenia častejšie po intravenóznom podaní. V
niektorých prípadoch sa symptómy vyskytli opätovne, takže sa predpokladá príčinný vzťah. Liečba filgrastímom sa musí natrvalo ukončiť u pacientov, u ktorých sa vyskytla závažná alergická reakcia.
U pacientov s bunkami s kosákovitosťou buniek alebo s kosáčikovitou anémiou sa vyskytli ojedinelé prípady kríz kosáčikovitej anémie (pozri časť 4.4). Z údajov z klinických skúšaní je odhadovaná frekvencia výskytu ako „menej časté“.
U pacientov s rakovinou liečených filgrastímom sa zaznamenala pseudodna.
U normálnych darcovpodstupujúcichPBPCmobilizáciu
Leukocytóza (biele krvinky WBC > 50 x 109/l) sa vyskytla u 41 % darcov a prechodná trombocytopénia
(krvné doštičky < 100 x 109/l) po podaní filgrastímu a po leukaferéze sa vyskytla u 35 % darcov.
U normálnych darcov, ktorí sa liečia filgrastímom, boli hlásené prechodné mierne zvýšené hodnoty alkalickej fosfatázy, laktátdehydrogenázy (LDH), SGOT a kyseliny močovej; bez klinickej súslednosti.
Veľmi zriedkavo bolo pozorované zhoršenie symptómov artritídy.
Veľmi zriedkavo boli hlásené príznaky pripomínajúce závažné alergické reakcie.
V štúdiách s PBPC darcami boli hlásené bolesti hlavy, pravdepodobne spôsobené podaním filgrastímu. U normálnych darcov a pacientov boli po podaní G-SCF hlásené bežné, ale obvykle asymptomatické
prípady splenomegálie a veľmi zriedkavo prípady ruptúry sleziny (pozri časť 4.4 ).
U normálnych darcov boli, po uvedení iných liekov obsahujúcich filgrastím na trh, veľmi zriedkavo hlásené pľúcne nežiaduce udalosti (hemoptýza, krvácanie do pľúc, pľúcne infiltráty, dyspnoe a hypoxia) (pozri časť
4.4).
U pacientov so závažnouchronickouneutrópiou(SCN)
U pacientov s SCN liečených filgrastímom boli hlásené nežiaduce reakcie a u niektorých pacientov sa ich
výskyt časom znižoval.
Medzi nežiaduce reakcie patria splenomegália, ktorá môže mať u malého počtu pacientov progresívny charakter a trombocytopénia. Krátko po začiatku liečby filgrastímom sa u menej ako 10 % pacientov vyskytli bolesť hlavy a hnačka. Tiež boli hlásené anémia a krvácanie z nosa.
Pozorovalo sa prechodné zvýšenie hladiny sériovej kyseliny močovej, laktátdehydrogenázy a alkalickej fosfatázy bez klinických prejavov, ako aj prechodný mierny pokles hladiny glukózy v krvi po požití potravy.
U< 2 % pacientov s SCN sa vyskytli nežiaduce reakcie pravdepodobne spojené s liečbou filgrastímom, a to bolesť v mieste podania, bolesť hlavy, hepatomegália, bolesť kĺbov, alopécia, osteoporóza a vyrážka.
U 2 % pacientov s SCN sa pri dlhodobej liečbe vyskytla kožná vaskulitída. V ojedinelých prípadoch sa vyskytla proteinúria alebo hematúria.
U pacientov s HIV infekciou
U menej ako 3 % pacientov liečených filgrastímom sa pozorovala splenomegália. Vo všetkých prípadoch
bola splenomegália mierna alebo stredne závažná a zistila sa palpačným vyšetrením. Klinický nález bol benígny; žiadny pacient nemal diagnózu hypersplenizmu a žiadny pacient nepodstúpil splenektómiu. Hoci je splenomegália bežným nálezom u pacientov s infekciou HIV a vyskytuje sa v rôznych stupňoch závažnosti u väčšiny pacientov s AIDS, súvislosť s liečbou filgrastímom nie je jasná.
Pediatrickápopulácia
Údaje z klinických štúdií u pediatrických pacientov poukazujú na to, že bezpečnosť a účinnosť filgrastímu u dospelých a u detí liečených cytotoxickou chemoterapiou sú podobné, čo naznačuje, že neexistujú žiadne rozdiely vo farmakokinetických vlastnostiach filgrastímu súvisiace s vekom. Jediným konzistentne hláseným nežiaducim účinkom bola muskuloskeletálna bolesť‚ čo sa zhoduje so skúsenosťami u dospelej populácie.
Na ďalšie vyhodnotenie používania filgrastímu u pediatrických pacientov nie sú k dispozícii dostatočné informácie.
Ďalšie osobitné populácieGeriatricképoužitieMedzi pacientmi vo veku nad 65 rokov sa nepozorovali žiadne celkové rozdiely v bezpečnosti ani účinnosti v porovnaní s mladšími dospelými (vo veku > 18 rokov) pacientmi dostávajúcimi cytotoxickú chemoterapiu a klinické skúsenosti neodhalili žiadne rozdiely v odpovediach medzi staršími a mladšími dospelými pacientmi. Nie sú k dispozícii dostatočné údaje na vyhodnotenie používania filgrastímu u geriatrických pacientov pre ostatné schválené indikácie filgrastímu.
PediatrickípacientisSCNU pediatrických pacientov s ťažkou chronickou neutropéniou dostávajúcich chronickú liečbu filgrastímom boli hlásené prípady zníženej hustoty kostného tkaniva a osteoporózy. Frekvencia je odhadovaná z údajov získaných počas klinického skúšania ako „častá“.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v Prílohe V.
4.9 PredávkovanieÚčinky predávkovania filgrastímom neboli stanovené.
Prerušenie liečby filgrastímom zvyčajne vedie k 50 % zníženiu počtu neutrofilov v priebehu 1 až 2 dní s návratom počtu neutrofilov na normálne hodnoty v priebehu 1 až 7 dní.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Imunostimulanciá, faktory stimulujúce kolónie, ATC kód: L03AA02
Nivestim je biologicky podobný liek. Podrobné informácie sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.Ľudský G-CSF je glykoproteín, ktorý reguluje tvorbu a uvoľňovanie funkčných neutrofilov z kostnej drene. Filgrastím obsahujúci r- metHuG-CSF (filgrastím) spôsobuje výrazné zvýšenie počtu neutrofilov v periférnej krvi do 24 hodín s malým vzostupom počtu monocytov. U niektorých pacientov s SCN môže filgrastím indukovať aj mierne zvýšenie počtu cirkulujúcich eozinofilov a bazofilov oproti východiskovej hodnote; niektorí z týchto pacientov môžu mať eozinofíliu alebo bazofíliu už pred liečbou. Pri dodržaní odporúčaných dávok závisí zvýšenie počtu neutrofilov od veľkosti dávky. Neutrofily vytvorené ako odpoveď na liečbu filgrastímom vykazujú normálnu alebo zlepšenú funkciu, čo preukázali testy chemotaktickej a fagocytárnej aktivity. Po ukončení liečby filgrastímom klesá počet cirkulujúcich neutrofilov o 50 % v priebehu 1 až 2 dní a normálne hodnoty sa dosiahnu v priebehu 1 až 7 dní.
Použitie filgrastímu u pacientov podstupujúcich cytotoxickú chemoterapiu vedie k významnému zníženiu výskytu, závažnosti a skráteniu trvania neutropénie a febrilnej neutropénie. Liečba filgrastímom významne
skracuje trvanie febrilnej neutropénie, antibiotickej liečby a hospitalizácie po indukovanej chemoterapii pri akútnej myelogénnej leukémii alebo po myeloablatívnej liečbe pred transplantáciou kostnej drene. Výskyt horúčky a zaznamenaných infekcií nebol znížený v žiadnom z prípadov. U pacientov podstupujúcich myeloablatívnu terapiu pred transplantáciou kostnej drene nebolo trvanie horúčky kratšie.
Použitie filgrastímu, či už samotného alebo po chemoterapii, vedie k mobilizácii hematopoetických progenitorových buniek v periférnej krvi. Tieto autológne PBPC je možné odobrať a podať vo forme transfúzie po cytotoxickej terapii s vysokými dávkami, či už namiesto transplantácie kostnej drene alebo ako doplnok k nej. Infúzne podanie PBPC urýchľuje obnovu krvotvorby pri súčasnom znížení rizika hemoragických komplikácií a potreby transfúzií trombocytov.
U príjemcov alogénnych PBPC mobilizovaných filgrastímom došlo výrazne rýchlejšie k obnove hematologických parametrov, čo viedlo k významnému skráteniu času do obnovy počtu trombocytov bez podpornej liečby v porovnaní s alogénnou transplantáciou kostnej drene.
Jedna retrospektívna európska štúdia hodnotiaca použitie G-CSF po alogénnej transplantácii kostnej drene u pacientov s akútnou leukémiou naznačila zvýšené riziko GvHD, mortality spojenej s liečbou (TRM) a mortality v prípade podania G-CSF. V inej retrospektívnej medzinárodnej štúdii u pacientov s akútnou a chronickou myelogénnou leukémiou sa nezistil žiadny vplyv na riziko GvHD, TRM a mortality. Metaanalýzou štúdií s alogénnou transplantáciou vrátane výsledkov z deviatich perspektívnych randomizovaných skúšaní, ôsmych retrospektívnych štúdií a jednej štúdie s kontrolovanými prípadmi sa nezistil vplyv na riziko akútnej GvHD, chronickej GvHD ani mortality spojenej so skorou liečbou.
Relatívne riziko (95 % IS) GvHD a TRM
po liečbe s G-CSF po transplantácii kostnej drene
P
ublikácia Obdobie trvania štúdie
N Akútny II. – IV. stupeň GvHD
C
hronická
G
vHD
TRM
Metaanalýza
(2003)
Európska retrospektívna štúdia (2004)
1986 – 2001a 1198 1,08
(0,87; 1.33)
1992 – 2002b 1789 1,33
(1,08; 1,64)
1,02
(0,82; 1,26)
1,29
(1,02; 1,61)
0,70
(0,38; 1,31)
1,73
(1,30; 2,32)
Medzinárodná retrospektívna štúdia (2006)
1995 – 2000b 2110 1,11
(0,86; 1,42)
1,10
(0,86; 1,39)
1,26
(0,95; 1,67)

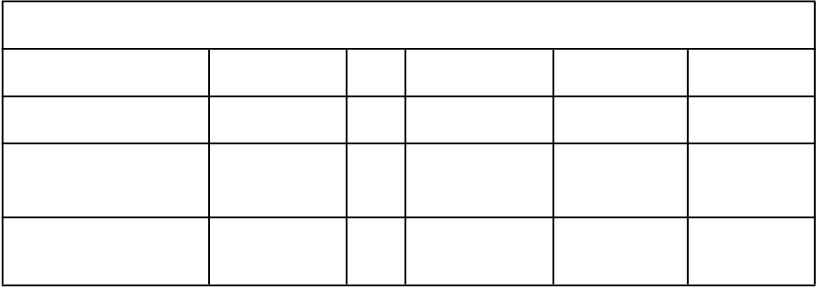
a Analýza zahŕňa štúdie s pacientmi po transplantácii kostnej drene počas tohto obdobia; niektoré štúdie použili GM-CSF
b Analýza zahŕňa pacientov, ktorí podstupujú transplantáciu kostnej drene počas tohto obdobia
Pred alogénnou transplantáciou PBPC sa použitie filgrastímu na mobilizáciu PBPC u normálnych darcov
umožňuje odber 4 x 106 CD34+ buniek/kg telesnej hmotnosti príjemcu, a to u väčšiny darcov po dvoch leukaferézach. Normálnym darcom sa podáva dávka 10 μg/kg/deň, podaná subkutánne v priebehu 4 až 5 po sebe nasledujúcich dňoch.
Použitie filgrastímu u detí alebo dospelých s SCN (závažná kongenitálna, cyklická a idiopatická neutropénia) spôsobuje pretrvávajúci nárast ACN v periférnej krvi a redukuje výskyt infekcií a s nimi súvisiacich príhod.
Použitie filgrastímu u pacientov s infekciou HIV vedie k udržaniu normálneho počtu neutrofilov, čo umožňuje plánované dávkovanie antivírusových a/alebo iných myelosupresívnych liekov. U pacientov s infekciou HIV liečených filgrastímom nebolo dokázané žiadne zvýšenie replikácie HIV.
Tak ako iné hematopoetické rastové faktory, G-CSF vykazuje in vitro stimulačné vlastnosti na ľudské endotelové bunky.
Bezpečnosť a účinnosť Nivestimu bola stanovená v randomizovanej, kontrolovanej štúdii III. fázy u pacientov s karcinómom prsníka. S ohľadom na trvanie závažnej neutropénie a výskyt febrilnej neutropénie neboli zistené rozdiely medzi Nivestimom a referenčným liekom.
5.2 Farmakokinetické vlastnosti
Randomizovaná, otvorená, jednodávková, komparátorom kontrolovaná, dvojito - prekrížená štúdia vykonaná u 46 zdravých dobrovoľníkov preukázali, že farmakokinetický profil Nivestimu bol porovnateľný s profilom referenčného lieku po subkutánnom a intravenóznom podaní. Ďalšia randomizovaná, dvojito zaslepená, viacdávková, komparátorom kontrolovaná, dvojito - prekrížená štúdia vykonaná u 50 zdravých dobrovoľníkov preukázali, že farmakokinetický profil Nivestimu bol porovnateľný s profilom referenčného lieku po subkutánnom podaní.
Klírens filgrastímu po subkutánnom a po intravenóznom podaní sa dá charakterizovať farmakokinetikou
1.rádu. Priemerný polčas eliminácie filgrastímu zo séra je približne 3,5 hod s hodnotou klírens približne
0,6 ml/min/kg. Kontinuálna infúzia filgrastímu pacientom, ktorí sa zotavili po autológnej transplantácii kostnej drene, trvajúca až do 28 dní neviedla k akumulácii lieku a polčas eliminácie mal porovnateľné hodnoty. Koncentrácia filgrastímu v sére je priamo úmerná dávke, či už podaného intravenózne alebo subkutánne. Po subkutánnom podaní lieku v odporúčaných dávkach sa v sére koncentrácie udržovali nad
10 µg/ml počas 8 až 16 hodín. Distribučný objem v krvi je približne 150 ml/kg
5.3 Predklinické údaje o bezpečnosti
Filgrastím sa skúmal v štúdiách toxicity po opakovanom podávaní počas 1 roka, ktoré odhalili zmeny, ktoré možno pripísať očakávaným farmakologickým účinkom, vrátane zvýšenia leukocytov, myeloidnej hyperplázie kostnej drene, extramedulárnej granulopoézy a zväčšenia sleziny. Všetky tieto zmeny ustúpili po prerušení liečby.
Účinky filgrastímu na prenatálny vývoj sa skúmali u potkanov a králikov. Intravenózne (80 µg/kg/deň) podávanie filgrastímu králikom počas organogenézy bolo toxické pre matku a pozorovala sa zvýšená frekvencia spontánnych potratov, postimplantačných strát a znížená priemerná veľkosť vrhu a hmotnosť plodu.
Na základe hlásených údajov od iných liekov obsahujúcich filgrastím sa pozorovali porovnateľné nálezy plus zvýšené malformácie plodu pri dávke 100 µg/kg/deň, čo je pre matku toxická dávka, ktorá zodpovedá systémovej expozícii približne 50-90-násobku expozícií pozorovaných u pacientov liečených klinickou dávkou 5 µg/kg/deň. Hladina bez pozorovaného nežiaduceho účinku embryo-fetálnej toxicity bola v tejto štúdii 10 µg/kg/deň, čo zodpovedá systémovej expozícii približne 3-5-násobku expozícií pozorovaných u pacientov liečených klinickou dávkou.
U gravidných potkanov sa nepozorovala maternálna ani fetálna toxicita pri dávkach až 575 µg/kg/deň. Potomkovia potkanov, ktorým sa podával filgrastím počas perinatálneho obdobia a laktácie, vykazovali oneskorenie vo vonkajšej diferenciácii a spomalenie rastu (≥ 20 µg/kg/deň) a mierne zníženú mieru prežívania (100 µg/kg/deň).
Filgrastím nemá žiadny pozorovaný vplyv na fertilitu samcov alebo samíc potkanov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Ľadová kyselina octová
Hydroxid sodný Sorbitol (E420) Polysorbát 80
Voda na injekciu
6.2 Inkompatibility
Nivestim sa nesmie riediť s roztokmi chloridu sodného.
Zriedený filgrastím sa môže adsorbovať na sklenené alebo plastové materiály pokiaľ nie je zriedený v infúznom roztoku glukózy 50 mg/ml (5 %) (pozri časť 6.6).
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Naplnenáinjekčnástriekačka
30 mesiacov
Pozriedení: Chemická a fyzikálna stabilita pri používaní zriedeného roztoku na infúziu bola dokázaná počas
24 hodín pri teplote 2 °C až 8 °C. Z mikrobiologického hľadiska sa má liek použiť ihneď. Ak sa nepoužije hneď, za čas a podmienky uchovávania pred použitím je zodpovedný používateľ a obvykle by sa nemalo presiahnuť 24 hodín pri teplote 2 °C až 8 °C, pokiaľ zriedenie neprebehlo za kontrolovaných a schválených aseptických podmienok.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2 °C – 8 °C).
Neuchovávajte v mrazničke. Uchovávajte naplnenú injekčnú striekačku v vonkajšom obale na ochranu pred svetlom.
Náhodné vystavenie teplotám pod bodom mrazu do 24 hodín neovplyvní stabilitu Nivestimu.
Zmrazená injekčná liekovka môže byť rozmrazená a následne znovu schladená na ďalšie použitie. Ak je vystavenie dlhšie ako 24 hodín alebo došlo k zmrazeniu viac ako jedenkrát, Nivestim sa nemá použiť.
V rámci času použiteľnosti a na účely ambulantného použitia, môže pacient vybrať liek z chladničky
a uskladniť do pri izbovej teplote (neprevyšujúcej 25 °C) pre jednorazové použitie do 7 dní. Po tomto čase sa liek nemá uskladniť späť do chladničky, ale má byť zlikvidovaný.
Podmienky na uchovávanie po riedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Naplnená injekčná striekačka (sklo typu I) s injekčnou ihlou (z nehrdzavejúcej ocele), s ochranným krytom ihly, obsahujúca 0,5 ml injekčného a infúzneho roztoku.
Veľkosti balenia 1, 5, 8 alebo 10 naplnených injekčných striekačiek. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Ak je to potrebné, Nivestim sa môže riediť v infúznom roztoku glukózy 50 mg/ml (5 %).
Riedenie na konečnú koncentráciu < 0,2 MU (2 mikrogramy)/ml sa v žiadnom prípade neodporúča. Pred použitím sa má roztok vizuálne skontrolovať. Majú sa použiť len číre roztoky bez častíc.
U pacientov liečených filgrastímom zriedeným na koncentrácie menej ako 1,5 MU (15 mikrogramov)/ml sa má ku konečnej koncentrácii 2 mg/ml pridať ľudský sérový albumín (HSA).
Príklad: V konečnom objeme 20 ml sa má k celkovej dávke filgrastímu nižšej ako 30 MU (300 mikrogramov) pridať 0,2 ml roztoku 20 %ľudského sérového albumínu.
Po zriedení v infúznom roztoku glukózy s koncentráciou 50 mg/ml (5 %) je filgrastím kompatibilný so sklom a rôznymi plastmi vrátane polyvinylchloridu (PVC), polyolefínu (kopolymér polypropylénu a polyetylénu) a polypropylénu.
Nivestim neobsahuje žiadne konzervačné látky: Z hľadiska na možného rizika mikrobiologickej kontaminácie sú injekčné striekačky Nivestimu určené len na jednorazové použitie. Nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIHospira UK Limited
Horizon Honey Lane Hurley Maidenhead SL6 6RJ
Veľká Británia
Tel: + 44 (0) 1628 515500
Fax: + 44 (0) 1628 829827
8. REGISTRAČNÁ ČÍSLAEU/1/10/631/004
EU/1/10/631/005
EU/1/10/631/006
EU/1/10/631/011
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 08. júna 2010
Dátum posledného predĺženia registrácie: 27. máj 2015
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
http://www.ema.europa.eu/.
1. NÁZOV LIEKU
Nivestim 48 MU/ 0,5 ml injekčný a infúzny roztok
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každý ml injekčného a infúzneho roztoku obsahuje 96 miliónov jednotiek (MU) (960 mikrogramov)
filgrastímu*.
Každá naplnená injekčná striekačka obsahuje 48 miliónov jednotiek (MU) (480 mikrogramov) filgrastímu v
0,5 ml (0,96 mg/ml).
* rekombinovaný metionylový faktor stimulujúci kolónie granulocytov [G-CSF] produkovaný v Escherichia
Coli (BL21) technológiou rekombinantnej DNA.
Pomocnálátkasoznámymúčinkom:
Každý ml roztoku obsahuje 50 mg sorbitolu. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA Injekčný a infúzny roztok. Číry, bezfarebný roztok.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Filgrastím je indikovaný na skrátenie trvania neutropénie a zníženie výskytu febrilnej neutropénie u pacientov s nariadenou cytotoxickou chemoterapiou kvôli malígnemu nádorovému ochoreniu (s výnimkou chronickej myeloidnej leukémie a myelodysplastických syndrómov) a skrátenie trvania neutropénie u pacientov podstupujúcich myeloablatívnu terapiu pred transplantáciou kostnej drene, u ktorých sa predpokladá zvýšené riziko dlhotrvajúcej závažnej neutropénie.
U dospelých a detí, ktorí dostávajú cytotoxickú chemoterapiu je bezpečnosť a účinnosť filgrastímu podobná. Filgrastím je indikovaný na mobilizáciu progenitorových buniek v periférnej krvi (PBPC).
U pacientov, detí a dospelých, so závažnou kongenitálnou, cyklickou a idiopatickou neutropéniou
s absolútnym počtom neutrofilov (ANC) ≤ 0,5 x 109/l) a závažnými alebo opakujúcimi sa infekciami
v anamnéze je dlhodobé podávanie filgrastímu indikované na zvýšenie počtu neutrofilov a skrátenie trvania stavov súvisiaci s infekciou.
Filgrastím je indikovaný na liečbu perzistentnej neutropénie (ANC ≤ 1,0 x 109/l) u pacientov s pokročilou infekciou HIV na zníženie rizika výskytu bakteriálnych infekcií, keď nie sú vhodné iné terapeutické možnosti.
4.2 Dávkovanie a spôsob podávania
Liečba filgrastímom sa má podávať len v spolupráci s onkologickým centrom, ktoré má skúsenosti s liečbou
G-CSF a hematológiou a má potrebné diagnostické vybavenie. Postupy mobilizácie a aferézy sa majú
vykonávať v spolupráci s onkohematologickým centrom, ktoré má zodpovedajúce skúsenosti v tejto oblasti a v ktorom je možné správne vykonávať monitorovanie krvotvorných progenitorových buniek.
Dávkovanie
Nariadenácytotoxickáchemoterapia
Odporúčaná dávka filgrastímu je 0,5 MU (5 mikrogramov)/kg/deň. Prvá dávka filgrastímu sa má podať najmenej 24 hodín po cytotoxickej chemoterapii.
Podávanie dennej dávky filgrastímu má pokračovať pokiaľ neodznie očakávaný pokles počtu neutrofilov na minimum a ich počet sa nevráti na normálne hodnoty. Po nariadenej chemoterapii solídnych tumorov, lymfómov a pri lymfoidnej leukémii sa očakáva, že dĺžka liečby, ktorá spĺňa tieto kritériá, bude maximálne
14 dní. Po indukčnej a konsolidačnej terapii akútnej myeloidnej leukémie môže byť liečba podstatne dlhšia
(až 38 dní) v závislosti od typu, dávky a režimu použitej cytotoxickej chemoterapie.
U pacientov, ktorí dostávajú cytotoxickú chemoterapiu, sa zvyčajne 1 až 2 dni po začiatku liečby filgrastímom prejaví prechodné zvýšenie počtu neutrofilov. Z dôvodu dosiahnutia trvalej terapeutickej odpovede sa však liečba filgrastímom nemá prerušiť pred odznením očakávaného poklesu počtu neutrofilov na minimum a pokiaľ sa počet neutrofilov nevráti na normálne hodnoty. Predčasné ukončenie liečby filgrastímom pred odznením očakávaného poklesu počtu neutrofilov na minimum sa neodporúča.
U pacientov podstupujúcich myeloablatívnu terapiu, po ktorej nasleduje transplantácia kostnej drene
Odporúčaná dávka filgrastímu je 1,0 MU (10 mikrogramov)/kg/deň
Prvá dávka filgrastímu sa má podať najmenej 24 hodín po cytotoxickej chemoterapii a najmenej 24 hodín po infúzii kostnej drene.
Keď sa prekročí dolná hranica (nadir) počtu neutrofilov, denná dávka filgrastímu sa má titrovať v závislosti od zmeny počtu neutrofilov nasledovne:
Absolútny počet neutrofilov Úprava dávky Nivestimu
> 1,0 x 109/l počas 3 po sebe nasledujúcich dní Znížiť na 0,5 MU/kg/deň

Potom, ak ANC zostáva > 1,0 x 109/l počas ďalších 3 po sebe nasledujúcich dní
Prerušiť liečbu filgrastímom
Ak ANC klesne počas liečby na < 1,0 x 109/l, dávka filgrastímu sa má postupne zvyšovať podľa vyššie uvedených krokov.
Mobilizácia PBPC
Na mobilizáciu progenitorových buniek v periférnej krvi (PBPC) u pacientov podstupujúcich myelosupresívnu alebo myeloablatívnu terapiu, po ktorých nasleduje autológna transplantácia progenitorových buniek v periférnej krvi
Odporúčaná dávka filgrastímu na mobilizáciu PBPC v monoterapii je 1,0 MU (10 mikrogramov)/kg/deň počas 5 až 7 po sebe nasledujúcich dňoch. Načasovanie leukaferézy: 1 alebo 2 leukaferézy na 5. a 6. deň sú často postačujúce. Za iných okolností môžu byť potrebné ďalšie leukaferézy. Podávanie filgrastímu má pokračovať až do poslednej leukaferézy.
Odporúčaná dávka filgrastímu na mobilizáciu PBPC po myelosupresívnej chemoterapii je 0,5 MU
(5 mikrogramov)/kg/deň podávaná jedenkrát od prvého dňa po skončení chemoterapie, až pokiaľ neodznie očakávaný maximálny pokles počtu neutrofilov a kým sa počet neutrofilov nevráti na normálne hodnoty. Leukaferéza sa má vykonať v období, keď ANC stúpa z < 0,5 x 109/l na > 5,0 x 109/l. U pacientov, ktorí sa
nepodrobili extenzívnej chemoterapii, zvyčajne postačí jedna leukaferéza. V ostatných prípadoch sa odporúčajú ďalšie leukaferézy.
Na mobilizáciu progenitorových buniek v periférnej krvi (PBPC) u normálnych darcov pred alogénnou transplantáciou PBPC
V prípade mobilizácie PBPC u normálnych darcov sa má filgrastím podávať v dávke
10 mikrogramov/kg/deň subkutánnou injekciou počas 4 až 5 po sebe nasledujúcich dní. Leukaferéza sa má začať na 5. deň a ak je to potrebné, má pokračovať až do 6. dňa, aby sa získalo 4 x 106 CD34+ buniek/kg telesnej hmotnosti (BW) príjemcu.'
Upacientovsozávažnouchronickouneutropéniou
Kongenitálna neutropénia: odporúčaná začiatočná dávka je 1,2 MU (12 mikrogramov)/kg/deň v jednej dávke alebo vo viacerých rozdelených dávkach.
Idiopatická alebo cyklická neutropénia: odporúčaná začiatočná dávka je 0,5 MU (5 mikrogramov)/kg/deň podaná subkutánne v jednej dávke alebo vo viacerých rozdelených dávkach.
Úprava dávkovania: Filgrastím sa má podávať jedenkrát denne, pokiaľ počet neutrofilov nedosiahne hodnotu 1,5 x 109/l a kým sa neudrží na ešte vyššej hodnote. Keď sa dosiahne odpoveď, má sa stanoviť minimálna účinná dávka na udržanie tejto hodnoty. Na udržanie adekvátneho počtu neutrofilov je potrebné dlhodobé každodenné podávanie lieku. Po 1 až 2 týždňoch liečby sa môže začiatočná dávka zdvojnásobiť alebo rozdeliť na polovicu v závislosti od odpovede pacienta. Potom sa dávka môže individuálne upravovať každé 1 až 2 týždne tak, aby sa priemerný počet neutrofilov udržal medzi hodnotami 1,5 x 109/l a 10 x 109/l. U pacientov so závažnými infekciami sa môže zvážiť rýchlejší režim zvyšovania dávky. V klinických štúdiách sa u 97 % pacientov, u ktorých sa dostavila odpoveď, dosiahla úplná odpoveď pri dávkach
≤ 24 mikrogramov/kg/deň. Dlhodobá bezpečnosť podávania filgrastímu v dávkach vyšších ako
24 mikrogramov/kg/deň u pacientov so závažnou chronickou neutrópiou nebola stanovená.
UpacientovsHIVinfekciou
Zvrat neutropénie
Odporúčaná začiatočná dávka filgrastímu je 0,1 MU (1 mikrogram)/kg/deň podávaná jedenkrát denne s titráciou až do maximálnej dávky 0,4 MU/kg/deň (4 mikrogramy/kg/deň), pokiaľ sa nedosiahne normálny počet neutrofilov a kým sa neudrží na tejto hodnote (ANC > 2,0 x 109/l). V klinických štúdiách odpovedalo na tieto dávky viac ako 90 % pacientov a zvrat neutropénie sa dosiahol v priemere po 2 dňoch.
U malého počtu pacientov (< 10 %) boli na dosiahnutie zvratu neutropénie potrebné dávky až 1,0 (10 mikrogramov)/kg/deň.
Na udržanie normálneho počtu neutrofilov
Po dosiahnutí zvratu neutropénie sa má stanoviť minimálna účinná dávka na udržanie normálneho počtu neutrofilov. Odporúča sa upraviť počiatočnú dávku tak, aby zodpovedala dennému dávkovaniu 30 MU (300 mikrogramov)/deň. Ďalšia úprava dávkovania môže byť potrebná, v závislosti od hodnôt ANC u pacienta, na udržanie počtu neutrofilov na hodnotách > 2,0 x 109/l. V klinických štúdiách bola potrebná
dávka 30 MU (300 mikrogramov)/deň počas 1 až 7 dní do týždňa, aby sa hodnota ANC udržala na hodnote
> 2,0 x 109/l, s priemernou frekvenciou dávky 3 dni do týždňa. Dlhodobé podávanie lieku môže byť nevyhnutné na udržanie hodnoty ANC > 2,0 x 109/l.
Osobitné skupiny pacientov
Starší pacienti
Do klinických skúšaní s filgrastímom bol zahrnutý malý počet starších pacientov, ale s touto populáciou pacientov sa neuskutočnili žiadne osobitné štúdie. Preto nie je možné u týchto pacientov stanoviť špecifické odporúčania týkajúce sa dávkovania.
Pacienti s poruchou funkcie obličiek alebo pečene
Štúdie filgrastímu u pacientov so závažnou poruchou funkcie obličiek alebo pečene preukázali, že filgrastím vykazuje podobný farmakokinetický a farmakodynamický profil ako u normálnych jedincov. Za týchto okolností nie je potrebná úprava dávkovania.
Pediatrickí pacienti so závažnou chronickou neutrópiou (SCN) a nádorových ochorením
V klinických štúdiách, ktoré zahŕňali pacientov s SCN, bolo 65 % pacientov mladších ako 18 rokov. V tejto vekovej skupine, ktorá prevažne zahŕňala pacientov s kongenitálnou neutropéniou, sa dokázala účinnosť liečby. U pediatrických pacientov liečených kvôli SCN sa nezaznamenali žiadne rozdiely v profile bezpečnosti v porovnaní s dospelými.
Údaje z klinických štúdií u pediatrických pacientov naznačujú, že bezpečnosť a účinnosť filgrastímu u dospelých aj detí liečených cytotoxickou chemoterapiou sú podobné.
Odporúčané dávkovania u pediatrických pacientov sú rovnaké ako u dospelých, ktorí dostávajú myelosupresívnu cytotoxickú chemoterapiu.
Spôsob podávania
Nariadenácytotoxickáchemoterapia
Filgrastím sa môže podávať ako denná subkutánna injekcia alebo ako denná intravenózna infúzia po zriedení v infúznom roztoku glukózy s koncentráciou 50 mg/ml (5 %) trvajúcej aspoň 30 minút (pozri časť 6.6
pokyny na nariedenie lieku).Vo väčšine prípadov sa uprednostňuje subkutánne podanie. V štúdii, v ktorej sa podávala jednorazová dávka, sa zistilo, že intravenózne podávanie môže skrátiť trvanie účinku. Klinický význam tohto zistenia pre viacnásobné podanie dávky nie je jasný. Voľba cesty podania lieku závisí od individuálnych klinických okolností. V randomizovaných klinických skúšaniach sa používala subkutánna dávka 230 mikrogramov/m2/deň) (4,0 až 8,4 mikrogramov/kg/deň).
Pacientipodstupujúcimyeloablatívnuterapiu,poktorejnasledujetransplantáciakostnejdreneFilgrastím sa podáva ako intravenózna infúzia počas 30 minút alebo ako intravenózna alebo kontinuálna subkutánna infúzia počas 24 hodín. Filgrastím sa má zriediť v 20 ml infúzneho roztoku glukózy 50 mg/ml (5 %) (pozri časť 6.6).
MobilizáciaPBPC
Na mobilizáciu PBPC u pacientov podstupujúcich myelosupresívnu alebo myeloablatívnu terapiu, po ktorých nasleduje autológna transplantácia PBPC, sa odporúčaná dávka filgrastímu môže podať aj ako 24- hodinová kontinuálna subkutánna infúzia alebo jedna denná subkutánna injekcia počas 5 až 7 po sebe nasledujúcich dní. Filgrastím sa má pred infúznym podaním zriediť v 20 ml infúzneho roztoku glukózy
50 mg/ml (5 %) ((pozri časť 6.6).
SCN/infekciaHIV
Subkutánna injekcia.
Pokyny na riedenie lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Osobitné upozornenia
Filgrastím sa nemá používať na zvýšenie dávky cytotoxickej chemoterapie nad stanovené dávkovacie režimy.
Filgrastím sa nemá podávať pacientom so závažnou kongenitálnou neutropéniou (Kostmannov syndróm) s cytogenetickými poruchami.
U pacientov liečených filgrastímom sa pri úvodnej alebo následnej liečbe zaznamenala precitlivenosť, vrátane anafylaktických reakcií. U pacientov s klinicky významnou precitlivenosťou trvalo ukončite liečbu filgrastímom. Filgrastím nepodávajte pacientom s precitlivenosťou na filgrastím alebo pegfilgrastím v anamnéze.
Rovnako ako u všetkých terapeutických proteínov existuje možnosť imunogenicity Miera tvorby protilátok proti filgrastímu je vo všeobecnosti nízka. Väzba protilátok je podobná ako u všetkých biologických liekov; doposiaľ však neboli spájané s neutralizačnou aktivitou.
Rast malígnych buniek
GCSF môže podporovať rast myeloidných buniek in vitro a podobné prípady sa môžu vyskytnúť u niektorých nemyeloidných buniek in vitro.
Bezpečnosť a účinnosť podávania filgrastímu u pacientov s myelodysplastickým syndrómom alebo chronickou myelogénnou leukémiou neboli stanovené.
Filgrastím nie je indikovaný na použitie za týchto podmienok. Obzvlášť je potrebná pozornosť pri odlíšení diagnózy transformácie blastov pri chronickej myeloidnej leukémii od akútnej myeloidnej leukémie.
Vzhľadom na obmedzené údaje o bezpečnosti a účinnosti u pacientov so sekundárnou akútnou myeloidnou leukémiou (AML) sa má filgrastím podávať opatrne.
Bezpečnosť a účinnosť podávania Nivestimu u pacientov s de novo AML mladších ako 55 rokov s dobrými cytogenetickými parametrami [t(8;21), t(15;17) a inv(16)] nebola stanovená.
Ďalšie osobitné upozornenia
U pacientov s osteoporózou ako základným ochorením, ktorí podstupujú kontinuálnu liečbu s filgrastímom dlhšie ako 6 mesiacov, sa odporúča monitorovanie minerálnej denzity kostí.
Po podaní G-CSF boli zaznamenané zriedkavé (> 0,01 % a < 0,1 %) pľúcne nežiaduce reakcie, najmä intersticiálna pneumónia. U pacientov s výskytom pľúcnych infiltrátov alebo pneumóniou v nedávnej anamnéze môže byť riziko vyššie. Nástup pľúcnych príznakov, ako sú kašeľ, horúčka a dyspnoe, v spojení s rádiologicky zistenými príznakmi pľúcnych infiltrátov a zhoršením pľúcnych funkcií môžu byť počiatočnými príznakmi syndrómu respiračnej tiesne dospelých (ARDS). V týchto prípadoch sa má ukončiť liečba filgrastímom a má sa začať vhodná liečba.
Po podaní faktora stimulujúceho kolónie granulocytov sa zaznamenal syndróm kapilárneho presakovania, ktorý je charakterizovaný hypotenziou, hypoalbuminémiou, edémom a hemokoncentráciou. Pacienti,
u ktorých sa vyvinú príznaky syndrómu kapilárneho presakovania, sa majú starostlivo sledovať a majú dostať štandardnú symptomatickú liečbu, ktorá môže zahŕňať potrebu intenzívnej starostlivosti (pozri časť
4.8).
Osobitnéupozorneniaprepacientovsnádorovýmiochoreniami
Leukocytóza
U menej ako 5 % pacientov liečených filgrastímom v dávkach nad 0,3 MU (3 mikrogramy)/kg/deň bol pozorovaný počet bielych krviniek 100 x 109/l alebo vyšší. Neboli zaznamenané žiadne nežiaduce reakcie, ktoré by bolo možné priamo pripísať tomuto stupňu leukocytózy. Avšak vzhľadom na potenciálne riziká spojené so závažnou leukocytózou sa má počas liečby filgrastímom pravidelne kontrolovať počet bielych krviniek. Ak počet leukocytov prevýši 50 x 109/l po ich očakávanom poklese na minimum, liečba filgrastímom sa musí okamžite ukončiť. Ak sa však počas liečby filgrastímom z dôvodu mobilizácie PBPC zvýši počet leukocytov nad 70 x 109/l, má sa ukončiť liečba alebo znížiť dávkovanie.
R
i
ziká spojené so zvýšenými dávkami chemoterapie
Pri liečbe pacientov s vysokými dávkami chemoterapie je nutná mimoriadna opatrnosť, pretože sa nedokázalo zlepšenie stavu nádoru a zvýšené dávkovanie chemoterapeutík môže viesť k zvýšenej toxicite vrátane srdcových, pľúcnych, neurologických a dermatologických účinkov (pozri, prosím, súhrn charakteristických vlastností použitých špecifických chemoterapeutík).
Liečba samotným filgrastímom nevylučuje výskyt trombocytopénie a anémie v dôsledku myelosupresívnej chemoterapie. U pacienta môže byť vyššie riziko vzniku trombocytopénie a anémie z dôvodu možnej liečby vyššími dávkami chemoterapie (napr. plné dávky v predpísanom režime). Odporúča sa pravidelné monitorovanie počtu trombocytov a hematokritu. Počas podávania jedného chemoterapeutika alebo kombinácie chemoterapeutík, o ktorých je známe, že spôsobujú závažnú trombocytopéniu, sa musí zachovávať zvláštna opatrnosť.
Dokázalo sa, že použitie filgrastímom mobilizovaných PBPC znižuje stupeň a trvanie trombocytopénie po myelosupresívnej alebo myeloablatívnej chemoterapii.
Splenomegália
Po podaní filgrastímu boli hlásené menej časté prípady splenomegálie a ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne. U ľudí s bolesťami v oblasti ľavej hornej časti brušnej dutiny a/alebo hornej časti ramena a dostávajú filgrastím, treba sledovať zväčšenie sleziny alebo ruptúru sleziny.
Ďalšie osobitné opatrenia
Účinky filgrastímu sa neskúmali u pacientov s výrazne zníženými myeloidnými progenitormi. Filgrastím účinkuje primárne na prekurzory neutrofilov, kedy sa uplatňuje jeho účinok na zvýšenie počtu neutrofilov. Preto u pacientov so zníženým počtom prekurzorov môže byť odpoveď neutrofilov oslabená (napríklad u tých, ktorí sú liečení extenzívnou rádioterapiou alebo chemoterapiou, alebo u ktorých dochádza k infiltrácii kostnej drene tumorom).
U pacientov, ktorí dostávali G-CSF po alogénnej transplantácii kostnej drene, boli hlásené reakcie štepu proti hostiteľovi (Graft versus Host Disease – GvHD) a úmrtia (pozri časť 5.1).
Účinok filgrastímu na GvHD nebol stanovený.
Zvýšená hematopoetická aktivita kostnej drene v odpovedi na liečbu rastovým faktorom bola spojená s prechodne pozitívnymi nálezmi v RTG kostí, a to je potrebné zvážiť pri interpretácii výsledkov RTG kostí.
Osobitnéupozorneniaprepacientovpodstupujúcichmobilizáciuprogenitorovýchbuniekvperiférnejkrvi
Mobilizácia
V rámci rovnakej populácie pacientov sa nevykonali žiadne perspektívne randomizované porovnávania dvoch odporúčaných mobilizačných metód (monoterapia filgrastímom alebo kombinácia s myelosupresívnou chemoterapiou). Rozdiely medzi jednotlivými pacientmi ako aj vo výsledkoch laboratórnych analýz CD34+ buniek značia, že priame porovnanie medzi odlišnými štúdiami je zložité. Z tohto dôvodu je ťažké odporučiť optimálnu metódu. Mobilizačná metóda sa má zvoliť podľa celkových cieľov liečby u jednotlivých pacientov.
Predchádzajúca expozícia cytotoxickými látkami
U pacientov, ktorí pred podaním filgrastímu na mobilizáciu PBPC podstúpili veľmi extenzívnu myelosupresívnu terapiu, sa nemusí prejaviť dostatočná mobilizácia PBPC na dosiahnutie odporučenej minimálnej výťažnosti (≥ 2,0 x 106 CD34+ buniek/kg) alebo urýchlenie obnovenia trombocytov na rovnakú úroveň.
Niektoré cytotoxické látky vykazujú špecifickú toxicitu voči zásobe krvotvorných progenitorov a môžu nepriaznivo ovplyvniť mobilizáciu progenitorov. Ak sa počas dlhého obdobia pred pokusmi o mobilizáciu progenitorov podávajú látky ako melfalan, karmustín (BCNU) a karboplatina, tieto môžu obmedziť výťažnosť progenitorov. Podávanie melfalanu, karboplatiny alebo BCNU spolu s filgrastímom sa však ukázalo ako účinné pri mobilizácii progenitorov. V prípade, že sa predpokladá transplantácia PBPC,
odporúča sa naplánovať mobilizáciu kmeňových buniek vo včasnej fáze liečby pacienta. Osobitná pozornosť sa má venovať počtu mobilizovaných progenitorov u takýchto pacientov pred podaním vysokých dávok chemoterapie. Ak sú výťažnosti neadekvátne vzhľadom na vyššie uvedené kritériá, majú sa zvážiť alternatívne formy liečby, ktoré nevyžadujú podporu progenitorov.
Zhodnotenie výťažností progenitorových buniek
Pri vyhodnocovaní počtu progenitorových buniek odobratých od pacientov liečených filgrastímom sa má venovať osobitná pozornosť metóde kvantifikácie. Výsledky prietokovej cytometrickej analýzy počtu CD34+ buniek sa líšia v závislosti od presnosti použitej metodológie, a preto odporúčania týkajúce sa počtov získaných na základe štúdií v iných laboratóriách je potrebné interpretovať opatrne.
Štatistická analýza vzťahu medzi počtom opätovne infundovaných CD34+ buniek a rýchlosťou obnovenia trombocytov po podaní vysokých dávok chemoterapie naznačuje zložitý, avšak kontinuálny vzťah.
Odporúčanie minimálnej výťažnosti ≥ 2,0 x 106 CD34+ buniek/kg sa zakladá na publikovaných skúsenostiach, vedúcich k primeranej hematologickej obnove. Výťažnosti prevyšujúce túto minimálnu výťažnosť korelujú s rýchlejším obnovením, výťažnosti nižšie ako táto hodnota korelujú s pomalším zotavením.
Osobitnéupozorneniaprenormálnychdarcovpodstupujúcichmobilizáciuprogenitorovýchbuniekvperiférnejkrvi
Mobilizácia PBPC nie je priamym klinickým prínosom pre normálnych darcov a má sa vziať do úvahy len
na účely alogénnej transplantácie kmeňových buniek.
Nad mobilizáciou PBPC sa má uvažovať len u darcov, ktorí spĺňajú normálne klinické a laboratórne kritériá vhodnosti pre darovanie kmeňových buniek s osobitnou pozornosťou na hematologických hodnotách a infekčných ochoreniach.
Bezpečnosť a účinnosť filgrastímu neboli stanovené u normálnych darcov mladších ako 16 rokov alebo starších ako 60 rokov.
Prechodná trombocytopénia (počet trombocytov < 100 x 109/l) po podaní filgrastímu a po leukaferéze sa pozorovala u 35 % skúmaných pacientov. V tejto skupine bol v dvoch prípadoch zaznamenaný počet trombocytov < 50 x 109/l v dôsledku leukaferézy.
Ak je potrebných viac leukaferéz, zvláštna pozornosť sa má venovať darcom s počtom trombocytov
< 100 x 109/l pred leukaferézou; vo všeobecnosti sa aferéza nemá vykonať, ak je počet trombocytov
< 75 x 109/l.
Leukaferéza sa nemá vykonať u darcov, ktorí sú liečení antikoagulanciami alebo ktorí majú poruchy hemostázy.
Ak počet leukocytov stúpne na 70 x 109/l, podávanie filgrastímu sa má ukončiť alebo sa má znížiť dávkovanie.
Darcovia, ktorí na mobilizáciu PBPC dostávajú G-CSF, majú byť monitorovaní, až pokiaľ sa hematologické ukazovatele nevrátia na normálnu úroveň.
U normálnych darcov sa po podaní G-CSF pozorovali prechodné cytogenetické modifikácie. Význam týchto zmien nie je známy.
Sledovanie dlhodobej bezpečnosti darcov pokračuje. Napriek tomu nemožno vylúčiť zvýšené riziko malígnych myeloidných klonov. Odporúča sa, aby stredisko aferézy podávalo systematickú správu a sledovalo darcov kmeňových buniek , čím sa zabezpečí monitorovanie dlhodobej bezpečnosti.
U normálnych darcov a pacientov boli po podaní G-CSF hlásené bežné, ale obvykle asymptomatické prípady splenomegálie a veľmi zriedkavo prípady ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne. Z tohto dôvodu sa má dôkladne monitorovať veľkosť sleziny (napr. klinickým vyšetrením, ultrazvukom). Diagnóza ruptúry sleziny sa má zvážiť u darcov a/alebo pacientov, ktorí uvádzajú bolesť v ľavej hornej abdominálnej oblasti alebo v hornej časti ramena.
U normálnych darcov boli veľmi zriedkavo hlásené pľúcne nežiaduce udalosti (hemoptýza, krvácanie do pľúc, pľúcne infiltráty, dyspnoe a hypoxia) po uvedení na trh s inými liekmi obsahujucími filgrastím. V prípade podozrenia na pľúcne nežiaduce udalosti alebo ich potvrdenia sa má zvážiť predčasné ukončenie liečby filgrastímom a poskytnúť vhodná lekárska starostlivosť.
Osobitné upozornenia pre príjemcov alogénnych progenitorových buniek v periférnej krvi mobilizovaných filgrastímom
Najnovšie údaje naznačujú, že imunologické interakcie medzi alogénnym štepom PBPC a príjemcom môžu byť spojené so zvýšeným rizikom výskytu akútnej a chronickej GvHD v porovnaní s transplantáciou kostnej drene.
Osobitnéupozorneniaprepacientovsozávažnouchronickouneutropéniou(SCN)
Počty krvných buniek
Počty trombocytov sa majú dôkladne monitorovať, najmä počas prvých pár týždňov liečby filgrastímom.
U pacientov, u ktorých sa rozvinie trombocytopénia, t. j. trvalý pokles počtu trombocytov pod 100 x 109/l, sa má zvážiť občasné prerušenie liečby alebo zníženie dávky filgrastímu.
Vyskytujú sa ďalšie zmeny počtu krvných buniek vrátane anémie a prechodného zvýšenia počtu myeloidných progenitorov, čo si vyžaduje dôkladné sledovanie počtu krvných buniek.
Transformácia na leukémiu alebo myelodysplastický syndróm
Osobitná pozornosť sa má venovať odlíšeniu diagnózy závažnej chronickej neutropénie od ostatných porúch krvotvorby, ako je aplastická anémia, myelodysplázia a myeloidná leukémia. Pred začatím liečby sa má vyšetriť kompletný krvný obraz s diferenciálnym a absolútnym počtom trombocytov a má sa vyhodnotiť morfológia kostnej drene a karyotyp.
V klinickej štúdii bol nízky výskyt (približne 3 %) myelodysplastických syndrómov (MDS) alebo leukémie u pacientov so závažnou chronickou neutropéniou liečených filgrastímom. Toto pozorovanie sa vykonalo
len u pacientov s kongenitálnou neutropéniou. MDS a leukémie sú prirodzené komplikácie tohto ochorenia a ich súvislosť s liečbou filgrastímom nie je jasná. U podskupiny približne 12 % pacientov s normálnymi cytogenetickými výsledkami vo východiskovom bode sa pri rutinnom opakovanom vyhodnotení postupne zistili poruchy vrátane monozómie 7. Ak sa u pacientov so závažnou chronickou neutropéniou vyvinú abnormality cytogenetiky, majú sa dôkladne zvážiť riziká a výhody pokračovania liečby filgrastímom; ak sa objaví MDS alebo leukémia, liečba filgrastímom sa musí ukončiť. V súčasnosti nie je jasné, či dlhotrvajúca liečba pacientov so závažnou chronickou neutropéniou predisponuje pacientov k cytogenetickým poruchám, MDS alebo leukemickej transformácii. U pacientov sa odporúča v pravidelných intervaloch vykonávať morfologické a cytogenetické vyšetrenie kostnej drene (približne každých 12 mesiacov).
Splenomegália
Po podaní filgrastímu boli hlásené menej časté prípady splenomegálie a ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne. U ľudí s bolesťami v oblasti ľavej hornej časti brušnej dutiny a/alebo hornej časti ramena a dostávajú filgrastím, treba sledovať zväčšenie sleziny alebo ruptúru sleziny.
Ďalšie osobitné upozornenia
Musia sa vylúčiť príčiny prechodnej neutropénie, ako sú vírusové infekcie.
Zväčšenie sleziny je priamym dôsledkom liečby filgrastímom. V štúdiách sa u 31 % pacientov zaznamenala hmatateľná splenomegália. Hneď na začiatku liečby filgrastímom sa rádiologicky zistilo zväčšenie objemu sleziny, ktoré sa postupne stabilizovalo. Zistilo sa, že zníženie dávok viedlo k spomaleniu alebo zastaveniu
zväčšovania sleziny a u 3 % pacientov bola nutná splenektómia. Veľkosť sleziny sa má pravidelne sledovať. Na zistenie abnormálneho zväčšenia objemu sleziny postačuje palpačné vyšetrenie brucha.
U malého počtu pacientov sa vyskytla hematúria/proteinúria. Na sledovanie tohto stavu sa má pravidelne vyšetrovať moč.
Bezpečnosť a účinnosť lieku u novorodencov a pacientov s autoimúnnou neutropéniou neboli stanovené. OsobitnéupozorneniaprepacientovsHIVinfekciou
Počty krvných buniek
Absolútny počet neutrofilov (ANC) sa má dôkladne monitorovať, najmä počas prvých pár týždňov liečby filgrastímom. Niektorí pacienti môžu veľmi rýchlo reagovať na prvú dávku filgrastímu výrazným zvýšením počtu neutrofilov. Počas prvých 2 až 3 dní podávania filgrastímu sa odporúča denne monitorovať ANC. Následne sa odporúča monitorovať ANC aspoň dvakrát týždenne počas prvých dvoch týždňov liečby a potom raz týždenne alebo každé dva týždne počas udržiavacej liečby. Počas prerušovaného dávkovania na úrovni 30 MU (300 mikrogramov)/deň filgrastímu sa môžu objaviť veľké výkyvy hodnôt ANC u pacientov. Na určenie dolnej hranice ANC u pacienta sa odporúča odobrať vzorky krvi na zistenie ANC bezprostredne pred akýmkoľvek plánovaným podaním filgrastímu.
Riziko spojené so zvýšenými dávkami myelosupresívnych liekov
Liečba samotným filgrastímom nevylučuje výskyt trombocytopénie a anémie v dôsledku myelosupresívnych terapií. Následkom možného prijatia vyšších dávok alebo väčšieho množstva týchto liekov spolu s liečbou filgrastímom sa u pacienta môže vyskytnúť zvýšené riziko rozvoja trombocytopénie a anémie. Odporúča sa pravidelné monitorovanie krvného obrazu (pozri vyššie).
Infekcie a malígne ochorenia spôsobujúce myelosupresiu
Neutropénia môže byť spôsobená infliltráciou kostnej drene oportúnnymi infekciami, ako je komplex Mycobacterium avium, alebo malígnymi ochoreniami, napríklad lymfómom. U pacientov so známou infiltráciou kostnej drene infekciami alebo malígnym ochorením sa má okrem podávania filgrastímu na liečbu neutropénie zvážiť aj vhodná liečba základného ochorenia. Účinky filgrastímu na neutropéniu zapríčinenú infiltráciou kostnej drene infekciou alebo malígnym ochorením neboli dostatočne preukázané.
Splenomegália
Po podaní filgrastímu boli hlásené menej časté prípady splenomegálie a ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne. U ľudí s bolesťami v oblasti ľavej hornej časti brušnej dutiny a/alebo hornej časti ramena a dostávajú filgrastím, treba sledovať zväčšenie sleziny alebo ruptúru sleziny.
Osobitnéupozorneniaprikosáčikovitejčrte(heterozygotnomhemoglobíneS)akosáčikovitejanémii
U pacientov s kosáčikovitou črtou alebo s kosáčikovitou anémiou sa zaznamenala po použití filgrastímu kríza kosáčikovitej anémie, v niektorých prípadoch fatálna. Lekári musia byť opatrní, keď zvažujú podávanie filgrastímu pacientom s kosáčikovitou črtou alebo s kosáčikovitou anémiou, a majú sa rozhodnúť až po starostlivom zvážení potenciálnych rizík a výhod.
Pomocnélátky
Nivestim obsahuje sorbitol. Pacienti so zriedkavými dedičnými problémami fruktózovej intolerancie nemajú používať tento liek. Tiež obsahuje menej ako 1 mmol sodíka (23 mg) v dávke, t.j.v podstate „bez sodíka“.
4.5 Liekové a iné interakcie
Bezpečnosť a účinnosť filgrastímu, ktorý sa podáva v rovnaký deň ako myelosupresívna cytotoxická chemoterapia, sa definitívne nestanovila. Filgrastím sa neodporúča podávať v období od 24 hodín pred chemoterapiou až do 24 hodín po chemoterapii vzhľadom na citlivosť rýchlo sa deliacich myeloidných buniek na myelosupresívnu cytotoxickú chemoterapiu. Predbežné dôkazy pozorované u malej skupiny pacientov liečených súbežne filgrastímom a 5-fluórouracilom naznačujú, že závažnosť neutropénie sa môže zhoršiť.
Možné interakcie s inými krvotvornými rastovými faktormi a cytokínmi sa doposiaľ v klinických štúdiách nepreskúmali.
Keďže lítium podporuje uvoľňovanie neutrofilov, pravdepodobne môže zvýšiť účinok filgrastímu. Hoci táto interakcia nebola formálne preskúmaná, neexistuje dôkaz, že takáto interakcia je škodlivá.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití u gravidných žien . Štúdie na zvieratách preukázali reprodukčnú toxicitu. Zvýšený výskyt potratov bol pozorovaný u králikov pri vysokých násobkoch klinickej expozície a v prítomnosti toxicity matky (pozri časť 5.3). Existujú literárne údaje popisujúce transplacentárny prechod filgrastímu u gravidných žien. Filgrastím sa neodporúča počas gravidity.
Laktácia
Nie je známe, či sa filgrastím vylučuje do ľudského mlieka, preto sa neodporúča používať filgrastím u dojčiacich žien. Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu flgrastímom sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Filgrastím neovplyvnil reprodukčnú schopnosť ani fertilitu samcov alebo samíc potkanov (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Filgrastím má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Ak pacient pociťuje únavu, odporúča sa zvýšiť pozornosť pri vedení vozidiel alebo obsluhe strojov.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Počas klinických štúdií sa Nivestim podával 183 pacientom s nádorovým ochorením a 96 zdravým
dobrovoľníkom.
V klinických štúdiách sa profil bezpečnosti filgrastímu zhodol s tým, ktorý bol hlásený pri referenčnom lieku použitom v týchto štúdiách.
V klinických skúšaniach u pacientov s nádorovým ochorením bola najčastejšou nežiaducou reakciou súvisiacou s filgrastímom pri odporúčanom dávkovaní muskuloskeletálna bolesť, ktorá bola mierna alebo stredne silná u 10 % pacientov a silná u 3 % pacientov.
Bola hlásená aj reakcia štepu proti hostiteľovi (Graft versus Host Disease, GvHD) (pozri nižšie). Pri mobilizácii PBPC u normálnych darcov bola najčastejšou hlásenou nežiaducou reakciou
muskuloskeletálna bolesť. U darcov sa pozorovala leukocytóza a po podaní filgrastímu a po
leukaferéze sa u darcov pozorovala aj prechodná trombocytopénia. Boli hlásené aj prípady splenomegálie a ruptúry sleziny. Niektoré prípady ruptúry sleziny boli fatálne.
U pacientov s SCN boli najčastejšími nežiaducimi reakciami spôsobenými filgrastímom bolesť kostí, celková muskuloskeletálna bolesť a splenomegália.
Syndróm kapilárneho presakovania, ktorý môže ohroziť život, ak sa oneskorí liečba, sa zaznamenal menej často (≥ 1/1 000 až < 1/100) po podaní faktorov stimulujúcich kolónie granulocytov u pacientov s rakovinou, ktorí podstupujú chemoterapiu a u normálnych darcov, podstupujúcich mobilizáciu
V klinických štúdiách u pacientov s HIV boli jedinými nežiaducimi reakciami, ktoré sa pripisovali podávaniu filgrastímu, muskuloskeletálna bolesť, bolesť kostí a myalgia. Výskyt týchto prípadov bol podobná ako u pacientov s nádorovým ochorením.
Súhrn nežiaducichreakciízoradenýchdotabuľky.
Na základe publikovaných informácií sa počas liečby filgrastímom vyskytli nasledujúce nežiaduce reakcie
a ich frekvencie.
Zhodnotenie nežiaducich reakcií je založené na nasledujúcich frekvenciách výskytu: Veľmi časté: ≥ 1/10
Časté: ≥ 1/100 až < 1/10
Menej časté: ≥ 1/1 000 až < 1/100
Zriedkavé: ≥ 1/10 000 až < 1/1 000
Veľmi zriedkavé: < 1/10 000
Neznáme: častosť sa nedá sa odhadnúť z dostupných údajov
V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané podľa klesajúcej závažnosti.
U pacientov s nádorovým ochorením
Trieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy metabolizmu a výživy Veľmi časté Zvýšené hodnoty alkalickej fosfatázy, laktátdehydrogenázy (LDH)
a kyseliny močovej
Poruchy nervového systému Časté Bolesť hlavy
Poruchy ciev Menej časté Syndrom zvýšené propustnosti kapilár
Zriedkavé Poruchy ciev, angiopatia
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Časté Kašeľ, bolesť hrdla Veľmi zriedkavé Pľúcne infiltráty Veľmi časté Nevoľnosť/vracanie
Časté Zápcha, anorexia, hnačka, mukozitída
Poruchy pečene a žlčových ciest Veľmi časté Zvýšené hodnoty gama-
glutamyltransferázy (GGT)
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Celkové poruchy a reakcie v mieste podania
Časté Alopécia, vyrážka
Veľmi zriedkavé Sweetov syndróm, kožná vaskulitída
Veľmi časté Bolesť hrude, muskuloskeletálna bolesť
Veľmi zriedkavé Zhoršenie symptómov reumatickej artritídy
Veľmi zriedkavé Abnormality močového systému
Časté Únava, všeobecná slabosť
Menej časté Nešpecifikovaná bolesť
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Veľmi zriedkavé Alergická reakcia
UnormálnychdarcovpodstupujúcichPBPCmobilizáciu
Trieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy krvi a lymfatického
systému
Veľmi časté Leukocytóza, trombocytopénia
Menej časté Porucha sleziny
Poruchy metabolizmu a výživy Časté Zvýšené hodnoty alkalickej fosfatázy a LDH
Menej časté Zvýšené hodnoty SGOT, nadbytok kyseliny močovej v krvi
Poruchy nervového systému Veľmi časté Bolesť hlavy
Poruchy ciev Menej časté Syndrom zvýšené propustnosti kapilár
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Celkové poruchy a reakcie v mieste podania
Veľmi časté Muskuloskeletálna bolesť
Menej časté Reumatická artritída a zhoršenie symptómov artritídy
Menej časté Závažná alergická reakcia
U
pacientov
s
o
závažnou
chronickou
neutropéniou
(SCN)
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy krvi a lymfatického systému
Veľmi časté Anémia, splenomegália Časté Trombocytopénia Menej časté Porucha sleziny
Poruchy metabolizmu a výživy Veľmi časté Znížené hodnoty glukózy v krvi, zvýšené hodnoty alkalickej fosfatázy, LDH, a nadbytok kyseliny močovej v krvi
Poruchy nervového systému Časté Bolesť hlavy
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Veľmi časté Epistaxa
Časté Hnačka
Poruchy pečene a žlčových ciest Časté Hepatomegália



Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté Alopécia, kožná vaskulitída, bolesť v mieste injekcie, výražka
Veľmi časté Muskuloskeletálna bolesť
Časté Osteoporóza
Poruchy obličiek a močových ciest
Menej časté Hematúra, proteinúia
U
pacientov
s
H
I
V
infekciou
T
rieda orgánových systémov Frekvencia Nežiaduca reakcia
Poruchy krvi a lymfatického systému
Poruchy svalovej a kostrovej sústavy a spojivového tkaniva

Časté Poruchy sleziny
Veľmi časté Muskuloskeletálna bolesť
 Popis
vy
braných
nežiaducich
reakcií
Popis
vy
braných
nežiaducich
reakcií
U pacientov, ktorí dostávali G-CSF po alogénnej transplantácii kostnej drene, boli hlásené reakcie
štepu proti hostiteľovi (Graft versus Host Disease, GvHD) a úmrtia (pozri časť 5.1).
Po uvedení faktora stimulujúceho kolónie granulocytov na trh sa zaznamenali prípady syndrómu kapilárneho presakovania. Zvyčajne sa vyskytovali u pacientov s pokročilým nádorovým ochorením, sepsou, u pacientov liečených kombinovanou chemoterapiou alebo podstupujúcich aferézu (pozri časť 4.4).
U pacientov s nádorovým ochorenímMuskuloskeletálna bolesť sa dá zvyčajne zvládnuť štandardnými analgetikami. Menej časté nežiaduce rekcie
zahŕňajú abnormality močového systému prevažne miernu až stredne silnú dyzúriu.
V randomizovaných, placebom kontrolovaných klinických skúšaniach filgrastím nezvýšil výskyt nežiaducich reakcií spojených s cytotoxickou chemoterapiou. Nežiaduce reakcie hlásené s rovnakou frekvenciou u pacientov liečených kombináciou filgrastím/chemoterapia a placebo/chemoterapia zahŕňajú nauzeu a vracanie, alopéciu, hnačku, únavu, anorexiu, mukozitídu, bolesť hlavy, kašeľ, kožnú vyrážku, bolesť v hrudi, celkovú slabosť, bolesť v hrdle, zápchu a nešpecifikovanú bolesť.
U približne 50 %, 35 %, 25 % a 10 % pacientov, jednotlivo u odporúčaných dávok, liečených filgrastímom sa vyskytli reverzibilné, závislé od dávky a zvyčajne mierne alebo stredne závažne zvýšené hodnoty laktátdehydrogenázy, alkalickej fosfatázy, kyseliny močovej a gamma-glutamyltransferázy.
Príležitostne boli hlásené prechodné zníženia krvného tlaku nevyžadujúce si klinickú liečbu.
U pacientov, ktorí dostávali vysoké dávky chemoterapie pred autológnou transplantáciou kostnej drene, boli hlásené cievne poruchy zahrňujúce veno-okluzívne ochorenie a poruchy objemu telesných tekutín. Príčinná súvislosť s liečbou filgrastímom nebola stanovená.
U pacientov liečených filgrastímom boli hlásené veľmi zriedkavé udalosti kožnej vaskulitídy. U pacientov liečených filgrastímom nie je známy mechanizmus vaskulitídy.
Výskyt Sweetovho syndrómu (akútna febrilná neutrofilná dermatóza) bol hlásený príležitostne. Nakoľko však významné percento týchto pacientov malo leukémiu, stav, ktorý je spojený so Sweetovým syndrómom, príčinná súvislosť s liečbou filgrastímom nebola stanovená.
V jednotlivých prípadoch bolo hlásené zhoršenie existujúcej reumatoidnej artritídy.
V niektorých prípadoch boli hlásené zriedkavé pľúcne nežiaduce udalosti, zahŕňajúce intersticiálnu pneumóniu, pľúcny edém a pľúcne infiltráty, vedúce k respiračnému zlyhaniu alebo syndrómu respiračnej tiesne dospelých (ARDS), ktoré môžu byť fatálne (pozri časť 4.4).
Alergické reakcie: U pacientov dostávajúcich filgrastím sa počas počiatočnej alebo následnej liečby vyskytli reakcie alergického typu vrátane anafylaxie, kožnej vyrážky, žihľavky, angioedému (bolestivý opuch tváre alebo hrdla), dyspnoe a nízkeho krvného tlaku. Celkovo boli hlásenia častejšie po intravenóznom podaní. V niektorých prípadoch sa symptómy vyskytli opätovne, takže sa predpokladá príčinný vzťah. Liečba filgrastímom sa musí natrvalo ukončiť u pacientov, u ktorých sa vyskytla závažná alergická reakcia.
U pacientov s bunkami s kosáčikovitou črtou (heterozygotnýmhemoglobínomS) alebo s kosáčikovitou anémiou sa vyskytli ojedinelé prípady kríz kosáčikovitej anémie (pozri časť 4.4). Z údajov z klinických skúšaní je odhadovaná frekvencia výskytu ako „menej časté“.
U pacientov s rakovinou liečených filgrastímom sa zaznamenala pseudodna.
U normálnych darcovpodstupujúcichPBPCmobilizáciu
Leukocytóza (biele krvinky WBC > 50 x 109/l) sa vyskytla u 41 % darcov a prechodná trombocytopénia
(krvné doštičky < 100 x 109/l) po podaní filgrastímu a po leukaferéze sa vyskytla u 35 % darcov
U normálnych darcov, ktorí sa liečia filgrastímom, sa vyskytli prechodné mierne zvýšené hodnoty alkalickej fosfatázy, laktátdehydrogenázy (LDH), SGOT a kyseliny močovej; bez klinickej súslednosti.
Veľmi zriedkavo bolo pozorované zhoršenie symptómov artritídy.
Veľmi zriedkavo boli hlásené príznaky pripomínajúce závažné alergické reakcie.
V štúdiách s PBPC darcami boli hlásené bolesti hlavy, pravdepodobne spôsobené podaním filgrastímu. U normálnych darcov a pacientov boli po podaní G-SCF hlásené bežné, ale obvykle asymptomatické
prípady splenomegálie a veľmi zriedkavo prípady ruptúry sleziny (pozri časť 4.4 ).
U normálnych darcov boli, po uvedení iných liekov obsahujúcich filgrastím na trh, veľmi zriedkavo hlásené pľúcne nežiaduce udalosti (hemoptýza, krvácanie do pľúc, pľúcne infiltráty, dyspnoe a hypoxia) (pozri časť
4.4).
U pacientov so závažnouchronickouneutropéniou(SCN)
U pacientov s SCN liečených filgrastímom boli hlásené nežiaduce reakcie a u niektorých pacientov sa ich
výskyt časom znižoval.
Medzi nežiaduce reakcie patria splenomegália, ktorá môže mať u malého počtu pacientov progresívny charakter a trombocytopénia. Krátko po začiatku liečby filgrastímom sa u menej ako 10 % pacientov vyskytli bolesť hlavy a hnačka. Tiež boli hlásené anémia a krvácanie z nosa.
Pozorovalo sa prechodné zvýšenie hladiny sériovej kyseliny močovej, laktátdehydrogenázy a alkalickej fosfatázy bez klinických prejavov, ako aj prechodný mierny pokles hladiny glukózy v krvi po požití potravy.
U < 2 % pacientov s SCN sa vyskytli nežiaduce reakcie pravdepodobne spojené s liečbou filgrastímom, a to bolesť v mieste podania, bolesť hlavy, hepatomegália, bolesť kĺbov, alopécia, osteoporóza a vyrážka.
U 2 % pacientov s SCN sa pri dlhodobej liečbe vyskytla kožná vaskulitída. V ojedinelých prípadoch sa vyskytla proteinúria alebo hematúria.
UpacientovsHIVinfekciou
U menej ako 3 % pacientov liečených filgrastímom sa pozorovala splenomegália. Vo všetkých prípadoch bola splenomegália mierna alebo stredne závažná a zistila sa palpačným vyšetrením. Klinický nález bol benígny; žiadny pacient nemal diagnózu hypersplenizmu a žiadny pacient nepodstúpil splenektómiu. Hoci je splenomegália bežným nálezom u pacientov s infekciou HIV a vyskytuje sa v rôznych stupňoch závažnosti u väčšiny pacientov s AIDS, súvislosť s liečbou filgrastímom nie je jasná.
Pediatrická populáciaÚdaje z klinických štúdií u pediatrických pacientov poukazujú na to, že bezpečnosť a účinnosť
filgrastímu u dospelých a u detí liečených cytotoxickou chemoterapiou sú podobné, čo naznačuje, že neexistujú žiadne rozdiely vo farmakokinetických vlastnostiach filgrastímu súvisiace s vekom. Jediným konzistentne hláseným nežiaducim účinkom bola muskuloskeletálna bolesť‚ čo sa zhoduje so skúsenosťami u dospelej populácie.
Na ďalšie vyhodnotenie používania filgrastímu u pediatrických pacientov nie sú k dispozícii dostatočné informácie.
Ďalšie osobitné populácieGeriatricképoužitieMedzi pacientmi vo veku nad 65 rokov sa nepozorovali žiadne celkové rozdiely v bezpečnosti ani účinnosti v porovnaní s mladšími dospelými (vo veku > 18 rokov) pacientmi dostávajúcimi cytotoxickú chemoterapiu a klinické skúsenosti neodhalili žiadne rozdiely v odpovediach medzi staršími a mladšími dospelými pacientmi. Nie sú k dispozícii dostatočné údaje na vyhodnotenie používania filgrastímu u geriatrických pacientov pre ostatné schválené indikácie filgrastímu.
PediatrickípacientisSCNU pediatrických pacientov s ťažkou chronickou neutropéniou dostávajúcich chronickú liečbu filgrastímom boli hlásené prípady zníženej hustoty kostného tkaniva a osteoporózy. Frekvencia je odhadovaná z údajov získaných počas klinického skúšania ako „častá“.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v Prílohe V.
4.9 PredávkovanieÚčinky predávkovania filgrastímom neboli stanovené.
Prerušenie liečby filgrastímom zvyčajne vedie k 50 % zníženiu počtu neutrofilov v priebehu 1 až 2 dní s návratom počtu neutrofilov na normálne hodnoty v priebehu 1 až 7 dní.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Imunostimulanciá, faktory stimulujúce kolónie, ATC kód: L03AA02
Nivestim je biologicky podobný liek. Podrobné informácie sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.Ľudský G-CSF je glykoproteín, ktorý reguluje tvorbu a uvoľňovanie funkčných neutrofilov z kostnej drene. Filgrastím obsahujúci r-metHuG-CSF (filgrastím) spôsobuje výrazné zvýšenie počtu neutrofilov v periférnej krvi do 24 hodín s malým vzostupom počtu monocytov. U niektorých pacientov s SCN môže filgrastím
indukovať aj mierne zvýšenie počtu cirkulujúcich eozinofilov a bazofilov oproti východiskovej hodnote; niektorí z týchto pacientov môžu mať eozinofíliu alebo bazofíliu už pred liečbou. Pri dodržaní odporúčaných dávok závisí zvýšenie počtu neutrofilov od veľkosti dávky. Neutrofily vytvorené ako odpoveď na liečbu filgrastímom vykazujú normálnu alebo zlepšenú funkciu, čo preukázali testy chemotaktickej a fagocytárnej aktivity. Po ukončení liečby filgrastímom klesá počet cirkulujúcich neutrofilov o 50 % v priebehu 1 až 2 dní
a normálne hodnoty sa dosiahnu v priebehu 1 až 7 dní.
Použitie filgrastímu u pacientov podstupujúcich cytotoxickú chemoterapiu vedie k významnému zníženiu výskytu, závažnosti a skráteniu trvania neutropénie a febrilnej neutropénie. Liečba filgrastímom významne skracuje trvanie febrilnej neutropénie, antibiotickej liečby a hospitalizácie po indukovanej chemoterapii pri akútnej myelogénnej leukémii alebo po myeloablatívnej liečbe pred transplantáciou kostnej drene. Výskyt horúčky a zaznamenaných infekcií nebol znížený v žiadnom z prípadov. U pacientov podstupujúcich myeloablatívnu terapiu pred transplantáciou kostnej drene nebolo trvanie horúčky kratšie.
Použitie filgrastímu, či už samotného alebo po chemoterapii, vedie k mobilizácii hematopoetických progenitorových buniek v periférnej krvi. Tieto autológne PBPC je možné odobrať a podať vo forme transfúzie po cytotoxickej terapii s vysokými dávkami, či už namiesto transplantácie kostnej drene alebo ako doplnok k nej. Infúzne podanie PBPC urýchľuje obnovu krvotvorby pri súčasnom znížení rizika hemoragických komplikácií a potreby transfúzií trombocytov.
U príjemcov alogénnych PBPC mobilizovaných filgrastímom došlo výrazne rýchlejšie k obnove hematologických parametrov, čo viedlo k významnému skráteniu času do obnovy počtu trombocytov bez podpornej liečby v porovnaní s alogénnou transplantáciou kostnej drene.
Jedna retrospektívna európska štúdia hodnotiaca použitie G-CSF po alogénnej transplantácii kostnej drene u pacientov s akútnou leukémiou naznačila zvýšené riziko GvHD, mortality spojenej s liečbou (TRM) a mortality v prípade podania G-CSF. V inej retrospektívnej medzinárodnej štúdii u pacientov s akútnou a chronickou myelogénnou leukémiou sa nezistil žiadny vplyv na riziko GvHD, TRM a mortality. Metaanalýzou štúdií s alogénnou transplantáciou vrátane výsledkov z deviatich perspektívnych randomizovaných skúšaní, ôsmych retrospektívnych štúdií a jednej štúdie s kontrolovanými prípadmi sa nezistil vplyv na riziko akútnej GvHD, chronickej GvHD ani mortality spojenej so skorou liečbou.
Relatívne riziko (95 % IS) GvHD a TRM
po liečbe s G-CSF po transplantácii kostnej drene
P
ublikácia Obdobie trvania štúdie
N Akútny II. – IV. stupeň GvHD
C
hronická
G
vHD
TRM
Metaanalýza (2003) Európska
retrospektívna štúdia
(2004)
Medzinárodná retrospektívna štúdia (2006)
1986 – 2001a 1198 1,08
(0,87; 1.33)
1992 – 2002b 1789 1,33
(1,08; 1,64)
1995 – 2000b 2110 1,11
(0,86; 1,42)
1,02
(0,82; 1,26)
1,29
(1,02; 1,61)
1,10
(0,86; 1,39)
0,70
(0,38; 1,31)
1,73
(1,30; 2,32)
1,26
(0,95; 1,67)

aAnalýza zahŕňa štúdie s pacientmi po transplantácii kostnej drene počas tohto obdobia; niektoré štúdie použili GM-CSF
bAnalýza zahŕňa pacientov, ktorí podstupujú transplantáciu kostnej drene počas tohto obdobia
Pred alogénnou transplantáciou PBPC sa použitie filgrastímu na mobilizáciu PBPC u normálnych darcov
umožňuje odber 4 x 106 CD34+ buniek/kg telesnej hmotnosti príjemcu, a to u väčšiny darcov po dvoch leukaferézach. Normálnym darcom sa podáva dávka 10 μg/kg/deň, podaná subkutánne v priebehu 4 až 5 po sebe nasledujúcich dňoch.
Použitie filgrastímu u detí alebo dospelých s SCN (závažná kongenitálna, cyklická a idiopatická neutropénia) spôsobuje pretrvávajúci nárast ACN v periférnej krvi a redukuje výskyt infekcií a s nimi súvisiacich príhod.
Použitie filgrastímu u pacientov s infekciou HIV vedie k udržaniu normálneho počtu neutrofilov, čo umožňuje plánované dávkovanie antivírusových a/alebo iných myelosupresívnych liekov. U pacientov s infekciou HIV liečených filgrastímom nebolo dokázané žiadne zvýšenie replikácie HIV.
Tak ako iné hematopoetické rastové faktory, G-CSF vykazuje in vitro stimulačné vlastnosti na ľudské endotelové bunky.
Bezpečnosť a účinnosť Nivestimu bola stanovená v randomizovanej, kontrolovanej štúdii III. fázy u pacientov s karcinómom prsníka. S ohľadom na trvanie závažnej neutropénie a výskyt febrilnej neutropénie neboli zistené rozdiely medzi Nivestimom a referenčným liekom.
5.2 Farmakokinetické vlastnosti
Randomizovaná, otvorená, jednodávková, komparátorom kontrolovaná, dvojito - prekrížená štúdia vykonaná u 46 zdravých dobrovoľníkov preukázali, že farmakokinetický profil Nivestimu bol porovnateľný s profilom referenčného lieku po subkutánnom a intravenóznom podaní. Ďalšia randomizovaná, dvojito zaslepená, viacdávková, komparátorom kontrolovaná, dvojito - prekrížená štúdia vykonaná u 50 zdravých dobrovoľníkov preukázali, že farmakokinetický profil Nivestimu bol porovnateľný s profilom referenčného lieku po subkutánnom podaní.
Klírens filgrastímu po subkutánnom a po intravenóznom podaní sa dá charakterizovať farmakokinetikou
1.rádu. Priemerný polčas eliminácie filgrastímu zo séra je približne 3,5 hod s hodnotou klírens približne
0,6 ml/min/kg. Kontinuálna infúzia filgrastímu pacientom, ktorí sa zotavili po autológnej transplantácii kostnej drene, trvajúca až do 28 dní neviedla k akumulácii lieku a polčas eliminácie mal porovnateľné hodnoty. Koncentrácia filgrastímu v sére je priamo úmerná dávke, či už podaného intravenózne alebo subkutánne. Po subkutánnom podaní lieku v odporúčaných dávkach sa v sére koncentrácie udržovali nad
10 µg/ml počas 8 až 16 hodín. Distribučný objem v krvi je približne 150 ml/kg
5.3 Predklinické údaje o bezpečnosti
Filgrastím sa skúmal v štúdiách toxicity po opakovanom podávaní počas 1 roka, ktoré odhalili zmeny, ktoré možno pripísať očakávaným farmakologickým účinkom, vrátane zvýšenia leukocytov, myeloidnej hyperplázie kostnej drene, extramedulárnej granulopoézy a zväčšenia sleziny. Všetky tieto zmeny ustúpili po prerušení liečby.
Účinky filgrastímu na prenatálny vývoj sa skúmali u potkanov a králikov. Intravenózne (80 µg/kg/deň) podávanie filgrastímu králikom počas organogenézy bolo toxické pre matku a pozorovala sa zvýšená frekvencia spontánnych potratov, postimplantačných strát a znížená priemerná veľkosť vrhu a hmotnosť plodu.
Na základe hlásených údajov od iných liekov obsahujúcich filgrastím sa pozorovali porovnateľné nálezy plus zvýšené malformácie plodu pri dávke 100 µg/kg/deň, čo je pre matku toxická dávka, ktorá zodpovedá systémovej expozícii približne 50-90-násobku expozícií pozorovaných u pacientov liečených klinickou dávkou 5 µg/kg/deň. Hladina bez pozorovaného nežiaduceho účinku embryo-fetálnej toxicity bola v tejto štúdii 10 µg/kg/deň, čo zodpovedá systémovej expozícii približne 3-5-násobku expozícií pozorovaných u pacientov liečených klinickou dávkou.
U gravidných potkanov sa nepozorovala maternálna ani fetálna toxicita pri dávkach až 575 µg/kg/deň. Potomkovia potkanov, ktorým bol podávaný filgrastím počas perinatálneho obdobia a laktácie, vykazovali oneskorenie vo vonkajšej diferenciácii a spomalenie rastu (≥ 20 µg/kg/deň) a mierne zníženú mieru prežívania (100 µg/kg/deň).
Filgrastím nemá žiadny pozorovaný vplyv na fertilitu samcov alebo samíc potkanov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Ľadová kyselina octová Hydroxid sodný Sorbitol (E420) Polysorbát 80
Voda na injekciu
6.2 Inkompatibility
Nivestim sa nesmie riediť s roztokmi chloridu sodného.
Zriedený filgrastím sa môže adsorbovať na sklenené alebo plastové materiály pokiaľ nie je zriedený v infúznom roztoku glukózy 50 mg/ml (5 %) (pozri časť 6.6).
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Naplnenáinjekčnástriekačka
30 mesiacov
Pozriedení: Chemická a fyzikálna stabilita pri používaní zriedeného roztoku na infúziu bola dokázaná počas
24 hodín pri teplote 2 °C až 8 °C. Z mikrobiologického hľadiska sa má liek použiť ihneď. Ak sa nepoužije hneď, za čas a podmienky uchovávania pred použitím je zodpovedný používateľ a obvykle by sa nemalo presiahnuť 24 hodín pri teplote 2 °C až 8 °C, pokiaľ zriedenie neprebehlo za kontrolovaných a schválených aseptických podmienok.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte a prepravujte v chlade (2 °C – 8 °C).
Neuchovávajte v mrazničke. Uchovávajte naplnenú injekčnú striekačku v vonkajšom obale na ochranu pred svetlom.
Náhodné vystavenie teplotám pod bodom mrazu do 24 hodín neovplyvní stabilitu Nivestimu.
Zmrazená injekčná liekovka môže byť rozmrazená a následne znovu schladená na ďalšie použitie. Ak je vystavenie dlhšie ako 24 hodín alebo došlo k zmrazeniu viac ako jedenkrát, Nivestim sa nemá použiť.
V rámci času použiteľnosti a na účely ambulantného použitia, môže pacient vybrať liek z chladničky
a uskladniť do pri izbovej teplote (neprevyšujúcej 25 °C) pre jednorazové použitie do 7 dní. Po tomto čase sa liek nemá uskladniť späť do chladničky, ale má sa zlikvidovať.
Podmienky na uchovávanie po riedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Naplnená injekčná striekačka (sklo typu I) s injekčnou ihlou (z nehrdzavejúcej ocele), s ochranným krytom ihly, obsahujúca 0,5 ml injekčného a infúzneho roztoku.
Veľkosti balenia 1, 5, 8 alebo 10 naplnených injekčných striekačiek. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Ak je to potrebné, Nivestim sa môže riediť v infúznom roztoku glukózy 50 mg/ml (5 %).
Riedenie na konečnú koncentráciu < 0,2 MU (2 mikrogramy)/ml sa v žiadnom prípade neodporúča. Pred použitím sa má roztok vizuálne skontrolovať. Majú sa použiť len číre roztoky bez častíc.
U pacientov liečených filgrastímom zriedeným na koncentrácie menej ako 1,5 MU (15 mikrogramov)/ml sa má ku konečnej koncentrácii 2 mg/ml pridať ľudský sérový albumín (HSA).
Príklad: V konečnom objeme 20 ml sa má k celkovej dávke filgrastímu nižšej ako 30 MU (300 mikrogramov) pridať 0,2 ml roztoku 20 %ľudského sérového albumínu.
Po zriedení v infúznom roztoku glukózy s koncentráciou 50 mg/ml (5 %) je filgrastím kompatibilný so sklom a rôznymi plastmi vrátane polyvinylchloridu (PVC), polyolefínu (kopolymér polypropylénu a polyetylénu) a polypropylénu.
Nivestim neobsahuje žiadne konzervačné látky: Z hľadiska na možného rizika mikrobiologickej kontaminácie sú injekčné striekačky Nivestimu určené len na jednorazové použitie. Nepoužitý liek alebo odpad vzniknutý z lieku má byť zlikvidovaný v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIHospira UK Limited
Horizon Honey Lane Hurley Maidenhead SL6 6RJ
Veľká Británia
Tel: + 44 (0) 1628 515500
Fax: + 44 (0) 1628 829827
8. REGISTRAČNÁ ČÍSLAEU/1/10/631/007
EU/1/10/631/008
EU/1/10/631/009
EU/1/10/631/012
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 08. júna 2010
Dátum posledného predĺženia registrácie: 27. máj 2015
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
http://www.ema.europa.eu/.