
br />
66
|
100 % (94,6; 100)
|
523 (382; 717)
|
Pred posilňo- vacou
dávkou
|
131
|
65,6 % (56,9; 73,7)
|
27,4 (20,6; 36,6)
|
78
|
96,2 % (89,2; 99,2)
|
151 (109; 210)
|
Po posilňo- vacej dávke(1)
|
139
|
99,3 % (96,1; 100)
|
2 525
(2 102; 3 033)
|
92
|
100 % (96,1; 100)
|
13 360
(10 953; 16 296)
|
W
|
Po dávke
1(1)
|
163
|
93,9 % (89; 97)
|
1 256 (917; 1 720)
|
47
|
87,2 % (74,3; 95,2)
|
137 (78,4; 238)
|
Pred posilňo- vacou dávkou
|
131
|
77,9 % (69,8; 84,6)
|
63,3 (45,6; 87,9)
|
53
|
100 % (93,3; 100)
|
429 (328; 559)
|
Po posilňo- vacej dávke(1)
|
139
|
100 % (97,4; 100)
|
3 145
(2 637; 3 750)
|
59
|
100 % (93,9; 100)
|
9 016
(7 045; 11 537)
|
Y
|
Po dávke
1(1)
|
163
|
98,8 % (95,6; 99,9)
|
1 470
(1 187; 1 821)
|
52
|
92,3 % (81,5; 97,9)
|
195 (118; 323)
|
Pred posilňo- vacou dávkou
|
131
|
88,5 % (81,8; 93,4)
|
106 (76,4; 148)
|
61
|
98,4 % (91,2; 100)
|
389 (292; 518)
|
Po posilňo- vacej dávke(1)
|
139
|
100 % (97,4; 100)
|
2 749
(2 301; 3 283)
|
69
|
100 % (94,8; 100)
|
5 978
(4 747; 7 528)
|
Analýza imunogenity sa uskutočnila na primárnej kohorte ATP
*rSBA analýza vykonaná v laboratóriách PHE (PHE; Public Health England) v UK
**hSBA analýza vykonaná v laboratóriách Neomed v Kanade
(1) vzorky krvi sa odobrali 1 mesiac po očkovaní
Meranie hSBA titrov bolo sekundárnym cieľovým ukazovateľom v klinickej štúdii MenACWY-TT-
087. Aj keď boli pozorované podobné odpovede na skupiny A a C pri oboch dávkovacích schémach, jedna primárna dávka u dojčiat vo veku 6 mesiacov bola spojená s nižšími hSBA titrami
proti skupinám W-135 a Y meranými percentuálnym zastúpením jedincov s titrami pri hSBA ≥ 8
[87,2 % (95 % IS: 74,3; 95,2) a 92,3 % (95 % IS: 81,5; 97,9)] v uvedenom poradí, v porovnaní s troma primárnymi dávkami vo veku 2, 4 a 6 mesiacov [100 % (95 % IS: 96,6; 100) a 100 % (95 % IS: 97,1;
100)] v uvedenom poradí (pozri časť 4.4). Po posilňovacej dávke boli titre pri hSBA u všetkých
štyroch meningokokových skupín porovnateľné pre obe dávkovacie schémy. Výsledky sú uvedené v tabuľke 3.
Imunogenita u batoliat vo veku 12 až 23 mesiacov
V klinických štúdiách MenACWY-TT-039 a MenACWY-TT-040 jedna dávka Nimenrixu vyvolala
SBA titre proti štyrom skupinám meningokokov, pričom rSBA titre proti skupine C boli
v percentuálnom vyjadrení jedincov s titrami rSBA ≥ 8 porovnateľné s titrami vyvolanými
registrovanou očkovacou látkou MenC-CRM. V klinickej štúdii MenACWY-TT-039 sa ako sekundárny cieľový ukazovateľ meralo aj hSBA. Výsledky sú uvedené v tabuľke 4.
Tabuľka 4: SBA* titre po jednorazovej dávke Nimenrixu (alebo MenC-CRM) u batoliat vo veku12 – 23 mesiacov (klinické štúdie MenACWY-TT-039/040)
Menin- gokoková skupina
|
Skupina s očkova- cou látkou
|
Štúdia MenACWY-TT-039(1)
| Štúdia
MenACWY-TT-040(2)
|
rSBA*
| hSBA*
| rSBA*
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
N
| ≥ 8 (95 % IS)
| GMT (95 % IS)
|
N
| ≥ 8 (95 % IS)
|
GMT (95 % IS)
|
A
|
Nimenrix
|
354
|
99,7 % (98,4; 100)
| 2 205 (2 008;
2 422)
|
338
| 77,2 % (72,4;
81.6)
| 19,0 (16,4;
22,1)
|
183
| 98,4 % (95,3;
99,7)
| 3 170 (2 577;
3 899)
|
C
|
Nimenrix
|
354
|
99,7 % (98,4; 100)
|
478 (437; 522)
|
341
| 98,5 % (96,6;
99,5)
| 196 (175;
219)
|
183
| 97,3 % (93,7;
99,1)
|
829 (672; 1 021)
|
Očkovacia látka MenC-CR M
|
121
|
97,5 % (92,9;
99,5)
|
212 (170; 265)
|
116
|
81,9 % (73,7;
88,4)
|
40,3 (29,5;
55,1)
|
114
|
98,2 % (93,8;
99,8)
|
691 (521; 918)
|
W-135
|
Nimenrix
|
354
|
100 % (99,0; 100)
| 2 682 (2 453;
2 932)
|
336
| 87,5 % (83,5;
90,8)
| 48,9 (41,2;
58,0)
|
186
| 98,4 % (95,4;
99,7)
| 4 022 (3 269;
4 949)
|
Y
|
Nimenrix
|
354
|
100 % (99,0; 100)
| 2 729 (2 473;
3 013)
|
329
| 79,3 % (74,5;
83,6)
| 30.9 (25,8;
37,1)
|
185
| 97,3 % (93,8;
99,1)
| 3 168 (2 522;
3 979)
|
Analýza imunogenity sa uskutočnila v ATP kohortách.
(1) vzorky krvi sa odobrali 42 až 56 dní po očkovaní
(2) vzorky krvi sa odobrali 30 až 42 dní po očkovaní
* SBA analýzy sa vykonávali v laboratóriách GSK
V klinickej štúdii Men ACWY-TT-104 Nimenrix vyvolal rSBA titre proti všetkým štyrom meningokokovým skupinám po jednej alebo dvoch dávkach podávaných s 2-mesačným odstupom, ktoré boli podobné v percentuálnom vyjadrení jedincov s titrom rSBA ≥ 8 a GMT ako je uvedené
v tabuľke 5.
Tabuľka 5: titre rSBA a hSBA po jednej alebo dvoch dávkach Nimenrixu s prvou dávkou podávanou batoľatám vo veku 12 – 14 mesiacov (klinická štúdia MenACWY-TT-
Meningok oková skupina
| Skupina s dávkou očkovacej látky
Nimenrix
|
Časový bod(1)
| rSBA*
| hSBA**
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
A
|
1 dávka
|
Po dávke 1
|
180
|
97,8 % (94,4; 99,4)
|
1 437
(1 118;1 847)
|
74
|
95,9 % (88,6, 99,2)
|
118 (86,8; 161)
|
2 dávky
|
Po dávke 1
|
158
|
96,8 % (92,8; 99,0)
|
1 275 (970; 1 675)
|
66
|
97,0 % (89,5; 99,6)
|
133 (98; 180)
|
Po dávke 2
|
150
| 98,0 % (94,3; 99,6)
| 1 176 (922; 1 501)
|
66
| 97,0 % (89,5; 99,6)
| 170 (126; 230)
|
C
|
1 dávka
|
Po dávke 1
|
179
|
95,0 % (90,7; 97,7)
|
452 (345,6; 591,9)
|
78
|
98,7 % (93,1; 100)
|
152 (105; 220)
|
2 dávky
|
Po dávke 1
|
157
|
95,5 % (91,0; 98,2)
|
369,3 (281; 485)
|
70
|
95,7 % (88,0; 99,1)
|
161 (110; 236)
|
|
|
104)
Meningok
oková skupina
|
Skupina s dávkou očkovacej látky Nimenrix
|
Časový bod
(1)
|
rSBA*
|
hSBA**
|
N
|
≥ 8
(9
5 % IS)
|
G
M
T (95 % IS)
|
N
|
≥ 8
(9
5 % IS)
|
G
M
T (95 % IS)
|
Po dávke 2
|
150
|
98,7 % (95,3; 99,8)
|
639 (522; 783)
|
69
|
100 % (94,8; 100)
|
1 753 (1 278;
2 404)
|
W-135
|
1 dávka
|
Po dávke 1
|
180
|
95,0 % (90,8; 97,7)
|
2 120
(1 601; 2 808)
|
72
|
62,5 % (50,3; 73,6)
|
27,5 (16,1; 46,8)
|
2 dávky
|
Po dávke 1
|
158
|
94,9 % (90,3; 97,8)
|
2 030
(1 511; 2 728)
|
61
|
68,9 % (55,7; 80,1)
|
26,2 (16,0; 43,0)
|
Po dávke 2
|
150
|
100 % (97,6; 100)
|
3 533
(2 914; 4 283)
|
70
|
97,1 % (90,1; 99,7)
|
757 (550; 1 041)
|
Y
|
1 dávka
|
Po dávke 1
|
180
|
92,8 % (88,0; 96,1)
|
952 (705; 1 285)
|
71
|
67,6 % (55,5; 78,2)
|
41,2 (23,7; 71,5)
|
2 dávky
|
Po dávke 1
|
157
|
93,6 % (88,6; 96,9)
|
933 (692; 1 258)
|
56
|
64,3 % (50,4; 76,6)
|
31,9 (17,6; 57,9)
|
Po dávke 2
|
150
|
99,3 % (96,3; 100)
|
1 134 (944; 1 360)
|
64
|
95,3 % (86,9; 99,0)
|
513 (339; 775)
|
Analýza imunogenity sa uskutočnila v ATP kohorte.
(1) vzorky krvi sa odobrali 21 až 48 dní po očkovaní
*rSBA analýza vykonaná v laboratóriách PHE
**hSBA analýza vykonaná v laboratóriách GSK
V klinickej štúdii MenACWY-TT-104 sa merali hSBA titre ako sekundárny cieľový ukazovateľ. Nimenrixom vyvolané hSBA titre proti skupinám W-135 a Y boli vyššie v percentuálnom vyjadrení jedincov s titrom hSBA ≥ 8, keď boli podané dve dávky v porovnaní s jednou dávkou (pozri časť 4.4). Nimenrix vyvolával hSBA titre proti skupinám A a C, ktoré boli podobné v percentuálnom vyjadrení jedincov s titrom hSBA ≥ 8, keď sa podávali dve dávky, v porovnaní s jednou. Výsledky sú uvedené
v tabuľke 5.
rSBA a hSBA titre sa stanovovali v období 10 rokov u detí, ktoré na začiatku podstúpili očkovanie s jednou dávkou Nimenrixu alebo MenC-CRM vo veku 12 až 23 mesiacov v klinickej štúdii MenACWY-TT-027. Pretrvávanie SBA titrov sa vyhodnocovalo v dvoch predĺžených klinických štúdiách: MenACWY-TT-032 (do 5 rokov) a MenACWY-TT-100 (do 10 rokov). V klinickej štúdii MenACWY-TT-100 sa vyhodnocovala aj odpoveď na jedinú posilňovaciu dávku Nimenrixu podávanú 10 rokov po prvom očkovaní s Nimenrixom alebo MenC-CRM. Výsledky sú uvedené
v tabuľke 6 (pozri časť 4.4).
Tabuľka 6: rSBA a hSBA titre po jednorazovej dávke Nimenrixu (alebo MenC-CRM) u batoliat vo veku 12 – 23 mesiacov, pretrvávanie až do 10 rokov a po podaní posilňovacej dávky 10 rokov po prvom očkovaní (klinické štúdie MenACWY-TT-027/032/100)Menin- goko- ková
skupi- na
|
Skupina
s očkovacou látkou
|
Časový bod
| rSBA*
| hSBA**
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
A
|
Nimenrix
|
Mesiac 1(1)
|
222
| 100 % (98,4; 100)
| 3 707
(3 327; 4 129)
|
217
| 91,2 % (86,7; 94,6)
| 59,0 (49,3; 70,6)
|
(2)
|
45
| 64,4 % (48,8; 78,1)
| 35,1 (19,4; 63,4)
|
44
| 52,3 % (36,7; 67,5)
| 8,8 (5,4; 14,2)
|
Rok 5(2)
|
49
| 73,5 % (58,9; 85,1)
| 37,4 (22,1; 63,2)
|
45
| 35,6 % (21,9; 51,2)
| 5,2 (3,4; 7,8)
| Rok 10(3)
| 62
| 66,1 %
| 28,9
| 59
| 25,4 %
| 4,2
|
|
|
Rok 4
Meni
n- goko- ková skupi- na
|
S
kupina
s očkovacou látkou
|
Časov
ý bod
|
rSBA*
|
hSBA**
|
N
|
≥ 8
(9
5 % IS)
|
G
M
T (95 % IS)
|
N
|
≥ 8
(9
5 % IS)
|
G
M
T (95 % IS)
|
(pred posil.)
|
|
(53,0; 77,7)
|
(16,4; 51,0)
|
|
(15,0; 38,4)
|
(3,0; 5,9)
|
(po posil.)(3,4)
|
62
|
98,4 % (91,3; 100)
|
5 122
(3 726; 7 043)
|
62
|
100 % (94,2; 100)
|
1 534
(1 112; 2 117)
|
C
|
Nimenrix
|
Mesiac 1(1)
|
220
|
100 % (98,3; 100)
|
879 (779; 991)
|
221
|
99,1 % (96,8; 99,9)
|
190,0 (165; 219)
|
Rok 4(2)
|
45
|
97,8 % (88,2; 99,9)
|
110 (62,7; 192)
|
45
|
97,8 % (88,2; 99,9)
|
370 (214; 640)
|
Rok 5 (2)
|
49
|
77,6 % (63,4; 88,2)
|
48,9 (28,5; 84,0)
|
48
|
91,7 % (80,0; 97,7)
|
216 (124; 379)
|
Rok 10 (3)
(pred posil.)
|
62
|
82,3 % (70,5; 90,8)
|
128 (71,1; 231)
|
60
|
91,7 % (81,6; 97,2)
|
349 (197; 619)
|
(po posil.)(3,4)
|
62
|
100 % (94,2; 100)
|
7 164
(5 478; 9 368)
|
59
|
100 % (93,9; 100)
|
33 960 (23 890;
48 274)
|
Očkovacia
látk
a MenC- CRM
|
Mesiac 1(1)
|
68
|
98,5 % (92,1; 100)
|
415 (297; 580)
|
68
|
72,1 % (59,9; 82,3)
|
21,2 (13,9; 32,3)
|
Rok 4 (2)
|
10
|
80,0 % (44,4; 97,5)
|
137 (22,6; 832)
|
10
|
70,0 % (34,8; 93,3)
|
91,9 (9,8; 859)
|
Rok 5 (2)
|
11
|
63,6 % (30,8; 89,1)
|
26,5 (6,5; 107)
|
11
|
90,9 % (58,7; 99,8)
|
109 (21,2; 557)
|
Rok 10 (3)
(pred posil.)
|
16
|
87,5 % (61,7; 98,4)
|
86,7 (29,0; 259)
|
15
|
93,3 % (68,1; 99,8)
|
117 (40,0; 344)
|
(po posil.)(3,4)
|
16
|
100 % (79,4; 100)
|
5 793
(3 631; 9 242)
|
15
|
100 % (78,2; 100)
|
42 559 (20 106;
90 086)
|
W-135
|
Nimenrix
|
Mesiac 1(1)
|
222
|
100 % (98,4; 100)
|
5 395
(4 870; 5 976)
|
177
|
79,7 % (73,0; 85,3)
|
38,8 (29,7; 50,6)
|
Rok 4 (2)
|
45
|
60,0 % (44,3; 74,3)
|
50,8 (24,0; 108)
|
45
|
84,4 % (70,5; 93,5)
|
76,9 (44,0; 134)
|
Rok 5 (2)
|
49
|
34,7 % (21,7; 49,6)
|
18,2 (9,3; 35,3)
|
46
|
82,6 % (68,6; 92,2)
|
59,7 (35,1; 101)
|
Rok 10 (3)
(pred posil.)
|
62
|
30,6 % (19,6; 43,7)
|
15,8 (9,1; 27,6)
|
52
|
44,2 % (30,5; 58,7)
|
7,7 (4,9; 12,2)
|
(po posil.)(3,4)
|
62
|
100 % (94,2; 100)
|
25 911
(19 120; 35 115)
|
62
|
100 % (94,2; 100)
|
11 925
(8 716; 16 316)
|
Y
|
Nimenrix
|
Mesiac 1 (1)
|
222
|
100 %
(98,4; 100)
|
2 824
(2 529; 3 153)
|
201
|
66,7 %
(59,7; 73,1)
|
24,4
(18,6; 32,1)
|
Rok 4 (2)
|
45
|
62,2 % (46,5; 76,2)
|
44,9 (22,6; 89,3)
|
41
|
87,8 % (73,8; 95,9)
|
74,6 (44,5; 125)
|
Rok 5 (2)
|
49
|
42,9 % (28,8; 57,8)
|
20,6 (10,9; 39,2)
|
45
|
80,0 % (65,4; 90,4)
|
70,6 (38,7; 129)
|
Rok 10 (3)
(pred posil.)
|
62
|
45,2 % (32,5; 58,3)
|
27,4 (14,7; 51,0)
|
56
|
42,9 % (29,7; 56,8)
|
9,1 (5,5; 15,1)
|
(po posil.)(3,4)
|
62
|
98,4 % (91,3; 100)
|
7 661
(5 263; 11 150)
|
61
|
100 % (94,1; 100)
|
12 154
(9 661; 15 291)
|
Analýza imunogenity sa uskutočňovala na ATP kohortách počas 1 mesiaca až 5 rokov po očkovaní
a v posilňovacej ATP kohorte. Jedinci so suboptimálnou odpoveďou na meningokokovú skupinu C (definovaná ako SBA titer pod vopred definovanou hraničnou hodnotou testu) mali dostať ďalšiu dávku MenC očkovacej látky pred 6. rokom. Títo jedinci boli vylúčení z analýzy v 4. roku a 5. roku, ale boli zahrnutí do analýzy
v 10. roku.
(1) Klinická štúdia MenACWY-TT-027 (2) Klinická štúdia MenACWY-TT-032 (3) Klinická štúdia MenACWY-TT-100
(4) vzorky krvi sa odoberali 1 mesiac po posilňovacej dávke v 10. roku.
* rSBA analýza vykonaná v laboratóriách GSK na vzorkách odobraných 1 mesiac po primárnom očkovaní a v laboratóriách PHE v UK pre nasledujúce časové body, v ktorých sa odoberali vzorky.
** hSBA analýza vykonaná v laboratóriách GSK a Neomed v Kanade pre časové body MenACWY-TT-100.
Pretrvávanie odpovede po posilňovacej dávkeKlinická štúdia MenACWY-TT-102 vyhodnocovala pretrvávanie SBA titrov až do 6 rokov
po posilňovacej dávke Nimenrixu alebo MenC-CRM197 podávaných deťom, ktoré na začiatku dostali rovnakú očkovaciu látku vo veku 12 až 23 mesiacov v klinickej štúdii MenACWY-TT-039. Jedna posilňovacia dávka sa podala 4 roky po začiatočnom očkovaní. Výsledky sú uvedené v tabuľke 7 (pozri časť 4.4).
Tabuľka 7: Titre rSBA a hSBA po jednorazovej dávke Nimenrixu (alebo MenC-CRM) u batoliat vo vekuMenin- goko- ková
skupi-na
| Skupina s očkova- cou
látkou
|
Časový bod
| rSBA*
| hSBA**
|
N
|
≥8
(95 % IS)
|
GMT (95 % IS)
|
N
|
≥8
(95 % IS)
|
GMT (95 % IS)
|
A
|
Nimenrix
|
Mesiac 1(1)
|
354
| 99,7 % (98,4; 100)
| 2205 (2008; 2422)
|
338
| 77,2 % (72,4; 81,6)
| 19,0 (16,4; 22,1)
| Rok 4(2) (pred posil. Nimenrixom)
|
212
|
74,5 % (68,1; 80,2)
|
112 (80,3; 156)
|
187
| 28,9 % (22,5; 35,9)
|
4,8 (3,9; 5,9)
|
(po posil.)(2,3)
|
214
| 100 % (98,3; 100)
| 7173 (6389; 8054)
|
202
| 99,5 % (97,3; 100)
| 1343 (1119; 1612)
| 5 rokov
po posilňovacej dávke(4)
|
137
|
89,8 % (83,4; 94,3)
|
229 (163; 322)
|
135
|
53,3 % (44,6; 62,0)
|
13.2 (9,6; 18,3)
| 6 rokov
po posilňovacej dávke(4)
|
134
|
92,5 % (86,7; 96,4)
|
297 (214; 413)
|
130
|
58,5 % (49,5; 67,0)
|
14.4 (10,5; 19,7)
|
C
|
Nimenrix
|
Mesiac 1(1)
|
354
| 99,7 % (98,4; 100)
| 478 (437; 522)
|
341
| 98,5 % (96.6; 99.5)
| 196 (175; 219)
| Rok 4(2)
(pred posil. Nimenrixom)
|
213
|
39,9 % (33,3; 46,8)
|
12,1 (9,6; 15,2)
|
200
|
73,0 % (66,3; 79,0)
|
31,2 (23,0; 42,2)
|
(po posil.)(2,3)
|
215
| 100 % (98,3; 100)
| 4512 (3936; 5172)
|
209
| 100 % (98,3; 100)
| 15831 (13626; 18394)
| 5 rokov
po posilňovacej dávke(4)
|
137
|
80,3 % (72,6; 86,6)
|
66,0 (48,1; 90,5)
|
136
|
99,3 % (96,0; 100)
|
337 (261; 435)
| 6 rokov
po posilňovacej dávke(4)
|
134
|
71,6 % (63,2; 79,1)
|
39,6 (28,6; 54,6)
|
130
|
97,7 % (93,4; 99,5)
|
259 (195; 345)
|
MenC- CRM Očkovaci a látka
|
Mesiac 1(1)
|
121
| 97,5 % (92,9; 99,5)
| 212 (170; 265)
|
116
| 81,9 % (73,7; 88,4)
| 40,3 (29,5; 55,1)
| Rok 4(2)
(Pre-MenC- CRM197 booster)
|
43
|
37,2 % (23,0; 53,3)
|
14.3 (7,7; 26,5)
|
31
|
48.4 % (30,2; 66,9)
|
11.9 (5,1; 27,6)
|
(Po posil.)(2,3)
|
43
| 100 % (91,8; 100)
| 3718 (2596; 5326)
|
33
| 100 % (89,4; 100)
| 8646 (5887; 12699)
| 5 rokov
po posilňovacej dávke(4)
|
23
|
78,3 % (56,3; 92,5)
|
47,3 (19,0; 118)
|
23
|
100 % (85,2; 100)
|
241 (139; 420)
| 6 rokov po posilňovacej dávke(4)
|
23
|
65,2 % (42,7; 83,6)
|
33,0 (14,7; 74,2)
|
23
|
95,7 % (78,1; 99,9)
|
169 (94,1; 305)
|
W-135
|
Nimenrix
|
Mesiac 1(1)
|
354
| 100 % (99,0; 100)
| 2682 (2453; 2932)
|
336
| 87,5 % (83,5; 90,8)
| 48,9 (41,2; 58,0)
| Rok 4(2)
(pred posil. Nimenrixom)
|
213
|
48,8 % (41,9; 55,7)
|
30,2 (21,9; 41,5)
|
158
|
81,6 % (74,7; 87,3)
|
48.3 (36,5; 63,9)
| (Po posil.)(2,3)
| 215
| 100 %
| 10950
| 192
| 100 %
| 14411
|
|
|
12-23 mesiacov, pretrvávanie v 4.roku a odpoveď po posilňovacej dávke 4 roky po prvom očkovaní (klinické štúdie MenACWY-TT-039/048/102)
Tabuľka 7: Titre rSBA a hSBA po jednorazovej dávke Nimenrixu (alebo MenC-CRM) u batoliat vo veku
Meni
n- goko- ková
skupi-na
|
Skupina s
očkova- cou
látkou
|
Časov
ý bod
|
rSBA*
|
hSBA**
|
N
|
≥8
(9
5 % IS)
|
G
M
T (95 % IS)
|
N
|
≥8
(9
5 % IS)
|
G
M
T (95 % IS)
|
|
|
(98,3; 100)
|
(9531; 12579)
|
|
(98,1; 100)
|
(12972; 16010)
|
5 rokov
po posilňovacej dávke(4)
|
137
|
88,3 % (81,7; 93,2)
|
184 (130; 261)
|
136
|
100 % (97,3; 100)
|
327 (276; 388)
|
6 rokov
po posilňovacej dávke(4)
|
134
|
85,8 % (78,7; 91,2)
|
172 (118; 251)
|
133
|
98,5 % (94,7; 99,8)
|
314 (255; 388)
|
Y
|
Nimenrix
|
Mesiac 1(1)
|
354
|
100 % (99,0; 100)
|
2729 (2473; 3013)
|
329
|
79,3 % (74,5; 83,6)
|
30,9 (25,8; 37,1)
|
Rok 4(2) (pred posil. Nimenrixom)
|
213
|
58,2 % (51,3; 64,9)
|
37.3 (27.6; 50.4)
|
123
|
65,9 % (56,8; 74,2)
|
30,2 (20,2; 45,0)
|
(Po posil.)(2,3)
|
215
|
100 % (98,3; 100)
|
4585 (4129; 5093)
|
173
|
100 % (97,9; 100)
|
6776 (5961; 7701)
|
5 rokov po posilňovacej dávke(4)
|
137
|
92,7 % (87,0; 96,4)
|
265 (191; 368)
|
137
|
97,8 % (93,7; 99,5)
|
399 (321; 495)
|
6 rokov po posilňovacej dávke(4)
|
134
|
94,0 % (88,6; 97,4)
|
260 (189; 359)
|
131
|
97,7 % (93,5; 99,5)
|
316 (253; 394)
|
|
|
12-23 mesiacov, pretrvávanie v 4.roku a odpoveď po posilňovacej dávke 4 roky po prvom očkovaní (klinické štúdie MenACWY-TT-039/048/102)
Analýza imunogenity sa uskutočňovala na ATP kohorte pre každý časový bod.
(1) Klinická štúdia MenACWY-TT-039
(2) Klinická štúdia MenACWY-TT-048
(3) vzorky krvi sa odoberali 1 mesiac po posilňovacej dávke v 4. roku.
(4) Klinická štúdia MenACWY-TT-102
* rSBA analýza vykonaná v laboratóriách GSK na vzorkách odobraných 1 mesiac po primárnom očkovaní a v laboratóriách PHE v UK pre nasledujúce časové body, v ktorých sa odoberali vzorky.
** hSBA analýza vykonaná v laboratóriách GSK a Neomed v Kanade pre časové body MenACWY-TT-102.
Imunogenita u detí vo veku 2 až 10 rokovV klinickej štúdii MenACWY-TT-081 sa preukázala noninferiorita jedinej dávky Nimenrixu oproti
ďalšej registrovanej očkovacej látke MenC-CRM v zmysle odpovede na skupinu C vyvolanej očkovacou látkou [94,8 % (95 % IS: 91,4; 97,1) a resp. 95,7 % (95 % IS: 89,2; 98,8)]. GMT protilátok boli nižšie v skupine s Nimenrixom [2 795 (95 % IS: 2 393; 3 263)] oproti skupine s očkovacou látkou MenC-CRM [5 292 (95 % IS: 3 815; 7 340)].
V klinickej štúdii MenACWY-TT-038 sa preukázala noninferiorita jedinej dávky Nimenrixu oproti registrovanej očkovacej látke ACWY-PS v zmysle odpovede na štyri skupiny meningokokov, ako je uvedené v tabuľke 8.
Tabuľka 8: rSBA* titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u detí vo veku 2 –
10 rokov (klinická štúdia MenACWY-TT-038)
Meni
n- goko- ková skupi- na
|
Nimenrix
(1)
|
Očkovacia látka ACWY-PS
(1)
|
N
|
VR
(9
5 % IS)
|
G
M
T (95 % IS)
|
N
|
VR
(9
5 % IS)
|
G
M
T (95 % IS)
|
A
|
594
|
89,1 % (86,3; 91,5)
|
6 343
(5 998; 6 708)
|
192
|
64,6 % (57,4; 71,3)
|
2 283
(2 023; 2 577)
|
C
|
691
|
96,1 % (94,4; 97,4)
|
4 813
(4 342; 5 335)
|
234
|
89,7 % (85,1; 93,3)
|
1 317
(1 043; 1 663)
|
W-135
|
691
|
97,4 % (95,9; 98,4)
|
11 543
(10 873; 12 255)
|
236
|
82,6 % (77,2; 87,2)
|
2 158
(1 815; 2 565)
|
Y
|
723
|
92,7 % (90,5; 94,5)
|
10 825
(10 233; 11 452)
|
240
|
68,8 % (62,5; 74,6)
|
2 613
(2 237; 3 052)
|
Analýza imunogenity sa uskutočnila v ATP kohorte.
(1) vzorky krvi sa odoberali 1 mesiac po očkovaní
VR: odpoveď na očkovaciu látku definovaná ako podiel jedincov s:
· titrami rSBA ³ 32 u jedincov, ktorí boli na začiatku séronegatívni (t.j. titre rSBA pred očkovaním < 8)
· najmenej 4-násobným zvýšením titrov rSBA od obdobia pred očkovaním po obdobie po očkovaní u jedincov, ktorí boli na začiatku séropozitívni (t.j. titre rSBA pred očkovaním ≥ 8)
* rSBA analýza vykonaná v laboratóriách GSK
Pretrvávanie SBA titrov sa hodnotilo u detí, ktoré na začiatku podstúpili očkovanie v klinickej štúdii
MenACWY-TT-081, ako je uvedené v tabuľke 9 (pozri časť 4.4).
Menin- goko- ková
skupina
|
Skupina
s očkova-cou látkou
| Časový bod (me-
siace)
| rSBA*
| hSBA**
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
A
|
Nimenrix
|
32
|
193
| 86,5 % (80,9; 91,0)
| 196 (144; 267)
|
90
| 25,6 % (16,9; 35,8)
| 4,6 (3,3; 6,3)
|
44
|
189
| 85,7 % (79,9; 90,4)
| 307 (224; 423)
|
89
| 25,8 % (17,1; 36,2)
| 4,8 (3,4; 6,7)
|
C
|
Nimenrix
|
32
|
192
| 64,6 % (57,4; 71,3)
| 34,8 (26,0; 46,4)
|
90
| 95,6 % (89,0; 98,8)
| 75,9 (53,4; 108)
|
44
|
189
| 37,0 % (30,1; 44,3)
| 14,5 (10,9; 19,2)
|
82
| 76,8 % (66,2; 85,4)
| 36,4 (23,1; 57,2)
|
Očkovacia látka MenC- CRM
|
32
|
69
| 76,8 % (65,1; 86,1)
| 86,5 (47,3; 158)
|
33
| 90,9 % (75,7; 98,1)
| 82,2 (34,6; 196)
|
44
|
66
| 45,5 % (33,1; 58,2)
| 31,0 (16,6; 58,0)
|
31
| 64,5 % (45,4; 80,8)
| 38,8 (13,3; 113)
|
W-135
|
Nimenrix
|
32
|
193
| 77,2 % (70,6; 82,9)
| 214 (149; 307)
|
86
| 84,9 % (75,5; 91,7)
| 69,9 (48,2; 101)
|
44
|
189
| 68,3 % (61,1; 74,8)
| 103 (72,5; 148)
|
87
| 80,5 % (70,6; 88,2)
| 64,3 (42,7; 96,8)
|
Y
|
Nimenrix
|
32
|
193
| 81,3 % (75,1; 86,6)
| 227 (165; 314)
|
91
| 81,3 % (71,8; 88,7)
| 79,2 (52,5; 119)
|
44
|
189
| 62,4 % (55,1; 69,4)
| 78,9 (54,6; 114)
|
76
| 82,9 % (72,5; 90,6)
| 127 (78,0; 206)
|
|
|
Tabuľka 9: rSBA a hSBA titre až do 44 mesiacov po Nimenrixe (alebo MenC-CRM) u detí, ktoré mali v čase očkovania 2 – 10 rokov (klinická štúdia MenACWY-TT-088)Analýza imunogenity sa uskutočnila v ATP kohorte určenej pre hodnotenie pretrvávania imunitnej
odpovede upravenej vzhľadom na každý časový bod.
* rSBA analýza vykonaná v laboratóriách PHE v UK
** hSBA analýza vykonaná v laboratóriách GSK
Pretrvávanie hSBA titrov sa hodnotilo 1 rok po očkovaní u detí vo veku 6 – 10 rokov, ktoré
na začiatku podstúpili očkovanie v klinickej štúdii MenACWY-TT-027 (tabuľka 10) (pozri časť 4.4).
Tabuľka 10: hSBA* titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u detí vo veku6 – 10 rokov a pretrvávanie 1 rok po očkovaní (klinické štúdie MenACWY-TT-027/028)
Menin- goko- ková skupina
|
Skupina s očkova- cou látkou
|
1 mesiac po očkovaní
(klinická štúdia MenACWY-TT-
027)
| Pretrvávanie imunitnej odpovede
po 1 roku
(klinická štúdia MenACWY-TT-
028)
|
N(1)
| ³ 8
(95 % IS)
| GMT (95 % IS)
|
(1)
| ³ 8
(95 % IS)
| GMT (95 % IS)
|
A
| Nimenrix
|
105
| 80,0 % (71,1; 87,2)
| 53,4 (37,3; 76,2)
|
104
| 16,3 % (9,8; 24,9)
| 3,5 (2,7; 4,4)
| Očkovaci a látka
ACWY-P S
|
35
|
25,7 % (12,5; 43,3)
| 4,1 (2,6; 6,5)
|
35
|
5,7 % (0,7; 19,2)
| 2,5 (1,9; 3,3)
|
C
| Nimenrix
|
101
| 89,1 % (81,3; 94,4)
| 156 (99,3; 244)
|
105
| 95,2 % (89,2; 98,4)
| 129 (95,4; 176)
| Očkovaci a látka ACWY-P S
|
38
|
39,5 % (24,0; 56,6)
|
13,1 (5,4; 32,0)
|
31
|
32,3 % (16,7; 51,4)
|
7,7 (3,5; 17,3)
|
W-135
| Nimenrix
|
103
| 95,1 %
(89,0; 98,4)
| 133
(99,9; 178)
|
103
| 100 %
(96,5; 100)
| 257
(218; 302)
| Očkovaci
a látka ACWY-P S
|
35
|
34,3 % (19,1; 52,2)
|
5,8 (3,3; 9,9)
|
31
|
12,9 % (3,6; 29,8)
|
3,4 (2,0; 5,8)
|
Y
| Nimenrix
|
89
| 83,1 %
(73,7; 90,2)
| 95,1
(62,4; 145)
|
106
| 99,1 %
(94,9; 100)
| 265
(213; 330)
| Očkovaci
a látka ACWY-P S
|
32
|
43,8 % (26,4; 62,3)
|
12,5 (5,6; 27,7)
|
36
|
33,3 % (18,6; 51,0)
|
9,3 (4,3; 19,9)
|
|
|
N
Analýza imunogenity sa uskutočnila v ATP kohorte počas pretrvávania v 1. roku.
hSBA analýza sa nevykonávala pre deti vo veku 2 až < 6 rokov (v čase očkovania).
* hSBA analýza vykonaná v laboratóriách GSK
SBA titre sa stanovovali počas 10 rokov u detí, ktoré sa na začiatku očkovali jednou dávkou Nimenrixu alebo ACWY-PS vo veku 2 až 10 rokov, v klinickej štúdii MenACWY-TT-027. Pretrvávanie SBA titrov sa vyhodnocovalo v dvoch predĺžených klinických štúdiách: MenACWY-TT-
032 (až do 5 rokov) a MenACWY-TT-100 (až do 10 rokov). V klinickej štúdii MenACWY-TT-100 sa vyhodnocovala aj odpoveď na jedinú posilňovaciu dávku Nimenrixu podávanú 10 rokov
po začiatočnom očkovaní s Nimenrixom alebo ACWY-PS. Výsledky sú uvedené v tabuľke 11 (pozri časť 4.4).
Tabuľka 11:
rSBA a hSBA titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u detí vo veku 2 –Menin- goko- ková skupina
| Skupina s očko- vacou látkou
|
Časový bod
| rSBA*
| hSBA**
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
A
|
Nimenrix
|
Mesiac 1(1)
|
225
| 100 % (98,4; 100)
| 7 301
(6 586; 8 093)
|
111(5)
| 81,1% (72,5; 87,9)
| 57,0 (40,3; 80,6)
|
|
|
10 rokov, pretrvávanie až do 10 rokov a po podaní posilňovacej dávky 10 rokov po začiatočnom očkovaní (klinické štúdie MenACWY-TT-027/032/100)
Tabuľka 11:
rSBA a hSBA titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u detí vo veku 2 –
|
|
Rok 5(2)
|
98
| 90,8 % (83,3; 95,7)
| 141 (98,2; 203)
|
n/a(6)
|
--
|
--
|
Rok 6(3)
|
98
| 79,6 % (70,3; 87,1)
| 107 (66,0; 174)
|
90
| 41,1 % (30,8; 52,0)
| 6,5 (4,8; 8,8)
| Rok 10(3)
(pred posil.)
|
73
| 89,0 % (79,5; 95,1)
| 96,3 (57,1; 163)
|
62
| 33,9 % (22,3; 47,0)
| 4,5 (3,3; 6,2)
|
(po posil.)(3,4)
|
74
| 95,9 % (88,6; 99,2)
| 4 626
(3 041; 7 039)
|
73
| 100 % (95,1; 100)
| 1 213 (994; 1 481)
|
Očkovacia látka ACWY-PS
|
Mesiac 1(1)
|
75
| 100 % (95,2; 100)
| 2 033
(1 667; 2 480)
|
35(5)
| 25,7 % (12,5; 43,3)
| 4,1 (2,6; 6,5)
|
(2)
|
13
| 15,4 % (1,9; 45,4)
| 4,7 (3,7; 6,0)
|
(6)
|
--
|
--
|
Rok 6(3)
|
24
| 12,5 % (2,7; 32,4)
| 5,8 (3,5; 9,6)
|
21
| 33,3 % (14,6; 57,0)
| 5,9 (3,0; 11,7)
| Rok 10(3)
(pred posil.)
|
17
| 23,5 % (6,8; 49,9)
| 8,0 (3,3; 19,3)
|
17
| 29,4 % (10,3; 56,0)
| 6,2 (2,4; 15,7)
|
(po posil.)(3,4)
|
17
| 100 % (80,5; 100)
| 6 414
(3 879; 10 608)
|
17
| 100 % (80,5; 100)
| 211 (131; 340)
|
C
|
Nimenrix
|
Mesiac 1(1)
|
225
| 100 % (98,4; 100)
| 2 435
(2 106; 2 816)
|
107(5)
| 89,7 % (82,3; 94,8)
| 155 (101; 237)
|
Rok 5(2)
|
98
| 90,8 % (83,3; 95,7)
| 79,7 (56,0; 113)
|
n/a(6)
|
--
|
--
|
Rok 6(3)
|
98
| 82,7 % (73,7; 89,6)
| 193 (121; 308)
|
97
| 93,8 % (87,0; 97,7)
| 427 (261; 700)
| Rok 10(3)
(pred posil.)
|
74
| 85,1 % (75,0; 92,3)
| 181 (106; 310)
|
73
| 91,8 % (83,0; 96,9)
| 222 (129; 380)
|
(po posil.)(3,4)
|
74
| 100 % (95,1; 100)
| 4 020
(3 319; 4 869)
|
71
| 100 % (94,9; 100)
| 15 544
(11 735; 20 588)
|
Očkovacia látka ACWY-PS
|
Mesiac 1(1)
|
74
| 100 % (95,1; 100)
| 750 (555; 1 014)
|
38(5)
| 39,5 % (24,0; 56,6)
| 13,1 (5,4; 32,0)
|
Rok 5(2)
|
13
| 100 % (75,3; 100)
| 128 (56,4; 291)
|
n/a(6)
|
--
|
--
|
Rok 6(3)
|
24
| 79,2 % (57,8; 92,9)
| 98,7 (42,2; 231)
|
24
| 100 % (85,8; 100)
| 235 (122; 451)
| Rok 10(3)
(pred posil.)
|
17
| 76,5 % (50,1; 93,2)
| 96,2 (28,9; 320)
|
17
| 100,0 % (80,5; 100)
| 99,1 (35,8; 274)
|
(po posil.)(3,4)
|
17
|
100 % (80,5; 100)
|
15 101
(7 099; 32 122)
|
17
|
94,1 % (71,3; 99,9)
| 44 794 (10 112;
198 440)
|
|
|
10 rokov, pretrvávanie až do 10 rokov a po podaní posilňovacej dávky 10 rokov po začiatočnom očkovaní (klinické štúdie MenACWY-TT-027/032/100)
Rok 5
n/a
Tabuľka 11:
rSBA a hSBA titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u detí vo veku 2 –
W-135
|
Nimenrix
|
Mesiac 1(1)
|
225
| 100 % (98,4; 100)
| 11 777
(10 666; 13 004)
|
107(5)
| 95,3 % (89,4; 98,5)
| 134 (101; 178)
|
Rok 5(2)
|
98
| 78,6 % (69,1; 86,2)
| 209 (128; 340)
|
n/a(6)
|
--
|
--
|
Rok 6(3)
|
98
| 73,5 % (63,6; 81,9)
| 265 (155; 454)
|
92
| 81,5 % (72,1; 88,9)
| 62,5 (42,0; 93,1)
| Rok 10(3)
(pred posil.)
|
74
| 68,9 % (57,1; 79,2)
| 206 (109; 392)
|
59
| 61,0 % (47,4; 73,5)
| 17,5 (10,5; 29,2)
|
(po posil.)(3,4)
|
74
| 100 % (95,1; 100)
| 27 944
(22 214; 35 153)
|
74
| 100 % (95,1; 100)
| 6 965
(5 274; 9 198)
|
Očkovacia látka ACWY-PS
|
Mesiac 1(1)
|
75
| 100 % (95,2; 100)
| 2 186
(1 723; 2 774)
|
35(5)
| 34,3 % (19,1; 52,2)
| 5,8 (3,3, 9,9)
|
(2)
|
13
| 0 % (0,0; 24,7)
| 4,0 (4,0; 4,0)
|
(6)
|
--
|
--
|
Rok 6(3)
|
24
| 12,5 % (2,7; 32,4)
| 7,6 (3,7; 15,6)
|
23
| 30,4 % (13,2; 52,9)
| 7,0 (2,9; 16,9)
| Rok 10(3)
(pred posil.)
|
17
| 23,5 % (6,8; 49,9)
| 15,4 (4,2; 56,4)
|
15
| 26,7 % (7,8; 55,1)
| 4,1 (2,0; 8,5)
|
(po posil.)(3,4)
|
17
| 94,1 % (71,3; 99,9)
| 10 463
(3 254; 33 646)
|
15
| 100 % (78,2; 100)
| 200 (101; 395)
|
Y
|
Nimenrix
|
Mesiac 1(1)
|
225
| 100 % (98,4; 100)
| 6 641
(6 044; 7 297)
|
94(5)
| 83,0 % (73,8; 89,9)
| 93,7 (62,1; 141)
|
Rok 5(2)
|
98
| 78,6 % (69,1; 86,2)
| 143 (88,0; 233)
|
n/a(6)
|
--
|
--
|
Rok 6(3)
|
98
| 71,4 % (61,4; 80,1)
| 136 (82,6; 225)
|
89
| 65,2 % (54,3; 75,0)
| 40,3 (23,9; 68,1)
| Rok 10(3)
(pred posil.)
|
74
| 67,6 % (55,7; 78,0)
| 98,5 (54,3; 179)
|
65
| 72,3 % (59,8; 82,7)
| 35,7 (21,0; 60,6)
|
(po posil.)(3,4)
|
74
| 100 % (95,1; 100)
| 7 530
(5 828; 9 729)
|
74
| 100 % (95,1; 100)
| 11 127
(8 909; 13 898)
|
Očkovacia látka ACWY-PS
|
Mesiac 1(1)
|
75
| 100 % (95,2; 100)
| 1 410
(1 086; 1 831)
|
32(5)
| 43,8 % (26,4; 62,3)
| 12,5 (5,6; 27,7)
|
(2)
|
13
| 7,7 % (0,2; 36,0)
| 5,5 (2,7; 11,1)
|
(6)
|
--
|
--
|
Rok 6(3)
|
24
| 20,8 % (7,1; 42,2)
| 11,6 (4,7; 28,7)
|
24
| 25,0 % (9,8; 46,7)
| 7,3 (2,7; 19,8)
| Rok 10(3)
(pred posil.)
|
17
| 17,6 % (3,8; 43,4)
| 10,2 (3,5; 30,2)
|
14
| 35,7 % (12,8; 64,9)
| 7,8 (2,5; 24,4)
|
(po posil.)(3,4)
|
17
| 100 % (80,5; 100)
| 6 959
(3 637; 13 317)
|
17
| 100 % (80,5; 100)
| 454 (215; 960)
|
|
|
10 rokov, pretrvávanie až do 10 rokov a po podaní posilňovacej dávky 10 rokov po začiatočnom očkovaní (klinické štúdie MenACWY-TT-027/032/100)
Rok 5
n/a
Rok 5
n/a
Analýza imunogenity sa uskutočňovala na ATP kohorte pre každý časový bod. Jedinci so suboptimálnou
odpoveďou na meningokokovú skupinu C (definovaná ako SBA titer pod vopred definovanou hraničnou hodnotou testu) mali dostať ďalšiu dávku MenC očkovacej látky pred 6. rokom. Títo jedinci boli vylúčení z analýzy v 5. roku, ale boli zahrnutí do analýzy v 6.roku a 10. roku.
(1) Klinická štúdia MenACWY-TT-027 (2) Klinická štúdia MenACWY-TT-032 (3) Klinická štúdia MenACWY-TT-100
(4) vzorky krvi sa odoberali 1 mesiac po posilňovacej dávke v 10. roku.
(5) vrátane detí vo veku 6 až < 11 rokov. hSBA analýza sa nevykonávala pre deti vo veku 2 až < 6 rokov
(v čase očkovania).
(6) podľa protokolu pre klinickú štúdiu MenACWY-TT-032, hSBA sa pre túto vekovú skupinu nemeralo v 5. roku.
* rSBA analýza vykonaná v laboratóriách GSK na vzorkách odobraných 1 mesiac po primárnom očkovaní a v laboratóriách PHE v UK pre nasledujúce časové body, v ktorých sa odoberali vzorky.
** hSBA analýza vykonaná v laboratóriách GSK a v Neomed v Kanade pre časové body MenACWY-TT-100.
Imuno
g
enita u dospievajúcich vo veku 11 až 17 rokov a u dospelých vo veku ≥ 18 rokov
V dvoch klinických štúdiách, ktoré boli vykonané s dospievajúcimi vo veku 11 až 17 rokov (štúdia
MenACWY-TT-036) a s dospelými vo veku 18 až 55 rokov (štúdia MenACWY-TT-035), bola podaná buď jedna dávka Nimenrixu, alebo jedna dávka očkovacej látky ACWY-PS.
Preukázala sa imunologická noninferiorita Nimenrixu oproti očkovacej látke ACWY-PS v zmysle odpovede na očkovaciu látku uvedenú v tabuľke 12.
Menin- goko- ková
skupina
|
Skupina s očko- vacou látkou
| Klinická štúdia MenACWY-TT-036 (11 – 17 rokov)(1)
| Klinická štúdia MenACWY-TT-035 (18 – 55 rokov)(1)
|
N
|
VR
(95 % IS)
|
GMT (95 % IS)
|
N
|
VR
(95 % IS)
|
GMT (95 % IS)
|
A
| Nimenrix
|
553
| 85,4 % (82,1; 88,2)
| 5 928
(5 557; 6 324)
|
743
| 80,1 % (77,0; 82,9)
| 3 625
(3 372; 3 897)
| Očkova- cia látka ACWY-
PS
|
191
|
77,5 % (70,9; 83,2)
|
2 947
(2 612; 3 326)
|
252
|
69,8 % (63,8; 75,4)
|
2 127
(1 909; 2 370)
|
C
| Nimenrix
|
642
| 97,4 % (95,8; 98,5)
| 13 110
(11 939; 14 395)
|
849
| 91,5 % (89,4; 93,3)
| 8 866
(8 011; 9 812)
| Očkova- cia látka ACWY- PS
|
211
|
96,7 % (93,3; 98,7)
|
8 222
(6 807; 9 930)
|
288
|
92,0 % (88,3; 94,9)
|
7 371
(6 297; 8 628)
|
W-135
| Nimenrix
|
639
| 96,4 % (94,6; 97,7)
| 8 247
(7 639; 8 903)
|
860
| 90,2 % (88,1; 92,1)
| 5 136
(4 699; 5 614)
| Očkova- cia látka ACWY- PS
|
216
|
87,5 % (82,3; 91,6)
|
2 633
(2 299; 3 014)
|
283
|
85,5 % (80,9; 89,4)
|
2 461
(2 081; 2 911)
|
Y
| Nimenrix
|
657
| 93,8 % (91,6; 95,5)
| 14 086
(13 168; 15 069)
|
862
| 87,0 % (84,6; 89,2)
| 7 711
(7 100; 8 374)
| Očkova- cia látka ACWY-
PS
|
219
|
78,5 % (72,5; 83,8)
|
5 066
(4 463; 5 751)
|
288
|
78,8 % (73,6; 83,4)
|
4 314
(3 782; 4 921)
|
|
|
Tabuľka 12: rSBA* titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u dospievajúcich vo veku 11 – 17 rokov a u dospelých vo veku 18 – 55 rokov (klinické štúdie MenACWY-TT-035/036)Analýza imunogenity sa uskutočnila v ATP kohorte.
(1) vzorky krvi sa odoberali 1 mesiac po očkovaní
VR: odpoveď na očkovaciu látku definovaná ako podiel jedincov s:
· rSBA titre ³ 32 pre jedincov, ktorí boli na začiatku séronegatívni (t.j. rSBA titre pred očkovaním < 8)
· najmenej 4-násobné zvýšenie rSBA titrov z titrov pred očkovaním na titre po očkovaní pre jedincov, ktorí boli na začiatku séropozitívni (tzn. rSBA titre pred očkovaním ³ 8)
* rSBA analýza sa vykonávala v laboratóriách GSK
rSBA titre sa stanovovali počas 10 rokov u jedincov, ktorí sa na začiatku očkovali jednou dávkou Nimenrixu alebo ACWY-PS vo veku 11 až 17 rokov v klinickej štúdii MenACWY-TT-036. Pretrvávanie rSBA titrov sa vyhodnocovalo v dvoch predĺžených klinických štúdiách: Men ACWY- TT-043 (až do 5 rokov) a MenACWY-TT-101 (až do 10 rokov). V klinickej štúdii MenACWY-TT-
101 sa vyhodnocovala aj odpoveď na jedinú posilňovaciu dávku Nimenrixu podanú 10 rokov po začiatočnom očkovaní s Nimenrixom alebo ACWY-PS. Výsledky sú uvedené v tabuľke 13.
Tabuľka 13: rSBA* titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u dospievajúcich vo veku 11 – 17 rokov, pretrvávanie až do 10 rokov a po podaní posilňovacej
dávky 10 rokov po začiatočnom očkovaní (klinické štúdie MenACWY-TT-
036/043/101)
Meni
n- goko- ková skupina
|
Časov
ý bod
|
Nimenrix
|
ACWY-PS očkovacia látka
|
N
|
≥ 8
(9
5 % IS)
|
G
M
T (95 % IS)
|
N
|
≥ 8
(9
5 % IS)
|
G
M
T (95 % IS)
|
A
|
Mesiac 1(1)
|
674
|
100 % (99,5; 100)
|
5 929
(5 557; 6 324)
|
224
|
99,6 % (97,5; 100)
|
2 947
(2 612; 3 326)
|
Rok 3 (2)
|
449
|
92,9 % (90,1; 95,1)
|
448 (381; 527)
|
150
|
82,7 % (75,6; 88,4)
|
206 (147; 288)
|
Rok 5 (2)
|
236
|
97,5 % (94,5; 99,1)
|
644 (531; 781)
|
86
|
93,0 % (85,4; 97,4)
|
296 (202; 433)
|
Rok 10(3)
(pred posil.)
|
162
|
85,2 % (78,8; 90,3)
|
248 (181; 340)
|
51
|
80,4 % (66,9; 90,2)
|
143 (80,5; 253)
|
(po posil.)(3,4)
|
162
|
100 % (97,7; 100)
|
3 760
(3 268; 4 326)
|
51
|
100 % (93,0; 100)
|
2 956
(2 041; 4 282)
|
C
|
Mesiac 1(1)
|
673
|
100 % (99,5; 100)
|
13 110
(11 939; 14 395)
|
224
|
100 % (98,4; 100)
|
8 222
(6 808; 9 930)
|
Rok 3(2)
|
449
|
91,1 %
(88,1; 93,6)
|
371
(309; 446)
|
150
|
86,0 %
(79,4; 91,1)
|
390
(262; 580)
|
Rok 5 (2)
|
236
|
88,6 % (83,8; 92,3)
|
249 (194; 318)
|
85
|
87,1 % (78,0; 93,4)
|
366 (224; 599)
|
Rok 10(3)
(pred posil.)
|
162
|
90,1 % (84,5; 94,2)
|
244 (182; 329)
|
51
|
82,4 % (69,1; 91,6)
|
177 (86,1; 365)
|
(po posil.)(3,4)
|
162
|
100 % (97,7; 100)
|
8 698
(7 391 10 235)
|
51
|
100 % (93,0; 100)
|
3 879
(2 715; 5 544)
|
W-135
|
Mesiac 1(1)
|
678
|
99,9 % (99,2; 100)
|
8 247
(7 639; 8 903)
|
224
|
100 % (98,4; 100)
|
2 633
(2 299; 3 014)
|
Rok 3(2)
|
449
|
82,0 % (78,1; 85,4)
|
338 (268; 426)
|
150
|
30,0 % (22,8; 38,0)
|
16,0 (10,9; 23,6)
|
Rok 5(2)
|
236
|
86,0 % (80,9; 90,2)
|
437 (324; 588)
|
86
|
34,9 % (24,9; 45,9)
|
19,7 (11,8; 32,9)
|
Rok 10(3)
(pred posil.)
|
162
|
71,6 % (64,0; 78,4)
|
146 (97,6; 217)
|
51
|
43,1 % (29,3; 57,8)
|
16,4 (9,2; 29,4)
|
(po posil.)(3,4)
|
162
|
100 % (97,7; 100)
|
11 243
(9 367; 13 496)
|
51
|
100 % (93,0; 100)
|
3 674
(2 354; 5 734)
|
Y
|
Mesiac 1(1)
|
677
|
100 % (99,5; 100)
|
14 087
(13 168; 15 069)
|
224
|
100 % (98,4; 100)
|
5 066
(4 463; 5 751)
|
Rok 3(2)
|
449
|
93,1 % (90,3; 95,3)
|
740 (620; 884)
|
150
|
58,0 % (49,7; 66,0)
|
69,6 (44,6; 109)
|
Rok 5(2)
|
236
|
96,6 % (93,4; 98,5)
|
1 000 (824; 1 214)
|
86
|
66,3 % (55,3; 76,1)
|
125 (71,2; 219)
|
Rok 10(3)
(pred posil.)
|
162
|
90,7 % (85,2; 94,7)
|
447 (333; 599)
|
51
|
49,0 % (34,8; 63,4)
|
32,9 (17,1; 63,3)
|
(po posil.)(3,4)
|
162
|
100 % (97,7; 100)
|
7 585
(6 748; 8 525)
|
51
|
98,0 % (89,6; 100)
|
3 296
(1 999; 5 434)
|
Analýza imunogenity sa uskutočnila v ATP kohorte pre každý časový bod. (1) Klinická štúdia MenACWY-TT-036
(2) Klinická štúdia MenACWY-TT-043 (3) Klinická štúdia MenACWY-TT-101
(4) vzorky krvi sa odoberali 1 mesiac po posilňovacej dávke v 10. roku.
*rSBA analýza vykonaná v laboratóriách GSK na vzorkách odobraných 1 mesiac po primárnom očkovaní a v laboratóriách PHE v UK pre nasledujúce časové body, v ktorých sa odoberali vzorky.
Pretrvávanie hSBA sa hodnotilo do 5 rokov po očkovaní u dospievajúcich a dospelých, ktorí
na začiatku podstúpili očkovanie v klinickej štúdii MenACWY-TT-052, ako je uvedené v tabuľke 14 (pozri časť 4.4).
Tabuľka 14: hSBA* titre po jednorazovej dávke Nimenrixu u dospievajúcich a dospelých vo veku 11 – 25 rokov a pretrvávanie až do 5 rokov po očkovaní (klinické štúdie MenACWY-TT-052/059)
Meningokoková skupina
|
Časový bod
|
N
|
³ 8 (95% IS)
|
GMT (95% IS)
|
A
|
Mesiac 1(1)
|
356
|
82,0 % (77,6; 85,9)
|
58,7 (48,6; 70,9)
|
Rok 1(2)
|
350
|
29,1 % (24,4; 34,2)
|
5,4 (4,5; 6,4)
|
Rok 5(2)
|
141
|
48,9 % (40,4; 57,5)
|
8,9 (6,8; 11,8)
|
C
|
Mesiac 1(1)
|
359
|
96,1 % (93,5; 97,9)
|
532 (424; 668)
|
Rok 1(2)
|
336
|
94,9 % (92,0; 97,0)
|
172 (142; 207)
|
Rok 5(2)
|
140
|
92,9 % (87,3; 96,5)
|
94,6 (65,9; 136)
|
W-135
|
Mesiac 1(1)
|
334
|
91,0 % (87,4; 93,9)
|
117 (96,8; 141)
|
Rok 1(2)
|
327
|
98,5 % (96.5; 99,5)
|
197 (173; 225)
|
Rok 5(2)
|
138
|
87,0 % (80,2; 92,1)
|
103 (76,3; 140)
|
Y
|
Mesiac 1(1)
|
364
|
95,1 % (92,3; 97,0)
|
246 (208; 291)
|
Rok 1(2)
|
356
|
97,8 % (95,6; 99,0)
|
272 (237; 311)
|
Rok 5(2)
|
142
|
94,4 % (89,2; 97,5)
|
225 (174; 290)
|
Analýza imunogenity sa uskutočnila v ATP kohorte určenej pre hodnotenie pretrvávania imunitnej odpovede upravenej vzhľadom na každý časový bod
(1) Klinická štúdia MenACWY-TT-052 (2) Klinická štúdia MenACWY-TT-059
*hSBA analýza vykonaná v laboratóriách GSK
rSBA titre sa stanovovali počas 10 rokov u jedincov, ktorí sa na začiatku očkovali jednou dávkou Nimenrixu alebo ACWY-PS vo veku 11 až 55 rokov v klinickej štúdii MenACWY-TT-015. Pretrvávanie rSBA titrov sa vyhodnocovalo v dvoch predĺžených klinických štúdiách: Men ACWY- TT-020 (až do 5 rokov) a MenACWY-TT-099 (až do 10 rokov). V klinickej štúdii MenACWY-TT-
099 sa vyhodnocovala aj odpoveď na jedinú posilňovaciu dávku Nimenrixu podanú 10 rokov po začiatočnom očkovaní s Nimenrixom alebo ACWY-PS. Výsledky sú uvedené v tabuľke 15.
Tabuľka 15: rSBA* titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u dospievajúcich a dospelých vo veku 11 – 55 rokov, pretrvávanie až do 10 rokov a po podaní posilňovacej dávky 10 rokov po začiatočnom očkovaní (klinické
štúdie MenACWY-TT-015/020/099)
Menin-
goko- ková skupina
|
Časový bod
|
Nimenrix
|
Očkovacia látka ACWY-PS
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
A
|
Mesiac 1(1)
|
323
|
100 %
(98,9; 100)
|
4 945
(4 452, 5 493)
|
112
|
100 %
(96,8, 100)
|
2 190
(1 858, 2 582)
|
Rok 4(2)
|
43
|
95,3 % (84,2; 99,4)
|
365 (226; 590)
|
17
|
76,5 % (50,1; 93,2)
|
104 (31,0; 351)
|
Rok 5(2)
|
51
|
84,3 % (71,4; 93,0)
|
190 (108; 335)
|
19
|
57,9 % (33,5; 79,7)
|
37,0 (12,6; 109)
|
Rok 10(3)
(pred posil.)
|
155
|
78,1 % (70,7; 84,3)
|
154 (108; 219)
|
52
|
71,2 % (56,9; 82,9)
|
75,1 (41,4; 136)
|
(po posil.)(3,4)
|
155
|
100 % (97,6; 100)
|
4 060
(3 384; 4 870)
|
52
|
100 % (93,2; 100)
|
3585 (2751; 4672)
|
C
|
Mesiac 1(1)
|
341
|
99,7 % (98,4; 100)
|
10 074
(8 700, 11 665)
|
114
|
100 % (96,8; 100)
|
6 546
(5 048; 8 488)
|
Rok 4(2)
|
43
|
76,7 % (61,4; 88,2)
|
126 (61,6; 258)
|
17
|
41,2 % (18,4; 67,1)
|
16,7 (5,7; 48,7)
|
Rok 5(2)
|
51
|
72,5 % (58,3; 84,1)
|
78,5 (41,8; 147)
|
18
|
38,9 % (17,3; 64,3)
|
17,3 (6,0; 49,7)
|
Rok 10(3)
(pred posil.)
|
154
|
90,9 % (85,2; 94,9)
|
193 (141; 264)
|
52
|
88,5 % (76,6; 95,6)
|
212 (110; 412)
|
(po posil.)(3,4)
|
155
|
100 % (97,6; 100)
|
13 824 (10 840;
17 629)
|
52
|
98,1 % (89,7; 100)
|
3 444
(1 999; 5 936)
|
W-135
|
Mesiac 1(1)
|
340
|
99,7 %
(98,4; 100)
|
8 577
(7 615; 9 660)
|
114
|
100 %
(96,8; 100)
|
2 970
(2 439; 3 615)
|
Rok 4(2)
|
43
|
90,7 %
(77,9; 97,4)
|
240
(128; 450)
|
17
|
17,6 %
(3,8; 43,4)
|
8,3
(3,6; 19,5)
|
(2)
|
51
|
86,3 %
(73,7; 94,3)
|
282
(146; 543)
|
19
|
31,6 %
(12,6; 56,6)
|
15,4
(5,7; 41,9)
|
Rok 10(3)
(pred posil.)
|
154
|
71,4 %
(63,6; 78,4)
|
166
(107; 258)
|
52
|
21,2 %
(11,1; 34,7)
|
10,9
(6,1; 19,3)
|
(po posil.)(3,4)
|
155
|
100 % (97,6; 100)
|
23 431
(17 351;
31 641)
|
52
|
98,1 % (89,7; 100)
|
5 793
(3 586; 9 357)
|
Y
|
Mesiac 1(1)
|
340
|
100 % (98,9; 100)
|
10 315
(9 317; 11 420)
|
114
|
100 % (96,8; 100)
|
4 574
(3 864; 5 414)
|
Rok 4(2)
|
43
|
86,0 % (72,1; 94,7)
|
443 (230; 853)
|
17
|
47,1 % (23,0; 72,2)
|
30,7 (9,0; 105)
|
Rok 5(2)
|
51
|
92,2 % (81,1; 97,8)
|
770 (439; 1351)
|
19
|
63,2 % (38,4; 83,7)
|
74,1 (21,9; 250)
|
Rok 10(3)
(pred posil.)
|
154
|
86,4 % (79,9; 91,4)
|
364 (255; 519)
|
52
|
61,5 % (47,0; 74,7)
|
56,0 (28,8; 109)
|
(po posil.)(3,4)
|
155
|
100 % (97,6; 100)
|
8 958
(7 602; 10 558)
|
52
|
100 % (93,2; 100)
|
5 138
(3 528; 7 482)
|
|
|
Rok 5
Analýza imunogenity sa uskutočnila v ATP kohortách počas 1 mesiaca až 5 rokov po očkovaní a v posilňovacej
ATP kohorte.
(1) Klinická štúdia MenACWY-TT-015 (2) Klinická štúdia MenACWY-TT-020 (3) Klinická štúdia MenACWY-TT-099
(4) vzorky krvi sa odoberali 1 mesiac po posilňovacej dávke v 10. roku.
*rSBA analýza vykonaná v laboratóriách GSK na vzorkách odobraných 1 mesiac po primárnom očkovaní a v laboratóriách PHE v UK pre nasledujúce časové body, v ktorých sa odoberali vzorky.
V samostatnej klinickej štúdii (MenACWY-TT-085) jedna dávka Nimenrixu bola podaná 194
dospelým Libanončanom vo veku od 56 rokov (vrátane 133 vo veku od 56 do 65 rokov a 61 vo veku >
65 rokov). Percento jedincov s titrami rSBA (zmerané v laboratóriách GSK) ≥ 128 pred očkovaním bolo v rozsahu od 45 % (skupina C) do 62 % (skupina Y). Celkovo 1 mesiac po očkovaní percento s
titrami rSBA ≥ 128 bolo v rozsahu od 93 % (skupina C) do 97 % (skupina Y). V podskupine vo veku
> 65 rokov percento s titrami rSBA ≥ 128 1 mesiac po očkovaní bolo v rozsahu od 90 % (skupina A)
do 97 % (skupina Y).
Odpoveď na podanie posilňovacej dávky jedincom, ktorí sa v minulosti očkovali konjugovanoumeningokokovou očkovacou látkou proti Neisseria meningitidis
Očkovanie s posilňovacou dávkou Nimenrixu sa študovalo u jedincov vo veku od 12 mesiacov, ktorí
podstúpili základné očkovanie s monovalentnou (MenC-CRM) alebo kvadrivalentnou konjugovanou meningokokovou očkovacou látkou (MenACWY-TT). Pozorovali sa mohutné pamäťové odpovede
na antigén(y) pri základnom očkovaní (pozri tabuľky 6, 7, 11, 13 a 15).
Odpoveď na Nimenrix u jedincov v minulosti očkovaných čistou polysacharidovou očkovacou látkouproti Neisseria meningitidis
V štúdii MenACWY-TT-021 vykonanej s jedincami vo veku 4,5 až 34 rokov bola imunogenita
Nimenrixu podaného 30 až 42 mesiacov po očkovaní očkovacou látkou ACWY-PS porovnaná
s imunogenitou Nimenrixu podaného jedincom rovnakého veku, ktorí v predchádzajúcich 10 rokoch neboli očkovaní žiadnou meningokokovou očkovacou látkou. Imunitná odpoveď (titer rSBA ≥ 8)
na všetky štyri skupiny meningokokov sa zistila u všetkých jedincov bez ohľadu na to, či v minulosti
boli alebo neboli očkovaní meningokokovou očkovacou látkou. GMT rSBA boli významne nižšie u jedincov, ktorým bola podaná dávka očkovacej látky ACWY-PS 30 - 42 mesiacov pred podaním
Nimenrixu, avšak 100 % jedincov dosiahlo titre rSBA ≥ 8 pri všetkých štyroch skupinách
meningokokov (A, C, W-135, Y) (pozri časť 4.4).
Deti (vo veku 2 až 17 rokov) s anatomickou alebo funkčnou aspléniou
Štúdia MenACWY-TT-084 porovnávala imunitné odpovede na dve dávky Nimenrixu podávané s 2-
mesačným odstupom u 43 jedincov vo veku 2 až 17 rokov s anatomickou alebo funkčnou aspléniou s imunitnými odpoveďami 43 jedincov zodpovedajúceho veku s normálnou funkciou sleziny. Jeden mesiac po očkovaní prvou dávkou a 1 mesiac po druhej dávke boli v oboch skupinách podobné percentá jedincov, ktorí mali rSBA titre ≥ 8 a ≥ 128 a hSBA titre ≥ 4 a ≥ 8.
5.2 Farmakokinetické vlastnosti
Neaplikovateľné.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe štúdií lokálnej tolerancie, akútnej toxicity, toxicity po opakovanom podávaní, vývojovej/reprodukčnej toxicity a fertility neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok:
Sacharóza
Trometamol
Rozpúšťadlo:
Chlorid sodný
Voda na injekciu
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
4 roky
Po rekonštitúcii:
Očkovacia látka sa má po rekonštitúcii použiť okamžite. Aj keď odklad sa neodporúča, stabilita
očkovacej látky po rekonštitúcii bola preukázaná počas 8 hodín pri teplote 30 °C. Ak sa nepoužije v priebehu 8 hodín, očkovaciu látku nepodávajte.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C - 8 °C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom. Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Prášok v injekčnej liekovke (sklo typu I) s uzáverom (butylkaučuk) a rozpúšťadlo v naplnenej injekčnej striekačke s uzáverom (butylkaučuk).
Veľkosti balenia po 1 a 10 ks s ihlami alebo bez ihiel.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pokyny na rekonštitúciu očkovacej látky s rozpúšťadlom dodaným v naplnenej injekčnej striekačke
Nimenrix sa musí rekonštituovať pridaním celého obsahu naplnenej injekčnej striekačky
s rozpúšťadlom do injekčnej liekovky obsahujúcej prášok.
Nasaďte ihlu na injekčnú striekačku tak, ako je to zobrazené na nasledujúcom obrázku. Injekčná striekačka priložená k Nimenrixu sa však môže trochu líšiť (bez skrutkovacieho závitu) od injekčnej
striekačky zobrazenej na obrázku. V tomto prípade sa má ihla nasadiť bez skrutkovania.
1. Držte
valecinjekčnej striekačky v jednej ruke
(dbajte na to, aby ste nedržali piest injekčnej striekačky), a odskrutkujte vrchnák injekčnej striekačky tak,
že ho otočíte proti smeru hodinových ručičiek.
Piest injekčnej striekačky

Valec injekčnej striekačky
2. Nasaďte ihlu na injekčnú striekačku tak, že ihlu priložíte k injekčnej striekačke
a točíte ju v smere hodinových ručičiek,
až kým neucítite, že zapadla na svoje miesto
(pozri obrázok).
3. Snímte kryt ihly, ktorý pri tom môže klásť malý odpor.
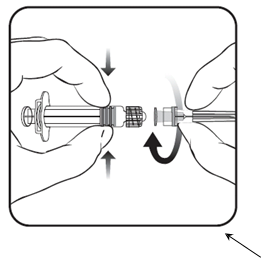
Vrchnák injekčnej striekačky
4. Pridajte rozpúšťadlo k prášku. Po pridaní rozpúšťadla k prášku sa musí zmes dôkladne pretrepať, až kým sa prášok v rozpúšťadle úplne nerozpustí.
Rekonštituovaná očkovacia látka je číry bezfarebný roztok.
Pred podaním sa má rekonštituovaná očkovacia látka opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo zmenu fyzikálneho vzhľadu. V prípade ich výskytu sa má očkovacia látka zlikvidovať.
Očkovacia látka sa má po rekonštitúcii použiť okamžite.
Na podanie očkovacej látky sa má použiť nová ihla.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Pfizer Europe MA EEIG Boulevard de la Plaine 17
1050 Bruxelles
Belgicko
8. REGISTRAČNÉ ČÍSLA
EU/1/12/767/001
EU/1/12/767/002
EU/1/12/767/003
EU/1/12/767/004
Kryt ihly
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 20. apríla 2012
Dátum posledného predĺženia registrácie: 16. februára 2017
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1. NÁZOV LIEKU
Nimenrix prášok a rozpúšťadlo na injekčný roztok v injekčných liekovkách
Konjugovaná očkovacia látka proti meningokokom skupín A, C, W-135 a Y
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
1 dávka (0,5 ml) po rekonštitúcii obsahuje:
Polysacharid Neisseria meningitidis skupiny A1 5 mikrogramov Polysacharid Neisseria meningitidis skupiny C1 5 mikrogramov Polysacharid Neisseria meningitidis skupiny W-1351 5 mikrogramov Polysacharid Neisseria meningitidis skupiny Y1 5 mikrogramov
1konjugovaný na tetanový toxoid ako proteínový nosič 44 mikrogramov
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok a rozpúšťadlo na injekčný roztok. Prášok alebo koláč je biely.
Rozpúšťadlo je číre a bezfarebné.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Nimenrix je indikovaný na aktívnu imunizáciu jedincov vo veku od 6 týždňov proti invazívnemu meningokokovému ochoreniu, ktoré je vyvolané baktériami Neisseria meningitidis skupín A, C, W-135 a Y.
4.2 Dávkovanie a spôsob podávania
Dávkovanie
Nimenrix sa má používať v súlade s dostupnými oficiálnymi odporúčaniami.
Primárna imunizácia
Dojčatá vo veku od 6 týždňov do menej ako 6 mesiacov: dve dávky, každá 0,5 ml, sa majú podať s intervalom 2 mesiace medzi dávkami.
U dojčiat vo veku od 6 mesiacov, detí, dospievajúcich a dospelých: má sa podať jedna dávka 0,5 ml. U niektorých jedincov môže byť považovaná za vhodnú ďalšia primárna dávka Nimenrixu (pozri časť 4.4).
Posilňovacie dávky
Po dokončení primárnej imunizačnej schémy u dojčiat vo veku 6 týždňov až menej ako 12 mesiacov sa má vo veku 12 mesiacov podať posilňovacia dávka, pričom interval od posledného očkovania Nimenrixom má byťaspoň 2 mesiace (pozri časť 5.1).
U predtým očkovaných jedincov vo veku 12 mesiacov a starších sa Nimenrix môže podať ako posilňovacia dávka, ak boli primárne očkovaní konjugovanou alebo čistou polysacharidovou meningokokovou očkovacou látkou (pozri časti 4.4 a 5.1).
Spôsob podávania
Imunizácia sa má uskutočniť iba intramuskulárnou injekciou.
Odporúčaným miestom podania injekcie u dojčiat je anterolaterálna strana stehna. U jedincov vo veku od 1 roka odporúčaným miestom podania injekcie je anterolaterálna strana stehna alebo deltový sval (pozri časti 4.4 a 4.5).
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Sledovateľnosť
Aby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo
šarže podaného lieku.
Nimenrix sa nesmie za žiadnych okolností podať intravaskulárne, intradermálne ani subkutánne.
V súlade so správnou klinickou praxou sa má pred očkovaním podrobne odobrať anamnéza (najmä s ohľadom na predchádzajúce očkovanie a na možný výskyt nežiaducich účinkov) a urobiť klinické vyšetrenie očkovaného.
Pre prípad zriedkavej anafylaktickej reakcie vyskytujúcej sa po podaní očkovacej látky musí byť vždy okamžite k dispozícii zodpovedajúca liečba a lekársky dohľad.
Pridružené ochorenie
Očkovanie Nimenrixom sa musí odložiť u jedincov trpiacich závažným akútnym febrilným
ochorením. Prítomnosť miernej infekcie, akou je nádcha, by nemalo viesť k odloženiu očkovania.
Synkopa
Po akomkoľvek očkovaní, alebo dokonca aj pred ním, sa najmä u dospievajúcich môže vyskytnúť
synkopa (strata vedomia) ako psychogénna reakcia na vpich ihly. Synkopa môže byť spojená s niekoľkými neurologickými príznakmi, akými sú prechodné poruchy videnia, parestézia a
tonicko-klonické pohyby končatín, objavujúcimi sa počas opätovného nadobúdania vedomia.
Je dôležité urobiť opatrenia, aby sa zabránilo zraneniu následkom straty vedomia.
Trombocytopénia a poruchy zrážanlivosti krvi
Nimenrix sa má podávať obozretne jedincom s trombocytopéniou alebo s akoukoľvek poruchou
zrážanlivosti krvi, pretože po intramuskulárnom podaní môže u týchto jedincov nastať krvácanie.
Imunodeficiencia
Je možné predpokladať, že u pacientov podstupujúcich imunosupresívnu liečbu alebo u pacientov
s imunodeficienciou sa nemusí vyvolať dostatočná imunitná odpoveď.
Osoby s familiárnou nedostatočnosťou komplementu (napríklad deficiencia C5 alebo C3)
a osoby dostávajúce liečbu inhibujúcu terminálnu aktiváciu komplementu (napríklad ekulizumab)
sú vo zvýšenom riziku invazívneho ochorenia spôsobeného Neisseria meningitidis skupín A, C,
W-135 a Y a to aj vtedy, ak u nich dochádza k tvorbe protilátok po očkovaní očkovacou látkou
Nimenrix.
Ochrana pred meningokokovým ochorením
Nimenrix poskytuje ochranu iba pred Neisseria meningitidis skupín A, C, W-135 a Y. Očkovacia látka
nechráni pred žiadnymi inými skupinami Neisseria meningitidis.
Ochranná imunitná odpoveď sa nemusí vyvolať u všetkých očkovaných jedincov.
Vplyv predchádzajúceho očkovania čistou polysacharidovou meningokokovou očkovacou látkou Jedinci, ktorí boli v minulosti očkovaní čistou polysacharidovou meningokokovou očkovacou látkou a o 30 až 42 mesiacov neskôr boli očkovaní Nimenrixom, mali nižšie geometrické priemery titrov (GMT) protilátok stanovené pomocou testu sérovej baktericídnej aktivity s využitím králičieho komplementu (rSBA) ako jedinci, ktorí v predchádzajúcich 10 rokoch neboli očkovaní žiadnou meningokokovou očkovacou látkou (pozri časť 5.1). Klinický význam tohto zistenia nie je známy.
Vplyv protilátok proti toxoidu tetanu vytvorených pred očkovaním
Bezpečnosť a imunogenita Nimenrixu boli hodnotené, keď sa podal následne po očkovacej látke obsahujúcej toxoidy diftérie a tetanu, acelulárnej zložky pertussis, inaktivované poliovírusy (1, 2 a 3), povrchový antigén hepatitídy B a polyribozylribózofosfát Haemophilus influenzae typ b konjugovaný na toxoid tetanu (DTaP-HBV-IPV/Hib), alebo keď sa podal súbežne s ňou v druhom roku života. Podanie Nimenrixu jeden mesiac po podaní očkovacej látky DTaP-HBV-IPV/Hib viedlo k nižším GMT rSBA proti skupinám A, C a W-135 v porovnaní so súbežným podaním (pozri časť 4.5). Klinický význam tohto zistenia nie je známy.
Imunitné odpovede u dojčiat vo veku 6 mesiacov až menej ako 12 mesiacov
Jedna dávka podaná v 6 mesiacoch bola spojená s nižšími titrami pri teste sérovej baktericídnej aktivity s využitím ľudského komplementu (hSBA) v skupinách W-135 a Y v porovnaní s troma dávkami podanými v 2, 4 a 6 mesiacoch (pozri časť 5.1). Klinický význam tohto pozorovania nie je známy. Ak sa očakáva, že je dojča vo veku 6 mesiacov až menej ako 12 mesiacov vo zvýšenom riziku invazívneho meningokokového ochorenia kvôli vystaveniu skupinám W-135 a/alebo Y, môže sa zvážiť podanie druhej primárnej dávky Nimenrixu po intervale 2 mesiacov.
Imunitné odpovede u batoliat vo veku 12 až 14 mesiacov
Mesiac po podaní dávky mali batoľatá vo veku 12 až 14 mesiacov podobné titre rSBA proti skupinám A, C, W-135 a Y po jednej dávke Nimenrixu alebo dvoch dávkach Nimenrixu podaných dva mesiace od seba.
Jedna dávka bola spojená s nižšími titrami pri teste hSBA v skupinách W-135 a Y v porovnaní s dvoma dávkami podanými dva mesiace od seba. Podobné odpovede boli pozorované v skupinách A
a C po podaní jednej alebo dvoch dávok (pozri časť 5.1). Klinický význam tohto zistenia nie je známy.
Ak sa očakáva, že je batoľa vo zvýšenom riziku invazívneho meningokokového ochorenia kvôli vystaveniu skupinám W-135 a/alebo Y, malo by sa zvážiť podanie druhej dávky Nimenrixu v intervale
2 mesiacov. Informácie ohľadom ubúdania protilátok proti skupine A alebo skupine C po podaní prvej
dávky Nimenrixu u detí vo veku 12 až 23 mesiacov nájdete v časti Pretrvávanie titrov sérových baktericídnych protilátok.
Pretrvávanie titrov sérových baktericídnych protilátok
Po podaní Nimenrixu dochádza k poklesu titrov sérových baktericídnych protilátok proti skupine A
v teste hSBA (pozri časť 5.1). Klinický význam tohto pozorovania nie je známy. Ak sa však predpokladá, že jedinec je vystavený významnému riziku expozície skupine A a dávka Nimenrixu mu
bola podaná pred viac než približne jedným rokom, môže sa zvážiť podanie posilňovacej dávky.
Pokles titrov protilátok v priebehu času sa pozoroval pri skupinách A, C, W-135 a Y. Klinický význam tohto pozorovania nie je známy. U jedincov, ktorí boli očkovaní v batolivom veku a sú
vystavení vysokému riziku expozície meningokokovému ochoreniu vyvolanému skupinami A, C, W-135 a Y, sa môže zvážiť podanie posilňovacej dávky (pozri časť 5.1).
Vplyv Nimenrixu na koncentrácie protilátok proti tetanu
Hoci sa po očkovaní Nimenrixom pozorovalo zvýšenie koncentrácií protilátok proti tetanovému
toxoidu (TT), Nimenrix nenahrádza imunizáciu proti tetanu.
Keď sa Nimenrix podáva spolu s očkovacou látkou obsahujúcou TT alebo jeden mesiac pred jej podaním v druhom roku života, nevedie to k narušeniu odpovede na TT ani k významnému ovplyvneniu bezpečnosti. K dispozícii nie sú údaje týkajúce sa podania po 2 roku života.
4.5 Liekové a iné interakcie
U dojčiat sa Nimenrix môže podať súbežne s kombinovanými DTaP-HBV-IPV/Hib očkovacími látkami a s 10-valentnou pneumokokovou konjugovanou očkovacou látkou.
Vo veku od 1 roka sa Nimenrix môže podať súbežne s ktoroukoľvek z nasledujúcich očkovacích látok: s očkovacou látkou proti hepatitíde A (HAV) a s očkovacou látkou proti hepatitíde B (HBV), s očkovacou látkou proti osýpkam - príušniciam - ružienke (MMR), s očkovacou látkou proti
osýpkam - príušniciam - ružienke - ovčím kiahňam (MMRV), s 10-valentnou pneumokokovou konjugovanou očkovacou látkou alebo s neadjuvovanou očkovacou látkou proti sezónnej chrípke.
V druhom roku života sa Nimenrix taktiež môže podať súbežne s kombinovanými očkovacími látkami proti záškrtu - tetanu - čiernemu kašľu (acelulárna zložka pertussis) (DTaP), vrátane očkovacích látok DTaP kombinovaných so zložkou hepatitídy B, inaktivovaným poliovírusom alebo Haemophilus influenzae typ b (HBV, IPV alebo Hib), akou je očkovacia látka DTaP-HBV-IPV/Hib, a 13-valentnou pneumokokovou konjugovanou očkovacou látkou.
Jedincom vo veku 9 až 25 rokov sa Nimenrix môže podať súbežne s humánnou papilomavírusovou bivalentnou [typ 16 a 18] rekombinantnou očkovacou látkou (HPV2).
Nimenrix a očkovacia látka obsahujúca TT, akou je očkovacia látka DTaP-HBV-IPV/Hib, sa majú podať súbežne vždy, keď je to možné, alebo sa má Nimenrix podať minimálne jeden mesiac pred podaním očkovacej látky obsahujúcej TT.
Jeden mesiac po súbežnom podaní Nimenrixu a 10-valentnej pneumokokovej konjugovanej očkovacej látky sa zistil nižší geometrický priemer koncentrácií protilátok (GMC) a protilátok stanovených pomocou opsonofagocytózneho testu (OPA) pri jednom pneumokokovom sérotype (18C konjugovaný na tetanový toxoid ako proteínový nosič). Klinický význam tohto zistenia nie je známy. Súbežné podanie nemalo žiaden vplyv na imunitné odpovede na ostatných deväť pneumokokových sérotypov.
Jeden mesiac po súbežnom podaní s kombinovanou adsorbovanou očkovacou látkou obsahujúcou toxoid tetanu, redukovaný toxoid diftérie a acelulárnu zložku pertussis (Tdap) sa u jedincov vo veku
9 až 25 rokov pozorovali nižšie GMC pre každý z pertussis antigénov (toxoid pertusssis [PT], vláknitý
hemaglutinín [FHA] a pertaktín [PRN]). U viac ako 98 % jedincov boli koncentrácie anti-PT, FHA alebo PRN vyššie ako prahové hodnoty testov. Klinický význam týchto zistení nie je známy. Súbežné podanie nemalo žiadny dopad na imunitné reakcie na Nimenrix alebo na antigény tetanu alebo diftérie, ktoré boli súčasťou Tdap.
Ak sa má Nimenrix podať v rovnakom čase ako iná injekčne podávaná očkovacia látka, očkovacie látky sa musia vždy podať do rôznych miest vpichu.
Je možné predpokladať, že u pacientov podstupujúcich imunosupresívnu liečbu sa nemusí vyvolať dostatočná imunitná odpoveď.
4.6 Fertilita, gravidita a laktácia
Gravidita
K dispozícii sú obmedzené skúsenosti s použitím Nimenrixu u gravidných žien.
Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky na graviditu, embryonálny/fetálny vývoj, pôrod alebo postnatálny vývoj (pozri časť 5.3).
Nimenrix sa má používať počas gravidity iba v nevyhnutných prípadoch a iba vtedy, keď možné výhody očkovania prevažujú nad možnými rizikami pre plod.
Dojčenie
Nie je známe, či sa Nimenrix vylučuje do ľudského mlieka.
Nimenrix sa má používať počas dojčenia iba vtedy, keď možné výhody očkovania prevažujú nad možnými rizikami.
Fertilita
Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch Nimenrixu na schopnosť viesť vozidlá alebo obsluhovať stroje.
Niektoré účinky spomenuté v časti 4.8 „Nežiaduce účinky“ však môžu ovplyvniť schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Bezpečnosť Nimenrixu prezentovaná v nižšie uvedenej tabuľke je založená na dátových súboroch
z dvoch klinických štúdií, a to nasledovných:
· Spojená analýza dát od 9 621 jedincov, ktorým sa podala jedna dávka Nimenrixu. Tento počet zahŕňal 3 079 batoliat (12- až 23-mesačných), 909 detí vo veku 2 až 5 rokov, 990 detí vo veku
6 až 10 rokov, 2 317 dospievajúcich (11- až 17-ročných) a 2 326 dospelých (18- až 55-ročných).
· Dáta zo štúdie u dojčiat vo veku od 6 do 12 týždňov v čase podania prvej dávky (štúdia
MenACWY-TT-083), v ktorej 1 052 jedincov dostalo najmenej jednu dávku primárnej schémy
2 alebo 3 dávok Nimenrixu a 1 008 jedincov dostalo posilňovaciu dávku približne vo veku 12
mesiacov.
Údaje o bezpečnosti sa tiež hodnotili v samostatnej štúdii, v ktorej bola jedna dávka Nimenrixu podaná 274 jedincom vo veku 56 rokov a starším.
Lokálne a celkové nežiaduce reakcie
V skupinách vo veku 6 až 12 týždňov a 12 až 14 mesiacov, ktoré dostali 2 dávky Nimenrixu 2 mesiace od seba, boli prvá a druhá dávka spojené s podobnou lokálnou a systémovou reaktogenitou.
Profil lokálnych a celkových nežiaducich reakcií na posilňovaciu dávku Nimenrixu podanú jedincom vo veku 12 mesiacov až 30 rokov po základnom očkovaní Nimenrixom alebo inými konjugovanými či čistými polysacharidovými meningokokovými očkovacími látkami bol podobný profilu lokálnych
a celkových nežiaducich reakcií pozorovaných po podaní základného očkovania Nimenrixom okrem
gastrointestinálnych príznakov (vrátane hnačky, vracania a nauzey), ktoré boli veľmi časté u jedincov vo veku 6 rokov a starších.
Zoznam nežiaducich reakcií uvedený v tabuľke
Hlásené nežiaduce reakcie sú uvedené podľa nasledujúcich kategórií frekvencie výskytu:
Veľmi časté: (≥ 1/10)
Časté: (≥ 1/100 až < 1/10) Menej časté: (≥ 1/1 000 až < 1/100) Zriedkavé: (≥ 1/10 000 až < 1/1 000) Veľmi zriedkavé: (< 1/10 000)
Neznáme (nedá sa odhadnúť z dostupných údajov)
Tabuľka 1 ukazuje nežiaduce reakcie hlásené zo štúdií u jedincov vo veku od 6 týždňov do 55 rokov a po uvedení očkovacej látky na trh. Nežiaduce reakcie hlásené u jedincov vo veku >55 rokov boli podobné nežiaducim reakciám zaznamenaným u mladších dospelých.
Tabuľka 1: Tabuľkový prehľad nežiaducich reakcií podľa triedy orgánových systémov
Trieda orgánových systémov Frekvencia výskytu Nežiaduce reakcie
Poruchy metabolizmu a výživy
Veľmi časté Nechutenstvo
Psychické poruchy Veľmi časté Podráždenosť
Menej časté Nespavosť, plač
Poruchy nervového systému Veľmi časté Ospalosť, bolesť hlavy
Menej časté Hypestézia, závraty
Poruchy gastrointestinálneho traktu
Časté Hnačka, vracanie a nauzea*
Poruchy kože a podkožného
tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva Celkové poruchy a reakcie
v mieste podania
Menej časté Pruritus, vyrážka**
Menej časté Myalgia, bolesť v končatine
Veľmi časté Horúčka, opuch v mieste vpichu, bolesť v mieste vpichu, začervenanie v mieste vpichu, únava
Časté Hematóm v mieste vpichu*
Menej časté Malátnosť, indurácia v mieste vpichu, pruritus v mieste vpichu, pocitu tepla v mieste vpichu, necitlivosť v mieste vpichu
Neznáme*** Rozsiahly opuch končatiny v mieste vpichu, často spojený s erytémom, niekedy postihujúci vedľajší kĺb alebo opuch celej očkovanej končatiny

*Nauzea a hematóm v mieste vpichu sa vyskytovali u dojčiat s menej častou frekvenciou
**Vyrážka sa vyskytovala u dojčiat s častou frekvenciou
***Nežiaduce reakcie identifikované po uvedení očkovacej látky na trh
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
Hlásený nebol žiaden prípad predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: očkovacie látky, očkovacie látky proti meningokokom, ATC kód: J07AH08
Mechanizmus účinku
Protilátky proti kapsulárnym polysacharidom meningokokov chránia pred meningokokovým
ochorením prostredníctvom komplementom sprostredkovanej baktericídnej aktivity. Nimenrix navodzuje tvorbu baktericídnych protilátok proti kapsulárnym polysacharidom Neisseria meningitidis skupín A, C, W-135 a Y, čo sa stanovilo pomocou testov rSBA alebo hSBA.
Imunogenita u dojčiat
V klinickej štúdii MenACWY-TT-083 bola prvá dávka podaná vo veku od 6 do 12 týždňov, druhá
po intervale 2 mesiacov a tretia (posilňovacia) dávka bola podaná vo veku približne 12 mesiacov. DTaP-HBV-IPV/Hib a 10-valentná pneumokoková očkovacia látka boli podané súbežne. Nimenrix
vyvolal rSBA a hSBA titre proti štyrom meningokokovým skupinám, ako je uvedené v tabuľke 2.
Odpoveď proti skupine C bola noninferiorná voči odpovedi vyvolanej registrovanými očkovacími látkami MenC-CRM a MenC-TT v percentuálnom vyjadrení s titrom rSBA ≥ 8 1 mesiac po druhej dávke.
Údaje z tejto klinickej štúdie podporujú extrapoláciu údajov o imunogenite a dávkovaní u dojčiat vo veku od 12 týždňov do menej ako 6 mesiacov.
Tabuľka 2: Titre rSBA a hSBA po dvoch dávkach Nimenrixu (alebo MenC-CRM alebo MenC- TT) podaných s 2-mesačným odstupom, pričom prvá dávka sa podala dojčiatám
vo veku 6 - 12 týždňov a nasledujúca posilňovacia dávka vo veku 12 mesiacov
(
klinická štúdia MenACWY-TT-083)
Men
ing okoková skupina
|
Skupina s očkova- cou látkou
|
Časový
bod
|
rSBA*
|
hSBA**
|
N
|
³ 8
(95 % IS)
|
G
M
T (95 % IS)
|
N
|
³ 8
(95 % IS)
|
G
M
T (95 % IS)
|
A
|
Nimenrix
|
Po dávke
2(1)
Po posil- ňovacej dávke(1)
|
456
462
|
97,4 % (95,4;
98,6)
99,6 % (98,4;
99,9)
|
203 (182; 227)
1 561
(1 412; 1
725)
|
202
214
|
96,5 % (93,0; 98,6)
99,5 % (97,4; 100)
|
157 (131; 188)
1 007 (836; 1
214)
|
C
|
Nimenrix
|
Po dávke
2(1)
Po posilňova- cej dávke(1)
|
456
463
|
98,7 % (97,2;
99,5)
99,8 % (98,8;
100)
|
612 (540; 693)
1 177
(1 059; 1
308)
|
218
221
|
98,6 % (96,0; 99,7)
99,5 % (97,5; 100)
|
1 308
(1 052; 1 627)
4 992
(4 086; 6 100)
|
MenC- CRM očkovacia látka
|
Po dávke
2(1)
Po posilňovac ej dávke(1)
|
455
446
|
99,6 % (98,4;
99,9)
98,4 % (96,8;
99,4)
|
958 (850; 1
079)
1 051 (920; 1
202)
|
202
216
|
100 % (98,2; 100)
100 % (98,3; 100)
|
3 188
(2 646; 3 841)
5 438
(4 412; 6 702)
|
MenC-TT očkovacia látka
|
Po dávke
2(1)
Po posiňova- cej dávke(1)
|
457
459
|
100 % (99,2;
100)
100 % (99,2;
100)
|
1 188
(1 080; 1
307)
1 960
(1 776; 2
163)
|
226
219
|
100 % (98,4; 100)
100 % (98,3; 100)
|
2 626
(2 219; 3 109)
5 542
(4 765; 6 446)
|
W
|
Nimenrix
|
Po dávke
2(1)
Po posil- ňovacej dávke(1)
|
455
462
|
99,1 % (97,8;
99,8)
99,8 % (98,8;
100)
|
1 605
(1 383; 1
862)
2 777
(2 485; 3
104)
|
217
218
|
100 % (98,3; 100)
100 % (98,3; 100)
|
753 (644; 882)
5 123
(4 504; 5 826)
|
Y
|
Nimenrix
|
Po dávke
2(1)
Po posilňo vacej dávke(1)
|
456
462
|
98,2 % (96,6;
99,2)
99,4 % (99,1;
99,9)
|
483 (419; 558)
881 (787; 986)
|
214
217
|
97,7 % (94,6; 99,2)
100 % (98,3; 100)
|
328 (276; 390)
2 954
(2 498; 3 493)
|
Analýza imunogenity sa uskutočnila na primárnej kohorte podľa protokolu (ATP).
*rSBA analýza vykonaná v laboratóriách Public Health England (PHE) v UK
**hSBA analýza vykonaná v laboratóriách GSK
(1) vzorky krvi sa odobrali 21 až 48 dní po očkovaní
V klinickej štúdii MenACWY-TT-087 dostávali dojčatá buď jednu primárnu dávku vo veku
6 mesiacov nasledovanú posilňovacou dávkou vo veku 15 – 18 mesiacov (DTaP-IPV/Hib a 10- valentná pneumokoková konjugovaná očkovacia látka sa podávali súbežne pri oboch očkovaniach),
alebo tri primárne dávky vo veku 2, 4 a 6 mesiacov nasledované posilňovacou dávkou vo veku 15 –
18 mesiacov. Jedna primárna dávka podaná vo veku 6 mesiacov vyvolala robustné rSBA titre proti štyrom meningokokovým skupinám, ako sa nameralo percentuálnym zastúpením jedincov s titrami v rSBA ≥ 8, ktoré boli porovnateľné s odpoveďami po poslednej dávke trojdávkovej primárnej
schémy. Posilňovacia dávka vytvorila robustné odpovede na všetky štyri meningokokové skupiny, ktoré boli porovnateľné u oboch skupín dávkovania. Výsledky sú uvedené v tabuľke 3.
Meningo- koková skupina
|
Časový bod
| rSBA*
| hSBA**
|
N
| ³ 8
(95 % IS)
| GMT (95 % IS)
|
N
| ³ 8
(95 % IS)
| GMT (95 % IS)
|
A
|
Po dávke
1(1)
Pred posilňo- vacou dávkou Po posilňo- vacej dávke(1)
|
163
131
139
|
98,8 % (95,6; 99,9)
81,7 % (74; 87,9)
99,3 % (96,1; 100)
|
1 333
(1 035; 1 716)
125 (84,4; 186)
2 762
(2 310; 3 303)
|
59
71
83
|
98,3 % (90,9; 100)
66,2 % (54; 77)
100 % (95,7; 100)
|
271 (206; 355)
20,8 (13,5; 32,2)
1 416
(1 140; 1 758)
|
C
| Po dávke
1(1)
Pred posilňo- vacou dávkou Po posilňo- vacej dávke(1)
|
163
131
139
| 99,4 % (96,6; 100)
65,6 % (56,9; 73,7)
99,3 % (96,1; 100)
| 592 (482; 726)
27,4 (20,6; 36,6)
2 525
(2 102; 3 033)
|
66
78
92
| 100 % (94,6; 100)
96,2 % (89,2; 99,2)
100 % (96,1; 100)
| 523 (382; 717)
151 (109; 210)
13 360
(10 953; 16 296)
|
W
| Po dávke
1(1)
Pred posilňo- vacou dávkou Po posilňo- vacej dávke(1)
|
163
131
139
| 93,9 % (89; 97)
77,9 % (69,8; 84,6)
100 % (97,4; 100)
| 1 256 (917; 1 720)
63,3 (45,6; 87,9)
3 145
(2 637; 3 750)
|
47
53
59
| 87,2 % (74,3; 95,2)
100 % (93,3; 100)
100 % (93,9; 100)
| 137 (78,4; 238)
429 (328; 559)
9 016
(7 045; 11 537)
|
Y
| Po dávke
1(1)
Pred posilňo- vacou dávkou Po posilňo- vacej dávke(1)
|
163
131
139
| 98,8 % (95,6; 99,9)
88,5 % (81,8; 93,4)
100 % (97,4; 100)
| 1 470
(1 187; 1 821)
106 (76,4; 148)
2 749
(2 301; 3 283)
|
52
61
69
| 92,3 % (81,5; 97,9)
98,4 % (91,2; 100)
100 % (94,8; 100)
| 195 (118; 323)
389 (292; 518)
5 978
(4 747; 7 528)
|
|
|
Tabuľka 3: Titre rSBA a hSBA po jednorazovej dávke Nimenrixu u dojčiat vo veku 6 mesiacov a pred a po posilňovacej dávke vo veku 15 – 18 mesiacov (klinická štúdia MenACWY-TT-087)Analýza imunogenity sa uskutočnila na primárnej kohorte ATP.
*rSBA analýza vykonaná v laboratóriách PHE (PHE; Public Health England ) v UK
**hSBA analýza vykonaná v laboratóriách Neomed, Laval, Kanada
(1) vzorky krvi sa odobrali 1 mesiac po očkovaní
Meranie hSBA titrov bolo sekundárnym cieľovým ukazovateľom v klinickej štúdii MenACWY-TT-
087. Aj keď boli pozorované podobné odpovede na skupiny A a C pri oboch dávkovacích schémach,
jedna primárna dávka u dojčiat vo veku 6 mesiacov bola spojená s nižšími hSBA titrami proti skupinám W-135 a Y meranými percentuálnym zastúpením jedincov s titrami pri hSBA ≥ 8 [87,2 % (95 % IS: 74,3; 95,2) a 92,3 % (95 % IS: 81,5; 97,9)] v uvedenom poradí, v porovnaní s troma primárnymi dávkami vo veku 2, 4 a 6 mesiacov [100 % (95 % IS: 96,6; 100) a 100 % (95 % IS: 97,1;
100)] v uvedenom poradí (pozri časť 4.4). Po posilňovacej dávke boli titre pri hSBA u všetkých štyroch meningokokových skupín porovnateľné pre obe dávkovacie schémy. Výsledky sú uvedené
v tabuľke 3.
Imunogenita u batoliat vo veku 12 až 23 mesiacovV klinických štúdiách MenACWY-TT-039 a MenACWY-TT-040 jediná dávka Nimenrixu vyvolala
SBA titre proti štyrom skupinám meningokokov, pričom rSBA titre proti skupine C boli v percentuálnom vyjadrení jedincov s titrami rSBA ≥ 8 porovnateľné s titrami vyvolanými registrovanou
očkovacou látkou MenC-CRM. V klinickej štúdii MenACWY-TT-039 sa ako sekundárny cieľový ukazovateľ meralo aj hSBA. Výsledky sú uvedené v tabuľke 4.
Tabuľka 4: SBA* titre po jednorazovej dávke Nimenrixu (alebo MenC-CRM) u batoliat vo veku12 - 23 mesiacov (klinické štúdie MenACWY-TT-039/040)
Meningokoková skupina
|
Skupina
s očkovacou látkou
|
Štúdia MenACWY-TT-039 (1)
| Štúdia MenACWY-TT-040 (2)
|
rSBA*
| hSBA*
| rSBA*
|
N
| ≥ 8 (95 % IS)
| GMT (95 % IS)
|
N
| ≥ 8 (95 % IS)
| GMT (95 % IS)
|
N
| ≥ 8 (95 % IS)
| GMT (95 % IS)
|
A
|
Nimenrix
|
354
| 99,7% (98,4;
100)
| 2 205 (2 008;
2 422)
|
338
| 77,2 % (72,4;
81.6)
| 19,0 (16,4;
22,1)
|
183
| 98,4 % (95,3;
99,7)
| 3 170 (2 577;
3 899)
|
C
|
Nimenrix
|
354
| 99,7 % (98,4;
100)
| 478 (437;
522)
|
341
| 98,5 % (96,6;
99,5)
| 196 (175;
219)
|
183
| 97,3 % (93,7;
99,1)
| 829 (672;
1 021)
|
Očkovacia látka
MenC-CRM
|
121
| 97,5 % (92,9;
99,5)
| 212 (170;
265)
|
116
| 81,9 % (73,7;
88,4)
| 40,3 (29,5;
55,1)
|
114
| 98,2 % (93,8;
99,8)
| 691 (521;
918)
|
W-135
|
Nimenrix
|
354
| 100 % (99,0;
100)
| 2 682 (2 453;
2 932)
|
336
| 87,5 % (83,5;
90,8)
| 48,9 (41,2;
58,0)
|
186
| 98,4 % (95,4;
99,7)
| 4 022 (3 269;
4 949)
|
Y
|
Nimenrix
|
354
| 100 % (99,0;
100)
| 2 729 (2 473;
3 013)
|
329
| 79,3 % (74,5;
83,6)
| 30.9 (25,8;
37,1)
|
185
| 97,3 % (93,8;
99,1)
| 3 168 (2 522;
3 979)
|
Analýza imunogenity sa uskutočnila v ATP kohortách.
(1) vzorky krvi sa odobrali 42 až 56 dní po očkovaní
(2) vzorky krvi sa odobrali 30 až 42 dní po očkovaní
* SBA analýzy sa vykonávali v laboratóriách GSK
V klinickej štúdii MenACWY-TT-104 Nimenrix vyvolal rSBA titre proti všetkým štyrom meningokokovým skupinám po jednej alebo dvoch dávkach podávaných s 2-mesačným odstupom, ktoré boli podobné v percentuálnom vyjadrení jedincov s titrom rSBA ≥ 8 a GMT ako je uvedené
v tabuľke 5.
T
abuľka 5: rSBA a hSBA titre po jednej alebo dvoch dávkach Nimenrixu s prvou dávkou podávanou batoľatám vo veku 12 - 14 mesiacov (klinická štúdia MenACWY-TT-
104)
Meningokoková skupina
|
Skupina s dávkou očkovacej látky Nimenrix
|
Časový
bod
(1)
|
rSBA*
|
hSBA**
|
N
|
≥ 8 (95 % IS)
|
G
M
T
(9
5 % IS)
|
N
|
≥ 8 (95 % IS)
|
G
M
T
(9
5 % IS)
|
A
|
1 dávka
|
Po dávke 1
|
180
|
97,8 % (94,4;
99,4)
|
1 437 (1 118;
1 847)
|
74
|
95,9 % (88,6,
99,2)
|
118 (86,8;
161)
|
2 dávky
|
Po dávke 1
|
158
|
96,8 % (92,8;
99,0)
|
1 275 (970;
1 675)
|
66
|
97,0 % (89,5;
99,6)
|
133 (98;
180)
|
Po dávke 2
|
150
|
98,0 % (94,3;
99,6)
|
1 176 (921,8;
1 501)
|
66
|
97,0 % (89,5;
99,6)
|
170 (126;
230)
|
C
|
1 dávka
|
Po dávke 1
|
179
|
95,0 % (90,7;
97,7)
|
452 (346;
592)
|
78
|
98,7 % (93,1;
100)
|
152 (105;
220)
|
2 dávky
|
Po dávke 1
|
157
|
95,5 % (91,0;
98,2)
|
369 (281;
485)
|
70
|
95,7 % (88,0;
99,1)
|
161 (110;
236)
|
Po dávke 2
|
150
|
98,7 % (95,3;
99,8)
|
639 (522;
783)
|
69
|
100 % (94,8;
100)
|
1 753 (1 278;
2 404)
|
W-135
|
1 dávka
|
Po dávke 1
|
180
|
95,0 % (90,8;
97,7)
|
2 120 (1 601;
2 808)
|
72
|
62,5 % (50,3;
73,6)
|
27,5 (16,1;
46,8)
|
2 dávky
|
Po dávke 1
|
158
|
94,9 % (90,3;
97,8)
|
2 030 (1 511;
2 728)
|
61
|
68,9 % (55,7;
80,1)
|
26,2 (16,0;
43,0)
|
Po dávke 2
|
150
|
100 (97,6;
100)
|
3 533 (2 914;
4 283)
|
70
|
97,1% (90,1;
99,7)
|
757 (550;
1 041)
|
Y
|
1 dávka
|
Po dávke 1
|
180
|
92,8 % (88,0;
96,1)
|
951,8 (705;
1 285)
|
71
|
67,6% (55,5;
78,2)
|
41,2 (23,7;
71,5)
|
2 dávky
|
Po dávke 1
|
157
|
93,6 % (88,6;
96,9)
|
933 (692;
1 258)
|
56
|
64,3% (50,4;
76,6)
|
31,9 (17,6;
57,9)
|
Po dávke 2
|
150
|
99,3 % (96,3;
100)
|
1 134 (944;
1 360)
|
64
|
95,3% (86,9;
99,0)
|
513 (339;
775)
|
Analýza imunogenity sa uskutočnila v ATP kohorte.
(1) vzorky krvi sa odobrali 21 až 48 dní po očkovaní
* rSBA analýza vykonaná v laboratóriách PHE
**hSBA analýza vykonaná v laboratóriách GSK
V klinickej štúdii MenACWY-TT-104 sa merali hSBA titre ako sekundárny cieľový ukazovateľ. Nimenrixom vyvolané hSBA titre proti skupinám W-135 a Y boli vyššie v percentuálnom vyjadrení jedincov s titrom hSBA ≥ 8, keď boli podané dve dávky v porovnaní s jednou dávkou (pozri časť 4.4). Nimenrix vyvolával hSBA titre proti skupinám A a C, ktoré boli podobné v percentuálnom vyjadrení jedincov s titrom hSBA ≥ 8, keď sa podávali dve dávky, v porovnaní s jednou. Výsledky sú uvedené
v tabuľke 5.
rSBA a hSBA titre sa stanovovali v období 10 rokov u detí, ktoré na začiatku podstúpili očkovanie s jednou dávkou Nimenrixu alebo MenC-CRM vo veku 12 až 23 mesiacov v klinickej štúdii MenACWY-TT-027. Pretrvávanie SBA titrov sa vyhodnocovalo v dvoch predĺžených klinických štúdiách: MenACWY-TT-032 (do 5 rokov) a MenACWY-TT-100 (do 10 rokov) V klinickej štúdii MenACWY-TT-100 sa vyhodnocovala aj odpoveď na jedinú posilňovaciu dávku Nimenrixu podávanú 10 rokov po prvom očkovaní s Nimenrixom alebo MenC-CRM. Výsledky sú uvedené
v tabuľke 6 (pozri časť 4.4).
Meningoko ková skupi- na
| Skupina s očkova- cou
látkou
|
Ča-sový bod
| rSBA*
| hSBA**
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
A
|
Nimenrix
|
Mesiac 1(1)
|
222
| 100 % (98,4; 100)
| 3 707
(3 327; 4 129)
|
217
| 91,2 % (86,7; 94,6)
| 59,0 (49,3; 70,6)
|
Rok 4(2)
|
45
| 64,4 % (48,8; 78,1)
| 35,1 (19,4; 63,4)
|
44
| 52,3 % (36,7; 67,5)
| 8,8 (5,4; 14,2)
|
Rok 5(2)
|
49
| 73,5 % (58,9; 85,1)
| 37,4 (22,1; 63,2)
|
45
| 35,6 % (21,9; 51,2)
| 5,2 (3,4; 7,8)
| Rok 10(3)
(pred posil.)
|
62
| 66,1 % (53,0; 77,7)
| 28,9 (16,4; 51,0)
|
59
| 25,4 % (15,0; 38,4)
| 4,2 (3,0; 5,9)
| (po posil.)(3,4)
|
62
| 98,4 % (91,3; 100)
| 5 122
(3 726; 7 043)
|
62
| 100 % (94,2; 100)
| 1 534
(1 112; 2 117)
|
C
|
Nimenrix
|
Mesiac 1(1)
|
220
| 100 % (98,3; 100)
| 879 (779; 991)
|
221
| 99,1 % (96,8; 99,9)
| 190,0 (165; 219)
|
Rok 4(2)
|
45
| 97,8 % (88,2; 99,9)
| 110 (62,7; 192)
|
45
| 97,8 % (88,2; 99,9)
| 370 (214; 640)
|
Rok 5(2)
|
49
| 77,6 % (63,4; 88,2)
| 48,9 (28,5; 84,0)
|
48
| 91,7 % (80,0; 97,7)
| 216 (124; 379)
| Rok 10 (3)
(pred posil.)
|
62
| 82,3 % (70,5; 90,8)
| 128 (71,1; 231)
|
60
| 91,7 % (81,6; 97,2)
| 349 (197; 619)
|
(po posil.)(3,4)
|
62
|
100 % (94,2; 100)
|
7 164
(5 478; 9 368)
|
59
|
100 % (93,9; 100)
| 33 960 (23 890;
48 274)
|
Očkova- cia látka MenC- CRM
|
Mesiac 1(1)
|
68
| 98,5 % (92,1; 100)
| 415 (297; 580)
|
68
| 72,1 % (59,9; 82,3)
| 21,2 (13,9; 32,3)
|
Rok 4(2)
|
10
| 80,0 % (44,4; 97,5)
| 137 (22,6; 832)
|
10
| 70,0 % (34,8; 93,3)
| 91,9 (9,8; 859)
|
Rok 5(2)
|
11
| 63,6 % (30,8; 89,1)
| 26,5 (6,5; 107)
|
11
| 90,9 % (58,7; 99,8)
| 109 (21,2; 557)
| Rok 10 (3)
(pred posil.)
|
16
| 87,5 % (61,7; 98,4)
| 86,7 (29,0; 259)
|
15
| 93,3 % (68,1; 99,8)
| 117 (40,0; 344)
|
(po posil.)(3,4)
|
16
|
100 % (79,4; 100)
|
5 793
(3 631; 9 242)
|
15
|
100 % (78,2; 100)
| 42 559 (20 106;
90 086)
|
W-135
|
Nimenrix
|
Mesiac 1(1)
|
222
| 100 % (98,4; 100)
| 5 395
(4 870; 5 976)
|
177
| 79,7 % (73,0; 85,3)
| 38,8 (29,7; 50,6)
|
Rok 4(2)
|
45
| 60,0 % (44,3; 74,3)
| 50,8 (24,0; 108)
|
45
| 84,4 % (70,5; 93,5)
| 76,9 (44,0; 134)
|
Rok 5(2)
|
49
| 34,7 % (21,7; 49,6)
| 18,2 (9,3; 35,3)
|
46
| 82,6 % (68,6; 92,2)
| 59,7 (35,1; 101)
| Rok 10 (3)
(pred posil.)
|
62
| 30,6 % (19,6; 43,7)
| 15,8 (9,1; 27,6)
|
52
| 44,2 % (30,5; 58,7)
| 7,7 (4,9; 12,2)
|
|
|
Tabuľka 6: rSBA a hSBA titre po jednorazovej dávke Nimenrixu (alebo MenC-CRM) u batoliat vo veku 12 až 23 mesiacov, pretrvávanie až do 10 rokov a po podaní posilňovacej dávky 10 rokov po prvom očkovaní (klinické štúdie MenACWY-TT-027/032/100)
Men
ingoko
ková skupi- na
|
Skupina s
očkova- cou látkou
|
Ča-sový bod
|
rSBA*
|
hSBA**
|
N
|
≥ 8
(9
5 % IS)
|
G
M
T (95 % IS)
|
N
|
≥ 8
(9
5 % IS)
|
G
M
T (95 % IS)
|
(po posil.)(3,4)
|
62
|
100 % (94,2; 100)
|
25 911 (19 120;
35 115)
|
62
|
100 % (94,2; 100)
|
11 925
(8 716; 16 316)
|
Y
|
Nimenrix
|
Mesiac 1(1)
|
222
|
100 % (98,4; 100)
|
2 824
(2 529; 3 153)
|
201
|
66,7 % (59,7; 73,1)
|
24,4 (18,6; 32,1)
|
Rok 4(2)
|
45
|
62,2 % (46,5; 76,2)
|
44,9 (22,6; 89,3)
|
41
|
87,8 % (73,8; 95,9)
|
74,6 (44,5; 125)
|
Rok 5(2)
|
49
|
42,9 % (28,8; 57,8)
|
20,6 (10,9; 39,2)
|
45
|
80,0 % (65,4; 90,4)
|
70,6 (38,7; 129)
|
Rok 10 (3)
(pred posil.)
|
62
|
45,2 % (32,5; 58,3)
|
27,4 (14,7; 51,0)
|
56
|
42,9 % (29,7; 56,8)
|
9,1 (5,5; 15,1)
|
(po posil.)(3,4)
|
62
|
98,4 % (91,3; 100)
|
7 661 (5 263;
11 150)
|
61
|
100 % (94,1; 100)
|
12 154
(9 661; 15 291)
|
Analýza imunogenity sa uskutočňovala na ATP kohortách počas 1 mesiaca až 5 rokov po očkovaní
a v posilňovacej ATP kohorte. Jedinci so suboptimálnou odpoveďou na meningokokovú skupinu C (definovaná ako SBA titer pod vopred definovanou hraničnou hodnotou testu) mali dostať ďalšiu dávku MenC očkovacej látky pred 6. rokom. Títo jedinci boli vylúčení z analýzy v 4. roku a 5. roku, ale boli zahrnutí do analýzy
v 10. roku.
(1) Klinická štúdia MenACWY-TT-027 (2) Klinická štúdia MenACWY-TT-032 (3) Klinická štúdia MenACWY-TT-100
(4) vzorky krvi sa odoberali 1 mesiac po posilňovacej dávke v 10. roku.
* rSBA analýza vykonaná v laboratóriách GSK na vzorkách odobraných 1 mesiac po primárnom očkovaní a v laboratóriách PHE v UK pre nasledujúce časové body, v ktorých sa odoberali vzorky.
** hSBA analýza vykonaná v laboratóriách GSK a Neomed v Kanade pre časové body MenACWY-TT-100. odobratých
Pretrvávanie odpovede po posilňovacej dávkeKlinická štúdia MenACWY-TT-102 vyhodnocovala pretrvávanie SBA titrov až do 6 rokov
po posilňovacej dávke Nimenrixu alebo MenC-CRM197 podávaných deťom, ktoré na začiatku dostali rovnakú očkovaciu látku vo veku 12 až 23 mesiacov v klinickej štúdii MenACWY-TT-039. Jedna posilňovacia dávka sa podala 4 roky po začiatočnom očkovaní. Výsledky sú uvedené v tabuľke 7 (pozri časť 4.4).
Tabuľka 7: Titre SBA a hSBA po jednorazovej dávke Nimenrixu (alebo MenC-CRM) u batoliat vo vekuMenin- goko- ková
skupi-na
| Skupina s očkova- cou
látkou
|
Časový bod
| rSBA*
| hSBA**
|
N
|
≥8
(95 % IS)
|
GMT (95 % IS)
|
N
|
≥8
(95 % IS)
|
GMT (95 % IS)
|
A
|
Nimenrix
|
Mesiac 1(1)
|
354
| 99,7 % (98,4; 100)
| 2205 (2008; 2422)
|
338
| 77,2 % (72,4; 81,6)
| 19,0 (16,4; 22,1)
| Rok 4(2) (pred posil. Nimenrixom)
|
212
|
74,5 % (68,1; 80,2)
|
112 (80,3; 156)
|
187
| 28,9 % (22,5; 35,9)
|
4,8 (3,9; 5,9)
|
(po posil.)(2,3)
|
214
| 100 % (98,3; 100)
| 7173 (6389; 8054)
|
202
| 99,5 % (97,3; 100)
| 1343 (1119; 1612)
| 5 rokov
po posilňovacej dávke(4)
|
137
|
89,8 % (83,4; 94,3)
|
229 (163; 322)
|
135
|
53,3 % (44,6; 62,0)
|
13.2 (9,6; 18,3)
| 6 rokov
po posilňovacej dávke(4)
|
134
|
92,5 % (86,7; 96,4)
|
297 (214; 413)
|
130
|
58,5 % (49,5; 67,0)
|
14.4 (10,5; 19,7)
|
C
|
Nimenrix
|
Mesiac 1(1)
|
354
| 99,7 % (98,4; 100)
| 478 (437; 522)
|
341
| 98,5 % (96.6; 99.5)
| 196 (175; 219)
|
|
|
12-23 mesiacov, pretrvávanie v 4.roku a odpoveď po posilňovacej dávke 4 roky po prvom očkovaní (klinické štúdie MenACWY-TT-039/048/102)'
Tabuľka 7: Titre SBA a hSBA po jednorazovej dávke Nimenrixu (alebo MenC-CRM) u batoliat vo veku
Meni
n- goko- ková
skupi-na
|
Skupina s
očkova- cou
látkou
|
Časov
ý bod
|
rSBA*
|
hSBA**
|
N
|
≥8
(9
5 % IS)
|
G
M
T (95 % IS)
|
N
|
≥8
(9
5 % IS)
|
G
M
T (95 % IS)
|
Rok 4(2) (pred posil. Nimenrixom)
|
213
|
39,9 % (33,3; 46,8)
|
12,1 (9,6; 15,2)
|
200
|
73,0 % (66,3; 79,0)
|
31,2 (23,0; 42,2)
|
(po posil.)(2,3)
|
215
|
100 % (98,3; 100)
|
4512 (3936; 5172)
|
209
|
100 % (98,3; 100)
|
15831 (13626; 18394)
|
5 rokov
po posilňovacej dávke(4)
|
137
|
80,3 % (72,6; 86,6)
|
66,0 (48,1; 90,5)
|
136
|
99,3 % (96,0; 100)
|
337 (261; 435)
|
6 rokov
po posilňovacej dávke(4)
|
134
|
71,6 % (63,2; 79,1)
|
39,6 (28,6; 54,6)
|
130
|
97,7 % (93,4; 99,5)
|
259 (195; 345)
|
Men
C- CRM očkovacia látka
|
Mesiac 1(1)
|
121
|
97,5 % (92,9; 99,5)
|
212 (170; 265)
|
116
|
81,9 % (73,7; 88,4)
|
40,3 (29,5; 55,1)
|
Rok 4(2)
(Pre-MenC- CRM197 booster)
|
43
|
37,2 % (23,0; 53,3)
|
14.3 (7,7; 26,5)
|
31
|
48.4 % (30,2; 66,9)
|
11.9 (5,1; 27,6)
|
(Po posil.)(2,3)
|
43
|
100 % (91,8; 100)
|
3718 (2596; 5326)
|
33
|
100 % (89,4; 100)
|
8646 (5887; 12699)
|
5 rokov
po posilňovacej dávke(4)
|
23
|
78,3 % (56,3; 92,5)
|
47,3 (19,0; 118)
|
23
|
100 % (85,2; 100)
|
241 (139; 420)
|
6 rokov po posilňovacej dávke(4)
|
23
|
65,2 % (42,7; 83,6)
|
33,0 (14,7; 74,2)
|
23
|
95,7 % (78,1; 99,9)
|
169 (94,1; 305)
|
W-135
|
Nimenrix
|
Mesiac 1(1)
|
354
|
100 % (99,0; 100)
|
2682 (2453; 2932)
|
336
|
87,5 % (83,5; 90,8)
|
48,9 (41,2; 58,0)
|
Rok 4(2) (pred posil. Nimenrixom)
|
213
|
48,8 % (41,9; 55,7)
|
30,2 (21,9; 41,5)
|
158
|
81,6 % (74,7; 87,3)
|
48.3 (36,5; 63,9)
|
(Po posil.)(2,3)
|
215
|
100 % (98,3; 100)
|
10950 (9531; 12579)
|
192
|
100 % (98,1; 100)
|
14411 (12972; 16010)
|
5 rokov
po posilňovacej dávke(4)
|
137
|
88,3 % (81,7; 93,2)
|
184 (130; 261)
|
136
|
100 % (97,3; 100)
|
327 (276; 388)
|
6 rokov
po posilňovacej dávke(4)
|
134
|
85,8 % (78,7; 91,2)
|
172 (118; 251)
|
133
|
98,5 % (94,7; 99,8)
|
314 (255; 388)
|
Y
|
Nimenrix
|
Mesiac 1(1)
|
354
|
100 % (99,0; 100)
|
2729 (2473; 3013)
|
329
|
79,3 % (74,5; 83,6)
|
30,9 (25,8; 37,1)
|
Rok 4(2) (pred posil. Nimenrixom)
|
213
|
58,2 % (51,3; 64,9)
|
37.3 (27.6; 50.4)
|
123
|
65,9 % (56,8; 74,2)
|
30,2 (20,2; 45,0)
|
(Po posil.)(2,3)
|
215
|
100 % (98,3; 100)
|
4585 (4129; 5093)
|
173
|
100 % (97,9; 100)
|
6776 (5961; 7701)
|
5 rokov po posilňovacej dávke(4)
|
137
|
92,7 % (87,0; 96,4)
|
265 (191; 368)
|
137
|
97,8 % (93,7; 99,5)
|
399 (321; 495)
|
6 rokov po posilňovacej dávke(4)
|
134
|
94,0 % (88,6; 97,4)
|
260 (189; 359)
|
131
|
97,7 % (93,5; 99,5)
|
316 (253; 394)
|
|
|
12-23 mesiacov, pretrvávanie v 4.roku a odpoveď po posilňovacej dávke 4 roky po prvom očkovaní (klinické štúdie MenACWY-TT-039/048/102)
Analýza imunogenity sa uskutočňovala na ATP kohorte pre každý časový bod.
(1) Klinická štúdia MenACWY-TT-039
(2) Klinická štúdia MenACWY-TT-048
(3) vzorky krvi sa odoberali 1 mesiac po posilňovacej dávke v 4. roku.
(4) Klinická štúdia MenACWY-TT-102
* rSBA analýza vykonaná v laboratóriách GSK na vzorkách odobraných 1 mesiac po primárnom očkovaní a v laboratóriách PHE v UK pre nasledujúce časové body, v ktorých sa odoberali vzorky.
** hSBA analýza vykonaná v laboratóriách GSK a Neomed v Kanade pre časové body MenACWY-TT-102.
Imunogenita u detí vo veku 2 až 10 rokovV klinickej štúdii MenACWY-TT-081 sa preukázala noninferiorita jedinej dávky Nimenrixu oproti
ďalšej registrovanej očkovacej látke MenC-CRM v zmysle odpovede na skupinu C vyvolanej očkovacou látkou [94,8 % (95 % IS: 91,4; 97,1) a resp. 95,7 % (95 % IS: 89,2; 98,8)]. GMT protilátok
boli nižšie v skupine s Nimenrixom [2 795 (95 % IS: 2 393; 3 263)] oproti skupine s očkovacou látkou
MenC-CRM [5 292 (95 % IS: 3 815; 7 340)].
V klinickejštúdii MenACWY-TT-038 sa preukázala noninferiorita jedinej dávky Nimenrixu
oproti registrovanej očkovacej látke ACWY-PS v zmysle odpovede na štyri skupiny meningokokov, ako je uvedené v tabuľke 8).
Tabuľka 8: Titre rSBA* po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u detí vo veku2 až 10 rokov (klinická štúdia MenACWY-TT-038)Mening okoková skupina
| Nimenrix(1)
| Očkovacia látka ACWY-PS(1)
|
N
| VR
(95 % IS)
| GMT (95 % IS)
|
N
| VR
(95 % IS)
| GMT (95 % IS)
|
A
|
594
| 89,1 % (86,3; 91,5)
| 6 343
(5 998; 6 708)
|
192
| 64,6 % (57,4; 71,3)
| 2 283
(2 023; 2 577)
|
C
|
691
| 96,1 % (94,4; 97,4)
| 4 813
(4 342; 5 335)
|
234
| 89,7 % (85,1; 93,3)
| 1 317
(1 043; 1 663)
|
W-135
|
691
| 97,4 % (95,9; 98,4)
| 11 543
(10 873; 12 255)
|
236
| 82,6 % (77,2; 87,2)
| 2 158
(1 815; 2 565)
|
Y
|
723
| 92,7 % (90,5; 94,5)
| 10 825
(10 233; 11 452)
|
240
| 68,8 % (62,5; 74,6)
| 2 613
(2 237; 3 052)
|
Analýza imunogenity sa uskutočnila v ATP kohorte.
(1) vzorky krvi sa odoberali 1 mesiac po očkovaní
VR: odpoveď na očkovaciu látku definovaná ako podiel jedincov s:
· titrami rSBA ³32 u jedincov, ktorí boli na začiatku séronegatívni (t.j. titre rSBA pred očkovaním < 8)
· najmenej 4-násobným zvýšením titrov rSBA od obdobia pred očkovaním po obdobie po očkovaní u jedincov, ktorí boli na začiatku séropozitívni (t.j. titre rSBA pred očkovaním ≥ 8)
* rSBA analýza vykonaná v laboratóriách GSK
Pretrvávanie SBA titrov sa hodnotilo u detí, ktoré na začiatku podstúpili očkovanie v klinickej štúdii
MenACWY-TT-081, ako je uvedené v tabuľke 9 (pozri časť 4.4).
Men
ingo koková skupina
|
Skupina
s očkovacou látkou
|
Časový
bod (me- siace)
|
rSBA*
|
hSBA**
|
N
|
≥ 8
(9
5 % IS)
|
G
M
T (95 % IS)
|
N
|
≥ 8
(9
5 % IS)
|
G
M
T (95 % IS)
|
A
|
Nimenrix
|
32
|
193
|
86,5 % (80,9; 91,0)
|
196 (144; 267)
|
90
|
25,6 % (16,9; 35,8)
|
4,6 (3,3; 6,3)
|
44
|
189
|
85,7 % (79,9; 90,4)
|
307 (224; 423)
|
89
|
25,8 % (17,1; 36,2)
|
4,8 (3,4; 6,7)
|
C
|
Nimenrix
|
32
|
192
|
64,6 % (57,4; 71,3)
|
34,8 (26,0; 46,4)
|
90
|
95,6 % (89,0; 98,8)
|
75,9 (53,4; 108)
|
44
|
189
|
37,0 % (30,1; 44,3)
|
14,5 (10,9; 19,2)
|
82
|
76,8 % (66,2; 85,4)
|
36,4 (23,1; 57,2)
|
Očkovaciu látku
Men
C-CRM
|
32
|
69
|
76,8 % (65,1; 86,1)
|
86,5 (47,3; 158)
|
33
|
90,9 % (75,7; 98,1)
|
82,2 (34,6; 196)
|
44
|
66
|
45,5 % (33,1; 58,2)
|
31,0 (16,6; 58,0)
|
31
|
64,5 % (45,4; 80,8)
|
38,8 (13,3; 113)
|
W-135
|
Nimenrix
|
32
|
193
|
77,2 % (70,6; 82,9)
|
214 (149; 307)
|
86
|
84,9 % (75,5; 91,7)
|
69,9 (48,2; 101)
|
44
|
189
|
68,3 %
(61,1; 74,8)
|
103
(72,5; 148)
|
87
|
80,5 %
(70,6; 88,2)
|
64,3
(42,7; 96,8)
|
Y
|
Nimenrix
|
32
|
193
|
81,3 % (75,1; 86,6)
|
227 (165; 314)
|
91
|
81,3 % (71,8; 88,7)
|
79,2 (52,5; 119)
|
44
|
189
|
62,4 % (55,1; 69,4)
|
78,9 (54,6; 114)
|
76
|
82,9 % (72,5; 90,6)
|
127 (78,0; 206)
|
|
|
Tabuľka 9: rSBA a hSBA titre až do 44 mesiacov po Nimenrixe (alebo MenC-CRM) u detí, ktoré mali v čase očkovania 2 až 10 rokov (klinická štúdia MenACWY-TT-088)
Analýza imunogenity sa uskutočnila v ATP kohorte určenej pre hodnotenie pretrvávania imunitnej odpovede
upravenej vzhľadom na každý časový bod.
* rSBA analýza vykonaná v laboratóriách PHE v UK
** hSBA analýza vykonanáv laboratóriách GSK
Pretrvávanie hSBA titrov sa hodnotilo 1 rok po očkovaní u detí vo veku 6 až 10 rokov, ktoré na začiatku podstúpili očkovanie v klinickej štúdii MenACWY-TT-027 (tabuľka 9) (pozri časť 4.4).
Tabuľka 10: hSBA* titre po jedinej dávke Nimenrixu (alebo ACWY-PS) u detí vo veku6 až 10 rokov a pretrvávanie 1 rok po očkovaní (klinické štúdie MenACWY-TT-Meni ngok o- ková skup
ina
|
Skupina
s očkovacou látkou
|
1 mesiac po očkovaní
(štúdia MenACWY-TT-027)
| Pretrvávanie imunitnej odpovede po 1 roku
(štúdia MenACWY-TT-028)
|
N
|
³ 8
(95 % IS)
|
GMT (95 % IS)
|
N
|
³ 8
(95 % IS)
|
GMT (95 % IS)
|
A
|
Nimenrix
|
105
| 80,0 % (71,1; 87,2)
| 53,4 (37,3; 76,2)
|
104
| 16,3 % (9,8; 24,9)
| 3,5 (2,7; 4,4)
| Očkovacia látka ACWY-PS
|
35
|
25,7 % (12,5; 43,3)
| 4,1 (2,6; 6,5)
|
35
|
5,7 % (0,7; 19,2)
| 2,5 (1,9; 3,3)
|
C
|
Nimenrix
|
101
| 89,1 % (81,3; 94,4)
| 156 (99,3; 244)
|
105
| 95,2 % (89,2; 98,4)
| 129 (95,4; 176)
| Očkovacia látka ACWY-PS
|
38
|
39,5 % (24,0; 56,6)
|
13,1 (5,4; 32,0)
|
31
|
32,3 % (16,7; 51,4)
|
7,7 (3,5; 17,3)
|
W-1
35
|
Nimenrix
|
103
| 95,1 % (89,0; 98,4)
| 133 (99,9; 178)
|
103
| 100 % (96,5; 100)
| 257 (218; 302)
| Očkovacia látka ACWY-PS
|
35
|
34,3 % (19,1; 52,2)
|
5,8 (3,3; 9,9)
|
31
|
12,9 % (3,6; 29,8)
|
3,4 (2,0; 5,8)
|
Y
|
Nimenrix
|
89
| 83,1 % (73,7; 90,2)
| 95,1 (62,4; 145)
|
106
| 99,1 % (94,9; 100)
| 265 (213; 330)
| Očkovacia
| 32
| 43,8 %
| 12,5
| 36
| 33,3 %
| 9,3
|
|
|
027/028)
Meni
ngok o- ková skup ina
|
Skupina
s očkovacou látkou
|
1 mesiac po očkovaní
(štúdia MenACWY-TT-027)
|
Pr
etrvávanie imunitnej odpovede po 1 roku
(štúdia MenACWY-TT-028)
|
N
|
³ 8
(95 % IS)
|
G
M
T (95 % IS)
|
N
|
³ 8
(95 % IS)
|
G
M
T (95 % IS)
|
látka
ACWY-PS
|
|
(26,4; 62,3)
|
(5,6; 27,7)
|
|
(18,6; 51,0)
|
(4,3; 19,9)
|
Analýza imunogenity sa uskutočnila v ATP kohorte počas pretrvávania v 1. roku.
hSBA analýza sa nevykonávala pre deti vo veku 2 až < 6 rokov (v čase očkovania).
*hSBA analýza vykonaná v laboratóriách GSK
SBA titre sa stanovovali počas 10 rokov u detí, ktoré sa na začiatku očkovali s jednou dávkou Nimenrixu alebo ACWY-PS vo veku 2 až 10 rokov v klinickej štúdii MenACWY-TT-027. Pretrvávanie SBA titrov sa vyhodnocovalo v dvoch predĺžených klinických štúdiách: Men ACWY- TT-032 (až do 5 rokov) a MenACWY-TT-100 (až do 10 rokov). V klinickej štúdii MenACWY-TT-
100 sa vyhodnocovala aj odpoveď na jedinú posilňovaciu dávku Nimenrixu podávanú 10 rokov po začiatočnom očkovaní s Nimenrixom alebo ACWY-PS. Výsledky sú uvedené v tabuľke 11 (pozri
časť 4.4).
Tabuľka 11:
rSBA a hSBA titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u detí vo veku 2 -Meningo koková skupina
| Skupina
s očkovaco u látkou
|
Časový bod
| rSBA*
| hSBA**
|
N
| ≥ 8
(95 % IS)
| GMT (95 % IS)
|
N
| ≥ 8
(95 % IS)
| GMT (95 % IS)
|
A
|
Nimenrix
|
Mesiac 1(1)
|
225
| 100 % (98,4; 100)
| 7 301
(6 586; 8 093)
|
111(5)
| 81,1% (72,5; 87,9)
| 57,0 (40,3; 80,6)
|
Rok 5(2)
|
98
| 90,8 % (83,3; 95,7)
| 141 (98,2; 203)
|
n/a(6)
|
--
|
--
|
Rok 6(3)
|
98
| 79,6 % (70,3; 87,1)
| 107 (66,0; 174)
|
90
| 41,1 % (30,8; 52,0)
| 6,5 (4,8; 8,8)
| Rok 10(3)
(pred posil.)
|
73
| 89,0 % (79,5; 95,1)
| 96,3 (57,1; 163)
|
62
| 33,9 % (22,3; 47,0)
| 4,5 (3,3; 6,2)
|
(po posil.)(3,4)
|
74
| 95,9 % (88,6; 99,2)
| 4 626
(3 041; 7 039)
|
73
| 100 % (95,1; 100)
| 1 213 (994; 1 481)
|
Očkovacia látka ACWY-PS
|
Mesiac 1(1)
|
75
| 100 % (95,2; 100)
| 2 033
(1 667; 2 480)
|
35(5)
| 25,7 % (12,5; 43,3)
| 4,1 (2,6; 6,5)
|
(2)
|
13
| 15,4 % (1,9; 45,4)
| 4,7 (3,7; 6,0)
|
(6)
|
--
|
--
|
Rok 6(3)
|
24
| 12,5 % (2,7; 32,4)
| 5,8 (3,5; 9,6)
|
21
| 33,3 % (14,6; 57,0)
| 5,9 (3,0; 11,7)
| Rok 10(3)
(pred posil.)
|
17
| 23,5 % (6,8; 49,9)
| 8,0 (3,3; 19,3)
|
17
| 29,4 % (10,3; 56,0)
| 6,2 (2,4; 15,7)
|
(po posil.)(3,4)
|
17
| 100 % (80,5; 100)
| 6 414
(3 879; 10 608)
|
17
| 100 % (80,5; 100)
| 211 (131; 340)
|
C
|
Nimenrix
|
Mesiac 1(1)
|
225
| 100 % (98,4; 100)
| 2 435
(2 106; 2 816)
|
107(5)
| 89,7 % (82,3; 94,8)
| 155 (101; 237)
|
|
|
10 rokov, pretrvávanie až do 10 rokov a po podaní posilňovacej dávky 10 rokov po začiatočnom očkovaní (klinické štúdie MenACWY-TT-027/032/100)
Rok 5
n/a
Tabuľka 11:
rSBA a hSBA titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u detí vo veku 2 -Meningo koková skupina
| Skupina
s očkovaco u látkou
|
Časový bod
| rSBA*
| hSBA**
|
N
| ≥ 8
(95 % IS)
| GMT (95 % IS)
|
N
| ≥ 8
(95 % IS)
| GMT (95 % IS)
|
Rok 5(2)
|
98
| 90,8 % (83,3; 95,7)
| 79,7 (56,0; 113)
|
n/a(6)
|
--
|
--
|
Rok 6(3)
|
98
| 82,7 % (73,7; 89,6)
| 193 (121; 308)
|
97
| 93,8 % (87,0; 97,7)
| 427 (261; 700)
| Rok 10(3)
(pred posil.)
|
74
| 85,1 % (75,0; 92,3)
| 181 (106; 310)
|
73
| 91,8 % (83,0; 96,9)
| 222 (129; 380)
|
(po posil.)(3,4)
|
74
| 100 % (95,1; 100)
| 4 020
(3 319; 4 869)
|
71
| 100 % (94,9; 100)
| 15 544
(11 735; 20 588)
|
Očkovacia látka ACWY-PS
|
Mesiac 1(1)
|
74
| 100 % (95,1; 100)
| 750 (555; 1 014)
|
38(5)
| 39,5 % (24,0; 56,6)
| 13,1 (5,4; 32,0)
|
Rok 5(2)
|
13
| 100 % (75,3; 100)
| 128 (56,4; 291)
|
n/a(6)
|
--
|
--
|
Rok 6(3)
|
24
| 79,2 % (57,8; 92,9)
| 98,7 (42,2; 231)
|
24
| 100 % (85,8; 100)
| 235 (122; 451)
| Rok 10(3)
(pred posil.)
|
17
| 76,5 % (50,1; 93,2)
| 96,2 (28,9; 320)
|
17
| 100,0 % (80,5; 100)
| 99,1 (35,8; 274)
|
(po posil.)(3,4)
|
17
|
100 % (80,5; 100)
|
15 101
(7 099; 32 122)
|
17
|
94,1 (71,3; 99,9)
| 44 794 (10 112;
198 440)
|
W-135
|
Nimenrix
|
Mesiac 1(1)
|
225
| 100 % (98,4; 100)
| 11 777
(10 666; 13 004)
|
107(5)
| 95,3 % (89,4; 98,5)
| 134 (101; 178)
|
Rok 5(2)
|
98
| 78,6 % (69,1; 86,2)
| 209 (128; 340)
|
n/a(6)
|
--
|
--
|
Rok 6(3)
|
98
| 73,5 % (63,6; 81,9)
| 265 (155; 454)
|
92
| 81,5 % (72,1; 88,9)
| 62,5 (42,0; 93,1)
| Rok 10(3)
(pred posil.)
|
74
| 68,9 % (57,1; 79,2)
| 206 (109; 392)
|
59
| 61,0 % (47,4; 73,5)
| 17,5 (10,5; 29,2)
|
(po posil.)(3,4)
|
74
| 100 % (95,1; 100)
| 27 944
(22 214; 35 153)
|
74
| 100 % (95,1; 100)
| 6 965
(5 274; 9 198)
|
Očkovacia látka ACWY-PS
|
Mesiac 1(1)
|
75
| 100 % (95,2; 100)
| 2 186
(1 723; 2 774)
|
35(5)
| 34,3 % (19,1; 52,2)
| 5,8 (3,3, 9,9)
|
(2)
|
13
| 0 % (0,0; 24,7)
| 4,0 (4,0; 4,0)
|
(6)
|
--
|
--
|
Rok 6(3)
|
24
| 12,5 % (2,7; 32,4)
| 7,6 (3,7; 15,6)
|
23
| 30,4 % (13,2; 52,9)
| 7,0 (2,9; 16,9)
| Rok 10(3)
(pred posil.)
|
17
| 23,5 % (6,8; 49,9)
| 15,4 (4,2; 56,4)
|
15
| 26,7 % (7,8; 55,1)
| 4,1 (2,0; 8,5)
|
(po posil.)(3,4)
|
17
| 94,1 % (71,3; 99,9)
| 10 463
(3 254; 33 646)
|
15
| 100 % (78,2; 100)
| 200 (101; 395)
|
Y
|
Nimenrix
|
Mesiac 1(1)
|
225
| 100 % (98,4; 100)
| 6 641
(6 044; 7 297)
|
94(5)
| 83,0 % (73,8; 89,9)
| 93,7 (62,1; 141)
|
Rok 5(2)
|
98
| 78,6 % (69,1; 86,2)
| 143 (88,0; 233)
|
n/a(6)
|
--
|
--
|
Rok 6(3)
|
98
| 71,4 % (61,4; 80,1)
| 136 (82,6; 225)
|
89
| 65,2 % (54,3; 75,0)
| 40,3 (23,9; 68,1)
| Rok 10(3)
(pred posil.)
|
74
| 67,6 % (55,7; 78,0)
| 98,5 (54,3; 179)
|
65
| 72,3 % (59,8; 82,7)
| 35,7 (21,0; 60,6)
|
(po posil.)(3,4)
|
74
| 100 % (95,1; 100)
| 7 530
(5 828; 9 729)
|
74
| 100 % (95,1; 100)
| 11 127
(8 909; 13 898)
|
Očkovacia látka ACWY-PS
|
(1)
|
75
| 100 % (95,2; 100)
| 1 410
(1 086; 1 831)
|
(5)
| 43,8 % (26,4; 62,3)
| 12,5 (5,6; 27,7)
|
Rok 5(2)
|
13
| 7,7 % (0,2; 36,0)
| 5,5 (2,7; 11,1)
|
n/a(6)
|
--
|
--
|
Rok 6(3)
|
24
| 20,8 % (7,1; 42,2)
| 11,6 (4,7; 28,7)
|
24
| 25,0 % (9,8; 46,7)
| 7,3 (2,7; 19,8)
|
|
|
10 rokov, pretrvávanie až do 10 rokov a po podaní posilňovacej dávky 10 rokov po začiatočnom očkovaní (klinické štúdie MenACWY-TT-027/032/100)
Rok 5
n/a
Mesiac 1 32
Tabuľka 11:
rSBA a hSBA titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u detí vo veku 2 -Meningo koková skupina
| Skupina
s očkovaco u látkou
|
Časový bod
| rSBA*
| hSBA**
|
N
| ≥ 8
(95 % IS)
| GMT (95 % IS)
|
N
| ≥ 8
(95 % IS)
| GMT (95 % IS)
| Rok 10(3)
(pred posil.)
|
17
| 17,6 % (3,8; 43,4)
| 10,2 (3,5; 30,2)
|
14
| 35,7 % (12,8; 64,9)
| 7,8 (2,5; 24,4)
|
(po posil.)(3,4)
|
17
| 100 % (80,5; 100)
| 6 959
(3 637; 13 317)
|
17
| 100 % (80,5; 100)
| 454 (215; 960)
|
|
|
10 rokov, pretrvávanie až do 10 rokov a po podaní posilňovacej dávky 10 rokov po začiatočnom očkovaní (klinické štúdie MenACWY-TT-027/032/100)Analýza imunogenity sa uskutočňovala na ATP kohorte pre každý časový bod. Jedinci so suboptimálnou
odpoveďou na meningokokovú skupinu C (definovaná ako SBA titer pod vopred definovanou hraničnou hodnotou testu) mali dostať ďalšiu dávku MenC očkovacej látky pred 6. rokom. Títo jedinci boli vylúčení z analýzy v 5. roku, ale boli zahrnutí do analýzy v 6. roku a 10. roku.
(1) Klinická štúdia MenACWY-TT-027 (2) Klinická štúdia MenACWY-TT-032 (3) Klinická štúdia MenACWY-TT-100
(4) vzorky krvi sa odoberali 1 mesiac po posilňovacej dávke v 10. roku.
(5) vrátane detí vo veku 6 až < 11 rokov. hSBA analýza sa nevykonávala pre deti vo veku 2 až < 6 rokov
(v čase očkovania).
(6) podľa protokolu pre klinickú štúdiu MenACWY-TT-032, hSBA sa pre túto vekovú skupinu nemeralo v 5. roku.
* rSBA analýza vykonaná v laboratóriách GSK na vzorkách odobraných 1 mesiac po primárnom očkovaní a v laboratóriách PHE v UK pre nasledujúce časové body, v ktorých sa odoberali vzorky.
** hSBA analýza vykonaná v laboratóriách GSK a v Neomed v Kanade pre časové body MenACWY-TT-100.
Imunogenita u dospievajúcich vo veku 11 až 17 rokov a u dospelých vo veku ≥ 18 rokovV dvoch klinických štúdiách, ktoré boli vykonané s dospievajúcimi vo veku 11 až 17 rokov (štúdia
MenACWY-TT-036) a s dospelými vo veku 18 až 55 rokov (štúdia MenACWY-TT-035), bola podaná buď jedna dávka Nimenrixu, alebo jedna dávka očkovacej látky ACWY-PS.
Preukázala sa imunologická noninferiorita Nimenrixu oproti očkovacej látke ACWY-PS v zmysle odpovede na očkovaciu látku uvedenú v tabuľke 11.
Tabuľka 12: Titre rSBA* po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u dospievajúcich vo veku 11 - 17 rokov a u dospelých vo veku 18 až 55 rokov (klinické štúdie MenACWY-TT-035/36)
Men
ingok oková skupina
|
Skupina
s očkovaco u látkou
|
Klinická štúdia MenACWY-TT-036 (11 – 17 rokov)
(1)
|
Klinická štúdia MenACWY-TT-035 (18 – 55 rokov)
(1)
|
N
|
VR
(9
5 % IS)
|
G
M
T (95 % IS)
|
N
|
VR
(9
5 % IS)
|
G
M
T (95 % IS)
|
A
|
Nimenrix
|
553
|
85,4 % (82,1; 88,2)
|
5 928
(5 557; 6 324)
|
743
|
80,1 % (77,0; 82,9)
|
3 625
(3 372; 3 897)
|
O
čkovacia látka ACWY-PS
|
191
|
77,5 % (70,9; 83,2)
|
2 947
(2 612; 3 326)
|
252
|
69,8 % (63,8; 75,4)
|
2 127
(1 909; 2 370)
|
C
|
Nimenrix
|
642
|
97,4 % (95,8; 98,5)
|
13 110
(11 939; 14 395)
|
849
|
91,5 % (89,4; 93,3)
|
8 866
(8 011; 9 812)
|
O
čkovacia látka ACWY-PS
|
211
|
96,7 % (93,3; 98,7)
|
8 222
(6 807; 9 930)
|
288
|
92,0 % (88,3; 94,9)
|
7 371
(6 297; 8 628)
|
W-135
|
Nimenrix
|
639
|
96,4 % (94,6; 97,7)
|
8 247
(7 639; 8 903)
|
860
|
90,2 % (88,1; 92,1)
|
5 136
(4 699; 5 614)
|
O
čkovacia látka ACWY-PS
|
216
|
87,5 % (82,3; 91,6)
|
2 633
(2 299; 3 014)
|
283
|
85,5 % (80,9; 89,4)
|
2 461
(2 081; 2 911)
|
Y
|
Nimenrix
|
657
|
93,8 % (91,6; 95,5)
|
14 086
(13 168; 15 069)
|
862
|
87,0 % (84,6; 89,2)
|
7 711
(7 100; 8 374)
|
O
čkovacia látka ACWY-PS
|
219
|
78,5 % (72,5; 83,8)
|
5 066
(4 463; 5 751)
|
288
|
78,8 % (73,6; 83,4)
|
4 314
(3 782; 4 921)
|
Analýza imunogenity sa uskutočnila v ATP kohorte.
(1) vzorky krvi sa odoberali 1 mesiac po očkovaní
VR: odpoveď na očkovaciu látku definovaná ako podiel jedincov s:
· rSBA titre ³ 32 pre jedincov, ktorí boli na začiatku séronegatívni (tzn. rSBA titre pred očkovaním < 8)
· najmenej 4-násobné zvýšenie rSBA titrov z titrov pred očkovaním na titre po očkovaní pre jedincov, ktorí boli na začiatku séropozitívni (tzn. rSBA titre pred očkovaním ³ 8)
* rSBA analýza vykonaná v laboratóriách GSK
rSBA titre sa stanovovali počas 10 rokov u jedincov, ktorí sa na začiatku očkovali jednou dávkou Nimenrixu alebo ACWY-PS vo veku 11 až 17 rokov v štúdii MenACWY-TT-036. Pretrvávanie rSBA titrov sa vyhodnocovalo v dvoch predĺžených štúdiách: Men ACWY-TT-043 (až do 5 rokov)
a MenACWY-TT-101 (až do 10 rokov). V klinickej štúdii MenACWY-TT-101 sa vyhodnocovala aj odpoveď na jedinú posilňovaciu dávku Nimenrixu podanú 10 rokov po začiatočnom očkovaní
s Nimenrixom alebo ACWY-PS. Výsledky sú uvedené v tabuľke 13.
Tabuľka 13: rSBA* titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS) u dospievajúcich vo veku 11 až 17 rokov, pretrvávanie až do 10 rokov a po podaní posilňovacej dávky 10 rokov po začiatočnom očkovaní (klinické štúdie MenACWY-TT-
036/043/100)
Meningo koková skupina
|
Časový bod
|
Nimenrix
|
ACW
Y
-
P
S očkovacia látka
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
N
|
≥ 8
(95 % IS)
|
GMT (95 % IS)
|
A
|
Mesiac 1(1)
|
674
|
100 % (99,5; 100)
|
5 929
(5 557; 6 324)
|
224
|
99,6 % (97,5; 100)
|
2 947
(2 612; 3 326)
|
Rok 3(2)
|
449
|
92,9 % (90,1; 95,1)
|
448 (381; 527)
|
150
|
82,7 % (75,6; 88,4)
|
206 (147; 288)
|
Rok 5(2)
|
236
|
97,5 % (94,5; 99,1)
|
644 (531; 781)
|
86
|
93,0 % (85,4; 97,4)
|
296 (202; 433)
|
Rok 10(3)
(pred posil.)
|
162
|
85,2 % (78,8; 90,3)
|
248 (181; 340)
|
51
|
80,4 % (66,9; 90,2)
|
143 (80,5; 253)
|
(po posil.)(3,4)
|
162
|
100 % (97,7; 100)
|
3 760
(3 268; 4 326)
|
51
|
100 % (93,0; 100)
|
2 956
(2 041; 4 282)
|
C
|
Mesiac 1(1)
|
673
|
100 % (99,5; 100)
|
13 110
(11 939; 14 395)
|
224
|
100 % (98,4; 100)
|
8 222
(6 808; 9 930)
|
Rok 3(2)
|
449
|
91,1 % (88,1; 93,6)
|
371 (309; 446)
|
150
|
86,0 % (79,4; 91,1)
|
390 (262; 580)
|
Rok 5(2)
|
236
|
88,6 % (83,8; 92,3)
|
249 (194; 318)
|
85
|
87,1 % (78,0; 93,4)
|
366 (224; 599)
|
Rok 10(3)
(pred posil.)
|
162
|
90,1 % (84,5; 94,2)
|
244 (182; 329)
|
51
|
82,4 % (69,1; 91,6)
|
177 (86,1; 365)
|
(po posil.)(3,4)
|
162
|
100 % (97,7; 100)
|
8 698
(7 391; 10 235)
|
51
|
100 % (93,0; 100)
|
3 879
(2 715; 5 544)
|
W-135
|
Mesiac 1(1)
|
678
|
99,9 % (99,2; 100)
|
8 247
(7 639; 8 903)
|
224
|
100 % (98,4; 100)
|
2 633
(2 299; 3 014)
|
Rok 3(2)
|
449
|
82,0 % (78,1; 85,4)
|
338 (268; 426)
|
150
|
30,0 % (22,8; 38,0)
|
16,0 (10,9; 23,6)
|
Rok 5(2)
|
236
|
86,0 % (80,9; 90,2)
|
437 (324; 588)
|
86
|
34,9 % (24,9; 45,9)
|
19,7 (11,8; 32,9)
|
Rok 10(3)
(pred posil.)
|
162
|
71,6 % (64,0; 78,4)
|
146 (97,6; 217)
|
51
|
43,1 % (29,3; 57,8)
|
16,4 (9,2; 29,4)
|
(po posil.)(3,4)
|
162
|
100 % (97,7; 100)
|
11 243
(9 367; 13 496)
|
51
|
100 % (93,0; 100)
|
3 674
(2 354; 5 734)
|
Y
|
Mesiac 1(1)
|
677
|
100 % (99,5; 100)
|
14 087
(13 168; 15 069)
|
224
|
100 % (98,4; 100)
|
5 066
(4 463; 5 751)
|
Rok 3(2)
|
449
|
93,1 % (90,3; 95,3)
|
740 (620; 884)
|
150
|
58,0 % (49,7; 66,0)
|
69,6 (44,6; 109)
|
Rok 5(2)
|
236
|
96,6 % (93,4; 98,5)
|
1 000 (824; 1 214)
|
86
|
66,3 % (55,3; 76,1)
|
125 (71,2; 219)
|
Rok 10(3)
(pred posil.)
|
162
|
90,7 % (85,2; 94,7)
|
447 (333; 599)
|
51
|
49,0 % (34,8; 63,4)
|
32,9 (17,1; 63,3)
|
(po posil.)(3,4)
|
162
|
100 % (97,7; 100)
|
7 585
(6 748; 8 525)
|
51
|
98,0 % (89,6; 100)
|
3 296
(1 999; 5 434)
|
Analýza imunogenity sa uskutočnila v ATP kohorte pre každý časový bod. (1) Klinická štúdia MenACWY-TT-036
(2) Klinická štúdia MenACWY-TT-043 (3) Klinická štúdia MenACWY-TT-101
(4) vzorky krvi sa odoberali 1 mesiac po posilňovacej dávke v 10. roku.
* rSBA analýza vykonaná v laboratóriách GSK na vzorkách 1 mesiac po primárnej vakcinácii a v laboratóriách
PHE v Spojenom kráľovstve pre nasledujúce časové body, v ktorých sa odoberali vzorky.
Pretrvávanie hSBA sa hodnotilo do 5 rokov po očkovaní u dospievajúcich a dospelých, ktorí na začiatku podstúpili očkovanie v štúdii MenACWY-TT-052, ako je uvedené v tabuľke 13 (pozri časť
4.4).
Tabuľka 14: hSBA* titre po jednorazovej dávke Nimenrixu u dospievajúcich a dospelých vo veku 11 až 25 rokov a pretrvávanie až do 5 rokov po očkovaní (klinickéštúdie MenACWY-TT-052/059)
Meningokoková skupina
|
Časový bod
|
N
|
³ 8 (95 % IS)
|
GMT (95 % IS)
|
A
| Mesiac 1(1)
| 356
| 82,0 % (77,6; 85,9)
| 58,7 (48,6; 70,9)
|
Rok 1(2)
| 350
| 29,1 % (24,4; 34,2)
| 5,4 (4,5; 6,4)
|
Rok 5(2)
| 141
| 48,9 % (40,4; 57,5)
| 8,9 (6,8; 11,8)
|
C
| Mesiac 1(1)
| 359
| 96,1 % (93,5; 97,9)
| 532 (424; 668)
|
Rok 1(2)
| 336
| 94,9 % (92,0; 97,0)
| 172 (142; 207)
|
Rok 5(2)
| 140
| 92,9 % (87,3; 96,5)
| 94,6 (65,9; 136)
|
W-135
| Mesiac 1(1)
| 334
| 91,0 % (87,4; 93,9)
| 117 (96,8; 141)
|
Rok 1(2)
| 327
| 98,5 % (96.5; 99,5)
| 197 (173; 225)
|
Rok 5(2)
| 138
| 87,0 % (80,2; 92,1)
| 103 (76,3; 140)
|
Y
| Mesiac 1(1)
| 364
| 95,1 % (92,3; 97,0)
| 246 (208; 291)
|
Rok 1(2)
| 356
| 97,8 % (95,6; 99,0)
| 272 (237; 311)
|
Rok 5(2)
| 142
| 94,4 % (89,2; 97,5)
| 225 (174; 290)
|
Analýza imunogenity sa uskutočnila v ATP kohorte určenej pre hodnotenie pretrvávania imunitnej odpovede upravenej vzhľadom na každý časový bod.
(1) štúdia MenACWY-TT-052 (2) štúdia MenACWY-TT-059
*hSBA analýza vykonaná v laboratóriách GSK
rSBA titre sa stanovovali počas 10 rokov u jedincov, ktorí sa na začiatku očkovali s jednou dávkou Nimenrixu alebo ACWY-PS vo veku 11 až 55 rokov v štúdii MenACWY-TT-015. Pretrvávanie rSBA titrov sa vyhodnocovalo v dvoch predĺžených štúdiách: Men ACWY-TT-020 (až do 5 rokov)
a MenACWY-TT-099 (až do 10 rokov). V štúdii MenACWY-TT-099 sa vyhodnocovala aj odpoveď na jedinú posilňovaciu dávku Nimenrixu podávanú 10 rokov po začiatočnom očkovaní s Nimenrixom
alebo ACWY-PS. Výsledky sú uvedené v tabuľke 14.
Tabuľka 15: rSBA* titre po jednorazovej dávke Nimenrixu (alebo ACWY-PS)
u dospievajúcich a dospelých vo veku 11 až 55 rokov, pretrvávanie až do 10 rokov a po podaní posilňovacej dávky 10 rokov po začiatočnom
očkovaní (štúdie MenACWY-TT-015/020/099)
Meningo koková skupina
|
Časový bod
|
Nimenrix
|
Očkovacia látka ACWY-PS
|
N
|
≥ 8
(95 % IS)
|
GMT
(95 % IS)
|
N
|
≥ 8
(95 % IS)
|
GMT
(95 % IS)
|
A
|
Mesiac 1(1)
|
323
|
100 %
(98,9; 100)
|
4 945
(4 452, 5 493)
|
112
|
100 %
(96,8, 100)
|
2 190
(1 858, 2 582)
|
Rok 4(2)
|
43
|
95,3 %
(84,2; 99,4)
|
365
(226; 590)
|
17
|
76,5 %
(50,1; 93,2)
|
104
(31,0; 351)
|
Rok 5(2)
|
51
|
84,3 %
(71,4; 93,0)
|
190
(108; 335)
|
19
|
57,9 %
(33,5; 79,7)
|
37,0
(12,6; 109)
|
Rok 10(3)
(pred posil.)
|
155
|
78,1 %
(70,7; 84,3)
|
154
(108; 219)
|
52
|
71,2 %
(56,9; 82,9)
|
75,1
(41,4; 136)
|
(po posil.)(3,4)
|
155
|
100 %
(97,6; 100)
|
4 060
(3 384; 4 870)
|
52
|
100 %
(93,2; 100)
|
3 585
(2 751; 4 672)
|
C
|
Mesiac 1(1)
|
341
|
99,7 %
(98,4; 100)
|
10 074
(8 700, 11 665)
|
114
|
100 %
(96,8; 100)
|
6 546
(5 048; 8 488)
|
Rok 4(2)
|
43
|
76,7 %
(61,4; 88,2)
|
126
(61,6; 258)
|
17
|
41,2 %
(18,4; 67,1)
|
16,7
(5,7; 48,7)
|
(2)
|
51
|
72,5 %
(58,3; 84,1)
|
78,5
(41,8; 147)
|
18
|
38,9 %
(17,3; 64,3)
|
17,3
(6,0; 49,7)
|
Rok 10(3)
(pred posil.)
|
154
|
90,9 %
(85,2; 94,9)
|
193
(141; 264)
|
52
|
88,5 %
(76,6; 95,6)
|
212
(110; 412)
|
(po posil.)(3,4)
|
155
|
100 % (97,6; 100)
|
13 824
(10 840;
17 629)
|
52
|
98,1 % (89,7; 100)
|
3 444
(1 999; 5 936)
|
W-135
|
Mesiac 1(1)
|
340
|
99,7 %
(98,4; 100)
|
8 577
(7 615; 9 660)
|
114
|
100 %
(96,8; 100)
|
2 970
(2 439; 3 615)
|
Rok 4(2)
|
43
|
90,7 %
(77,9; 97,4)
|
240
(128; 450)
|
17
|
17,6 %
(3,8; 43,4)
|
8,3
(3,6; 19,5)
|
(2)
|
51
|
86,3 %
(73,7; 94,3)
|
282
(146; 543)
|
19
|
31,6 %
(12,6; 56,6)
|
15,4
(5,7; 41,9)
|
Rok 10(3)
(pred posil.)
|
154
|
71,4 %
(63,6; 78,4)
|
166
(107; 258)
|
52
|
21,2 %
(11,1; 34,7)
|
10,9
(6,1; 19,3)
|
(po posil.)(3,4)
|
155
|
100 % (97,6; 100)
|
23 431
(17 351;
31 641)
|
52
|
98,1 % (89,7; 100)
|
5 793
(3 586; 9 357)
|
Y
|
Mesiac 1(1)
|
340
|
100 % (98,9; 100)
|
10 315
(9 317; 11 420)
|
114
|
100 % (96,8; 100)
|
4 574
(3 864; 5 414)
|
Rok 4(2)
|
43
|
86,0 % (72,1; 94,7)
|
443 (230; 853)
|
17
|
47,1 % (23,0; 72,2)
|
30,7 (9,0; 105)
|
Rok 5(2)
|
51
|
92,2 % (81,1; 97,8)
|
770 (439; 1 351)
|
19
|
63,2 % (38,4; 83,7)
|
74,1 (21,9; 250)
|
Rok 10(3)
(pred posil.)
|
154
|
86,4 % (79,9; 91,4)
|
364 (255; 519)
|
52
|
61,5 % (47,0; 74,7)
|
56,0 (28,8; 109)
|
(po posil.)(3,4)
|
155
|
100 % (97,6; 100)
|
8 958
(7 602; 10 558)
|
52
|
100 % (93,2; 100)
|
5 138
(3 528; 7 482)
|
|
|
Rok 5
Rok 5
Analýza imunogenity sa uskutočnila v ATP kohortách počas 1 mesiaca až 5 rokov po očkovaní a v posilňovacej
ATP kohorte.
(1) štúdia MenACWY-TT-015 (2) štúdia MenACWY-TT-020 (3) štúdia MenACWY-TT-099
(4) vzorky krvi sa odoberali 1 mesiac po posilňovacej dávke v 10. roku.
*rSBA analýza vykonaná v laboratóriách GSK na vzorkách 1 mesiac po primárnej vakcinácii a v laboratóriách
PHE v Spojenom kráľovstve pre nasledujúce časové body, v ktorých sa odoberali vzorky.
V samostatnej klinickej štúdii (MenACWY-TT-085) jedna dávka Nimenrixu bola podaná 194
dospelým Libanončanom vo veku od 56 rokov (vrátane 133 vo veku od 56 do 65 rokov a 61 vo veku >
65 rokov). Percento jedincov s titrami rSBA (zmerané v laboratóriách GSK) ≥ 128 pred očkovaním bolo v rozsahu od 45 % (skupina C) do 62 % (skupina Y). Celkovo 1 mesiac po očkovaní percento s
titrami rSBA ≥ 128 bolo v rozsahu od 93 % (skupina C) do 97 % (skupina Y). V podskupine vo veku
> 65 rokov percento s titrami rSBA ≥128 1 mesiac po očkovaní bolo v rozsahu od 90 % (skupina A)
do 97 % (skupina Y).
Odpoveď na podanie posilňovacej dávky jedincom, ktoré sa v minulosti očkovali konjugovanoumeningokokovou očkovacou látkou proti Neisseria meningitidis
Očkovanie s posilňovacou dávkou Nimenrixu sa študovalo u jedincov vo veku od 12 mesiacov, ktorí
podstúpili základné očkovanie s monovalentnou (MenC-CRM) alebo kvadrivalentnou konjugovanou meningokokovou očkovacou látkou (MenACWY-TT). Pozorovali sa mohutné pamäťové odpovede na
antigén(y) pri základnom očkovaní (pozri tabuľky 6, 10, 12 a 14).
Štúdie MenACWY-TT-048 a 102 vyhodnocovali pretrvávanie SBA titrov až do 6 rokov po posilňovacej dávke Nimenrixu alebo MenC-CRM197 podávaných deťom, ktoré na začiatku dostali rovnakú očkovaciu látku vo veku 12 až 23 mesiacov v štúdii MenACWY-TT-039. Jediná posilňovacia dávka sa podala 4 roky po začiatočnom očkovaní. Výsledky sú uvedené v tabuľke 15 (pozri časť 4.4).
Odpoveď na Nimenrix u jedincov v minulosti očkovaných čistou polysacharidovou očkovacou látkouproti Neisseria meningitidis
V štúdii MenACWY-TT-021 vykonanej s jedincami vo veku 4,5 až 34 rokov bola imunogenita
Nimenrixu podaného 30 až 42 mesiacov po očkovaní očkovacou látkou ACWY-PS porovnaná
s imunogenitou Nimenrixu podaného jedincom rovnakého veku, ktorí v predchádzajúcich 10 rokoch neboli očkovaní žiadnou meningokokovou očkovacou látkou. Imunitná odpoveď (titer rSBA ≥ 8) na
všetky štyri skupiny meningokokov sa zistila u všetkých jedincov bez ohľadu na to, či v minulosti boli
alebo neboli očkovaní meningokokovou očkovacou látkou. GMT rSBA boli významne nižšie
u jedincov, ktorým bola podaná dávka očkovacej látky ACWY-PS 30 - 42 mesiacov pred podaním Nimenrixu, avšak 100 % jedincov dosiahlo titre rSBA ≥ 8 pri všetkých štyroch skupinách meningokokov (A, C, W-135, Y) (pozri časť 4.4).
Deti (vo veku 2 až 17 rokov) s anatomickou alebo funkčnou aspléniou
Štúdia MenACWY-TT-084 porovnávala imunitné odpovede na dve dávky Nimenrixu podávané s 2-
mesačným odstupom u 43 jedincov vo veku 2 až 17 rokov s anatomickou alebo funkčnou aspléniou s imunitnými odpoveďami 43 jedincov zodpovedajúceho veku s normálnou funkciou sleziny. Jeden mesiac po očkovaní prvou dávkou a 1 mesiac po druhej dávke boli v oboch skupinách podobné percentá jedincov, ktorí mali rSBA titre ≥ 8 a ≥ 128 a hSBA titre ≥ 4 a ≥ 8.
5.2 Farmakokinetické vlastnosti
Neaplikovateľné.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe štúdií lokálnej tolerancie, akútnej toxicity, toxicity
po opakovanom podávaní, vývojovej/reprodukčnej toxicity a fertility neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Prášok:
Sacharóza
Trometamol
Rozpúšťadlo:
Chlorid sodný
Voda na injekciu
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
4 roky
Po rekonštitúcii:
Očkovacia látka sa má po rekonštitúcii použiť okamžite. Aj keď odklad sa neodporúča, stabilita
očkovacej látky po rekonštitúcii bola preukázaná počas 8 hodín pri teplote 30 °C. Ak sa nepoužije v priebehu 8 hodín, očkovaciu látku nepodávajte.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C - 8 °C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom. Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Prášok v injekčnej liekovke (sklo typu I) s uzáverom (butylkaučuk) a rozpúšťadlo v injekčnej liekovke
(sklo typu I) s uzáverom (butylkaučuk). Veľkosť balenia po 50 ks.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pokyny na rekonštitúciu očkovacej látky s rozpúšťadlom dodaným v inejkčných liekovkách
Nimenrix sa musí rekonštituovať pridaním celého obsahu injekčnej liekovky s rozpúšťadlom do
injekčnej liekovky obsahujúcej prášok.
1. Natiahnite celý obsah injekčnej liekovky s rozpúšťadlom do injekčnej striekačky a pridajte rozpúšťadlo do injekčnej liekovky s práškom.
2. Zmes sa musí dôkladne pretrepať, až kým sa prášok v rozpúšťadle úplne nerozpustí.
Rekonštituovaná očkovacia látka je číry bezfarebný roztok.
Pred podaním sa má rekonštituovaná očkovacia látka opticky skontrolovať na prítomnosť cudzorodých častíc a/alebo zmenu fyzikálneho vzhľadu. V prípade ich výskytu sa má očkovacia látka zlikvidovať.
Očkovacia látka sa má po rekonštitúcii použiť okamžite.
Na podanie očkovacej látky sa má použiť nová ihla.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIPfizer Europe MA EEIG Boulevard de la Plaine 17
1050 Bruxelles
Belgicko
8. REGISTRAČNÉ ČÍSLAEU/1/12/767/008
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. apríla 2012
Dátum posledného predĺženia registrácie: 16. februára 2017
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu