
podávania
Neuraceq je určený na intravenózne použitie a na použitie ako jednorazová dávka.
Aktivita florbetabenu (18F) sa musí odmerať aktivimetrom (kalibrátorom dávky) tesne pred injekčným
podaním.
Florbetaben (18F) sa nesme riediť.
Dávka sa podáva vo forme injekcie pomalého intravenózneho bolusu (6 sek/ml), po ktorom nasleduje prepláchnutie približne 10 ml injekčného roztoku chloridu sodného 9 mg/ml (0,9 %), aby sa zaistilo podanie celej dávky. Ak je objem injekcie v rozmedzí 0,5 a 1 ml, majú sa použiť iba striekačky príslušnej veľkosti (1 ml) a striekačku je nutné prepláchnuť roztokom chloridu sodného (pozri
časť 12).
Injekčná aplikácia florbetabenu (18F) musí byť intravenózna, aby sa predišlo ožiareniu v dôsledku
lokálneho preniknutia mimo cievy a tiež aby nedošlo k zobrazovacím artefaktom.
Snímkovanie
20-minútové PET zobrazenie sa má začať získavať približne 90 minút po aplikácii intravenóznej injekcie florbetabenu (18F).
Pacient má ležať na chrbte s umiestnením hlavy v zornom poli PET skenera tak, aby bol vycentrovaný mozog vrátane malého mozgu. Na obmedzenie pohybov hlavy môžeme použiť pásku alebo iné flexibilné upnutie hlavy. Rekonštrukcia má zahŕňať korekciu útlmu s výslednou veľkosťou transaxiálnych pixlov medzi 2,0 a 3,0 mm.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
O
dôvodnenie individuálneho prínosu/rizika
Expozícia každého pacienta žiareniu musí byť odôvodnená pravdepodobným prínosom. Aplikovaná aktivita má byť v každom prípade len taká nízka, aby ešte umožnila získať potrebné diagnostické informácie.
Porucha funkcie obličieka porucha funkcie pečeneU týchto pacientov treba starostlivo zvážiť pomer prínosu a rizika, pretože môže dôjsť k zvýšenej expozícii žiareniu. Florbetaben (18F) sa primárne vylučuje prostredníctvom hepatobiliárneho systému a u pacientov s poruchou funkcie pečene môže nastať zvýšená expozícia žiareniu. Pozri tiež časť 4.2.
Pediatrická populáciaPre informácie o použití u pediatrickej populácie pozri časti 4.2 alebo 5.1.
Interpretácia snímok získaných pomocou NeuracequSnímky získané pomocou Neuracequ majú interpretovať iba hodnotitelia vyškolení v hodnotení PET snímok s florbetabenom (18F). Negatívny sken zobrazuje veľmi malé množstvo alebo žiadnu hustotu kortikálnych β-amyloidových plakov. Pozitívny sken zobrazuje strednú až často sa vyskytujúcu hustotu. Boli pozorované chyby v interpretácii zobrazenia v dôsledku nesprávneho odhadu výskytu hustoty mozgových β-amyloidových neuritických plakov, vrátane falošne negatívnych a falošne pozitívnych výsledkov.
PET snímky sa čítajú v transaxiálnej orientácii s použitím šedej stupnice. Hodnotiteľ by mal porovnať intenzitu signálu šedej hmoty kôry s maximálnou intenzitou signálu bielej hmoty. Snímky je potrebné čítať systematicky (Obrázok 1), od úrovne malého mozgu a posúvať sa nahor cez laterálne temporálne a frontálne laloky do oblasti posterior cingulate cortex a precuneus, a nakoniec do parietálneho laloku.
Interpretácia snímok sa vykonáva vizuálnym porovnaním aktivity v kortikálnej šedej hmote s aktivitou priľahlej bielej hmoty mozgovej kôry. Každá z týchto oblastí mozgu, laterálno-temporálna, frontálna, posteriórne cingulum, precuneus a parietálne laloky, sa musí systematicky vizuálne posúdiť
a ohodnotiť podľa skóre vychytávania rádioaktívneho indikátora v oblasti kôry (RCTU) (Tabul´ka 1).
Tabuľka 1: Definície vychytávania rádioaktívneho indikátora v oblasti kôry (RCTU)Skóre vychytávania rádioaktívneho indikátora v oblasti kôry
|
Stav, ktorý treba posúdiť
|
1 (Žiadne vychytávanie indikátora)
| Vychytávanie indikátora (t.j. intenzita signálu) v šedej hmote v danej oblasti je slabšie ako v bielej hmote.
|
2 (Mierne vychytávanie indikátora)
| Menšie oblasti vychytávania indikátora sú rovnaké alebo silnejšie ako tie prítomné v bielej hmote: rozšírenie za okraj bielej hmoty do vonkajšieho okraja kôry je prítomné na väčšine rezov hodnotenej oblasti.
|
3 (Výrazné vychytávanie indikátora)
| Veľká splývavá oblasť vychytávania indikátora, ktorá je rovnaká alebo silnejšia ako v bielej hmote a rozširuje sa za lem bielej hmoty do vonkajšieho okraja kôry. Zahŕňa celú oblasť
a je na väčšine rezov príslušnej oblasti.
|
Poznámka: Na pridelenie skóre vychytávania rádioaktívneho indikátora v kôre musia byť nálezy prítomné na väčšine rezov skúmanej oblasti.
O
brázok 1: Prípady PET s Neuraceqom, ktoré ukazujú príklady negatívneho PET skenu s florbetabenom (
18
F
) (horný riadok) a pozitívneho skenu (spodný riadok).
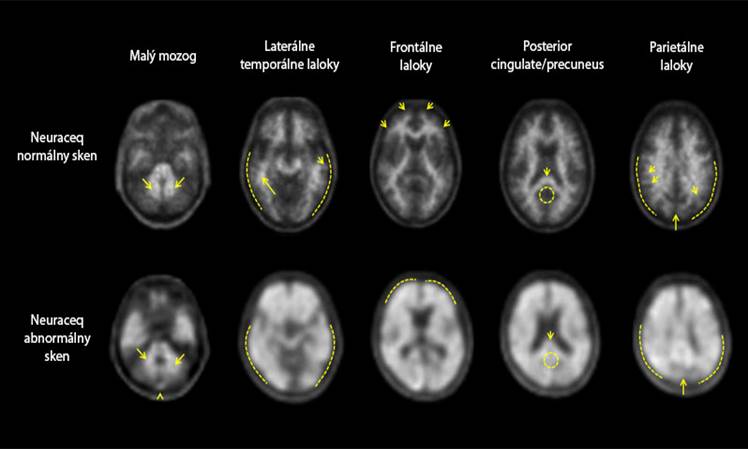
Celkové rozhodnutie pri vizuálnom hodnotení PET skenu vychádza z posúdenia pacienta
a z binárneho výsledku ‘pozitívny’ alebo ‘negatívny‘. Pacient sa posudzuje ako „pozitívny“ alebo
„negatívny“ na základe skóre zaťaženia mozgu amyloidovými plakmi BAPL (Tabuľka 2), ktoré je odvodené zo skóre RCTU v štyroch oblastiach mozgu (Tabuľka 1).
Tabuľka 2: Definície zaťaženia mozgu amyloidovými plakmi (BAPL)Hodnotenie
|
Skóre BAPL
|
Pravidlo pre hodnotenie
|
Negatívny sken
| 1
| Sken bez beta-amyloidových depozitov
| Skóre RCTU 1 v každej zo 4 oblastí mozgu (laterálno-temporálne laloky, frontálne laloky, oblasti posterior cingulum/precuneus, parietálne laloky)
|
Pozitívny sken
| 2
| Sken s miernym výskytom beta-amyloidových depozitov
| Skóre RCTU 2 v niektorej alebo
vo všetkých 4 oblastiach mozgu a žiadne skóre 3 v týchto 4 oblastiach mozgu
|
3
| Sken s výrazným výskytom beta-amyloidových depozitov
| Skóre RCTU 3 v aspoň jednej zo 4 oblastí mozgu
|
Obmedzenia pri používaníPozitívny sken sám osebe nepostačuje na stanovenie diagnózy AD či iných kognitívnych porúch, pretože depozity neuritických plakov v šedej hmote môžu byť prítomné u asymptomatických starších osôb alebo pri niektorých neurodegeneratívnych demenciách (Alzheimerova choroba, demencia s Lewyho telieskami, demencia pri Parkinsonovej chorobe).
Pre obmedzenie pri použití u pacientov s miernou kognitívnou poruchou (MCI – „mild cognitive impairment“) pozri časť 5.1.
Účinnosť florbetabenu (18F) pri predvídaní vzniku AD alebo monitorovaní odpovedí na liečbu nebola potvrdená (pozri časť 5.1).
Niektoré skeny môžu byť ťažko interpretovateľné v dôsledku obrazového šumu, atrofie so stenčenou vrstvou kôry (angl. „cortical ribbon“) alebo v dôsledku rozmazania obrazu, ktoré môžu viesť
k chybám v interpretácii. V prípadoch, keď sa nedá presne zistiť umiestnenie šedej hmoty alebo rozhrania medzi šedou a bielou hmotou na PET skene a máme k dispozícii súčasne zaznamenanú snímku zhotovenú počítačovou tomografiou CT alebo magnetickou rezonanciou MR, musí hodnotiteľ preskúmať zlúčenú snímku PET-CT alebo PET-MR, aby mohol objasniť vzťah medzi PET rádioaktivitou a anatómiou šedej hmoty.
V niektorých prípadoch bolo zistené zvýšené vychytávanie v extracerebrálnych štruktúrach, ako sú napríklad tvár a koža na hlave. Niekedy možno pozorovať reziduálnu aktivitu v midsagitálnom sínuse (pozri časť 5.2).
Po vyšetrení
V priebehu prvých 24 hodín po podaní injekcie má byť obmedzený blízky kontakt pacienta s
dojčatami a tehotnými ženami.
Špeciálne upozornenie
Jedna dávka tohto lieku obsahuje až 1,5 mmol sodíka (t.j. 33 mg). Toto treba vziať do úvahy u
pacientov, ktorí majú diétu s obmedzeným obsahom sodíka.
Jedna dávka tohto lieku obsahuje 15 objemových % etanolu (alkoholu), t.j. až 1,2 g, čo zodpovedá
30 ml piva alebo 12,5 ml vína na jednu dávku. Toto množstvo môže byť škodlivé pre osoby trpiace alkoholizmom a má sa brať do úvahy aj u tehotných alebo dojčiacich žien a u vysoko rizikových skupín osôb, akými sú pacienti s ochorením pečene alebo epilepsiou.
Opatrenia týkajúce sa rizika pre životné prostredie nájdete v časti 6.6.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie in vivo.
Nebola zistená žiadna signifikantná väzba pri hodnoteniach väzby rádioligandu s použitím širokého spektra zvieracích a ľudských receptorov, iontových kanálov a transportérov.
Štúdie in vitro s použitím ľudských pečeňových mikrozómov nenaznačili žiadnu potenciálnu inhibíciu enzýmového systému cytochrómu P450.
4.6 Fertilita, gravidita a laktácia
Ženyvreprodukčnomveku
V prípade plánovaného podania rádiofarmák u žien v reprodukčnom veku je dôležité zistiť, či táto žena je alebo nie je tehotná. Každá žena, ktorej vynechala menštruácia, musí byť pokladaná za tehotnú, až do času, kým nie je dokázaný opak. V prípade pochybností o jej možnej gravidite (ak žene vynechala menštruácia, ak je menštruácia veľmi nepravidelná atď.), sa pacientke majú ponúknuť alternatívne metódy, ktoré nevyužívajú ionizujúce žiarenie (ak sú k dispozícii).
Gravidita
Postupy využívajúce rádioaktívne nuklidy vykonávané u tehotných žien sú spojené s dávkou žiarenia, ktorej je vystavený aj plod. Preto sa v období gravidity majú vykonávať iba nevyhnutné vyšetrenia, u ktorých pravdepodobný prínos výrazne prevyšuje riziko, ktorému je vystavená matka a plod.
Neuskutočnili sa žiadne štúdie u tehotných žien. Neuskutočnili sa žiadne štúdie u zvierat, ktoré by
skúmali reprodukčný účinok florbetabenu (18F) (pozri časť 5.3).
Laktácia
Nie je známe, či sa florbetaben (18F) počas dojčenia vylučuje do ľudského mlieka. Pred podaním rádiofarmák dojčiacej matke treba zvážiť možnosť neskoršieho podania rádioaktívneho nuklidu, keď matka prestane dojčiť, a treba tiež zvážiť, aké je najvhodnejšie rádiofarmakum vzhľadom k sekrécii aktivity do materského mlieka. Ak sa podanie rádiofarmaka považuje za potrebné, dojčenie sa má na 24 hodín prerušiť a odsaté mlieko zlikvidovať.
V priebehu počiatočných 24 hodín po podaní injekcie treba vylúčiť úzky kontakt s deťmi.
Fertilita
Neuskutočnili sa žiadne štúdie fertility.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuraceq nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Zhrnutie bezpečnostnéhoprofilu
Celkový bezpečnostný profil Neuracequ vychádza z údajov z 978 podaní Neuracequ 872 subjektom a
12 subjektom, ktorí dostali vehikulum. Pri opakovanom podávaní s intervalom 1 rok sa ukázalo, že neboli rozdiely v bezpečnostnom profile po prvej, druhej alebo tretej dávke.
Zoznam nežiaducich reakcií
Frekvencie výskytu nežiaducich reakcií sú definované ako veľmi časté (≥1/10); časté (≥1/100 až
<1/10); menej časté (≥1/1000 až <1/100); zriedkavé (≥1/10 000 až <1/1000); veľmi zriedkavé
(<1/10 000); neznáme (nedajú sa určiť z dostupných údajov). Hoci sa môžu v skutočnosti vyskytovať
v nižších frekvenciách než je uvedené nižšie, rozsah zdrojovej databázy neumožnil vykonať priradenie nižších frekvenčných kategórií než je kategória „menej časté“ (≥1/1000 až <1/100).
Poruchy nervového systému
Menej časté: pocity pálenia, bolesť hlavy, neuralgia, tras
Poruchy ciev
Menej časté: návaly tepla, hematóm, hypotenzia
Gastrointestinálne poruchy
Menej časté: hnačka, nauzea
Poruchypečeneažlčovýchciest
Menej časté: abnormálna funkcia pečene
Poruchy kože a podkožného tkaniva
Menej časté: hyperhydróza, vyrážka, kožné toxicity
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Menej časté: nepríjemné pocity v končatinách, bolesť v končatinách
Celkové poruchy a reakcie v mieste podania
Časté: podráždenie v mieste podania a bolesť v mieste podania
Menej časté: erytém v mieste podania, bolesť v mieste zavedenia katétra, nepríjemné pocity v mieste aplikácie injekcie, erytém v mieste aplikácie injekcie, hematóm v mieste aplikácie injekcie, pocit tepla
v mieste podania injekcie, reakcia v mieste vpichu, bolesť v mieste prepichnutia cievy, únava, pocit tepla, pyrexia
LaboratórneafunkčnévyšetreniaMenej časté: zvýšenie kreatinínu v krvi
Expozícia ionizujúcemu žiareniu súvisí s rozvojom zhubných nádorov a s rizikom vzniku dedičných
porúch. Pri podaní odporúčanej aktivity 300 MBq florbetabenu (18F) je účinná dávka približne
5,8 mSv, a preto je malá pravdepodobnosť výskytu týchto nežiaducich účinkov.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieKeďže každá dávka obsahuje len malé množstvo florbetabenu (18F), neočakáva sa, že by predávkovanie viedlo k farmakologickým účinkom. V prípade predávkovania ožiarením sa má dávka absorbovaná pacientom, pokiaľ to je možné, znížiť zvýšením eliminácie rádioaktívneho nuklidu z tela častým močením a častou defekáciou. Môže pomôcť odhad účinnej dávky, ktorá bola aplikovaná.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: diagnostické rádiofarmaká, centrálna nervová sústava; ATC kód: V09AX06
MechanizmusúčinkuFlorbetaben (18F) sa viaže na β-amyloidové neuritické plaky v mozgu.
In vitro vykazuje florbetaben (18F) nanomolárnu väzobnú afinitu k syntetickým β-amyloidovým vláknam a AD mozgovému homogenátu. Navyše bola väzba florbetabenu (18F) k β-amyloidovým plakom v rezoch mozgu mŕtvych pacientov s AD preukázaná pomocou autorádiografie a podporená imunohistochemicky alebo Bielschowského farbením.
Kvantitatívna korelácia
in vivo nebola stanovená u pacientov v terminálnej fáze života medzi vychytávaním florbetabenu(18F) v šedej hmote kôry a depozitamiβ-amyloidových plakov u vzoriek z autopsie.
In vivo väzba florbetabenu (18F) k ostatným amyloidovým štruktúram alebo k iným štruktúram alebo receptorom mozgu zostáva nejasná.
FarmakodynamickéúčinkyPri nízkych chemických koncentráciách prítomných v Neuraceqe nemá florbetaben (18F) žiadnu
zistiteľnú farmakodynamickú aktivitu.
V ukončených klinických skúšaniach prebiehalo kvantitatívne meranie vychytávania florbetabenu (18F) v 7 preddefinovaných oblastiach mozgovej kôry (frontálnej, parietálnej, laterálnej a mediálnej temporálnej, occipitálnej, v oblasti caudate, v oblasti posterior cingulum/ precuneus a v oblasti anterior cingulate gyrus) a kôry mozgu, ktoré sa meralo kvantitatívne pomocou štandardizovaných hodnôt vychytávania (SUV – „standardized uptake values“). Pomery priemernej kortikálnej SUV (SUVRs, v porovnaní s kôrou malého mozgu) sú vyššie u pacientov s AD ako u zdravých dobrovoľníkov.
Kli
nická
účinnosť
Hlavná štúdia u 31 pacientov v terminálnej fáze života bola zameraná na stanovenie diagnostickej účinnosti florbetabenu (18F) pri detekcii hustoty kortikálnych neuritických plakov (žiadne alebo zriedkavé verzus stredne časté až časté), ako stanovujú kritéria CERAD. Výsledky PET snímok boli porovnané s maximálnou hustotou neuritických plakov meraných na rezoch: strednom frontálnom, gyrus, superiórneho a stredného temporálneho gyru, inferiórneho parietálneho laloku, hippokampu
a iných častí mozgu pri autopsii vykonanej u pacientov. Stav kognitívnych funkcií pacientov sa nedal spoľahlivo zmerať. U všetkých 31 subjektoch viedlo zaslepené vizuálne hodnotenie snímok pacientov, uskutočnené 3 lekármi v podmienkach zaslepenia, vo väčšine prípadov k senzitivite odpočtu (read sensitivity) 100 % (95 % IS: 80,5─100 %) a špecifickosti 85,7 % (95 % IS: 67,4─100 %). V post-hoc analýze senzitivity a špecifickosti väčšiny vizuálne hodnotených PET snímok pacientov vs histopatológie u širšej populácie (74 pacientov) bola 97,9 % (95 % IS: 93,8─100 %)
a 88,9 % (95 % IS: 77─100 %).
Senzitivita a špecifickosť pri odhade beta-amyloidových depozitov florbetabenom (18F) sa ďalej
hodnotila v jednej ďalšej štúdii, v ktorej iná skupina 5 elektronicky trénovaných hodnotiteľov
v podmienkach zaslepenia interpretovala snímky od 54 subjektov, ktorí boli sledovaní až po autopsiu v hlavnej štúdii. Histopatologické kritéria nezodpovedali kritériám CERAD. Výsledky boli nižšie ako výsledky získané v hlavnej štúdii: senzitivita bola v rozpätí od 77,5 % do 90 % a špecifickosť bola
v rozpätí od 62,5-85,7 %. Zhoda medzi hodnotiteľmi vyhodnotená pomocou hodnôt Fleiss’ kappa, ktoré sa pohybovali v rozpätí od 0,68 to 0,87. Pri porovnaní výsledkov hodnotenia PET skenu s histopatologickým hodnotením zozbieraným pre všetky subjekty (rovnaké ako boli v originálnom pivotnom skúšaní a v jej post-hoc analýze), väčšina hodnotení mala senzitivitu 100 % (95% CI: 89,4-
100 %) a špecifickosť 71,4 % (95% CI: 52,1-90,8 %).
V jednej dlhodobej štúdii podstúpilo 45 pacientov s klinickou diagnózou mierneho kognitívneho deficitu (MCI) základné PET vyšetrenie s florbetabenom (18F) a bolo sledovaných počas nasledujúcich 24 mesiacov s cieľom vyhodnotiť vzťah medzi vyobrazením pomocou
florbetabenu (18F) a zmenami diagnostického stavu. 29 (64,4 %) pacientov s diagnózou MCI bolo pozitívnych pri použití florbetabenu (18F) pri PET snímkovaní. Pri 24-mesačnom sledovaní došlo u
19 pacientov (42,2 %) ku konverzii na klinickú AD. 19 (65,5 %) pacientov s MCI z 29, ktorí mali pozitívny PET sken, bolo po 24 mesiacoch klasifikovaných za konvertovaných na klinickú AD
v porovnaní s 0 (0 %) zo 16, ktorí mali negatívny sken. Senzitivita skenu s florbetabenom (18F) na
preukázanie pomeru konverzie MCI na AD u 19 konvertovaných pacientov bola 100 %, špecifickosť
26 nekonvertovaných bola 61,5 % (95 % IS: 42,8─80,2 %) a pozitívny pravdepodobnostný pomer („positive likelihood ratio“) bol 2,60 (1,60─4,23). Dizajn tejto štúdie neumožňuje stanoviť riziko progresie z MCI do klinickej AD.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s
florbetabenom (18F) vo viacerých podskupinách pediatrickej populácie, keďže ochorenie, pre ktoré je tento konkrétny liek určený, sa vyskytuje len u dospelej populácie a tento konkrétny liek nepredstavuje významný terapeutický prínos v porovnaní s existujúcimi spôsobmi liečby
u pediatrických pacientov.
5.2 Farmakokinetické vlastnosti
Distribúcia
Po intravenóznej bolusovej injekcii dosiahne koncentrácia rádioaktivity v arteriálnej plazme do
10 minút 2-3 % injikovanej dávky/l.
Florbetaben (18F) sa vysoko viaže na plazmatické proteíny (>98,5 %). Vychytávanie v orgánoch
Vychytávanie rádioaktivity v mozgu je rýchle, 10 minút po injekcii dosahuje 6 % injekčne podanej
rádioaktivity.
U zdravých kontrolných subjektov sa ukázalo, že dochádza k relatívne nízkej úrovni retencie florbetabenu (18F) v kôre. Najvyššia úroveň vychytávania je vo Varolovom moste a iných oblastiach s bielou hmotou. U pacientov s AD boli pozorované významne vyššie hodnoty vychytávania
v kortikálnych a striatálnych oblastiach ako u kontrolnej vzorky. U pacientov s AD dochádza, rovnako ako u kontrolnej vzorky, k vysokej retencii vo Varolovom moste a v ďalších oblastiach s bielou hmotou.
V niektorých prípadoch sa vychytávanie pozorovalo aj v extracerebrálnych štruktúrach, akými sú napríklad tvár a koža na hlave. Dôvod tohto vychytávania nie je známy, ale môže byť spôsobený akumuláciou florbetabenu (18F), niektorého z jeho rádioaktívnych metabolitov alebo krvnou rádioaktivitou.
Reziduálna aktivita v midsagitálnom sínuse môže byť pozorovaná pravdepodobne z dôvodu prítomnosti indikátora v krvných zásobách.'
Biofyzikálny základ retencie florbetabenu (18F) v bielej hmote v živom ľudskom mozgu sa nedá spoľahlivo vysvetliť. Predpokladá sa, že k retencii v bielej hmote môže prispievať nešpecifická väzba rádiofarmaka na myelínovú pošvu obsahujúcu lipidy.
Eliminácia
Florbetaben (18F) sa z plazmy pacientov s AD eliminuje s priemerným biologickým polčasom asi
1 hodina. Približne 4 hodiny po injekcii už nie je v krvi merateľná žiadna rádioaktivita.
Pri skúmaní in vitro sa florbetaben (18F) metabolizoval predovšetkým enzýmovým systémom CYP2J2
a CYP4F2.
Pri meraní uskutočnenom 12 hodín po podaní injekcie bolo v moči zistených v priemere až 30 % injekčne podanej rádioaktivity. Po tomto časovom rámci už nebolo možné ďalej kvantifikovať aktivitu v moči.
Polčasrozpadu
Fluór (18F)má fyzikálny polčas rozpadu 110 minút.
12 hodín po injekcii je 98,93 % aktivity rozloženej, 24 hodín po injekcii je 99,99 % aktivity rozloženej.
Poškodenieobličiek/pečene
Farmakokinetika u pacientov s poškodením obličiek alebo pečene nebola opísaná.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po jednorazovom podaní, toxicity po opakovanom podávaní a genotoxicity, neodhalili žiadne osobitné riziko pre ľudí. U potkanov a psov sa testovala potenciálna toxicita po 28 dňoch opakovaného podávania intravenóznych injekcií florbetabenu a zistilo sa, že NOAEL je aspoň 20-krát vyšší ako maximálna dávka pre človeka.
Keďže liek nie je určený na pravidelné alebo kontinuálne podávanie, nevykonali sa štúdie chronického podávania a karcinogenity.
Štúdie reprodukčnej toxicity neboli vykonané.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
kyselina askorbová etanol bezvodý makrogol 400
askorbát sodný (na úpravu pH)
voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto tento liek sa nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
Maximálne 10 hodín od konca syntézy.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Uchovávanie rádiofarmák musí byť v súlade s národnými predpismi pre rádioaktívne materiály.
6.5 Druh obalu a obsah balenia
Tento liek sa dodáva v jednodávkovej, bezfarebnej 15ml injekčnej liekovke zo skla typu I, s chlorobutylovou zátkou a hliníkovým uzáverom.
Každá jednodávková injekčná liekovka obsahuje 1,0 až 10 ml roztoku, čo zodpovedá 300 až
3000 MBq v deň a čas kalibrácie.
V dôsledku rozdielov vo výrobnom procese je možné, že niektoré injekčné liekovky produktu sú
distribuované s prepichnutou gumovou zátkou.
Veľkosť balenia: 1 injekčná liekovka.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všeobecné upozornenie:
Rádiofarmaká majú v určenom klinickom prostredí prijímať, používať a podávať len oprávnené osoby. Ich príjem, uchovávanie, používanie, preprava a likvidácia podliehajú právnym úpravám a/alebo príslušným licenciám vydaným príslušným štátnym úradom.
Rádiofarmaká sa majú pripravovať spôsobom, ktorý je v súlade s požiadavkami radiačnej bezpečnosti
a farmaceutickej kvality. Je potrebné prijať príslušné aseptické bezpečnostné opatrenia.
Liekovka sa nesmie používať, ak je narušená jej celistvosť.
Postupy pri podávaní lieku sa musia vykonávať tak, aby bolo riziko kontaminácie lieku a riziko ožiarenia obsluhujúcich osôb obmedzené na minimum. Použitie primeraných ochranných prostriedkov je povinné.
Podávanie rádiofarmák sa spája s rizikom pre ďalšie osoby (vrátane tehotných zdravotníckych pracovníčok) z vonkajšieho ožiarenia alebo kontaminácie v dôsledku rozliatia moču, zvratkov atď. Preto je nevyhnutné prijať bezpečnostné opatrenia na ochranu pred žiarením v súlade s národnými právnymi predpismi.
Nepoužitý liek alebo odpad vzniknutý z lieku treba zlikvidovať v súlade s národnými požiadavkami na
rádioaktívne materiály.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIPiramal Imaging GmbH Tegeler Strasse 6-7
13353 Berlin
Nemecko
8. REGISTRAČNÉ ČÍSLO <ČÍSLA>EU/1/13/906/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE{DD mesiac RRRR}
10. DÁTUM REVÍZIE TEXTU11. DOZIMETRIAV nasledujúcej tabuľke je uvedená dozimetria vypočítaná pomocou softvéru OLINDA (
Organ
Level
INternal
Dose
Assessment – stanovenie vnútornej dávky na úrovni orgánov).
Odhad absorbovaných dávok ionizovaného žiarenia v orgánoch je uvedený v Tabul´ka 3, na základe údajov od zdravých dobrovoľníkov belošskej rasy (n=17). Výpočty dozimetrie boli upravené pre model s dospelými osobami (s telesnou hmotnosťou 70 kg).
Tabuľka 3: Odhad absorbovaných dávok radiácie po intravenóznej injekcii Neuracequ subjektom belošskej rasy
Orgán
| Absorbovaná dávka na jednotku podanej rádioaktivity [mGy/MBq]
|
Nadobličky
| 0,0130
|
Mozog
| 0,0125
|
Prsia
| 0,0074
|
Žlčník
| 0,137
|
Gastrointestinálny trakt
|
Dolná časť hrubého čreva
| 0,0351
|
Tenké črevo
| 0,0314
|
Žalúdok
| 0,0116
|
Horná časť hrubého čreva
| 0,0382
|
Srdce
| 0,0139
|
Obličky
| 0,0238
|
Pečeň
| 0,0386
|
Pľúca
| 0,0148
|
Svaly
| 0,00948
|
Vaječníky
|
0,0156
|
Pankreas
|
0,0139
|
Červená kostná dreň
|
0,0122
|
Osteogénne bunky
|
0,0148
|
Koža
|
0,00689
|
Slezina
|
0,0102
|
Semenníky
|
0,00913
|
Týmus
|
0,00892
|
Štítna žľaza
|
0,00842
|
Močový mechúr
|
0,0695
|
Maternica
|
0,0163
|
Ostatné orgány
|
0,0110
|
Ú
činná dávka (mSv/MBq)
|
0,0193
|
Účinná dávka po podaní maximálnej odporúčanej dávky rádioaktivity 360 MBq dospelej osobe s
hmotnosťou 70 kg je asi 7,0 mSv. Ak sa simultánne vykonáva aj CT snímkovanie ako súčasť PET procedúry, zvýši sa expozícia ionizačnému žiareniu o množstvo závislé od nastavenia použitého pri získavaní CT. Pre podanú aktivitu 360 MBq je typická dávka žiarenia do cieľového orgánu (mozgu)
4,5 mGy.
Pre podanú rádioaktivitu 360 MBq sú typické dávky žiarenia do kritických orgánov 49,3 mGy pre žlčník, 25,0 mGy pre močový mechúr, 13,8 mGy pre hornú časť hrubého čreva, 12,6 mGy pre dolnú časť hrubého čreva, 11,3 mGy pre tenké črevo a 13,9 mGy pre pečeň.
12. POKYNY NA PRÍPRAVU RÁDIOFARMÁKSpôsob prípravyPred použitím je potrebné balenie skontrolovať a aktivitu zmerať aktivimetrom.
Odbery sa majú vykonávať za aseptických podmienok. Liekovky sa nesmú otvárať pred dezinfekciou zátky liekovky. Roztok sa má odoberať cez zátku pomocou jednorazových injekčných striekačiek vybavených ochranným odtienením a jednorazovou sterilnou ihlou alebo pomocou schváleného automatizovaného aplikačného systému. Ak je celistvosť liekovky porušená, produkt sa nesmie použiť.
Florbetaben (18F) sa nesmie riediť.
Dávka sa podáva formou pomalej intravenóznej bolusovej injekcie (6 sek/ml), po ktorej nasleduje prepláchnutie približne 10 ml injekčného roztoku chloridu sodného 9 mg/ml (0,9 %), aby sa zaistilo podanie celej dávky. Ak je objem injekcie v rozmedzí 0,5 a 1 ml, majú sa použiť iba striekačky príslušnej veľkosti (1 ml) a striekačku je nutné prepláchnuť roztokom chloridu sodného.
Injekcia florbetabenu (18F) musí byť intravenózna, aby sa zabránilo ožiareniu v dôsledku lokálnej
extravazácie, ako aj zobrazovacím artefaktom.
Kontrola kvalityRoztok sa pred použitím musí vizuálne skontrolovať. Použiť možno iba číry roztok bez viditeľných častíc.
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.