
, aby do postihnutého oka (postihnutých očí) kvapla jedna kvapka. Aby sa predišlo možnej kontaminácii, nedovoľte, aby sa špička jednodávkového obalu dotýkala oka, očného viečka, ani iného povrchu.
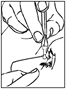
Systémovú absorpciu je možné znížiť stlačením slzného vaku v mediálnom očnom kútiku na minútu počas a po instilácii kvapiek. (Toto zabraňuje prestupu kvapiek cez nosovo-slzný kanálik do veľkej absorpčnej oblasti nosovej a faryngálnej sliznice).
 Dĺžkaliečby
DĺžkaliečbyZvyčajná dĺžka liečby je 5 dní. V prípade refraktérnej alebo komplikovanej infekcie môže lekár odporučiť dlhšiu liečbu.
4.3 KontraindikáciePrecitlivenosť na liečivo, aminoglykozidové antibiotiká alebo na ktorúkoľvek z pomocných látok
uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníU pacientov liečených systémovými aminoglykozidmi sa vyskytli závažné nežiaduce reakcie vrátane
neurotoxicity, ototoxicity a nefrotoxicity. Pri súbežnom podaní sa odporúča opatrnosť (pozri časť 4.5).
Dlhodobé použitie topických antibiotík môže spôsobiť premnoženie rezistentných mikroorganizmov. Pokiaľ sa v priebehu relatívne krátkeho časového obdobia neprejaví klinické zlepšenie alebo ak sa vyskytnú akékoľvek podráždenie alebo prejav senzibilizácie, je potrebné terapiu ukončiť a začať primeranú liečbu.
Netilmicin NewLine Pharma nie je určený na podanie injekciou, preto sa nesmie podať injekciou subkonjunktiválne, ani zavádzať do prednej komory.
Pri povrchovej očnej infekcii sa použitie kontaktných šošoviek dôrazne neodporúča.
Pediatrická populácia
Použitie lieku Netilmicin NewLine Pharma u detí a dospievajúcich sa neodporúča (pozri časť 4.2).
4.5 Liekové a iné interakciePri použití lieku Netilmicin NewLine Pharma neboli hlásené žiadne významné farmakologické
interakcie.
Súbežné podanie, dokonca aj topické a
najmä intrakavitárne, iných potenciálne nefrotoxických
a ototoxických antibiotík môže zvýšiť riziko takýchto účinkov.
Súbežné alebo po sebe nasledujúce použitie ďalej uvedených nefrotoxických liekov
s aminoglykozidmi môže zvýšiť potenciál nefrotoxicity a súbežnému podaniu je potrebné sa vyhnúť:
cisplatina, polymyxín B, kolistín, viomycín, streptomycín, vankomycín, iné aminoglykozidy
a niektoré cefalosporíny (cefaloridín) alebo silné diuretiká, ako kyselina etakrynová a furosemid, kvôli ich účinku na obličky.
In vitro môže spojenie aminoglykozidov a beta-laktámových antibiotík (penicilínov alebo cefalosporínov) spôsobiť recipročnú a významnú inaktiváciu. U pacientov s renálnou insuficienciou a niektorých pacientov s normálnou funkciou obličiek sa vyskytli zníženia polčasu alebo
plazmatických hladín aminoglykozidov, dokonca aj ak boli aminoglykozidy a penicilínové antibiotiká podané dvoma rozličnými cestami podania.
Pacientov je potrebné informovať, že pri použití viac než jedného oftalmologického lieku sa tieto lieky musia podávať s odstupom najmenej 5 minút. Očné masti sa majú podávať ako posledné.
4.6 Fertilita, gravidita a laktáciaGraviditaHoci predklinické štúdie pri topickom podaní netilmicínu nepreukázali vďaka nízkej systémovej absorpcii lieku žiadnu fetálnu toxicitu, liek sa môže počas gravidity podávať len po starostlivom zhodnotení prínosu a rizika a za prísneho lekárskeho dohľadu.
DojčeniePodanie Netilmicin NewLine Pharma sa počas dojčenia neodporúča, keďže aminoglykozidy sa
v malom množstve vylučujú do materského mlieka.
FertilitaNie sú dostupné žiadne údaje o účinku Netilmicin NewLine Pharma na fertilitu u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeInstilácia očných kvapiek môže spôsobiť dočasné zahmlenie videnia. Ak sa počas instilácie vyskytne zahmlené videnie, pacient má pred vedením vozidiel alebo obsluhou strojov počkať, kým sa jeho zrak vyjasní.
4.8 Nežiaduce účinkyHlásené nežiaduce účinky podľa MedDRA klasifikácie orgánových systémov sú uvedené nižšie.
K dispozícii nie je dostatok údajov na určenie frekvencie jednotlivých uvedených účinkov (neznáma
frekvencia).
Poruchy oka:- podráždenie oka
- hyperémia spojovky
- vyrážka očného viečka
- opuch očného viečka
- svrbenie oka (pruritus)
Poruchy i muni t ného s ys t ému :- precitlivenosť
- urtikária
Epizódy podráždenia oka a precitlivenosti spôsobenej liekom Netilmicin NewLine Pharma sú mierne
a prechodné.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePrípady predávkovania neboli hlásené.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antiinfektíva, antibiotiká, ATC kód: S01AA23
Netilmicín je semisyntetické, širokospektrálne aminoglykozidové antibiotikum. V nízkych koncentráciách sa ukázalo ako účinné proti rôznym patogénnym baktériám, grampozitívnym
a gramnegatívnym vrátane kmeňov rezistentných na gentamycín. Toto antibiotikum nie je, na rozdiel od gentamycínu, citlivé na inaktivačnú aktivitu bakteriálnych fosforylačných a adenylačných enzýmov.
Netilmicín má rýchly baktericídny účinok prostredníctvom nesprávnej translácie genetického kódu
mRNA a následným zavedením nesprávnych aminokyselín do rastúcich polypeptidových reťazcov.
Prevalencia rezistencie sa môže u vybraných kmeňov líšiť geograficky a v závislosti od času a preto je vhodné mať miestnu informáciu o rezistencii, najmä pri liečbe závažných infekcií. Nasledujúce informácie udávajú len približnú pravdepodobnosť toho, či budú baktérie citlivé na netilmicín v lieku Netilmicin NewLine Pharma.
Definície hraničných hodnôt, ktoré triedia izoláty na citlivé alebo rezistentné, sú užitočné pri predikcii klinickej účinnosti systémovo podávaných antibiotík. Ak sa však antibiotiká podávajú vo vysokej koncentrácii topicky, priamo do miesta infekcie, nemusia byť definície hraničných hodnôt vhodné. Väčšina izolátov, ktoré by boli klasifikované ako rezistentné podľa hraničných hodnôt pri
systémovom podaní, je úspešne liečená topicky.
Frekvencia celkovej rezistencie na aminoglykozidy môže byť v niektorých európskych krajinách až
50 % všetkých stafylokokov.
T
abuľka 1 Druhovo špecifické klinické hraničné hodnoty MIC netilmicínu (EUCAST 2017)
Mikroorganizmus
|
Kli
nické hraničné hodnoty MIC (mg/l)
|
S (£)
|
R (³)
|
EC
O
F
F
|
Enterobacteriaceae
|
2
|
4
|
2
|
Pseudomonas
|
4
|
4
|
4
|
Acinetobacter
|
4
|
4
|
NR
|
Staphylococcus
|
1
|
1
|
1
|
Staphylococcus, koaguláza negatívny
|
1
|
1
|
NR
|
Enterococcus
|
IE
|
IE
|
NR
|
Streptococcus A, B, C a G
|
NR
|
NR
|
NR
|
Streptococcus pneumoniae
|
NR
|
NR
|
NR
|
Viridans Streptococci
|
NR
|
NR
|
NR
|
H
aemophilus influenzae
|
IE
|
IE
|
NR
|
M
oraxella catarrhalis
|
IE
|
IE
|
NR
|
N
eisseria gonorrhea
|
NR
|
NR
|
NR
|
N
eisseria meningitidis
|
NR
|
NR
|
NR
|
Grampozitívne anaeróby s výnimkou Clostridium difficile
|
NR
|
NR
|
NR
|
Gramnegatívne anaeróby
|
NR
|
NR
|
NR
|
Hraničné hodnoty bez ohľadu na druh
|
2
|
4
|
NR
|
Poznámka: S = citlivý. R = rezistentný. ECOFF = bežná epidemiologická hraničná hodnota pre sledovanie rezistencie. IE = nie je dostatočný dôkaz, že skúmaný druh je správny cieľ pre liečbu týmto liekom. NR = nehlásené.
|
I
n vitro štúdie preukázali aktivitu netilmicínu proti väčšine kmeňov bežných očných patogénov
a bežných baktérií kožnej flóry. Tabuľka 2 poskytuje zoznam úrovní citlivosti na netilmicín u celkovo
767 bakteriálnych izolátov zo vzoriek z klinických štúdií, ktoré boli zhromaždené z Francúzska (FR), Nemecka (DE), Talianska (IT), Poľska (PL), Slovenskej republiky (SK), Španielska (ES) a Spojeného kráľovstva (UK), čo demonštruje celkovú úroveň citlivosti bežnej očnej flóry na antibiotiká.
Tabuľka 2 Údaje bežnej citlivosti in vitro na netilmicín z izolátov z EÚ'
| Citlivý
| Stredne citlivý
| Rezistentný
| MIC50
(µg/ml)
| MIC90
(µg/ml)
|
Organizmus
| [n]
| [%]
| [n]
| [%]
| [n]
| [%]
|
S.aureus
| 252
| 100
| 0
| 0
| 0
| 0
| 0,25
| 0,5
|
S. aureus (koaguláza negatívny)
| 302
| 96,5
| 10
| 3,2
| 1
| 0,3
| 0,06
| 4
|
S. epidermidis
| 216
| 95,6
| 9
| 4
| 1
| 0,4
| 0,05
| 4
|
S. pneumoniae
|
|
|
|
|
|
| 4
| 8
|
H. influenzae
|
|
|
|
|
|
| 0,25
| 0,5
|
Ps. Aeruginosa
| 39
| 100
| 0
| 0
| 0
| 0
| 4
| 4
|
Ďalšie informácie:Skrížená rezistencia pri aminoglykozidoch (napr. gentamycíne, tobramycíne a netilmicíne) je
dôsledkom špecifity modifikácií enzýmov adenyltransferázy (
adenyltransferase, ANT) a acetyltransferázy (
acetyltransferase, ACC). Avšak skrížená rezistencia sa medzi aminoglykozidovými antibiotikami líši kvôli odlišnej špecifite rôznych modifikujúcich enzýmov. Najbežnejším mechanizmom získanej rezistencie na aminoglykozidy je inaktivácia antibiotík modifikujúcimi enzýmami, kódovanými plazmidmi a transpozónmi.
5.2 Farmakokinetické vlastnosti
Po podaní lieku Netilmicin NewLine Pharma do spojovkového vaku sa očakáva malá topická
a systémová absorpcia.
Maximálna plazmatická koncentrácia 5 mg/ml netilmicínu sa dosahuje v priebehu 30 – 60 minút po intramuskulárnej injekcii 2 mg/ml. Intravenózna infúzia podaná po dobu 60 minút vedie k maximálnej plazmatickej koncentrácii približne 11 mg/ml. U dospelých je obyčajne polčas 2,0 až 2,5 hodiny a pri renálnej insuficiencii sa zvyšuje.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe relevantných štúdií, ktoré sa uskutočnili na potkanoch, psoch,
morčatách, mačkách, králikoch a opiciach neodhalili žiadne osobitné riziko pre ľudí.
LD50 pri intramuskulárnom a intraperitoneálnom podaní je 142 a 186 mg/kg u myší, 166 a 266 mg/kg u potkanov a 160 < LD50 < 200 i.m. a 40 < LD50 < 72 i.v. u psov, v uvedenom poradí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
chlorid sodný
hydroxid sodný (na úpravu pH)
čistená voda
6.2 Inkompatibility:
Neaplikovateľné.
6.3 Čas použiteľnosti
Neotvorené: 24 mesiacov.
Obsah jednodávkových obalov sa musí použiť ihneď po otvorení; akýkoľvek zvyšný obsah sa musí zlikvidovať.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 °C.
Jednodávkové obaly uchovávajte v pôvodnom hliníkovom vrecku na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
15 jednodávkových obalov z polyetylénu s nízkou hustotou s obsahom 0,3 ml očných roztokových
kvapiek.
20 jednodávkových obalov z polyetylénu s nízkou hustotou s obsahom 0,3 ml očných roztokových
kvapiek.
Jednodávkové obaly sú zabalené po 5 kusoch v hliníkových vreckách. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINewLine Pharma, S.L.
Calle Tarragona 151-157, Planta 11, Puerta 01, Bloque A
08014 Barcelona
Španielsko
8. REGISTRAČNÉ ČÍSLO64/0106/21-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUMarec 2021
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Štátneho ústavu pre kontrolu liečiv (
www.sukl.sk).