
ový obal a jeho špičku umiestnite blízko k oku, ale tak, aby sa oka
nedotýkala. Špičkou obalu sa nedotýkajte oka ani očného viečka.
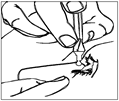
8. Jednodávkový obal stlačte tak, aby ste podali len jednu kvapku, a potom uvoľníte spodné viečko.
9. Zatvorte oko a prstom stlačte kútik postihnutého oka pri nose. Držte 2 minúty.
10. Zopakujte aj s druhým okom podľa lekárskeho predpisu.
11. Po použití jednodávkový obal zlikvidujte.
Liek Netilmicin/Dexamethasone NewLine Pharma očné kvapky v jednodávkovom obale sa musí použiť ihneď po otvorení.
Po podaní sa má jednodávkový obal a všetok nepoužitý obsah zlikvidovať.
Opatrenia pred zaobchádzaním alebo podaním lieku
Pri povrchovej očnej infekcii alebo zápale sa použitie kontaktných šošoviek dôrazne neodporúča.
Pacientov je potrebné poučiť, že nesprávne zaobchádzanie s očnými kvapkami môže viesť ku kontaminácii baktériami, z čoho môžu plynúť infekcie oka. Z použitia kontaminovaných očných kvapiek môže plynúť vážne poškodenie oka a následná strata zraku.
Ak sa používa viac než jeden topicky podávaný oftalmologický liek, musia sa lieky podávať
s odstupom najmenej 10 minút. Očné masti sa majú podávať ako posledné.
Trvanieliečby
Bežná dĺžka liečby môže trvať od 5 do 14 dní.
4.3 Kontraindikácie
Precitlivenosť na liečivá, aminoglykozidové antibiotiká alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Produkt obsahuje kortikosteroidy, preto je jeho použitie kontraindikované u pacientov s:
1) intraokulárnou hypertenziou,
2) herpetickou keratitídou alebo inými očnými infekciami spôsobenými herpesom simplex,
3) vírusovými ochoreniami rohovky a spojovky,
4) očnými mykotickými ochoreniami,
5) mykobakteriálnymi očnými infekciami.
4.4 Osobitné upozornenia a opatrenia pri používaní
Netilmicin/Dexamethasone NewLine Pharma je určený len na podanie do oka a nemá sa podávať perorálne ani do prednej očnej komory.
V prípade liečby dlhšej ako 15 dní sa má pravidelne monitorovať vnútroočný tlak.
Dlhodobé používanie môže vyústiť do očnej hypertenzie/glaukómu s výsledným poškodením optického nervu a výpadkami zrakovej ostrosti a zorného poľa.
Dlhodobé používanie kortikosteroidov môže vyústiť do:
1) tvorby zadnej subkapsulárnej katarakty,
2) spomalenia hojenia rán,
3) poklesu hostiteľskej odpovede, z čoho plynie zvýšené riziko sekundárnej očnej infekcie najmä mykotickej alebo vírusovej povahy.
Pri akútnych hnisavých infekciách oka podávanie kortikosteroidov môže skrývať alebo zhoršiť infekciu. Pri chorobách spôsobujúcich stenčenie rohovky alebo skléry boli pri použití topicky podávaných steroidov hlásené perforácie.
U niektorých pacientov sa môže vyskytnúť citlivosť na topicky podané aminoglykozidy. Ak
sa citlivosť vyskytne, prestaňte liek používať.
Tento produkt obsahuje dexametazón; má sa používať s opatrnosťou u pacientov s glaukómom, a použitie sa má starostlivo zvážiť u pacientov s rodinnou anamnézou tohto ochorenia.
Predpokladá sa, že súbežná liečba s inhibítormi CYP3A vrátane liekov s obsahom ritonavíru a kobicistatu zvyšuje riziko systémových vedľajších účinkov. Tejto kombinácii sa má vyhnúť, pokiaľ výhody neprevyšujú zvýšené riziko systémových vedľajších účinkov
kortikosteroidov, pričom v takom prípade majú byť pacienti monitorovaní s ohľadom na systémové vedľajšie účinky kortikosteroidov.
Tento liek obsahuje fosforečnany, čo môže pri topickom podávaní vyvolať depozity rohovky alebo opacitu rohovky. Má sa používať opatrne u pacientov s poškodenou rohovkou a v prípadoch, keď je pacient liečený viacerými očnými liekmi obsahujúcimi fosforečnany (pozri časť 4.5).
Ak do pár dní nenastane výrazné klinické zlepšenie alebo sa objaví podráždenie alebo citlivosť, zastavte liečbu a začnite vhodnú terapiu.
Zrakové poruchy
Zrakové poruchy sa môžu vyskytnúť pri systémovom a topickom použití kortikosteroidov. Ak sa u pacienta objavia príznaky ako rozmazané videnie alebo iné zrakové poruchy, má byť vyšetrený očným lekárom, aby zhodnotil možné príčiny, ktoré môžu zahŕňať kataraktu, glaukóm alebo zriedkavé ochorenia, napr. centrálnu seróznu chorioretinopatiu (central serous chorioretinopathy, CSCR), ktoré boli hlásené po použití systémových a topických kortikosteroidov.
Pediatrická populácia
Použitie lieku Netilmicin/Dexamethasone NewLine Pharma u detí a dospievajúcich sa neodporúča (pozri časť 4.2).
4.5 Liekové a iné interakcie
S liekom Netilmicin/Dexamethasone NewLine Pharma sa neuskutočnili žiadne interakčné štúdie.
Informácie o všetkých zložkách nájdete nižšie:
Netilmicín:
S použitím netilmicínových očných roztokových kvapiek neboli hlásené žiadne zásadné liekové interakcie.
Súbežné podanie iných potenciálne nefrotoxických a ototoxických antibiotík (dokonca aj topických, najmä intrakavitárnych) môže zvýšiť riziko takýchto účinkov.
Potenciálne zvýšenie nefrotoxicity niektorých aminoglykozidov bolo hlásené po súbežnom alebo následnom podávaní iných potenciálne nefrotoxických látok ako: cisplatina, polymyxín B, kolistín, viomycín, streptomycín, vankomycín, iné aminoglykozidy a niektoré cefalosporíny (cefaloridín) alebo silné diuretiká, ako kyselina etakrynová a furosemid, kvôli ich účinku na obličky.
Súbežnému alebo následnému podávaniu týchto liekov s netilmicínom sa má vyhnúť.
In vitro môže kombinácia aminoglykozidov a beta-laktámových antibiotík (penicilínov alebo cefalosporínov) spôsobiť významnú vzájomnú inaktiváciu.
U pacientov s renálnou nedostatočnosťou a niektorých pacientov s normálnou funkciou obličiek boli hlásené zníženia polčasu alebo plazmatických hladín aminoglykozidov, dokonca aj ak boli aminoglykozidové antibiotiká a antibiotiká podobné penicilínu podané dvoma rozličnými spôsobmi.
Dexametazón:
Riziko zvýšeného vnútroočného tlaku spojené s dlhodobou kortikosteroidovou terapiou sa pravdepodobnejšie ukáže pri súbežnom použití anticholinergík, najmä atropínu a príbuzných zlúčenín u pacientov s predispozíciou k akútnemu zatváraniu uhla.
Inhibítory CYP3A4 (vrátane ritonavíru a kobicistatu) môžu znížiť klírens dexametazónu, z čoho plynú silnejšie účinky a adrenálna supresia/Cushingov syndróm. Tejto kombinácii sa má vyhnúť, pokiaľ výhody neprevyšujú zvýšené riziko systémových vedľajších účinkov kortikosteroidov, pričom v takom prípade majú byť pacienti monitorovaní s ohľadom na systémové vedľajšie účinky kortikosteroidov.
Riziko výskytu depozitov rohovky alebo opacity rohovky je pravdepodobnejšie u pacientov s poškodenou rohovkou a u pacientov liečených viacerými očnými liekmi s obsahom fosforečnanov.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii údaje o použití lieku Netilmicin/Dexamethasone NewLine Pharma u gravidných žien.
Štúdie na zvieratách preukázali teratogénnu aktivitu dexametazónu.
Odporúča sa vyhnúť sa použitiu lieku Netilmicin/Dexamethasone NewLine Pharma počas
tehotenstva.
Dojčenie
Nie sú dostatočné informácie o vylučovaní dexametazónu alebo netilmicínu alebo ich metabolitov do ľudského mlieka.
Riziko u novorodencov/dojčiat sa nedá vylúčiť.
Netilmicin/Dexamethasone NewLine Pharma sa nemá počas dojčenia používať.
Fertilita
Nie sú k dispozícii žiadne údaje o účinku lieku Netilmicin/Dexamethasone NewLine Pharma na fertilitu u ľudí.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Netilmicin/Dexamethasone NewLine Pharma má mierny vplyv na schopnosť viesť vozidlá
a obsluhovať stroje.
Instilácia očných kvapiek môže spôsobiť prechodné rozmazané videnie. Kým tieto účinky pominú, pacienti nemajú viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Hlásené nežiaduce účinky podľa MedDRA klasifikácie orgánových systémov sú uvedené nižšie. K dispozícii nie je dostatok údajov na určenie frekvencie jednotlivých uvedených účinkov (neznáma frekvencia).
Poruchy oka:
- zvýšený vnútroočný tlak (po 15-20 dňoch topického podávania citlivým alebo glaukomatóznym pacientom)
- tvorba zadnej subkapsulárnej katarakty
- rozmazané videnie
- príznaky zhoršenia herpesu simplex alebo mykotických infekcií
- zhoršené hojenie.
Poruchy imunit ného syst ému:
Endokrinné poruchy
- Cushingov syndróm,
- adrenálna supresia (pozri časť 4.4).
V súvislosti s používaním očných kvapiek obsahujúcich fosforečnany boli veľmi zriedkavo u niektorých pacientov so závažne poškodenými rohovkami hlásené prípady kalcifikácie rohovky.
Hlásenie vedľajších účinkovHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePrípady predávkovania neboli hlásené.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antiflogistiká a antiinfektíva v kombinácii, kortikosteroidy a antiinfektíva v kombinácii, ATC kód: S01C A01
Netilmicin/Dexamethasone NewLine Pharma obsahuje dve liečivá: dexametazón a netilmicín.
Dexametazón:· Mechanizmus účinku
Dexametazón je kortikosteroid s pozoruhodnou protizápalovou silou, 25-krát väčšou než hydrokortizón. Tak ako všetky kortikosteroidy, aj on najmä inhibuje uvoľňovanie kyseliny arachidónovej, ktorá je prekurzorom najdôležitejších mediátorov zápalu, t.j. prostaglandínov a leukotriénov.
Účinnosť dexametazónu na liečbu zápalových stavov oka je osvedčená.
· Farmakodynamické účinky
Kortikosteroidy dosahujú svoje protizápalové účinky potlačením adhézie molekúl do buniek cievného endotelu a expresiou cytokínov. To vedie k zníženej expresii prozápalových mediátorov a potlačeniu adhézie cirkulujúcich leukocytov do cievneho endotelu, a zabráneniu prechodu do zapálených očných tkanív.
Dexametazón má významnú protizápalovú aktivitu so zníženou mineralokortikoidovou aktivitou v porovnaní s niektorými inými steroidmi a je to jedna z najúčinnejších protizápalových látok.
Netilmicín:• Mechanizmus účinku
Netilmicín je účinné, širokospektrálne, rýchlo baktericídne aminoglykozidové antibiotiku. Svojimi primárnymi účinkami pôsobí na bakteriálne bunky inhibíciou polypeptidovej väzby a
antibakteriálnu ochranu proti citlivým baktériám.
• Farmakodynamické účinky
Tabuľka 1 zobrazuje hraničné hodnoty MIC, ktoré oddeľujú citlivé od stredne citlivých organizmov a stredne citlivé od rezistentných organizmov, podľa údajov EURCAST. Prevalencia rezistencie sa môže u vybraných kmeňov líšiť geograficky a v závislosti od času a preto je vhodné mať miestnu informáciu o rezistencii, najmä pri liečbe závažných infekcií. V prípade potreby je potrebné sa poradiť s odborníkom, keď je miestna prevalencia rezistencie taká, že je prospešnosť látky pri aspoň niektorých typoch infekcií otázna. Nasledujúce informácie poskytujú len orientačnú predstavu o tom, či budú baktérie citlivé na netilmicín v lieku Netilmicin/Dexamethasone NewLine Pharma.
Definície hraničných hodnôt, ktoré triedia izoláty na citlivé alebo rezistentné, sú užitočné pri predikcii klinickej účinnosti systémovo podávaných antibiotík. Ak sa však antibiotiká podávajú vo veľmi vysokej koncentrácii topicky, priamo do miesta infekcie, nemusia byť definície hraničných hodnôt platné. Väčšina izolátov, ktoré by boli klasifikované ako rezistentné podľa hraničných hodnôt pri systémovom podaní, je úspešne liečená topicky. Frekvencia celkovej rezistencie na aminoglykozidy môže byť v niektorých európskych krajinách až 50 % všetkých stafylokokov.
Tabuľka 1 Druhovo špecifické klinické hraničné hodnoty MIC (EUCAST 2012)Mikroorganizmus
| Klinické hraničné hodnoty MIC
(mg/l)
|
S (£)
| R (³)
| ECOFF
|
Enterobacteriaceae
| 2
| 4
| 2
|
Pseudomonas
| 4
| 4
| 4
|
Acinetobacter
| 4
| 4
| NR
|
Staphylococcus
| 1
| 1
| 1
|
Staphylococcus, koaguláza negatívny
| 1
| 1
| NR
|
Enterococcus
| IE
| IE
| NR
|
Streptococcus A, B, C a G
| NR
| NR
| NR
|
Streptococcus pneumoniae
| NR
| NR
| NR
|
viridujúce streptokoky
| NR
| NR
| NR
|
Haemophilus influenzae
| IE
| IE
| NR
|
Moraxella catarrhalis
| IE
| IE
| NR
|
Neisseria gonorrhea
| NR
| NR
| NR
|
Neisseria meningitidis
| NR
| NR
| NR
|
Gram-pozitívne anaeróby s výnimkou Clostridium difficile
| NR
| NR
| NR
|
Gram-negatívne anaeróby
| NR
| NR
| NR
|
Hraničné hodnoty bez ohľadu na druh
| 2
| 4
| NR
|
Poznámka: S = citlivý. R = rezistentný. ECOFF = bežná epidemiologická hraničná hodnota pre sledovanie
rezistencie. IE = Nie je dostatočný dôkaz, že skúmaný druh je správny cieľ liečby týmto liekom. NR = nehlásené.
|
In vitro štúdie preukázali aktivitu netilmicínu proti väčšine kmeňov bežných očných patogénov a bežných baktérií kožnej flóry. Tabuľka 2 poskytuje zoznam úrovní citlivosti na netilmicín u celkovo 767 bakteriálnych izolátov z očných klinických vzoriek, ktoré boli zhromaždené z Francúzska (FR), Nemecka (DE), Talianska (IT), Poľska (PL), Slovenskej republiky (SK), Španielska (ES) a Spojeného kráľovstva (UK), čo demonštruje celkovú úroveň citlivosti bežnej očnej flóry na antibiotiká.
Tabuľka 2 In vitro údaje bežnej citlivosti na netilmicín z izolátov z EÚ
|
Citlivý
|
Stredne citlivý
|
Rezistentný
|
M
I
C
50
(
µg/ml)
|
M
I
C
90
(
µg/ml)
|
O
rganizmus
|
[
n]
|
[
%]
|
[
n]
|
[
%]
|
[
n]
|
[
%]
|
S
.aureus
|
252
|
100
|
0'
|
0
|
0
|
0
|
0,25
|
0,5
|
S
. aureus (koaguláza
negatívny)
|
302
|
96,5
|
10
|
3,2
|
1
|
0,3
|
0,06
|
4
|
S
. epidermidis
|
216
|
95,6
|
9
|
4
|
1
|
0,4
|
0,05
|
4
|
S
. pneumoniae
|
|
|
|
|
|
|
4
|
8
|
H. influenzae
|
|
|
|
|
|
|
0,25
|
0,5
|
Ps. Aeruginosa
|
39
|
100
|
0
|
0
|
0
|
0
|
4
|
4
|
Ďalšie informácie:
Skrížená rezistencia pri aminoglykozidoch (napr. gentamicíne, tobramycíne a netilmicíne) je
dôsledkom špecifity modifikácií enzýmov adenyltransferázy (
adenyltransferase, ANT) a acetyltransferázy (
acetyltransferase, ACC). Avšak skrížená rezistencia medzi rôznymi aminoglykozidovými antibiotikami sa líši kvôli odlišnej špecifite rôznych modifikujúcich enzýmov. Najbežnejším mechanizmom získanej rezistencie na aminoglykozidy je inaktivácia antibiotík modifikujúcimi enzýmami, kódovanými plazmidom a transpozónom.
5.2 Farmakokinetické vlastnostiDexametazón:•Absorpcia:
Dexametazón dosahuje vnútroočné terapeutické koncentrácie po instilácii v spojovkovom vaku. Maximálne koncentrácie v rohovke a v komorovom moku nastanú do 1-2 hodín. Polčas rozpadu plazmatického dexametazónu je približne 3 hodiny.
• Distribúcia:
Systémová expozícia po topickom očnom podaní lieku Netilmicin/Dexamethasone NewLine
Pharma je nízka.
Maximálne hladiny dexametazónu v plazme po poslednej topicky podanej dávke sa pohybujú medzi 220 až 888 pikogramov/ml (priemer 555 ± 217 pg/ml) po podaní jednej kvapky lieku Netilmicin/Dexamethasone NewLine Pharma do každého oka 4-krát denne počas dvoch po sebe nasledujúcich dní.
• Metabolizmus:
Po podaní je sodná soľ dexametazón-fosfátu podrobená hydrolýze, katalyzovanej enzýmami v slznom filme a rohovke a je čiastočne konvertovaná na dexametazón alkohol, ktorý je rozpustný v tukoch.
•Vylučovanie:
Dexametazón je eliminovaný extenzívne vo forme metabolitov.
Netilmicín:•Absorpcia:
Rovnako ako všetky aminoglykozidy, aj netilmicín je len slabo lipofilný, takže po topickom
podaní slabo preniká do prednej očnej komory.
• Distribúcia:
Štúdie na ľuďoch odhalili, že po jedinom topickom podaní je koncentrácia netilmicínu v slzách bežne 256 mikrogramov/ml po 5 minútach, 182 mikrogramov/ml po 10 minútach,
94 mikrogramov/ml po 20 minútach a 27 mikrogramov/ml po 1 hodine.
• Metabolizmus:
Netimilicín nie je po topickom podaní do oka metabolizovaný.
• Vylučovanie:
Podobne ako iné aminoglykozidové antibiotiká, aj netilmicín je primárne eliminovaný nezmenený prostredníctvom obličiek.
5.3 Predklinické údaje o bezpečnosti
Predklinické bezpečnostné údaje sú odvodené hlavne z publikovaných informácií.
Dexametazón
Preukázalo sa, že dexametazón veľmi dobre znášajú laboratórne zvieratá (králiky a potkany)
po lokálnej aplikácii po dobu až 6 mesiacov.
Príznaky toxicity dexametazónu pozorované u rôznych zvieracích druhov po perorálnom podaní sú spojené s adenokortikosteroidnými účinkami a zahŕňajú aj alteráciu adreno- hypofýzovej osy a miernu anémiu.
Prejavy toxicity sa našli v žalúdku, pečeni, nadobličkách a hypofýze, pľúcach a slezine laboratórnych zvierat.
V štúdiách urobených po topickom podaní väčšina z týchto stavov chýbala alebo bola zriedkavá.
Súčasné zistenia neukazujú žiadne náznaky klinicky relevantných genotoxických vlastností
glukokortikoidov.
Pri experimentoch na zvieratách sa ukázalo, že podanie kortikoidov môže mať za následok fetálne resorpcie a rázštep podnebia. U králikov mali kortikosteroidy za následok fetálne resorpcie a viaceré abnormality na hlave, ušiach, končatinách a podnebí. Navyše boli hlásené inhibícia vnútromaternicového rastu a zmeny vo funkčnom vývoji centrálneho nervového systému.
Netilmicín
Aminoglykozidy ako trieda antibiotík sú známe tým, že majú potenciál spôsobiť výrazné nefrotoxické a otoxické účinky, pričom niektoré môžu byť nezvratné. Fertilita, teratogenita a postnatálne štúdie netilmicínu na potkanoch a králikoch neposkytli žiadny výrazný dôkaz toxicity netilmicínu a už vôbec nie po očnom podaní. V štúdii očnej tolerancie u králikov sa nenašli žiadne zranenia na spojovkovej a rohovkovej úrovni alebo na očnom pozadí a očné reflexy neboli ovplyvnené.
Fixná kombinácia
Podobné výsledky ako boli sumarizované vyššie pre každé liečivo sa objavili aj v štúdiách na
králikoch s fixnou kombináciou.
Hodnotenie environmentálneho rizika
Kalkulácia predpovedanej environmentálnej koncentrácie (PEC)povrchová voda pre dexametazón aj netilmicín vychádzala z maximálnej ľudskej dávky ôsmich kvapiek lieku počas 24 hodín.
Každá kvapka obsahuje 0,05 mg dexametazónu a 0,15 mg netilmicínu. Vypočítané hodnoty PEC povrchovej vody vychádzajúce z podania očných kvapiek sú 0,002 mikrogramov/l pre dexametazón a 0,006 mikrogramov/l pre netilmicín. Tieto hodnoty sú nižšie ako 5 % akčný
limit (0,01 mikrogramov/l), a preto by množstvo dexametazónu a netilmicínu vydané pri normálnom použití nemalo predstavovať riziko pre vodné prostredie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Citrónan sodný,
Dihydrogenfosforečnan sodný, monohydrát Hydrogenfosforečnan sodný, dodekahydrát Čistená voda.
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky.
Tento liek neobsahuje konzervanty.
Po prvom otvorení: Po podaní sa má jednodávkový obal, aj keď len čiastočne použitý, zlikvidovať.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 30 °C.
Jednodávkové obaly uchovávajte vo vrecku na ochranu pred svetlom a vlhkosťou.
Podmienky uchovávania po prvom otvorení lieku pozri v časti 6.3.
6.5 Druh obalu a obsah balenia
Jednodávkové obaly s objemom 0,3 ml z polyetylénu s nízkou hustotou (LDPE) zabalené v hliníkových vreckách s obsahom 5 jednodávkových obalov.
Balenia s obsahom 15 alebo 20 jednodávkových balení. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
NewLine Pharma, S.L.
Calle Tarragona 151-157, Planta 11, Puerta 01, Bloque A
08014 Barcelona
Španielsko
8. REGISTRAČNÉ ČÍSLO/ČÍSLA
64/0246/21-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTU10/2021
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Štátneho ústavu pre kontrolu lieč
iv (www.sukl.sk).