
i metabolizéri CYP2D6
Pacienti s pomalým metabolizmom CYP2D6 môžu vykazovať zvýšené hladiny mexiletínu v krvi (pozri časť 5.2). Pred zvýšením dávky musí byť dodržané obdobie najmenej 7 dní, aby sa zabezpečilo dosiahnutie rovnovážnych hladín bez ohľadu na polymorfizmus CYP450 pacienta.
Spôsob podávania
Perorálne použitie.
Kapsuly sa majú užívať s vodou. Kapsuly sa nemajú užívať v polohe ležmo na chrbte. V prípade tráviacich ťažkostí sa majú kapsuly užívať počas jedla.
4.3 Kontraindikácie
• Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
• Precitlivenosť na ktorékoľvek lokálne anestetikum,
• ventrikulárna tachyarytmia,
• úplná srdcová blokáda (napr. atrioventrikulárna blokáda tretieho stupňa) alebo akákoľvek srdcová blokáda, ktorá môže prerásť do úplnej srdcovej blokády (atrioventrikulárna blokáda prvého stupňa s výrazne predĺženými intervalom PR (≥240 ms) a/alebo širokým komplexom QRS (≥120 ms), atrioventrikulárna blokáda druhého stupňa, blokáda ramienka, bifascikulárna a trifascikulárna blokáda),
• infarkt myokardu (akútny alebo minulý) alebo abnormalita Q vĺn
• symptomatická koronárna choroba srdca,
• zlyhanie srdca so stredne zníženou (40 – 49 %) a zníženou (<40 %) ejekčnou frakciou,
• atriálna tachyarytmia, fibrilácia alebo flutter,
• porucha sínusového uzla (vrátane sínusovej frekvencie < 50 úderov za minútu),
• súbežné podávanie liekov vyvolávajúcich torsades de pointes (pozri časť 4.5),
• súbežné podávanie liekov s úzkym terapeutickým indexom (pozri časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Srdcové arytmogénne účinky
Mexiletín môže vyvolávať arytmiu alebo zvýrazniť existujúcu arytmiu, diagnostikovanú alebo
nediagnostikovanú. Pozri tiež časti 4.3 a 4.5 o vzťahu s inými liekmi s arytmogénnymi účinkami.
Pred zahájením liečby mexiletínom je potrebné u všetkých pacientov vykonať podrobné a dôsledné srdcové vyšetrenie (EKG, 24 – 48-hodinové Holterove monitorovanie a echokardiografia), aby bola stanovená srdcová znášanlivosť mexiletínu. Srdcové vyšetrenie sa odporúča krátko po zahájení liečby (t. j. v priebehu 48 hodín).
Monitorovanie srdca pacientov je počas liečby mexiletínom a vo vzťahu k zmenám dávky potrebné
prispôsobiť podľa stavu srdcovej funkcie pacienta:
• u pacientov bez srdcových abnormalít sa odporúča pravidelné sledovanie EKG (každé 2 roky alebo častejšie, ak je to potrebné),
• u pacientov so srdcovými abnormalitami a u pacientov náchylných na tieto abnormality sa má podrobné srdcové vyšetrenie vrátane EKG vykonať pred každým zvýšením dávky a po každom zvýšení dávky. Počas udržiavacej liečby sa odporúča vykonať srdcové vyšetrenie vrátane
EKG, 24 – 48-hodinového Holterovho monitorovania a echokardiografie minimálne raz za rok alebo častejšie, ak je to potrebné ako súčasť rutinného vyšetrenia srdca.
Pacientov treba informovať o príznakoch arytmií (mdloby, palpitácie, bolesť v hrudníku, dýchavičnosť, závrat, lipotýmia a synkopa) a zároveň im odporučiť, aby v prípade akýchkoľvek príznakov arytmií ihneď kontaktovali centrum prvej pomoci.
Pri poruchách srdca a srdcovej činnosti, ktoré nie sú uvedené v časti 4.3, je treba prínos antimyotonických účinkov mexiletínu zvážiť podľa rizika srdcových komplikácií individuálne u každého pacienta.
V prípade zistených srdcových abnormalít kondukcie alebo v prípade kontraindikácií uvedených v
časti 4.3 je potrebné liečbu mexiletínom ihneď ukončiť.
Elektrolytická nerovnováha ako je hypokalémia, hyperkalémia alebo hypomagnézia môže zvýšiť proarytmické účinky mexiletínu. Preto je u všetkých pacientov potrebné vykonať elektrolytické vyšetrenie pred zahájením liečby mexiletínom. Elektrolytickú nerovnováhu je potrebné upraviť pred podaním mexiletínu a monitorovať počas liečby (frekvenciu monitorovania treba upraviť individuálne u každého pacienta).
Liekové reakcie s eozinofíliou a systémovými príznakmi (DRESS)
DRESS označuje syndróm, ktorý vo svojej úplnej forme zahŕňa závažný kožný výsev, horúčku,
lymfadenopatiu, hepatitídu, hematologické abnormality s eozinofíliou a abnormality v lymfocytoch a môže postihovať aj iné orgány. Príznaky sa obyčajne objavia v priebehu 1 – 8 týždňov po expozícii na liek. Závažné systémové manifestácie sú zodpovedné za 10 %-nú mieru úmrtnosti. Výskyt syndrómu DRESS bol hlásený u 1:100 až 1:10 000 liečených pacientov.
Niektoré lieky ako antikonvulzíva, antibiotiká a tiež mexiletín boli vyhodnotené ako možné príčiny výskytu. U pacientov so známou precitlivenosťou na mexiletín alebo na iné zložky tohto produktu alebo na iné lokálne anestetiká je vysoké riziko vzniku syndrómu DRESS a nemali by mexiletín užívať.
Porucha funkcie pečene
Skúsenosti s podávaním mexiletínu u pacientov so závažnou poruchou funkcie pečene sú obmedzené.
Preto sa mexiletín nemá používať u tejto populácie pacientov (pozri časť 4.2).
Porucha funkcie obličiek
Skúsenosti s podávaním mexiletínu u pacientov so závažnou poruchou funkcie obličiek sú obmedzené.
Preto sa podávanie mexiletínu neodporúča u tejto populácie pacientov (pozri časť 4.2).
Epilepsia
Epileptických pacientov je potrebné monitorovať, pretože mexiletín môže zvýšiť frekvenciu
záchvatov.
Polymorfizmus CYP2D6
Polymorfizmus CYP2D6 môže pôsobiť na farmakokinetiku mexiletínu (pozri časť 5.2). U pacientov,
ktorí sú pomalí metabolizéri CYP2D6 alebo ktorí užívajú lieky inhibujúce CYP2D6, sa očakáva vyššia miera systémovej expozície (pozri časť 4.5). Pred zvýšením dávky musí byť dodržané obdobie najmenej 7 dní, aby sa zabezpečilo dosiahnutie rovnovážnych hladín a aby bol mexiletín dobre tolerovaný u všetkých pacientov bez ohľadu na polymorfizmus CYP450 pacienta.
Fajčenie
Fajčenie pôsobí na farmakokinetiku mexiletínu (pozri časť 4.5). Dávku mexiletínu je potrebné zvýšiť,
ak pacient začne fajčiť, alebo znížiť, ak pacient prestane fajčiť.
4.5 Liekové a iné interakcie
Farmakodynamické interakcie
Antiarytmiká vyvolávajúce torsades de pointes (trieda antiarytmík Ia, Ic, III):
súbežné podávanie mexiletínu a antiarytmík vyvolávajúcich torsades de pointes (trieda Ia: chinidín, prokaínamid, dizopyramid, ajmalín, trieda Ic: enkainid, flekainid, propafenón, moracizín, trieda III: amiodaron, sotalol, ibutilid, dofetilid, dronedarón, vernakalant) zvyšuje riziko potenciálne smrtiaceho stavu torsades de pointes. Súbežné užívanie mexiletínu a antiarytmík, ktoré vyvolávajú torsades de pointes, je kontraindikované (pozri časť 4.3).
Iné antiarytmiká (trieda antiarytmík Ib, II, IV):
súbežné podávanie mexiletínu a iných tried antiarytmík (trieda Ib: lidokaín, fenytoín, tokainíd, trieda II: propranolol, esmolol, timolol, metoprolol, atenolol, carvedilol, bisoprolol, nebivolol, trieda IV: verapamil, diltiazem) sa odporúča iba vo výnimočných prípadoch z dôvodu zvýšeného rizika vzniku nežiaducich reakcií srdca (pozri časť 4.4).
Farmakokinetické interakcie
Účino k iných liekov na mexiletín
Mexiletín je substrát pre metabolické dráhy, ktoré zapájajú hepatické enzýmy. Predpokladá sa, že
inhibícia alebo indukcia týchto enzýmov ovplyvňuje koncentrácie mexiletínu v plazme.
Inhibítory CYP1A2 a CYP2D6
Súbežné podávanie mexiletínu s inhibítorom hepatického enzýmu (inhibítor CYP1A2: ciprofloxacín, fluvoxamín, propafenón, inhibítor CYP2D6: propafenón, chinidín) výrazne zvyšuje expozíciu mexiletínu a tým súvisiace riziko nežiaducich reakcií na mexiletín.
V interakčnej štúdii s jednou dávkou sa klírens mexiletínu znížil o 38 % po súbežnom podaní fluvoxamínu, inhibítora CYP1A2.
Preto môže byť klinické a EKG monitorovanie a zároveň úprava dávkovania mexiletínu indikovaná
počas a po liečbe inhibítorom CYP1A2 alebo CYP2D6.
Induktori CYP1A2 a CYP2D6
Súbežné podávanie mexiletínu s induktormi hepatického enzýmu (induktor CYP1A2: omeprazol, induktor CYP2D6: fenytoín, rifampicín) môže zvýšiť klírens a rýchlosť eliminácie mexiletínu z dôvodu zvýšeného hepatického metabolizmu, čo vedie k zníženým plazmatickým koncentráciám mexiletínu a jeho polčasu.
V klinickej štúdii viedlo súbežné podávanie mexiletínu s fenyotínom k výraznému zníženiu expozície mexiletínu (p <0,003) z dôvodu zvýšeného klírensu, čo sa odrazilo vo výraznom znížení polčasu eliminácie (17,2 až 8,4 hodiny, p <0,02).
Dávkovanie mexiletínu má preto byť na základe klinickej odpovede upravené počas a po liečbe
induktormi enzýmu.
Po perorálnom podaní jednej dávky (167mg) a opakovaných dávok (83 mg dvakrát denne počas 8 dní) mexiletínu sa celkový klírens mexiletínu výrazne zvýšil u fajčiarov (1,3-násobne až 1,7-násobne) z dôvodu indukcie CYP1A2, čo viedlo k zodpovedajúcemu zníženiu polčasu eliminácie a expozície lieku. Dávku mexiletínu je potrebné zvýšiť, ak pacient začne fajčiť počas liečby mexiletínom a znížiť, ak pacient prestane fajčiť.
Účino k mexiletínu na iné lieky
Potenciál mexiletínu ako sprostredkovateľa interakcie medzi liekmi nie je známy. Pacienti majú byť
starostlivo sledovaní, ak sú liečení súbežne inými liekmi, a obzvlášť ak sú to lieky s úzkym
terapeutickým indexom.
Substráty pre CYP1A2
Mexiletín je potentný inhibítor CYP1A2, preto súbežné podávanie mexiletínu s inými liekmi metabolizovanými CYP1A2 (ako je teofylín, kofeín, lidokaín alebo tizanidín) môže byť spojené so zvýšením koncentrácií v plazme súbežného lieku, čo môže spôsobiť zvýšenie alebo predĺženie terapeutickej účinnosti a/alebo nežiaducich reakcií, obzvlášť ak sa mexiletín podáva súbežne so substrátmi CYP1A2 úzkym terapeutickým indexom, napr. teofylín a tizanidín.
Hladiny substrátu CYP1A2 v krvi je potrebné monitorovať, najmä pri zmene dávky mexiletínu. Vhodná úprava dávky substrátu CYP1A2 sa má zvážiť.
Kofeín
V klinickom skúšaní s 12 účastníkmi (5 zdravých účastníkov a 7 pacientov so srdcovými arytmiami) sa klírens kofeínu znížil o 50 % po podaní mexiletínu. Zvýšené koncentrácie kofeínu, ktoré nastali pri súbežnom podaní mexiletínu, je potrebné zobrať do úvahy u pacientov so srdcovou arytmiou. Počas liečby mexiletínom sa preto odporúča znížiť príjem kofeínu.
Substráty OCT2
Organický katiónový transportér 2 (OCT2) poskytuje významnú dráhu pre príjem katiónových zlúčenín v obličke. Mexiletín môže vzájomne pôsobiť na lieky prenášané OCT2 (ako je metformín a dofetilid).
Ak sa má mexiletín a iné substráty OCT2 podávať súbežne, hladiny substrátu OCT2 v krvi je potrebné
monitorovať, najmä pri zmene dávky mexiletínu. Vhodná úprava dávky substrátu OCT2 sa má zvážiť.
Substráty iných enzýmov a transportérov
Potenciálne interakcie medzi mexiletínom a substrátmi iných bežných enzýmov a transportérov neboli doteraz hodnotené. V súčasnosti je používanie mexiletínu so substrátom s úzkym terapeutickým indexom, ako napríklad digoxín, lítium, fenytoín, teofylín alebo warfarín, kontraindikované (pozri
časť 4.3).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii údaje o použití mexiletínu u gravidných žien alebo je takých údajov iba obmedzené
množstvo. Obmedzené množstvo klinických údajov o používaní mexiletínu u gravidných žien naznačuje, že mexiletín prechádza placentou a zasahuje plod. Štúdie na zvieratách nepreukázali priame alebo nepriame účinky z hľadiska reprodukčnej toxicity (pozri časť 5.3).
Ako preventívne opatrenie je vhodnejšie vyhnúť sa užívaniu mexiletínu počas gravidity.
Dojčenie
Mexiletín sa vylučuje do ľudského mlieka. Nie sú dostatočné informácie o účinkoch mexiletínu u
novorodencov/dojčiat. Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu mexiletínom, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Účinky mexiletínu na fertilitu u ľudí neboli skúmané. Štúdie na zvieratách s mexiletínom nepreukázali
škodlivé účinky z hľadiska fertility (pozri časť 5.3).
 4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Mexiletín má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Po podaní mexiletínu sa
môžu vyskytnúť mdloby, zmätenosť, rozmazané videnie (pozri časť 4.8).
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluK najčastejšie hláseným nežiaducim reakciám u pacientov liečených mexiletínom patria abdominálna
bolesť (12 %), vertigo (8 %) a insomnia (12 %).
K najzávažnejším hláseným nežiaducim reakciám u pacientov liečených mexiletínom patria lieková reakcia s eozinofíliou a systémovými príznakmi a arytmia (atrioventrikulárna blokáda, arytmia, ventrikulárna fibrilácia).
Súhrn nežiaducich reakcií v tabuľkeKategórie frekvencie sú odvodené podľa nasledujúcej konvencie: veľmi časté (≥1/10), časté (≥1/100
až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov). Veľmi časté a časté nežiaduce reakcie pochádzajú z údajov získaných zo štúdie MYOMEX. Menej časté nežiaduce účinky pochádzajú z obdobia po uvedení lieku na trh.
Poruchy krvi a lymfatického systému Neznáme: leukopénia, trombocytopénia
Poruchy imunitného systémuVeľmi zriedkavé: liekové reakcie s eozinofíliou a systémovými príznakmi
Neznáme: lupus-like syndróm, exfoliatívna dermatitída, Stevens-Johnsonov syndróm
Psychické poruchy Veľmi časté: insomnia Časté: ospalosť
Neznáme: halucinácie, zmätenosť
Poruchy nervového systémuČasté: bolesť hlavy, parestézia, rozmazané videnie
Menej časté: záchvat, poruchy reči Neznáme: diplopia, dysgeúzia
Poruchy ucha a labyrintuČasté: vertigo
Poruchy srdca a srdcovej činnostiČasté: tachykardia
Menej časté: bradykardia
Neznáme: atrioventrikulárna blokáda
Poruchy cievČasté: nával, hypotenzia
Neznáme: obehový kolaps, návaly tepla
Poruchy dýchacej sústavy, hrudníka a mediastínaNeznáme: pulmonárna fibróza
Poruchy gastrointestinálneho traktu Veľmi časté: abdominálna bolesť Časté: nevoľnosť
Neznáme: hnačka, vracanie, vredy a perforácie pažeráka
Poruchy pečene a žlčových ciestZriedkavé: abnormálne funkcia pečene
Veľmi zriedkavé: poškodenie pečene vyvolané liekom, porucha pečene, hepatitída
Poruchy kože a podkožného tkanivaČasté: akné
 Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Časté: bolesť končatín
Celkové poruchy a reakcie v mieste podaniaČasté: mdloby, asténia, nepríjemné pocity v hrudníku, malátnosť
Hlásenie podozrení na nežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePríznakyFatálne výsledky boli hlásené pri akútnom predávkovaní dávkou 4,4 g hydrochloridu mexiletínu, ale
prežitie bolo tiež hlásené po akútnom predávkovaní približne 4 g perorálneho hydrochloridu mexiletínu.
K príznakom predávkovania mexiletínom patria neurologické poruchy (parestézia, zmätenosť, halucinácie, záchvat) a poruchy srdca a srdcovej činnosti (sínusová bradykardia, hypotenzia, kolaps a v extrémnych prípadoch zástava srdca).
Liečba predávkovaniaLiečba je prevažne symptomatická. Závažnosť príznakov si môže vyžadovať nemocničný dohľad. V
prípade bradykardie s hypotenziou sa má použiť intravenózny atropín. V prípade záchvatu sa majú
používať benzodiazepíny.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: kardiaká, antiarytmiká, trieda Ib, ATC kód: C01BB02.
Mechanizmus účinkuMexiletín blokuje sodíkové kanály so silnejšou potenciou v situáciách excesivných burstov akčných
potenciálov (blokáda závislá na frekvencii depolarizácie – use dependent block) a/alebo predĺženej depolarizácie (blokáda závislá na veľkosti depolarizačného potenciálu – voltage-dependent block), ako to prebieha v chorých tkanivách na rozdiel od fyziologickej excitability (pokojové alebo tonické blokovanie). Mexiletín je preto zväčša aktívny na svalových tkanivách s opakovanými impulzmi (kontrakciami) (ako u kostrových svalov). Myotonické príznaky zmierňuje znižovaním svalovej stuhnutosti pomocou redukcie omeškania svalovej relaxácie.
Klinická účinnosť a bezpečnosťÚčinnosť a bezpečnosť mexiletínu u non-dystrofickej myotónie boli hodnotené v MYOMEX –
multicentrickej, dvojito zaslepenej, placebom kontrolovanej, skríženej (2 liečebné obdobia s trvaním
18 dní) štúdii so 4-dňovým obdobím vyplavenia liečiva u 13 pacientov s myotónia congenita (MC) a u
12 pacientov s paramyotónia congenita (PC). Vek celej skúšanej populácie sa pohyboval v rozmedzí od 20 do 66 rokov a asi 2/3 pacientov boli muži.
Pacienti, ktorí mali príznaky myotónie, ktoré postihovali najmenej 2 segmenty a ktoré mali vplyv na najmenej 3 každodenné aktivity, boli zaradení do štúdie. Pacienti boli randomizovaní podľa skríženého návrhu štúdie do sekvencie, ktorá pozostávala z nasledujúcich 2 liečob: a) mexiletín s
úvodnou dávkou 167 mg/deň s následnou titráciou o 167 mg každé 3 dni až do maximálnej dávky 500
mg/deň v 1 týždni alebo b) placebo.1
Primárnym meradlom účinnosti pre MC aj PC bolo skóre závažnosti stuhnutosti podľa hlásenia pacientov na vizuálnej analógovej stupnici (Visual Analogue Scale, VAS). VAS je zostavená ako absolútne meradlo so 100 mm rovnou horizontálnou čiarou s koncovými bodmi „žiadna stuhnutosť“ (0) a „najhoršia možná stuhnutosť“ (100). Hlavnými sekundárnymi koncovými ukazovateľmi boli
zmeny v kvalite života súvisiace so zdravím merané podľa stupnice individualizovanej neuromuskulárnej kvality života (INQoL) a času potrebného na zdvihnutie sa zo stoličky, chôdzu
okolo stoličky a sadnutie si na stoličku (chair test).
Výsledky primárnych a kľúčových sekundárnych koncových ukazovateľov sú zhrnuté v tabuľke nižšie.'
Primárna analýza
Skóre stuhnutosti (VAS) (mm)
Mexiletín Placebo
Počet účastníkov 25 25
Stredná hodnota VAS pri východiskovej návšteve 71,0 81,0
Stredná hodnota VAS v 18. deň 16,0 78,0
Stredná absolútna zmena VAS od východiskovej hodnoty -42,0 2,0
Podiel pacientov s absolútnou zmenou
VAS od východiskovej hodnoty ≥50 mm v 18. deň
12/21 (57,1 %) 3/22 (13,6 %)
Účinok liečby (Lineárny zmiešaný model účinkov) p <0,001
Sekundárna analýzaChair testPočet účastníkov 25 25
Priemerná (SD) hodnota pri východiskovej návšteve 7,3 (3,5)
Priemerná (SD) hodnota v 18. deň 5,2 (1,6) 7,5 (4,1) Priemerná (SD) absolútna zmena od východiskovej hodnoty -2,1 (2,9) 0,2 (1,6) Účinok liečby (Wilcoxonov znamienkový párový test) p = 0,0007
Sekundárna analýzaIndividualizovaná neuromuskulárna kvalita života – Celková kvalita života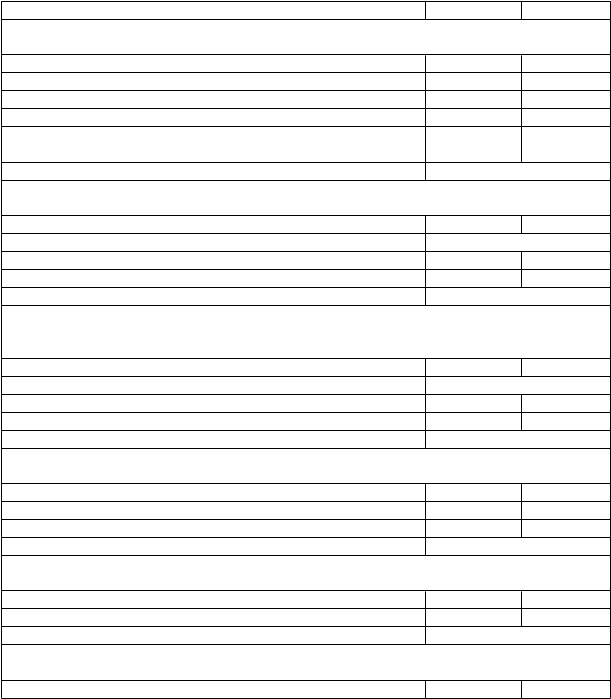
Počet účastníkov 25 25
Stredná hodnota pri východiskovej návšteve 51,1
Stredná hodnota v 18. deň 23,3 48,3
Stredná absolútna zmena od východiskovej hodnoty -25,0 1,1
Účinok liečby (Lineárny zmiešaný model) p <0,001
Sekundárna analýzaIndex účinnosti podľa Celkového klinického dojmu (CGI)Počet účastníkov 25 25
Hodnotenie účinnosti podľa CGI skúšajúcimi 22 (91,7 %) 5 (20,0 %) Hodnotenie účinnosti podľa CGI pacientmi 23 (92,0 %) 6 (24,0 %) Účinok liečby (McNemarov test) p <0,001
Sekundárna analýzaPreferencie medzi 2 liečebnými obdobiamiPočet účastníkov 25 25
Preferované obdobie 20 (80,0 %) 5 (20,0 %)
Účinok liečby (binomiálny test) p = 0,0041
Sekundárna analýzaKlinická stupnica myotónie – globálne skóre závažnosti
Počet účastníkov 25 25
1 V správe z klinického skúšania sa uvádza 200 mg dávka, čo je množstvo hydrochloridu mexiletínu (čo
zodpovedá základu 166,62 mg mexiletínu)

Priemerná (SD) hodnota pri východiskovej návšteve 53,8 (10,0)
Priemerná (SD) hodnota v 18. deň 24,0 (17,1) 47,6 (23,3) Priemerná (SD) absolútna zmena od východiskovej hodnoty -29,8 (16,0) -6,2 (19,0) Účinok liečby (Lineárny zmiešaný model) p <0,001
Sekundárna analýzaStupnica klinickej myotónie – globálne skóre postihnutiaPočet účastníkov 25 25
Priemerná (SD) hodnota pri východiskovej návšteve 7,8 (2,8)
Priemerná (SD) hodnota v 18. deň 2,7 (2,6) 7,0 (3,8) Priemerná (SD) absolútna zmena od východiskovej hodnoty -5,1 (3,1) -0,8 (3,4) Účinok liečby (Lineárny zmiešaný model) p <0,001
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Namuscla vo
všetkých podskupinách pediatrickej populácie pri symptomatickej liečbe myotonických porúch
(informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaMexiletín sa rýchlo a takmer úplne absorbuje po perorálnom podaní s biodostupnosťou približne 90 %
u zdravých účastníkov. Maximálne koncentrácie v plazme po perorálnom podaní boli dosiahnuté v priebehu 2 až 3 hodín. Po opakovanom podaní nebola pozorovaná žiadna pozorovateľná akumulácia mexiletínu.
Jedlo neovplyvňuje ani rýchlosť, ani rozsah absorpcie mexiletínu. Preto je možné mexiletín užívať s jedlom aj bez jedla.
DistribúciaMexiletín sa v tele rýchlo distribuuje. Objem distribúcie je veľký a pohybuje sa u zdravých osôb v
rozmedzí od 5 až 9 l/kg.
Mexiletín sa slabo viaže na plazmatické proteíny (55 %).
Mexiletín prechádza placentárnou bariérou a preniká do ľudského mlieka.
BiotransformáciaMexiletín je metabolizovaný prevažne (90 %) v pečeni. Primárnou dráhou je metabolizmus enzýmom
CYP2D6, hoci je aj substrátom pre enzým CYP1A2. Metabolická degradácia prebieha rôznymi dráhami vrátane aromatickej a alifatickej hydroxylácie, dealkylácie, deaminácie a N-oxidácie. Niekoľko výsledných metabolitov je podrobených ďalšej konjugácii s kyselinou glukurónovou (II. fáza metabolizmu). K týmto metabolitom patria hlavné metabolity p-hydroxymexiletín, hydroxy- metylmexiletín a N-hydroxymexiletín.
Vplyv fenotypu CYP2D6 na metabolizmus mexiletínu bol skúmaný v rozsiahlej miere. Farmakokinetika mexiletínu je charakteristická výrazne nižším celkovým a renálnym klírensom, čo vedie k predĺženému polčasu vylučovania, vyššej expozícii a nižšiemu objemu distribúcie u pomalých metabolizérov v porovnaní s rýchlymi metabolizérmi.
Približne 10 % sa vylučuje v nezmenenej forme obličkami.
ElimináciaMexiletín sa u ľudí eliminuje pomaly (priemerný polčas eliminácie je 10 hodín, v rozmedzí 5 až 15
hodín).
K vylučovaniu mexiletínu dochádza hlavne cez obličky (90 % dávky vrátane 10 % mexiletínu v nezmenenej forme).
K zvýšenému vylučovaniu mexiletínu môže dôjsť v prípade kyslých hodnôt pH moču v porovnaní s normálnymi alebo zásaditými hodnotami pH. V klinickej štúdii sa 51 % dávky mexiletínu vylučovalo obličkami pri hodnote pH moču 5 v porovnaní s 10 % pri normálnej hodnote pH. Neočakáva sa,
že zmeny pH hodnôt moču budú mať vplyv na účinnosť alebo bezpečnosť.
Linearita/nelinearita
V dávkovom rozsahu 83 až 500 mg bol pozorovaný lineárny vzťah medzi dávkou mexiletínu a
plazmatickou koncentráciou.
Špeciálne populácie
Polymorfizmus CYP2D6
Polymorfizmus CYP2D6 ovplyvňuje farmakokinetiku mexiletínu. Osoby, ktoré sú pomalými metabolizérmi CYP2D6 (poor metabolisers, PM), prejavujú vyššie koncentrácie mexiletínu ako strední metabolizéri CYP2D6 (intermediate, IM), rýchli (t. j. normálni) alebo ultra-rýchli (ultra-rapid metabolisers, UM) metabolizéri. Podiely rôznych etnických populácií v týchto rôznych triedach sú uvedené v nasledovnej tabuľke.
Etnická príslušnosť Pomalí metabolizéri
(PM)
Strední metabolizéri
(IM)
Ultra-rýchli
metabolizéri (UM)
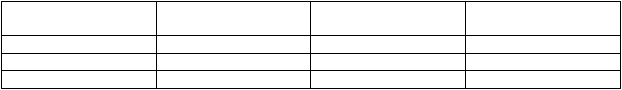
Belošská populácia Najviac 10 % 1 – 2 % Najviac 10 % Africká populácia Najviac 10 % - Najviac 5 % Ázijská populácia Najviac 5 % Viac ako 50 % Najviac 2 %
Telesná hmotnosťV populačných farmakokinetických analýzach sa zistilo, že telesná hmotnosť ovplyvňuje
farmakokinetiku mexiletínu.
VekVek nemá žiadny klinicky relevantný vplyv na expozíciu mexiletínu u dospelých.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí. Hlavné pozorované účinky u potkanov a/alebo psov boli vracanie, hnačka, tras, ataxia, konvulzie a tachykardia. Tieto štúdie však neboli vykonané v súlade so súčasnými normami a majú tak nejasný klinický význam.
Štúdie na potkanoch zamerané na karcinogénny potenciál mali negatívne výsledky, neboli však vykonané v súlade so súčasnými normami, a preto majú nejasný klinický význam. Negatívny genotoxický potenciál nenaznačuje zvýšené karcinogénne riziko liečby mexiletínom.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokObsah kapsulykukuričný škrob
oxid kremičitý, koloidný stearan horečnatý
Obal kapsuly
oxid železitý (III) (E 172)
oxid titaničitý (E 171)
želatína
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti3 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote neprevyšujúcej 30 °C.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah baleniaKapsuly sú balené v PVC/PVDC/hliníkových blistroch s obsahom 30, 50, 100 alebo 200 kapsúl. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIILupin Europe GmbH
Hanauer Landstraße 139-143,
60314 Frankfurt am Main
Nemecko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)EU/1/18/1325/001 - 004
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 18.12.2018
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.