
rneho očkovania a preočkovania u detí vo veku < 1 rok.
Staršia populácia
U starších osôb vo veku ≥ 65 rokov nie je potrebná úprava dávkovania.
Osoby infikované HIV
U osôb infikovaných vírusom HIV s infekciou kontrolovanou antiretrovírusovou liečbou nie je potrebná úprava dávkovania (pozri časť 5.1).
Sp
ô
sob pod
á
vania
Mvabea sa má podávať intramuskulárne (i.m.). Preferovaným miestom je deltový sval v hornej časti
ramena. U menších detí sú prijateľnými miestami podania intramuskulárnej injekcie buď deltoidná
oblasť ramena, alebo anterolaterálna časť stehna.
Nepodávajte túto očkovaciu látku intravenózne ani subkutánne.
Očkovacia látka sa nemá miešať v tej istej striekačke s inými očkovacími látkami alebo liekmi. Opatrenia, ktoré sa majú prijať pred podaním očkovacej látky, pozri časť 4.4.
Opatrenia týkajúce sa rozmrazovania, manipulácie a likvidácie očkovacej látky, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1 alebo na stopové rezíduá (kuracie alebo vaječné bielkoviny a gentamicín).
4.4 Osobitné upozornenia a opatrenia pri používaní
Sledovateľnosť
Aby sa zlepšila (do)sledovateľnosť biologického lieku, má sa zrozumiteľne zaznamenať názov a číslo
šarže podaného lieku.
Precitlivenosť
Po očkovaní sa odporúča starostlivé pozorovanie za účelom identifikácie skorých prejavov anafylaxie
alebo anafylaktoidných reakcií. Tak ako v prípade všetkých injekčných očkovacích látok má byť vždy
k dispozícii vhodná lekárska starostlivosť a dohľad pre prípad zriedkavých anafylaktických reakcií po
podaní tejto očkovacej látky. Osoby majú byť pozorované zdravotníckym pracovníkom najmenej
15 minút po očkovaní.
Úzkostné reakcie
V súvislosti s vakcináciou sa môžu vyskytnúť úzkostné reakcie vrátane vazovagálnych reakcií
(synkopa), hyperventilácie alebo reakcie súvisiace so stresom ako psychogénna reakcia na injekciu
s ihlou. Je dôležité zabezpečiť opatrenia, aby sa predišlo zraneniu v dôsledku mdloby.
Trombocytopénia a poruchykoagulácie
Očkovacia látka sa má podávať opatrne osobám s trombocytopéniou alebo akoukoľvek poruchou
koagulácie, pretože po intramuskulárnom podaní sa u týchto osôb môže vyskytnúť krvácanie alebo
tvorba modrín.
Súbežné ochorenie
Očkovanie sa má odložiť u osôb trpiacich akútnym závažným horúčkovitým ochorením alebo akútnou
infekciou, pokiaľ prínos okamžitého očkovania nepreváži možné riziká. Očkovanie sa nemá oddialiť
pre prítomnosť menšej infekcie a/alebo zvýšenej teploty.
Imunokompromitované osoby
Bezpečnosť a imunogenita očkovacieho režimu Zabdeno, Mvabea sa nehodnotili
u imunokompromitovaných osôb vrátane tých, ktoré dostávajú imunosupresívnu liečbu.
Imunokompromitované osoby nemusia na očkovací režim Zabdeno, Mvabea reagovať rovnako dobre ako imunokompetentné osoby.
Úroveň ochrany
Presná úroveň ochrany poskytovaná očkovacím režimom nie je známa.
Pri absencii údajov o účinnosti z klinickej praxe sa ochranný účinok očkovacieho režimu u ľudí odvodil metódou premostenia imunogenity u ľudí s údajmi o imunogenite a účinnosti získaných u nehumánnych primátov (immunobridging) (pozri časť 5.1).
Pri podaní iba jednej z očkovacích látok Zabdeno alebo Mvabea sa predpokladá, že účinnosť je nižšia v porovnaní s 2-dávkovým očkovacím režimom.
Očkovací režim nemusí ochrániť všetky osoby proti ochoreniu spôsobenému vírusom Ebola (druh Zaire ebolavirus) a nenahrádza preventívne opatrenia na zabránenie expozície vírusu Ebola. Očkované osoby majú dodržiavať miestne smernice a odporúčania na prevenciu alebo liečbu expozície vírusu Ebola.
Očkovací režim Zabdeno, Mvabea sa nemá začať za účelom poexpozičnej profylaxie proti vírusu
Ebola.
Trvanie ochrany
Trvanie ochrany nie je známe. Ukázalo sa, že posilňovacia dávka Zabdena podaná v rôznych
intervaloch po dokončení primárnej série očkovania so Zabdenom a Mvabeou vyvoláva anamnestickú
odpoveď (pozri časť 5.1). O preočkovaní Zabdenom sa má ako o preventívnom opatrení uvažovať
u osôb, u ktorých je bezprostredné riziko expozície vírusu Ebola, ako sú zdravotnícki pracovníci a
osoby, ktoré žijú v oblastiach s pokračujúcim výskytom ochorenia spôsobeného vírusom Ebola alebo
ich navštevujú, a ktoré ukončili 2-dávkový režim primárneho očkovania pred viacako 4 mesiacmi
(pozri časti 4.2 a 5.1).
Ochrana pred ochorením spôsobeným filovírusmi
Účelom očkovacieho režimu nie je predchádzať chorobám spôsobeným inými filovírusmi, ako je druh
Zaire ebolavirus.
Sodík
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v dávke, t. j. v podstate zanedbateľné množstvo
sodíka.
4.5 Liekové a iné interakcie
Bezpečnosť, imunogenita a účinnosť súbežného podávania Mvabey s inými očkovacími látkami sa nehodnotili, a preto sa súbežné podávanie neodporúča.
Ak sa Mvabea musí podať súbežne s inou injekčnou očkovacou látkou (očkovacími látkami), taká očkovacia látka (očkovacie látky) sa má vždy podať do iného miesta. Nemiešajte Mvabeu s inou očkovacou látkou v tej istej striekačke alebo injekčnej liekovke.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití Mvabey u gravidných žien.
Štúdie na zvieratách nepreukázali priame alebo nepriame škodlivé účinky z hľadiska reprodukčnej toxicity. Očkovacie režimy Zabdeno a Mvabea vyvolali detegovateľné titre materských protilátok viažucich sa špecificky na GP vírusu Ebola (EBOV), ktoré sa preniesli na plody (pozri časť 5.3).
Ako preventívne opatrenie je vhodnejšie vyhnúť sa očkovaniu Mvabeou počas gravidity. Napriek tomu sa vzhľadom na závažnosť ochorenia spôsobeného vírusom Ebola nemá od očkovania upustiť, ak existuje zjavné riziko expozície infekcii vírusom Ebola.
Dojčenie
Nie je známe, či sa Mvabea vylučuje do ľudského mlieka.
Riziko u novorodencov/dojčiat z dojčenia očkovanými matkami nemôže byť vylúčené.
Ako preventívne opatrenie je vhodnejšie vyhnúť sa očkovaniu Mvabeou počas dojčenia. Napriek tomu sa vzhľadom na závažnosť ochorenia spôsobeného vírusom Ebola nemá od očkovania upustiť, ak existuje zjavné riziko expozície infekcii vírusom Ebola.
Fertilita
Nie sú dostupné žiadne údaje o plodnosti u ľudí. Štúdia reprodukčnej toxicity na zvieratách
s očkovacími režimami Zabdeno a Mvabea neodhalila žiadne dôkazy o zníženej plodnosti samíc.
Všeobecné štúdie toxicity neodhalili žiadne účinky na pohlavné orgány samcov, ktoré by narušili
plodnosť samcov (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Mvabea nemá žiadny známy vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Najčastejšie lokálne nežiaduce reakcie hlásené u dospelých, ktorí dostali Mvabeu, boli bolesť (45 %),
teplo (20 %) a opuch (10 %) v mieste podania injekcie. Najčastejšie systémové nežiaduce reakcie boli
únava (30 %), myalgia (26 %) a artralgia (16 %). Väčšina nežiaducich reakcií sa vyskytla do 7 dní po
očkovaní a bola mierna až stredne závažná a krátkodobá (2 – 3 dni).
Najčastejšia lokálna nežiaduca reakcia zaznamenaná u detí vo veku 1 až 17 rokov, ktoré dostali Mvabeu, bola bolesť (21 %) v mieste podania injekcie. Najčastejšia systémová nežiaduca reakcia bola únava (11 %). Väčšina nežiaducich reakcií sa vyskytla do 7 dní po očkovaní. Väčšina nežiaducich reakcií bola mierna až stredne závažná a krátkodobá (1 – 3 dni).
Pyrexia bola hlásená častejšie u mladších detí vo veku od 1 do 3 rokov (8 %) a od 4 do 11 rokov (4 %)
v porovnaní s adolescentmi vo veku 12 až 17 rokov (2 %) a dospelými (4 %). Frekvencia pyrexie
u menších detí bola nižšia ako frekvencia pozorovaná v kontrolnej skupine s placebom.
Bezpečnostný profil Mvabey u detí vo veku 1 až 17 rokov bol vo všeobecnosti podobný profilu pozorovanému u dospelých.
Tabuľkový zoznam nežiaducich reakcií
Nežiaduce reakcie pozorované počas klinických štúdií sú uvedené nižšie podľa nasledujúcich
frekvenčných kategórií:
veľmi časté (≥ 1/10);
časté (≥ 1/100 až < 1/10);
menej časté (≥ 1/1 000 až < 1/100);
zriedkavé (≥ 1/10 000 až < 1/1 000).
V rámci každej skupiny frekvencie sú nežiaduce reakcie zoradené v poradí klesajúcej závažnosti.
DospelíTabuľka 1 uvádza nežiaduce reakcie hlásené z klinických štúdií u dospelých.
Tabuľka 1: Nežiaduce reakcie hlásené u dospelých po očkovaní Mvabeou
|
Trieda orgánových systémov
| Frekvencia
| Nežiaduce reakcie
|
Poruchy gastrointestinálneho traktu
| časté
| vracanie
|
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
| veľmi časté
| myalgia, artralgia
|
Poruchy kože a podkožného tkaniva
| menej časté
| svrbenie
|
Celkové poruchy a reakcie v mieste
podania
| veľmi časté
| únava, bolesť v mieste podania injekcie, opuch v mieste podania injekcie, teplo v mieste podania injekcie
|
časté
| svrbenie v mieste podania injekcie
|
menej časté
| indurácia v mieste podania injekcie, erytém v mieste podania injekcie
|
Deti vo veku 1 až 17 rokovTabuľka 2 uvádza nežiaduce reakcie hlásené z klinických štúdií u detí vo veku 1 až 17 rokov.
Tabuľka 2: Nežiaduce reakcie hlásené u detí vo veku 1 až 17 rokov po očkovaní Mvabeou
|
Trieda orgánových systémov
| Frekvencia
| Nežiaduce reakcie
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
| časté
| myalgia, artralgia
|
Celkové poruchy a reakcie v mieste podania
| veľmi časté
| únava, bolesť v mieste podania injekcie
|
časté
| pyrexia, zimnica, svrbenie v mieste podania injekcie, opuch v mieste podania injekcie, erytém v mieste podania injekcie
|
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii liekuje dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNeboli hlásené prípady predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Očkovacie látky, iné vírusové očkovacie látky, ATC kód: J07BX02
Mechanizmus účinkuMvabea je rekombinantná multivalentná očkovacia látka proti filovírusom, nereplikujúca sa
v ľudských bunkách, na platforme Modified Vaccinia Ankara – Bavarian Nordic (MVA-BN), ktorá
kóduje GP vírusu
Zaire ebolavirus variant Mayinga, GP vírusu
Sudan ebolavirus variant Gulu,
nukleoproteín vírusu
Taï Forest ebolavirus, GP vírusu
Marburg marburgvirus variant Musoke. GP EBOV kódovaný Zabdenom má 100 % homológiu s GP kódovaným Mvabeou. Po podaní je GP EBOV exprimovaný lokálne a stimuluje imunitnú odpoveď.
ÚčinnosťPri chýbajúcich údajoch o účinnosti z klinických štúdií sa účinnosť 2-dávkového režimu primárneho
očkovania hodnotila v štúdiách so úmyselnou expozíciou (challenge study) na nehumánnych
primátoch (NHP, z angl.
non-human primates, makaky dlhochvosté,
Macaca fascicularis), čo je
najdôležitejší zvierací model pre ochorenie EBOV. Dvojdávkový režim primárneho očkovania
podávaného v intervale 8 týždňov poskytoval ochranu až do prvej dávky 2 x 109 vírusových častíc
Zabdena v kombinácii s 1 x 108 Inf.U Mvabey v modeli úmyselnej expozície NHP letálnej
intramuskulárnej dávke EBOV Kikwit. Humorálne imunitné odpovede u NHP merané hladinou
protilátok viažucich GP EBOV silne korelovali s prežitím. Ochranný účinok u ľudí bol odvodený
z porovnania koncentrácií protilátok viažucich GP EBOV (immunobridging).
Klinická imunogenitaPri chýbajúcich údajoch o účinnosti z klinických štúdií sa ochranný účinok očkovacej látky odvodil
z údajov o imunogenite. Pri tejto analýze sa použili údaje z 5 klinických štúdií uskutočnených
v Európe, Spojených štátoch amerických a Afrike u 764 dospelých vo veku 18 až 50 rokov, ktorí
dostali 2-dávkový režim primárneho očkovania v intervale 8 týždňov. Protilátky viažuce sa na anti-GP
EBOV korelovali s ochranným účinkom proti rýchlo progredujúcej úplne smrteľnej infekcii vírusom
Ebola u nehumánnych primátov. Ľudské imunitné odpovede merané 21 dní po podaní druhej dávky
boli spojené so zvýšením predpokladanej pravdepodobnosti prežitia z 0 % (t. j. úplne smrteľná
infekcia) na 53,4 % (98,68 % IS: 33,8 %; 70,9 %) s použitím zvieracieho modelu. Na základe tejto
analýzy možno predpokladať, že očkovací režim Zabdeno, Mvabea bude mať ochranný účinok proti
ochoreniu EBOV u ľudí. Aj keď vzťah medzi titrom protilátok a prežitím bol skúmaný iba
u dospelých NHP, immunobridging uskutočnený u pediatrických pacientov, starších ľudí a osôb
infikovaných HIV naznačuje, že potenciálne ochranné účinky pre tieto populácie sú konzistentné s
účinkami, ktoré sa odhadujú u dospelých.
ImunogenitaÚdaje o imunogenite sú uvedené celkovo pre 842 dospelých a 509 detí (vo veku 1 až 17 rokov), ktorí dostali 2-dávkový režim primárneho očkovania v klinických štúdiách fázy II a III: štúdia EBL2001
v Spojenom kráľovstve a vo Francúzsku, štúdie EBL3002 a EBL3003 v Spojených štátoch amerických, štúdia EBL2002 v Ugande, Keni, Burkine Faso a Pobreží Slonoviny a štúdia EBL3001 v Sierra Leone. Koncentrácie protilátok viažucich sa špecificky na GP EBOV sa merali približne
3 týždne po dokončení 2-dávkového režimu primárneho očkovania. Uvádzajú sa ako priemerné
geometrické koncentrácie (geometric mean concentrations, GMC).
Údaje o imunogenite u dospelých po 2-dávkovom režime primárneho očkovaniaImunitná odpoveď na 2-dávkový režim primárneho očkovania podaného v 8-týždňovom intervale sa hodnotila v 5 štúdiách fázy II a III uskutočňovaných v Európe, Afrike a USA (pozri tabuľku 3). Vo všetkých štúdiách vykazovalo 98 % až 100 % účastníkov štúdie odpoveď v podobe tvorby väzbových protilátok na GP EBOV definovanú ako viacnež 2,5-násobné zvýšenie koncentrácie väzbových protilátok nad východiskovú hodnotu.
Tabuľka 3: Odpoveď na 2-dávkový očkovací režim Zabdeno, Mvabea u dospelých (8-týždňový interval) v podobe tvorby protilátok viažucich sa špecificky na GP EBOV: GMC EU/ml (95 % IS)
|
Štúdia
| Východiskové hodnoty
| 21 dní po podaní
2. dávky
| 6 mesiacov po podaní 2. dávky
| 10 mesiacov po podaní 2. dávky
|
EBL2001
| (N = 70)
< LLOQ
(< LLOQ;
< LLOQ)
| (N = 69)
10131
(8554; 11999)
|
-
| (N = 50)
1205
(971; 1497)
|
EBL2002
|
(N = 134)
39
(< LLOQ; 48)
|
(N = 136)
7518
(6468; 8740)
|
-
|
(N = 133)
342
(291; 401)
|
EBL3001
|
(N = 231)
68
(56; 81)
|
(N = 224)
3976
(3517; 4495)
|
-
|
(N = 199)
268
(234; 307)
|
EBL3002
|
(N = 140)
< LLOQ
(< LLOQ;
< LLOQ)
|
(N = 135)
11054
(9673; 12633)
|
(N = 131)
1263
(1100; 1450)
|
-
|
EBL3003
|
(N = 258)
< LLOQ
(< LLOQ;
< LLOQ)
|
(N = 254)
11052
(9959; 12265)
|
(N = 244)
1151
(1024; 1294)
|
-
|
Údaje sú uvedené pre očkovaných účastníkov, ktorí dostali 2-dávkový očkovací režim v skupine pre analýzu podľa protokolu.
EU = jednotky ELISA
IS = interval spoľahlivosti
N = počet účastníkov s údajmi
LLOQ = dolná hranica kvantifikácie
Interval medzi dávkami v týchto štúdiách bol 8 týždňov +/- 3 dni. Zatiaľ čo imunogenita očkovacích
režimov s dlhším intervalom medzi dávkami až do 69 týždňov (483 dní) bola podobná, očkovacie
režimy s intervalom 4 týždne boli menej imunogénne.
Po dvojdávkovom režime primárneho očkovania s 8-týždňovým intervalom sa pozorovali GMC EU/ml (95 % IS) 5283 (4094; 6817) u dospelých pacientov infikovaných HIV na antiretrovírusovej liečbe s počtom buniek CD4+ > 350 buniek/mikroliter a bez prejavov imunosupresie (N = 59).
Údaje o imunogenite u detí po 2-dávkovom režime primárneho očkovaniaImunitná odpoveď na 2-dávkový režim primárneho očkovania podaného v 8-týždňovom intervale sa hodnotila u detí (vo veku 1 až 17 rokov) v dvoch štúdiách uskutočnených v Afrike (pozri tabuľku 4). V týchto dvoch štúdiách vykazovalo 98 % až 100 % účastníkov štúdie odpoveď v podobe tvorby väzbových protilátok na GP EBOV. Imunitné odpovede u detí boli vyššie ako u dospelých
v rovnakých štúdiách.
Tabuľka 4: Odpoveď na 2-dávkový očkovací režim Zabdeno, Mvabea u detí vo veku 1 až 17 rokov (8-týždňový interval) v podobe tvorby protilátok viažucich sa špecificky na GP EBOV: GMC EU/ml (95 % IS)
|
Vek
|
Štúdia
| Východiskové
hodnoty
| 21 dní po
podaní 2. dávky
| 6 mesiacov po
podaní 2. dávky
| 10 mesiacov po
podaní 2. dávky
|
1 – 3 roky
| EBL3001
| (N = 123)
< LLOQ
(< LLOQ; < LLOQ)
| (N = 124)
22568
(18426; 27642)
| (N = 122)
713
(598; 849)
| (N = 120)
750
(629; 894)
|
4 – 11 rokov
| EBL2002
| (N = 52)
< LLOQ
(< LLOQ; < LLOQ)
| (N = 53)
17388
(12973; 23306)
| (N = 53)
715
(602; 851)
| (N = 54)
637
(529; 767)
|
EBL3001
| (N = 130)
62
(49; 78)
| (N = 124)
10212
(8419; 12388)
| (N = 126)
442
(377; 518)
| (N = 123)
436
(375; 506)
|
12 – 17
rokov
| EBL2002
| (N = 53)
< LLOQ
(< LLOQ; 37)
| (N = 53)
13532
(10732; 17061)
| (N = 41)
577
(454; 734)
| (N = 52)
541
(433; 678)
|
EBL3001
| (N = 142)
65
(52; 81)
| (N = 134)
9929
(8172; 12064)
| (N = 135)
469
(397; 554)
| (N = 132)
386
(326; 457)
|
Údaje sú uvedené pre očkovaných účastníkov, ktorí dostali 2-dávkový očkovací režim v skupine pre analýzu podľa protokolu.
EU = jednotky ELISA
IS = interval spoľahlivosti
N = počet účastníkov s údajmi
LLOQ = dolná hranica kvantifikácie
Údaje o imunogenite u dospelých po preočkovaní Zabdenom
Imunitná odpoveď na preočkovanie Zabdenom vykonanom 1 alebo 2 roky po primárnom očkovacom režime sa hodnotila v 2 klinických štúdiách (pozri tabuľku 5). Preočkovanie viedlo k rýchlej aktivácii anamnestickej odpovede so 40- až 56-násobným zvýšením koncentrácií protilátok do 7 dní. Rozsah odpovede, pokiaľ ide o násobok nárastu GMC a ich hodnotu po preočkovaní, bol podobný bez ohľadu na čas od primárneho očkovania (1 alebo 2 roky).
Tabuľka 5: Odpoveď na preočkovanie Zabdenom u dospelých v podobe tvorby protilátok viažucich sa špecificky na GP EBOV: GMC EU/ml (95 % IS)
|
Štúdia
| Pred preočkovaním
| 7 dní po preočkovaní
| 21 dní po preočkovaní
| 1 rok po preočkovaní
|
EBL2002a
| (N = 39)
366
(273; 491)
| (N = 39)
20416
(15432; 27009)
| (N = 39)
41643
(32045; 54116)
| (N = 37)
4383
(2969; 6470)
|
EBL3001b
| (N = 29)
274
(193; 387)
| (N = 25)
11166
(5881; 21201)
| (N = 29)
30411
(21972; 42091)
| (N = 26)
3237
(2305; 4547)
|
a preočkovanie vykonané 1 rok po primárnom očkovaní
b preočkovanie vykonané 2 roky po primárnom očkovaní
Údaje sú uvedené pre očkovaných účastníkov, ktorí boli preočkovaní v skupine pre analýzu podľa protokolu.
EU = jednotky ELISA
IS = interval spoľahlivosti
N = počet účastníkov s údajmi
Dlhodobé pretrvávanie protilátok u dospelýchTri týždne po ukončení 2-dávkového režimu primárneho očkovania dosahuje imunitná odpoveď
(GMC) vrchol („A“ na obrázku 1 nižšie). Po dosiahnutí vrcholu odpoveď klesá do 6. mesiaca
a zostáva stabilná najmenej 1 rok po podaní dávky 1 (tabuľka 3). Ako vyplýva z údajov o 43'
dospelých v štúdii EBL3001, odpoveď zostáva stabilná aj po dvoch rokoch od podania dávky 1
(posledný dostupný časový bod) („B“ na obrázku 1 nižšie). Po preočkovaní Zabdenom sa pozoruje
rýchla anamnestická odpoveď do 7 dní. Najvyššie koncentrácie väzbových protilátok sa pozorujú
21 dní po preočkovaní („C“ na obrázku 1 nižšie), po čom nasleduje pokles koncentrácií protilátok.
Jeden rok po preočkovaní boli GMC vyššie ako pred podaním preočkovacej dávky („D“ na obrázku 1
nižšie).
Obrázok 1. Odpovede v podobe tvorby protilátok viažucich sa špecificky na GP EBOV po 2- dávkovom očkovacom režime Zabdeno, Mvabea a preočkovaní Zabdenom 2 roky po primárnom očkovacom režime u dospelých v štúdii EBL3001
a
; GMC (95 % IS)
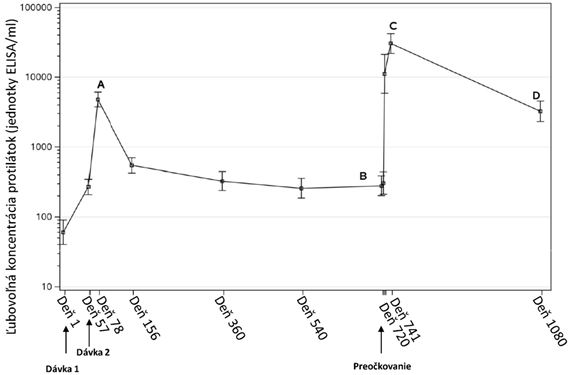
a Analýza je založená na skupine pre analýzu podľa protokolu.
Chybové úsečky predstavujú priemernú geometrickú koncentráciu a jej 95 % interval spoľahlivosti.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Mvabeou na prevenciu ochorenia spôsobeného vírusom Ebola v jednej alebo vo viacerých podskupinách pediatrickej populácie (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Tento liek bol registrovaný za tzv. mimoriadnych okolností. To znamená, že z vedeckých dôvodov nebolo možné získať všetky informácie o tomto lieku. Európska agentúra pre lieky každý rok posúdi nové dostupné informácie o tomto liekua tento súhrn charakteristických vlastností liekubude podľa potreby aktualizovať.
5.2 Farmakokinetické vlastnostiNeaplikovateľné.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe štúdií toxicity po opakovanom podávaní a lokálnej tolerancie a štúdií reprodukčnej toxicity na králikoch neodhalili žiadne osobitné riziko pre ľudí.
Všeobecné štúdie toxicity (opakovaná dávka) vrátane lokálnej tolerancieOčkovanie králikov rôznymi očkovacími režimami Zabdeno a Mvabea bolo pri intramuskulárnom
podaní pri plnej dávke pre ľudí dobre tolerované. Ukázalo sa, že nálezy súvisiace s očkovacou látkou
(prejavujúce sa zápalovými zmenami v mieste podania injekcie, zvýšením fibrinogénu, C-reaktívneho
proteínu a globulínu, a mikroskopickénálezy v podobe zvýšenej lymfoidnej celularity a/alebo
zárodočných centier v drenážnych lymfatických uzlinách a slezine) sa obnovujú 2 týždne po
poslednom očkovaní a odrážajú normálnu fyziologickú odpoveď spojenú s vakcináciou. Neboli
zaznamenané žiadne účinky, ktoré by sa považovali za nežiaduce.
Plodnos
ť
/reproduk
č
n
á a vývinová toxicita
Štúdie biodistribúcie uskutočnené na králikoch nepreukázali distribúciu vektora MVA-BN do gonád
(semenníky, vaječníky) po i.m. injekcii.
Všeobecné štúdie toxicity (opakovaná dávka) očkovacích režimov Zabdeno a Mvabea neodhalili žiadne účinky na pohlavné orgány samcov, ktoré by zhoršili plodnosť samcov. Okrem toho štúdie o všeobecnej a/alebo reprodukčnej toxicite neodhalili žiadne dôkazy o zníženej plodnosti samíc.
V štúdii reprodukčnej toxicity nevyvolali očkovacie režimy Zabdeno a Mvabea materskú ani vývinovú
toxicitu po expozícii matiek počas obdobia pred párením a počas gravidity. V tejto štúdii očkovacie
režimy vyvolali detegovateľné titre materských protilátok viažucich sa špecificky na GP EBOV, ktoré
sa preniesli na plody.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Chlorid sodný Trometamol Voda na injekcie
Kyselina chlorovodíková (na úpravu pH)
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa Mvabea nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
4 roky pri teplote -85 °C až -55 °C
6.4 Špeciálne upozornenia na uchovávanie
Prepravujte v zmrazenom stave pri teplote -25 °C až -15 °C. Po prevzatí sa liek môže uchovávať, ako je uvedené nižšie:
Uchovávajte v mrazničke pri teplote -85 °C až -55 °C u distribútora v prípade skladovania. Dátum exspirácie pre uchovávanie pri teplote -85 °C až -55 °C je uvedený na injekčnej liekovke a vonkajšom obale po EXP.
Distribútor alebo koncový používateľ môže očkovaciu látku uchovávať aj v mrazničke pri teplote -25 °C až -15 °C počas jedného obdobia až 7 mesiacov. Po vybratí z mrazničky
s teplotou -85 °C až -55 °C musí distribútor alebo koncový používateľ napísať na vonkajší obal nový
dátum exspirácie a očkovacia látka sa má použiť alebo sa má po uplynutí 7 mesiacov zlikvidovať.
Tento nový dátum exspirácie nemá byť neskôr ako pôvodný dátum exspirácie (EXP). Pôvodný dátum
exspirácie má byť nečitateľný.
Distribútor alebo koncový používateľ môže očkovaciu látku uchovávať aj v chladničke pri teplote
2 °C až 8 °C počas jedného obdobia až 1 mesiac. Po premiestnení liekudo prostredia uchovávania pri
teplote 2 °C až 8 °C musí distribútor alebo koncový používateľ napísať na vonkajší obal dátum
likvidácie a očkovacia látka sa má použiť alebo sa má po uplynutí 1 mesiaca zlikvidovať. Tento dátum
likvidácie nemá byť neskôr ako pôvodný dátum exspirácie (EXP) alebo nový dátum exspirácie určený
pre podmienky uchovávania pri teplote -25 °C až -15 °C. Pôvodný dátum exspirácie a/alebo nový
dátum exspirácie určený pre podmienky uchovávania pri teplote ‑25 °C až ‑15 °C majú byť
nečitateľné.
Po rozmrazení sa očkovacia látka nesmie znovu zmraziť.
Injekčná liekovka sa musí uchovávať v pôvodnom obale na ochranu pred svetlom a za účelom sledovania dátumu exspirácie alebo likvidácie pre rôzne podmienky uchovávania.
6.5 Druh obalu a obsah balenia
0,5 ml suspenzia v jednodávkovej sklenenej injekčnej liekovke typu I s gumovou zátkou (chlórbutylová s povrchom potiahnutým fluórpolymérom), hliníkovým lemom a žltým plastovým uzáverom.
Veľkosť balenia: 20 jednodávkových injekčných liekoviek.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Mvabea je svetložltá, číra až mliečna suspenzia. Pred podaním sa má očkovacia látka vizuálne skontrolovať, či neobsahuje pevné častice a či nedošlo k zmene farby. Pred podaním sa má injekčná liekovka vizuálne skontrolovať kvôli prasklinám alebo akýmkoľvek abnormalitám, napríklad prejavom nedovoleného zaobchádzania. Ak sa čokoľvek z toho vyskytne, očkovaciu látku nepodávajte.
Ak sa očkovacia látka vyberie z mrazničky a rozmrazí, použite ju ihneď alebo ju uchovávajte
v chladničke pri teplote 2 °C až 8 °C (pozri časť 6.4). Ak sa očkovacia látka vyberie z chladničky za
účelom podania, má sa použiť ihneď.
Opatrne premiešajte obsah injekčnej liekovky krúživým pohybom po dobu 10 sekúnd. Netraste. Na extrakciu celého obsahu z injekčnej liekovky na podanie použite sterilnú ihlu a sterilnú striekačku.
Pre každú osobu použite samostatnú sterilnú ihlu a striekačku. Nie je potrebné vymeniť ihly medzi extrakciou očkovacej látky z injekčnej liekovky a jej aplikáciou príjemcovi, pokiaľ nie je ihla poškodená alebo kontaminovaná. Všetok zostávajúci obsah v injekčnej liekovke sa musí zlikvidovať.
Všetok nepoužitý liek alebo odpad vzniknutý z liekusa má zlikvidovať v súlade s národnými požiadavkami. Prípadná rozliata tekutina sa má dezinfikovať látkami s viricídnou aktivitou proti vírusu vakcínie.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Janssen-Cilag International NV Turnhoutseweg 30
B-2340 Beerse
Belgicko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/20/1445/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: {DD. mesiac RRRR}
10. DÁTUM REVÍZIE TEXTU
{MM/RRRR}
Podrobné informácie o tomto liekusú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.euNasledujúca informácia je určená len pre zdravotníckych pracovníkov:· Tak ako v prípade všetkých injekčných očkovacích látok musí byť vždy k dispozícii vhodná lekárska starostlivosť a dohľad pre prípad anafylaktickej reakcie po podaní Mvabey. Osoby majú byť pozorované zdravotníckym pracovníkom najmenej 15 minút po očkovaní.
· Mvabea sa nesmie miešať s inými liekmi v tej istej striekačke.
· Mvabea sa za žiadnych okolností nesmie podávať intravaskulárnou injekciou.
· Imunizácia sa má vykonať intramuskulárnou (i.m.) injekciou, prednostne do hornej časti ramena
v oblasti deltového svalu alebo do stehna.
· Synkopa (mdloba) sa môže vyskytnúť po akomkoľvek očkovaní alebo aj pred ním ako
psychogénna reakcia na injekciu s ihlou. Majú byť zavedené postupy na zabránenie zraneniu
následkom pádu a na zvládnutie synkopálnych reakcií.
Pokyny na podávanie a manipuláciuMvabea je svetložltá, číra až mliečna suspenzia. Pred podaním sa má očkovacia látka vizuálne skontrolovať, či neobsahuje pevné častice a či nedošlo k zmene farby. Pred podaním sa má injekčná liekovka vizuálne skontrolovať kvôli prasklinám alebo akýmkoľvek abnormalitám, napríklad prejavom nedovoleného zaobchádzania. Ak sa čokoľvek z toho vyskytne, očkovaciu látku nepodávajte.
Ak sa očkovacia látka vyberie z mrazničky a rozmrazí, použite ju ihneď alebo ju uchovávajte
v chladničke pri teplote 2 °C až 8 °C (pozri časť 6.4). Ak sa očkovacia látka vyberie z chladničky za
účelom podania, má sa použiť ihneď.
Opatrne premiešajte obsah injekčnej liekovky krúživým pohybom po dobu 10 sekúnd. Netraste. Na extrakciu celého obsahu z injekčnej liekovky na podanie použite sterilnú ihlu a sterilnú striekačku.
Pre každú osobu použite samostatnú sterilnú ihlu a striekačku. Nie je potrebné vymeniť ihly medzi extrakciou očkovacej látky z injekčnej liekovky a jej aplikáciou príjemcovi, pokiaľ nie je ihla poškodená alebo kontaminovaná. Všetok zostávajúci obsah v injekčnej liekovke sa musí zlikvidovať.
Všetok nepoužitý liek alebo odpad vzniknutý z liekusa má zlikvidovať v súlade s národnými požiadavkami. Prípadná rozliata tekutina sa má dezinfikovať látkami s viricídnou aktivitou proti vírusu vakcínie.
Informácie o uchovávaníNepoužívajte túto očkovaciu látku po dátume exspirácie, ktorý je uvedený na škatuli po EXP. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci.
Prepravujte v zmrazenom stave pri teplote -25 °C až -15 °C. Po prevzatí sa liek môže uchovávať, ako je uvedené nižšie:
Uchovávajte v mrazničke pri teplote -85 °C až -55 °C u distribútora v prípade skladovania. Dátum exspirácie pre uchovávanie pri teplote -85 °C až -55 °C je uvedený na injekčnej liekovke a vonkajšom obale po EXP.
Distribútor alebo koncový používateľ môže očkovaciu látku uchovávať aj v mrazničke pri teplote -25 °C až -15 °C počas jedného obdobia až 7 mesiacov. Po vybratí z mrazničky
s teplotou -85 °C až -55 °C musí distribútor alebo koncový používateľ napísať na vonkajší obal nový
dátum exspirácie a očkovacia látka sa má použiť alebo sa má po uplynutí 7 mesiacov zlikvidovať.
Nový dátum exspirácie nemá byť neskôr ako pôvodný dátum exspirácie (EXP). Pôvodný dátum
exspirácie má byť nečitateľný.
Distribútor alebo koncový používateľ môže očkovaciu látku uchovávať aj v chladničke pri teplote
2 °C až 8 °C počas jedného obdobia až 1 mesiac. Po premiestnení liekudo prostredia uchovávania pri
teplote 2 °C až 8 °C musí distribútor alebo koncový používateľ napísať na vonkajší obal dátum
likvidácie a očkovacia látka sa má použiť alebo sa má po uplynutí 1 mesiaca zlikvidovať. Tento dátum
likvidácie nemá byť neskôr ako pôvodný dátum exspirácie (EXP) alebo nový dátum exspirácie určený
pre podmienky uchovávania pri teplote -25 °C až -15 °C. Pôvodný dátum exspirácie a/alebo nový
dátum exspirácie určený pre podmienky uchovávania pri teplote ‑25 °C až ‑15 °C majú byť
nečitateľné.
Po rozmrazení sa očkovacia látka nesmie znovu zmraziť.
Injekčná liekovka sa musí uchovávať v pôvodnom obale na ochranu pred svetlom a za účelom sledovania dátumu exspirácie alebo likvidácie pre rôzne podmienky uchovávania.
PRÍLOHA IVZÁVERY TÝKAJÚCE SA UDELENIA POVOLENIA NA UVEDENIE NA TRH ZA MIMORIADNYCH OKOLNOSTÍ, PREDLOŽENÉ EURÓPSKOU AGENTÚROU PRE LIEKYZávery predložené Európskou agentúrou pre lieky:·
Povolenie na uvedenie na trh za mimoriadnych okolnostíVýbor CHMP po posúdení žiadosti zastáva názor, že vyváženosť rizika a prínosu je priaznivá, a preto odporúča udeliť povolenie na uvedenie na trh za mimoriadnych okolností, ako je to podrobnejšie opísané v Európskej verejnej hodnotiacej správe.