
adna úprava dávky. Odporúča sa však sledovať pacientov užívajúcich perorálne lieky s úzkym terapeutickým indexom (napr. warfarín, digoxín), najmä na začiatku liečby tirzepatidom a po zvýšení dávky. Riziko oneskoreného účinku sa má zvážiť aj pri perorálnych liekoch, pre ktoré je dôležitý rýchly nástup účinku.
Paracetamol
Po jednorazovej dávke 5 mg tirzepatidu sa maximálna plazmatická koncentrácia (Cmax) paracetamolu
znížila o 50 % a medián (tmax) sa oneskoril o 1 hodinu. Účinok tirzepatidu na perorálnu absorpciu paracetamolu závisí od dávky a času. Pri nízkych dávkach (0,5 a 1,5 mg) došlo len k malej zmene expozície paracetamolu. Po štyroch po sebe nasledujúcich týždenných dávkach tirzepatidu
(5/5/8/10 mg) sa nepozoroval žiadny účinok na Cmax a tmax paracetamolu. Celková expozícia (AUC)
nebola ovplyvnená. Pri podávaní s tirzepatidom nie je potrebná žiadna úprava dávky paracetamolu.
Perorálne kontraceptíva
Podávanie kombinovaných perorálnych kontraceptív (0,035 mg etinylestradiolu s 0,25 mg
norgestimátu, prekurzoru norelgestromínu) v prítomnosti jednej dávky tirzepatidu (5 mg) viedlo k zníženiu Cmax perorálnych kontraceptív a plochy pod krivkou (AUC). Cmax etinylestradiolu sa znížila o
59 % a AUC o 20 % s oneskorením tmax o 4 hodiny. Cmax norelgestromínu sa znížila o 55 % a AUC o
23 % s oneskorením tmax o 4,5 hodiny. Cmax norgestimátu sa znížila o 66 % a AUC o 20 %
s oneskorením tmax o 2,5 hodiny. Toto zníženie expozície po jednorazovej dávke tirzepatidu sa nepovažuje za klinicky významné. Nie je potrebná žiadna úprava dávky perorálnych kontraceptív.
4.6
Fertilita, gravidita a laktácia
G
r
avidita
Nie sú k dispozícii žiadne alebo je len obmedzené množstvo údajov o užívaní tirzepatidu u gravidných
žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Tirzepatid sa neodporúča užívať počas tehotenstva ani u žien vo fertilnom veku, ktoré nepoužívajú antikoncepciu.
DojčenieNie je známe, či sa tirzepatid vylučuje do ľudského materského mlieka. Riziko pre
novorodencov/dojčatá sa nedá vylúčiť.
Rozhodnutie, či prerušiť dojčenie alebo ukončiť/nenasadiť liečbu tirzepatidom, sa musí urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
FertilitaÚčinok tirzepatidu na fertilitu u ľudí nie je známy.
Štúdie na zvieratách s tirzepatidom nepreukázali priame škodlivé účinky na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeTirzepatid nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Ak sa tirzepatid užíva v kombinácii s derivátmi sulfonylmočoviny alebo inzulínom, pacientov je potrebné upozorniť, aby prijali opatrenia na zabránenie hypoglykémii počas vedenia vozidiel
a obsluhy strojov (pozri časť 4.4).
4.8 Nežiaduce účinkyZhrnutie bezpečnostného profiluV 7 dokončených štúdiách fázy 3 bolo 5 119 pacientov vystavených tirzepatidu samotnému alebo
v kombinácii s inými liekmi znižujúcimi hladinu glukózy. Najčastejšie hlásené nežiaduce účinky boli gastrointestinálne poruchy vrátane nauzey (veľmi časté), hnačky (veľmi časté) a vracania (časté). Vo
všeobecnosti boli tieto reakcie väčšinou mierne alebo stredne závažné, častejšie sa vyskytovali počas
zvyšovania dávky a časom ubúdali (pozri časti 4.2 a 4.4).
Zoznam nežiaducich účinkovvtabuľkeNasledujúce súvisiace nežiaduce účinky z klinických štúdií sú nižšie zoradené podľa triedy
orgánových systémov a podľa klesajúcej frekvencie výskytu (veľmi časté: ≥ 1/10; časté: ≥ 1/100 až
< 1/10; menej časté: ≥ 1/1 000 až < 1/100; zriedkavé: ≥ 1/10 000 až < 1/1 000; veľmi zriedkavé:
< 1/10 000). V rámci každej skupiny výskytu sú nežiaduce účinky usporiadané v poradí klesajúcej frekvencie výskytu.
Tabuľka č 1. Nežiaduce účinkyTrieda orgánových
systémov
| Veľmi časté
| Časté
| Menej časté
|
Poruchy imunitného
systému
|
| hypersenzitívne reakcie
|
|
T
rieda orgánových systémov
|
V
eľmi časté
|
Č
asté
|
Menej časté
|
Poruchy metabolizmu
a výživy
|
hypoglykémia* pri užívaní s derivátmi sulfonylmočoviny alebo inzulínom
|
hypoglykémia* pri užívaní s metformínom a SGLT2i,
znížená chuť do jedla
|
hypoglykémia* pri užívaní
s metformínom,
redukcia hmotnosti
|
Poruchy gastrointestinálneho
t
raktu
|
nauzea, hnačka
|
bolesť brucha, vracanie, dyspepsia,
zápcha,
abdominálna distenzia, eruktácia, plynatosť, gastroezofageálna
refluxná choroba
|
cholelitiáza, akútna pankreatitída
|
C
elkové poruchy
a reakcie v mieste podania
|
|
únava†, reakcie
v mieste podania injekcie
|
|
L
aboratórne
a funkčné vyšetrenia
|
|
Zvýšená srdcová frekvencia, zvýšená lipáza, zvýšená amyláza
|
Zvýšená hladina kalcitonínu v krvi
|
* Hypoglykémia definovaná nižšie.
† Únava zahŕňa pojmy únava, asténia, malátnosť a letargia
Opis vybraných nežiaducichreakciíHypersenzitívnereakcieV skupine placebom kontrolovaných štúdií boli hlásené reakcie z precitlivenosti na tirzepatid, niekedy
závažné (napr. žihľavka a ekzém); reakcie z precitlivenosti boli hlásené u 3,2 % pacientov liečených tirzepatidom v porovnaní s 1,7 % pacientov liečených placebom.
HypoglykémiaKlinicky významná hypoglykémia (glykémia < 3,0 mmol/l (< 54 mg/dl) alebo závažná hypoglykémia
(vyžadujúca pomoc inej osoby)) sa vyskytla u 10 až 14 % (0,14 až 0,16 epizód/pacientský rok)
pacientov, ak bol tirzepatid pridaný k derivátom sulfonylmočoviny a u 14 až 19 % (0,43 až
0,64 epizód/pacientský rok) pacientov, ak bol tirzepatid pridaný k bazálnemu inzulínu.
Miera klinicky významnej hypoglykémie, ak bol tirzepatid použitý v monoterapii alebo pridaný
k iným perorálnym antidiabetickým liekom, bola do 0,04 epizód/pacientský rok (pozri tabuľku č. 1 a časti 4.2, 4.4 a 5.1).
V klinických štúdiách fázy 3 hlásilo 10 (0,2 %) pacientov 12 epizód závažnej hypoglykémie. Z týchto
10 pacientov užívalo 5 (0,1 %) súčasne liečbu inzulínom glargínom alebo derivátmi sulfonylmočoviny, pričom každý hlásil 1 epizódu.
Gastrointestinálne nežiaduce reakcieV placebom kontrolovaných štúdiách fázy 3 sa gastrointestinálne poruchy zvýšili v závislosti od
dávky pre tirzepatid 5 mg (37,1 %), 10 mg (39,6 %) a 15 mg (43,6 %) v porovnaní s placebom
(20,4 %). Nauzea sa vyskytla u 12,2 %, 15,4 % a 18,3 % oproti 4,3 % a hnačka u 11,8 %, 13,3 % a 16,2 % oproti 8,9 % pri tirzepatide 5 mg, 10 mg a 15 mg oproti placebu. Gastrointestinálne nežiaduce reakcie boli väčšinou mierne (74 %) alebo stredne závažné (23,3 %). Výskyt nauzey, vracania a hnačky bol vyšší počas obdobia zvyšovania dávky a časom klesal.
Viac jedincov v skupinách s tirzepatidom 5 mg (3,0 %), 10 mg (5,4 %) a 15 mg (6,6 %) v porovnaní so skupinou s placebom (0,4 %) trvalo prerušilo liečbu kvôli gastrointestinálnej príhode.
I
m
unogenita
U 5 025 tirzepatidom liečených pacientov v klinických štúdiách fázy 3 sa hodnotili protilátky proti
lieku (anti-drug antibodies, ADA). Z nich sa u 51,1 % vyvinuli liečbou vyvolané (treatment-emergent, TE) ADA počas trvania liečby. U 38,3 % hodnotených pacientov boli TE ADA perzistujúce (ADA
prítomné počas obdobia 16 týždňov alebo dlhšie). 1,9 % a 2,1 % malo neutralizačné protilátky proti
aktivite tirzepatidu na receptory glukózo-dependentného inzulínotropného polypeptidu (GIP) a receptory glukagónu podobného peptidu-1 (GLP-1) v uvedenom poradí a 0,9 %a 0,4 % malo
neutralizačné protilátky proti natívnemu GIP a GLP-1 v uvedenom poradí. Nevyskytol sa žiaden
dôkaz o zmenenom farmakokinetickom profile ani o vplyve na účinnosť a bezpečnosť tirzepatidu v súvislosti s rozvojom ADA.
Srdcová frekvenciaV placebom kontrolovaných štúdiách fázy 3 viedla liečba tirzepatidom k priemernému zvýšeniu
srdcovej frekvencie o 3 až 5 úderov za minútu. U placebom liečených pacientov bolo priemerné zvýšenie srdcovej frekvencie o 1 úder za minútu.
Výskyt pacientov, ktorí mali zmenu základnej srdcovej frekvencie > 20 tepov za minútu pri 2 alebo viacerých po sebe nasledujúcich návštevách, bol 2,1 %, 3,8 % a 2,9 % pre tirzepatid 5 mg, 10 mg
a 15 mg v uvedenom poradí v porovnaní s 2,1 % pre placebo.
Malé priemerné predĺženia PR intervalu sa pozorovali pri tirzepatide v porovnaní s placebom
(priemerné zvýšenie o 1,4 až 3,2 ms a priemerné zníženie o 1,4 ms). Medzi tirzepatidom 5 mg, 10 mg,
15 mg a placebom sa pri liečbe nepozoroval žiadny rozdiel vo výskyte arytmie a porúch srdcového vedenia (3,8 %, 2,1 %, 3,7 % a 3 % v uvedenom poradí).
Reakcie v mieste podania injekcieV placebom kontrolovaných štúdiách fázy 3 boli reakcie v mieste podania injekcie pre tirzepatid
zvýšené (3,2 %) v porovnaní s placebom (0,4 %).
Celkovo v štúdiách fázy 3 boli najčastejšími príznakmi a prejavmi reakcií v mieste vpichu erytém
a pruritus. Maximálna závažnosť reakcií v mieste vpichu u pacientov bola mierna (90 %) alebo stredná
(10 %). Žiadne z reakcií v mieste vpichu neboli závažné.
Pankreatické enzýmyV placebom kontrolovaných štúdiách fázy 3 viedla liečba tirzepatidom k priemernému zvýšeniu
hladiny pankreatickej amylázy oproti vstupným hodnotám o 33 % až 38 % a lipázy o 31 % až 42 %. U pacientov liečených placebom došlo k zvýšeniu hladiny amylázy oproti vstupným hodnotám o 4 % a u lipázy neboli pozorované žiadne zmeny.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieV prípade predávkovania sa má začať s vhodnou podpornou liečbou podľa klinických príznakov
a prejavov pacienta. U pacientov sa môžu vyskytnúť gastrointestinálne nežiaduce reakcie vrátane nauzey. Pri predávkovaní tirzepatidom neexistuje žiadne špecifické antidotum. Ak berieme do úvahy
polčas eliminácie tirzepatidu (približne 5 dní), môže byť potrebné dlhšie obdobie pozorovania a liečby týchto príznakov.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antidiabetiká, antidiabetiká s výnimkou inzulínov, ATC kód: zatiaľ
nepridelený
Mechanizmus účinku
Tirzepatid je dlhodobo účinkujúci duálny agonista GIP a GLP-1 receptora. Oba receptory sú prítomné
na pankreatických α- a β-endokrinných bunkách, v mozgu, v srdci, vaskulatúre, imunitných bunkách
(leukocytoch), v čreve a obličkách. GIP receptory sú tiež prítomné v adipocytoch.
Tirzepatid je vysoko selektívny voči ľudským receptorom GIP a GLP-1. Tirzepatid má vysokú afinitu k obom receptorom GIP a GLP-1. Aktivita tirzepatidu na GIP receptore je podobná ako u natívneho GIP hormónu. Aktivita tirzepatidu na GLP-1 receptore je v porovnaní s natívnym GLP-1 hormónom nižšia.
Kontrola glykémie
Tirzepatid zlepšuje glykemickú kontrolu znižovaním koncentrácií glukózy nalačno a po jedle
u pacientov s diabetom 2. typu prostredníctvom niekoľkých mechanizmov.
Farmakodynamické účinky
Sekréciainzulínu
Tirzepatid zvyšuje citlivosť pankreatických β-buniek na glukózu. Zvyšuje prvú a druhú fázu sekrécie
inzulínu glukózo-dependentným spôsobom.
V hyperglykemickej clamp štúdii sa u pacientov s diabetom 2. typu tirzepatid porovnával s placebom a selektívne sa viažucim agonistom GLP-1 receptora semaglutidom 1mg na sekréciu inzulínu. Tirzepatid 15 mg zvýšil rýchlosť prvej fázy sekrécie inzulínu o 466 % oproti vstupným hodnotám
a rýchlosť druhej fázy o 302 %. U placeba nedošlo k žiadnej zmene v prvej ani druhej fáze rýchlosti sekrécie inzulínu.
Citlivosť na inzulín
Tirzepatid zlepšuje citlivosť na inzulín.
Tirzepatid 15 mg zlepšil citlivosť celého tela na inzulín o 63 %, merané podľa hodnoty M, čo je miera absorpcie glukózy tkanivom pomocou hyperinzulínového euglykemického clampu. Hodnota M sa
u placeba nemenila.
Tirzepatid znižuje telesnú hmotnosť u pacientov s diabetom 2. typu, čo môže prispieť k zlepšeniu citlivosti na inzulín. Znížený príjem potravy pri užívaní tirzepatidu prispieva k zníženiu telesnej hmotnosti. Redukcia telesnej hmotnosti je spôsobená najmä redukciou tukovej hmoty.
Koncentrácia glukagónu
Tirzepatid znižoval koncentrácie glukagónu nalačno a po jedle glukózo-dependentným spôsobom.
Tirzepatid 15 mg znížil koncentrácie glukagónu nalačno o 28 % a AUC glukagónu po zmiešanom
jedle o 43 %, v porovnaní so žiadnou zmenou pri užívaní placeba.
V
yprázdňovanie
ž
alúdka
Tirzepatid spomaľuje vyprázdňovanie žalúdka, čo môže spomaliť absorpciu glukózy po jedle a môže
viesť k priaznivému účinku na postprandiálnu glykémiu. Tirzepatidom vyvolané oneskorené vyprázdňovanie žalúdka časom slabne.
Klinická účinnosť abezpečnosť
Bezpečnosť a účinnosť tirzepatidu sa hodnotili v piatich globálnych, randomizovaných,
kontrolovaných štúdiách fázy 3 (SURPASS 1-5), v ktorých sa ako primárny cieľ hodnotila kontrola glykémie. Do štúdií bolo zaradených 6 263 liečených pacientov s diabetom 2. typu (4 199 liečených tirzepatidom). Sekundárne ciele zahŕňali telesnú hmotnosť, sérovú glukózu nalačno (fasting serum glucose, FSG) a podiel pacientov, ktorí dosiahli cieľovú hodnotu HbA1c. Všetkých päť štúdií
fázy 3 hodnotilo tirzepatid 5 mg, 10 mg a 15 mg. Všetci pacienti liečení tirzepatidom začali s dávkou
2,5 mg počas 4 týždňov. Potom sa dávky tirzepatidu zvyšovali každé 4 týždne o 2,5 mg dovtedy, kým nedosiahli svoju určenú dávku.
Vo všetkých štúdiách liečba tirzepatidom preukázala trvalé, štatisticky signifikantné a klinicky významné zníženie hodnôt HbA1c oproti vstupným hodnotám v porovnaní s liečbou placebom alebo aktívnou kontrolou (semaglutid, inzulín degludek a inzulín glargín) po dobu až 1 rok. V 1 štúdii tieto účinky pretrvávali až 2 roky. Rovnako boli preukázané štatisticky signifikantné a klinicky významné zníženie telesnej hmotnosti oproti vstupným hodnotám. Výsledky zo štúdií fázy 3 sú uvedené nižšie na základe údajov o liečbe bez záchrannej terapie v populácii s modifikovaným zámerom liečby
(modified intent-to-treat, mITT) pozostávajúcej zo všetkých náhodne zaradených pacientov, ktorí boli
vystavení najmenej 1 dávke skúšaného lieku, s výnimkou pacientov, ktorí liečbu skúšaným liekom prerušili z dôvodu chybného zaradenia.
SURPASS 1 - monoterapia
V 40-týždňovej dvojito zaslepenej placebom kontrolovanej štúdii bolo 478 pacientov s nedostatočnou
glykemickou kontrolou s diétou a cvičením randomizovaných na tirzepatid 5 mg, 10 mg alebo 15 mg raz týždenne alebo placebo. Priemerný vek pacientov bol 54 rokov a 52 % tvorili muži. Na začiatku liečby mali pacienti priemerné trvanie diabetu 5 rokov a priemerné BMI bolo 32 kg/m2.
T
abuľka č. 2. SURPASS 1: Výsledky v 40. týždni
|
T
i
rzepatid
5 mg
|
T
i
rzepatid
10 mg
|
T
i
rzepatid
15 mg
|
Placebo
|
m
ITT populácia (n)
|
121
|
121
|
120
|
113
|
H
bA
1c
(
%)
|
Východisková hodnota
(priemer)
|
7,97
|
7,88
|
7,88
|
8,08
|
Zmena oproti
východiskovej hodnote
|
-1,87##
|
-1,89##
|
-2,07##
|
+0,04
|
Rozdiel oproti placebu
[95 % CI]
|
-1,91**
[-2,18; -1,63]
|
-1,93**
[-2,21; -1,65]
|
-2,11**
[-2,39; -1,83]
|
-
|
H
bA
1c
(
m
m
ol/mol)
|
Východisková hodnota
(priemer)
|
63,6
|
62,6
|
62,6
|
64,8
|
Zmena oproti
východiskovej hodnote
|
-20,4##
|
-20,7##
|
-22,7##
|
+0,4
|
Rozdiel oproti placebu
[95 % CI]
|
-20,8**
[-23,9; -17,8]
|
-21,1**
[-24,1; -18,0]
|
-23,1**
[-26,2; -20,0]
|
-
|
Pacienti (%)
dosahujúci
H
bA
1c
|
< 7 %
|
86,8**
|
91,5**
|
87,9**
|
19,6
|
≤ 6,5 %
|
81,8††
|
81,4††
|
86,2††
|
9,8
|
< 5,7 %
|
33,9**
|
30,5**
|
51,7**
|
0,9
|
FSG (mmol/l)
|
Východisková hodnota
(priemer)
|
8,5
|
8,5
|
8,6
|
8,6
|
Zmena oproti
východiskovej hodnote
|
-2,4##
|
-2,6##
|
-2,7##
|
+0,7#
|
Rozdiel oproti placebu
[95 % CI]
|
-3,13**
[-3,71; -2,56]
|
-3,26**
[-3,84; -2,69]
|
-3,45**
[-4,04; -2,86]
|
-
|
FSG (mg/dl)
|
Východisková hodnota
(priemer)
|
153,7
|
152,6
|
154,6
|
155,2
|
Zmena oproti
východiskovej hodnote
|
-43,6##
|
-45,9##
|
-49,3##
|
+12,9#
|
Rozdiel oproti placebu
[95 % CI]
|
-56,5**
[-66,8; -46,1]
|
-58,8**
[-69,2; -48,4]
|
-62,1**
[-72,7; -51,5]
|
-
|
T
elesná
hmotnosť (kg)
|
Východisková hodnota
(priemer)
|
87,0
|
85,7
|
85,9
|
84,4
|
Zmena oproti
východiskovej hodnote
|
-7,0##
|
-7,8##
|
-9,5##
|
-0,7
|
Rozdiel oproti placebu
[95 % CI]
|
-6,3**
[-7,8; -4,7]
|
-7,1**
[-8,6; -5,5]
|
-8,8**
[-10,3; -7,2]
|
-
|
Pacienti (%)
dosahujúci pokles hmotnosti
|
≥ 5 %
|
66,9††
|
78,0††
|
76,7††
|
14,3
|
≥ 10 %
|
30,6††
|
39,8††
|
47,4††
|
0,9
|
≥ 15 %
|
13,2†
|
17,0†
|
26,7†
|
0,0
|
* p < 0,05, ** p < 0,001 pre superioritu, upravené pre multiplicitu.
† p < 0,05, †† p < 0,001 v porovnaní s placebom, neupravené pre multiplicitu.
# p < 0,05, ## p < 0,001 v porovnaní s východiskovou hodnotou, neupravené pre multiplicitu.
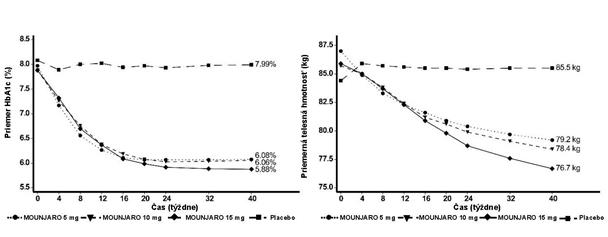 O
brázok č. 1. Priemerná hodnota HbA
1c
(
%
) a telesnej hmotnosti (kg) od východiskovej hodnoty
po 40. týždeň
SURPASS 2 - kombinovaná
li
e
čba
smetformínom
O
brázok č. 1. Priemerná hodnota HbA
1c
(
%
) a telesnej hmotnosti (kg) od východiskovej hodnoty
po 40. týždeň
SURPASS 2 - kombinovaná
li
e
čba
smetformínom
V 40-týždňovej otvorenej štúdii s aktívnou kontrolou (dvojito zaslepenej vzhľadom na určenie dávky
tirzepatidu) bolo 1 879 pacientov randomizovaných na tirzepatid 5 mg, 10 mg alebo 15 mg raz týždenne alebo na semaglutid 1 mg raz týždenne, vždy v kombinácii s metformínom. Priemerný vek
pacientov bol 57 rokov a 47 % tvorili muži. Na začiatku liečby mali pacienti priemerné trvanie diabetu
9 rokov a priemerná hodnota BMI bola 34 kg/m2.
T
abuľka č. 3. SURPASS 2: Výsledky v 40. týždni
|
T
i
rzepatid
5 mg
|
T
i
rzepatid
10 mg
|
T
i
rzepatid
15 mg
|
Semaglutid
1 mg
|
m
ITT populácia (n)
|
470
|
469
|
469
|
468
|
H
bA
1c
(
%)
|
Východisková hodnota
(priemer)
|
8,33
|
8,31
|
8,25
|
8,24
|
Zmena oproti
východiskovej hodnote
|
-2,09##
|
-2,37##
|
-2,46##
|
-1,86##
|
Rozdiel oproti semaglutidu [95 % CI]
|
-0,23**
[-0,36; -0,10]
|
-0,51**
[-0,64; -0,38]
|
-0,60**
[-0,73; -0,47]
|
-
|
H
bA
1c
(
m
m
ol/mol)
|
Východisková hodnota
(priemer)
|
67,5
|
67,3
|
66,7
|
66,6
|
Zmena oproti
východiskovej hodnote
|
-22,8##
|
-25,9##
|
-26,9##
|
-20,3
|
Rozdiel oproti semaglutidu [95 % CI]
|
-2,5**
[-3,9; -1,1]
|
-5,6**
[-7; -4,1]
|
-6,6**
[-8; -5,1]
|
N/A
|
Pacienti (%)
dosahujúci
H
bA
1c
|
< 7 %
|
85,5*
|
88,9**
|
92,2**
|
81,1
|
≤ 6.5 %
|
74,0†
|
82,1††
|
87,1††
|
66,2
|
< 5.7 %
|
29,3††
|
44,7**
|
50,9**
|
19,7
|
FSG (mmol/l)
|
Východisková hodnota
(priemer)
|
9,67
|
9,69
|
9,56
|
9,49
|
Zmena oproti
východiskovej hodnote
|
-3,11##
|
-3,42##
|
-3,52##
|
-2,70##
|
Rozdiel oproti semaglutidu [95 % CI]
|
-0,41†
[-0,65; -0,16]
|
-0,72††
[-0,97; -0,48]
|
-0,82††
[-1,06; -0,57]
|
-
|
FSG (mg/dl)
|
Východisková hodnota
(priemer)
|
174,2
|
174,6
|
172,3
|
170,9
|
Zmena oproti
východiskovej hodnote
|
-56,0##
|
-61,6##
|
-63,4##
|
-48,6##
|
Rozdiel oproti semaglutidu [95 % CI]
|
-7,3†
[-11,7; -3,0]
|
-13,0††
[-17,4; -8,6]
|
-14,7††
[-19,1; -10,3]
|
-
|
T
elesná hmotnosť (kg)
|
Východisková hodnota
(priemer)
|
92,6
|
94,9
|
93,9
|
93,8
|
Zmena oproti
východiskovej hodnote
|
-7,8##
|
-10,3##
|
-12,4##
|
-6,2##
|
Rozdiel oproti semaglutidu [95 % CI]
|
-1,7**
[-2,6; -0,7]
|
-4,1**
[-5,0; -3,2]
|
-6,2**
[-7,1; -5,3]
|
-
|
Pacienti (%) dosahujúci pokles hmotnosti
|
≥ 5 %
|
68,6†
|
82,4††
|
86,2††
|
58,4
|
≥ 10 %
|
35,8††
|
52,9††
|
64,9††
|
25,3
|
≥ 15 %
|
15,2†
|
27,7††
|
39,9††
|
8,7
|
* p < 0,05, ** p < 0,001 pre superioritu, upravené pre multiplicitu.
† p < 0,05, †† p < 0,001 v porovnaní so semaglutidom 1 mg, neupravené pre multiplicitu.
# p < 0,05, ## p < 0,001 v porovnaní s východiskovou hodnotou, neupravené pre multiplicitu.
 O
brázok č. 2. Priemerná hodnota HbA
1c
(
%
) a telesnej hmotnosti (kg) od začiatku liečby
po 40. týždeň
SURPASS 3 - kombinovaná
li
e
čba
smetformínom, so SGLT2i alebobezSGLT2i
O
brázok č. 2. Priemerná hodnota HbA
1c
(
%
) a telesnej hmotnosti (kg) od začiatku liečby
po 40. týždeň
SURPASS 3 - kombinovaná
li
e
čba
smetformínom, so SGLT2i alebobezSGLT2i
V 52-týždňovej otvorenej štúdii s aktívnou kontrolou bolo 1 444 pacientov randomizovaných na
tirzepatid 5 mg, 10 mg alebo 15 mg raz týždenne alebo na inzulín degludek, vždy v kombinácii
s metformínom s SGLT2i alebo bez SGLT2i. Na začiatku liečby 32 % pacientov užívalo SGLT2i.
Na začiatku liečby mali pacienti priemerné trvanie diabetu 8 rokov, priemernú hodnotu BMI 34 kg/m2, a priemerný vek 57 rokov a 56 % tvorili muži.
Pacienti liečení inzulínom degludekom začali s dávkou 10 U/denne, ktorá bola upravená pomocou algoritmu pre cieľovú glykémiu nalačno < 5 mmol/l. Priemerná dávka inzulínu degludeku v 52. týždni bola 49 jednotiek/deň.
|
T
i
rzepatid
5 mg
|
T
i
rzepatid
10 mg
|
T
i
rzepatid
15 mg
|
T
it
rovaný
i
nzulín degludek
|
m
ITT populácia (n)
|
358
|
360
|
358
|
359
|
H
bA
1c
(
%)
|
Východisková hodnota
(priemer)
|
8,17
|
8,19
|
8,21
|
8,13
|
Zmena oproti
východiskovej hodnote
|
-1,93##
|
-2,20##
|
-2,37##
|
-1,34##
|
Rozdiel oproti inzulínu
degludeku [95 % CI]
|
-0,59**
[-0,73; -0,45]
|
-0,86**
[-1,00; -0,72]
|
-1,04**
[-1,17; -0,90]
|
-
|
H
bA
1c
(
m
m
ol/mol)
|
Východisková hodnota
(priemer)
|
65,8
|
66,0
|
66,3
|
65,4
|
Zmena oproti
východiskovej hodnote
|
-21,1##
|
-24,0##
|
-26,0##
|
-14,6##
|
Rozdiel oproti inzulínu degludeku [95 % CI]
|
-6,4**
[-7,9; -4,9]
|
-9,4**
[-10,9; -7,9]
|
-11,3**
[-12,8; -9,8]
|
-
|
Pacienti (%)
dosahujúci
H
bA
1c
|
< 7 %
|
82,4**
|
89,7**
|
92,6**
|
61,3
|
≤ 6.5 %
|
71,4††
|
80,3††
|
85,3††
|
44,4
|
< 5.7 %
|
25,8††
|
38,6††
|
48,4††
|
5,4
|
FSG (mmol/l)
|
Východisková hodnota
(priemer)
|
9,54
|
9,48
|
9,35
|
9,24
|
Zmena oproti
východiskovej hodnote
|
-2,68##
|
-3,04##
|
-3,29##
|
-3,09##
|
Rozdiel oproti inzulínu degludeku [95 % CI]
|
0,41†
[0,14; 0,69]
|
0,05
[-0,24; 0,33]
|
-0,20
[-0,48; 0,08]
|
-
|
FSG (mg/dl)
|
Východisková hodnota
(priemer)
|
171,8
|
170,7
|
168,4
|
166,4
|
Zmena oproti
východiskovej hodnote
|
-48,2##
|
-54,8##
|
-59,2##
|
-55,7
|
Rozdiel oproti inzulínu
degludeku [95 % CI]
|
7,5†
[2,4; 12,5]
|
0,8
[-4,3; 5,9]
|
-3,6
[-8,7; 1,5]
|
-
|
T
elesná
hmotnosť
(
kg)
|
Východisková hodnota
(priemer)
|
94,5
|
94,3
|
94,9
|
94,2
|
Zmena oproti
východiskovej hodnote
|
-7,5##
|
-10,7##
|
-12,9##
|
+2,3##
|
Rozdiel oproti inzulínu degludeku [95 % CI]
|
-9,8**
[-10,8; -8,8]
|
-13,0**
[-14,0; -11,9]
|
-15,2**
[-16,2; -14,2]
|
-
|
Pacienti (%)
dosahujúci
pokles hmotnosti
|
≥ 5 %
|
66,0††
|
83,7††
|
87,8††
|
6,3
|
≥ 10 %
|
37,4††
|
55,7††
|
69,4††
|
2,9
|
≥ 15 %
|
12,5††
|
28,3††
|
42,5††
|
0,0
|
* p < 0,05, ** p < 0,001 pre superioritu, upravené pre multiplicitu.
† p < 0,05, †† p < 0,001 v porovnaní s inzulínom degludekom, neupravené pre multiplicitu.
# p < 0,05, ## p < 0,001 v porovnaní s východiskovou hodnotou, neupravené pre multiplicitu.
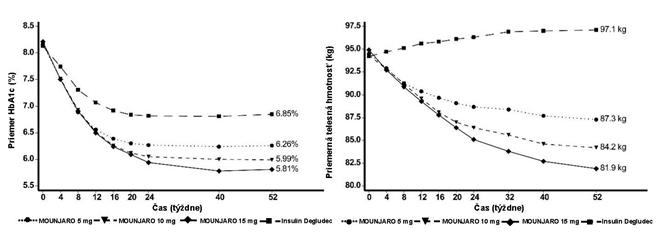 O
brázok č. 3. Priemerná hodnota HbA
1c
(
%
) a telesnej hmotnosti (kg) od začiatku liečby
do 52. týždňa
SURPASS 4 - kombinovaná
li
e
čba
s
1-3 perorálnymi antidiabetickými liekmi:metformínom, derivátmi
s
ulfonylmočoviny
alebo
SGLT2i
O
brázok č. 3. Priemerná hodnota HbA
1c
(
%
) a telesnej hmotnosti (kg) od začiatku liečby
do 52. týždňa
SURPASS 4 - kombinovaná
li
e
čba
s
1-3 perorálnymi antidiabetickými liekmi:metformínom, derivátmi
s
ulfonylmočoviny
alebo
SGLT2i
V otvorenej štúdii s aktívnou kontrolou v trvaní do 104 týždňov (primárny koncový ukazovateľ
v 52. týždni) bolo 2 002 pacientov s diabetom 2. typu a zvýšeným kardiovaskulárnym rizikom randomizovaných na tirzepatid 5 mg, 10 mg alebo 15 mg raz týždenne alebo inzulín glargín raz denne,
v kombinácii s metformínom (95 %) a/alebo derivátmi sulfonylmočoviny (54 %) a/alebo SGLT2i
(25 %). Na začiatku liečby mali pacienti priemernú dĺžku trvania diabetu 12 rokov, priemernú hodnotu BMI 33 kg/m2, priemerný vek 64 rokov a 63 % tvorili muži. Pacient liečený inzulínom glargínom začínal s dávkou 10 U/deň, ktorá bola upravená algoritmom s cieľovou hodnotou glukózy v krvi nalačno < 5,6 mmol/l. Priemerná dávka inzulínu glargínu v 52. týždni bola 44 jednotiek/deň.
|
T
i
rzepatid
5 mg
|
T
i
rzepatid
10 mg
|
T
i
rzepatid
15 mg
|
T
it
rovaný
i
nzulín glargín
|
m
ITT populácia (n)
|
328
|
326
|
337
|
998
|
52. týždeň
|
H
bA
1c
(
%)
|
Východisková hodnota
(priemer)
|
8,52
|
8,60
|
8,52
|
8,51
|
Zmena oproti
východiskovej hodnote
|
-2,24##
|
-2,43##
|
-2,58##
|
-1,44##
|
Rozdiel oproti inzulínu
glargínu [95 % CI]
|
-0,80**
[-0,92; -0,68]
|
-0,99**
[-1,11; -0,87]
|
-1,14**
[-1,26; -1,02]
|
-
|
H
bA
1c
(
m
m
ol/mol)
|
Východisková hodnota
(priemer)
|
69,6
|
70,5
|
69,6
|
69,5
|
Zmena oproti
východiskovej hodnote
|
-24,5##
|
-26,6##
|
-28,2##
|
-15,7##
|
Rozdiel oproti inzulínu
glargínu [95 % CI]
|
-8,8**
[-10,1; -7,4]
|
-10,9**
[-12,3; -9,6]
|
-12,5**
[-13,8; -11,2]
|
-
|
Pacienti (%)
dosahujúci
H
bA
1c
|
< 7 %
|
81,0**
|
88,2**
|
90,7**
|
50,7
|
≤ 6.5 %
|
66,0††
|
76,0††
|
81,1††
|
31,7
|
< 5.7 %
|
23,0††
|
32,7††
|
43,1††
|
3,4
|
FSG (mmol/l)
|
Východisková hodnota
(priemer)
|
9,57
|
9,75
|
9,67
|
9,37
|
Zmena oproti
východiskovej hodnote
|
-2,80##
|
-3,06##
|
-3,29##
|
-2,84##
|
Rozdiel oproti inzulínu
glargínu [95 % CI]
|
0,04
[-0,22; 0,30]
|
-0,21
[-0,48; 0,05]
|
-0,44††
[-0,71; -0,18]
|
-
|
FSG (mg/dl)
|
Východisková hodnota
(priemer)
|
172,3
|
175,7
|
174,2
|
168,7
|
Zmena oproti
východiskovej hodnote
|
-50,4##
|
-54,9##
|
-59,3##
|
-51,4##'
|
Rozdiel oproti inzulínu glargínu [95 % CI]
|
1,0
[-3,7; 5,7]
|
-3,6
[-8,2; 1,1]
|
-8,0††
[-12,6; -3,4]
|
-
|
T
elesná
hmotnosť (kg)
|
Východisková hodnota
(priemer)
|
90,3
|
90,7
|
90,0
|
90,3
|
Zmena oproti
východiskovej hodnote
|
-7,1##
|
-9,5##
|
-11,7##
|
+1,9##
|
Rozdiel oproti inzulínu glargínu [95 % CI]
|
-9,0**
[-9,8; -8,3]
|
-11,4**
[-12,1; -10,6]
|
-13,5**
[-14,3; -12,8]
|
-
|
Pacienti (%)
dosahujúci
pokles hmotnosti
|
≥ 5 %
|
62,9††
|
77,6††
|
85,3††
|
8,0
|
≥ 10 %
|
35,9††
|
53,0††
|
65,6††
|
1,5
|
≥ 15 %
|
13,8††
|
24,0††
|
36,5††
|
0,5
|
* p < 0,05, ** p < 0,001 pre superioritu, upravené pre multiplicitu.
† p < 0,05, †† p < 0,001 v porovnaní s inzulínom glargínom, neupravené pre multiplicitu.
# p < 0,05, ## p < 0,001 v porovnaní s východiskovou hodnotou, neupravené pre multiplicitu.
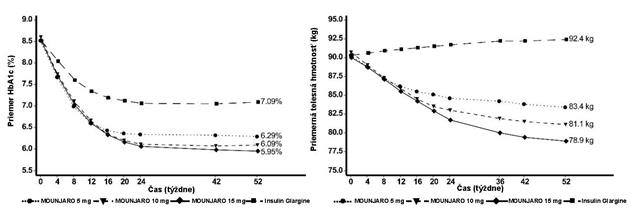 O
brázok č. 4. Priemerná hodnota HbA
1c
(
%
) a telesnej hmotnosti (kg) od východiskovej hodnoty
do 52. týždňa
SURPASS 5 - kombinovaná
li
e
čba
s
titrovaným bazálnym
inzulínom, s metformínom
alebo
bez
metformínu
O
brázok č. 4. Priemerná hodnota HbA
1c
(
%
) a telesnej hmotnosti (kg) od východiskovej hodnoty
do 52. týždňa
SURPASS 5 - kombinovaná
li
e
čba
s
titrovaným bazálnym
inzulínom, s metformínom
alebo
bez
metformínu
V 40-týždňovej dvojito zaslepenej placebom kontrolovanej štúdii bolo 475 pacientov s nedostatočnou
glykemickou kontrolou užívajúcich inzulín glargín s metformínom alebo bez metformínu randomizovaných na tirzepatid 5 mg, 10 mg alebo 15 mg raz týždenne alebo na placebo. Dávky
inzulínu glargínu boli upravené pomocou algoritmu s cieľovou hodnotou glukózy v krvi nalačno
< 5,6 mmol/l. Na začiatku liečby mali pacienti priemernú dĺžku trvania diabetu 13 rokov, priemernú hodnotu BMI 33 kg/m2, priemerný vek 61 rokov a 56 % tvorili muži. Celková odhadovaná stredná dávka inzulínu glargínu na začiatku liečby bola 34 jednotiek/deň. Stredná dávka inzulínu glargínu
v 40. týždni bola 38, 36, 29 a 59 jednotiek/deň u tirzepatidu 5 mg, 10 mg, 15 mg a u placeba v uvedenom poradí.
T
abuľka č. 6. SURPASS 5: Výsledky v 40. týždni
|
T
i
rzepatid
5 mg
|
T
i
rzepatid
10 mg
|
T
i
rzepatid
15 mg
|
Placebo
|
m
ITT populácia (n)
|
116
|
118
|
118
|
119
|
H
bA
1c
(
%)
|
Východisková hodnota
(priemer)
|
8,29
|
8,34
|
8,22
|
8,39
|
Zmena oproti
východiskovej hodnote
|
-2,23##
|
-2,59##
|
-2,59##
|
-0,93##
|
Rozdiel oproti placebu
[95 % CI]
|
-1,30**
[-1.52; -1,07]
|
-1,66**
[-1,88; -1,43]
|
-1,65**
[-1,88; -1,43]
|
-
|
H
bA
1c
(
m
m
ol/mol)
|
Východisková hodnota
(priemer)
|
67,1
|
67,7
|
66,4
|
68,2
|
Zmena oproti
východiskovej hodnote
|
-24,4##
|
-28,3##
|
-28,3##
|
-10,2##
|
Rozdiel oproti placebu
[95 % CI]
|
-14,2**
[-16,6; -11,7]
|
-18,1**
[-20,6; -15,7]
|
-18,1**
[-20,5; -15,6]
|
-
|
Pacienti (%)
dosahujúci
H
bA
1c
|
< 7 %
|
93,0**
|
97,4**
|
94,0**
|
33,9
|
≤ 6,5 %
|
††
|
††
|
††
|
17,0
|
< 5,7 %
|
26,1††
|
47,8††
|
62,4††
|
2,5
|
FSG (mmol/l)
|
Východisková hodnota
(priemer)
|
9,00
|
9,04
|
8,91
|
9,13
|
Zmena oproti
východiskovej hodnote
|
-3,41##
|
-3,77##
|
-3,76##
|
-2,16##
|
Rozdiel oproti placebu
[95 % CI]
|
-1,25**
[-1,64; -0,86]
|
-1,61**
[-2,00; -1,22]
|
-1,60**
[-1,99; -1,20]
|
-
|
FSG (mg/dl)
|
Východisková hodnota
(priemer)
|
162,2
|
162,9
|
160,4
|
164,4
|
Zmena oproti
východiskovej hodnote
|
-61,4##
|
-67,9##
|
-67,7##
|
-38,9##
|
Rozdiel oproti placebu
[95 % CI]
|
-22,5**
[-29,5; -15,4]
|
-29,0**
[-36,0; -22,0]
|
-28,8**
[-35,9; -21,6]
|
-
|
T
elesná
hmotnosť
(
kg)
|
Východisková hodnota
(priemer)
|
95,5
|
95,4
|
96,2
|
94,1
|
Zmena oproti
východiskovej hodnote
|
-6,2##
|
-8,2##
|
-10,9##
|
+1,7#
|
Rozdiel oproti placebu
[95 % CI]
|
-7,8**
[-9,4; -6,3]
|
-9,9**
[-11,5; -8,3]
|
-12,6**
[-14,2; -11,0]
|
-
|
Pacienti (%)
dosahujúci pokles hmotnosti
|
≥ 5 %
|
53,9††
|
64,6††
|
84,6††
|
5,9
|
≥ 10 %
|
22,6††
|
46,9††
|
51,3††
|
0,9
|
≥ 15 %
|
7,0†
|
26,6†
|
31,6††
|
0,0
|
|
|
80,0
94,7
92,3
* p < 0,05, ** p < 0,001 pre superioritu, upravené pre multiplicitu.
† p < 0,05, †† p < 0,001 v porovnaní s placebom, neupravené pre multiplicitu.
# p < 0,05, ## p < 0,001 v porovnaní s východiskovou hodnotou, neupravené pre multiplicitu.
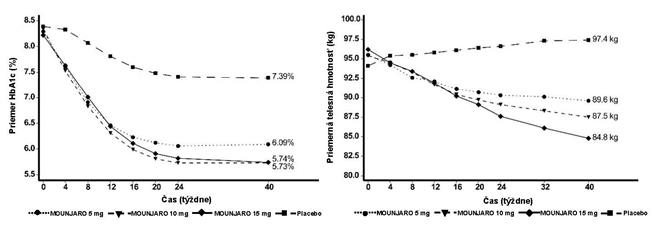 O
brázok č. 5. Priemerná hodnota HbA
1c
(
%
) a telesnej hmotnosti (kg) od východiskovej hodnoty
do 40. týždňa
K
ardiovaskulárne
hodnotenie
O
brázok č. 5. Priemerná hodnota HbA
1c
(
%
) a telesnej hmotnosti (kg) od východiskovej hodnoty
do 40. týždňa
K
ardiovaskulárne
hodnotenie
Kardiovaskulárne (Cardiovascular, CV) riziko bolo hodnotené prostredníctvom metaanalýzy
pacientov s najmenej jednou posudkom potvrdenou závažnou nežiaducou srdcovou príhodou (major adverse cardiac event, MACE). Kompozitný koncový ukazovateľ MACE-4 zahŕňal CV úmrtie,
nefatálny infarkt myokardu, nefatálnu cievnu mozgovú príhodu alebo hospitalizáciu pre nestabilnú
angínu pektoris.
V primárnej metaanalýze registračných štúdií fázy 2 a 3 zaznamenalo celkom 116 pacientov (tirzepatid: 60 [n = 4 410]; všetky komparátory: 56 [n = 2 169]) najmenej jednu posudkom potvrdenú MACE-4: Výsledky ukázali, že tirzepatid nesúvisel s nadmerným rizikom CV príhod v porovnaní
so združenými komparátormi (HR: 0,81; CI: 0,52 až 1,26).
Dodatočná analýza bola vykonaná špeciálne pre štúdiu SURPASS-4, do ktorej boli zaradení pacienti s potvrdeným CV ochorením. Celkom 109 pacientov (tirzepatid: 47 [n = 995]; inzulín glargín:
62 [n = 1 000]) prekonalo najmenej jednu posudkom potvrdenú MACE-4: Výsledky potvrdili, že
tirzepatid nesúvisel s nadmerným rizikom CV príhod v porovnaní s inzulínom glargínom (HR: 0,74; CI: 0,51 až 1,08).
Krvný tlakV placebom kontrolovaných štúdiách fázy 3 liečba tirzepatidom viedla k priemernému poklesu systolického tlaku o 6 až 9 mmHg a diastolického krvného tlaku o 3 až 4 mmHg. U pacientov
liečených placebom došlo k priemernému poklesu systolického aj diastolického krvného tlaku
o 2 mmHg.
Iné informácieSérováglukózanalačnoLiečba tirzepatidom viedla k významnému zníženiu hodnoty FSG oproti vstupným hodnotám (zmeny
od východiskovej hodnoty po primárny koncový ukazovateľ boli -2,4 mmol/l až -3,8 mmol/l). Významné zníženie hodnoty FSG od začiatku liečby bolo možné pozorovať už v 2. týždni. Ďalšie
zlepšenie FSG bolo pozorované až do 42. týždňa, potom sa udržalo v priebehu trvania najdlhšej štúdie
104 týždňov.
P
ostprandiálna
glukóza
Liečba tirzepatidom viedla k významnému zníženiu priemernej hladiny glukózy 2 hodiny po jedle
(priemer z 3 hlavných denných jedál) od začiatku liečby (zmeny od východiskovej hdnoty po
primárny koncový ukazovateľ boli -3,35 mmol/l až -4,85 mmol/l).
Triglyceridy
Vo všetkých štúdiách SURPASS 1-5 viedol tirzepatid 5 mg, 10 mg a 15 mg k zníženiu sérových
triglyceridov o 15-19 %, 18-27 % a 21-25 % v uvedenom poradí.
V 40-týždňovom klinickom skúšaní oproti semaglutidu 1 mg, tirzepatid 5 mg, 10 mg a 15 mg viedol k
19 %, 24 % a 25 % zníženiu hladiny sérových triglyceridov v uvedenom poradí, v porovnaní s 12 %
znížením u semaglutidu 1 mg.
Podiel pacientov dosahujúcich HbA1c < 5,7 % bezklinickyvýznamnejhypoglykémie
V 4 štúdiách, v ktorých sa tirzepatid nekombinoval s bazálnym inzulínom, 93,6 % až 100 % pacientov,
ktorí dosiahli normálnu glykémiu HbA1c < 5,7 % (≤ 39 mmol/mol), ju pri návšteve s primárnym koncovým ukazovateľom dosiahli bez klinicky významnej hypoglykémie. V štúdii SURPASS-5 ju dosiahlo 85,9 % pacientov liečených tirzepatidom, ktorí dosiahli HbA1c < 5,7 % (≤ 39 mmol/mol) bez klinicky významnej hypoglykémie.
Osobitné skupiny pacientov
Účinnosť tirzepatidu nebola ovplyvnená vekom, pohlavím, rasou, etnickým pôvodom, regiónom ani
vstupnými hodnotami BMI, HbA1c, trvaním diabetu ani stupňom poruchy funkcie obličiek.
Pediatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Mounjarom
v jednej alebo vo viacerých podskupinách pediatrickej populácie pre liečbu diabetes mellitus 2. typu
(informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Tirzepatid je peptid skladajúci sa z 39-aminokyselín s C20 dvojsýtnou mastnou kyselinou, ktorá umožňuje viazanie albumínu a predlžuje polčas eliminácie.
Absorpcia
Maximálna koncentrácia tirzepatidu sa dosahuje 8 až 72 hodín po podaní dávky. Rovnovážny stav
expozície sa dosiahne po 4 týždňoch podávania dávky raz týždenne. Expozícia tirzepatidu sa zvyšuje úmerne dávke.
Podobná expozícia sa dosiahla pri subkutánnom podávaní tirzepatidu do brucha, stehna alebo ramena. Absolútna biologická dostupnosť subkutánne podávaného tirzepatidu bola 80 %.
Distribúcia
Odhadovaný priemerný distribučný objem tirzepatidu v stabilnom stave po subkutánnom podaní
pacientom s diabetom 2. typu je približne 10,3 l.
Tirzepatid sa vo veľkej miere viaže na plazmatický albumín (99 %).
B
i
otransformácia
Tirzepatid sa metabolizuje proteolytickým štiepením hlavného peptidového reťazca, beta-oxidáciou
C20 dvojsýtnej mastnej kyseliny a hydrolýzou amidu.
Eliminácia
Priemerný zdanlivý klírens tirzepatidu v populácii je 0,06 l/hod. s polčasom eliminácie približne 5 dní,
čo umožňuje podávanie raz týždenne.
Tirzepatid sa eliminuje prostredníctvom látkovej premeny. Primárne cesty eliminácie metabolitov tirzepatidu sú moč a stolica. V moči ani stolici nebol pozorovaný nezmenený tirzepatid.
Osobitné skupiny pacientov
Vek, pohlavie, rasa, etnickýpôvod, telesnáhmotnosť
Vek, pohlavie, rasa, etnický pôvod ani telesná hmotnosť nemajú klinicky významný vplyv na
farmakokinetiku (PK) tirzepatidu.
Poruchafunkcieobličiek
Porucha funkcie obličiek nemá vplyv na PK tirzepatidu. PK tirzepatidu po podaní jednej 5 mg dávky sa hodnotila u pacientov s rôznym stupňom poruchy funkcie obličiek (miernej, stredne závažnej,
závažnej, ESRD) oproti osobám s normálnou funkciou obličiek a neboli pozorované žiadne klinicky významné rozdiely. Na základe údajov z klinických štúdií sa to ukázalo u pacientov s diabetom
mellitus 2. typu aj s poruchou funkcie obličiek.
Porucha funkcie pečene
Porucha funkcie pečene nemá vplyv na PK tirzepatidu. PK tirzepatidu po podaní jednej 5 mg dávky sa
hodnotila u pacientov s rôznym stupňom poruchy funkcie pečene (miernej, stredne závažnej, závažnej)
oproti osobám s normálnou funkciou pečene a neboli pozorované žiadne klinicky významné rozdiely.
Pediatrická populácia
Neuskutočnili sa žiadne štúdie s tirzepatidom u pediatrických pacientov.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje vychádzajúce z konvenčných štúdií farmakologickej bezpečnosti, toxicity opakovanej dávky alebo genotoxicity neodhalili žiadne osobitné riziká pre ľudí.
U samcov a samíc potkanov sa uskutočnila 2-ročná štúdia karcinogenity s tirzepatidom v dávkach
0,15; 0,50 a 1,5 mg/kg (0,12; 0,36 a 1,02-násobkom maximálnej odporúčanej dávky pre ľudí
(maximum recommended human dose, MRHD) podľa AUC), ktorý bol podávaný subkutánnou
injekciou dvakrát týždenne. Tirzepatid vo všetkých dávkach spôsobil zvýšenie počtu nádorov
C-buniek štítnej žľazy (adenómov a karcinómov) oproti kontrolným skupinám. Význam týchto zistení pre ľudí nie je známy.
V 6-mesačnej štúdii karcinogenity u rasH2 transgénnych myší nespôsobil tirzepatid v dávkach 1, 3 a 10 mg/kg podávaný subkutánnou injekciou dvakrát týždenne zvýšený výskyt hyperplázie ani neoplázie C-buniek štítnej žľazy v žiadnej dávke.
Štúdie na zvieratách s tirzepatidom nepreukázali žiadne priame škodlivé účinky na fertilitu.
V reprodukčných štúdiách na zvieratách tirzepatid spôsobil spomalenie rastu plodu a fetálne abnormality pri expozíciách nižších ako MRHD podľa AUC. U potkanov bol pozorovaný zvýšený
výskyt externých, viscerálnych a skeletálnych malformácií a viscerálnych a skeletálnych vývojových variácií. U potkanov a králikov bolo pozorované spomalenie rastu plodu. Všetky nežiaduce účinky
na vývin sa vyskytli pri dávkach toxických pre matku.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
heptahydrát hydrogenfosforečnanu sodného chlorid sodný
koncentrovaná kyselina chlorovodíková a hydroxid sodný (na úpravu pH)
voda na injekcie
6.2 Inkompatibility
Nevykonali sa štúdie kompatibility, preto sa tento liek sa nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 ºC – 8 ºC). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Mounjaro sa môže uchovávať mimo chladničky pri teplotách neprevyšujúcich 30 ºC najviac 21 dní.
6.5 Druh obalu a obsah balenia
Sklenená injekčná striekačka vložená do naplneného pera na jedno použitie.
Naplnené pero má skrytú ihlu, ktorá sa po stlačení injekčného tlačidla automaticky vpichne do kože. Jedno naplnené pero obsahuje 0,5 ml roztoku.
Veľkosti balenia tvoria 2 naplnené perá, 4 naplnené perá a multibalenia obsahujúce 12 (3 balenia po 4)
naplnených pier. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Návod napoužitie
Naplnené pero je určené na jednorazové použitie.
Návod na použitie pera vrátane písomnej informácie pre používateľa sa musia starostlivo dodržiavať. Pred použitím Mounjaro vizuálne skontrolujte a ak obsahuje častice alebo zmenilo farbu, zlikvidujte ho.
Ak Mounjaro zamrzlo, nesmie sa používať.
Likvidácia
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528 BJ Utrecht, Holandsko.
8. REGISTRAČNÉ ČÍSLOEU/1/22/1685/001
EU/1/22/1685/002
EU/1/22/1685/003
EU/1/22/1685/004
EU/1/22/1685/005
EU/1/22/1685/006
EU/1/22/1685/007
EU/1/22/1685/008
EU/1/22/1685/009
EU/1/22/1685/010
EU/1/22/1685/011
EU/1/22/1685/012
EU/1/22/1685/013
EU/1/22/1685/014
EU/1/22/1685/015
EU/1/22/1685/016
EU/1/22/1685/017
EU/1/22/1685/018
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú k dispozícii na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
u