i možno dávku znížiť.
Pediatrická populáciaDeti vo veku 6 až 11 rokov: Obvyklá odporúčaná dávka je jedno vstreknutie (50 mikrogramov v jednom streknutí) do každej nosovej dierky raz denne (celková dávka 100 mikrogramov).
Mometasone furoate nosová suspenzná aerodisperzia preukázala klinicky významný nástup účinku u niektorých pacientov so sezónnou alergickou rinitídou v priebehu 12 hodín po prvej dávke, avšak úplný úžitok liečby sa nemusí dosiahnuť ani v priebehu prvých 48 hodín. Preto majú pacienti pokračovať v pravidelnom používaní, aby dosiahli úplný terapeutický úžitok.
Nazálna polypózaObvyklá odporúčaná počiatočná dávka u polypózy sú dve vstreknutia dávkovačom (jedna dávka = 50 mikrogramov) do každej nosovej dierky raz denne (celková denná dávka = 200 mikrogramov). Ak po 5 až 6 týždňoch sú príznaky iba neprimerane kontrolované, môže sa denná dávka zvýšiť na dve vstreknutia dávkovačom do každej nosovej dierky dva razy denne (celková denná dávka = 400 mikrogramov). Dávka sa musí titrovať na najnižšiu dávku, ktorou sa podarí udržať účinnú kontrolu príznakov. Ak sa nepodarí dosiahnuť zlepšenie príznakov ani po 5 až 6 týždňoch podávania, majú sa zvážiť alternatívne liečebné postupy. Štúdie účinnosti a bezpečnosti nosovej aerodisperzie mometazónfuroátu pri liečbe nazálnej polypózy ukázali, že liečba je bezpečná pokiaľ netrvá dlhšie ako štyri mesiace.
Spôsob podávaniaPo úvodnej iniciácii dávkovača suspenznej pumpy nosovej aerodisperzie Mometasone furoate, (obvykle je treba 10 stlačení, kým sa dosiahne uniformita dávok) sa pri každom stlačení dávkovača uvoľní približne 100 mg suspenzie monohydrátu mometazónfuroátu, čo zodpovedá 50 mikrogramom mometazónfuroátu. Ak sa pumpa dávkovača nepoužívala po dobu 14 dní alebo dlhšie, má sa pred najbližším použitím znovu iniciovať 2 stlačeniami dávkovača, kým sa nedosiahne rovnaká dávka.
Fľaštička sa má zlikvidovať po dosiahnutí počtu stlačení dávkovača uvedeného na štítku alebo po uplynutí 2 mesiacov od prvého použitia.
4.3. KontraindikácieHypersenzitivita na akékoľvek zložky lieku Mometasone furoate nosová suspenzná aerodisperzia.
Mometasone furoate nosová suspenzná aerodisperzia sa nesmie používať počas neliečenej lokalizovanej infekcie postihujúcej nosovú sliznicu.
Vzhľadom na inhibičný účinok kortikosteroidov na liečenie rán, pacienti, ktorí nedávno podstúpili operáciu nosa alebo utrpeli úraz nosa, nemajú používať nazálny kortikosteroid, kým nedôjde k zahojeniu.
4.4. Osobitné upozornenia a opatrenia pri používaníMometasone furoate nosová suspenzná aerodisperzia sa musí používať opatrne, najmä u pacientov s aktívnymi alebo neaktívnymi tuberkulóznymi infekciami, alebo s neliečenými plesňovými, bakteriálnymi systémovými vírusovými infekciami alebo očným herpesom simplex.
Po 12 mesiacoch liečby liekom Mometasone furoate nosová suspenzná aerodisperzia sa nenašli dôkazy atrofie nosovej sliznice; mometazónfuroát preukázal sklon k reverzii nosovej sliznice bližšie k normálnemu histologickému fenotypu. Ako pri každej dlhodobej liečbe, je nutné pacientov používajúcich Mometasone furoate nosovú suspenznú aerodisperziu po dobu niekoľkých mesiacov alebo dlhšie pravidelne vyšetriť na možné zmeny nosovej sliznice. Ak sa vyvinú lokalizované plesňové infekcie nosa alebo hltanu, musí sa liečba liekom Mometasone furoate nosová suspenzná aerodisperzia prerušiť a/alebo nahradiť inou primeranou liečbou. Pretrvávanie nazofaryngeálneho podráždenia môže byť indikáciou pre prerušenie liečby liekom Mometasone furoate nosová suspenzná aerodisperzia.
Hoci Mometasone furoate nosová suspenzná aerodisperzia bude kontrolovať nosové príznaky u väčšiny pacientov, môže súčasné použitie vhodnej doplnkovej liečby poskytnúť pridanú úľavu od iných, najmä očných príznakov.
Nie je žiaden dôkaz o tom, že by predĺžená liečba liekom Mometasone furoate nosová suspenzná aerodisperzia viedla k potlačeniu hypotalamo-pituitárno-adrenálneho (HPA) systému. No pacienti, ktorí boli prevedení z dlhodobého podávania systémovo účinných kortikosteroidov na aplikáciu lieku Mometasone furoate nosová suspenzná aerodisperzia, si vyžadujú zvýšenú pozornosť. Vysadenie systémových kortikosteroidov môže mať u týchto pacientov za následok adrenálnu insuficienciu trvajúcu niekoľko mesiacov až do zotavenia funkcie HPA systému. Ak sa u týchto pacientov prejavia znaky a príznaky adrenálnej insuficiencie, treba pokračovať v podávaní systémových kortikosteroidov a zaviesť iné spôsoby liečby a vhodné opatrenia.
Počas prevodu zo systémových kortikosteroidov na používanie lieku Mometasone furoate nosová suspenzná aerodisperzia môžu sa u niektorých pacientov prejaviť príznaky vysadenia systémovo účinných kortikosteroidov (napr. bolesť kĺbov a/alebo svalov, slabosť a zo začiatku depresia), a to aj napriek úľave od nazálnych príznakov, a preto bude nutné ich povzbudiť, aby pokračovali v liečbe liekom Mometasone furoate nosová suspenzná aerodisperzia. Tento prevod môže tiež odhaliť preexistujúce alergické stavy, ako je alergická konjunktivitída a ekzém, predtým potláčané systémovou terapiou kortikosteroidmi.
Nebola študovaná bezpečnosť a účinnosť lieku Mometasone furoate nosová suspenzná aerodisperzia pri liečbe jednostranných polypov, polypov spojených s cystickou fibrózou alebo polypov, ktoré celkom zapchajú nosové dutiny.
Liečba jednostranných polypov, ktoré sú vzhľadom neobvyklé a nepravidelné, najmä ak ulcerujú a krvácajú, sa musí ďalej vyhodnocovať.
Pacientov, ktorí dostávajú kortikosteroidy a ktorých imunita je prípadne potlačená, je treba varovať pred rizikom vystavenia sa istým infekciám (napr. ovčie kiahne, osýpky) a upozorniť ich na význam vyhľadania lekárskej starostlivosti, ak by k takému vystaveniu došlo.
Po používaní intranazálnych kortikosteroidov boli hlásené veľmi zriedkavé prípady perforácie nosovej priehradky alebo zvýšenia vnútroočného tlaku.
Liečba vyššími dávkami než sú odporúčané môže mať za následok klinicky signifikantnú adrenálnu supresiu. Ak je dokázané, že sa používali vyššie ako odporúčané dávky, potom je treba uvážiť poskytnutie doplňujúceho pokrytia systémovými kortikosteroidmi počas stresových období alebo pred elektívnou operáciou.
Pediatrická populáciaBezpečnosť a účinnosť použitia lieku Mometasone furoate nosová suspenzná aerodisperzia na liečbu nazálnej polypózy u detí a adolescentov mladších ako 18 rokov zatiaľ neboli študované.
Systémové účinky nazálnych kortikosteroidov sa môžu vyskytnúť najmä vtedy, ak sú vysoké dávky predpísané na dlhšie obdobie. Tieto účinky sa vyskytujú s menšou pravdepodobnosťou, ako u perorálnych kortikosteroidov a môžu variovať u jednotlivých pacientov a medzí rôznymi liekortikosteroidmi. Prípadné systémové účinky môžu zahŕňať Cushingov syndróm, Cushingoidné črty, adrenálnu supresiu, spomalenie rastu u detí a adolescentov, šedý zákal, glaukóm a zriedkavejšie určitý rozsah psychologických a behaviorálnych účinkov vrátane psychomotorickej hyperaktivity, porúch spánku, úzkosti, depresie alebo agresie.
U detí, ktoré sú dlhodobo liečené nazálnymi kortikosteroidmi, sa odporúča pravidelne sledovať výšku. Ak sa rast spomalí, musí sa liečba prehodnotiť s cieľom znížiť dávku nazálneho kortikosteroidu pokiaľ možno na čo najmenšiu mieru, pri ktorej je ešte uchovaná účinná kontrola príznakov. Okrem toho je treba zvážiť, či neodoslať pacienta na odborné vyšetrenie k pediatrickému špecialistovi.
4.5 Liekové a iné interakcie(Pozri 4.4. Osobitné upozornenia a osobitné opatrenia pri používaní).
Pediatrická populáciaKlinická interakčná štúdia u dospelých a detí sa uskutočnila s loratadínom. Neboli pozorované žiadne interakcie.
4.6 Fertilita, gravidita a laktáciaGraviditaNie sú k dispozícii žiadne adekvátne alebo dobre kontrolované štúdie u gravidných žien. Rovnako ako u iných nazálnych kortikosteroidných liekov, Mometasone furoate nosová suspenzná aerodisperzia sa počas gravidity nesmie používať.
Dojčatá matiek, ktoré počas gravidity dostávali kortikosteroidy, musia byť starostlivo sledované kvôli hypoadrenalizmu.
LaktáciaRovnako ako ostatné glukokortikoidy, aj Mometasone furoate nosová suspenzná aerodisperzia sa má používať počas dojčenia iba vtedy, keď potenciálny úžitok pre matku prevýši potenciálne riziko pre plod alebo dojča.
FertilitaS liekom Mometasone furoate nosová suspenzná aerodisperzia sa zatiaľ neuskutočnili žiadne štúdie fertility.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkyNežiaduce účinky súvisiace s liečbou alergickej rinitídy zaznamenané v klinických štúdiách u dospelých a dospievajúcich pacientov sú uvedené nižšie (Tabuľka 1).
Tab. 1: Alergická rinitída – Nežiaduce účinky súvisiace s liečbou liekom Mometasone furoate nosová suspenzná aerodisperzia
veľmi časté (>1/10), časté (>1/100, <1/10), menej časté (>1/1000, <1/100), zriedkavé (>1/10 000, <1/1000), veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov)
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
|
Časté:
| Krvácanie z nosa, faryngitída, pálenie v nose, podráždenie nosovej sliznice, ulcerácia nosovej sliznice
|
Celkové poruchy a reakcie v mieste podania
|
|
Časté:
| Bolesti hlavy
|
Krvácanie vo všeobecnosti spontánne vymizlo, jeho závažnosť bola mierna a jeho výskyt bol vyšší v porovnaní s placebom (5 %), no porovnateľný alebo nižší pri porovnaní s účinnou kontrolou študovaných nazálnych kortikosteroidov (až o 15 %). Výskyt všetkých ostatných účinkov bol porovnateľný s výskytom pri užívaní placeba.
U pediatrickej populácie bol výskyt nežiaducich účinkov, ako napr. krvácanie z nosa (6 %), bolesť hlavy (3 %), podráždenie nosovej sliznice (2 %) a kýchanie (2 %) porovnateľný s placebom.

U pacientov liečených na nazálnu polypózu bol celkový výskyt nežiaducich účinkov porovnateľný s placebom a podobný výskytu pozorovanému u pacientov s alergickou rinitídou. Nežiaduce účinky súvisiace s liečbou hlásené u ≥1 % pacientov v klinických štúdiách polypózy sú zobrazené nižšie (Tabuľka 2).
Tab. 2: Polypóza – Nežiaduce účinky súvisiace s liečbou liekom Mometasone furoate nosová suspenzná aerodisperzia
veľmi časté (> 1/10), časté (> 1/100, < 1/10), menej časté (> 1/1000, < 1/100), zriedkavé
(>1/10 000, <1/1000), veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov)
|
| (200 μg raz denne)
| (200 μg dva razy denne)
|
Poruchy dýchacej sústavy, hrudníka a mediastína
|
|
|
Infekcia horného dýchacieho traktu
| Časté
| Menej časté
|
Krvácanie z nosa
| Časté
| Veľmi časté
|
Poruchy gastrointestinálneho traktu
|
|
|
Podráždenie hrtanu
|
| Časté
|
Celkové poruchy a reakcie v mieste podania
|
|
|
Bolesti hlavy
| Časté
| Časté
|
U pacientov liečených na akútnu rinosinusitídu bol výskyt krvácania z nosa u lieku Mometasone furoate nosová suspenzná aerodisperzia 3,3 % vs. 2,6 % u placeba a podobný výskytu pozorovanému u pacientov liečených na alergickú rinitídu.
Zriedkavejšie sa môžu po intranazálnom podaní monohydrátu mometazónfuroátu vyskytnúť bezprostredné reakcie z precitlivenosti, vrátane bronchospazmu a dyspney. Veľmi zriedkavo bola hlásená anafylaxia a angioedém.
Poruchy chuti a vône boli hlásené veľmi zriedkavo.
Systémové účinky nazálnych kortikosteroidov sa môžu vyskytnúť najmä keď sú predpisované vo vysokých dávkach na dlhotrvajúce obdobie.
Pediatrická populáciaSpomalenie rastu bolo hlásené u detí, ktoré dostávali nazálne kortikosteroidy v povolenej dávke.
4.9 Predávkovanie
Keďže systémová biologická dostupnosť lieku Mometasone furoate nosová suspenzná aerodisperzia je zanedbateľne malá (
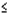
0,1 %), je nepravdepodobné, aby si predávkovanie suspenzie vyžadovalo inú terapiu ako pozorovanie, nasledované iniciáciou vhodného predpísaného dávkovania. Inhalovanie alebo perorálne podanie nadmerných dávok kortikosteroidov môže viesť k supresii funkcie HPA systému.
5.FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Dekongestanty a iné nazálne lieky pre miestne použitie kortikosteroidov, ATC kód: R01A D09
Mechanizmus účinkuMometazónfuroát je lokálny glukosteroid s miestnymi protizápalovými vlastnosťami pri dávkach, ktoré nie sú systémovo účinné.'
Farmakodynamické účinkyJe pravdepodobné, že veľká časť mechanizmu protizápalového účinku mometazónfuroátu spočíva v jeho schopnosti inhibovať uvoľňovanie mediátorov alergických reakcií. Mometazónfuroát signifikantne inhibuje uvoľňovanie leukotriénov z leukocytov alergických pacientov.
V bunkovej kultúre mometazónfuroát dokázal vysokú potenciu v inhibovaní syntézy a uvoľňovania IL-1, IL-5, IL-6 a TNFα a je tiež silným inhibítorom tvorby leukotriénov. Okrem toho je mimoriadne potentným inhibítorom tvorby Th2 cytokínov, IL-4 a IL-5 z ľudských T-buniek CD4+.
V štúdiách využívajúcich výzvu nazálneho antigénu, Mometasone furoate nosová suspenzná aerodisperzia suspenzia ukázal protizápalový účinok v počiatočnej i neskorej fáze alergických odpovedí. Demonštrovali to poklesy (vs. placebo) účinku histamínu a eozínofilov a obmedzenia počtu (vs. východiskový stav) eozinofilov, neutrofilov a adhéznych proteínov epitelových buniek.
Klinická účinnosť a bezpečnosťU 28 % pacientov so sezónnou alergickou rinitídou Mometasone furoate nosová suspenzná aerodisperzia preukázal klinicky signifikantný nástup účinku v priebehu 12 hodín po prvej dávke. Medián (50 %) času nástupu úľavy bol 35,9 h.
V dvoch klinických skúšaniach s 1954 pacientmi Mometasone furoate nosová suspenzná aerodisperzia 200 μg podaný dva razy denne preukázal signifikantné zlepšenie príznakov spojených s akútnou rinosinusitídou v porovnaní s placebom, ktoré boli vyhodnotené pomocou skóre hlavných príznakov (Major Symptom Score – MSS) pozostávajúcich zo zmesi príznakov (bolesť/tlak/citlivosť v oblasti obličaja, bolesť v oblasti prinosových dutín, rinorea, zatekanie hlienov do hltana a kongescia nosovej sliznice/upchatý nos) v priebehu 15dňovej liečby (P02683 p < 0,001; P02692 p = 0,038). Rameno liečené 500 mg amoxicilínu trikrát denne nebolo oproti placebu signifikantne odlišné v znížení príznakov akútnej rinosinusitídy hodnotených pomocou MSS. Dotazník SNOT-20 HRQL ukázal signifikantný prínos u dávky 200 μg mometazónfuroátu dvakrát denne oproti placebu (p=0,047). Liečba presahujúca 15 dní nebola u akútnej rinosinusitídy hodnotená.
V klinických štúdiách kontrolovaných placebom, v ktorých bol pediatrickým pacientom (n=49/skupina) podávaný Mometasone furoate nosová suspenzná aerodisperzia 100 mikrogramov denne po dobu jedného roku, nebolo pozorované zníženie rýchlosti rastu.
Pediatrická populáciaO bezpečnosti a účinnosti lieku Mometasone furoate nosová suspenzná aerodisperzia u pediatrickej populácie vo veku od 3 do 5 rokov sú k dispozícii len obmedzené údaje a preto nie je možné stanoviť vhodné dávkovacie rozmedzie. V štúdii zahrňujúcej 48 detí vo veku od 3 do 5 rokov, liečených intranazálnym mometazónfuroátom 50, 100 alebo 200 μg/deň po dobu 14 dní, neboli v porovnaní s placebom pozorované signifikantné rozdiely priemernej zmeny hladiny plazmatického kortizolu ako odpovede na tetrakozaktidový stimulačný test.
5.2Farmakokinetické vlastnosti
Mometazónfuroát podávaný vo forme vodnej nosovej aerodisperzie, má zanedbateľnú systémovú biologickú dostupnosť (0,1 %) a je väčšinou v plazme nedetekovateľný, a to aj pri použití senzitívnych analýz s veľmi nízkym kvantitatívnym limitom 50 pg/ml; preto nie sú u tejto liekovej formy k dispozícii žiadne relevantné farmakokinetické údaje. Suspenzia mometazónfuroátu sa veľmi zle absorbuje z gastrointestinálneho traktu a malé množstvo, ktoré môže byť prehltnuté a absorbované, prechádza intenzívnym metabolizmom už pri prvom prechode pečeňou a vylúči sa v moči a v žlči.
5.3 Predklinické údaje o bezpečnostiDoteraz neboli preukázané žiadne toxické účinky špecifické pre mometazónfuroát. Všetky pozorované účinky sú typické pre celú túto skupinu látok a súvisia s výraznými farmakologickými účinkami glukokortikoidov.
Výsledky predklinických štúdií preukázali, že mometazónfuroát nemá androgénny, antiandrogénny, estrogénny alebo antiestrogénny účinok, ale rovnako ako ostatné glukokortikoidy preukazuje na zvieracích modeloch niektoré antiuterotrofné účinky a odďaľuje otváranie vagíny pri perorálnom podávaní vysokých dávok 56 mg/kg/deň a 280 mg/kg/deň.
Podobne ako ostatné glukokortikoidy má mometazónfuroát pri vysokých koncentráciách klastrogenný potenciál
in vitro. Avšak pri terapeuticky relevantných dávkach sa neočakávajú žiadne mutagénne účinky.
V štúdiách reprodukčnej funkcie subkutánny mometazónfuroát v dávke 15 mikrogramov/kg spôsobil predĺženie gestačnej doby, predĺženie trvania a väčšiu obťažnosť pôrodu s následným nižším prežívaním a nižšou telesnou hmotnosťou alebo nižšími hmotnostnými prírastkami u potomkov. Fertilita zostala neovplyvnená.
Podobne ako ostatné glukokortikoidy aj mometazónfuroát sa u hlodavcov a králikov javil ako teratogénny. U potkanov bol pozorovaný výskyt umbilikálnej hernie, u myší výskyt rozštepu podnebia a u králikov výskyt agenézy žlčníka, umbilikálnej hernie a deformovaných predných labiek. Ďalej boli pozorované tiež nižšie hmotnostné prírastky u samíc potkanov, účinky na rast plodu (nižšia telesná hmotnosť a/alebo oneskorená osifikácia) u potkanov, králikov a myší a nižšie prežívanie novonarodených jedincov u myší.
Kancerogénny potenciál inhalačného mometazónfuroátu (aerosól s CFC pohonom a surfaktantom) v koncentrácii 0,25 až 2,0 mikrogramov/l bol študovaný v 24-mesačnej štúdii u myší a potkanov. Boli zistené typické účinky glukokortikoidov, vrátane niekoľkých novotvarov. U žiadneho typu tumoru však nebola zistená štatisticky významná závislosť od veľkosti dávky.
6.FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokglycerol
mikrokryštalická celulóza
sodná soľ karmelózy
monohydrát kyseliny citrónovej
polysorbát 80
chlorid benzalkónia
dihydrát citrónanu sodného
voda na injekciu
6.2 InkompatibilityNeboli zaznamenané.
6.3 Čas použiteľnosti2 roky
Po prvom použití: 2 mesiace
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 25 °C. Nezmrazujte. Uchovávajte v pôvodnom obale
.
6.5 Druh obalu a obsah baleniaMometasone furoate sa dodáva v bielej nepriesvitnej fľaštičke z polyetylénu s vysokou hustotou, ktorá je vybavená ručným polypropylénovým dávkovačom aerosólu.
Veľkosť balenia: 1 fľaštička obsahujúca 18,0 g suspenzie, ekvivalentná 140 odmeraným dávkam.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomŽiadne zvláštne požiadavky.
7.DRŽITEĽ ROZHODNUTIA O REGISTRÁCIICipla (EU) Limited
Hillbrow House, Hillbrow Road, Esher, Surrey, KT10 9NW, Veľká Británia
8.REGISTRAČNÉ ČÍSLO69/0039/14-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTU