
/>
Paratyreoidný karcinóm a primárna hyperparatyreóza
Dospelí a starší pacienti (> 65 rokov)
Odporúčaná úvodná dávka Mimpary u dospelých pacientov je 30 mg dvakrát denne. Dávka Mimpary sa má titrovať každé 2 až 4 týždne po následných dávkach 30 mg dvakrát denne, 60 mg dvakrát denne,
90 mg dvakrát denne a 90 mg tri alebo štyrikrát denne podľa potreby na zníženie koncentrácie
sérového vápnika k hornej hranici normálnej koncentrácie alebo pod túto hranicu. Maximálna dávka, ktorá sa podala v klinických štúdiách, bola 90 mg štyrikrát denne.
Sérová hladina vápnika má byť stanovená do 1 týždňa po začatí liečby alebo úprave dávky Mimpary. Po stanovení udržiavacej dávky sa má hladina sérového vápnika stanovovať každé 2 až 3 mesiace. Po titrácii po maximálnu dávku Mimpary sa má sérová hodnota vápnika pravidelne kontrolovať; ak sa nepodarilo udržať klinicky relevantné zníženie sérového vápnika, má sa zvážiť ukončenie liečby Mimparou (pozri časť 5.1).
Pediatrická populácia
Bezpečnosť a účinnosť Mimpary u detí na liečbu paratyreoidného karcinómu a primárnej hyperparatyreózy neboli stanovené. K dispozícii nie sú žiadne údaje.
Porucha funkciepečene
Úvodnú dávku nie je potrebné upravovať. U pacientov so stredne ťažkou až ťažkou poruchou funkcie
pečene sa má Mimpara používať opatrne a počas titrácie dávky a následnej liečby sa má liečba starostlivo sledovať (pozri časti 4.4 a 5.2).
Spôsob podávania
Na perorálne použitie.
Tablety sa majú užívať celé a nemajú sa rozhrýzť, rozdrviť ani rozlomiť.
Odporúča sa užívať Mimparu s jedlom alebo krátko po jedle, pretože v štúdiách sa preukázalo, že biodostupnosť cinakalcetu sa zvyšuje pri užívaní s jedlom (pozri časť 5.2).
Mimpara je dostupná aj ako granulát na pediatrické použitie. Deti, ktoré vyžadujú nižšie dávky ako
30 mg alebo ktoré nie sú schopné prehĺtať tablety, majú dostať granulát Mimpara.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Hypokalciémia (pozri časti 4.2 a 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Sérový vápnik
U dospelých a pediatrických pacientov liečených Mimparou sa zaznamenali život ohrozujúce udalosti
a fatálne následky súvisiace s hypokalciémiou. Prejavy hypokalciémie môžu zahŕňať parestézie, myalgie, kŕčovité sťahy, tetaniu a kŕče. Pokles sérového vápnika môže tiež predĺžiť QT interval, čo
môže viesť ku komorovej arytmii sekundárne pri hypokalciémii. U pacientov liečených cinakalcetom
boli hlásené prípady predĺženia QT intervalu a komorová arytmia (pozri časť 4.8). Opatrnosť sa odporúča u pacientov s ďalšími rizikovými faktormi pre predĺženie QT intervalu, ako napríklad
u pacientov so známym vrodeným syndrómom dlhého QT intervalu alebo u pacientov užívajúcich
lieky, ktoré spôsobujú predĺženie QT intervalu.
Keďže cinakalcet znižuje sérovú hladinu vápnika, pacienti majú byť starostlivo monitorovaní na výskyt hypokalciémie (pozri časť 4.2). Sérový vápnik sa má merať v priebehu 1 týždňa po začatí liečby Mimparou alebo po úprave dávky.
Dospelí
Liečba Mimparou sa nemá začať u pacientov s hodnotou sérového vápnika (prepočítaného na
albumín) pod dolnou hranicou normálnych hodnôt.
U pacientov s CKD na dialýze, ktorým sa podávala Mimpara, približne 30 % pacientov malo minimálne jednu hodnotu sérového vápnika nižšiu ako 7,5 mg/dl (1,9 mmol/l).
Pediatrická populácia
Podávanie Mimpary sa má začať iba na liečbu sekundárnej HPT u detí vo veku ≥ 3 roky s ESRD na
udržiavacej dialyzačnej liečbe, u ktorých sekundárna HPT nie je primerane kontrolovaná liečbou
v rámci štandardnej starostlivosti, ak je hladina sérového vápnika v hornom rozmedzí referenčného rozpätia hodnôt špecifických pre vek alebo nad ním.
Počas liečby cinakalcetom starostlivo sledujte hladiny sérového vápnika (pozri časť 4.2)
a komplianciu pacienta. Ak je podozrenie na nonkomplianciu, nezačnite podávať cinakalcet ani
nezvyšujte dávku.
Pred začatím podávania cinakalcetu a počas liečby zvážte riziká a prínosy a schopnosť pacienta dodržiavať odporúčania na sledovanie a zvládanie rizika hypokalciémie.
Informujte pediatrických pacientov a/alebo ich opatrovateľov o príznakoch hypokalciémie
a o význame dodržiavania pokynov na sledovanie sérového vápnika, dávkovaní a spôsobe podávania.
Pacienti s CKD bez dialýzy
Cinakalcet nie je indikovaný pacientom s CKD bez dialýzy. Štúdie preukázali, že u dospelých pacientov s CKD bez dialýzy liečených cinakalcetom existuje zvýšené riziko hypokalciémie (sérové koncentrácie vápnika < 8,4 mg/dl [2,1 mmol/l]) v porovnaní s pacientmi s CKD na dialýze, ktorí sú
liečení cinakalcetom. Príčinou môžu byť nižšie východiskové koncentrácie vápnika a/alebo prítomnosť reziduálnej renálnej funkcie.
Záchvaty
Prípady záchvatov boli hlásené u pacientov liečených Mimparou (pozri časť 4.8). Prah pre záchvaty
bol znížený významnou redukciou sérových hladín vápnika. Preto sa u pacientov užívajúcich
Mimparu, predovšetkým u pacientov so záchvatovým ochorením v anamnéze, majú starostlivo
sledovať hladiny sérového vápnika.
Hypotenzia a/alebozhoršeniesrdcovéhozlyhania
Prípady hypotenzie a/alebo zhoršenia srdcového zlyhania boli hlásené u pacientov s poruchou srdcovej
funkcie, u ktorých sa kauzálny vzťah s cinakalcetom nedá úplne vylúčiť a môžu byť sprostredkované
znížením sérových koncentrácií vápnika (pozri časť 4.8).
Súbežné podávaniesinými liekmi
Mimparu podávajte s opatrnosťou pacientom užívajúcich iné lieky, o ktorých je známe, že znižujú
sérový vápnik. Pozorne sledujte sérový vápnik (pozri časť 4.5).
Pacientom liečeným Mimparou sa nemá podávať etelkalcetid. Súbežné podávanie môže viesť
k závažnej hypokalciémii.
Všeobecne
Adynamické ochorenie kostí sa môže rozvinúť, ak hodnoty hladín PTH sú chronicky nižšie ako
približne 1,5-násobok horného limitu normálnych hodnôt pri iPTH stanovení. Ak sa hodnoty PTH znížia pod odporučený cieľový interval u pacientov liečených Mimparou, má sa znížiť dávka Mimpary a/alebo sterolov vitamínu D alebo sa má liečba prerušiť.
Hladiny testosterónu
Hladiny testosterónu bývajú často pod normálnym intervalom u pacientov s konečným štádiom
renálneho ochorenia. V klinickej štúdii s dospelými ESRD pacientmi na dialýze sa po 6 mesiacoch
liečby hladiny voľného testosterónu znížili o medián 31,3 % u pacientov liečených Mimparou a o 16,3 % u pacientov, ktorí dostávali placebo. V následnej otvorenej časti tejto štúdie sa nepreukázalo žiadne ďalšie zníženie koncentrácie voľného a celkového testosterónu u pacientov liečených Mimparou počas obdobia 3 rokov. Klinický význam týchto redukcií hladiny sérového testosterónu nie je známy.
Porucha funkciepečene
V dôsledku potenciálne 2- až 4-násobne vyšších plazmatických hladín cinakalcetu u pacientov so
stredne ťažkou až ťažkou poruchou funkcie pečene (Childova-Pughova klasifikácia) sa má Mimpara
podávať u týchto pacientov s opatrnosťou a lekári majú liečbu starostlivo monitorovať (pozri časti 4.2
a 5.2).
Laktóza
Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy
alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Lieky, oktorýchjeznáme,žeznižujúhladinysérovéhovápnika
Súbežné podávanie iných liekov, o ktorých je známe, že znižujú hladiny sérového vápnika a Mimpary
môže viesť k zvýšenému riziku hypokalciémie (pozri časť 4.4). Pacientom liečeným Mimparou sa nemá podávať etelkalcetid (pozri časť 4.4).
Účinok iných liečivnacinakalcet
Cinakalcet je čiastočne metabolizovaný enzýmom CYP3A4. Súbežné podávanie ketokonazolu, silného
inhibítora CYP3A4, 200 mg dvakrát denne spôsobilo približne 2-násobné zvýšenie hladín cinakalcetu. Môže byť potrebné upraviť dávku Mimpary, ak pacient užívajúci Mimparu má začať alebo prerušiť
liečbu silným inhibítorom (napr. ketokonazol, itrakonazol, telitromycín, vorikonazol, ritonavir) alebo induktorom tohto enzýmu (napr. rifampicín).
Údaje získané in vitro ukazujú, že cinakalcet je čiastočne metabolizovaný enzýmom CYP1A2. Fajčenie indukuje CYP1A2 a bolo zistené, že klírens cinakalcetu bol u fajčiarov o 36-38 % vyšší ako u nefajčiarov. Pôsobenie inhibítorov CYP1A2 (napr. fluvoxamínu, ciprofloxacínu) na plazmatické hladiny cinakalcetu nebolo skúmané. Úprava dávky môže byť nevyhnutná, ak pacient začne alebo skončí s fajčením alebo ak bola začatá alebo ukončená súčasná liečba silnými inhibítormi CYP1A2.
Uhličitan vápenatý: Súbežné podávanie uhličitanu vápenatého (1 500 mg v jednej dávke) nemenilo farmakokinetiku cinakalcetu.
Sevelamer: Súbežné podávanie sevelameru (2 400 mg trikrát denne) neovplyvňovalo farmakokinetiku cinakalcetu.
Pantoprazol: Súbežné podávanie pantoprazolu (80 mg denne) nemenilo farmakokinetiku cinakalcetu.
Účinok cinakalcetu nainéliečivá
Lieky metabolizované prostredníctvom enzýmu P450 2D6 (CYP2D6): Cinakalcet je silný inhibítor
CYP2D6. Úprava dávky súbežne podávaných liekov môže byť potrebná, ak sa Mimpara podáva s individuálne titrovanými látkami s úzkym terapeutickým indexom, ktoré sa metabolizujú
predovšetkým prostredníctvom CYP2D6 (napr. flekainid, propafenón, metoprolol, dezipramín, nortriptylín, klomipramín).
Dezipramín: Pri súbežnom podávaní 90 mg cinakalcetu raz denne spolu s 50 mg dezipramínu (tricyklické antidepresívum metabolizované prevažne enzýmom CYP2D6) sa významne zvýšila expozícia voči dezipramínu 3,6-krát (90 % IS 3,0; 4,4) v prípade silných CYP2D6 metabolizérov.
Dextrometorfán: Opakované dávky 50 mg cinakalcetu zvyšovali AUC 30 mg dextrometorfánu (metabolizovaného prevažne enzýmom CYP2D6) 11-násobne v prípade silných metabolizérov CYP2D6.
Warfarín: Opakované perorálne dávky cinakalcetu neovplyvnili farmakokinetiku ani
farmakodynamiku warfarínu (stanovené pomocou protrombínového času a koagulačného faktora VII).
Na základe chýbajúceho účinku cinakalcetu na farmakokinetiku R- a S-warfarínu a absencie autoindukcie po opakovanom podaní u pacientov možno predpokladať, že cinakalcet nie je induktorom CYP3A4, CYP1A2 alebo CYP2C9 u ľudí.
Midazolam: Súbežné podávanie cinakalcetu (90 mg) spolu s perorálnym podaním midazolamu (2 mg), substrátu pre CYP3A4 a CYP3A5, neovplyvnilo farmakokinetiku midazolamu. Tieto údaje naznačujú, že cinakalcet by nemal ovplyvňovať farmakokinetiku tých skupín liekov, ktoré sú metabolizované cez CYP3A4 a CYP3A5, ako sú niektoré imunosupresíva vrátane cyklosporínu a takrolimu.
4.6 Fertilita, gravidita a laktácia
G
r
avidita
Nie sú k dispozícii žiadne klinické údaje o používaní cinakalcetu u gravidných žien. Štúdie na
zvieratách nepreukázali priame škodlivé účinky na graviditu, pôrod alebo postnatálny vývoj.
V štúdiách na gravidných potkanoch a králikoch sa nepozorovali žiadne známky toxicity na
embryo/plod s výnimkou poklesu telesnej hmotnosti plodu u potkanov pri dávkach toxických pre samicu (pozri časť 5.3). Mimpara sa má použiť počas gravidity, len ak potenciálny úžitok z liečby prevyšuje možné riziko pre plod.
Dojčenie
Nie je známe, či sa cinakalcet vylučuje do materského mlieka u ľudí. Cinakalcet sa vylučuje do materského mlieka u potkanov s vysokým pomerom koncentrácie v mlieku a plazme. Po dôkladnom zvážení pomeru prínosu a rizika sa treba rozhodnúť, či prerušiť dojčenie alebo liečbu Mimparou.
Fertilita
Nie sú k dispozícii žiadne klinické údaje týkajúce sa účinku cinakalcetu na fertilitu. V štúdiách
na zvieratách sa nepozorovali žiadne účinky na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
U pacientov užívajúcich Mimparu boli hlásené závrat a záchvaty, ktoré môžu významne ovplyvňovať schopnosť viesť vozidlá a obsluhovať stroje (pozri časť 4.4).
4.8 Nežiaduce účinky
a) Súhrn bezpečnostného profilu
Sekundárna hyperparatyreóza, paratyreoidný karcinóm a primárna hyperparatyreóza
Na základe dostupných údajov od pacientov užívajúcich cinakalcet v placebom kontrolovaných
štúdiách a v štúdiách s jednou skupinou boli najčastejšie hlásené nežiaduce reakcie nauzea a vracanie. Nauzea a vracanie boli mierne až stredne závažné a prechodné u väčšiny pacientov. Prerušenie liečby
pre výskyt nežiaducich účinkov bolo predovšetkým pre nauzeu a vracanie.
b) Zoznam nežiaducich reakcií zoradených do tabuľky
Nežiaduce reakcie, ktoré je možné aspoň pravdepodobne prisúdiť následkom liečby cinakalcetom
v placebom kontrolovaných štúdiách a v štúdiách s jednou skupinou na základe stanovenia príčinných súvislostí sú uvedené nižšie s použitím nasledujúcej konvencie: veľmi časté (≥ 1/10); časté (≥ 1/100 až
< 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé
(< 1/10 000).
Výskyt nežiaducich reakcií z kontrolovaných klinických štúdií a so skúseností po uvedení lieku na trh sú:
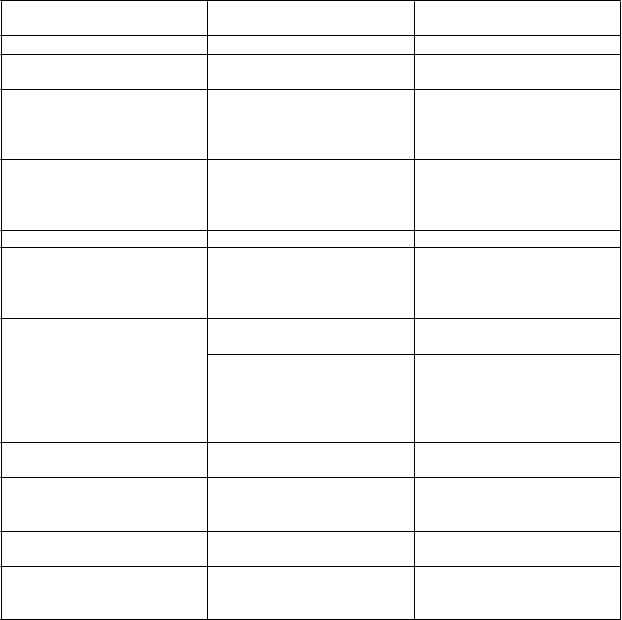
T
rieda orgánových systémov
podľa databázy MedDRA
V
ýskyt Nežiaduca reakcia
Poruchy imunitného systému Časté* Hypersenzitívne reakcie
Poruchy metabolizmu a výživy Časté Anorexia
Znížená chuť do jedla
Poruchy nervového systému Časté Kŕče† Závrat Parestézia Bolesť hlavy
Poruchy srdca a srdcovej
činnosti
Neznáme* Zhoršenie srdcového zlyhania† Predĺženie QT intervalu a ventrikulárna arytmia sekundárne pri hypokalciémii†
Poruchy ciev Časté Hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného
tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Celkové poruchy a reakcie v mieste podania Laboratórne a funkčné vyšetrenia
†pozri časť 4.4
*pozri časť c
Časté Infekcia horných dýchacích ciest
Dyspnoe
Kašeľ
Veľmi časté Nauzea
Vracanie
Časté Dyspepsia
Hnačka
Bolesť brucha
Bolesť brucha – v hornej časti
Zápcha
Časté Vyrážka
Časté Myalgia
Svalové spazmy
Bolesť chrbta
Časté Asténia
Časté Hypokalciémia†
Hyperkaliémia
Znížené hladiny testosterónu†
c) Opis vybraných nežiaducich reakcií
Hypersenzitívne reakciePo uvedení Mimpary na trh sa zaznamenali hypersenzitívne reakcie vrátane angioedému a urtikárie. Frekvencie jednotlivých uprednostňovaných termínov vrátane angioedému a urtikárie nie je možné odhadnúť z dostupných údajov.
Hypotenzia a/alebo zhoršenie srdcového zlyhaniaU pacientov s poruchou srdcovej funkcie liečených cinakalcetom, v sledovaní bezpečnosti po uvedení lieku na trh, sa zaznamenali idiosynkratické prípady hypotenzie a/alebo zhoršenie srdcového zlyhania, ktorých frekvencie nie je možné odhadnúť z dostupných údajov.
Predĺženie QT intervalu a ventrikulárna arytmia sekundárne pri hypokalciémii
Po uvedení lieku na trh sa zaznamenali počas používania Mimpary predĺženie QT intervalu
a ventrikulárna arytmia sekundárne pri hypokalciémii, ktorých frekvencie nie je možné odhadnúť
z dostupných údajov (pozri časť 4.4). d) Pediatrická populácia
Bezpečnosť Mimpary na liečbu sekundárnej HPT u pediatrických pacientov s ESRD na dialýze sa hodnotila v dvoch randomizovaných kontrolovaných štúdiách a v štúdii s jednou skupinou (pozri časť
5.1). Spomedzi všetkých pediatrických jedincov vystavených cinakalcetu v klinických štúdiách malo
spolu 19 pacientov (24,1 %; 64,5 na 100 pacientorokov) najmenej jednu nežiaducu udalosť
hypokalciémie. V pediatrickom klinickom skúšaní sa u pacienta so závažnou hypokalciémiou zaznamenal fatálny následok (pozri časť 4.4).
Mimpara sa u pediatrických pacientov má použiť iba vtedy, ak potenciálny prínos prevyšuje možné
riziko.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieDávky titrované až do 300 mg raz denne boli dospelým pacientom na dialýze podané bez nežiaduceho následku. V klinickej štúdii bola pediatrickému pacientovi na dialýze predpísaná denná dávka
3,9 mg/kg s následnou miernou bolesťou brucha, nauzeou a vracaním.
Predávkovanie Mimparou môže viesť k hypokalciémii. V prípade predávkovania pacienti majú byť monitorovaní na prejavy a príznaky hypokalciémie a liečba má byť symptomatická a podporná. Keďže sa cinakalcet vysoko viaže na proteíny, hemodialýza nie je účinná pri liečbe predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Liečivá ovplyvňujúce homeostázu vápnika, iné antiparatyreoidálne liečivá. ATC kód: H05BX01.
Mechanizmus účinkuReceptor citlivý na vápnik na povrchu hlavnej bunky prištítnej žľazy je hlavným regulátorom sekrécie
PTH. Cinakalcet je kalcimimetická látka, ktorá priamo znižuje hladiny PTH zvýšením citlivosti
receptoru citlivého na vápnik na extracelulárny vápnik. Zníženie hladiny PTH je spojené so súčasným znížením sérových hladín vápnika.
Zníženie hladín PTH koreluje s koncentráciou cinakalcetu.
Po dosiahnutí rovnovážneho stavu zostávajú sérové koncentrácie vápnika počas dávkovacieho
intervalu konštantné.
Sekundárna hyperparatyreóza
D
ospelí
Troch 6-mesačných, dvojito zaslepených, placebom kontrolovaných klinických štúdií sa zúčastnili
pacienti s ESRD s nekontrolovanou sekundárnou HPT na dialýze (n = 1 136). Demografické
a východiskové charakteristiky zodpovedali populácii dialyzovaných pacientov so sekundárnou HPT. Priemerné východiskové koncentrácie iPTH v 3 štúdiách boli 733 pg/ml (77,8 pmol/l) pre skupinu liečenú cinakalcetom a 683 pg/ml (72,4 pmol/l) pre placebo. 66 % pacientov dostávalo steroly vitamínu D na začiatku štúdie a viac ako 90 % užívalo viazače fosfátu. Významné zníženie hladiny iPTH, súčinu sérových koncentrácií vápnika a fosforu (Ca x P) a hladín vápnika a fosforu sa pozorovalo v skupine pacientov liečených cinakalcetom v porovnaní s placebo skupinou pri dodržaní
štandardnej starostlivosti, výsledky boli zhodné vo všetkých troch štúdiách. V jednotlivých štúdiách sa
primárny cieľový ukazovateľ (podiel pacientov s iPTH ≤ 250 pg/ml (≤ 26,5 pmol/l) dosiahol u 41 %,
46 % a 35 % pacientov užívajúcich cinakalcet v porovnaní so 4 %, 7 % a 6 % pacientov, ktorí dostávali placebo. U približne 60 % pacientov liečených cinakalcetom sa dosiahla ≥ 30 % redukcia hladín iPTH a tento účinok bol zhodný v celom spektre východiskových hladín iPTH. Priemerný pokles sérového Ca x P, vápnika a fosforu bol 14 %, 7 % a 8 %.
Redukcia iPTH a Ca x P sa udržiavala počas 12 mesiacov liečby. Cinakalcet znižoval iPTH, Ca x P, hladiny vápnika a fosforu nezávisle od východiskových hodnôt iPTH alebo Ca x P, dialyzačnej modality (PD oproti HD), dĺžky dialýzy a bez ohľadu na to, či sa podávali, alebo nepodávali steroly vitamínu D.
Redukcia PTH sa spájala s nevýznamným znížením markerov kostného metabolizmu (kostná špecifická alkalická fosfatáza, N-telopeptid, kostný obrat a fibróza kostí). Podľa dodatočného vyhodnotenia sumárnych údajov z klinických štúdií trvajúcich 6 a 12 mesiacov sa podľa Kaplanovho- Meierovho stanovenia vyskytli fraktúry kostí a paratyreoidektómia v menšom počte v skupine pacientov s cinakalcetom v porovnaní s kontrolnou skupinou.
Štúdie u nedialyzovaných pacientov s CKD a sekundárnou HPT naznačujú, že cinakalcet znížil hladinu PTH v ich prípade do podobnej miery ako u dialyzovaných pacientov s ESRD a so sekundárnou HPT. Avšak účinnosť, bezpečnosť, optimálne dávkovanie a liečebné ciele u pacientov s obličkovým zlyhávaním pred dialýzou neboli stanovené. Tieto štúdie ukazujú, že pacienti s CKD
liečení cinakalcetom, ktorí nie sú dialyzovaní, sú vystavení zvýšenému riziku vzniku hypokalciémie v porovnaní s dialyzovanými pacientmi s ESRD liečenými cinakalcetom, čo môže byť spôsobené
nižšími východiskovými hladinami vápnika a/alebo prítomnosťou reziduálnej renálnej funkcie.
EVOLVE (EValuation Of Cinacalcet Therapy to Lower CardioVascular Events) bola randomizovaná, dvojito zaslepená klinická štúdia hodnotiaca cinakalcet oproti placebu na zníženie rizika celkovej mortality a kardiovaskulárnych udalostí u 3 883 pacientov so sekundárnou HPT a CKD na dialýze. Štúdia nesplnila primárny cieľ: zníženie rizika celkovej mortality alebo kardiovaskulárnych udalostí vrátane infarktu myokardu, hospitalizácie pre nestabilnú angínu pektoris, srdcového zlyhania alebo periférnej vaskulárnej udalosti (HR 0,93; 95 % IS: 0,85; 1,02; p = 0,112). V sekundárnej analýze po úprave vzhľadom na východiskové charakteristiky bol HR pre primárny kombinovaný koncový ukazovateľ 0,88; 95 % IS: 0,79; 0,97.
Pediatrická populácia
Účinnosť a bezpečnosť cinakalcetu na liečbu sekundárnej HPT u pediatrických pacientov s ESRD na dialýze sa hodnotila v dvoch randomizovaných kontrolovaných štúdiách a v štúdii s jednou skupinou.
Štúdia 1 bola dvojito zaslepená, placebom kontrolovaná štúdia, v ktorej 43 pacientov vo veku 6 až
< 18 rokov bolo randomizovaných na užívanie buď cinakalcetu (n = 22) alebo placeba (n = 21). Štúdia
sa skladala z 24-týždňového obdobia titrácie dávky, za ktorým nasledovala 6-týždňová fáza hodnotenia účinnosti (efficacy assessment phase, EAP) a 30-týždňové otvorené predĺženie štúdie. Priemerný vek na začiatku bol 13 (rozpätie 6 až 18) rokov. Väčšina pacientov (91%) užívala na začiatku steroly vitamínu D. Priemerné (SD) koncentrácie iPTH na začiatku boli 757,1 (440,1) pg/ml v skupine s cinakalcetom a 795,8 (537,9) pg/ml v skupine s placebom. Priemerné (SD) korigované
koncentrácie celkového sérového vápnika na začiatku boli 9,9 (0,5) mg/dl v skupine s cinakalcetom a 9,9 (0,6) mg/dl v skupine s placebom. Priemerná maximálna denná dávka cinakalcetu bola
1,0 mg/kg/deň.
Percento pacientov, ktorí dosiahli primárny koncový ukazovateľ (≥ 30 % zníženie priemerných plazmatických koncentrácií iPTH počas EAP oproti východiskovej hodnote; v 25. až 30. týždni), bolo
55 % v skupine s cinakalcetom a 19,0 % v skupine s placebom (p = 0,02). Priemerné sérové hladiny vápnika počas EAP boli v liečebnej skupine s cinakalcetom v normálnom rozmedzí. Táto štúdia bola
predčasne ukončená v dôsledku úmrtia súvisiaceho so závažnou hypokalciémiou v skupine s cinakalcetom (pozri časť 4.8).
Štúdia 2 bola otvorená štúdia, v ktorej bolo 55 pacientov vo veku 6 až < 18 rokov (priemer 13 rokov) randomizovaných na užívanie buď cinakalcetu pridaného k štandardnej liečbe (ŠL, n = 27), alebo na ŠL samotnú (n = 28). Väčšina pacientov (75 %) užívala na začiatku steroly vitamínu D. Priemerné (SD) koncentrácie iPTH na začiatku boli 946 (635) pg/ml v skupine s cinakalcetom + ŠL a 1 228
(732) pg/ml v skupine so ŠL. Priemerné (SD) korigované koncentrácie celkového sérového vápnika na začiatku boli 9,8 (0,6) mg/dl v skupine s cinakalcetom + ŠL a 9,8 (0,6) mg/dl v skupine so ŠL. 25 pacientov dostalo najmenej jednu dávku cinakalcetu a priemerná maximálna denná dávka cinakalcetu bola 0,55 mg/kg/deň. Štúdia nesplnila svoj primárny koncový ukazovateľ (≥ 30% zníženie
priemerných plazmatických koncentrácií iPTH počas EAP oproti východiskovej hodnote; v 17. až 20.
týždni). Zníženie priemerných plazmatických koncentrácií iPTH ≥ 30 % počas EAP oproti východiskovej hodnote dosiahlo 22 % pacientov v skupine s cinakalcetom + ŠL a 32 % pacientov v skupine so ŠL.
Štúdia 3 bola 26-týždňová otvorená štúdia s jednou skupinou, zameraná na bezpečnosť, s pacientmi vo veku 8 mesiacov až < 6 rokov (priemerný vek 3 roky). Pacienti užívajúci súbežne lieky, o ktorých je známe, že predlžujú korigovaný QT interval, boli zo štúdie vylúčení. Priemerná suchá telesná hmotnosť na začiatku bola 12 kg. Úvodná dávka cinakalcetu bola 0,20 mg/kg. Väčšina pacientov
(89 %) užívala na začiatku steroly vitamínu D.
Sedemnásť pacientov užilo najmenej jednu dávku cinakalcetu a 11 dokončilo najmenej 12 týždňov liečby. Ani jeden pacient vo veku 2 – 5 rokov nemal korigovaný sérový vápnik < 8,4 mg/dl
(2,1 mmol/l). Koncentrácie iPTH boli znížené o ≥ 30 % oproti východiskovej hodnote u 71 % (12 zo
17) pacientov v štúdii.
Paratyreoidný karcinóm a primárna hyperparatyreóza
V jednej štúdii 46 dospelých pacientov (29 s paratyreoidným karcinómom a 17 s primárnou HPT
a závažnou hyperkalciémiou, u ktorých paratyreoidektómia zlyhala alebo bola kontraindikovaná)
dostávalo cinakalcet počas maximálne 3 rokov (priemerne 328 dní u pacientov s paratyreoidným karcinómom a priemerne 347 dní u pacientov s primárnou HPT). Cinakalcet sa podával v dávkach od
30 mg dvakrát denne po 90 mg štyrikrát denne. Primárnym cieľovým ukazovateľom štúdie bol pokles
hladiny sérového vápnika o ³ 1 mg/dl (0,25 mmol/l). U pacientov s paratyreoidným karcinómom klesla priemerná hladina sérového vápnika zo 14,1 mg/dl na 12,4 mg/dl (z 3,5 mmol/l na 3,1 mmol/l), zatiaľ čo u pacientov s primárnou HPT sérové hladiny vápnika klesli z 12,7 mg/dl na 10,4 mg/dl
(z 3,2 mmol/l na 2,6 mmol/l ). U osemnástich (18) z 29 pacientov (62 %) s paratyreoidným karcinómom a u 15 zo 17 jedincov (88 %) s primárnou HPT sa dosiahlo zníženie sérovej hladiny
vápnika ≥ 1 mg/dl (≥ 0,25 mmol/l).
Do 28-týždňovej, placebom kontrolovanej štúdie bolo zaradených 67 dospelých pacientov s primárnou HPT, ktorí splnili kritériá pre paratyreoidektómiu na základe korigovanej hladiny celkového sérového vápnika > 11,3 mg/dl (2,82 mmol/l), ale ≤ 12,5 mg/dl (3,12 mmol/l), ktorí však neboli schopní podstúpiť paratyreoidektómiu. Cinakalcet sa začal podávať v dávke 30 mg dvakrát denne a bol titrovaný na dávku, ktorá udržovala korigovanú koncentráciu celkového sérového vápnika
v normálnom rozmedzí. Významne vyššie percento pacientov liečených cinakalcetom dosiahlo priemernú korigovanú koncentráciu celkového sérového vápnika ≤ 10,3 mg/dl (2,57 mmol/l) a pokles
o ≥ 1 mg/dl (0,25 mmol/l) oproti východiskovej hodnote priemernej korigovanej koncentrácie
celkového sérového vápnika v porovnaní s pacientmi, ktorí dostávali placebo (75,8 % oproti 0 %
a 84,8 % oproti 5,9 %, v uvedenom poradí).
5.2 Farmakokinetické vlastnosti
Absorpcia
Po perorálnom podaní Mimpary sa maximálna plazmatická koncentrácia cinakalcetu dosiahne
približne za 2 až 6 hodín. Na základe porovnaní medzi štúdiami je absolútna biodostupnosť cinakalcetu podávaného nalačno odhadovaná asi na 20-25 %. Podávanie Mimpary s potravou zvyšuje biodostupnosť cinakalcetu približne o 50-80 %. Zvýšenie plazmatickej koncentrácie cinakalcetu je podobné, nezávisle od obsahu tukov v potrave.
Pri dávkach nad 200 mg bola absorpcia saturovaná, pravdepodobne v dôsledku slabej rozpustnosti. Distribúcia
Distribučný objem je vysoký (približne 1 000 litrov), čo nasvedčuje extenzívnej distribúcii. Cinakalcet
sa približne z 97 % viaže na plazmatické proteíny a distribuuje sa len minimálne do červených
krviniek.
Po absorpcii klesá koncentrácia cinakalcetu bifázickým spôsobom s iniciálnym polčasom približne
6 hodín a terminálnym polčasom približne 30 až 40 hodín. Rovnovážne hladiny cinakalcetu sa
dosahujú do 7 dní s minimálnou kumuláciou. Farmakokinetika cinakalcetu sa nemení časom.
Biotransformácia
Cinakalcet sa metabolizuje prostredníctvom mnohých enzýmov, prevažne CYP3A4 a CYP1A2 (podiel
CYP1A2 sa necharakterizoval klinicky). Hlavné cirkulujúce metabolity sú neaktívne.
Na základe in vitro údajov je cinakalcet silný inhibítor CYP2D6, ale pri klinicky dosiahnutých koncentráciách nie je inhibítorom iných CYP enzýmov vrátane CYP1A2, CYP2C8, CYP2C9, CYP2C19 a CYP3A4 ani induktorom CYP1A2, CYP2C19 a CYP3A4.
Eliminácia
Po podaní 75 mg rádioaktívne značenej dávky zdravým dobrovoľníkom sa cinakalcet rýchlo
a extenzívne metabolizoval oxidáciou a následne konjugáciou. Renálna exkrécia metabolitov bola
hlavnou cestou eliminácie rádioaktivity. Približne 80 % dávky sa vylúčilo močom a 15 % stolicou.
Linearita/nelinearita
Hodnoty AUC a Cmax cinakalcetu sa zvyšujú približne lineárne v intervale dávok 30 až 180 mg raz denne.
Farmakokinetický/farmakodynamický vzťah
Ihneď po podaní dávky sa PTH začína znižovať až na minimálnu hodnotu približne 2 až 6 hodín po
podaní dávky, čo sa zhoduje s Cmax cinakalcetu. Následne, keďže hladiny cinakalcetu začínajú klesať, hladiny PTH sa zvyšujú až do 12 hodín po dávke a potom supresia PTH pretrváva približne na
konštantnej úrovni až do konca dávkovacieho intervalu jedenkrát denne. V klinických skúšaniach
s Mimparou boli hladiny PTH merané na konci dávkovacieho intervalu.
Starší pacienti: Nie sú známe žiadne klinicky významné rozdiely vo farmakokinetike cinakalcetu v dôsledku veku.
Renálna insuficiencia: Farmakokinetický profil cinakalcetu u pacientov s ľahkou, stredne ťažkou a ťažkou renálnou insuficienciou a u pacientov na hemodialýze alebo peritoneálnej dialýze je porovnateľný s profilom u zdravých dobrovoľníkov.
Hepatálna insuficiencia: Ľahká porucha funkcie pečene podstatne neovplyvňuje farmakokinetiku cinakalcetu. V porovnaní s osobami s normálnou funkciou pečene boli priemerné hodnoty AUC cinakalcetu približne 2-násobne vyššie u osôb so stredne ťažkou poruchou a približne 4-násobne vyššie u osôb so závažnou poruchou. Priemerný polčas cinakalcetu bol predĺžený o 33 % u pacientov so stredne ťažkou a o 70 % u pacientov s ťažkou poruchou funkcie pečene. Väzba cinakalcetu na proteíny nie je ovplyvnená poruchou funkcie pečene. Keďže dávky sa titrujú pre každého pacienta na základe parametrov bezpečnosti a účinnosti, nie je potrebná ďalšia úprava dávok u osôb s poruchou funkcie pečene (pozri časti 4.2 a 4.4).
Pohlavie: Klírens cinakalcetu môže byť u žien nižší ako u mužov. Keďže dávky sa titrujú zvlášť pre
každého pacienta, nie je nutné ďalej dávku upravovať podľa pohlavia pacienta.
Pediatrická populácia: Farmakokinetika cinakalcetu sa skúmala u pediatrických pacientov s ESRD na dialýze vo veku 3 až 17 rokov. Po jednorazovej a viacnásobných perorálnych dávkach cinakalcetu raz denne boli plazmatické koncentrácie cinakalcetu (hodnoty Cmax a AUC po štandardizácii podľa dávky
a telesnej hmotnosti) podobné koncentráciám pozorovaným u dospelých pacientov.
Na vyhodnotenie vplyvu demografických charakteristík sa vykonala populačná farmakokinetická analýza. Táto analýza nepreukázala žiadny významný vplyv veku, pohlavia, rasy, plochy telesného povrchu a telesnej hmotnosti na farmakokinetiku cinakalcetu.
Fajčenie: Klírens cinakalcetu je u fajčiarov vyšší než u nefajčiarov pravdepodobne z dôvodu indukcie metabolizmu sprostredkovaného enzýmom CYP1A2. Ak pacient začne alebo skončí s fajčením, plazmatické hladiny cinakalcetu sa môžu zmeniť a môže byť nevyhnutné upraviť dávku lieku.
5.3 Predklinické údaje o bezpečnosti
Cinakalcet nebol teratogénny pri králikoch, ak sa podával v dávkach vo výške 0,4-násobku (na základe hodnôt AUC) maximálnej dávky u ľudí pri sekundárnej HPT (180 mg denne). Neteratogénna dávka
pri potkanoch bola vo výške 4,4-násobku (na základe hodnoty AUC) maximálnej dávky pri sekundárnej HPT. Nezistili sa žiadne účinky na fertilitu u samcov ani samíc po expozícii maximálne
4-násobku ľudskej dávky 180 mg/deň (bezpečná hranica u malej skupiny pacientov, ktorým sa podávala maximálna klinická dávka 360 mg denne, predstavuje približne polovicu dávky uvedenej
vyššie).
Pri gravidných potkanoch sa pri najvyššej dávke zaznamenalo mierne zníženie telesnej hmotnosti
a príjmu potravy. Zníženie hmotnosti plodu sa pozorovalo na potkanoch pri dávkach, ktoré matkám
spôsobovali závažnú hypokalciémiu. Cinakalcet prestupoval placentárnou bariérou pri králikoch.
Cinakalcet nevykazoval žiaden genotoxický ani karcinogénny potenciál. Z toxikologických štúdií sú hranice bezpečnosti malé v dôsledku dávku limitujúcej hypokalciémie pozorovanej na zvieracích modeloch. V štúdiách zameraných na vplyv opakovaných dávok na toxicitu a karcinogenicitu na hlodavcoch bol pozorovaný výskyt katarákt a šošovkových opacít. Tento jav však nebol zaznamenaný v štúdiách so psami ani s opicami a ani v klinických štúdiách, v ktorých sa sledoval vznik katarákt. Známy je výskyt katarákt pri hlodavcoch v dôsledku hypokalciémie.
V štúdiách in vitro boli zistené hodnoty IC50 pre nosič sérotonínu 7-krát vyššie a pre KATP kanály
12-krát vyššie ako hodnota EC50 pre receptor citlivý na vápnik získaná za rovnakých
experimentálnych podmienok. Klinický význam nie je známy, avšak možnosť účinku cinakalcetu na tieto sekundárne ciele nemožno celkom vylúčiť.
V toxikologických štúdiách s mladými psami bol pozorovaný tremor následne po znížení sérového
vápnika, eméza, znížená telesná hmotnosť a zvýšenie telesnej hmotnosti, znížený počet erytrocytov,
mierny pokles v parametroch kostnej denzitometrie, reverzibilné rozšírenie rastových platničiek dlhých kostí a histologické lymfoidné zmeny (obmedzené na hrudnú dutinu a pripisované chronickému vracaniu). Všetky tieto účinky sa pozorovali na základe hodnôt AUC pri systémovej expozícii, rovnajúcej sa približne expozícii u pacientov na maximálnej dávke na liečbu sekundárnej HPT.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
predželatínovaný kukuričný škrob
mikrokryštalická celulóza
povidón krospovidón magnéziumstearát
koloidný oxid kremičitý, bezvodý
Filmová vrstva tablety
karnaubský vosk
opadry II zelená: (monohydrát laktózy, hypromelóza, oxid titaničitý (E171), glycerol triacetát,
FD&C modré (E132), žltý oxid železitý (E172))
opadry bezfarebná: (hypromelóza, makrogol)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
Blister: 5 rokov.
Fľaša: 5 rokov.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Aclar/PVC/PVAc/Al blister obsahujúci 14 tabliet. Veľkosti balenia: 1 blister (14 tabliet), 2 blistre
(28 tabliet), 6 blistrov (84 tabliet) v škatuli.
Fľaša z polyetylénu s vysokou hustotou (HDPE) s kúskom vaty a s detským bezpečnostným
polypropylénovým uzáverom s indukčným tesnením, vložená do škatule. Každá fľaša obsahuje
30 tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky na likvidáciu.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Amgen Europe B.V. Minervum 7061
4817 ZK Breda
Holandsko
8. REGISTRAČNÉ ČÍSLAEU/1/04/292/001 – 30 mg škatuľa so 14 tabletami EU/1/04/292/002 – 30 mg škatuľa s 28 tabletami EU/1/04/292/003 – 30 mg škatuľa s 84 tabletami EU/1/04/292/004 – 30 mg fľaša s 30 tabletami EU/1/04/292/005 – 60 mg škatuľa so 14 tabletami EU/1/04/292/006 – 60 mg škatuľa s 28 tabletami EU/1/04/292/007 – 60 mg škatuľa s 84 tabletami EU/1/04/292/008 – 60 mg fľaša s 30 tabletami EU/1/04/292/009 – 90 mg škatuľa so 14 tabletami EU/1/04/292/010 – 90 mg škatuľa s 28 tabletami EU/1/04/292/011 – 90 mg škatuľa s 84 tabletami EU/1/04/292/012 – 90 mg fľaša s 30 tabletami
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 22. októbra 2004
Dátum posledného predĺženia registrácie: 23. septembra 2009
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
Mimpara 1 mg granulát v kapsulách na otvorenie Mimpara 2,5 mg granulát v kapsulách na otvorenie Mimpara 5 mg granulát v kapsulách na otvorenie
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá kapsula obsahuje 1 mg; 2,5 mg alebo 5 mg cinakalcetu (vo forme hydrochloridu).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Biely až sivobiely granulát v kapsulách na otvorenie. Mimpara 1 mg granulát v kapsulách na otvorenie
Kapsula sa skladá z tmavozeleného viečka s označením „AMG“ a bieleho nepriehľadného tela
s označením „1 mg“.
Mimpara 2,5 mg granulát v kapsulách na otvorenie
Kapsula sa skladá z tmavožltého viečka s označením „AMG“ a bieleho nepriehľadného tela
s označením „2,5 mg“.
Mimpara 5 mg granulát v kapsulách na otvorenie
Kapsula sa skladá z modrého viečka s označením „AMG“ a bieleho nepriehľadného tela s označením
„5 mg“.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Sekundárna hyperparatyreóza
Dospelí
Liečba sekundárnej hyperparatyreózy (HPT) u dospelých pacientov s konečným štádiom renálneho ochorenia (ESRD) na udržiavacej dialyzačnej liečbe.
Pediatrická populácia
Liečba sekundárnej hyperparatyreózy (HPT) u detí od 3 rokov a viac s konečným štádiom renálneho ochorenia (ESRD, end stage renal disease) na udržiavacej dialyzačnej liečbe, u ktorých sekundárna HPT nie je primerane kontrolovaná v rámci štandardnej liečby (pozri časť 4.4).
Mimpara sa môže používať ako súčasť terapeutických režimov, ktoré zahŕňajú primeranú liečbu viazačmi fosfátov a/alebo sterolmi vitamínu D (pozri časť 5.1).
Paratyreoidný karcinóm a primárna hyperparatyreóza u dospelých
Redukcia hyperkalciémie u dospelých pacientov:
s paratyreoidným karcinómom;
s primárnou HPT, pre ktorých by bola indikovaná paratyreoidektómia na základe sérových hladín vápnika (ako je definované príslušnou liečebnou schémou), ale u ktorých paratyreoidektómia nie je klinicky vhodná alebo je kontraindikovaná.
4.2 Dávkovanie a spôsob podávania
Sekundárna hyperparatyreóza
Dospelí a starší pacienti (> 65 rokov)
Odporúčaná úvodná dávka u dospelých pacientov je 30 mg raz denne. Dávka lieku Mimpara sa má titrovať každé 2 až 4 týždne po maximálnu dávku 180 mg raz denne, pokým sa nedosiahne cieľová hladina parathormónu (PTH) u dialyzovaných pacientov medzi 150-300 pg/ml (15,9-31,8 pmol/l) pomocou intaktnej analýzy PTH (iPTH). Hladiny PTH majú byť vyšetrené najmenej 12 hodín po podaní Mimpary. Výsledky sa majú využiť v prebiehajúcej liečebnej schéme.
Hodnota PTH má byť stanovená 1 až 4 týždne po začatí liečby alebo úprave dávky Mimpary. PTH sa má monitorovať približne každé 1-3 mesiace počas udržiavacej liečby. Na stanovenie hladín PTH sa môže použiť buď intaktný PTH (iPTH) alebo biointaktný PTH (biPTH); liečba Mimparou nemení vzťah medzi iPTH a biPTH.
Úprava dávky na základe sérových hladín vápnika
Korigovaný sérový vápnik sa má vyšetriť a monitorovať a pred podaním prvej dávky Mimpary má byť jeho hodnota na dolnej hranici normálnych hodnôt alebo nad ňou (pozri časť 4.4). Normálne rozpätie hodnôt vápnika sa môže odlišovať v závislosti od metód, ktoré používa vaše miestne laboratórium.
Počas titrácie dávky sa majú často monitorovať sérové hladiny vápnika, a to do 1 týždňa po začatí liečby alebo úprave dávky Mimpary. Po stanovení udržiavacej dávky sa má sérová hladina vápnika stanovovať približne raz za mesiac. V prípade, že hladiny sérového vápnika klesnú pod 8,4 mg/dl (2,1 mmol/l) a/alebo sa objavia príznaky hypokalciémie, odporúča sa nasledujúci manažment:
K
origovaná sérová hodnota vápnika alebo
klinické príznaky hypokalciémie
< 8,4 mg/dl (2,1 mmol/l) a > 7,5 mg/dl
(1,9 mmol/l), alebo v prítomnosti klinických príznakov hypokalciémie
< 8,4 mg/dl (2,1 mmol/l) a > 7,5 mg/dl
(1,9 mmol/l) alebo ak príznaky hypokalciémie pretrvávajú aj napriek snahe o zvýšenie
hladiny sérového vápnika
≤ 7,5 mg/dl (1,9 mmol/l) alebo ak príznaky hypokalciémie pretrvávajú a dávku vitamínu D nie je možné zvýšiť
Odporúčania
Na základe klinického posúdenia sa na zvýšenie sérovej hladiny vápnika môžu použiť viazače fosfátov obsahujúce vápnik, steroly vitamínu D a/alebo úprava koncentrácie vápnika v dialyzačnom roztoku.
Znížte alebo prerušte podávanie Mimpary.
Prerušte podávanie Mimpary až kým sérové hladiny vápnika nedosiahnu 8,0 mg/dl (2,0 mmol/l) a/alebo kým neustúpia príznaky hypokalciémie.
Liečba sa má opätovne nasadiť za použitia nasledujúcej najnižšej dávky Mimpary.
 Pediatrická populácia
Pediatrická populácia
Hodnota korigovaného sérového vápnika má byť pred podaním prvej dávky Mimpary v hornom rozmedzí referenčného rozpätia hodnôt špecifických pre vek alebo nad ním a má byť dôkladne monitorovaná (pozri časť 4.4). Normálne rozpätie hodnôt vápnika sa môže odlišovať v závislosti od metód, ktoré používa vaše miestne laboratórium, a od veku dieťaťa/pacienta.
Odporúčaná úvodná dávka pre deti vo veku ≥ 3 roky až < 18 rokov je ≤ 0,20 mg/kg raz denne na
základe suchej hmotnosti pacienta (pozri tabuľku 1).
Dávku možno zvýšiť, aby sa dosiahol požadovaný cieľový rozsah hladín iPTH. Dávka sa má zvyšovať postupne podľa dostupných dávkovacích úrovní (pozri tabuľku 1), nie častejšie, ako každé 4 týždne. Dávku možno zvýšiť maximálne na 2,5 mg/kg/deň a neprekročiť pritom celkovú dennú dávku 180 mg.
Tabuľka 1. Denná dávka Mimpary u pediatrických pacientov
Suchá hmotnosť pacienta (kg) Úvodná dávka (mg) Dostupné sekvenčné úrovne dávky (mg)
10 až < 12,5 1 1; 2,5; 5; 7,5; 10 a 15
≥ 12,5 až < 25 2,5 2,5; 5; 7,5; 10; 15 a 30
≥ 25 až < 36 5 5; 10; 15; 30 a 60
≥ 36 až < 50 5; 10; 15; 30; 60 a 90
≥ 50 až < 75 10 10; 15; 30; 60; 90 a 120
≥ 75 15 15; 30; 60; 90; 120 a 180
Úprava dávky na základe hladín PTH
Hodnota PTH má byť vyšetrená najmenej 12 hodín po podaní Mimpary a hodnota iPTH má byť
meraná 1 až 4 týždne po začatí liečby alebo úprave dávky Mimpary.
Dávka sa má upraviť podľa hladín iPTH tak, ako je uvedené ďalej:
Ak je iPTH < 150 pg/ml (15,9 pmol/l) a ≥ 100 pg/ml (10,6 pmol/l), dávku Mimpary znížte na najbližšiu nižšiu úroveň.
Ak je iPTH < 100 pg/ml (10,6 pmol/l), prerušte liečbu Mimparou; keď iPTH bude > 150 pg/ml (15,9 pmol/l), liečbu Mimparou obnovte najbližšou nižšou dávkou. Ak bola liečba Mimparou prerušená viac ako 14 dní, obnovte ju odporúčanou úvodnou dávkou.
Úprava dávky na základe sérových hladín vápnika
Sérová hladina vápnika má byť stanovená do 1 týždňa po začatí liečby alebo úprave dávky Mimpary.
Po stanovení udržiavacej dávky sa odporúča stanovovať hladiny sérového vápnika každý týždeň. Hladiny sérového vápnika u pediatrických pacientov sa majú udržiavať v normálnom rozmedzí. Ak sa sérové hladiny vápnika znížia pod normálnu hranicu alebo sa objavia príznaky hypokalciémie, má sa prijať vhodná úprava dávky, ako je uvedené v nasledujúcej tabuľke 2:
Tabuľka 2: Úprava dávky u pediatrických pacientov vo veku ≥ 3 až < 18 rokov
K
origovaná sérová hodnota vápnika
alebo klinické príznaky hypokalciémie Korigovaná koncentrácia sérového vápnika je na dolnej hranici normálnych hodnôt podľa veku alebo pod ňou
alebo
ak sa objavia príznaky hypokalciémie, bez ohľadu na hladinu vápnika. Korigovaná koncentrácia celkového sérového vápnika je nad dolnou hranicou normálnych hodnôt podľa veku a
príznaky hypokalciémie ustúpili.
Odporúčania na dávkovanie
Prerušte liečbu Mimparou.*
Podávajte doplnky vápnika, viazače fosfátov obsahujúce vápnik a/alebo steroly vitamínu D, ak je to klinicky indikované.
Obnovte liečbu najbližšou nižšou dávkou. Ak bola liečba Mimparou prerušená viac ako 14 dní, obnovte ju odporúčanou úvodnou dávkou.
Ak pacient užíval najnižšiu dávku (1 mg/deň) pred
prerušením liečby, obnovte ju rovnakou dávkou
(1 mg/deň).
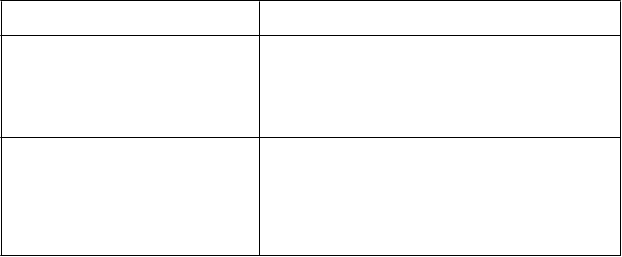

*Ak sa podávanie dávok prerušilo, korigovaná sérová hladina vápnika má byť stanovená do 5 až 7 dní.
Bezpečnosť a účinnosť Mimpary u detí vo veku menej ako 3 roky na liečbu sekundárnej
hyperparatyreózy neboli stanovené. K dispozícii nie sú dostatočné údaje.
Paratyreoidný karcinóm a primárna hyperparatyreóza
D
ospelí a starší pacienti (> 65 rokov)
Odporúčaná úvodná dávka Mimpary u dospelých pacientov je 30 mg dvakrát denne. Dávka Mimpary
sa má titrovať každé 2 až 4 týždne po následných dávkach 30 mg dvakrát denne, 60 mg dvakrát denne,
90 mg dvakrát denne a 90 mg tri alebo štyrikrát denne podľa potreby na zníženie koncentrácie sérového vápnika k hornej hranici normálnej koncentrácie alebo pod túto hranicu. Maximálna dávka, ktorá sa podala v klinických štúdiách, bola 90 mg štyrikrát denne.
Sérová hladina vápnika má byť stanovená do 1 týždňa po začatí liečby alebo úprave dávky Mimpary. Po stanovení udržiavacej dávky sa má hladina sérového vápnika stanovovať každé 2 až 3 mesiace. Po titrácii po maximálnu dávku Mimpary sa má sérová hodnota vápnika pravidelne kontrolovať; ak sa nepodarilo udržať klinicky relevantné zníženie sérového vápnika, má sa zvážiť ukončenie liečby Mimparou (pozri časť 5.1).
Pediatrická populáciaBezpečnosť a účinnosť Mimpary u detí na liečbu paratyreoidného karcinómu a primárnej hyperparatyreózy neboli stanovené. K dispozícii nie sú žiadne údaje.
Porucha funkciepečeneÚvodnú dávku nie je potrebné upravovať. U pacientov so stredne ťažkou až ťažkou poruchou funkcie
pečene sa má Mimpara používať opatrne a počas titrácie dávky a následnej liečby sa má liečba starostlivo sledovať (pozri časti 4.4 a 5.2).
Spôsob podávaniaGranulát Mimpara možno podávať perorálne alebo nazogastrickou, prípadne gastrostomickou sondou.
Kapsuly sa
nesmú prehltnúť. Kapsula sa musí otvoriť a celý obsah kapsuly sa má nasypať do jedla alebo tekutiny a podať. Aby sa predišlo chybám v dávkovaní, na dosiahnutie potrebnej dávky sa kapsuly s odlišnými silami (1; 2,5 alebo 5 mg)
nesmú zmiešať.
Odporúča sa užívať Mimparu s jedlom alebo krátko po jedle, pretože v štúdiách sa preukázalo, že biodostupnosť cinakalcetu sa zvyšuje pri užívaní s jedlom (pozri časť 5.2).
Perorálne podávanie Kapsuly sa majú otvoriť jemným stlačením a odkrútením farebného vrchu od bieleho tela kapsuly, pričom treba najprv opatrne po kapsule poklepať, aby sa obsah usadil na jej spodku (biela časť kapsule). Pri otváraní sa odporúča držať kapsulu vzpriamene nad malým množstvom mäkkého jedla alebo tekutiny.
Celý granulát sa má vysypať do malého množstva mäkkého jedla (napr. jablkového pyré alebo jogurtu) alebo tekutiny (napr. jablkovej šťavy alebo renálnej tekutej detskej výživy), a prehltnúť. Ak sa za deň užijú 1 – 3 kapsuly, použite najmenej 15 ml jedla; Ak sa za deň užije 4 – 6 kapsúl, použite najmenej 30 ml jedla.
Pacienti sa po perorálnom podaní majú napiť tekutín, aby sa zabezpečilo prehltnutie celej zmesi.
Rozmiešanie granulátu vo vode na perorálne podanie sa neodporúča, lebo následkom môže byť horká chuť.
Granulát zmiešaný s mäkkým jedlom alebo tekutinou sa má okamžite podať.
Podávanie s použitím nazogastrickej alebo gastrostomickej sondy Pacientom, ktorí majú nazogastrickú alebo gastrostomickú sondu, možno granulát podať s malým množstvom (najmenej 5 ml) vody cez PVC hadičku. Použitú enterálnu hadičku vypláchnite dostatočným množstvom. Granulát sa nesmie podávať cez hadičky vyrobené z polyuretánu alebo silikónu.
Mimpara je dostupná aj v tabletách. Deti, ktoré potrebujú dávku 30 mg a viac a ktoré sú schopné
prehĺtať tablety, môžu dostať príslušné dávky tabliet Mimpara.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Hypokalciémia (pozri časti 4.2 a 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaníSérový vápnikU dospelých a pediatrických pacientov liečených Mimparou sa zaznamenali život ohrozujúce udalosti
a fatálne následky súvisiace s hypokalciémiou. Prejavy hypokalciémie môžu zahŕňať parestézie, myalgie, kŕčovité sťahy, tetaniu a kŕče. Pokles sérového vápnika môže tiež predĺžiť QT interval, čo
môže viesť ku komorovej arytmii sekundárne pri hypokalciémii. U pacientov liečených cinakalcetom boli hlásené prípady predĺženia QT intervalu a komorová arytmia (pozri časť 4.8). Opatrnosť sa
odporúča u pacientov s ďalšími rizikovými faktormi pre predĺženie QT intervalu, ako napríklad
u pacientov so známym vrodeným syndrómom dlhého QT intervalu alebo u pacientov užívajúcich lieky, ktoré spôsobujú predĺženie QT intervalu.
Keďže cinakalcet znižuje sérovú hladinu vápnika, pacienti majú byť starostlivo monitorovaní na výskyt hypokalciémie (pozri časť 4.2). Sérový vápnik sa má merať v priebehu 1 týždňa po začatí liečby Mimparou alebo po úprave dávky.
DospelíLiečba Mimparou sa nemá začať u pacientov s hodnotou sérového vápnika (prepočítaného na
albumín) pod dolnou hranicou normálnych hodnôt.
U pacientov s CKD na dialýze, ktorým sa podávala Mimpara, približne 30 % pacientov malo minimálne jednu hodnotu sérového vápnika nižšiu ako 7,5 mg/dl (1,9 mmol/l).
Pediatrická populáciaPodávanie Mimpary sa má začať iba na liečbu sekundárnej HPT u detí vo veku ≥ 3 roky s ESRD na
udržiavacej dialyzačnej liečbe, u ktorých sekundárna HPT nie je primerane kontrolovaná liečbou
v rámci štandardnej starostlivosti, ak je hladina sérového vápnika v hornom rozmedzí referenčného rozpätia hodnôt špecifických pre vek alebo nad ním.
Počas liečby cinakalcetom starostlivo sledujte hladiny sérového vápnika (pozri časť 4.2)
a komplianciu pacienta. Ak je podozrenie na nonkomplianciu, nezačnite podávať cinakalcet ani nezvyšujte dávku.
Pred začatím podávania cinakalcetu a počas liečby zvážte riziká a prínosy a schopnosť pacienta dodržiavať odporúčania na sledovanie a zvládanie rizika hypokalciémie.
Informujte pediatrických pacientov a/alebo ich opatrovateľov o príznakoch hypokalciémie
a o význame dodržiavania pokynov na sledovanie sérového vápnika, o dávkovaní a spôsobe podávania.
Pacienti s CKD bez dialýzy
Cinakalcet nie je indikovaný pacientom s CKD bez dialýzy. Štúdie preukázali, že u dospelých pacientov s CKD bez dialýzy liečených cinakalcetom existuje zvýšené riziko hypokalciémie (sérové koncentrácie vápnika < 8,4 mg/dl [2,1 mmol/l]) v porovnaní s pacientmi s CKD na dialýze, ktorí sú liečení cinakalcetom. Príčinou môžu byť nižšie východiskové koncentrácie vápnika a/alebo prítomnosť reziduálnej renálnej funkcie.
Záchvaty
Prípady záchvatov boli hlásené u pacientov liečených Mimparou (pozri časť 4.8). Prah pre záchvaty
bol znížený významnou redukciou sérových hladín vápnika. Preto sa u pacientov užívajúcich
Mimparu, predovšetkým u pacientov so záchvatovým ochorením v anamnéze, majú starostlivo
sledovať hladiny sérového vápnika.
Hypotenzia a/alebozhoršeniesrdcovéhozlyhania
Boli hlásené prípady hypotenzie a/alebo zhoršenia srdcového zlyhania u pacientov s poruchou
srdcovej funkcie, u ktorých sa kauzálny vzťah s cinakalcetom nedá úplne vylúčiť a môžu byť sprostredkované znížením sérových koncentrácií vápnika (pozri časť 4.8).
Súbežné podávaniesinými liekmi
Mimparu podávajte s opatrnosťou pacientom užívajúcim iné lieky, o ktorých je známe, že znižujú
sérový vápnik. Pozorne sledujte sérový vápnik (pozri časť 4.5).
Pacientom liečeným Mimparou sa nemá podávať etelkalcetid. Súbežné podávanie môže viesť
k závažnej hypokalciémii.
Všeobecne
Adynamické ochorenie kostí sa môže rozvinúť, ak hodnoty hladín PTH sú chronicky nižšie ako
približne 1,5-násobok horného limitu normálnych hodnôt pri iPTH stanovení. Ak sa hodnoty PTH
znížia pod odporučený cieľový interval u pacientov liečených Mimparou, má sa znížiť dávka Mimpary a/alebo sterolov vitamínu D alebo sa má liečba prerušiť.
Hladiny testosterónu
Hladiny testosterónu bývajú často pod normálnym intervalom u pacientov s konečným štádiom
renálneho ochorenia. V klinickej štúdii s dospelými ESRD pacientmi na dialýze sa po 6 mesiacoch
liečby hladiny voľného testosterónu znížili o medián 31,3 % u pacientov liečených Mimparou
a o 16,3 % u pacientov, ktorí dostávali placebo. V následnej otvorenej časti tejto štúdie sa nepreukázalo žiadne ďalšie zníženie koncentrácie voľného a celkového testosterónu u pacientov liečených Mimparou počas obdobia 3 rokov. Klinický význam týchto redukcií hladiny sérového testosterónu nie je známy.
Porucha funkciepečene
V dôsledku potenciálne 2- až 4-násobne vyšších plazmatických hladín cinakalcetu u pacientov so
stredne ťažkou až ťažkou poruchou funkcie pečene (Childova-Pughova klasifikácia) sa má Mimpara podávať u týchto pacientov s opatrnosťou a lekári majú liečbu starostlivo monitorovať (pozri časti 4.2 a 5.2).
4.5 Liekové a iné interakcie
Lieky, oktorýchjeznáme,žeznižujúhladinysérovéhovápnika
Súbežné podávanie iných liekov, o ktorých je známe, že znižujú hladiny sérového vápnika a Mimpary
môže viesť k zvýšenému riziku hypokalciémie (pozri časť 4.4). Pacientom liečeným Mimparou sa
nemá podávať etelkalcetid (pozri časť 4.4).
Účinok iných liečivnacinakalcet
Cinakalcet je čiastočne metabolizovaný enzýmom CYP3A4. Súbežné podávanie ketokonazolu, silného
inhibítora CYP3A4, 200 mg dvakrát denne spôsobilo približne 2-násobné zvýšenie hladín cinakalcetu. Môže byť potrebné upraviť dávku Mimpary, ak pacient užívajúci Mimparu má začať alebo prerušiť liečbu silným inhibítorom (napr. ketokonazol, itrakonazol, telitromycín, vorikonazol, ritonavir) alebo induktorom tohto enzýmu (napr. rifampicín).
Údaje získané in vitro ukazujú, že cinakalcet je čiastočne metabolizovaný enzýmom CYP1A2.'
Fajčenie indukuje CYP1A2 a bolo zistené, že klírens cinakalcetu bol u fajčiarov o 36-38 % vyšší ako u nefajčiarov. Pôsobenie inhibítorov CYP1A2 (napr. fluvoxamínu, ciprofloxacínu) na plazmatické
hladiny cinakalcetu nebolo skúmané. Úprava dávky môže byť nevyhnutná, ak pacient začne alebo
skončí s fajčením alebo ak bola začatá alebo ukončená súčasná liečba silnými inhibítormi CYP1A2.
Uhličitan vápenatý: Súbežné podávanie uhličitanu vápenatého (1 500 mg v jednej dávke) nemenilo farmakokinetiku cinakalcetu.
Sevelamer: Súbežné podávanie sevelameru (2 400 mg trikrát denne) neovplyvňovalo farmakokinetiku
cinakalcetu.
Pantoprazol: Súbežné podávanie pantoprazolu (80 mg denne) nemenilo farmakokinetiku cinakalcetu.
Účinok cinakalcetu nainéliečivá
Lieky metabolizované prostredníctvom enzýmu P450 2D6 (CYP2D6): Cinakalcet je silný inhibítor
CYP2D6. Úprava dávky súbežne podávaných liekov môže byť potrebná, ak sa Mimpara podáva s individuálne titrovanými látkami s úzkym terapeutickým indexom, ktoré sa metabolizujú predovšetkým prostredníctvom CYP2D6 (napr. flekainid, propafenón, metoprolol, dezipramín, nortriptylín, klomipramín).
Dezipramín: Pri súbežnom podávaní 90 mg cinakalcetu raz denne spolu s 50 mg dezipramínu (tricyklické antidepresívum metabolizované prevažne enzýmom CYP2D6) sa významne zvýšila expozícia voči dezipramínu 3,6-krát (90 % IS 3,0; 4,4) v prípade silných CYP2D6 metabolizérov.
Dextrometorfán: Opakované dávky 50 mg cinakalcetu zvyšovali AUC 30 mg dextrometorfánu (metabolizovaného prevažne enzýmom CYP2D6) 11-násobne v prípade silných metabolizérov CYP2D6.
Warfarín: Opakované perorálne dávky cinakalcetu neovplyvnili farmakokinetiku ani
farmakodynamiku warfarínu (stanovené pomocou protrombínového času a koagulačného faktora VII).
Na základe chýbajúceho účinku cinakalcetu na farmakokinetiku R- a S-warfarínu a absencie autoindukcie po opakovanom podaní u pacientov možno predpokladať, že cinakalcet nie je induktorom CYP3A4, CYP1A2 alebo CYP2C9 u ľudí.
Midazolam: Súbežné podávanie cinakalcetu (90 mg) spolu s perorálnym podaním midazolamu (2 mg), substrátu pre CYP3A4 a CYP3A5, neovplyvnilo farmakokinetiku midazolamu. Tieto údaje naznačujú, že cinakalcet by nemal ovplyvňovať farmakokinetiku tých skupín liekov, ktoré sú metabolizované cez CYP3A4 a CYP3A5, ako sú niektoré imunosupresíva vrátane cyklosporínu a takrolimu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne klinické údaje o používaní cinakalcetu u gravidných žien. Štúdie na
zvieratách nepreukázali priame škodlivé účinky na graviditu, pôrod alebo postnatálny vývoj.
V štúdiách na gravidných potkanoch a králikoch sa nepozorovali žiadne známky toxicity na embryo/plod s výnimkou poklesu telesnej hmotnosti plodu u potkanov pri dávkach toxických pre samicu (pozri časť 5.3). Mimpara sa má použiť počas gravidity, len ak potenciálny úžitok z liečby prevyšuje možné riziko pre plod.
Dojčenie
Nie je známe, či sa cinakalcet vylučuje do materského mlieka u ľudí. Cinakalcet sa vylučuje do
materského mlieka u potkanov s vysokým pomerom koncentrácie v mlieku a plazme. Po dôkladnom
zvážení pomeru prínosu a rizika sa treba rozhodnúť, či prerušiť dojčenie alebo liečbu Mimparou.
Fertilita
Nie sú k dispozícii žiadne klinické údaje týkajúce sa účinku cinakalcetu na fertilitu. V štúdiách
na zvieratách sa nepozorovali žiadne účinky na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
U pacientov užívajúcich Mimparu boli hlásené závrat a záchvaty, ktoré môžu významne ovplyvňovať schopnosť viesť vozidlá a obsluhovať stroje (pozri časť 4.4).
4.8 Nežiaduce účinky
a) Súhrn bezpečnostného profilu
Sekundárna hyperparatyreóza, paratyreoidný karcinóm a primárna hyperparatyreóza
Na základe dostupných údajov od pacientov užívajúcich cinakalcet v placebom kontrolovaných
štúdiách a v štúdiách s jednou skupinou boli najčastejšie hlásené nežiaduce reakcie nauzea a vracanie. Nauzea a vracanie boli mierne až stredne závažné a prechodné u väčšiny pacientov. Prerušenie liečby
pre výskyt nežiaducich účinkov bolo predovšetkým pre nauzeu a vracanie.
b) Zoznam nežiaducich reakcií zoradených do tabuľky
Nežiaduce reakcie, ktoré je možné aspoň pravdepodobne prisúdiť následkom liečby cinakalcetom
v placebom kontrolovaných štúdiách a v štúdiách s jednou skupinou na základe stanovenia príčinných súvislostí sú uvedené nižšie s použitím nasledujúcej konvencie: veľmi časté (≥ 1/10); časté (≥ 1/100 až
< 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé
(< 1/10 000).
Výskyt nežiaducich reakcií z kontrolovaných klinických štúdií a so skúseností po uvedení lieku na trh sú:
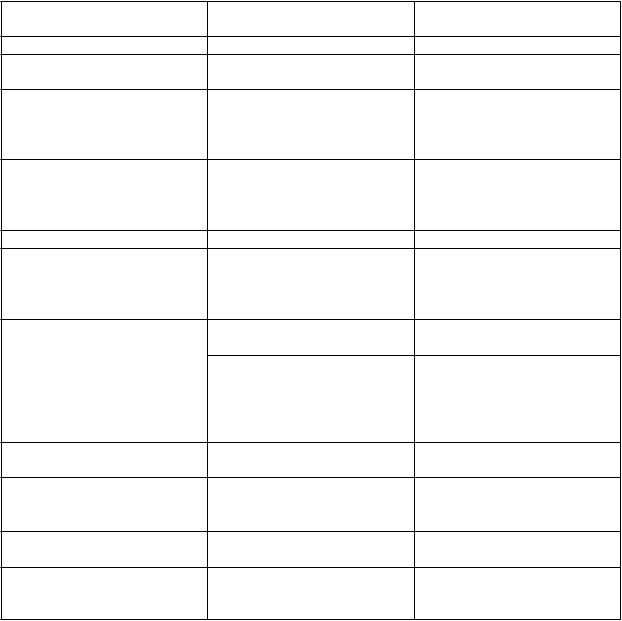
T
rieda orgánových systémov
podľa databázy MedDRA
V
ýskyt Nežiaduca reakcia
Poruchy imunitného systému Časté* Hypersenzitívne reakcie
Poruchy metabolizmu a výživy Časté Anorexia
Znížená chuť do jedla
Poruchy nervového systému Časté Kŕče† Závrat Parestézia Bolesť hlavy
Poruchy srdca a srdcovej
činnosti
Neznáme* Zhoršenie srdcového zlyhania†
Predĺženie QT intervalu a ventrikulárna arytmia sekundárne pri hypokalciémii†
Poruchy ciev Časté Hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného
tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
†pozri časť 4.4
*pozri časť c
Časté Infekcia horných dýchacích ciest
Dyspnoe
Kašeľ
Veľmi časté Nauzea
Vracanie
Časté Dyspepsia
Hnačka
Bolesť brucha
Bolesť brucha – v hornej časti
Zápcha
Časté Vyrážka
Časté Myalgia
Svalové spazmy
Bolesť chrbta
Časté Asténia
Časté Hypokalciémia†
Hyperkaliémia
Znížené hladiny testosterónu†
c) Opis vybraných nežiaducich reakcií
Hypersenzitívne reakciePo uvedení Mimpary na trh sa zaznamenali hypersenzitívne reakcie vrátane angioedému a urtikárie. Frekvencie jednotlivých uprednostňovaných termínov vrátane angioedému a urtikárie nie je možné odhadnúť z dostupných údajov.
Hypotenzia a/alebo zhoršenie srdcového zlyhaniaU pacientov s poruchou srdcovej funkcie liečených cinakalcetom, v sledovaní bezpečnosti po uvedení lieku na trh, sa zaznamenali idiosynkratické prípady hypotenzie a/alebo zhoršenie srdcového zlyhania, ktorých frekvencie nie je možné odhadnúť z dostupných údajov.
Predĺženie QT intervalu a ventrikulárna arytmia sekundárne pri hypokalciémii
Po uvedení lieku na trh sa zaznamenali počas používania Mimpary predĺženie QT intervalu
a ventrikulárna arytmia sekundárne pri hypokalciémii, ktorých frekvencie nie je možné odhadnúť
z dostupných údajov (pozri časť 4.4).
d) Pediatrická populácia
Bezpečnosť Mimpary na liečbu sekundárnej HPT u pediatrických pacientov s ESRD na dialýze sa hodnotila v dvoch randomizovaných kontrolovaných štúdiách a v štúdii s jednou skupinou (pozri časť
5.1). Spomedzi všetkých pediatrických jedincov vystavených cinakalcetu v klinických štúdiách malo
spolu 19 pacientov (24,1 %; 64,5 na 100 pacientorokov) najmenej jednu nežiaducu udalosť
hypokalciémie. V pediatrickom klinickom skúšaní sa u pacienta so závažnou hypokalciémiou
zaznamenal fatálny následok (pozri časť 4.4).
Mimpara sa u pediatrických pacientov má použiť iba vtedy, ak potenciálny prínos prevyšuje možné
riziko.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieDávky titrované až do 300 mg raz denne boli dospelým pacientom na dialýze podané bez nežiaduceho následku. V klinickej štúdii bola pediatrickému pacientovi na dialýze predpísaná denná dávka
3,9 mg/kg s následnou miernou bolesťou brucha, nauzeou a vracaním.
Predávkovanie Mimparou môže viesť k hypokalciémii. V prípade predávkovania pacienti majú byť monitorovaní na prejavy a príznaky hypokalciémie a liečba má byť symptomatická a podporná. Keďže sa cinakalcet vysoko viaže na proteíny, hemodialýza nie je účinná pri liečbe predávkovania.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Liečivá ovplyvňujúce homeostázu vápnika, iné antiparatyreoidálne liečivá. ATC kód: H05BX01.
Mechanizmus účinkuReceptor citlivý na vápnik na povrchu hlavnej bunky prištítnej žľazy je hlavným regulátorom sekrécie
PTH. Cinakalcet je kalcimimetická látka, ktorá priamo znižuje hladiny PTH zvýšením citlivosti receptoru citlivého na vápnik na extracelulárny vápnik. Zníženie hladiny PTH je spojené so súčasným
znížením sérových hladín vápnika.
Zníženie hladín PTH koreluje s koncentráciou cinakalcetu.
Po dosiahnutí rovnovážneho stavu zostávajú sérové koncentrácie vápnika počas dávkovacieho intervalu konštantné.
Sekundárna hyperparatyreóza
D
ospelí
Troch 6-mesačných, dvojito zaslepených, placebom kontrolovaných klinických štúdií sa zúčastnili
pacienti s ESRD s nekontrolovanou sekundárnou HPT na dialýze (n = 1 136). Demografické
a východiskové charakteristiky zodpovedali populácii dialyzovaných pacientov so sekundárnou HPT. Priemerné východiskové koncentrácie iPTH v 3 štúdiách boli 733 pg/ml (77,8 pmol/l) pre skupinu liečenú cinakalcetom a 683 pg/ml (72,4 pmol/l) pre placebo. 66 % pacientov dostávalo steroly vitamínu D na začiatku štúdie a viac ako 90 % užívalo viazače fosfátu. Významné zníženie hladiny iPTH, súčinu sérových koncentrácií vápnika a fosforu (Ca x P) a hladín vápnika a fosforu sa pozorovalo v skupine pacientov liečených cinakalcetom v porovnaní s placebo skupinou pri dodržaní
štandardnej starostlivosti, výsledky boli zhodné vo všetkých troch štúdiách. V jednotlivých štúdiách sa primárny cieľový ukazovateľ (podiel pacientov s iPTH ≤ 250 pg/ml (≤ 26,5 pmol/l) dosiahol u 41 %,
46 % a 35 % pacientov užívajúcich cinakalcet v porovnaní so 4 %, 7 % a 6 % pacientov, ktorí dostávali placebo. U približne 60 % pacientov liečených cinakalcetom sa dosiahla ≥ 30 % redukcia
hladín iPTH a tento účinok bol zhodný v celom spektre východiskových hladín iPTH. Priemerný pokles sérového Ca x P, vápnika a fosforu bol 14 %, 7 % a 8 %.
Redukcia iPTH a Ca x P sa udržiavala počas 12 mesiacov liečby. Cinakalcet znižoval iPTH, Ca x P, hladiny vápnika a fosforu nezávisle od východiskových hodnôt iPTH alebo Ca x P, dialyzačnej modality (PD oproti HD), dĺžky dialýzy a bez ohľadu na to, či sa podávali, alebo nepodávali steroly vitamínu D.
Redukcia PTH sa spájala s nevýznamným znížením markerov kostného metabolizmu (kostná špecifická alkalická fosfatáza, N-telopeptid, kostný obrat a fibróza kostí). Podľa dodatočného vyhodnotenia sumárnych údajov z klinických štúdií trvajúcich 6 a 12 mesiacov sa podľa Kaplanovho- Meierovho stanovenia vyskytli fraktúry kostí a paratyreoidektómia v menšom počte v skupine pacientov s cinakalcetom v porovnaní s kontrolnou skupinou.
Štúdie u nedialyzovaných pacientov s CKD a sekundárnou HPT naznačujú, že cinakalcet znížil hladinu PTH v ich prípade do podobnej miery ako u dialyzovaných pacientov s ESRD a so sekundárnou HPT. Avšak účinnosť, bezpečnosť, optimálne dávkovanie a liečebné ciele u pacientov s obličkovým zlyhávaním pred dialýzou neboli stanovené. Tieto štúdie ukazujú, že pacienti s CKD
liečení cinakalcetom, ktorí nie sú dialyzovaní, sú vystavení zvýšenému riziku vzniku hypokalciémie
v porovnaní s dialyzovanými pacientmi s ESRD liečenými cinakalcetom, čo môže byť spôsobené
nižšími východiskovými hladinami vápnika a/alebo prítomnosťou reziduálnej renálnej funkcie.
EVOLVE (EValuation Of Cinacalcet Therapy to Lower CardioVascular Events) bola randomizovaná, dvojito zaslepená klinická štúdia hodnotiaca cinakalcet oproti placebu na zníženie rizika celkovej mortality a kardiovaskulárnych udalostí u 3 883 pacientov so sekundárnou HPT a CKD na dialýze. Štúdia nesplnila primárny cieľ: zníženie rizika celkovej mortality alebo kardiovaskulárnych udalostí vrátane infarktu myokardu, hospitalizácie pre nestabilnú angínu pektoris, srdcového zlyhania alebo periférnej vaskulárnej udalosti (HR 0,93; 95 % IS: 0,85, 1,02; p = 0,112). V sekundárnej analýze po úprave vzhľadom na východiskové charakteristiky bol HR pre primárny kombinovaný koncový ukazovateľ 0,88; 95 % IS: 0,79; 0,97.
Pediatrická populácia
Účinnosť a bezpečnosť cinakalcetu na liečbu sekundárnej HPT u pediatrických pacientov s ESRD
dostávajúcich dialýzu sa hodnotila v dvoch randomizovaných kontrolovaných štúdiách a v štúdii
s jednou skupinou.
Štúdia 1 bola dvojito zaslepená, placebom kontrolovaná štúdia, v ktorej 43 pacientov vo veku 6 až
< 18 rokov bolo randomizovaných na užívanie buď cinakalcetu (n = 22) alebo placeba (n = 21). Štúdia
sa skladala z 24-týždňového obdobia titrácie dávky, za ktorým nasledovala 6-týždňová fáza hodnotenia účinnosti (efficacy assessment phase, EAP) a 30-týždňové otvorené predĺženie štúdie.
Priemerný vek na začiatku bol 13 (rozpätie 6 až 18) rokov. Väčšina pacientov (91 %) užívala na
začiatku steroly vitamínu D. Priemerné (SD) koncentrácie iPTH na začiatku boli 757,1 (440,1) pg/ml
v skupine s cinakalcetom a 795,8 (537,9) pg/ml v skupine s placebom. Priemerné (SD) korigované koncentrácie celkového sérového vápnika na začiatku boli 9,9 (0,5) mg/dl v skupine s cinakalcetom a 9,9 (0,6) mg/dl v skupine s placebom. Priemerná maximálna denná dávka cinakalcetu bola
1,0 mg/kg/deň.
Percento pacientov, ktorí dosiahli primárny koncový ukazovateľ (≥ 30 % zníženie priemerných
plazmatických koncentrácií iPTH počas EAP oproti východiskovej hodnote; v 25. až 30. týždni), bolo
55 % v skupine s cinakalcetom a 19,0 % v skupine s placebom (p = 0,02). Priemerné sérové hladiny
vápnika počas EAP boli v normálnom rozmedzí v liečebnej skupine s cinakalcetom. Táto štúdia bola
predčasne ukončená v dôsledku úmrtia súvisiaceho so závažnou hypokalciémiou v skupine s cinakalcetom (pozri časť 4.8).
Štúdia 2 bola otvorená štúdia, v ktorej bolo 55 pacientov vo veku 6 až < 18 rokov (priemer 13 rokov) randomizovaných na užívanie buď cinakalcetu pridaného k štandardnej liečbe (ŠL, n = 27), alebo na ŠL samotnú (n = 28). Väčšina pacientov (75 %) užívala na začiatku steroly vitamínu D. Priemerné (SD) koncentrácie iPTH na začiatku boli 946 (635) pg/ml v skupine s cinakalcetom + ŠL a 1 228
(732) pg/ml v skupine so ŠL. Priemerné (SD) korigované koncentrácie celkového sérového vápnika na
začiatku boli 9,8 (0,6) mg/dl v skupine s cinakalcetom + ŠL a 9,8 (0,6) mg/dl v skupine so ŠL. 25
pacientov dostalo najmenej jednu dávku cinakalcetu a priemerná maximálna denná dávka cinakalcetu bola 0,55 mg/kg/deň. Štúdia nesplnila svoj primárny koncový ukazovateľ (≥ 30 % zníženie priemerných plazmatických koncentrácií iPTH počas EAP oproti východiskovej hodnote; v 17. až 20. týždni). Zníženie priemerných plazmatických koncentrácií iPTH ≥ 30 % počas EAP oproti východiskovej hodnote dosiahlo 22 % pacientov v skupine s cinakalcetom + ŠL a 32 % pacientov
v skupine so ŠL.
Štúdia 3 bola 26-týždňová otvorená štúdia s jednou skupinou zameraná na bezpečnosť, s pacientmi vo veku 8 mesiacov až < 6 rokov (priemerný vek 3 roky). Pacienti užívajúci súbežne lieky, o ktorých je známe, že predlžujú korigovaný QT interval, boli zo štúdie vylúčení. Priemerná suchá telesná hmotnosť na začiatku bola 12 kg. Úvodná dávka cinakalcetu bola 0,20 mg/kg. Väčšina pacientov
(89 %) užívala na začiatku steroly vitamínu D.
Sedemnásť pacientov užilo najmenej jednu dávku cinakalcetu a 11 dokončilo najmenej 12 týždňov liečby. Ani jeden pacient vo veku 2 – 5 rokov nemal korigovaný sérový vápnik < 8,4 mg/dl
(2,1 mmol/l). Koncentrácie iPTH oproti východiskovej hodnote boli znížené o ≥ 30 % u 71 % (12 zo
17) pacientov v štúdii.
Paratyreoidný karcinóm a primárna hyperparatyreóza
V jednej štúdii 46 dospelých pacientov (29 s paratyreoidným karcinómom a 17 s primárnou HPT
a závažnou hyperkalciémiou, u ktorých paratyreoidektómia zlyhala alebo bola kontraindikovaná)
dostávalo cinakalcet počas maximálne 3 rokov (priemerne 328 dní u pacientov s paratyreoidným karcinómom a priemerne 347 dní u pacientov s primárnou HPT). Cinakalcet sa podával v dávkach od
30 mg dvakrát denne po 90 mg štyrikrát denne. Primárnym cieľovým ukazovateľom štúdie bol pokles
hladiny sérového vápnika o ³ 1 mg/dl (³ 0,25 mmol/l ). U pacientov s paratyreoidným karcinómom klesla priemerná hladina sérového vápnika zo 14,1 mg/dl na 12,4 mg/dl (z 3,5 mmol/l na 3,1 mmol/l), zatiaľ čo u pacientov s primárnou HPT sérové hladiny vápnika klesli z 12,7 mg/dl na 10,4 mg/dl
(z 3,2 mmol/l na 2,6 mmol/l). U osemnástich (18) z 29 pacientov (62 %) s paratyreoidným karcinómom a u 15 zo 17 jedincov (88 %) s primárnou HPT sa dosiahlo zníženie sérovej hladiny
vápnika o ≥ 1 mg/dl (≥ 0,25 mmol/l).
Do 28-týždňovej, placebom kontrolovanej štúdie bolo zaradených 67 dospelých pacientov s primárnou HPT, ktorí splnili kritériá pre paratyreoidektómiu na základe korigovanej hladiny celkového sérového vápnika > 11,3 mg/dl (2,82 mmol/l), ale ≤ 12,5 mg/dl (3,12 mmol/l), ktorí však neboli schopní podstúpiť paratyreoidektómiu. Cinakalcet sa začal podávať v dávke 30 mg dvakrát denne a bol titrovaný na dávku, ktorá udržovala korigovanú koncentráciu celkového sérového vápnika
v normálnom rozmedzí. Významne vyššie percento pacientov liečených cinakalcetom dosiahlo priemernú korigovanú koncentráciu celkového sérového vápnika ≤ 10,3 mg/dl (2,57 mmol/l) a pokles
o ≥ 1 mg/dl (0,25 mmol/l) oproti východiskovej hodnote priemernej korigovanej koncentrácie celkového sérového vápnika v porovnaní s pacientmi, ktorí dostávali placebo (75,8 % oproti 0 % a 84,8 % oproti 5,9 %, v uvedenom poradí).
5.2 Farmakokinetické vlastnosti
Absorpcia
Po perorálnom podaní Mimpary sa maximálna plazmatická koncentrácia cinakalcetu dosiahne
približne za 2 až 6 hodín. Na základe porovnaní medzi štúdiami je absolútna biodostupnosť cinakalcetu podávaného nalačno odhadovaná asi na 20-25 %. Podávanie Mimpary s potravou zvyšuje
biodostupnosť cinakalcetu približne o 50-80 %. Zvýšenie plazmatickej koncentrácie cinakalcetu je
podobné, nezávisle od obsahu tukov v potrave.
Pri dávkach nad 200 mg bola absorpcia saturovaná, pravdepodobne v dôsledku slabej rozpustnosti. Distribúcia
Distribučný objem je vysoký (približne 1 000 litrov), čo nasvedčuje extenzívnej distribúcii. Cinakalcet
sa približne z 97 % viaže na plazmatické proteíny a distribuuje sa len minimálne do červených krviniek.
Po absorpcii klesá koncentrácia cinakalcetu bifázickým spôsobom s iniciálnym polčasom približne
6 hodín a terminálnym polčasom približne 30 až 40 hodín. Rovnovážne hladiny cinakalcetu sa
dosahujú do 7 dní s minimálnou kumuláciou. Farmakokinetika cinakalcetu sa nemení časom.
Biotransformácia
Cinakalcet sa metabolizuje prostredníctvom mnohých enzýmov, prevažne CYP3A4 a CYP1A2 (podiel
CYP1A2 sa necharakterizoval klinicky). Hlavné cirkulujúce metabolity sú neaktívne.
Na základe in vitro údajov je cinakalcet silný inhibítor CYP2D6, ale pri klinicky dosiahnutých koncentráciách nie je inhibítorom iných CYP enzýmov vrátane CYP1A2, CYP2C8, CYP2C9, CYP2C19 a CYP3A4 ani induktorom CYP1A2, CYP2C19 a CYP3A4.
Eliminácia
Po podaní 75 mg rádioaktívne značenej dávky zdravým dobrovoľníkom sa cinakalcet rýchlo
a extenzívne metabolizoval oxidáciou a následne konjugáciou. Renálna exkrécia metabolitov bola
hlavnou cestou eliminácie rádioaktivity. Približne 80 % dávky sa vylúčilo močom a 15 % stolicou.
Linearita/nelinearita
Hodnoty AUC a Cmax cinakalcetu sa zvyšujú približne lineárne v intervale dávok 30 až 180 mg raz denne.
Farmakokinetický/farmakodynamický vzťah
Ihneď po podaní dávky sa PTH začína znižovať až na minimálnu hodnotu približne 2 až 6 hodín po
podaní dávky, čo sa zhoduje s Cmax cinakalcetu. Následne, keďže hladiny cinakalcetu začínajú klesať, hladiny PTH sa zvyšujú až do 12 hodín po dávke a potom supresia PTH pretrváva približne na
konštantnej úrovni až do konca dávkovacieho intervalu jedenkrát denne. V klinických skúšaniach
s Mimparou boli hladiny PTH merané na konci dávkovacieho intervalu.
Starší pacienti: Nie sú známe žiadne klinicky významné rozdiely vo farmakokinetike cinakalcetu
v dôsledku veku.
Renálna insuficiencia: Farmakokinetický profil cinakalcetu u pacientov s ľahkou, stredne ťažkou a ťažkou renálnou insuficienciou a u pacientov na hemodialýze alebo peritoneálnej dialýze je porovnateľný s profilom u zdravých dobrovoľníkov.
Hepatálna insuficiencia: Ľahká porucha funkcie pečene podstatne neovplyvňuje farmakokinetiku cinakalcetu. V porovnaní s osobami s normálnou funkciou pečene boli priemerné hodnoty AUC cinakalcetu približne 2-násobne vyššie u osôb so stredne ťažkou poruchou a približne 4-násobne vyššie u osôb so závažnou poruchou. Priemerný polčas cinakalcetu bol predĺžený o 33 % u pacientov so stredne ťažkou a o 70 % u pacientov s ťažkou poruchou funkcie pečene. Väzba cinakalcetu na proteíny nie je ovplyvnená poruchou funkcie pečene. Keďže dávky sa titrujú pre každého pacienta na základe parametrov bezpečnosti a účinnosti, nie je potrebná ďalšia úprava dávok u osôb s poruchou funkcie pečene (pozri časti 4.2 a 4.4).
Pohlavie: Klírens cinakalcetu môže byť u žien nižší ako u mužov. Keďže dávky sa titrujú zvlášť pre každého pacienta, nie je nutné ďalej dávku upravovať podľa pohlavia pacienta.
Pediatrická populácia: Farmakokinetika cinakalcetu sa skúmala u pediatrických pacientov s ESRD na dialýze vo veku 3 až 17 rokov. Po jednorazovej a viacnásobných perorálnych dávkach cinakalcetu raz denne boli plazmatické koncentrácie cinakalcetu (hodnoty Cmax a AUC po štandardizácii podľa dávky
a telesnej hmotnosti) podobné koncentráciám pozorovaným u dospelých pacientov.
Na vyhodnotenie vplyvu demografických charakteristík sa vykonala populačná farmakokinetická analýza. Táto analýza nepreukázala žiadny významný vplyv veku, pohlavia, rasy, plochy telesného povrchu a telesnej hmotnosti na farmakokinetiku cinakalcetu.
Fajčenie: Klírens cinakalcetu je u fajčiarov vyšší než u nefajčiarov pravdepodobne z dôvodu indukcie metabolizmu sprostredkovaného enzýmom CYP1A2. Ak pacient začne alebo skončí s fajčením, plazmatické hladiny cinakalcetu sa môžu zmeniť a môže byť nevyhnutné upraviť dávku lieku.
5.3 Predklinické údaje o bezpečnosti
Cinakalcet nebol teratogénny pri králikoch, ak sa podával v dávkach vo výške 0,4-násobku (na základe hodnôt AUC) maximálnej dávky u ľudí pri sekundárnej HPT (180 mg denne). Neteratogénna dávka
pri potkanoch bola vo výške 4,4-násobku (na základe hodnoty AUC) maximálnej dávky pri
sekundárnej HPT. Nezistili sa žiadne účinky na fertilitu u samcov ani samíc po expozícii maximálne
4-násobku ľudskej dávky 180 mg/deň (bezpečná hranica u malej skupiny pacientov, ktorým sa podávala maximálna klinická dávka 360 mg denne, predstavuje približne polovicu dávky uvedenej vyššie).
Pri gravidných potkanoch sa pri najvyššej dávke zaznamenalo mierne zníženie telesnej hmotnosti
a príjmu potravy. Zníženie hmotnosti plodu sa pozorovalo na potkanoch pri dávkach, ktoré matkám
spôsobovali závažnú hypokalciémiu. Cinakalcet prestupoval placentárnou bariérou pri králikoch.
Cinakalcet nevykazoval žiaden genotoxický ani karcinogénny potenciál. Z toxikologických štúdií sú hranice bezpečnosti malé v dôsledku dávku limitujúcej hypokalciémie pozorovanej u zvieracích modelov. V štúdiách zameraných na vplyv opakovaných dávok na toxicitu a karcinogenicitu na hlodavcoch bol pozorovaný výskyt katarákt a šošovkových opacít. Tento jav však nebol zaznamenaný v štúdiách so psami ani s opicami a ani v klinických štúdiách, v ktorých sa sledoval vznik katarákt. Známy je výskyt katarákt pri hlodavcoch v dôsledku hypokalciémie.
V štúdiách in vitro boli zistené hodnoty IC50 pre nosič sérotonínu 7-krát vyššie a pre KATP kanály
12-krát vyššie ako hodnota EC50 pre receptor citlivý na vápnik získaná za rovnakých
experimentálnych podmienok. Klinický význam nie je známy, avšak možnosť účinku cinakalcetu na tieto sekundárne ciele nemožno celkom vylúčiť.
V toxikologických štúdiách s mladými psami bol pozorovaný tremor následne po znížení sérového
vápnika, eméza, znížená telesná hmotnosť a zvýšenie telesnej hmotnosti, znížený počet erytrocytov,
mierny pokles v parametroch kostnej denzitometrie, reverzibilné rozšírenie rastových platničiek dlhých kostí a histologické lymfoidné zmeny (obmedzené na hrudnú dutinu a pripisované chronickému vracaniu). Všetky tieto účinky sa pozorovali na základe hodnôt AUC pri systémovej expozícii, rovnajúcej sa približne expozícii u pacientov na maximálnej dávke na liečbu sekundárnej HPT.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Granulát
predželatínovaný kukuričný škrob
mikrokryštalická celulóza
povidón krospovidón
oxid kremičitý na dentálne použitie
Kapsula
potlačová farba: čierny oxid železitý, šelak, propylénglykol
Mimpara 1 mg granulát v kapsulách na otvorenie
želatína
žltý oxid železitý (E172) indigokarmín (E132) oxid titaničitý (E171)
Mimpara 2,5 mg granulát v kapsulách na otvorenie
želatína
žltý oxid železitý (E172)
oxid titaničitý (E171)
Mimpara 5 mg granulát v kapsulách na otvorenie
želatína
indigokarmín (E132)
oxid titaničitý (E171)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
4 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Granulát sa dodáva v kapsulách na otvorenie. Pozri časť 6.1
Kapsuly sú dodané vo fľaši z polyetylénu s vysokou hustotou (HDPE) tesnením z ochrannej fólie
a s detským bezpečnostným polypropylénovým uzáverom, vložené do škatule. Každá fľaša obsahuje
30 kapsúl.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAmgen Europe B.V. Minervum 7061
4817 ZK Breda
Holandsko
8. REGISTRAČNÉ ČÍSLAEU/1/04/292/013 – 1 mg kapsuly na otvorenie EU/1/04/292/014 – 2,5 mg kapsuly na otvorenie EU/1/04/292/015 – 5 mg kapsuly na otvorenie
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 22. októbra 2004
Dátum posledného predĺženia registrácie: 23. septembra 2009
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.