
nfúziou, ktorá trvá jednu hodinu. Liek MEPACT sa nesmie podať ako bolusová injekcia.
Ďalšie pokyny o rekonštituovaní, prefiltrovaní pomocou priloženého filtra a zriedení pred podávaním sa nachádzajú v časti 6.6.
4.3 Kontraindikácie
Precitlivenosť na účinnú látku alebo na ktorúkoľvek z pomocných látok.
Súbežné používanie s cyklosporínom alebo inými inhibítormi kalcineurínu (pozri časť 4.5). Súbežné používanie s vysokými dávkami nesteroidných protizápalových liekov (NSAID,
inhibítory cyklooxygenázy) (pozri časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Respiračná tieseň
U pacientov s anamnézou astmy alebo inej chronickej obštrukčnej choroby pľúc by sa malo zvážiť podanie bronchodilatansov na profylaktickom základe. U dvoch pacientov s už predtým existujúcou astmou sa v súvislosti s liečbou vyvinula mierna až stredne závažná respiračná tieseň. Ak sa objaví závažná respiračná reakcia, podávanie lieku MEPACT by sa malo prerušiť a malo by sa začať s vhodnou liečbou.
Neutropénia
Podávanie lieku MEPACT sa často spájalo s prechodnou neutropéniou, obvykle pri používaní spolu s chemoterapiou. Epizódy neutropenickej horúčky by sa mali sledovať a vhodne liečiť. Liek MEPACT možno podávať počas obdobia neutropénie, ale následnú horúčku pripisovanú liečbe treba prísne sledovať. Horúčka alebo zimnica pretrvávajúca dlhšie ako 8 hodín po podaní lieku MEPACT sa má zhodnotiť kvôli možnej sepse.
Zápalová odpoveď
Spájanie lieku MEPACT so príznakmi výslovnej zápalovej odpovede vrátane perikarditídy a pleuritídy, nebolo obvyklé. Liek MEPACT by sa mal používať opatrne u pacientov s anamnézou autoimunitných, zápalových ochorení alebo iných kolagénových ochorení. Počas podávania lieku MEPACT by sa mali u pacientov sledovať nezvyčajné príznaky alebo prejavy, ako je artritída alebo synovitída, náznaky nekontrolovaných zápalových reakcií.
Kardiovaskulárne poruchy
Pacientov s anamnézou venóznej trombózy, vaskulitídy alebo nestabilných kardiovaskulárnych porúch treba počas podávania lieku MEPACT prísne sledovať. Ak prejavy pretrvávajú a zhoršujú sa, podávanie sa má oddialiť alebo prerušiť. Krvácanie sa pozorovalo pri veľmi vysokých dávkach
v prípade zvierat. Tieto sa neočakávajú pri odporúčanej dávke, no odporúča sa sledovať parametre zrážania krvi po prvej dávke a opätovne po niekoľkých dávkach.
Alergické reakcie
S liečbou liekom MEPACT sa spájajú občasné alergické reakcie zahŕňajúce vyrážky, dýchavicu a hypertenziu 4. stupňa. Môže byť ťažké odlíšiť alergické reakcie od prehnaných zápalových odpovedí, pacienti by však mali byť sledovaní, pokiaľ ide o príznaky alergických reakcií.
Gastrointestinálna toxicita
Nauzea, vracanie a nechutenstvo sú veľmi časté nežiaduce reakcie na liek MEPACT. Gastrointestinálna toxicita sa môže zhoršovať, ak sa liek MEPACT používal v kombinácii
s vysokými dávkami chemoterapie využívajúcej viacero liekov a bola spojená so zvýšeným podávaním parenterálnej výživy.
4.5 Liekové a iné interakcie
Uskutočnili sa obmedzené štúdie týkajúce sa interakcie lieku MEPACT s chemoterapiou. Hoci tieto štúdie nepriniesli konečné dôkazy, neexistuje dôkaz o interakcii lieku MEPACT
s protinádorovými účinkami chemoterapie a naopak.
Odporúča sa oddeliť časy podávania lieku MEPACT a doxorubicínu alebo iných lipofilných liekov, ak sa používajú v rovnakom chemoterapeutickom režime.
Používanie lieku MEPACT súčasne s cyklosporínom alebo inými inhibítormi kalcineurínu je kontraindikované z dôvodu ich predpokladaného účinku na makrofágy v slezine a fagocytárnu aktivitu jednojadrových buniek (pozri časť 4.3).
Taktiež sa in vitro dokázalo, že vysoké dávky NSAID (inhibítorov cyklooxygenázy) môžu blokovať aktivujúci účinok lipozomálneho mifamurtidu na makrofágy. Z tohto dôvodu je používanie vysokých dávok NSAID kontraindikované (pozri časť 4.3).
Pretože mifamurtid účinkuje prostredníctvom stimulácie imunitného systému, počas liečby liekom
MEPACT by sa malo vyhnúť chronickému alebo pravidelnému užívaniu kortikosteroidov.
Interakčné štúdie in vitro ukázali, že lipozomálny a nelipozomálny mifamurtid neinhibuje metabolickú aktivitu cytochrómu P450 v nahromadených pečeňových mikrozómoch u ľudí. Lipozomálny a nelipozomálny mifamurtid neindukuje metabolickú aktivitu alebo transkripciu cytochrómu P450 v primárnych kultúrach čerstvo izolovaných ľudských hepatocytov. Preto sa neočakáva interakcia mifamurtidu s metabolizmom látok, ktoré sú substrátmi hepatického cytochrómu P450.
Vo veľkej kontrolovanej randomizovanej štúdii sa pri užívaní lieku MEPACT v odporúčanej dávke a podľa odporúčaného časového harmonogramu s inými liekmi so známou renálnou (cisplatina, ifosfamid) alebo hepatickou (vysoké dávky metotrexátu, ifosfamid) toxicitou nezhoršila takáto toxicita a nebolo potrebné upraviť dávku mifamurtidu.
4.6 Gravidita a laktácia
Gravidita
Neexistujú žiadne údaje o používaní mifamurtidu u tehotných pacientok. Štúdie na zvieratách sú nedostatočné, pokiaľ ide o reprodukčnú toxicitu (pozri časť 5.3). Liek MEPACT by sa nemal používať počas gravidity a nemali by ho užívať ženy, ktoré nepoužívajú účinnú antikoncepciu.
Laktácia
Nie je známe, či sa mifamurtid vylučuje do ľudského mlieka. Vylučovanie mifamurtidu do mlieka sa u zvierat neskúmalo. Rozhodnutie o pokračovaní/prerušení dojčenia alebo o
pokračovaní/prerušení liečby by sa malo prijať so zohľadnením prínosu dojčenia pre dieťa a prínosu liečby liekom MEPACT pre ženu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Niektoré veľmi časté alebo časté nežiaduce účinky liečby liekom MEPACT (ako sú závraty, vertigo, únava a zahmlené videnie) môžu mať vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Každý z 248 pacientov liečených liekom MEPACT počas ranej fázy štúdií s jedným liečebným ramenom u pacientov s najviac pokročilými malignitami pociťoval najmenej jeden nežiaduci účinok. O mnohých z najčastejšie pozorovaných nežiaducich účinkoch, ktoré sa uvádzajú v nasledujúcej súhrnnej tabuľke, sa predpokladá ich súvislosť s mechanizmom účinku mifamurtidu. Väčšina týchto udalostí bola hlásená ako udalosti mierne alebo stredne závažné. Tento profil je jednotný, či už pre zhrnutie všetkých raných štúdií (n=248) alebo iba štúdií týkajúcich sa osteosarkómu (n=51). Je pravdepodobné, že nežiaduce účinky sa vyskytli aj vo veľkej randomizovanej štúdii, ale neboli zaznamenané, pretože v tejto štúdii sa zhromažďovali len závažné a život ohrozujúce nežiaduce účinky.
Nežiaduce reakcie sú usporiadané podľa systémovej triedy orgánov a frekvencie. Skupiny frekvencií sú definované podľa nasledujúcej konvencie: Veľmi časté (≥1/10), časté (≥1/100 až
<1/10). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí
klesajúcej závažnosti.
Tabuľka 1. Nežiaduce reakcie súvisiace s liekom MEPACT u ≥ 1/100 pacientov
Infekcie a parazitárne ochorenia
Časté: Sepsa, celulitída, nazofaryngitída, katétrová infekcia, infekcia horných dýchacích ciest, infekcia močových ciest, faryngitída, infekcia vírusom Herpes simplex
Nezhubné novotvary, zhubné a nešpecifikované (vrátane cýst a polypov)
Časté: Nádorová bolesť
Poruchy krvného a lymfatického systému
Veľmi časté: Anémia
Časté: Leukopénia, trombocytopénia, granulocytopénia
Poruchy metabolizmu a výživy
Veľmi časté: Nechutenstvo
Časté: Dehydratácia, hypokalémia, znížená chuť do jedla
Psychiatrické poruchy
Časté: Stav zmätenosti, depresia, nespavosť, úzkosť
Poruchy nervového systému
Veľmi časté: Bolesti hlavy, závraty
Časté: Parestézia, hypestézia, tremor, somnolencia, letargia
Očné poruchy
Časté: Zahmlené videnie
Poruchy sluchu a labyrintu
Časté: Vertigo, hučanie, strata sluchu
Kardiálne poruchy
Veľmi časté: Tachykardia
Časté: Cyanóza, palpitácie
Cievne poruchy
Veľmi časté: Hypertenzia, hypotenzia
Časté: Flebitída, návaly, bledosť
Respiračné, torakálne a mediastinálne poruchy
Veľmi časté: Dyspnoe, tachypnoe, kašeľ
Časté: Pleurálna efúzia, zhoršené dyspnoe, produktívny kašeľ, hemoptýza, sipot, epistáza, námahové dyspnoe, kongescia sínusov, nazálna kongescia, faryngolaryngálna bolesť
Gastrointestinálne poruchy
Veľmi časté: Vracanie, hnačka, zápcha, bolesti brucha, nauzea
Časté: Bolesť v hornej časti brucha, dyspepsia, abdominálna distenzia, bolesť
v dolnej časti brucha
Hepatobiliárne poruchy
Časté: Bolesť v oblasti pečene
Poruchy kože a podkožného tkaniva
Veľmi časté: Hyperhidróza
Časté: Kožné vyrážky, pruritus, erytém, alopécia, suchá koža
Muskuloskeletárne poruchy a poruchy spojivového tkaniva
Veľmi časté: Myalgia, artralgia, bolesti chrbta, bolesti končatín
Časté: Svalové kŕče, bolesť krku, bolesť v oblasti slabín, bolesť kostí, bolesť
ramena, bolesť hrudnej steny, stuhnutosť svalov a kostí
Poruchy obličiek a močových ciest
Časté: Hematúria, dyzúria, polakizúria
Poruchy reprodukčného systému a prsníkov
Časté: Dysmenorea
Všeobecné poruchy a reakcie na mieste podania
Veľmi časté: Horúčka, zimnica, únava, hypotermia, bolesť, nevoľnosť, asténia, bolesť
na hrudníku
Časté: Periférny edém, edém, zápal sliznice, erytém na mieste podania infúzie, reakcia na mieste podania infúzie, bolesť v oblasti katétra, diskomfort v hrudníku, pocit chladu
Vyšetrenia:
Časté: Zníženie hmotnosti
C
hirurgické a lekárske výkony
Časté: Bolesť po zákroku
Poruchy krvného a lymfatického systému
Anémia bola najčastejšie pozorovaná pri užívaní lieku MEPACT súčasne s chemoterapeutikami. V randomizovanej kontrolovanej skúške bola incidencia myeloidných nádorov (akútna myeloidná leukémia/myelodysplastický syndróm) rovnaká u pacientov užívajúcich MEPACT spolu
s chemoterapiou, ako u pacientov podstupujúcich len chemoterapiu (približne 2,5 %).
Poruchy metabolizmu a výživy
Veľmi často bola pozorovaná anorexia (21 %) počas skúšok lieku MEPACT v prípade pacientov v pokročilom štádiu rakoviny.
Poruchy nervového systému
V súlade s inými všeobecnými prejavmi, najčastejšími poruchami nervového systému boli bolesti hlavy (50 %) a závraty (17 %).
Poruchy sluchu a labyrintu
Hoci stratu sluchu možno pripísať ototoxickému účinku chemoterapie, napr. cisplatiny, nie je jasné, či liek MEPACT v spojení s chemoterapiou využívajúcou viaceré lieky môže zvýšiť možnosť straty sluchu.
Vyššie percento objektívnej a subjektívnej straty sluchu sa pozorovalo celkovo u pacientov, ktorí dostávali liek MEPACT a podstupovali chemoterapiu (12 %, resp. 7 %), v štúdii fázy III (pozri časť 5.1, kde sa nachádza opis skúšky) v porovnaní s pacientmi, ktorí podstupovali iba
chemoterapiu (7 % a 1 %). Všetci pacienti dostali celkovú dávku cisplatiny 480 mg/m2, ako súčasť ich indukčného (neoadjuvantného) a/alebo udržiavacieho (adjuvantného) režimu chemoterapie.
Kardiálne a vaskulárne poruchy
Mierna až stredne závažná tachykadia (50 %), hypertenzia (26 %) a hypotenzia (29 %) boli často pozorované v rámci nekontrolovaných skúšok lieku MEPACT. V raných štúdiách bol hlásený jeden závažný prípad subakútnej trombózy, ale žiadne závažné kardiálne príhody neboli spojené s liekom MEPACT vo veľkej randomizovanej kontrolovanej štúdii.
Respiračné poruchy
Respiračné poruchy zahŕňajúce dyspnoe (21 %), kašeľ (18 %) a tachypnoe (13 %) boli pozorované veľmi často a u dvoch pacientov s už existujúcou astmou sa rozvinula mierna až stredne závažná respiračná tieseň v súvislosti s liečbou liekom MEPACT v štúdii fázy II.
Gastrointestinálne poruchy
Gastrointestinálne poruchy boli často spojené s podávaním lieku MEPACT a zahŕňali nauzeu (57
%) a vracanie (44 %) u približne polovice pacientov, zápchu (17 %), hnačku (13 %) a bolesti brucha.
Poruchy kože a podkožného tkaniva
V nekontrolovaných štúdiách sa hyperhidróza (11 %) veľmi často vyskytovala u pacientov, ktorí dostávali liek MEPACT.
Muskuloskeletálne poruchy a poruchy spojivového tkaniva
Bolesť nízkej intenzity bola častá u pacientov užívajúcich liek MEPACT a zahŕňala myalgiu (31
%), bolesť chrbta (15 %), bolesť končatín (12 %) a artralgiu (10 %).
Všeobecné poruchy a reakcie na mieste podania
Väčšina pacientov pociťuje zimnicu (89 %), horúčku (85 %) a únavu (53 %). Tieto sú zvyčajne mierne až stredne závažné, v podstate prechodné a obvykle odpovedajú na paliatívnu liečbu (napr. paracetamol na horúčku). Ostatné celkové prejavy, ktoré boli zvyčajne mierne až stredne závažné
a vyskytovali sa veľmi často, zahŕňali hypotermiu (23 %), nevoľnosť (13 %), bolesť (15 %), asténiu (13 %) a bolesť na hrudníku (11 %). Edém, diskomfort v hrudníku, reakcie na mieste podania infúzie alebo v oblasti katétra a pocit chladu boli pozorované u týchto pacientov menej často, väčšinou pri nádorovom ochorení v pokročilom štádiu.
Vyšetrenia:
U jedného pacienta s osteosarkómom bola v súvislosti s užívaním lieku MEPACT zvýšená hladina močoviny a kreatinínu v krvi.
4.9 Predávkovanie
Nebol hlásený žiaden prípad predávkovania. Maximálna tolerovaná dávka v štúdiách fázy I bola 4
- 6 mg/m2 s vysokou premenlivosťou nežiaducich reakcií. Príznaky a prejavy, ktoré sa spájali
s vyššími dávkami a/alebo obmedzovali dávku, neohrozovali život a zahŕňali horúčku, zimnicu, únavu, nauzeu, vracanie, bolesť hlavy a hypo- alebo hypertenziu.
V prípade predávkovania sa odporúča nasadenie vhodnej podpornej liečby. Podporné opatrenia by mali vychádzať z inštitucionálnych usmernení a pozorovaných klinických prejavov. Príklady zahŕňajú paracetamol na horúčku, zimnicu a bolesť hlavy a antiemetiká (iné ako steroidy) na nauzeu a vracanie.
5
. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Iné cytokíny a imunomodulátory, ATC kód: L03AX15
Mechanizmus účinku
Mifamurtid (muramyltripeptid-fosfatidyletanolamín, MTP-PE) je plne syntetický derivát muramyldipeptidu (MDP), najmenšej prirodzene sa vyskytujúcej imúnnej stimulačnej zložky bunkových stien baktérie Mycobacterium sp. Má podobné imunostimulačné účinky ako prírodný MDP s dodatočnou výhodou dlhšieho plazmatického polčasu. Liek MEPACT je lipozomálna zmes navrhnutá špeciálne so zameraním sa na makrofágy in vivo po podaní intravenóznou infúziou.
MTP-PE je špecifickým ligandom NOD2, receptora, ktorý sa primárne nachádza na monocytoch, dendritických bunkách a na makrofágoch. MTP-PE je silný aktivátor monocytov a makrofágov. Aktivácia ľudských makrofágov liekom MEPACT sa spája s produkciou cytokínov vrátane tumor nekrotizujúceho faktora (TNF-α), interleukínu-1 (IL-1β), IL-6, IL-8 a IL-12, a adhezívnych molekúl vrátane antigénu-1 súvisiaceho s funkciou lymfocytov (LFA-1) a intercelulárnej adhezívnej molekuly-1 (ICAM-1). Ľudské monocyty pri liečbe in vitro zabíjali alogénne a autológové nádorové bunky (vrátane melanómu, ovariálneho karcinómu, karcinómu hrubého
čreva a obličiek), ale nevykazovali toxicitu pre normálne bunky.
Podávanie lieku MEPACT in vivo viedlo k inhibícii rastu nádoru u myšacích a potkaních modelov v prípade pľúcnej metastázy, rakoviny kože a pečene a fibrosarkómu. Významné zlepšenie
prežitia bez choroby sa preukázalo aj pri liečbe osteosarkómu a hemangiosarkómu u psov pri použití lieku MEPACT ako adjuvantnej terapie. Presný mechanizmus, ktorým aktivácia monocytov a makrofágov liekom MEPACT vedie k protinádorovej aktivite u zvierat a ľudí, nie je dosiaľ známy.
Klinická bezpečnosťa účinnosť
Bezpečnosť lipozomálneho mifamurtidu sa posudzovala u viac ako 700 pacientov s rôznymi druhmi a štádiami rakoviny a u 21 zdravých dospelých subjektov (pozri časť 4.8).
V porovnaní s chemoterapiou samotnou liek MEPACT výrazne zvýšil celkové prežitie pacientov s novo diagnostikovaným resekovateľným osteosarkómom vysokého stupňa, ak sa používal spolu
s kombinovanou chemoterapiou. V randomizovanej štúdii fázy III , do ktorej bolo zapojených 678 pacientov (vo veku od 1,4 do 30,6 rokov), s novo diagnostikovaným resekovateľným osteosarkómom vysokého stupňa, pridanie adjuvantného lieku MEPACT k chemoterapii buď doxorubicínom alebo cisplatinou a metotrexátom s ifosfamidom alebo bez ifosfamidu
viedlo k relatívnemu zníženiu rizika úmrtia o 28 % (p = 0,0313, miera nebezpečenstva (HR) =
0,72 [95 % interval spoľahlivosti (CI): 0,53, 0,97]).
5.2 Farmakokinetické vlastnosti
Po intravenóznom podaní v prípade 21 zdravých dospelých subjektov bol mifamurtid rýchlo odstránený z plazmy (minúty), čo malo za následok veľmi nízku plazmatickú koncentráciu celkového (lipozomálneho a voľného) mifamurtidu. Priemerná AUC bola 17,0 +/- 4,71 h x nM a Cmax bola 15,7 +/- 3,72 nM. V samostatnej štúdii so zapojením 14 pacientov sa krivky závislosti priemernej sérovej koncentrácie od času pre celkový a voľný mifamurtid, ktoré sa hodnotili po prvej infúzii lieku MEPACT a po poslednej infúzii o 11 alebo 12 týždňov neskôr, takmer prekrývali a priemerné hodnoty AUC pre voľný mifamurtid po prvej a poslednej infúzii boli podobné. Tieto údaje naznačujú, že počas liečebného obdobia nedochádzalo k hromadeniu celkového ani voľného mifamurtidu.
Po 6 hodinách od injekcie rádioaktívne značených lipozómov s obsahom 6 mg mifamurtidu sa zistila rádioaktivita v pečeni, slezine, nosohltane, štítnej žľaze a v menšom rozsahu v pľúcach. Lipozómy boli fagocytované bunkami retikuloendotelového systému. U 2 zo 4 pacientov
s metastázami v pľúcach súvisela rádioaktivita s pľúcnymi metastázami. Priemerný polčas rádioaktívne značeného materiálu bol bifázický s fázou α trvajúcou okolo 15 minút a konečným polčasom trvajúcim približne 18 hodín.'
5.3 Predklinické údaje o bezpečnosti
U citlivých druhov (králik a pes) bola najvyššia denná dávka lipozomálneho mifamurtidu, ktorá nespôsobovala nežiaduce účinky, 0,1 mg/kg zodpovedajúca 1,2, resp. 2 mg/m2. Hladina lieku MEPACT nevyvolávajúca nežiaduce účinky u zvierat zodpovedá približne 2 mg/m2 odporúčanej dávky pre ľudí.
Údaje zo 6-mesačnej štúdie u psov s denným podávaním intravenóznych injekcií lieku MEPACT v dávke do 0,5 mg/kg (10 mg/m2) poskytujú 8- až 19-násobnú mieru bezpečnosti kumulatívnej expozície pre zreteľnú toxicitu pre plánovanú klinickú dávku u ľudí. Hlavné toxické účinky spojené s týmito vysokými dennými a kumulatívnymi dávkami lieku MEPACT boli najmä prehnané farmakologické účinky: horúčka, príznaky výraznej zápalovej odpovede prejavujúce sa ako synovitída, bronchopneumónia, perikarditída a zápalová nekróza pečene a kostnej drene. Taktiež sa pozorovali nasledujúce udalosti: krvácanie a predĺženie času zrážania, infarkty, morfologické zmeny v stene malých artérií, edém a kongescia centrálneho nervového systému, slabé účinky na srdce a mierna hyponatrémia. Liek MEPACT nebol mutagénny a nevyvolával teratogénne účinky u potkanov a králikov. Embryotoxické účinky boli pozorované len pri hladinách toxických pre matku.
Neexistujú žiadne výsledky zo štúdií celkovej toxicity, ktoré naznačujú škodlivé vplyvy na mužské alebo ženské reprodukčné orgány. Osobitné štúdie týkajúce sa reprodukčnej funkcie, perinatálnej toxicity a karcinogénneho potenciálu sa neuskutočnili.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
1-palmitoyl-2-oleoyl-sn-glycero-3-fosfocholín (POPC)
monosodná soľ 1,2-dioleoyl-sn-glycero-3-fosfo-L-serínu (OOPS)
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorená liekovka s práškom:
2 roky
Rekonštituovaná suspenzia:
Chemická a fyzikálna stabilita bola preukázaná počas 6 hodín pri teplote do 25ºC.
Z mikrobiologického hľadiska sa odporúča okamžité použitie. V prípade, že sa nepoužije okamžite, za čas použiteľnosti a podmienky skladovania rekonštituovaného, prefiltrovaného a rozriedeného roztoku pred použitím rekonštituovaného lieku je zodpovedný používateľ, pričom toto obdobie nesmie presiahnuť 6 hodín pri 25ºC. Roztok neuchovávajte v chladničke, ani ho nezmrazujte.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2°C – 8°C). Nezmrazujte.
Liekovku ponechajte v krabičke, aby bola chránená pred svetlom. Podmienky na uchovávanie rekonštituovaného lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
50 ml sklenená liekovka typu I so sivou butylovou gumovou zátkou, hliníkovým uzáverom a umelohmotným preklopiteľným viečkom s obsahom 4 mg mifamurtidu.
Každá krabička obsahuje jednu liekovku a jeden nepyrogénny sterilný filter bez obsahu latexu na jednorazové použitie pre liek MEPACT, ktorý je dodávaný v blistrovom balení z PVC.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Liek MEPACT sa musí rekonštituovať, prefiltrovať použitím priloženého filtra a ďalej zriediť
použitím aseptickej techniky.
Každá liekovka by mala byť rekonštituovaná s 50 ml 9mg/ml (0,9 %) injekčného roztoku chloridu sodného. Po rekonštituovaní každý ml suspenzie v liekovke obsahuje 0,08 mg mifamurtidu.
Objem rekonštituovanej suspenzie zodpovedajúcej vypočítanej dávke sa prostredníctvom priloženého filtra odoberie a ďalej zriedi ďalšími 50 ml 9mg/ml (0,9%) injekčného roztoku chloridu sodného podľa podrobných pokynov uvedených ďalej.
Pokyny na prípravu lieku MEPACT na intravenóznu infúziu
Materiál dodávaný v každom balení -
• Prášok lieku MEPACT na infúznu suspenziu (liekovka)
• Filter pre liek MEPACT
Požadovaný materiál, ktorý nie je dodávaný -
• 9mg/ml (0,9 %) injekčný roztok chloridu sodného, EP/USP 100 ml vak
• Jedna 60 alebo 100 ml jednorazová sterilná injekčná striekačka s luerovou koncovkou
• Dve sterilné injekčné ihly stredných rozmerov (18)
Odporúča sa, aby sa rekonštituovanie lipozomálnej suspenzie uskutočnilo v boxe s laminárnym prúdením, aby sa použili sterilné rukavice a uplatnila aseptická technika.
Lyofilizovaný prášok sa má ponechať tak, aby pred rekonštituovaním, prefiltrovaním s použitím priloženého filtra a zriedením dosiahol teplotu približne 20°C – 25°C. Malo by to trvať približne
30 minút.
1. Uzáver liekovky sa má odstrániť a zátka očistiť s použitím tampónu napusteného alkoholom.
2. Filter sa má vybrať s blistrového obalu a má sa dať dolu čiapočka z bodca filtra. Bodec sa má následne pevne vsunúť do liekovky, až kým sa neusadí. V tomto čase sa nemá odstraňovať luerový spojovací uzáver filtra.
3. Treba rozbaliť vak so 100 ml 9mg/ml (0,9 % ) injekčného roztoku chloridu sodného, ihlu a injekčnú striekačku (nie sú súčasťou balenia).
4. Miesto na vaku obsahujúcom 9mg/ml (0,9 % ) injekčného roztoku chloridu sodného, do ktorého sa vloží ihla, sa má utrieť tampónom napusteným alkoholom.
5. Použitím ihly a injekčnej striekačky sa má z vaku natiahnuť 50 ml 9mg/ml (0,9 %) injekčného roztoku chloridu sodného.
6. Po vybratí ihly z injekčnej striekačky treba injekčnú striekačku priložiť k filtru otvorením luerového spojovacieho uzáveru filtra (Obrázok 1).

Obrázok 1
7. 9mg/ml (0,9 %) injekčného roztoku chloridu sodného sa pridáva do liekovky pomalým, pevným zatlačením piestu injekčnej striekačky.
Filter a injekčná striekačka nesmú byť oddelené od liekovky.8. Liekovka sa má nechať nerušene stáť počas jednej minúty s cieľom zaistiť dôkladnú
hydratáciu suchej látky.
9.
Liekovka sa má následne silno miešať počas jednej minúty, zatiaľ čo filter a injekčná striekačka zostávajú pripojené. V tomto čase sa lipozómy tvoria spontánne (Obrázok 2).

Obrázok 2
10. Požadovanú dávku je možné natiahnuť z liekovky po jej prevrátení pomalým ťahom piestu injekčnej striekačky (Obrázok 3). Každý ml rekonštituovanej suspenzie obsahuje 0,08 mg mifamurtidu. Objem suspenzie, ktorý sa má natiahnuť, sa pre množstvá dávky vypočíta nasledovne:
Objem, ktorý sa má natiahnuť = [12,5 x vypočítaná dávka (mg)] ml
Na uľahčenie sa uvádza nasledujúca ekvivalenčná tabuľka:
Dávka
| Objem
|
1,0 mg
| 12,5 ml
|
2,0 mg
| 25 ml
|
3,0 mg
| 37,5 ml
|
4,0 mg
| 50 ml
|
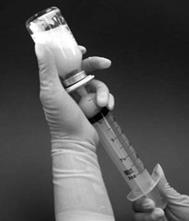
Obrázok 3
11. Injekčná striekačka sa má potom vybrať z filtra a na injekčnú striekačku naplnenú suspenziou sa má umiestniť nová ihla. Miesto vpichu na vaku sa má utrieť tampónom napusteným alkoholom a suspenzia v injekčnej striekačke sa má vpichnúť do originálneho vaku obsahujúceho ostávajúcich 50 ml 9mg/ml (0,9 %) injekčného roztoku chloridu sodného (Obrázok 4).
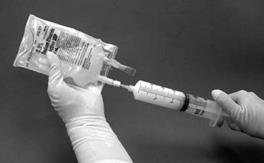
Obrázok 4
12. Vak treba jemne rozvíriť, aby sa roztok zamiešal.
13. Na štítok vaku s obsahom rekonštituovanej, prefiltrovanej a zriedenej lipozomálnej suspenzie sa má uviesť identifikácia pacienta, čas a dátum.
14. Chemická a fyzikálna stabilita použiteľnosti bola preukázaná pre 6 hodín pri izbovej teplote
(približne medzi 20°C – 25°C).
15. Z mikrobiologického hľadiska sa má produkt použiť okamžite. V prípade, že sa nepoužije okamžite, za čas použiteľnosti a podmienky skladovania pred použitím je zodpovedný používateľ, pričom toto obdobie by nemalo presiahnuť 6 hodín pri izbovej teplote.
16. Lipozomálna suspenzia sa podáva intravenóznou infúziou počas približne jednej hodiny.
LikvidáciaŽiadne špeciálne požiadavky.
7. DRŽITEĽ POVOLENIA NA UVEDENIE A TRHIDM Pharma, S.A.
47 rue de Chaillot
75116 Paríž
Francúzsko
Tel: +33 467 55 84 62
Fax: +33 174 90 00 17
8. ČÍSLO (-A) POVOLENIA NA UVEDENIE NA TRH
9
. DÁTUM PRVÉHO POVOLENIA/PREDĹŽENIA POVOLENIA
10
. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky (EMEA)
http://www.emea.europa.eu.