
/>
Luveris sa nesmie používať, keď existuje stav, ktorý by znemožnil normálne tehotenstvo, ako je:
• primárne zlyhanie ovárií
• malformácie pohlavných orgánov nekompatibilné s tehotenstvom
• fibroidné nádory maternice nekompatibilné s tehotenstvom
4.4 Osobitné upozornenia a opatrenia pri používaní
Pred začatím liečby je u oboch partnerov potrebné vyšetriť fertilitu, pričom treba zohľadniť aj prípadné kontraindikácie gravidity. Osobitne je potrebné vylúčiť hypotyreoidizmus, hypofunkciu kôry nadobličiek, hyperprolaktinémiu, nádory hypotalamu a hypofýzy, a v prípade ich potvrdenia začať špecifickú liečbu.
Pacientky, ktoré sa podrobujú stimulácii dozrievania folikulov, majú zvýšené riziko vzniku hyperstimulácie v dôsledku nadmernej estrogénovej odpovede a vývoja viacerých folikulov.
Ovariálny hyperstimulačný syndróm (OHSS) sa môže stať závažnou medicínskou udalosťou, ktorú charakterizujú veľké ovariálne cysty s tendenciou prasknúť. Pokiaľ sa na indukciu ovulácie nepodá hCG, nadmerná reakcia ovárií zriedkavo vyvolá signifikantnú hyperstimuláciu. V takýchto prípadoch je preto nevyhnutné hCG nepodať a pacientke odporučiť, aby sa najmenej 4 dni zdržala koitu alebo používala bariérovú metódu antikoncepcie.
Pred a počas stimulačnej liečby sa odporúča starostlivé ultrazvukové sledovanie ovariálnej odpovede, najmä u pacientok s polycystickými ováriami.
U pacientok, ktoré sa podrobujú indukcii ovulácie je zvýšený výskyt mnohopočetnej gravidity a pôrodov v porovnaní s prirodzeným počatím.
Ak sa predpokladá vážne riziko OHSS alebo mnohopočetných tehotenstiev, odporúča sa liečbu ukončiť. Na minimalizáciu rizika OHSS alebo mnohopočetnej gravidity sa odporúčajú ultrazvukové vyšetrenia ako
i merania estradiolu. Pri anovulácii je riziko OHSS zvýšené pri hladine estradiolu v sére > 900 pg/ml
(3300 pmol/l) a v prítomnosti viac ako troch folikulov s priemerom 14 mm alebo viac.
Dodržiavanie odporúčaného dávkovania lutropínu alfa a FSH, dávkovacieho režimu a starostlivé monitorovanie liečby zminimalizuje výskyt ovariálnej hyperstimulácie a mnohopočetnej gravidity.
V klinických štúdiách sa ukázalo, že tento liek zvyšuje citlivosť ovárií na folitropín alfa. Pokiaľ je potrebné dávku FSH zvýšiť, najvhodnejšie je dávku prispôsobovať v 7-14 dňových intervaloch o 37,5–
75 IU.
V klinických štúdiách sa nezaznamenala žiadna precitlivenosť na lutropín alfa.
Incidencia zániku tehotenstva pri spontánnom potrate alebo interupcii je vyššia u pacientok podrobujúcich sa stimulácii rastu folikulov na vyvolanie ovulácie než u normálnej populácie.
U žien s ochorením vajíčkovodov v anamnéze existuje riziko mimomaternicového tehotenstva, či už po spontánnom oplodnení alebo po liečbe neplodnosti. Výskyt mimomaternicového tehotenstva po IVF sa pohybuje v rozmedzí od 2 do 5 % v porovnaní s 1 až 1,5 % v bežnej populácii.
U žien, ktoré sa podrobili viacnásobným liečebným režimom na liečbu neplodnosti boli hlásené benígne aj malígne novotvary vaječníkov aj ďalších reprodukčných orgánov. Dosiaľ však nebolo zistené, či liečba gonádotropínmi zvyšuje alebo nezvyšuje základné riziko týchto nádorov u neplodných žien.
Výskyt vrodených malformácií po ART môže byť v porovnaní s prirodzeným počatím mierne zvýšený. Môže to byť zapríčinené rozdielmi v rodičovských faktoroch (napr. vek matky, genetika), postupmi ART a mnohopočetnými tehotenstvami.
U žien so všeobecne známymi rizikovými faktormi pre tromboembolické príhody, ako napríklad osobná alebo rodinná anamnéza, môže liečba gonádotropínmi toto riziko ešte zvýšiť. U týchto žien je potrebné zvážiť prospech podávania gonádotropínu v porovnaní s možnými rizikami. Treba však poukázať na to, že samotné tehotenstvo ako aj OHSS prináša tiež zvýšené riziko tromboembolických príhod.
4.5 Liekové a iné interakcie
S lutropínom alfa neboli vykonané žiadne interakčné štúdie.
Luveris sa nemá podávať v tej istej injekcii spolu s inými liekmi, okrem folitropínu alfa. Štúdie dokázali, že ich spoločná aplikácia významne nemení účinok, stabilitu, farmakokinetické ani farmakodynamické vlastnosti liečiv.
4.6 Gravidita a laktácia
Luveris sa nemá užívať počas gravidity alebo laktácie.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Všeobecný opis
Lutropín alfa sa užíva na stimuláciu vývoja folikulov v kombinácii s folitropínom alfa. V tomto kontexte je ťažké pripísať nežiaduce účinky jednej z týchto látok.
V klinických štúdiách boli u 7,4% pacientov hlásené mierne, respektíve u 0,9% stredne ťažké reakcie
v mieste vpichu injekcie (podliatiny, bolesť, sčervenenie, svrbenie alebo opuch). Neboli hlásené nijaké ťažké reakcie v mieste vpichu. Doteraz neboli po podaní Luverisu hlásené nijaké systémové alergické reakcie.
Ovariálny hyperstimulačný syndróm sa pozoroval u menej ako 6% pacientok liečených Luverisom. Nebol hlásený žiadny ťažký stupeň ovariálneho hyperstimulačného syndrómu (časť 4.4).
V zriedkavých prípadoch bola liečba ľudským menopauzálnym gonadotropínom spojená s torziou adnexov (komplikácia zväčšenia ovárií) a hemoperitoneom. I napriek tomu, že tieto nežiaduce reakcie sa nepozorovali po aplikácii Luverisu, ich vznik nemožno vylúčiť.
U žien s ochorením vajíčkovodov v anamnéze sa môže tiež objaviť ektopická gravidita. Nežiaduce reakcie
Na určenie frekvencie výskytu (prípad/počet pacientok) bola použitá nasledovná metóda:veľmi časté
(≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
Na základe dôkladného zhodnotenia možno po podaní Luverisu pozorovať nasledovné nežiaduce účinky. V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
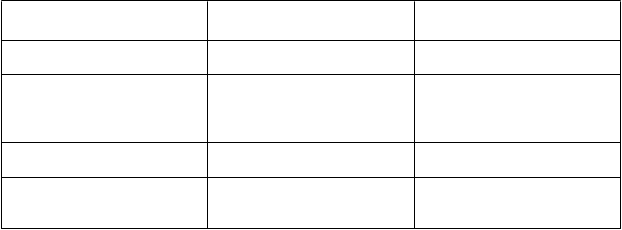
Trieda orgánových systémov Časté Veľmi zriedkavé
Poruchy gastrointestinálneho
traktu
Poruchy ciev
Celkové poruchy a reakcie v mieste podania
Poruchy reprodukčného systému a prsníkov
Nauzea, bolesť brucha, bolesť
panvy
Bolesť hlavy, ospalosť, reakcia v mieste podania injekcie Ovariálny hyperstimulačný syndróm, ovariálne cysty, bolesť prsníkov
Tromboembólia, zvyčajne v spojitosti s ťažkým ovariálnym hyperstimulačným syndrómom (OHSS)
 4.9 Predávkovanie
4.9 Predávkovanie
Následky predávkovania lutropínom alfa nie sú známe, napriek tomu je možnosť vývoja ovariálneho hyperstimulačného syndrómu, čo je bližšie popísané v časti 4.4.
Jednotlivé dávky až do 40 000 IU lutropínu alfa boli podané zdravým dobrovoľníčkam bez vzniku závažných nežiaducich reakcií, pričom boli dobre tolerované.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: gonadotropíny, ATC kód: G03GA07.
Lutropín alfa je rekombinantný ľudský luteinizačný hormón, glykoproteín zložený z nekovalentne viazaných α- a β-podjednotiek. Luteinizačný hormón sa viaže na bunky téky (a granulózové bunky) ovárií a Leydigove bunky semenníkov cez receptor spoločný s ľudským choriogonadotropínom (hCG). Tento transmembránový LH/CG receptor je súčasťou podskupiny receptorov spojených s G-proteínom. Je charakteristický tým, že má veľkú extracelulárnu doménu. In vitro afinita rekombinantného hLH na LH/CG receptor na bunkách tumoru Leydigových buniek (MA-10) je medzi afinitou hCG a afinitou hypofyzárneho hLH, avšak rádovo je rovnaká.
V ováriách stimuluje LH počas folikulárnej fázy bunky téky k sekrécii androgénov, ktoré slúžia ako
substrát pre enzým aromatázu v granulózových bunkách, kde sa syntetizuje estradiol, ktorý podporuje vývoj folikulov indukovaný FSH. V strede cyklu spúšťajú vysoké hladiny LH tvorbu corpus luteum a ovuláciu. Po ovulácii LH stimuluje produkciu progesterónu v corpus luteum zvýšením konverzie cholesterolu na pregnenolón.
Na stimuláciu vývoja folikulov u žien s anovuláciou s deficienciou LH a FSH je primárny účinok lutropínu alfa zvýšenie sekrécie estradiolu folikulmi, ktorých rast je stimulovaný FSH.
V klinických štúdiách boli pacientky definované na základe endogénnej hladiny LH v sére < 1,2 IU/l po meraní v ústredných laboratóriách. I napriek tomuto je potrebné vziať do úvahy rozličné hodnoty hladín LH, ktoré boli merané v rôznych laboratóriách.
V týchto štúdiách bola miera ovulácie na jeden cyklus 70-75%.
5.2 Farmakokinetické vlastnosti
Farmakokinetika lutropínu alfa sa študovala na dobrovoľníčkach s desenzibilizáciou hypofýzy v rozmedzí dávok od 75 IU až do 40 000 IU.
Farmakokinetický profil lutropínu alfa je podobný profilu hLH získaného z moču. Po intravenóznom podaní je lutropín alfa rýchlo distribuovaný s iniciálnym polčasom približne jedna hodina a eliminovaný z organizmu s terminálnym polčasom okolo 10-12 hodín. Distribučný objem v rovnovážnom stave je asi
10-14 l. Lutropín alfa vykazuje lineárnu farmakokinetiku, ako ukázalo hodnotenie AUC, ktorá je priamo úmerná podanej dávke. Celkový klírens je okolo 2 l/h. Menej ako 5% dávky sa vylúči močom. Priemerný čas pretrvávania v organizme je približne 5 hodín.
Absolútna biologická dostupnosť po subkutánnom podaní je približne 60%; terminálny polčas je mierne predĺžený. Farmakokinetika lutropínu alfa po jednotlivej a opakovanej dávke Luverisu je porovnateľná a miera kumulácie lutropínu alfa je minimálna. Ak sa podáva súbežne s folitropínom alfa nedochádza
k žiadnym farmakokinetickým interakciám.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
V dôsledku heterológnej proteínovej povahy hormónu vyvolal lutropín alfa po určitom čase u experimentálnych zvierat protilátkovú odpoveď, ktorá na jednej strane znížila merateľnú sérovú hladinu LH, ale na druhej strane úplne nezabránila jeho biologickému účinku. Neboli pozorované žiadne známky toxicity vyvolanej produkciou protilátok proti lutropínu alfa.
Opakované podávanie lutropínu alfa v dávkach 10 IU/kg/deň a vyšších spôsobilo gravidným potkanom a králikom poruchy reprodukčnej funkcie, ako sú resorpcia plodov a zníženie prírastku telesnej hmotnosti matiek. Ani na jednom modeli zvierat však nebola pozorovaná teratogenita spojená s aplikáciou liečiva. Iné štúdie dokázali, že lutropín alfa nie je mutagénny.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Sacharóza
Dihydrát hydrogénfosforečnanu sodného Monohydrát dihydrogénfosforečnanu sodného Polysorbát 20
Koncentrovaná kyselina fosforečná (na úpravu pH) Hydroxid sodný (na úpravu pH)
Metionín
Dusík
Rozpúšťadlo: voda na injekciu
6.2 Inkompatibility
Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25°C. Uchovávajte v pôvodnom balení na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Prášok je balený v 3 ml injekčných liekovkách z neutrálneho bezfarebného skla (typ I). Injekčné liekovky sú uzatvorené brómbutylovými zátkami chránenými hliníkovými tesniacimi krúžkami s vyklápacími viečkami. Rozpúšťadlo je balené v 2 alebo 3 ml injekčných liekovkách z neutrálneho bezfarebného skla (typ I) s gumenou zátkou potiahnutou teflónom alebo v 2 ml ampulkách z neutrálneho bezfarebného skla (typ I).
Liek sa dodáva v baleniach 1, 3 alebo 10 injekčných liekoviek so zodpovedajúcim množstvom injekčných liekoviek alebo ampuliek rozpúšťadla. Nie všetky veľkosti balenia musia byť uvedené do obehu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Liek je určený na okamžité jednorazové použitie po prvom otvorení a rozpustení. Prášok sa musí pred použitím rozpustiť v rozpúšťadle jemným krúživým pohybom. Rekonštituovaný roztok sa nesmie podávať, ak obsahuje častice alebo nie je číry.
Luveris sa môže miešať a podávať v jednej injekcii s folitropínom alfa. V takomto prípade je potrebné ako prvý rozpustiť Luveris a pripravený roztok následne použiť na rozpustenie prášku folitropínu alfa.
Aby sme sa vyhli veľkému objemu injekcie, môže sa jedna injekčná liekovka Luverisu rekonštituovať
v 1 ml rozpúšťadla spolu s jednou alebo dvoma ampulkami/injekčnými liekovkami folitropínu alfa
37,5 IU, 75 IU alebo 150 IU.
Všetky nepoužité lieky alebo odpad vzniknutý z liekov majú byť zlikvidované v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMerck Serono Europe Limited
56 Marsh Wall Londýn E14 9TP Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/00/155/001
EU/1/00/155/002
EU/1/00/155/003
EU/1/00/155/004
EU/1/00/155/005
EU/1/00/155/006
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 29. novembra 2000. Dátum posledného predĺženia: 30. novembra 2005.
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
(EMEA)
http://www.emea.europa.eu/.
1. NÁZOV LIEKU
Luveris 450 IU injekčný roztok.
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Jedna náplň obsahuje 450 IU/0,72 ml lutropínu alfa (rekombinantný ľudský luteinizačný hormón r-hLH)
a umožňuje podanie 6 dávok 75 IU lutropínu alfa.
Lutropín alfa je produkovaný bunkami ovárií čínskeho škrečka (CHO) metódou genetického inžinierstva. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Injekčný roztok.
Roztok je číry a bezfarebný.
pH roztoku je 7,5 – 8,5. Osmolalita je 250-450 mOsm/kg.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Luveris spolu s folikuly stimulujúcim hormónom (FSH) sa odporúča podávať na stimuláciu vývoja folikulov u žien so závažnou deficienciou luteinizačného hormónu (LH) a FSH. V klinických štúdiách bola u týchto pacientok určená endogénna hladina LH v sére <1,2 IU/l.
4.2 Dávkovanie a spôsob podávania
Liečba Luverisom sa má začať pod dohľadom lekára, ktorý má skúsenosti s liečbou porúch fertility. Tento liek si môžu podávať samy len tie pacientky, ktoré sú dobre motivované, adekvátne zaškolené a majú možnosť poradiť sa s lekárom.
Cieľom liečby lutropínom alfa spolu s FSH u žien s nedostatkom LH a FSH je vznik jediného zrelého Graafovho folikulu, z ktorého sa po podaní ľudského choriogonadotropínu (hCG) uvoľní vajíčko. Luveris možno podávať v sérii denných injekcií súbežne s FSH. Vzhľadom na to, že ide o pacientky s amenoreou, ktoré majú nízku sekréciu endogénnych estrogénov, liečbu možno začať kedykoľvek.
Luveris sa má podávať súbežne s folitropínom alfa.
Liečba sa prispôsobuje individuálnej odpovedi pacientky a je určená ultrazvukovým meraním veľkosti folikulu a estrogénovej odpovede. Odporúčaná schéma dávkovania je 75 IU lutropínu alfa so 75-150 IU FSH denne.
Pokiaľ je potrebné dávku FSH zvýšiť, najvhodnejšie je dávku prispôsobovať v 7-14 dňových intervaloch o
37,5 IU-75 IU. Prípustné je predĺženie trvania stimulácie v jednom cykle až na 5 týždňov.
Injekčný roztok Luveris v náplni sa musí podávať pomocou autoinjekčného zariadenia na opakované použitie, dodávaného osobitne. Pred aplikáciou si prečítajte príbalové informácie, ktoré sú súčasťou zariadenia.
Ak sa dosiahne optimálna odpoveď, 24–48 hodín po poslednej injekcii lutropínu alfa a FSH sa podá jediná injekcia 250 mikrogramov r-hCG alebo 5000 IU až 10 000 IU hCG. Pacientke sa odporúča, aby mala pohlavný styk v deň podania a deň po podaní hCG.
Prípadne sa môže vykonať vnútromaternicová inseminácia (IUI).
Vzhľadom na to, že nedostatok látok s luteotropnou aktivitou (LH/hCG) môže viesť po ovulácii k predčasnému zániku corpus luteum, je potrebné zvážiť podporu luteálnej fázy.
Ak sa dosiahne nadmerná odpoveď, liečbu je potrebné prerušiť a hCG nepodať. Liečbu sa odporúča znovu obnoviť v nasledujúcom cykle s použitím nižších dávok FSH.
Luveris je určený na podkožné podávanie.
4.3 Kontraindikácie
Luveris je kontraindikovaný u pacientok s:
• precitlivenosťou na gonadotropíny alebo niektorú z pomocných látok
• karcinómom ovárií, maternice alebo prsníka
• tumorom hypotalamu a hypofýzy
• zväčšenými ováriami alebo ovariálnymi cystami, ktoré nesúvisia s ochorením polycystických ovárií a sú neznámeho pôvodu
• gynekologickým krvácaním neznámej príčiny
Luveris sa nesmie používať, keď existuje stav, ktorý by znemožnil normálne tehotenstvo, ako je:
• primárne zlyhanie ovárií
• malformácie pohlavných orgánov nekompatibilné s tehotenstvom
• fibroidné nádory maternice nekompatibilné s tehotenstvom
4.4 Osobitné upozornenia a opatrenia pri používaní
Pred začatím liečby je u oboch partnerov potrebné vyšetriť fertilitu, pričom treba zohľadniť aj prípadné kontraindikácie gravidity. Osobitne je potrebné vylúčiť hypotyreoidizmus, hypofunkciu kôry nadobličiek, hyperprolaktinémiu, nádory hypotalamu a hypofýzy, a v prípade ich potvrdenia začať špecifickú liečbu.
Pacientky, ktoré sa podrobujú stimulácii dozrievania folikulov, majú zvýšené riziko vzniku hyperstimulácie v dôsledku nadmernej estrogénovej odpovede a vývoja viacerých folikulov.
Ovariálny hyperstimulačný syndróm (OHSS) sa môže stať závažnou medicínskou udalosťou, ktorú charakterizujú veľké ovariálne cysty s tendenciou prasknúť. Pokiaľ sa na indukciu ovulácie nepodá hCG, nadmerná reakcia ovárií zriedkavo vyvolá signifikantnú hyperstimuláciu. V takýchto prípadoch je preto nevyhnutné hCG nepodať a pacientke odporučiť, aby sa najmenej 4 dni zdržala koitu alebo používala bariérovú metódu antikoncepcie.
Pred a počas stimulačnej liečby sa odporúča starostlivé ultrazvukové sledovanie ovariálnej odpovede, najmä u pacientok s polycystickými ováriami.
U pacientok, ktoré sa podrobujú indukcii ovulácie je zvýšený výskyt mnohopočetnej gravidity a pôrodov v porovnaní s prirodzeným počatím.
Ak sa predpokladá vážne riziko OHSS alebo mnohopočetných tehotenstiev, odporúča sa liečbu ukončiť.
Na minimalizáciu rizika OHSS alebo mnohopočetnej gravidity sa odporúčajú ultrazvukové vyšetrenia ako i merania estradiolu. Pri anovulácii je riziko OHSS zvýšené pri hladine estradiolu v sére > 900 pg/ml
(3300 pmol/l) a v prítomnosti viac ako troch folikulov s priemerom 14 mm alebo viac.
Dodržiavanie odporúčaného dávkovania lutropínu alfa a FSH, dávkovacieho režimu a starostlivé monitorovanie liečby zminimalizuje výskyt ovariálnej hyperstimulácie a mnohopočetnej gravidity.
V klinických štúdiách sa ukázalo, že tento liek zvyšuje citlivosť ovárií na folitropín alfa. Pokiaľ je potrebné dávku FSH zvýšiť, najvhodnejšie je dávku prispôsobovať v 7-14 dňových intervaloch o 37,5–
75 IU.
V klinických štúdiách sa nezaznamenala žiadna precitlivenosť na lutropín alfa.
Incidencia zániku tehotenstva pri spontánnom potrate alebo interupcii je vyššia u pacientok podrobujúcich sa stimulácii rastu folikulov na vyvolanie ovulácie než u normálnej populácie.
U žien s ochorením vajíčkovodov v anamnéze existuje riziko mimomaternicového tehotenstva, či už po spontánnom oplodnení alebo po liečbe neplodnosti. Výskyt mimomaternicového tehotenstva po IVF sa pohybuje v rozmedzí od 2 do 5 % v porovnaní s 1 až 1,5 % v bežnej populácii.
U žien, ktoré sa podrobili viacnásobným liečebným režimom na liečbu neplodnosti boli hlásené benígne aj malígne novotvary vaječníkov aj ďalších reprodukčných orgánov. Dosiaľ však nebolo zistené, či liečba gonádotropínmi zvyšuje alebo nezvyšuje základné riziko týchto nádorov u neplodných žien.'
Výskyt vrodených malformácií po ART môže byť v porovnaní s prirodzeným počatím mierne zvýšený. Môže to byť zapríčinené rozdielmi v rodičovských faktoroch (napr. vek matky, genetika), postupmi ART a mnohopočetnými tehotenstvami.
U žien so všeobecne známymi rizikovými faktormi pre tromboembolické príhody, ako napríklad osobná alebo rodinná anamnéza, môže liečba gonádotropínmi toto riziko ešte zvýšiť. U týchto žien je potrebné zvážiť prospech podávania gonádotropínu v porovnaní s možnými rizikami. Treba však poukázať na to, že samotné tehotenstvo ako aj OHSS prináša tiež zvýšené riziko tromboembolických príhod.
4.5 Liekové a iné interakcie
S lutropínom alfa neboli vykonané žiadne interakčné štúdie. .
Spoločná aplikácia lutropínu alfa a folitropínu alfa významne nemení účinok, stabilitu, farmakokinetické ani farmakodynamické vlastnosti liečiv.
4.6 Gravidita a laktácia
Luveris sa nemá užívať počas gravidity alebo laktácie.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá alebo obsluhovať stroje.
4.8 Nežiaduce účinky
Všeobecný opis
Lutropín alfa sa užíva na stimuláciu vývoja folikulov v kombinácii s folitropínom alfa.
V tomto kontexte je ťažké pripísať nežiaduce účinky jednej z týchto látok.
V klinických štúdiách boli u 7,4% pacientov hlásené mierne, respektíve u 0,9% stredne ťažké reakcie
v mieste vpichu injekcie (podliatiny, bolesť, sčervenenie, svrbenie alebo opuch). Neboli hlásené nijaké ťažké reakcie v mieste vpichu. Doteraz neboli po podaní Luverisu hlásené nijaké systémové alergické reakcie.
Ovariálny hyperstimulačný syndróm sa pozoroval u menej ako 6% pacientok liečených Luverisom. Nebol hlásený žiadny ťažký stupeň ovariálneho hyperstimulačného syndrómu (časť 4.4).
V zriedkavých prípadoch bola liečba ľudským menopauzálnym gonadotropínom spojená s torziou adnexov (komplikácia zväčšenia ovárií) a hemoperitoneom. I napriek tomu, že tieto nežiaduce účinky sa nepozorovali po aplikácii Luverisu, ich vznik nemožno vylúčiť.
U žien s ochorením vajíčkovodov v anamnéze sa môže tiež objaviť ektopická gravidita. Nežiaduce reakcie
Na určenie frekvencie výskytu (prípad/počet pacientok) bola použitá nasledovná metóda: veľmi časté
(≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
Na základe dôkladného zhodnotenia možno po podaní Luverisu pozorovať nasledovné nežiaduce účinky. V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Trieda orgánových systémov Časté Veľmi zriedkavé
Poruchy gastrointestinálneho
traktu
Poruchy ciev
Celkové poruchy a reakcie v mieste podania
Poruchy reprodukčného systému a prsníkov
Nauzea, bolesť brucha, bolesť
panvy
Bolesť hlavy, ospalosť, reakcia v mieste podania injekcie Ovariálny hyperstimulačný syndróm, ovariálne cysty, bolesť prsníkov
Tromboembólia, zvyčajne v spojitosti s ťažkým ovariálnym hyperstimulačným syndrómom (OHSS)
 4.9 Predávkovanie
4.9 Predávkovanie
Následky predávkovania lutropínom alfa nie sú známe, napriek tomu je možnosť vývoja ovariálneho hyperstimulačného syndrómu, čo je bližšie popísané v časti 4.4.
Jednotlivé dávky až do 40 000 IU lutropínu alfa boli podané zdravým dobrovoľníčkam bez vzniku závažných nežiaducich reakcií, pričom boli dobre tolerované.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: gonadotropíny, ATC kód: G03GA07.
Lutropín alfa je rekombinantný ľudský luteinizačný hormón, glykoproteín zložený z nekovalentne viazaných α- a β-podjednotiek. Luteinizačný hormón sa viaže na bunky téky (a granulózové bunky) ovárií a Leydigove bunky semenníkov cez receptor spoločný s ľudským choriogonadotropínom (hCG). Tento transmembránový LH/CG receptor je súčasťou podskupiny receptorov spojených s G-proteínom. Je charakteristický tým, že má veľkú extracelulárnu doménu. In vitro afinita rekombinantného hLH na LH/CG receptor na bunkách tumoru Leydigových buniek (MA-10) je medzi afinitou hCG a afinitou hypofyzárneho hLH, avšak rádovo je rovnaká.
V ováriách stimuluje LH počas folikulárnej fázy bunky téky k sekrécii androgénov, ktoré slúžia ako
substrát pre enzým aromatázu v granulózových bunkách, kde sa syntetizuje estradiol, ktorý podporuje vývoj folikulov indukovaný FSH. V strede cyklu spúšťajú vysoké hladiny LH tvorbu corpus luteum a ovuláciu. Po ovulácii LH stimuluje produkciu progesterónu v corpus luteum zvýšením konverzie cholesterolu na pregnenolón.
Na stimuláciu vývoja folikulov u žien s anovuláciou s deficienciou LH a FSH je primárny účinok lutropínu alfa zvýšenie sekrécie estradiolu folikulmi, ktorých rast je stimulovaný FSH.
V klinických štúdiách boli pacientky definované na základe endogénnej hladiny LH v sére < 1,2 IU/l po meraní v ústredných laboratóriách. I napriek tomuto je potrebné vziať do úvahy rozličné hodnoty hladín LH, ktoré boli merané v rôznych laboratóriách.
V týchto štúdiách bola miera ovulácie na jeden cyklus 70-75%.
5.2 Farmakokinetické vlastnosti
Farmakokinetika lutropínu alfa sa študovala na dobrovoľníčkach s desenzibilizáciou hypofýzy v rozmedzí dávok od 75 IU až do 40 000 IU.
Farmakokinetický profil lutropínu alfa je podobný profilu hLH získaného z moču. Po intravenóznom podaní je lutropín alfa rýchlo distribuovaný s iniciálnym polčasom približne jedna hodina a eliminovaný z organizmu s terminálnym polčasom okolo 10-12 hodín. Distribučný objem v rovnovážnom stave je asi
10-14 l. Lutropín alfa vykazuje lineárnu farmakokinetiku, ako ukázalo hodnotenie AUC, ktorá je priamo úmerná podanej dávke. Celkový klírens je okolo 2 l/h. Menej ako 5% dávky sa vylúči močom. Priemerný čas pretrvávania v organizme je približne 5 hodín.
Absolútna biologická dostupnosť po subkutánnom podaní je približne 60%; terminálny polčas je mierne predĺžený. Farmakokinetika lutropínu alfa po jednotlivej a opakovanej dávke Luverisu je porovnateľná a miera kumulácie lutropínu alfa je minimálna. Ak sa podáva súbežne s folitropínom alfa nedochádza
k žiadnym farmakokinetickým interakciám.
Štúdia porovnávajúca receptúry registrovaného prášku a rozpúšťadla a injekčného roztoku preukázala bioekvivalenciu oboch receptúr.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje na základe obvyklých štúdií farmakologickej bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
V dôsledku heterológnej proteínovej povahy hormónu vyvolal lutropín alfa po určitom čase u
experimentálnych zvierat protilátkovú odpoveď, ktorá na jednej strane znížila merateľnú sérovú hladinu LH, ale na druhej strane úplne nezabránila jeho biologickému účinku. Neboli pozorované žiadne známky toxicity vyvolanej produkciou protilátok proti lutropínu alfa.
Opakované podávanie lutropínu alfa v dávkach 10 IU/kg/deň a vyšších spôsobilo gravidným potkanom a králikom poruchy reprodukčnej funkcie, ako sú resorpcia plodov a zníženie prírastku telesnej hmotnosti matiek. Ani na jednom modeli zvierat však nebola pozorovaná teratogenita spojená s aplikáciou liečiva. Iné štúdie dokázali, že lutropín alfa nie je mutagénny.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
L-arginín HCl
Dihydrát hydrogénfosforečnanu sodného Monohydrát dihydrogénfosforečnanu sodného Hydroxid sodný (na úpravu pH)
Kyselina fosforečná (na úpravu pH) Polysorbát 20
L-metionín
Fenol
Voda na injekcie
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
Po otvorení: 28 dní (v rámci doby použiteľnosti).
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (pri teplote 2 °C – 8 °C). Neuchovávajte v mrazničke. Uchovávajte v pôvodnom balení na ochranu pred svetlom.
Po otvorení sa náplň s autoinjekčným zariadením musí uchovávať v chladničke (pri teplote 2 °C – 8 °C)
maximálne 28 dní. (Pozri časť 6.3).
6.5 Druh obalu a obsah balenia
0,72 ml injekčného roztoku náplni (sklo typu 1) s tmavošedým brómbutylovým gumovým piestom a skrutkovacím vrchnákom vyrobeným s gumenou membránovou zátkou a hliníkom.
Balenie: 1 náplň.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Po prvom použití nevyberajte náplň z autoinjekčného zariadenia. Roztok sa nesmie podávať, ak obsahuje častice alebo nie je číry.
Všetok nepoužitý roztok sa musí zlikvidovať najneskôr do 28 dní po prvom otvorení. Použité ihly zlikvidujte okamžite po podaní injekcie.
Všetky nepoužité lieky alebo odpad vzniknutý z liekov majú byť zlikvidované v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMerck Serono Europe Limited
56 Marsh Wall Londýn E14 9TP Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/00/155/007
9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 29. novembra 2000. Dátum posledného predĺženia: 30. novembra 2005.
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej liekovej agentúry
(EMEA)
http://www.emea.europa.eu/.