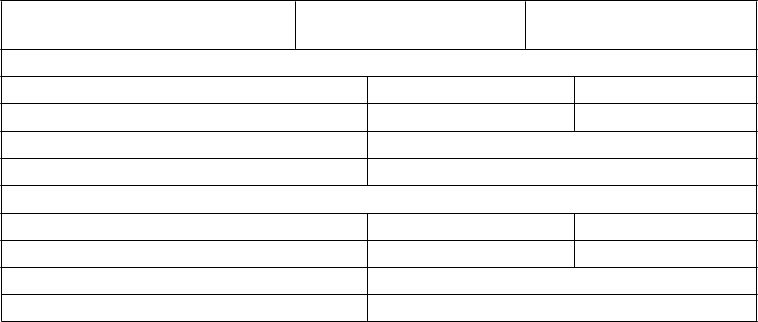
Neutrofily < 0,5 109/l 1,5 109/l
Trombocyty < 50 109/l 75 109/l
a Kritéria pre pokračovanie liečby sú aplikované na začiatku nasledujúceho cyklu u všetkých pacientov bez ohľadu na to, či boli alebo neboli splnené kritériá pre prerušenie liečby.

Tabuľka 3 – Odporúčané úpravy dávky Lonsurfu v prípade hematologických a nehematologických nežiaducich účinkov
Nežiaduci účinok Odporúčané úpravy dávky
Febrilná neutropénia
Neutropénia (< 0,5 x 109/l) alebo
trombocytopénia (< 25 109/l) 4. stupňa
CTCAE*, ktorá vedie k oddialeniu
Prerušte podávanie lieku, pokiaľ sa toxicita neupraví na 1. stupeň alebo na
východiskovú hodnotu.
začiatku nasledujúceho cyklu o viac ako 1
týždeň
Nehematologické nežiaduce účinky 3. alebo 4. stupňa CTCAE*; okrem nauzey a/alebo vracania 3. stupňa,

kontrolovaných liečbou antiemetikami
alebo hnačky reagujúcej na antidiaroiká
Pri pokračovaní liečby, znížte dávkovanie oproti predchádzajúcej úrovni dávkovania o 5 mg/m2/dávku (tabuľka 4).
Zníženie dávky je povolené po minimálnu dávku 20 mg/m2v jednej dávke, dvakrát denne.
Nezvyšujete dávku potom, ako bola znížená.
*Common terminology criteria for adverse events = všeobecne používané terminologické kritériá pre nežiaduce udalosti
Tabuľka 4 – Redukcie dávky podľa plochy povrchu tela (BSA)
Znížená dávka BSA (m2)
Dávka v
mg (2x denne)
Počet tabliet na dávku
(2x denne) Celková denná dávka (mg)
15 mg 20 mg
Úroveň 1 redukcie dávky: od 35 mg/m2 do 30 mg/m2
30 mg/m2 < 1,09 30 2 0 60
1,09 - 1,24 35 1 1 70
1,25 - 1,39 40 0 2 80
1,40 - 1,54 45 3 0 90
1,55 - 1,69 50 2 1 100
1,70 - 1,94 55 1 2 110
1,95 - 2,09 60 0 3 120
2,10 - 2,28 65 3 1 130
≥ 2,29 70 2 2 140
Úroveň 2 redukcie dávky: od 30 mg/m2 do 25 mg/m2
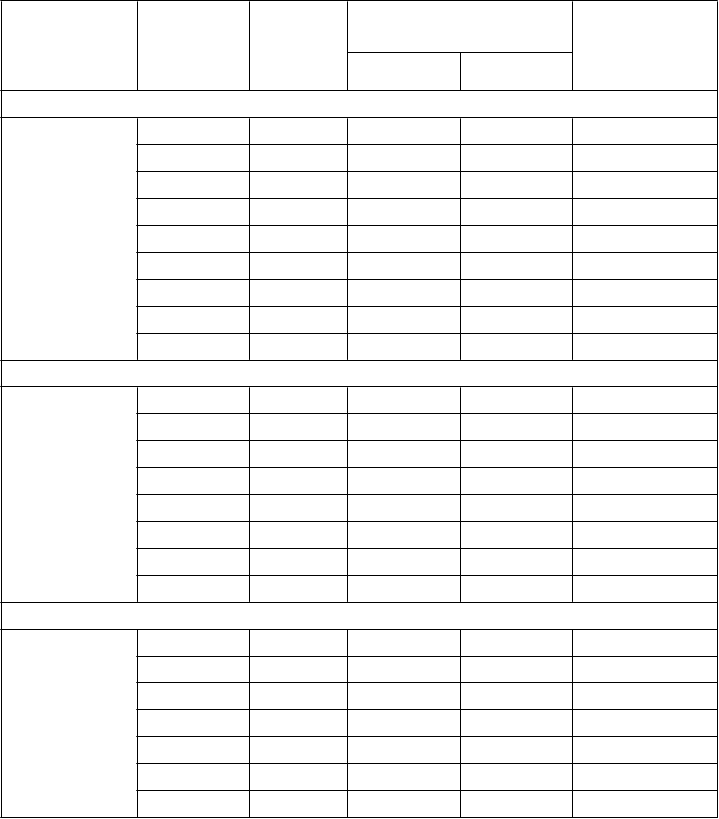
25 mg/m2 < 1,10 25a 2a 1a 50a
1,10 - 1,29 30 2 0 60
1,30 - 1,49 35 1 1 70
1,50 - 1,69 40 0 2 80
1,70 - 1,89 45 3 0 90
1,90 - 2,09 50 2 1 100
2,10 - 2,29 55 1 2 110
≥ 2,30 60 0 3 120
Úroveň 3 redukcie dávky : od 25 mg/m2 do 20 mg/m2
20 mg/m2 < 1,14 20 0 1 40
1,14 – 1,34 25a 2a 1a 50a
1,35 – 1,59 30 2 0 60
1,60 – 1,94 35 1 1 70
1,95 – 2,09 40 0 2 80
2,10 – 2,34 45 3 0 90
≥ 2,35 50 2 1 100
a Pri celkovej dennej dávke 50 mg majú pacienti užiť 1 x 20 mg tabletu ráno a 2 x 15 mg tablety večer.
O
sobitnépopulácie
Porucha funkcie obličiek
Mierna porucha funkcie obličiek (CrCl 60 až 89 ml/min) alebo stredne ťažká porucha funkcie obličiek (CrCl 30 až 59 ml/min)
U pacientov s miernou až stredne ťažkou poruchou funkcie obličiek sa neodporúča žiadna úprava začiatočnej dávky (pozri časti 4.4 a 5.2).
Ťažká porucha funkcie obličiek (CrCl pod 30 ml/min) alebo terminálne štádium ochorenia obličiek
U pacientov s ťažkou poruchou funkcie obličiek alebo terminálnym štádiom ochorenia obličiek sa
podávanie neodporúča, pretože k dispozícii nie sú žiadne údaje, týkajúce sa týchto pacientov (pozri časť 4.4).
Porucha funkcie pečene
Mierna porucha funkcie pečene
U pacientov s miernou poruchou funkcie pečene sa úprava začiatočnej dávky neodporúča.
Stredne ťažká až ťažká porucha funkcie pečene
U pacientov so stredne ťažkou až ťažkou poruchou funkcie pečene sa podávanie neodporúča, pretože
k dispozícii nie sú žiadne údaje, týkajúce sa týchto pacientov (pozri časti 4.4 a 5.2).
Starší ľudia
U pacientov vo veku ≥ 65 rokov nie je potrebná úprava začiatočnej dávky (pozri časti 4.8, 5.1 a 5.2). Údaje o bezpečnosti a účinnosti u pacientov nad 75 rokov sú obmedzené.
Pediatrická populácia
Neexistuje žiadne relevantné použitie Lonsurfu v pediatrickej populácii na indikáciu metastatického kolorektálneho karcinómu.
Rasa
Na základe rasovej príslušnosti pacienta nie je potrebná žiadna úprava začiatočnej dávky (pozri časti
5.1 a 5.2). K dispozícii sú len obmedzené údaje o Lonsurfe u černošských/afroamerických pacientov, ale neexistujú žiadne biologické dôvody, na základe ktorých by sa očakával prípadný rozdiel medzi touto podskupinou a celkovou populáciou.
Spôsobpodávania
Lonsurf je určený na perorálne použitie. Tablety sa musia zapiť pohárom vody do 1 hodiny po
raňajkách a večeri.
4.3 Kontraindikácie
Precitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Supresiakostnej drene
Lonsurf spôsoboval zvýšenie výskytu myelosupresie vrátane anémie, neutropénie, leukopénie a
trombocytopénie.
Pred začiatkom liečby, a podľa potreby na sledovanie toxicity sa musí vyšetriť kompletný krvný obraz, minimálne však pred každým liečebným cyklom.
Liečba sa nesmie začať, ak absolútny počet neutrofilov je < 1,5 109/l, počty trombocytov sú < 75
109/l, alebo ak má pacient nevyriešenú nehematologickú klinicky významnú toxicitu 3. alebo 4.
stupňa z predchádzajúcich terapií.
Počas liečby Lonsurfom boli hlásené závažné infekcie (pozri časť 4.8). Keďže väčšina bola hlásená v súvislosti so supresiou kostnej drene, má sa stav pacienta dôsledne sledovať a keď je klinicky indikované, majú sa vykonať vhodné opatrenia, ako je podávanie antimikrobiálnych látok a faktoru stimulujúceho kolónie granulocytov (G-CSF). V štúdii RECOURSE dostávalo G-CSF 9,4 % pacientov v skupine s Lonsurfom hlavne v terapeutickej indikácii.
Gastrointestinálna toxicita
Lonsurf spôsobil zvýšený výskyt gastrointestinálnej toxicity, vrátane nauzey, vracania a hnačky.
Pacienti s nauzeou, vracaním, hnačkou a inými gastrointestinálnymi toxicitami majú byť starostlivo sledovaní a keď je to klinicky indikované, majú sa im podávať antiemetiká, antidiaroiká alebo sa majú vykonať iné opatrenia, ako je liečba náhradou tekutín/elektrolytov. Podľa potreby sa má dávka upraviť (oddialenie a/alebo zníženie) (pozri časť 4.2).
Porucha funkcie obličiek
Použitie Lonsurfu sa neodporúča u pacientov s ťažkou poruchou funkcie obličiek alebo s terminálnym
štádiom ochorenia obličiek (klírens kreatinínu [CrCl] < 30 ml/min alebo potreba dialýzy, v uvedenom poradí), pretože u týchto pacientov sa Lonsurf neskúmal (pozri časť 5.2).
Pacienti so stredne ťažkou poruchou funkcie obličiek CrCl = 30 až 59 ml/min) majú vyšší výskyt
(definovaný ako rozdiel aspoň 5 %) nežiaducich udalostí (adverse events, AEs) ≥ 3. stupňa, závažných
AEs, ako aj oddialení a znížení dávky v porovnaní s pacientmi s normálnou funkciou obličiek
(CrCl ≥ 90 ml/min) alebo s miernou poruchou funkcie obličiek (CrCl = 60 až 89 ml/min). Okrem toho sa u pacientov so stredne ťažkou poruchou funkcie obličiek pozorovala vyššia expozícia trifluridínu a tipiracilu v porovnaní s pacientmi s normálnou funkciou obličiek alebo s miernou poruchou funkcie obličiek (pozri časť 5.2). Pacienti so stredne ťažkou poruchou obličiek majú byť monitorovaní častejšie kvôli hematologickej toxicite.
Poruchafunkciepečene
Lonsurf sa neodporúča používať u pacientov so stredne ťažkou alebo ťažkou poruchou funkcie pečene
(skupina C a D podľa kritérií Národného inštitútu pre rakovinu - National Cancer Institute [NCI]), pretože Lonsurf sa u týchto pacientov neskúmal (pozri časť 5.2).
Proteinúria
Pred začatím liečby a počas nej sa odporúča sledovanie proteinúrie pomocou analýzy moču (pozri časť
4.8).
Laktózováintolerancia
Lonsurf obsahuje laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie,
lapónského deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie
In vitro štúdie preukázali, že trifluridín, tipiracilhydrochlorid a 5-[trifluorometyl] uracil (FTY) neinhibujú aktivitu izoforiem ľudského cytochrómu P450 (CYP). Hodnotenie in vitro preukázalo, že trifluridín a FTY nemajú indukčný vplyv na ľudské izoformy CYP (pozri časť 5.2).
Indukčný vplyv tipiracilu na ľudské CYP izoformy nemožno vylúčiť.
In vitro štúdie preukázali, že trifluridín je substrát pre nukleozidové transportéry CNT1, ENT1 a ENT2. Preto je potrebná opatrnosť pri používaní liekov, ktoré sa vzájomne ovplyvňujú s týmito transportérmi. Tipiracil hydrochlorid bol substrát pre OCT2 a MATE1, preto sa pri súbežnom podávaní Lonsurfu s inhibítormi OCT2 alebo MATE1 môže jeho koncentrácia zvýšiť.
Opatrnosť sa vyžaduje pri používaní liekov, ktoré sú substrátmi ľudskej tymidínkinázy, napr. zidovudín. Ak sa takéto lieky používajú súbežne s Lonsurfom, môžu súťažiť s efektorom, trifluridínom, o aktiváciu tymidínkinázou. Preto, ak sa používajú antivirotiká, ktoré sú substrátmi ľudskej tymidínkinázy, je potrebné monitorovať možný pokles účinnosti antivirotika a zvážiť zmenu na alternatívny antivírusový liek, ktorý nie je substrátom ľudskej tymidínkinázy, ako je lamivudín, zalcitabín, didanozín a abakavir (pozri časť 5.1).
Nie je známe, či môže Lonsurf znižovať účinnosť hormónovej antikoncepcie. Preto musia ženy užívajúce hormónovú antikoncepciu používať aj bariérovú metódu antikoncepcie.
4.6 Fertilita, gravidita a laktácia
Ženy vofertilnomveku/ Antikoncepciaumužovažien
Na základe zistení u zvierat môže trifluridín podávaný gravidným ženám spôsobiť poškodenie plodu.
Počas užívania lieku Lonsurf a 6 mesiacov po ukončení liečby ženy nemajú otehotnieť. Preto musia ženy vo fertilnom veku, počas užívania lieku Lonsurf a 6 mesiacov po ukončení liečby používať
vysoko účinné antikoncepčné metódy. V súčasnosti nie je známe, či môže Lonsurf znižovať účinnosť
hormónovej antikoncecie, a preto majú ženy, ktoré užívajú hormónovú antikoncepciu, používať aj bariérovú antikoncepčnú metódu.
Muži, ktorých partnerka je vo fertilnom veku musia používať účinnú antikoncepciu počas liečby a 6
mesiacov po jej ukončení.
Gravidita
Nie sú k dispozícii údaje o použití Lonsurfu u gravidných žien. Na základe mechanizmu účinku
trifluridínu existuje podozrenie, že ak je podávaný počas gravidity, môže spôsobovať vrodené chyby. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Lonsurf sa nemá používať počas
gravidity, pokiaľ klinický stav ženy nevyžaduje liečbu Lonsurfom.
Dojčenie
Nie je známe, či sú Lonsurf alebo jeho metabolity vylučované do materského mlieka u ľudí. Štúdie na
zvieratách preukázali vylučovanie trifluridínu, tipiracilhydrochloridu a/alebo ich metabolitov do mlieka (pozri časť 5.3). Riziko pre dojča nemožno vylúčiť. Počas liečby Lonsurfom sa má dojčenie prerušiť.
Fertilita
Nie sú dostupné údaje o účinkoch Lonsurfu na fertilitu u ľudí. Výsledky štúdií na zvieratách
nepreukázali účinok Lonsurfu na fertilitu žien a mužov (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Lonsurf má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Počas liečby sa môže vyskytnúť únava, závrat alebo celková nevoľnosť (pozri časť 4.8).
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilu
Najzávažnejšie pozorované nežiaduce účinky u pacientov užívajúcich Lonsurf sú supresia kostnej drene a gastrointestinálna toxicita (pozri časť 4.4).
Najčastejšie pozorované nežiaduce účinky u pacientov užívajúcich Lonsurf (≥ 30 %) sú neutropénia (54 % [35 % ≥ stupeň 3]), nauzea (39 % [1 % ≥ stupeň 3]), únava (35 % [4 % ≥ stupeň 3]), anémia (32 % [13 % ≥ stupeň 3]) a leukopénia (31 % [12 % ≥ stupeň 3]).
Najčastejšie nežiaduce účinky u pacientov užívajúcich Lonsurf, ktoré viedli k ukončeniu liečby, zníženiu dávky, oddialeniu dávky alebo prerušeniu liečby boli neutropénia, celkové zhoršenie zdravotného stavu, anémia, febrilná neutropénia, únava, hnačka a dyspnoe.
Tabuľkovýzoznam nežiaducich účinkov lieku
Nežiaduce účinky pozorované v placebom kontrolovanom klinickom skúšaní fázy III (RECOURSE)
u 533 pacientov s metastatickým kolorektálnym karcinómom, liečených Lonsurfom so začiatočnou dávkou 35 mg/m2/dávku, sú uvedené v tabuľke 5. Sú klasifikované podľa tried orgánových systémov (System Organ Class - SOC) a na opis určitej reakcie na liek a jej synoným a súvisiacich stavov je použitý medzinárodný štandardný terminologický slovník MedDRA (Medical Dictionary for Regulatory).
Nežiaduce účinky sú rozdelené do skupín podľa ich frekvencie. Skupiny frekvencií sú definované podľa nasledovnej konvencie: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); a menej časté (≥1/1 000 až < 1/100).
V každej skupine frekvencie sú nežiaduce účinky uvedené v poradí podľa klesajúcej závažnosti.
Tabuľka 5 – Nežiaduce účinky lieku hlásené u pacientov s metastatickým kolorektálnym karcinómom liečených Lonsurfom vo fáze III klinického skúšania (RECOURSE)
Trieda orgánových
systémov
(MedDRA)a
Veľmi časté Časté Menej časté
Infekcie a nákazy Infekcia dolných dýchacích ciest Infekcia horných dýchacích ciest
Benígne a malígne nádory vrátane nešpecifikovaných novotvarov (cysty a polypy)
Septický šokb Infekčná enteritída Infekcia pľúc
Infekcia žlčových ciest
Chrípka
Infekcia močových ciest
Infekcia ďasien
Herpes zoster
Plesňová infekcia nôh (Tinea Pedis) Kandidóza
Bakteriálna infekcia
Infekcia
Nádorová bolesť
Poruchy krvi a
Neutropénia
Febrilná neutropénia
Pancytopénia
lymfatického systému Leukopénia Anémia Trombocytopénia
Lymfopénia
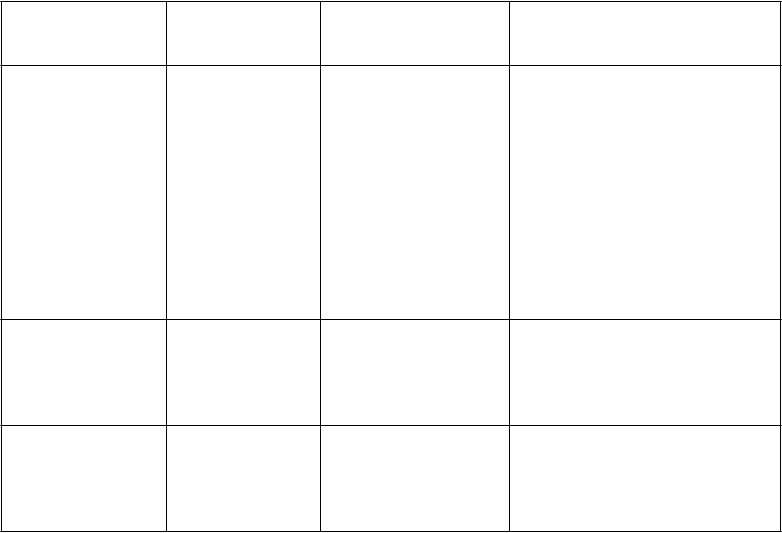
Monocytóza
Granulocytopénia Monocytopénia Erytropénia Leukocytóza
Trieda orgánových systémov (MedDRA)a
Veľmi časté Časté Menej časté
Poruchy metabolizmu Znížená chuť do
Hypoalbuminémia Dehydratácia
a výživy
jedla
Hyperglykémia Hyperkaliémia Hypokaliémia Hypofosfatiémia Hypernatriémia Hyponatriémia Hypokalciémia Dna
Psychické poruchy Insomnia Úzkosť
Poruchy nervového systému
Dysgeúzia
Periférna neuropatia
Závrat
Bolesť hlavy
Neurotoxicita Dyzestézia Hyperestézia Hypestézia Synkopa Parestézia Pocit pálenia Letargia
Poruchy oka Znížená ostrosť videnia Rozmazané videnie Diplopia
Katarakta
Konjunktivitída
Suché oko
Poruchy ucha a labyrintu Poruchy srdca a
srdcovej činnosti
Vertigo
Ušný diskomfort
Angína pektoris Arytmia Palpitácie
Poruchy ciev Začervenanie Embólia
Hypertenzia
Hypotenzia
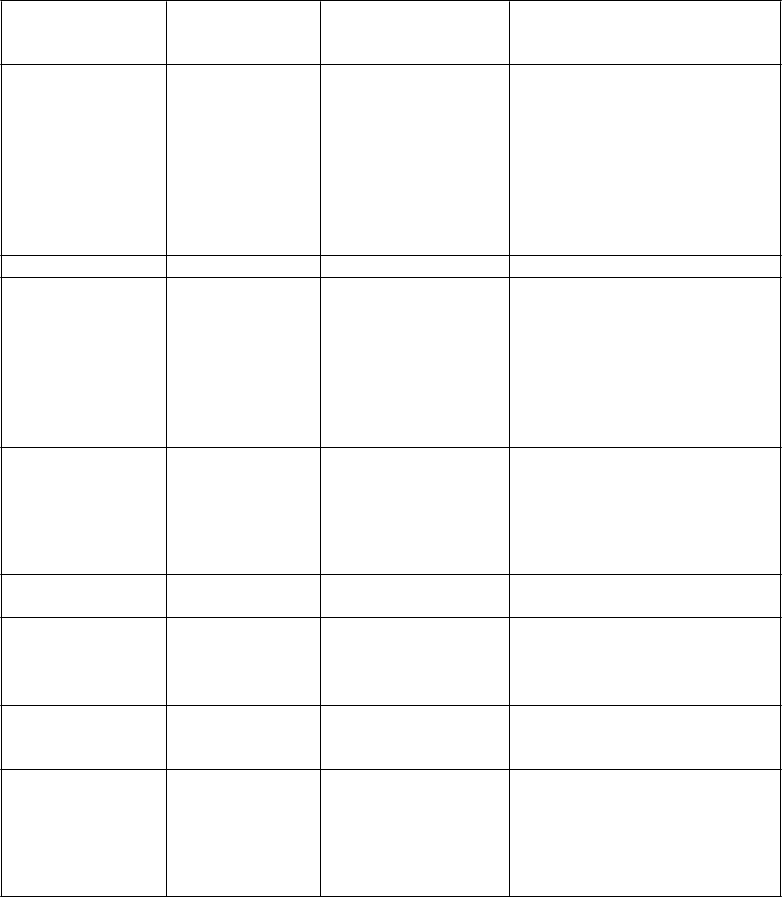
Poruchy dýchacej sústavy, hrudníka a mediastína
Dyspnoe
Kašeľ
Pľúcna embólia Pleurálny výpotok Rinorea
Dysfónia
Orofaryngeálna bolesť
Epistaxa
Trieda orgánových systémov (MedDRA)a
Veľmi časté Časté Menej časté
Poruchy gastrointestinálneho traktu
Hnačka Nauzea Vracanie
Bolesť brucha Zápcha Stomatitída
Porucha v ústnej dutine
Hemoragická enterokolitída Krvácanie do tráviaceho traktu Akútna pankreatitída
Ascites
Ileus Subileus Kolitída Gastritída
Refluxná gastritída
Ezofagitída
Porucha vyprázdňovania žalúdka
Abdominálna distenzia Zápal konečníka Ulcerácie v ústach Dyspepsia
Gastroezofageálna refluxná choroba
Proktalgia Bukálny polyp Krvácanie ďasien Glositída
Ochorenie parodontu
Ochorenia zubov Napínanie na vracanie Flatulencia
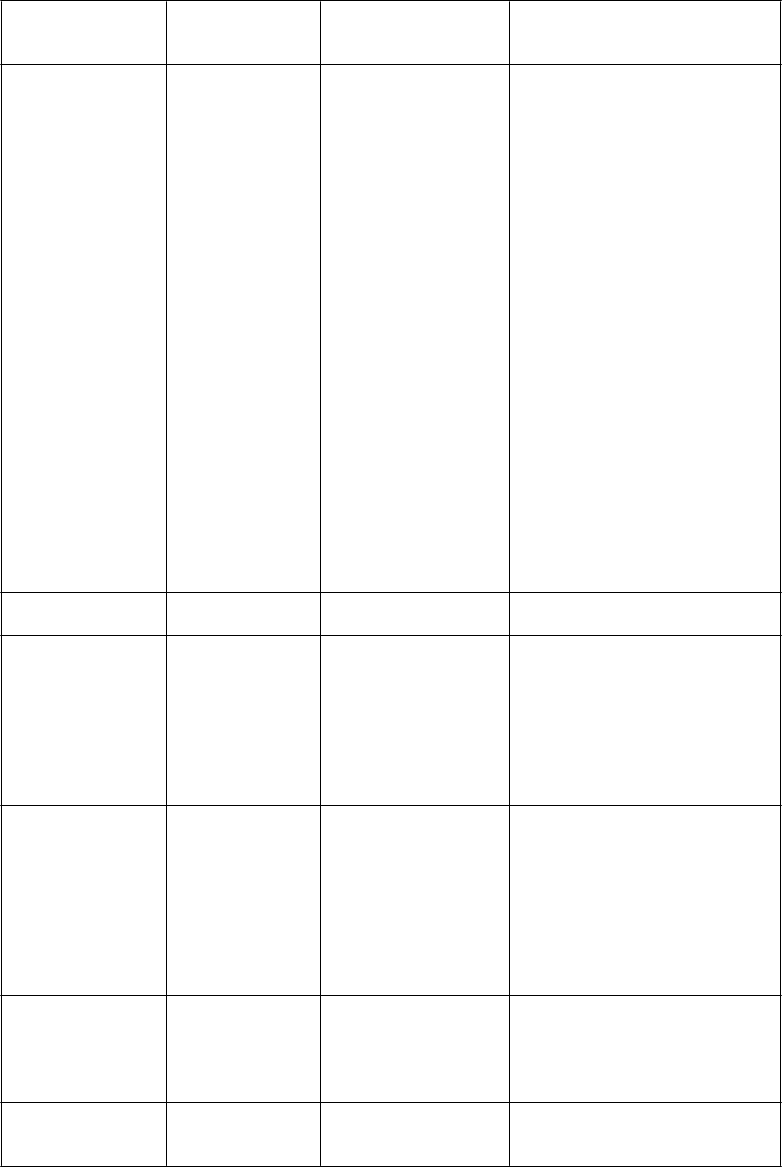
Zápach z úst
Poruchy pečene a žlčových ciest
Hyperbilirubinémia Hepatotoxicita
Biliárna dilatácia
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Syndróm palmárno- plantárnej Erytrodyzestéziec Vyrážka
Alopécia
Svrbenie
Suchá koža
Odlupovanie kože Urtikária Fotosenzitívna reakcia Erytém
Akné
Hyperhidróza
Pľuzgier
Porucha nechtov
Opuch kĺbov Artralgia Bolesť kostí Myalgia
Muskuloskeletálna bolesť
Svalová slabosť Svalové spazmy Bolesť končatín Pocit ťažoby
Poruchy obličiek a močových ciest
Poruchy reprodukčného systému a prsníkov
Proteinúria Zlyhanie obličiek Neinfekčná cystitída Poruchy močenia Hematúria Leukocytúria
Porucha menštruačného cyklu
Trieda orgánových systémov (MedDRA)a
Veľmi časté Časté Menej časté
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Únava Pyrexia
Edém
Zápal sliznice
Celková nevoľnosť
Zvýšenie pečeňových enzýmov
Zvýšenie alkalickej fosfatázy v krvi
Zhoršenie celkového fyzického zdravia
Bolesť
Pocit zmeny telesnej teploty
Xeróza
Zvýšenie kreatinínu v krvi Predĺžený QT interval elektrokardiogramu Zvýšený medzinárodný

Pokles telesnej hmotnosti normalizovaný pomer (INR)
Predĺžený aktivovaný parciálny tromboplastínový čas
Zvýšenie močoviny v krvi
Zvýšenie laktátdehydrogenázy v krvi
Pokles celkových bielkovín
Zvýšený C-reaktívny proteín
Znížený hematokrit
a. Rôzne termíny preferované MedDRA, ktoré boli považované za klinicky podobné, boli zlúčené do jedného termínu.
b. Hlásené boli fatálne prípady. c. Kožná reakcia ruka-noha.
Starší ľudiaPacienti vo veku 65 rokov alebo starší, ktorí užívali Lonsurf, mali v porovnaní s pacientmi mladšími
ako 65 rokov vyšší výskyt nasledujúcich udalostí: neutropénia stupňa 3 alebo 4 (48 % vs 30 %), anémia stupňa 3 (26 % vs 12 %), leukopénia stupňa 3 alebo 4 (26 % vs 18 %) a trombocytopénia
stupňa 3 alebo 4 (9 % vs 2 %).
InfekcieVo fáze III klinického skúšania (RECOURSE) sa infekcie súvisiace s liečbou vyskytli častejšie u
pacientov liečených Lonsurfom (5,6%) v porovnaní s tými, ktorí dostávali placebo (1,9%).
Proteinúria
V klinickom skúšaní RECOURSE sa proteinúria súvisiaca s liečbou vyskytovala častejšie u pacientov
liečených Lonsurfom (2,8%) v porovnaní s tými, ktorí dostávali placebo (1,5%), pričom všetky boli stupňa závažnosti 1 alebo 2 (pozri časť 4.4).
RádioterapiaV štúdii RECOURSE bol u pacientov, ktorí predtým podstúpili rádioterapiu, mierne vyšší výskyt
celkových hematologických a s myelosupresiou súviacich nežiaducich účinkov v porovnaní s pacientmi bez predchádzajúcej rádioterapie (54,6% verzus 49,2%), febrilná neutropénia bola vyššia u
pacientov užívajúcich Lonsurf, ktorí predtým podstúpili rádioterapiu oproti tým, ktorí ju nepodstúpili.
Post-marketingové skúsenosti u pacientov s neoperovateľným pokročilým alebo rekurentnýmkolorektálnymkarcinómomPo uvedení lieku na trh v Japonsku sa u pacientov, užívajúcich Lonsurf, zaznamenali prípady
intersticiálneho ochorenie pľúc.
H
l
ásenie
podozrení na
nežiaduce
r
eakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hláseniauvedeného
v
Prílohe V.4.9 Predávkovanie
Najvyššia dávka Lonsurfu podávaná v klinických skúšaniach bola 180 mg/m2 denne.
Nežiaduce účinky, súvisiace s predávkovaním, boli zhodné s tými, ktoré sú uvedené v bezpečnostnom profile.
Primárnou očakávanou komplikáciou predávkovania je supresia kostnej drene. Na predávkovanie Lonsurfom nie je známe žiadne antidotum.
Manažment liečby predávkovania má zahŕňať bežnú liečebnú a podpornú intervenciu, zameranú na úpravu klinických prejavov a prevenciu ich možných komplikácií.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antineoplastiká, antimetabolity, ATC kód: L01BC59
MechanizmusúčinkuLonsurf obsahuje antineoplastický nukleozidový analóg založený na tymidíne, trifluridín a inhibítor
tymidínfosforylázy (TPáza), tipiracilhydrochlorid v molárnom pomere 1:0,5 (hmotnostný pomer
1:0,471).
Po vychytaní nádorovými bunkami je trifluridín fosforylovaný tymidínkinázou, ďalej v bunkách metabolizovaný na substrát kyseliny deoxyribonukleovej DNA, a je priamo inkorporovaný do DNA, čím narúša funkciu DNA a bráni proliferácii bunky.
Trifluridín je však rýchlo degradovaný TPázou a po perorálnom podaní sa ihneď metabolizuje efektom prvého (first-pass) prechodu a preto je do zloženia pridaný inhibítor TPázy, tipiracilhydrochlorid.
V predklinických štúdiách trifluridín/tipiracilhydrochlorid preukázali protinádorovú aktivitu proti bunkovým líniám kolorektálneho karcinómu senzitívnym, aj rezistentným voči 5-fluorouracil (5-FU) .
Cytotoxická aktivita kombinácie trifluridín/tipiracilhydrochlorid proti niekoľkým ľudským nádorovým xenoimplantátom vysoko korelovala s množstvom trifluridínu inkorporovaného do DNA, čo
naznačuje, že sa jedná o primárny mechanizmus účinku.
FarmakodynamickéúčinkyLonsurf nemal klinicky významný vplyv na prolongáciu QT/QTc v porovnaní s placebom v otvorenej
štúdii u pacientov s pokročilými solidnými tumormi.
Klinickáúčinnosť abezpečnosťKlinická účinnosť a bezpečnosť Lonsurfu bola hodnotená v medzinárodnej randomizovanej dvojito
zaslepenej placebom kontrolovanej štúdii fázy III (RECOURSE) u pacientov, ktorí už boli liečení na metastatický kolorektálny karcinóm. Primárnym cieľovým parametrom účinnosti bolo celkové
prežívanie (overall survival - OS) a podpornými cieľovými parametrami účinnosti boli prežívanie bez progresie (progression-free survival - PFS), celková miera odpovede (overall response rate - ORR)
a miera kontroly ochorenia (disease control rate - DCR).
Celkovo bolo randomizovaných 800 pacientov v pomere 2:1, ktorí dostávali Lonsurf (N = 534) plus najlepšiu podpornú liečbu (best supportive care - BSC) alebo dostávali placebo (N = 266) plus BSC. Dávkovanie Lonsurfu bolo založené na BSA, pričom začiatočná dávka bola 35 mg/m2/dávku. Liečba v štúdii bola podávaná perorálne dvakrát denne po raňajkách a večeri počas 5 dní v týždni s 2-dňovou prestávkou bez liečby počas 2 týždňov, nasledovaných 14 dňami bez liečby, čo sa opakovalo každé 4 týždne. Pacienti pokračovali v liečbe až do progresie ochorenia alebo neprijateľnej toxicity (pozri časť
4.2).
Z 800 randomizovaných pacientov so strednou hodnotou veku 63 rokov, 61 % bolo mužov, 58 % bolo kaukazskej/bielej rasy, 35 % bolo ázijskej/orientálnej rasy a 1 % bolo černošskej/afroamerickej rasy; všetci pacienti mali východiskový výkonnostný stav (Performance Status - PS) podľa ECOG (Eastern Cooperative Oncology Group) 0 alebo 1. Primárnym miestom ochorenia bolo hrubé črevo (62 %) alebo rektum (38 %). Stav génu KRAS bol pri začlenení do štúdie nemutovaný (49 %) alebo
mutovaný (51 %). Stredný počet predchádzajúcich línií liečby metastatického ochorenia bol 3. Všetci pacienti predtým podstúpili chemoterapiu na báze fluoropyrimidínu, oxaliplatiny a irinotekanu. Všetci
pacienti okrem 1 užívali bevacizumab a všetci okrem 2 pacientov s tumormi nemutovaného
génu KRAS užívali panitumumab alebo cetuximab. Obe liečebné skupiny boli porovnateľné z hľadiska demografických charakteristík a východiskových charakteristík ochorenia.
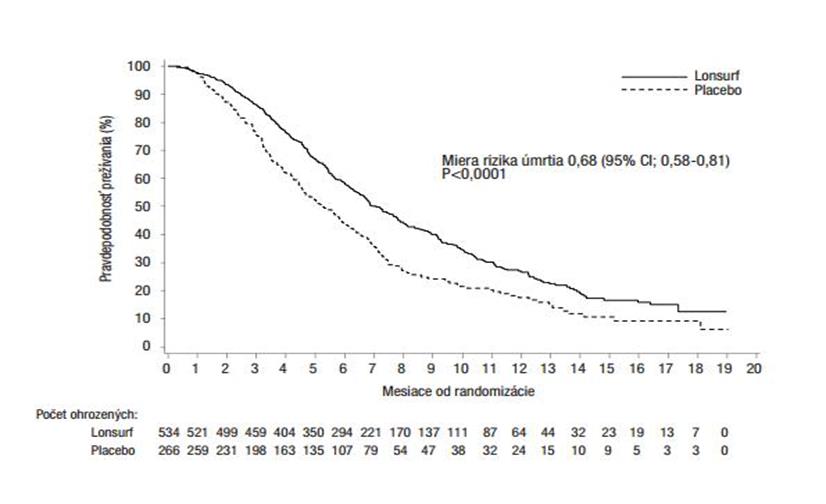
Analýza OS v štúdii vykonaná podľa plánu na 72 % (N = 574) príhod ukázala klinicky a štatisticky významný prínos v prežívaní v skupine Lonsurf plus BSC v porovnaní so skupinou placebo plus BSC (miera rizika: 0,68; 95 % interval spoľahlivosti [IS] [0,58 až 0,81]; p < 0,0001) a strednej hodnote OS
7,1 mesiacov v skupine Lonsurf plus BSC vs 5,3 mesiacov v skupine placebo plus BSC; s 1-ročnou mierou prežitia 26,6 % v skupine Lonsurf plus BSC a 17,6 % v skupine placebo plus BSC. PFS sa
významne zlepšilo u pacientov užívajúcich Lonsurf plus BSC (miera rizika: 0,48; 95 % IS [0,41 až
0,57]; p < 0,0001 (pozri Tabuľku 6, Obrázok 1 a Obrázok 2).
Tabuľka 6: Výsledky účinnosti z fázy III klinického skúšania (RECOURSE)
Celkové prežívanie
Lonsurf plus BSC (N=534)
Placebo plus BSC (N=266)
Počet úmrtí, N (%) 364 (68,2) 210 (78,9) Stredná hodnota OS (mesiace)a [95 % IS]b 7,1 [6,5, 7,8] 5,3 [4,6; 6,0] Miera rizika [95 % IS] 0,68 [0,58; 0,81]
Hodnota Pc < 0,0001 (1-stranná a 2-stranná)
Prežívanie bez progresie
Počet progresií alebo úmrtí, N (%) 472 (88,4) 251 (94,4) Stredná hodnota PFS (mesiace)a [95 % IS]b 2,0 [1,9; 2,1] 1,7 [1,7; 1,8] Miera rizika [95 % IS] 0,48 [0,41; 0,57]
Hodnota Pc <0,0001 (1-stranná a 2-stranná)
a Kaplan-Meierov odhad
b Metóda Brookmeyera a Crowleyho
c Stratifikovaný log-rank test (parametre stratifikácie: KRAS status, čas od diagnostikovania prvej metastázy, oblasť)
Obrázok 1 – Kaplan-Meierove krivky celkového prežívania
Obrázok 2 − Kaplan-Meierove krivky prežívania bez progresie

Aktualizovaná analýza OS vykonaná na 89 % (N = 712) príhod potvrdila klinicky a štatisticky významný prínos v prežívaní v skupine Lonsurf plus BSC v porovnaní so skupinou placebo plus BSC (miera rizika: 0,69; 95 % IS [0,59 až 0,81]; p < 0,0001) a stredná hodnota OS 7,2 mesiacov vs 5,2
mesiacov; miera 1-ročného prežívania bola v skupine Lonsurf plus BSC 27,1 % a v skupine placebo plus BSC 16,6 %.
Prínos pre OS a PFS bol pozorovaný zhodne vo všetkých preddefinovaných podskupinách vrátane rasy, geografickej oblasti, veku (< 65; ≥ 65), pohlavia, ECOG PS, KRAS statusu, času od diagnostikovania prvej metastázy, počtu metastatických miest a miesta primárneho tumoru. Prínos Lonsurfu v prežívaní sa zachoval po úprave všetkých významných prognostických faktorov, konkrétne času od diagnostikovania prvej metastázy, ECOG PS a počtu metastatických miest (miera rizika: 0,69;
95 % IS [0,58 až 0,81]).
Šesťdesiatjeden percent (61 %, N = 485) zo všetkých randomizovaných pacientov užívalo fluoropyrimidín ako súčasť ich poslednej terapie pred randomizáciou, pričom 455 (94 %) z nich v tom čase neodpovedalo na fluoropyrimidín. Medzi týmito pacientmi bol prínos Lonsurfu pre OS
zachovaný (miera rizika: 0,75; 95 % IS [0,59 až 0,94]).
Osemnásť percent (18 %, N = 144) zo všetkých randomizovaných pacientov užívalo pred randomizáciou regorafenib. Medzi týmito pacientmi bol prínos Lonsurfu pre OS zachovaný (miera rizika: 0,69; 95 % IS [0,45 až 1,05]). Účinok bol tiež zachovaný u regorafenibom zatiaľ neliečených pacientov (miera rizika: 0,69; 95 % IS [0,57 až 0,83]).
DCR (úplná odpoveď, alebo čiastočná odpoveď alebo stabilné ochorenie) bola významne vyššia u pacientov liečených Lonsurfom (44 % vs 16 %, p < 0,0001).'
Liečba Lonsurfom plus BSC viedla k štatisticky významnej prolongácii PS <2 v porovnaní s placebom plus BSC. Stredný čas do PS ≥ 2 bol v skupine Lonsurfu 5,7 mesiacov a v skupine placeba 4,0
mesiace, s mierou rizika 0,66 (95 % IS: [0,56; 0,78]), p < 0,0001.
Pediatrickápopulácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Lonsurfom vo
všetkých podskupinách pediatrickej populácie v prípade refraktérneho metastatického kolorektálneho karcinómu (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Starší ľudia
Údaje u pacientov vo veku medzi 75-84 rokov (N=60) sú obmedzené. V štúdii RECOURSE
ani v japonskej štúdii fázy 2 nebol žiadny pacient vo veku 85 rokov alebo starší. Účinok Lonsurfu na celkové prežívanie bol podobný u pacientov vo veku < 65 rokov a ≥ 65 rokov.
5.2 Farmakokinetické vlastnosti
Absorpcia
Po perorálnom podaní Lonsurfu s [14C]-trifluridínom sa minimálne 57 % podaného trifluridínu
absorbovalo a len 3 % dávky boli vylúčené stolicou. Po perorálnom podaní Lonsurfu s [14C]- tipiracilhydrochloridom sa minimálne 27 % podaného tipiracilhydrochloridu absorbovalo a 50 %
dávky celkovej radioaktivity bolo namerané v stolici, čo naznačuje strednú absorpciu tipiracilhydrochloridu v gastrointestinálnom trakte.
Po jednorazovej dávke Lonsurfu (35 mg/m2) pacientom s pokročilými solidnými tumormi bol priemerný čas dosiahnutia maximálnej plazmatickej koncentrácie (tmax) trifluridínu okolo 2 hodín a tipiracilhydrochloridu okolo 3 hodín.
V analýze farmakokinetiky (PK) po viacnásobnom podaní Lonsurfu (35 mg/m2/dávku, dvakrát denne počas 5 dní v týždni s 2-dňovou prestávkou v liečbe, v priebehu 2 týždňov, po ktorých nasledovalo 14- dňové obdobie bez liečby, cyklus opakovaný každé 4 týždne), bola plocha pod krivkou koncentrácie
a času trifluridínu od času 0 do poslednej merateľnej koncentrácie (AUC0-last) približne 3-násobne
vyššia a maximálna koncentrácia (Cmax) bola približne 2-násobne vyššia po viacnásobných dávkach
Lonsurfu (12. deň cyklu 1) ako po jednorazovom podaní (1. deň cyklu 1).
Avšak tipiracilhydrochlorid sa nekumuloval, rovnako ako sa nezaznamenala ďalšia kumulácia trifluridínu v nasledujúcich cykloch podávania Lonsurfu (12. deň cyklu 2 a 3). Po viacnásobných dávkach Lonsurfu (35 mg/m2/dávku dvakrát denne) pacientom s pokročilými solidnými tumormi bol priemerný čas dosiahnutia maximálnej plazmatickej koncentrácie (tmax) trifluridínu 2 hodiny a tipiracilhydrochloridu 3 hodiny.
Prínos tipiracilhydrochloridu
Jednorazové podanie Lonsurfu (35 mg/m2/dávku) zvýšilo priemernú AUC0-last trifluridínu 37-násobne
a Cmax 22-násobne so zníženou variabilitou v porovnaní so samotným trifluridínom (35 mg/m2/dávku).
Vplyv jedla
Keď sa Lonsurf jednorazovo podal v dávke 35 mg/m2 14 pacientom so solidnými tumormi po štandardizovanom vysokokalorickom jedle s vysokým obsahom tukov, plocha pod krivkou koncentrácie a času (AUC) trifluridínu sa nezmenila, ale Cmax trifluridínu a Cmax a AUC tipiracilhydrochloridu klesla o približne 40 % v porovnaní s hodnotami nalačno. V klinických štúdiách sa Lonsurf podával v priebehu 1 hodiny po raňajkách alebo večeri (pozri časť 4.2).
Distribúcia
Väzba trifluridínu na bielkoviny ľudskej plazmy bola viac ako 96 %, pričom sa trifluoridín viazal
hlavne na ľudský sérový albumín. Väzba tipiracilhydrochloridu na bielkoviny plazmy bola menej ako
8 %. Po jednorazovom podaní Lonsurfu (35 mg/m2) pacientom s pokročilými solidnými tumormi bol zjavný distribučný objem (Vd/F) trifluridínu 21 l a tipiracilhydrochloridu 333 l.
Biotransformácia
Trifluridín sa vylučoval hlavne metabolizmom prostredníctvom TPázy za vzniku neaktívneho
metabolitu FTY. Absorbovaný trifluridín sa metabolizoval avylučoval do moču ako FTY
a trifluridínglukuronidové izoméry. Ostatné menšie metabolity 5-karboxyuracil a 5-karboxy-2’- deoxyuridín boli detekované, ale ich hladiny v plazme a moči boli nízke alebo stopové.
Tipiracilhydrochlorid sa nemetabolizoval vo frakcii S9 ľudskej pečene ani v kryoskopicky ošetrených ľudských hepatocytoch. Tipiracilhydrochlorid bol hlavnou zložkou a 6-hydroxymetyluracil bol hlavným metabolitom rovnako v ľudskej plazme, moči a stolici.
Eliminácia
Po viacnásobnom podaní dávky Lonsurfu v odporúčaných dávkach a dávkovacom režime bol
priemerný polčas eliminácie (t1/2) trifluridínu v 1. deň cyklu 1 1,4 hodiny a v 12. deň cyklu 1 2,1 hodiny. Priemerná hodnota t1/2 tipiracilhydrochloridu v 1. deň cyklu 1 bola 2,1 hodiny a v 12. deň cyklu 1 2,4 hodiny.
Po jednorazovom podaní dávky Lonsurfu (35 mg/m2) pacientom s pokročilými solidnými tumormi bol perorálny klírens (CL/F) trifluridínu 10,5 l/hod. a tipiracilhydrochloridu 109 l/hod.,
v danom poradí.
Po jednorazovom perorálnom podaní Lonsurfu s [14C]-trifluridínom bola zaznamenaná celková kumulatívna exkrécia rádioaktivity 60 % podanej dávky. Väčšina zistenej rádioaktivity bola vylúčená
močom (55 % dávky) v priebehu 24 hodín a vylučovanie stolicou a vydychovaným vzduchom bolo menej ako 3 % pre oba spôsoby. Po jednorazovom perorálnom podaní Lonsurfu s [14C]- tipiracilhydrochloridom predstavovala zaznamenaná vylúčená rádioaktivita 77 % dávky, pričom pozostávala z 27 % vylúčených močom a 50 % vylúčených stolicou.
Linearita/nelinearita
V štúdii určovania dávky (15 až 35 mg/m2 dvakrát denne), mala AUC trifluridínu v čase od 0 do 10
hodín (AUC0-10) tendenciu narastať intenzívnejšie ako sa očakávalo na základe zvyšovania dávky; avšak perorálny klírens (CL/F) a zdanlivý distribučný objem (Vd/F) trifluridínu boli vo všeobecnosti konštantné v rozpätí dávok 20 až 35 mg/m2. Ostatné parametre expozície trifluridínu
a tipiracilhydrochloridu sa zdajú byť úmerné dávke.
Farmakokinetikav osobitných populáciách
Vek, pohlavie a rasa
Na základe PK analýzy populácie nie sú vek, pohlavie ani rasa klinicky významnými vplyvmi PK
trifluridínu ani tipiracilhydrochloridu.
Porucha funkcie obličiek
Z 533 patientov v štúdii RECOURSE, ktorí dostávali Lonsurf, malo 306 (57 %) pacientov normálnu funkciu obličiek (CrCl ≥90 ml/min), 178 (33 %) pacientov malo miernu poruchu funkcie obličiek (CrCl 60 až 89 ml/min) a 47 (9 %) malo stredne ťažkú poruchu funkcie obličiek (CrCl 30 až
59 ml/min), pričom u 2 pacientov chýbali údaje. Pacienti s ťažkou poruchou funkcie obličiek neboli začlenení do štúdie.
Na základe PK analýzy populácie, bola expozícia Lonsurfu u pacientov s miernou poruchou funkcie obličiek (CrCl = 60 až 89 ml/min) podobná expozícii u pacientov s normálnou funkciou obličiek (CrCl
≥ 90ml/min). Vyššia expozícia Lonsurfu bola pozorovaná u pacientov so stredne ťažkou poruchou funkcie obličiek (CrCl = 30 až 59 ml/min). Odhadovaný klírens kreatinínu (CrCl) bol významnou
kovariáciou pre CL/F u oboch finálnych modelov trifluridínu a tipiracilhydrochloridu. Priemerný relatívny pomer AUC u pacientov s miernou (n=38) a stredne ťažkou (n=16) poruchou funkcie
obličiek v porovnaní s pacientmi s normálnou funkciou obličiek (n=84) bol pre trifluridín 1,31 (mierna
porucha) a 1,43 (stredne ťažká porucha) a pre tipiracilhydrochlorid 1,34 (mierna porucha) a 1,65 (stredne ťažká porucha). PK trifluridínu a tipiracilhydrochloridu nebola skúmaná u pacientov s ťažkou poruchou funkcie obličiek ani s terminálnym štádiom ochorenia obličiek (pozri časť 4.4).
Porucha funkcie pečene
Na základe PK analýzy populácie neboli parametre funkcie pečene vrátane alkalickej fosfatázy (ALP,
36-2322 U/L), aspartátaminotransferázy (AST, 11-197 U/L), alanínaminotransferázy (ALT, 5-182
U/L) a celkového bilirubínu (0,17-3,20 mg/dl) významnými súvisiacimi premennými pre PK
parametre tak trifluridínu ako ani tipiracilhydrochloridu. PK trifluridínu a tipiracilhydrochloridu nebola skúmaná u pacientov so stredne ťažkou až ťažkou poruchou funkcie pečene (skupina C a D
podľa NCI kritérií) (pozri časť 4.4). Zistilo sa, že sérový albumín značne vplýva na klírens trifluridínu
s negatívnou koreláciou. Pre nízke hodnoty albumínu v rozmedzí od 2,2 až 3,5 g/dl sú príslušné hodnoty klírensu od 4,2 až 3,1 l/h.
Gastrektómia
Vplyv gastrektómie na PK parametre nebolo možné študovať v PK analýze populácie, pretože sa
v sledovanej populácii nachádzalo málo pacientov, ktorí podstúpili gastrektómiu (1 % z celkového počtu).
Interakčnéštúdie invitro
Trifluridín je substrátom TPázy, ale nemetabolizuje sa cytochrómom P450 (CYP).
Tipiracilhydrochlorid sa nemetabolizuje ani frakciou S9 ľudskej pečene ani kryoskopicky ošetrenými hepatocytmi.
In vitro štúdie preukázali, že trifluridín, tipiracilhydrochlorid a FTY (inaktívny metabolit trifluridínu) neinhibovali testované izoformy CYP (CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 a CYP3A4/5). In vitro hodnotenie preukázalo, že trifluridín a FTY neindukujú ľudský CYP1A2, CYP2B6 ani CYP3A4/5. Preto sa nepredpokladá, že by trifluridín spôsoboval alebo bol predmetom významnej liekovej interakcie sprostredkovanej CYP. Indukčný vplyv tipiracilu na ľudské izoformy CYP nemožno vylúčiť.
Trifluridín a tipiracilhydrochlorid boli hodnotené in vitro použitím ľudských transportérov vychytávania a efluxových transportérov (trifluridín s MDR1, OATP1B1, OATP1B3 a BCRP; tipiracilhydrochlorid s OAT1, OAT3, OCT2, MATE1, MDR1 a BCRP). Na základe in vitro štúdií neboli ani trifluridín ani tipiracilhydrochlorid inhibítormi, ani neboli substrátom pre ľudské transportéry vychytávania a efluxu okrem OCT2 a MATE1. Tipiracilhydrochlorid bol inhibítorom OCT2 a MATE1 in vitro, ale pri výrazne vyšších koncentráciách ako je ľudská plazmatická Cmax
v rovnovážnom stave. Preto je nepravdepodobné, že by interagovali s inými liekmi v odporúčaných dávkach v dôsledku inhibície OCT2 a MATE1. Transport tipiracilhydrochloridu prostredníctvom
OCT2 a MATE1 môže byť ovplyvnený v prípade, ak je Lonsurf podávaný súčasne s inhibítormi
OCT2 a MATE1.
Farmakokinetický/farmakodynamickývzťah
Účinnosť a bezpečnosť lieku Lonsurf bola porovnávaná medzi skupinami s vysokou expozíciou
(> stredná hodnota) a s nízkou expozíciou (≤ stredná hodnota) na základe strednej hodnoty trifluridínu AUC. OS sa javila priaznivejšie v skupine s vysokou AUC v porovnaní so skupinou s nízkou AUC (stredná hodnota OS 9,3 vs. 8,1 mesiacov). Počas obdobia sledovania mali všetky skupiny AUC lepšie výsledky než skupina s placebom. Výskyt neutropénie stupňa ≥ 3 bol vyšší v skupine AUC s vysokou dávkou trifluridínu (47,8%) v porovnaní so skupinou AUC s nízkou dávkou trifluridínu (30,4%).
5.3 Predklinické údaje o bezpečnosti
Toxicitaopakovaných dávok
Toxikologické hodnotenie trifluridínu/tipiracilhydrochloridu sa vykonávalo na potkanoch, psoch a
opiciach. Zistilo sa, že cieľovými orgánmi sú lymfatický a hematopoetický systém a gastrointestinálny trakt. Všetky zmeny, t.j. leukopénia, anémia, hypoplázia kostnej drene, atrofické zmeny
v lymfatických a hematopoetických tkanivách a gastrointestinálnom trakte, boli reverzibilné do 9
týždňov po vysadení lieku. U potkanov, ktorým bol podávaný trifluridín/tipiracilhydrochlorid bolo pozorované zosvetlenie, lámavosť a maloklúzia zubov, čo sa považuje za špecifické pre hlodavce a nie
je relevantné u ľudí.
Karcinogenitaamutagenita
Nevykonali sa žiadne dlhodobé štúdie hodnotiace karcinogénny potenciál
trifluridínu/tipiracilhydrochloridu u zvierat. V teste reverzných mutácií na baktériách, teste chromozomálnych aberácií na bunkových kultúrach cicavcov a mikronukleárnom teste na myšiach sa
ukázalo, že trifluridín je genotoxický. Preto sa s Lonsurfom má zaobchádzať ako s potenciálnym
karcinogénom.
Reprodukčná toxicita
Výsledky štúdií na zvieratách nepreukázali vplyv trifluridínu a tipiracilhydrochloridu na samčiu
a samičiu fertilitu potkanov. Zvýšenie počtu žltých teliesok a zahniezdených embryí pozorované
u samíc potkanov pri vysokých dávkach sa nepovažovalo za nežiaduce (pozri časť 4.6). Ukázalo sa, že Lonsurf spôsobuje embryofetálnu letalitu a embryofetálnu toxicitu u gravidných potkanov v dávkach nižších ako je klinická expozícia. Nevykonali sa žiadne štúdie peri/post-natálnej vývojovej toxicity.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tabliet
monohydrát laktózy
predželatinovaný škrob (kukuričný)
kyselina stearová
Filmový obal
Lonsurf 15 mg/ 6,14 mg filmom obalené tablety
hypromelóza
makrogol (8000)
oxid titaničitý (E171)
magnéziumstearát
Lonsurf 20 mg/ 8,19 mg filmom obalené tablety
hypromelóza
makrogol (8000)
oxid titaničitý (E171)
červený oxid železitý (E172)
magnéziumstearát
Potlačový atrament
šelak
červený oxid železitý (E172)
žltý oxid železitý (E172)
oxid titaničitý (E171)
hlinitý lak indigokarmínu (E132) Karnaubský vosk
Mastenec
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
30 mesiacov
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
ALU/ALU blister s vrstveným vysušovadlom obsahujúci 10 tabliet. Každé balenie obsahuje 20, 40 alebo 60 filmom obalených tabliet. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Po manipulácii s tabletami je potrebné umyť si ruky.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Les Laboratoires Servier
50 rue Carnot
92284 Suresnes Cedex
Francúzsko
8. REGISTRAČNÉ ČÍSLA
EU/1/16/1096/001-006
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
MM/YYYY Podrobné informácie o tomto lieku sú dostupné na webovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.