a>
Spôsob podávania
Cesta podania: transdermálne použitie
Kde aplikovať náplasťNáplasť sa má nalepiť iba na niektoré z nasledujúcich aplikačných oblastí (pozri obrázok nižšie): brucho, zadok, vonkajšia časť nadlaktia.
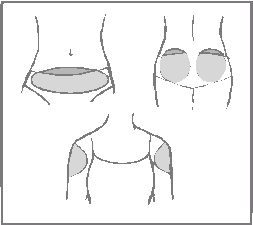
Treba sa vyhnúť tým oblastiam, kde by mohlo dôjsť k odlepeniu náplasti odieraním (napríklad opaskom šiat).
Náplasť sa má nalepiť na čistú, suchú, neporušenú, zdravú pokožku, najlepšie bez ochlpenia.
apleek sa nemá lepiť na pokožku, ktorá je mastná, začervenaná, podráždená, porezaná alebo inak poškodená.
Náplasti sa nesmú lepiť na prsníky.
Aby sa zabránilo narušeniu adhéznych vlastností apleeku, nemajú sa na oblasť pokožky, kde je apleek umiestnený alebo kde sa bude umiestňovať, aplikovať žiadne mejkapy, krémy, telové mlieka, púdre a ani iné topické prostriedky.
Miesta aplikácie sa majú meniť. To možno dosiahnuť lepením náplasti na rôzne miesta v rovnakej oblasti aplikácie. Žena môže zmeniť miesto aplikácie napríklad z ľavej na pravú stranu brucha alebo zadku alebo z ľavého na pravé nadlaktie.
Žena tiež môže používať inú oblasť aplikácie každý týždeň (napríklad jeden týždeň vonkajšie nadlaktie, nasledujúci týždeň brucho).
Žena má každý deň vizuálne kontrolovať náplasť, aby sa zaručilo, že je stále riadne nalepená.
Poznámka· Nalepená má byť vždy len jedna náplasť.
· Ak sa náplasť nalepí správne, žena sa môže kúpať alebo sprchovať ako zvyčajne.
· Transparentná náplasť je chránená pred ultrafialovým žiarením a slnečným svetlom, preto ju možno vystaviť slnečnému svetlu a nemusí zostať zahalená odevom.
V prípade podráždenia pokožkyAk má používanie náplasti za následok nepríjemné podráždenie v mieste jej aplikácie, má sa náplasť odstrániť a nová náplasť sa má nalepiť na iné miesto. Táto náplasť sa bude používať až do nasledujúceho naplánovaného „dňa výmeny náplasti“.
Ako pripraviť náplasť na aplikáciu
apleek sa dodáva v škatuľke, ktorá obsahuje nasledujúce: brožúru spolu s 3 alebo 9 alebo 18 zalepenými vreckami, z ktorých každé obsahuje jednu transdermálnu náplasť apleek.
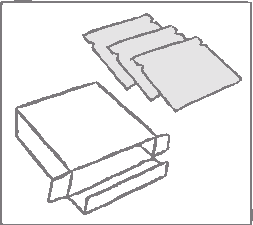
Náplasť je okrúhla a transparentná
Lepiaca strana náplasti je pokrytá dvojdielnou štvorcovou lesklou čírou ochrannou fóliou. Táto fólia chráni lepiacu stranu, ktorá obsahuje liečivá. Tiež zaručuje, že lepiaci povrch zostane neporušený až do aplikácie.
Na opačnej strane je náplasť prekrytá jednodielnou mliečne bielou štvorcovou krycou fóliou, ktorá zabraňuje prilepeniu náplasti vo vnútri vrecka.

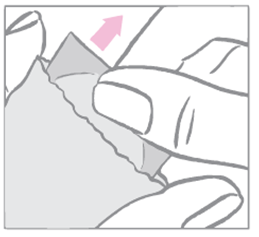
Žena musí roztrhnúť vrecko prstami pozdĺž jeho hornej strany. Správne roztrhnutie uľahčia zárezy.
Žena by nemala používať nožnice, ani náplasť strihať, poškodiť a ani inak upravovať, pretože to môže znížiť antikoncepčný účinok.

Okrúhla antikoncepčná náplasť je vložená medzi dvojdielnou štvorcovou lesklou čírou ochrannou fóliou a jednodielnou mliečne bielou štvorcovou krycou fóliou. Je dôležité vybrať náplasť z vrecka spolu s čírou ochrannou fóliou aj jednodielnou mliečne bielou krycou fóliou. Vrecko sa nemá zlikvidovať. Má sa odložiť na likvidáciu náplasti po jej použití.
Náplasť sa aplikuje okamžite po otvorení vrecka podľa nasledovného postupu:
Najskôr sa odstráni jednodielna mliečne biela štvorcová krycia fólia z hornej strany náplasti.
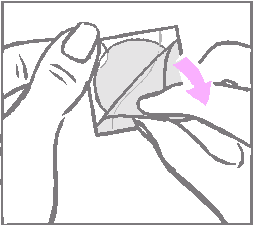
Jednodielna mliečne biela štvorcová krycia fólia, ktorá zabraňuje prilepeniu náplasti vo vnútri vrecka, sa má po odstránení z náplasti zlikvidovať.
Potom sa odstráni polovica dvojdielnej, štvorcovej lesklej čírej ochrannej fólie, ktorá zakrýva spodnú (lepiacu) stranu okrúhlej transparentnej náplasti. (Lepiaca strana obsahuje liečivá.) Treba sa vyhnúť dotyku lepiaceho povrchu náplasti, aby sa zachovala jej lepivosť.
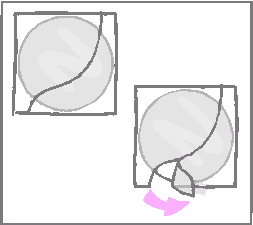
Pri umiestňovaní náplasti na miesto na pokožke, kde má byť nalepená, sa má náplasť držať za okraj, ktorý je stále prekrytý druhou polovicou ochrannej fólie.
Po opatrnom nalepení polovice náplasti na miesto aplikácie treba odstrániť druhú polovicu ochrannej fólie.
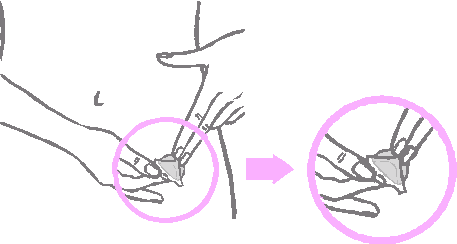
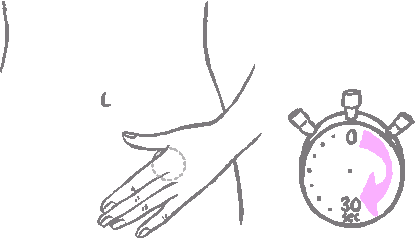
Náplasť sa má pevne pritlačiť dlaňou ruky počas 30 sekúnd a presvedčiť sa, že okraje náplasti sú dobre nalepené.
Poznámka: Vrecko sa nemá zlikvidovať, pretože bude potrebné na likvidáciu náplasti po jej použití.
Pozri časť 6.6.
Postup v prípade odlepenia, zabudnutia na výmenu alebo nevymenenia náplastí
Postup v prípade odchýlok aplikácie náplasti je založený na nasledujúcom pravidle:
Na dostatočné potlačenie hypotalamo-hypofyzárno-ovariárnej osi, ako základného predpokladu antikoncepčnej účinnosti, je potrebných najmenej 7 za sebou nasledujúcich dní so správne aplikovanou náplasťou.
· Ak je náplasť čiastočne alebo úplne odlepená
menej ako jeden deň (do 24 hodín):Žena sa má ihneď pokúsiť znova ju nalepiť na rovnaké miesto alebo vymeniť za novú náplasť. Nie je potrebná žiadna záložná antikoncepcia. „Deň výmeny náplasti“ zostane rovnaký.
viac ako jeden deň (24 hodín alebo viac),alebo ak si žena nie je istá, ako dlho bola náplasť odlepená:NEMUSÍ BYŤ CHRÁNENÁ PRED GRAVIDITOU. Musí okamžite ukončiť aktuálny antikoncepčný cyklus a začať nový cyklus aplikovaním novej náplasti. Toto je teraz nový „1. deň“ a nový „deň výmeny náplasti“. Počas prvého týždňa nového cyklu sa musí používať náhradná antikoncepcia, ako napríklad kondómy, spermicídne prostriedky alebo pesar.
Náplasť sa nemá aplikovať znova, ak už nelepí, ak sa zlepila alebo prilepila k inému povrchu, ak sa k nej prilepil iný materiál alebo ak sa predtým uvoľnila alebo odpadla. Ak náplasť nemožno znova nalepiť, okamžite sa má aplikovať nová náplasť. Na nalepenie apleeku na miesto aplikácie sa nesmú používať pomocné lepidlá ani obväzy.
· Ak žena zabudne vymeniť náplasť
na začiatku ľubovoľného cyklu náplasti (prvý týždeň/1. deň):NEMUSÍ BYŤ CHRÁNENÁ PRED GRAVIDITOU. Hneď, ako to zistí, musí aplikovať prvú náplasť jej nového cyklu. Toto je teraz nový „deň výmeny náplasti“ a nový „1. deň“. Počas prvého týždňa nového cyklu musí žena používať náhradnú antikoncepciu, ako napríklad kondómy, spermicídne prostriedky alebo pesar.
v strede cyklu náplasti (druhý týždeň/8. deň alebo tretí týždeň/15. deň):jeden alebo dva dni (do 48 hodín),
musí okamžite nalepiť novú náplasť. Nasledujúca náplasť sa má aplikovať vo zvyčajný „deň výmeny náplasti“. Nie je potrebná žiadna záložná antikoncepcia.
viac ako dva dni (48 hodín alebo viac),NEMUSÍ BYŤ CHRÁNENÁ PRED GRAVIDITOU. Musí okamžite ukončiť aktuálny antikoncepčný cyklus a začať nový 4-týždňový cyklus nalepením novej náplasti. Toto je teraz nový „deň výmeny náplasti“ a nový „1. deň“. Žena musí používať po dobu jedného týždňa náhradnú antikoncepciu.
na konci cyklu náplasti (štvrtý týždeň/22. deň):Ak žena zabudne odstrániť náplasť v 22. deň, musí ju odlepiť hneď, ako to zistí (najneskôr v 28. deň). Nasledujúci cyklus sa potom musí začať s novou náplasťou (v deň po 28. DNI – zvyčajný „deň výmeny náplasti“), nikdy nie neskôr. Nie je potrebná žiadna náhradná antikoncepcia.
· Dôsledky odlepenia, zabudnutia alebo nevymenenia náplastí a vyžadovaný postup:
Dôsledky odlepenia, zabudnutia na výmenu alebo nevymenenia náplastí a vyžadovaný postup
Odlepené náplastia
| Časový rámec
| Dôsledky vplývajúce na antikoncepčnú spoľahlivosťa
| Vyžadovaný postupa
|
Náplasť bola odlepená
| <24 hodín
| Antikoncepčná účinnosť je zaručená.
| - Okamžite nalepte novú náplasť.
- Nie je potrebná žiadna záložná antikoncepcia.
- „Deň výmeny náplasti“ zostáva nezmenený.
|
>24 hodín
| Antikoncepčná účinnosť bola narušená.
| - Okamžite začnite nový 4-týždňový cyklus aplikovaním novej náplasti.
- Po dobu nasledujúcich 7 dní používajte záložnú antikoncepciub.
- Poznamenajte si nový „deň výmeny náplasti“.
|
Náplasti nevymenené včasa
| Časový rámec
| Dôsledky vplývajúce na antikoncepčnú spoľahlivosťa
| Vyžadovaný postupa
|
1. náplasť
(1. týždeň, 1. deň)
neaplikovaná včas
| Interval bez používania náplastid
>7 dní
| Antikoncepčná účinnosť bola narušená.
| - Okamžite začnite nový 4‑týždňový cyklus aplikovaním novej náplasti.
- Po dobu nasledujúcich 7 dní používajte záložnú antikoncepciub.
- Poznamenajte si nový „deň výmeny náplasti“.
|
1. alebo 2. náplasť
(1./2. alebo 2./3. týždeň)
nevymenená včas
| <48 hodín
| Antikoncepčná účinnosť je zaručená.
| - Okamžite nalepte novú náplasť.
- Nie je potrebná žiadna záložná antikoncepcia.
- „Deň výmeny náplasti“ zostáva nezmenený.
|
>48 hodín
| Antikoncepčná účinnosť bola narušená.
| - Okamžite začnite nový 4-týždňový cyklus aplikovaním novej náplasti.
- Po dobu nasledujúcich 7 dní používajte náhradnú antikoncepciub.
- Poznamenajte si nový „deň výmeny náplasti“.
|
3. náplasť
(3./4. týždeň)
neodstránená včas
|
| Antikoncepčná účinnosť je zaručenác.
| - Odstráňte náplasť.
- Začnite nasledujúci 4-týždňový cyklus v zvyčajný „deň výmeny náplasti“.
|
a Platí pre každý cyklus.
b Náhradná antikoncepcia je ľubovoľný ďalší nehormonálny spôsob antikoncepcie s výnimkou kalendárnej metódy a teplotnej metódy.
c Ak bola 3. náplasť vymenená za novú najneskôr v zvyčajný 1. deň cyklu novej náplasti.
d Čas od odstránenia poslednej náplasti predchádzajúceho cyklu.
|
Nasledujúce balenie sa má predpísať včas, t. j. pred použitím poslednej náplasti v balení, aby sa zaručilo, že sa žene neminú náplasti.
Zmena „dňa výmeny náplasti“
Ak si chce žena zmeniť svoj „deň výmeny náplasti“, musí dokončiť svoj aktuálny cyklus s odstránením tretej náplasti v správny deň. Počas týždňa bez používania náplasti si môže zvoliť skorší „deň výmeny náplasti“ aplikovaním novej náplasti v požadovaný deň. V žiadnom prípade nesmie byť viac ako 7 za sebou nasledujúcich dní bez používania náplasti.
Pohlavieapleekjeindikovaný iba u žien.
Staršie ženyapleek nie je indikovaný po menopauze.
Index telesnej hmotnostiÚdaje o antikoncepčnej účinnosti u žien s indexom telesnej hmotnosti >30 kg/m
2 sú obmedzené.
Porucha funkcie obličiekapleek sa neskúmal u žien s poruchou funkcie obličiek. U žien s poruchou funkcie obličiek sa neočakáva žiadne zvýšené riziko (pozri časť 5.2).
Porucha funkcie pečeneapleek sa neskúmal u žien s poruchou funkcie pečene. apleek je kontraindikovaný u žien so závažným ochorením pečene v súčasnosti alebo v anamnéze, pokiaľ sa hodnoty pečeňových testov nevrátili na normálne hodnoty. Pozri tiež časť 4.3.
Etnické rozdielyFarmakokinetické vlastnosti etinylestradiolu sa skúmali v kombinácii s iným gestagénom u belošiek, Číňaniek a Japoniek, pričom tieto skúšania neodhalili žiadny klinicky významný rozdiel. Farmakokinetické vlastnosti apleeku sa neskúmali špecificky u žien rôznych etnických pôvodov. Nie sú známe žiadne polymorfné enzýmy prispievajúce vo veľkom rozsahu k metabolizácii gestodénu. Dostupné údaje nenaznačili u belošiek, černošiek a hispánskych žien žiadny rozdiel farmakokinetických vlastností apleeku medzi ženami rôznych rás/etnických pôvodov. Veľmi obmedzené dáta sú k dispozícii ohľadom ázijských žien.
Pediatrická populácia
Bezpečnosť a účinnosť u dospievajúcich vo veku do 18 rokov neboli stanovené. Použitie apleeku sa netýka detí a dospievajúcich pred prvou menštruáciou.
4.3 KontraindikácieKombinovaná hormonálna antikoncepcia (CHC) sa nemá používať pri nasledujúcich stavoch. Ak sa ľubovoľný z týchto stavov objaví po prvých raz počas používania apleeku, náplasť sa má okamžite odstrániť.
· Prítomnosť alebo riziko vzniku venóznej tromboembólie (VTE)
o Venózna tromboembólia – prítomná VTE (liečená antikoagulanciami) alebo v anamnéze (napr. trombóza hlbokých žíl [DVT] alebo pľúcna embólia [PE]).
o Známa dedičná alebo získaná predispozícia na vznik venóznej tromboembólie, ako napríklad rezistencia voči APC (vrátane faktora V Leiden), deficiencia antitrombínu-III, deficiencia proteínu C, deficiencia proteínu S.
o Závažný chirurgický zákrok s dlhodobou imobilizáciou (pozri časť 4.4).
o Vysoké riziko vzniku venóznej tromboembólie z dôvodu prítomnosti viacerých rizikových faktorov (pozri časť 4.4).
· Prítomnosť alebo riziko vzniku arteriálnej tromboembólie (ATE)
o Arteriálna tromboembólia – prítomná arteriálna tromboembólia, arteriálna tromboembólia v anamnéze (napríklad infarkt myokardu) alebo stav, ktorý je jej skorým príznakom (napríklad angina pectoris).
o Cievne mozgové ochorenie – prítomná cievna mozgová príhoda, cievna mozgová príhoda v anamnéze alebo stav, ktorý je jej skorým príznakom (napríklad prechodný ischemický záchvat, TIA).
o Známa vrodená alebo získaná predispozícia na vznik arteriálnej tromboembólie, ako napríklad hyperhomocysteinémia a antifosfolipidové protilátky (antikardiolipínové protilátky, lupus vyvolaný antikoaguláciou).
o Migréna s ložiskovými neurologickými symptómami v anamnéze.
o Vysoké riziko vzniku arteriálnej tromboembólie z dôvodu viacerých rizikových faktorov (pozri časť 4.4) alebo prítomnosti jedného závažného rizikového faktora, ako napríklad:
· diabetes mellitus s cievnymi príznakmi,
· závažná hypertenzia,
· závažná dyslipoproteinémia.
· Závažné ochorenie pečene v súčasnosti alebo v anamnéze, pokiaľ sa hodnoty pečeňových testov nevrátili na normálne hodnoty.
· Nádory pečene v súčasnosti alebo v anamnéze (benígne alebo malígne).
· Diagnostikované zhubné novotvary ovplyvnené pohlavnými steroidmi (napríklad pohlavných orgánov alebo prsníkov) alebo podozrenie na ne.
· Nediagnostikované vaginálne krvácanie.
· Precitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníAk je prítomný ktorýkoľvek zo stavov alebo rizikových faktorov uvedených nižšie, vhodnosť používania apleeku sa má s danou ženou prekonzultovať. Ženu treba upozorniť, že ak dôjde k zhoršeniu alebo prvému prejavu ktoréhokoľvek z týchto stavov alebo rizikových faktorov, má sa obrátiť na svojho lekára, ktorý určí, či má ukončiť používanie apleeku.
·
Poruchy krvného obehuRiziko vzniku venóznej tromboembólie (VTE)Používanie ktorejkoľvek kombinovanej hormonálnej antikoncepcie (CHC) zvyšuje riziko vzniku venóznej tromboembólie (VTE) v porovnaní s jej nepoužívaním.
Lieky, ktoré obsahujú levonorgestrel, norgestimát alebo noretisterón, sú spojené s najnižším rizikom vzniku VTE. Zatial nie je známe, aké je riziko u apleeku v porovnaní s liekmi s nižším rizikom. Rozhodnutie používať ktorýkoľvek iný liek než liek s najnižším rizikom výskytu VTE sa má urobiť len po konzultácii s danou ženou, aby sa zaručilo, že rozumie riziku výskytu VTE pri používaní apleeku, ako jej aktuálne rizikové faktory ovplyvňujú toto riziko, a že jej riziko vzniku VTE je najvyššie v prvom roku používania CHC. Sú taktiež aj určité dôkazy o tom, že sa toto riziko zvyšuje pri opätovnom začatí používania CHC po prerušení používania trvajúcom 4 týždne alebo dlhšie.U približne 2 z 10 000 žien, ktoré nepoužívajú CHC a nie sú gravidné, vznikne VTE v priebehu jedného roka. Avšak u každej jednej ženy môže byť toto riziko oveľa vyššie v závislosti od prítomných rizikových faktorov (pozri nižšie).
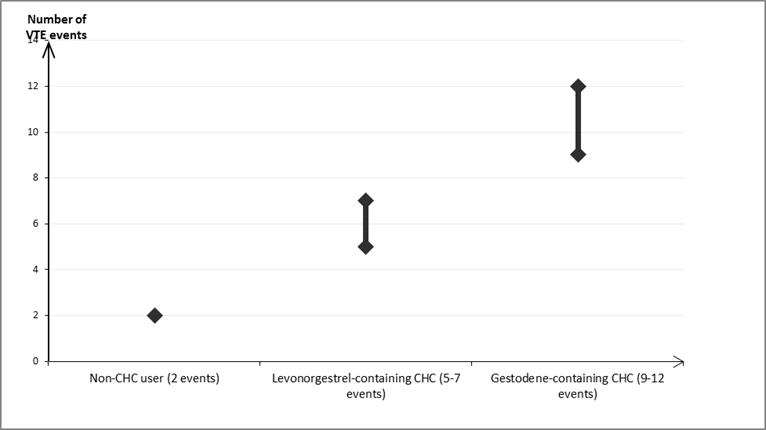
Odhaduje sa
[1], že VTE sa vyskytne v priebehu jedného roka u približne 9 až 12 žien z 10 000 žien, ktoré používajú CHC obsahujúcu gestodén, v porovnaní s približne 6
[2] ženami, ktoré používajú CHC obsahujúcu levonorgestrel.
V oboch prípadoch je počet výskytov VTE za rok nižší ako počet očakávaný u žien počas gravidity alebo v období po pôrode.
VTE sa môže v 1 až 2 % prípadov končiť smrťou.
Počet prípadov VTE na 10 000 žien v priebehu jedného roka
U používateliek CHC bol mimoriadne zriedkavo hlásený výskyt trombózy v iných krvných cievach, napr. v pečeňových, mezenterických, obličkových alebo sietnicových žilách a tepnách.
Rizikové faktory pre vznik VTERiziko vzniku venóznych tromboembolických komplikácií u používateliek CHC sa môže značne zvýšiť u ženy s ďalšími rizikovými faktormi, najmä ak ich má viacero (pozri tabuľku).
apleek je kontraindikovaný, ak má žena viacero rizikových faktorov, ktoré ju vystavujú vysokému riziku vzniku venóznej trombózy (pozri časť 4.3). Ak má žena viac ako jeden rizikový faktor, zvýšenie rizika môže byť väčšie ako súčet jednotlivých faktorov – v takomto prípade sa má zvážiť jej celkové riziko vzniku VTE. Ak sa pomer prínosov a rizík považuje za negatívny, CHC sa nemá predpisovať (pozri časť 4.3).
Tabuľka: Rizikové faktory pre vznik VTERizikový faktor
| Komentár
|
Obezita (index telesnej hmotnosti vyšší ako 30 kg/m²)
| Riziko sa výrazne zvyšuje so zvyšovaním BMI.
Obzvlášť dôležité je zvážiť, ak sú prítomné aj ďalšie rizikové faktory.
|
Dlhodobá imobilizácia, závažný chirurgický zákrok, akýkoľvek chirurgický zákrok na nohách alebo panve, neurochirurgický zákrok alebo závažný úraz.
Poznámka: Dočasná imobilizácia vrátane cestovania leteckou dopravou trvajúceho >4 hodiny môže byť tiež rizikovým faktorom pre vznik VTE, najmä u žien s ďalšími rizikovými faktormi.
| V týchto prípadoch sa odporúča prerušiť používanie náplasti (v prípade plánovaného chirurgického zákroku najmenej štyri týždne pred zákrokom) a pokračovať v ňom najskôr dva týždne po úplnom obnovení pohyblivosti. Aby sa zabránilo neželanej gravidite, má sa používať iný spôsob antikoncepcie.
Ak sa používanie apleeku nepreruší včas, má sa zvážiť antitrombotická liečba.
|
Pozitívna rodinná anamnéza (akýkoľvek výskyt venóznej tromboembólie u súrodenca alebo rodiča, najmä v relatívne skorom veku, napr. do 50 rokov).
| Ak existuje podozrenie na dedičnú predispozíciu, ženu musí pred rozhodnutím o používaní ľubovoľnej CHC vyšetriť odborný lekár.
|
Iné zdravotné stavy spojené s VTE
| Rakovina, systémový lupus erythematosus, hemolyticko-uremický syndróm, chronické zápalové ochorenie čriev (Crohnova choroba alebo ulcerózna kolitída) a kosáčikovitá anémia
|
Zvyšujúci sa vek
| Najmä nad 35 rokov
|
Nie je žiadny konsenzus možnej úlohy kŕčových žíl a povrchovej tromboflebitídy pri vzniku alebo progresii venóznej trombózy.
Musí sa zvážiť zvýšené riziko vzniku tromboembólie počas gravidity a najmä počas 6-týždňového obdobia šestonedelia (informácie o „gravidite a laktácii“, pozri časť 4.6).
Príznaky VTE (trombóza hlbokých žíl a pľúcna embólia)V prípade príznakov sa má žene odporučiť, aby bezodkladne vyhľadala lekársku pomoc a informovala zdravotníckeho pracovníka, že používa CHC.
Príznaky trombózy hlbokých žíl (DVT) môžu zahŕňať:
- jednostranný opuch nohy a/alebo chodidla alebo pozdĺž žily v nohe,
- bolesť alebo citlivosť v nohe, ktorú možno pociťovať iba v stoji alebo pri chôdzi,
- zvýšené teplo v postihnutej nohe, sčervenanie alebo zmena sfarbenia pokožky na nohe.
Príznaky pľúcnej embólie (PE) môžu zahŕňať:
- náhly nástup nevysvetliteľnej dýchavičnosti alebo rýchleho dýchania,
- náhly kašeľ, ktorý môže súvisieť s hemoptýzou,
- ostrú bolesť v hrudníku,
- závažný pocit omámenia alebo závrat,
- rýchly alebo nepravidelný srdcový rytmus.
Niektoré z týchto príznakov (napríklad „dýchavičnosť“, „kašeľ“) sú nešpecifické a môžu byť nesprávne interpretované ako bežnejšie alebo menej závažné udalosti (napríklad infekcie dýchacích ciest).
Medzi ďalšie prejavy vaskulárnej oklúzie môžu patriť: náhla bolesť, opuch a mierne zmodranie končatiny.
Ak dôjde k oklúzii v oku, medzi symptómy môžu patriť bezbolestné rozmazané videnie, ktoré môže postupne prechádzať až do straty zraku. Niekedy môže dôjsť k strate zraku takmer okamžite.
Riziko vzniku arteriálnej tromboembólie (ATE)Epidemiologické skúšania spájali používanie CHC so zvýšeným rizikom vzniku arteriálnej tromboembólie (infarkt myokardu) alebo cievnej mozgovej príhody (napr. prechodný ischemický záchvat, cievna mozgová príhoda). Arteriálne tromboembolické udalosti sa môžu končiť smrťou.
Rizikové faktory vzniku ATERiziko vzniku arteriálnych tromboembolických komplikácií alebo cerebrovaskulárnej udalosti u používateliek CHC sa zvyšuje u žien s rizikovými faktormi (pozri tabuľku). apleek je kontraindikovaný, ak má žena jeden závažný alebo viacero rizikových faktorov vzniku ATE, ktoré ju vystavujú vysokému riziku vzniku arteriálnej trombózy (pozri časť 4.3). Ak má žena viac ako jeden rizikový faktor, zvýšenie rizika môže byť väčšie ako súčet jednotlivých faktorov – v takomto prípade sa má zvážiť jej celkové riziko. Ak sa pomer prínosov a rizík považuje za negatívny, CHC sa nemá predpisovať (pozri časť 4.3).
Tabuľka: Rizikové faktory vzniku ATERizikový faktor
| Komentár
|
Zvyšujúci sa vek
| Najmä nad 35 rokov
|
Fajčenie
| Ženám sa má odporučiť, aby nefajčili, ak chcú používať CHC. Ženám vo veku nad 35 rokov, ktoré pokračujú vo fajčení, sa má dôrazne odporučiť, aby používali iný spôsob antikoncepcie.
|
Hypertenzia
|
|
Obezita (index telesnej hmotnosti vyšší ako 30 kg/m²)
| Riziko sa výrazne zvyšuje so zvyšovaním indexu BMI.
To je dôležité najmä u žien s ďalšími rizikovými faktormi.
|
Pozitívna rodinná anamnéza (akýkoľvek výskyt arteriálnej tromboembólie u súrodenca alebo rodiča, najmä v relatívne mladom veku, napr. do 50 rokov).
| Ak existuje podozrenie na dedičnú predispozíciu, ženu musí pred rozhodnutím o používaní ľubovoľnej CHC vyšetriť odborný lekár.
|
Migréna
| Zvýšenie frekvencie alebo závažnosti migrény v priebehu používania CHC (čo môžu byť skoré príznaky cievnej mozgovej príhody) môže byť dôvodom na okamžité prerušenie používania lieku.
|
Ďalšie zdravotné stavy spojené s nežiaducimi vaskulárnymi udalosťami.
| Diabetes mellitus, hyperhomocysteinémia, ochorenie srdcových chlopní a atriálna fibrilácia, dyslipoproteinémia a systémový lupus erythematosus.
|
Príznaky ATEV prípade príznakov sa má žene odporučiť, aby bezodkladne vyhľadala lekársku pomoc a informovala zdravotníckeho pracovníka, že používa CHC.
Príznaky cievnej mozgovej príhody môžu zahŕňať:
- náhla strata citlivosti alebo slabosť tváre, ruky alebo nohy, najmä na jednej strane tela,
- náhle problémy s chôdzou, závrat, strata rovnováhy alebo koordinácie,
- náhla zmätenosť, problémy s rečou alebo jej porozumením,
- náhle problémy so zrakom u jedného alebo oboch očí,
- náhla, závažná alebo dlhodobá bolesť hlavy bez známej príčiny,
- strata vedomia alebo mdloba so záchvatom alebo bez neho.
Dočasné príznaky naznačujúce, že udalosťou je prechodný ischemický záchvat (TIA).
Príznaky infarktu myokardu (MI) môžu zahŕňať:
- bolesť, nepohodlie, tlak, ťažoba, pocit stláčania alebo plnosti v hrudi, ruke alebo pod hrudnou kosťou,
- nepohodlie vyžarujúce do chrbta, čeľuste, hrdla, ruky, žalúdka,
- pocit plnosti, zažívacích problémov alebo dusenia sa,
- potenie, nevoľnosť, vracanie alebo závrat,
- mimoriadna slabosť, úzkosť alebo dýchavičnosť,
- rýchly alebo nepravidelný srdcový rytmus.
Pri zvažovaní pomeru rizík a prínosov má lekár zvážiť to, že vhodná liečba príslušného stavu môže znížiť súvisiace riziko trombózy a že riziko súvisiace s graviditou je vyššie ako riziko, ktoré súvisí s nízkodávkovou kombinovanou hormonálnou antikoncepciou (<0,05 mg etinylestradiolu).
· Nádory
V niektorých epidemiologických skúšaniach bolo hlásené u dlhodobých používateliek COC (>5 rokov) zvýšené riziko rakoviny krčka maternice, naďalej však existuje spor ohľadom rozsahu, v akom je toto zistenie dôsledkom nejasných vplyvov sexuálneho správania a ďalších faktorov, ako je napríklad ľudský papilomavírus (HPV).
Metaanalýza údajov z 54 epidemiologických skúšaní preukázala, že u žien, ktoré v súčasnosti užívajú COC, existuje mierne zvýšené relatívne riziko (RR=1,24) diagnostikovania rakoviny prsníka. V priebehu 10 rokov po skončení používania COC toto zvýšené riziko postupne vymizne. Keďže rakovina prsníka sa vyskytuje u žien mladších ako 40 rokov iba zriedkavo, zvýšený počet diagnostikovaných prípadov rakoviny prsníka u žien, ktoré v súčasnosti používajú alebo nedávno používali COC, je v porovnaní s celkovým rizikom vzniku rakoviny prsníka malé. Tieto skúšania neposkytujú dôkaz príčinnej súvislosti. Pozorovaný výskyt zvýšeného rizika môže byť spôsobený skoršou diagnostikou rakoviny prsníka u osôb používajúcich COC, biologickými účinkami COC alebo kombináciou oboch vplyvov. Rakovina prsníka u osôb, ktoré niekedy používali COC, sa spravidla diagnostikuje v menej klinicky pokročilom stave ako u osôb, ktoré COC nikdy neužívali.
V zriedkavých prípadoch sa u používateliek COC pozorovali benígne nádory pečene a v ešte zriedkavejších prípadoch malígne nádory pečene. V ojedinelých prípadoch tieto nádory viedli k život ohrozujúcemu intraabdominálnemu krvácaniu. V prípade výskytu silnej bolesti v hornej časti brucha, zväčšenia pečene alebo príznakov intraabdominálneho krvácania u žien používajúcich kombinovanú hormonálnu antikoncepciu sa má pri diferenciálnej diagnostike zvážiť možnosť výskytu nádoru pečene.
Pri používaní COC obsahujúcej viac ako 50 µg etinylestradiolu je riziko rakoviny endometria a vaječníkov znížené. Či sa to týka aj nižšie dávkovanej kombinovanej hormonálnej antikoncepcie zatiaľ nebolo potvrdené.
· Ďalšie stavy
Ak dochádza k opakovaným, pretrvávajúcim podráždeniam pokožky (napríklad pretrvávajúci erytém alebo pruritus v mieste aplikácie) aj v prípade, ak sa miesto aplikácie mení podľa pokynov, má sa zvážiť ukončenie transdermálnej liečby.
U žien s hypertriglyceridémiou alebo majúcich ju v rodinnej anamnéze môže existovať pri používaní kombinovanej hormonálnej antikoncepcie zvýšené riziko pankreatitídy.
Aj keď u mnohých žien užívajúcich kombinovanú hormonálnu antikoncepciu sa pozorovali malé zvýšenia krvného tlaku, klinicky významné zvýšenia sú zriedkavé. Ak sa však počas používania apleeku rozvinie trvalá klinicky významná hypertenzia, lekár by mal nariadiť ukončenie používania tohto prípravku a začať liečbu hypertenzie. Ak sa pomocou liečby hypertenzie darí dosiahnuť obnovenie normálnych hodnôt krvného tlaku, v používaní apleeku sa môže pokračovať, pokiaľ sa to považuje za vhodné.
Počas gravidity, aj pri používaní kombinovanej hormonálnej antikoncepcie boli hlásené nasledujúce stavy (alebo ich zhoršenia), avšak dôkaz súvislosti s používaním kombinovanej hormonálnej antikoncepcie je nejednoznačný: žltačka a/alebo pruritus súvisiaci s cholestázou, tvorba žlčových kameňov, porfýria, systémový lupus erythematosus, hemolytický uremický syndróm, Sydenhamova chorea, herpes gestationis, strata sluchu súvisiaca s otosklerózou.
U žien s dedičným exogénnym angioedémom môžu estrogény vyvolať alebo zhoršiť príznaky angioedému.
Akútne alebo chronické poruchy funkcie pečene môžu vyžadovať predčasné ukončenie používania apleeku, až kým sa markery funkcie pečene nevrátia na normálne hodnoty. Recidivujúca cholestatická žltačka vyskytujúca sa po prvý raz počas gravidity alebo predchádzajúceho používania pohlavných steroidov si vyžaduje ukončenie používania apleeku.
Aj keď kombinovaná hormonálna antikoncepcia môže mať účinok na periférnu inzulínovú rezistenciu a znášanlivosť glukózy, neexistuje žiadny dôkaz potreby zmeny terapeutického režimu u diabetičiek používajúcich nízkodávkovú kombinovanú hormonálnu antikoncepciu (obsahujúcu <50μg etinylestradiolu). Ženy s diabetes sa však musia počas používania kombinovanej hormonálnej antikoncepcie pozorne sledovať.
Počas používania kombinovanej hormonálnej antikoncepcie bolo hlásené zhoršenie endogénnej depresie, epilepsie, Crohnovej choroby a ulceróznej kolitídy.
Občas sa môže vyskytnúť aj chloazma, najmä u žien s chloazmou gravidarum v anamnéze. Ženy náchylné na vznik chloazmy by sa mali počas používania kombinovanej hormonálnej antikoncepcie vyhýbať slnečnému alebo ultrafialovému žiareniu.
Osobitná pozornosť sa má venovať interakcii kombinovanej hormonálnej antikoncepcie s lamotrigínom (pozri časť 4.5).
Pred začatím používania alebo opätovným začatím používania apleeku sa má vyšetriť celková anamnéza (vrátane rodinnej anamnézy) a musí sa vylúčiť gravidita. Má sa zmerať krvný tlak a vykonať zdravotná prehliadka s ohľadom na kontraindikácie (pozri časť 4.3) a upozornenia (pozri časť 4.4). Je dôležité ženu upozorniť na informácie o venóznej a arteriálnej trombóze vrátane rizika používania apleeku v porovnaní s inými CHC, o príznakoch VTE a ATE, o známych rizikových faktoroch a o tom, čo robiť v prípade podozrenia na trombózu.
Žena má byť poučená, aby si pozorne prečítala písomnú informáciu pre používateľku a dodržiavala odporúčania uvedené v nej. Frekvencia a druh vyšetrení sa majú robiť na základe stanovených postupov a majú sa prispôsobiť individuálnym potrebám ženy.
Ženy majú byť upozornené, že hormonálna antikoncepcia nechráni pred infekciami vírusom HIV (AIDS) ani inými ochoreniami prenášanými pohlavným stykom.
Účinnosť apleeku sa môže znížiť, napríklad v prípade:
- zabudnutia na naplánovanú aplikáciu náplasti,
- odlepenia náplasti,
- zabudnutia na výmenu náplasti (pozri „Postup v prípade odlepenia, zabudnutia na výmenu alebo nevymenenia náplastí“ v časti 4.2),
- súbežného podávania liekov (pozri časť 4.5).
Pri používaní každej kombinovanej hormonálnej antikoncepcie sa môže vyskytnúť nepravidelné krvácanie (špinenie alebo intracyklické krvácanie), najmä počas prvých mesiacov používania. V takýchto prípadoch sa má pokračovať v používaní apleeku. Vyhodnotenie akéhokoľvek nepravidelného krvácania má význam iba po adaptačnom období trvajúcom približne tri cykly používania apleeku. Percentuálny podiel žien používajúcich apleek, u ktorých sa vyskytlo intracyklické krvácanie po tomto adaptačnom období, dosahoval 7 až 12 %.
Iba u malého podielu žien, v rozsahu 1 % za cyklus, sa nedostavilo žiadne menštruačné krvácanie (amenorea).
Ak nepravidelné krvácanie pretrváva alebo sa vyskytne po pravidelných cykloch používania apleeku, treba zvážiť nehormonálne príčiny a sú indikované vhodné diagnostické opatrenia na vylúčenie gravidity alebo zhubného ochorenia. Tieto môžu zahŕňať kyretáž.
U niektorých žien nemusí počas intervalu bez používania náplasti dôjsť ku krvácaniu spôsobenému prerušením používania. Ak sa apleek používal podľa pokynov v časti 4.2, je nepravdepodobné, že by bola žena gravidná. Ak sa však apleek nepoužíval podľa týchto pokynov pred prvým nedostaveným krvácaním spôsobeným prerušením používania alebo ak sa krvácanie spôsobené prerušením používania nedostaví dvakrát, pred ďalším používaním apleekusa musí vylúčiť gravidita.
4.5 Liekové a iné interakcieMôžu sa vyskytnúť interakcie s liekmi indukujúcimi mikrozomálne enzýmy, čo môže spôsobiť zvýšený klírens pohlavných hormónov a viesť k intracyklickému krvácaniu a/alebo zlyhaniu antikoncepcie. Ženy liečené niektorými z týchto liekov musia okrem apleeku dočasne používať aj bariérovú metódu alebo zvoliť iný spôsob antikoncepcie. Bariérová metóda sa má používať počas súbežného podávania liekov a po dobu 28 dní po jeho ukončení. Ak obdobie, počas ktorého sa používa bariérová metóda, presahuje použitie tretej náplasti aplikačného cyklu, nasledujúca náplasť sa má začať používať bez zvyčajného intervalu bez používania náplasti.
Látky zvyšujúce klírens kombinovanej hormonálnej antikoncepcie (znížená účinnosť kombinovanej hormonálnej antikoncepcie spôsobená indukciou enzýmov), napríklad:fenytoín, barbituráty, primidón, karbamazepín, rifampicín, rifabutín, bosentan a pravdepodobne aj oxkarbazepín, eslikarbazepín, topiramát, felbamát, grizeofulvín, modafinil a lieky obsahujúce ľubovník bodkovaný (hypericum perforatum).
Látky s premenlivými účinkami na klírens kombinovanej hormonálnej antikoncepcie, napríklad:Pri súbežnom podávaní s kombinovanou hormonálnou antikoncepciou môžu mnohé inhibítory nenukleozidovej reverznej transkriptázy a inhibítory proteázy HIV/HCV zvyšovať alebo znižovať plazmatické koncentrácie estrogénu alebo gestagénu. Tieto zmeny môžu byť v niektorých prípadoch klinicky významné.
Látky zvyšujúce liekové koncentrácie kombinovanej hormonálnej antikoncepcie (inhibítory enzýmov)Bolo preukázané, že etoricoxib zvyšuje plazmatické koncentrácie etinylestradiolu (o 50 až 60 %) pri súbežnom užívaní s perorálnou trojfázovou hormonálnou antikoncepciou. Predpokladá sa, že etoricoxib zvyšuje koncentrácie etinylestradiolu, pretože inhibuje aktivitu sulfotransferázy, čím sa inhibuje metabolizmus etinylestradiolu.
Účinky kombinovanej hormonálnej antikoncepcie na iné lieky
Kombinovaná hormonálna antikoncepcia môže ovplyvniť metabolizmus niektorých iných liekov.
Osobitná pozornosť sa má venovať interakcii kombinovanej hormonálnej antikoncepcie s lamotrigínom. Súbežné používanie s lamotrigínom sa neodporúča, z dôvodu zníženia koncentrácie a účinnosti lamotrigínu (pozri časť 4.4). Pri titrácii dávky lamotrigínu sa nemá začínať používať kombinovaná hormonálna antikoncepcia. U žien užívajúcich lamotrigín je potrebné pri začínaní používania kombinovanej hormonálnej antikoncepcie a po jej ukončení, klinické sledovanie a úprava dávky lamotrigínu.
Iné formy interakcií
Laboratórne vyšetreniaPoužívanie antikoncepčných steroidov môže ovplyvniť výsledky niektorých laboratórnych vyšetrení vrátane biochemických parametrov funkcie pečene, štítnej žľazy, nadobličiek a obličiek, plazmatických hladín (transportných) proteínov, napríklad globulín viažuci kortikosteroidy a lipidové/lipoproteínové frakcie, parametrov metabolizmu uhľohydrátov a parametrov koagulácie a fibrinolýzy. Zmeny vo všeobecnosti zostávajú v normálnom laboratórnom rozsahu.
Poznámka: Pozrite si informácie o súbežne podávaných liekoch, aby sa identifikovali potenciálne interakcie.
4.6 Fertilita, gravidita a laktáciaapleek nie je indikovaný počas gravidity. Ak sa vyskytne gravidita počas používania apleeku, tento sa musí odstrániť a jeho ďalšie používanie sa musí ukončiť. Rozsiahle epidemiologické skúšania však nepreukázali žiadne zvýšené riziko poškodenia plodu u novorodencov narodených ženám, ktoré pred graviditou používali kombinovanú hormonálnu antikoncepciu, ani žiadny teratogénny účinok, ak sa kombinovaná hormonálna antikoncepcia použila náhodne počas skorej gravidity.
Pri opätovnom začatí používania apleeku treba vziať do úvahy zvýšené riziko VTE v období po pôrode (pozri časti 4.2 a 4.4).
Laktácia
Laktácia môže byť ovplyvnená kombinovanou hormonálnou antikoncepciou, pretože táto môže znižovať množstvo a meniť zloženie materského mlieka. Preto sa používanie kombinovanej hormonálnej antikoncepcie vo všeobecnosti nemá odporúčať, až kým dojčiaca matka úplne neprestane dojčiť svoje dieťa. Do mlieka sa môžu vylučovať malé množstvá antikoncepčných steroidov a/alebo ich metabolitov.
Fertilita
Používanie apleeku neovplyvňuje priebeh budúcej fertility. Po odstránení apleeku sa u žien obnoví normálna fertilita.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne skúšania účinkov na schopnosť viesť vozidlá a obsluhovať stroje. U používateliek kombinovanej hormonálnej antikoncepcie sa nepozorovalo žiadne ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkyNajčastejšie hlásenými nežiaducimi reakciami pri používaní apleeku sú reakcie v mieste aplikácie (vyrážka, pruritus, podráždenie, erytém a precitlivenosť). Vyskytujú sa u 20,9 % používateliek. Zriedkavými, závažnými nežiaducimi reakciami sú arteriálna a venózna tromboembólia
.
Tabuľkový zoznam nežiaducich reakcií
Frekvencie nežiaducich reakcií hlásené v klinických skúšaniach fázy 2 a 3 s apleekom (N=3 573) sú zosumarizované v tabuľke nižšie. V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti. Frekvencie sú definované ako veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1000 až <1/100) a zriedkavé (≥1/10 000 až <1/1 000).
Trieda orgánových systémov
(MedDRA)
| Veľmi časté
| Časté
| Menej časté
| Zriedkavé
|
Psychické poruchy
|
| emocionálna labilita
| depresia/depresívna nálada, pokles a strata libida
|
|
Poruchy nervového systému
|
| migréna
|
|
|
Poruchy ciev
|
|
|
| venózne a arteriálne tromboembolické udalosti*
|
Poruchy gastrointestinálneho traktu
|
| nevoľnosť
|
|
|
Poruchy kože a podkožného tkaniva
| reakcia v mieste aplikácie
|
|
|
|
Poruchy reprodukčného systému a prsníkov
|
| krvácanie z rodidiel**, bolesť prsníkov
|
|
|
1Nežiaduce účinky v klinických skúšaniach boli kódované použitím slovníka MedDRA (verzia 14.1). Na popis určitej reakcie a jej synoným a súvisiacich stavov sa použil preferovaný pojem podľa slovníka MedDRA.Rôzne pojmy slovníka MedDRA reprezentujúce rovnaký zdravotný stav boli zoskupené ako jednotlivé nežiaduce reakcie, aby sa zabránilo zmierneniu skutočného účinku alebo jeho zastretiu.'
*- Odhadovaná frekvencia z epidemiologických skúšaní zahŕňajúcich skupinu kombinovaných perorálnych antikoncepcií. Frekvencia bola na rozhraní zriedkavej až veľmi zriedkavej.
- Pojem „venózne a arteriálne tromboembolické udalosti“ sumarizuje nasledujúce zdravotné stavy: oklúzia periférnych hlbokých žíl, trombóza a embólia/pľúcna vaskulárna oklúzia, trombóza, embólia a infarkt/infarkt myokardu/mozgový infarkt a cievna mozgová príhoda nešpecifikovaná ako hemoragická.
** Zahŕňa nasledujúce zdravotné stavy: krvácanie z rodidiel, neočakávané maternicové krvácanie.
Popis vybraných nežiaducich reakcií
Nežiaduce reakcie s veľmi nízkou frekvenciou alebo s oneskoreným nástupom príznakov, ktoré sa považujú za súvisiace so skupinou kombinovaných hormonálnych antikoncepcií vrátane COC, sú uvedené nižšie (pozri tiež časti 4.3 a 4.4):
Poruchy krvného obehu· U žien používajúcich CHC sa pozorovalo zvýšené riziko vzniku arteriálnych a venóznych trombotických a tromboembolických udalostí vrátane infarktu myokardu, cievnej mozgovej príhody, prechodných ischemických záchvatov, venóznej trombózy a pľúcnej embólie, ktoré sú podrobnejšie uvedené v časti 4.4.
Nádory· Medzi používateľkami kombinovanej hormonálnej antikoncepcie je veľmi mierne zvýšená frekvencia diagnostikovania prípadov rakoviny prsníka. Keďže rakovina prsníka sa vyskytuje u žien mladších ako 40 rokov iba zriedkavo, zvýšený počet diagnostikovaných prípadov je v porovnaní s celkovým rizikom vzniku rakoviny prsníka malý. Príčinná súvislosť s používaním kombinovanej hormonálnej antikoncepcie je neznáma.
· Nádory pečene (benígne a malígne).
Ďalšie stavy· Nodózny erytém, multiformný erytém.
· Ženy s hypertriglyceridémiou (zvýšené riziko pankreatitídy pri používaní COC).
· Hypertenzia.
· Výskyt alebo zhoršenie stavov, pre ktoré neexistuje jednoznačná súvislosť s používaním COC: žltačka a/alebo pruritus súvisiaci s cholestázou, tvorba žlčových kameňov, porfýria, systémový lupus erythematosus, hemolytický uremický syndróm, Sydenhamova chorea, herpes gestationis, strata sluchu súvisiaca s otosklerózou.
· U žien s dedičným exogénnym angioedémom môžu estrogény vyvolať alebo zhoršiť príznaky angioedému.
· Poruchy funkcie pečene.
· Zmeny tolerancie glukózy alebo účinok na periférnu inzulínovú rezistenciu.
· Zhoršenie Crohnovej choroby a ulceróznej kolitídy.
· Zhoršenie epilepsie.
· Chloazma.
· Precitlivenosť (vrátane príznakov ako vyrážka, urtikária).
InterakcieV dôsledku interakcií iných liekov (induktory enzýmov) s kombinovanou hormonálnou antikoncepciou (pozri časť 4.5) môže dôjsť k intracyklickému krvácaniu a/alebo ku zlyhaniu antikoncepcie.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 PredávkovanieNa základe všeobecných skúseností s kombinovanou perorálnou antikoncepciou sa môžu vyskytnúť v tomto prípade nasledujúce príznaky: nevoľnosť, vracanie a u mladých dievčat slabé vaginálne krvácanie. Nie sú známe žiadne protilátky a ďalšia liečba má byť symptomatická. Ďalšie alebo nevhodne použité náplasti treba odstrániť z pokožky.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Hormonálne kontraceptíva na systémové použitie, gestagény a estrogény, kombinácie; ATC kód: G03AA10.
Mechanizmus účinku
Antikoncepčný účinok kombinovanej hormonálnej antikoncepcie je založený na interakcii rôznych faktorov, z ktorých sa za najdôležitejšie považujú inhibícia ovulácie a zmeny sekrécie krčka maternice.
Klinická účinnosť a bezpečnosť
V klinickom skúšaní vykonanom s apleekom v Európskej únii, Latinskej Amerike a Austrálii boli vypočítané nasledujúce Pearlove indexy:
Pearlov index (vek 18‑35 rokov, index telesnej hmotnosti ≤30 kg/m
2)
Zlyhanie metódy: Pearlov index 0,82 (horný 95 % limit spoľahlivosti 1,55)
Zlyhanie metódy a používateľky: Pearlov index 1,19 (horný 95 % limit spoľahlivosti 2,00)
Pre európsku populáciu boli vypočítané nasledujúce Pearlove indexy:
Pearlov index (vek 18‑35 rokov, index telesnej hmotnosti ≤30 kg/m
2)
Zlyhanie metódy: Pearlov index 0,40 (horný 95 % limit spoľahlivosti 1,18)
Zlyhanie metódy a používateľky: Pearlov index 0,76 (horný 95 % limit spoľahlivosti 1,66)
V klinickom skúšaní vykonanom s apleekom v USA boli vypočítané nasledujúce Pearlove indexy:
Pearlov index (vek 18‑35 rokov, žiadne obmedzenie týkajúce sa indexu telesnej hmotnosti)
Zlyhanie metódy: Pearlov index 2,91 (horný 95 % limit spoľahlivosti 4,41)
Zlyhanie metódy a používateľky: Pearlov index 3,92 (horný 95 % limit spoľahlivosti 5,53)
Miera zlyhania sa môže zvyšovať pri nesprávnom používaní apleeku.
V jednom klinickom skúšaní sa skúmala histológia endometria u 49 žien po 13 cykloch liečby. Nepozorovali sa žiadne abnormálne výsledky.
5.2 Farmakokinetické vlastnostiPo dermálnej aplikácii apleeku sa etinylestradiol a gestodén dobre absorbujú cez pokožku. Priemerné uvoľňovanie etinylestradiolu a gestodénu počas 7-dňového obdobia aplikácie apleeku má za následok rovnakú systémovú expozíciu (AUC) počas ustáleného stavu, ako sa pozorovala po dennom podávaní kombinovanej perorálnej antikoncepcie obsahujúcej 0,02 mg etinylestradiolu a 0,06 mg gestodénu.
Sérové koncentrácie etinylestradiolu a gestodénu sa zisťovali počas tretieho týždňa v rôznych liečebných cykloch (1. cyklus až 7. cyklus). Priemerné hodnoty maximálnych sérových koncentrácií etinylestradiolu v rozsahu 36‑51 ng/l sa dosahovali približne 1 deň po dermálnej aplikácii náplasti. Následne sa sérové koncentrácie znížili na priemerné minimálne hodnoty v rozsahu 15‑23 ng/l na konci 1-týždňového intervalu aplikácie. Priemerná koncentrácia počas 3. týždňa bola v rozsahu 22‑33 ng/l.
Priemerné hodnoty maximálnych sérových koncentrácií celkového gestodénu v rozsahu 4,7‑7,5 µg/l sa dosahovali približne 1‑1,5 dňa po dermálnej aplikácii náplasti. Následne sa sérové koncentrácie znížili na priemerné minimálne hodnoty v rozsahu 2,6‑4,0 µg/l na konci 1-týždňového intervalu aplikácie. Priemerná koncentrácia počas 3. týždňa bola v rozsahu 3,6‑5,7 µg/l.
Vplyv telesnej hmotnosti a indexu telesnej hmotnostiSérové koncentrácie etinylestradiolu a gestodénu počas liečby apleekom závisia od telesnej hmotnosti alebo indexu telesnej hmotnosti ženy. U obéznych žien s indexom telesnej hmotnosti >35 kg/m
2 súpriemerné sérové koncentrácie etinylestradiolu o 24 % a gestodénu o 30 % nižšie , ako sérové koncentrácie, ktoré sú pozorované u žien s normálnym indexom telesnej hmotnosti ≤30 kg/m
2. Údaje o antikoncepčnom účinku u žien s indexom telesnej hmotnosti ≥30 kg/m
2 sú obmedzené.
Vplyv tepla, vlhkosti, cvičenia a miesta aplikácieFarmakokinetické vlastnosti etinylestradiolu a gestodénu po aplikácii apleeku sa skúmali v špecifických podmienkach tepla, vlhkosti a cvičenia, napr. v saune, hydromasážnej vani, bazéne a pri rôznych telesných cvičeniach, v porovnaní s normálnou aktivitou. Bioekvivalencia bola vo všeobecnosti preukázaná pre parametre C
max a AUC etinylestradiolu a gestodénu v týchto špecifických podmienkach. Výsledky ukazujú, že sa nepozoruje žiadny klinicky významný rozdiel v expozícii etinylestradiolu a gestodénu v špecifických podmienkach vyskytujúcich sa v zariadeniach pre zdravý životný štýl, napríklad v saune, hydromasážnej vani, bazéne alebo pri rôznych telesných cvičeniach, v porovnaní s normálnymi aktivitami počas každodenného života.
Vo formálnom farmakokinetickom skúšaní (nekompartmentálna analýza), v ktorom sa porovnávali tri rôzne miesta aplikácie, bola priemerná systémová expozícia pri aplikovaní náplasti na vonkajšiu časť nadlaktia gestodénu o 24 % a etinylestradiolu o 31 % vyššia, v porovnaní so zadkom alebo bruchom. Rozsah expozičných údajov pre všetky tri miesta aplikácie sa vo veľkej miere prekrýval. Analýzy farmakokinetiky populácií (meta-analýza) preukázali, že geometrický priemer hodnôt expozície etinylestradiolu (AUC (0-168) and C
max) bol vyšší o 41 % po aplikácii na rameno alebo zadok v porovnaní s aplikáciou na brucho. Pre celkový gestodén boli rozdiely priemerných hodnôt AUC (0-168) 26 % a C
max 22 %. Nič nenasvedčuje tomu, že by rozdiely v priemernej expozícii ovplyvňovali bezpečnosť alebo účinnosť apleeku.
Údaje porovnávajúce transdermálny apleek s kombinovanou perorálnou antikoncepciouV skúšaní relatívnej biologickej dostupnosti sa ustálené sérové koncentrácie a farmakokinetické parametre etinylestradiolu a gestodénu po aplikácii apleeku porovnávali s kombinovanou perorálnou antikoncepciou obsahujúcou 0,020 mg etinylestradiolu a 0,075 mg gestodénu. Priemerné ustálené hodnoty C
max etinylestradiolu a gestodénu boli vo všeobecnosti o 30 %‑40 % nižšie po aplikácii apleeku v porovnaní s kombinovanou perorálnou antikoncepciou. Expozícia (AUC a C
av) etinylestradiolu bola porovnateľná po použití oboch ciest podania, zatiaľ čo expozícia na báze gestodénu (koncentrácia neviazaného liečiva) bola o 18 % nižšia po aplikácii apleeku. Na základe týchto údajov sa vykonali odhady priemernej expozície/dávky pre apleek, ktoré sú ekvivalentné dennému perorálnemu podávaniu 0,020 mg etinylestradiolu a 0,060 mg gestodénu. Variabilita medzi pacientmi (% CV) v prípade hlavných farmakokinetických parametrov ako C
max a AUC po aplikácii apleeku bola nižšia v prípade etinylestradiolu, ale vyššia v prípade gestodénu v porovnaní s variabilitou pozorovanou po perorálnom podaní.
Distribúcia
Etinylestradiol sa vo veľkej miere, ale nešpecificky viaže na sérový albumín (približne 98 %), nie však na SHBG. Gestodén sa v rozsiahlej miere viaže na sérový albumín a na SHBG. Iba približne 1 % z celkových sérových koncentrácií liečiva je prítomné ako voľný steroid, 40‑80 % sa viaže na SHBG. Etinylestradiol vyvoláva silné zvýšenie sérových koncentrácií SHBG, zatiaľ čo podanie gestodénu má za následok mierny pokles koncentrácie SHBG. Po opakovanej dermálnej aplikácii apleeku sú priemerné ustálené sérové koncentrácie SHBG v rozsahu 201‑237 nmol/l.
Po intravenóznom podaní etinylestradiolu bol zistený zdanlivý distribučný objem v rozsahu 3‑9 l/kg. Príslušný zdanlivý distribučný objem gestodénu je približne 0,7 l/kg.
Biotransformácia
Etinylestradiol (EE) sa metabolizuje najmä prostredníctvom aromatickej hydroxylácie, ale tvorí sa široký rozsah hydroxylovaných a metylovaných metabolitov, ktoré sú prítomné ako voľné metabolity a ako konjugáty s glukuronidmi a sulfátom. Hlavnou dráhou metabolizmu etinylestradiolu je 2-hydroxylácia závislá od enzýmu CYP450 a tvorba 2-hydroxy-EE katecholestrogénu. 2-hydroxylácia EE je katalyzovaná skupinami génov CYP2C, CYP2E a CYP3A. Rýchlosť metabolického klírensu je v rozsahu 2‑7 ml/min/kg.
Gestodén sa úplne metabolizuje na všeobecne polárnejšie metabolity. Metabolizmus gestodénu je charakterizovaný hydroxyláciou na niekoľkých pozíciách steroidového jadra a redukciou funkčnej skupiny 3-keto a dvojitej väzby delta-4. Neboli opísané žiadne aktívne metabolity. Okrem CYP3A4 môže prispievať k metabolizmu gestodénu v menšom rozsahu aj skupina ďalších enzýmov cytochrómu P450.V dvoch skúšaniach zaoberajúcich sa účinkom inhibítorov CYP3A4 (ketokonazol, erytromycín) neboli sérové koncentrácie etinylestradiolu v ustálenom stave ovplyvnené žiadnym z týchto dvoch inhibítorov. V prípade gestodénu malo súbežné podávanie inhibítorov za následok zvýšenie parametra AUC(0-168) o 11 % v prípade ketokonazolu a o 34 % v prípade erytromycínu. Toto malé zvýšenie, ktoré má za následok expozíciu v rozsahu kombinovaných perorálnych antikoncepcií dostupných na trhu, sa nepovažuje za klinicky významné.
V skúšaní skúmajúcom účinok apleeku na jednorazové podanie midazolamu, čo je modelový substrát pre látky, ktoré sú metabolizované prostredníctvom enzýmu CYP3A4, sa nepozorovalo žiadne klinicky významné zvýšenie plazmatických koncentrácií midazolamu. Súbežné podávanie midazolamu malo za následok malé zvýšenie parametrov midazolamu: AUC(0-t
last) o 7 % a C
max o 14 %
Etinylestradiol sa vo významnom rozsahu nevylučuje v nezmenenej forme. Metabolity etinylestradiolu sa vylučujú močom a žlčou v pomere 4:6. Pokles sérovej koncentrácie je charakterizovaný najmenej dvomi dispozičnými fázami s terminálnym polčasom približne 16 hodín zisteným po intravenóznom podaní, čo má za následok vo všeobecnosti nekvantifikovateľné koncentrácie dva dni po odstránení náplasti.
Gestodén sa nevylučuje v nezmenenej forme. Jeho metabolity sa vylučujú močom a žlčou v pomere približne 6:4. Po odstránení náplasti sa celkové sérové koncentrácie gestodénu znižujú pomalšie v porovnaní s etinylestradiolom s priemerným terminálnym polčasom približne 26 hodín.
Linearita/nelinearita
Farmakokinetické vlastnosti etinylestradiolu sú lineárne s ohľadom na dávku v rozsahu 0,020 mg‑0,100 mg. Nepozorovala sa žiadna klinicky významná zmena farmakokinetických vlastností etinylestradiolu s časom.
Farmakokinetické vlastnosti gestodénu závisia od koncentrácie SHBG, ktorá samotná je ovplyvnená estrogénmi, androgénmi a aj gestodénom. Po opakovanej dermálnej aplikácii apleeku sa pozorujú 3- až 4‑násobne zvýšené koncentrácie SHBG v porovnaní s typickými východiskovými hodnotami. V súlade s tým sa ustálené sérové hladiny gestodénu líšia od hladín po jednorazovej aplikácii. Tieto zmeny súvisiace s SHBG spôsobujú nelineárnu zmenu farmakokinetických vlastností gestodénu s časom. Okrem toho sa farmakokinetické vlastnosti neviazaného gestodénu považovali za súvisiace s koncentráciou na základe troch skúšaní zameraných na farmakokinetické vlastnosti apleeku počas obdobia troch cyklov. Preto sa farmakokinetické vlastnosti gestodénu považujú za nelineárne s ohľadom na čas a koncentráciu.
Osobitné populácie
Pohlavieapleekjeindikovaný iba u žien.
Staršie ženyapleek nie indikovaný po menopauze.
Index telesnej hmotnostiÚdaje o antikoncepčnom účinku u žien s indexom telesnej hmotnosti >30 kg/m
2 sú obmedzené.
Porucha funkcie obličiekapleek sa neskúmal u žien s poruchou funkcie obličiek. Z dôvodu úplnej metabolizácie etinylestradiolu a gestodénu na neaktívne metabolity pred elimináciou a z dôvodu dostupnosti druhej dráhy vylučovania prostredníctvom pečene sa neočakáva žiadne zvýšené riziko pre ženy s poruchou funkcie obličiek.
Porucha funkcie pečeneapleek sa neskúmal u žien s poruchou funkcie pečene. apleek je kontraindikovaný u žien so závažným ochorením pečene v súčasnosti alebo v anamnéze, pokiaľ sa hodnoty pečeňových testov nevrátili na normálne hodnoty. Pozri tiež časť 4.3.
Etnické rozdielyFarmakokinetické vlastnosti etinylestradiolu sa skúmali v kombinácii s iným gestagénom u belošiek, Číňaniek a Japoniek, pričom tieto skúšania neodhalili žiadny klinicky významný rozdiel. Farmakokinetické vlastnosti apleeku sa neskúmali špecificky u žien rôznych etnických pôvodov. Nie sú známe žiadne polymorfné enzýmy prispievajúce vo veľkom rozsahu k metabolizácii gestodénu. Preto dostupné údaje nenaznačili žiadny rozdiel farmakokinetických vlastností apleeku medzi ženami rôznych etnických pôvodov. Veľmi obmedzené dáta sú k dispozícii ohľadom ázijských žien.
FajčenieNeexistuje žiadny náznak toho, že by fajčenie malo nejaký vplyv na farmakokinetické vlastnosti etinylestradiolu a gestodénu.
Bezpečnosť a účinnosť u dospievajúcich vo veku do 18 rokov neboli stanovené. Použitie apleeku sa netýka detí a dospievajúcich pred prvou menštruáciou.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje o liečivách získané na základe zvyčajných skúšaní toxicity po opakovanom podávaní, genotoxicity, lokálnej znášanlivosti, karcinogénneho potenciálu a reprodukčnej toxicity neodhalili žiadne osobitné riziko pre ľudí. Treba však pamätať na to, že pohlavné steroidy môžu podporovať rast určitých tkanív a nádorov závislých od hormónov. Skúšania biologickej kompatibility s náplasťou a jej materiálmi neodhalili žiadne osobitné riziko pre ľudí s ohľadom na lokálnu a systémovú bezpečnosť náplasti.
Hodnotenie environmentálneho rizika (ERA)
Liečivá gestodén a etinylestradiol prestavujú riziko pre životné prostredie, najmä pre ryby. Gestodén a etinylestradiol navyše zostávajú dlhodobo v životnom prostredí. Všetky použité alebo nepoužité náplasti treba vrátiť do lekárne. V prípade pochybností sa poraďte s lekárnikom (pozri časť 6.6).
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokZadná vrstva:Vonkajšia vrstva z polyetylénu (PE) s nízkou hustotou
Lepiaca vrstva:Lep obsahuje:
ester hydrogenovanej živice
polybutén
polyizobutylén
pentaerytritol tetrakis(3‐(3,5‐di‐terc‐butyl‐4‐hydroxyfenyl) propionát)
bemotrizinol
Oddeľujúca fólia:Film z polyetyléntereftalátu (PET)
Lepiaca matrica:Lep obsahuje:
ester hydrogenovanej živice
polybutén
polyizobutylén
pentaerytritol tetrakis(3‐(3,5‐di‐terc‐butyl‐4‐hydroxyfenyl) propionát)
Vrstva uvoľňujúca liečivo:Film zo silikonizovaného polyetyléntereftalátu (PET)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti3 roky
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v pôvodnom vrecku na ochranu pred svetlom a vlhkosťou.
Neuchovávajte v mrazničke.
6.5 Druh obalu a obsah baleniaPrimárny obalový materiálVrecko je zložené zo štyroch vrstiev: film z polyetylénu s nízkou hustotou (najvnútornejšia vrstva), hliníková fólia, papierová vrstva a film z polyetyléntereftalátu.
Oddeľovacia fólia vyrobená zo silikonizovaného polyetyléntereftalátu zabraňuje prilepeniu transdermálnej náplasti vo vnútri vrecka.
Sekundárny obalový materiálVrecká sú označené a zabalené spolu s brožúrou (vrátane pripomienkovej karty a pripomienkových nálepiek) v kartónovej skladacej škatuľke.
Každá skladacia škatuľka obsahuje 3, 9 alebo 18 transdermálnych náplastí apleek v samostatných vreckách.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomNáplasť sa má aplikovať hneď po vybratí z ochranného vrecka.
Na oblasť pokožky, kde je umiestnený alebo kam sa bude umiestňovať apleek, sa nesmú aplikovať žiadne mejkapy, krémy, telové mlieka, púdre ani iné lokálne aplikované produkty, aby sa zabránilo narušeniu adhéznych vlastností apleeku.
Liečivá gestodén a etinylestradiol predstavujú riziko pre životné prostredie, najmä pre ryby. Gestodén a etinylestradiol navyše zostávajú dlhodobo v životnom prostredí. Použité náplasti sa nesmú splachovať do záchoda ani vyhadzovať do kanalizácie. Použitá náplasť sa má starostlivo zlikvidovať v súlade s nasledujúcimi pokynmi.
Pôvodné vrecko sa má po použití odložiť na likvidáciu náplasti. Použitú náplasť treba preložiť na polovicu adhéznou/lepiacou stranou smerom dovnútra. Treba ju vložiť do pôvodného vrecka a uzavrieť preložením otvoreného okraja.
Na vrecku je obojstranná nálepka. Prvú stranu nálepky treba zdvihnúť a použiť na zalepenie preloženého okraja vrecka. Na druhej strane pod prvou stranou možno nájsť pokyny na likvidáciu.
Náplasť sa má bezpečne odložiť mimo dosahu detí alebo domácich zvierat.
Všetky použité alebo nepoužité náplasti treba vrátiť do lekárne. V prípade pochybností sa poraďte s lekárnikom.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIBayer spol. s r.o
Digital Park II, Einsteinova 25
851 01 Bratislava
Slovakia
8. REGISTRAČNÉ ČÍSLO 17/0143/14-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU