
l, a/alebo je počet trombocytov
<75 x 109/l.
O
d
p
o
r
účaná dávka
Odporúčaná začiatočná dávka je 10 mg lenalidomidu perorálne jedenkrát denne v 1. až 21.deň opakovaných 28-dňových cyklov až 9 cyklov, melfalán 0,18 mg/kg perorálne v 1. až 4.deň opakovaných 28-dňových cyklov, prednizón 2 mg/kg perorálne v 1. až 4.deň opakovaných
28-dňových cyklov. Pacienti ktorí dokončia 9 cyklov, alebo ktorí nemôžu dokončiť kombinovanú liečbu z dôvodu intolerancie, sú liečení monoterapiou lenalidomidom nasledujúcim spôsobom: 10 mg perorálne jedenkrát denne v 1. až 21.deň opakovaných 28-dňových cyklov až do progresie ochorenia.
·
Kroky pri znižovaní dávky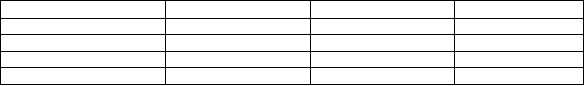
lenalidomid melfalán prednizón
Začiatočná dávka 10 mgª 0,18 mg/kg 2 mg/kg Dávka na úrovni -1 7,5 mg 0,14 mg/kg 1 mg/kg Dávka na úrovni -2 5 mg 0,10 mg/kg 0,5 mg/kg Dávka na úrovni -3 2,5 mg Neuplatňuje sa 0,25 mg/kg
ª Ak je neutropénia jedinou toxicitou na akejkoľvek úrovni dávky, pridajte faktor stimulujúci kolónie granulocytov (Granulocyte colony
Stimulating Factor, G-CSF), a udržujte dávku lenalidomidu
· Trombocytopénia Keďtrombocyty Odporúčanýpostup Prvýkrát klesnú na < 25 x 109/l Prerušenie liečby lenalidomidom
Vrátia sa na ≥ 25 x 109/l Pokračovanie liečby lenalidomidom
amelfalánomvdávkenaúrovni-1 Každý ďalší pokles pod 30 x 109/l Prerušenie liečby lenalidomidom
Vrátia sa na ≥ 30 x 109/l Pokračovanie liečby lenalidomidom v dávke najbližšej nižšej úrovne (dávka na úrovni -2
alebo -3) jedenkrát denne. 
·
NeutropéniaKeď neutrofily Odporúčaný postup

Prvýkrát klesnú na < 0,5 x 109/lª Prerušenie liečby lenalidomidom

Vrátia sa na ≥ 0,5 x 109/l keď je neutropénia jedinou pozorovanou toxicitou

Vrátia sa na ≥ 0,5 x 109/l keď sa pozorujú iné, od dávky závislé hematologické toxicity ako neutropénia
Pokračovanie liečby lenalidomidom v začiatočnej dávke jedenkrát denne Pokračovanie liečby lenalidomidom v dávke na úrovni -1 jedenkrát denne
Každý ďalší pokles pod < 0,5 x 109/l Prerušenie liečby lenalidomidom

Vrátia sa na ≥ 0,5 x 109/l Pokračovanie liečby lenalidomidom v dávke najbližšej nižšej úrovne jedenkrát denne.
ªV prípade, že pacient nebol liečený G-CSF, začnite liečbu G-CSF. V deň 1 nasledujúceho cyklu, pokračujte v podávaní G-CSF podľa potreby a udržujte dávku lenalidomidu v prípade, že neutropénia bola jediná DLT. V opačnom prípade, znížte dávku o jednu úroveň na začiatku nasledujúceho cyklu.
Mnohopočetný myelóm s aspoň jednou predchádzajúcou liečbouLiečba lenalidomidom sa nesmie začať, ak je ANC < 1,0 x 109/l a/alebo ak je počet trombocytov
< 75 x 109/l alebo, v závislosti od rozsahu infiltrácie kostnej drene plazmatickými bunkami, počet trombocytov < 30 x 109/l.
Odporúčaná dávkaOdporúčaná začiatočná dávka je 25 mg lenalidomidu perorálne jedenkrát denne v 1. až 21. deň opakovaných 28-dňových cyklov. Odporúčaná dávka dexametazónu je 40 mg perorálne jedenkrát denne v 1. až 4., 9. až 12. a 17. až 20. deň každého 28-dňového cyklu počas prvých 4 cyklov terapie a potom 40 mg denne v 1. až 4. deň každých 28 dní.
Predpisujúci lekári majú starostlivo zhodnotiť, ktorú dávku dexametazónu použiť, pričom treba vziať do úvahy zdravotný stav a stav ochorenia pacienta.
Kroky pri znižovaní dávky

Začiatočná dávka 25 mg Dávka na úrovni -1 15 mg Dávka na úrovni -2 10 mg Dávka na úrovni -3 5 mg
Trombocytopénia Keďtrombocyty Odporúčanýpostup Prvýkrát klesnú na < 30 x 109/l Prerušenie liečby lenalidomidom
Vrátia sa na ≥ 30 x 109/l Pokračovanie liečby lenalidomidom v dávke na
úrovni-1 Každý ďalší pokles pod 30 x 109/l Prerušenie liečby lenalidomidom
Vrátia sa na ≥ 30 x 109/l Pokračovanie liečby lenalidomidom v dávke najbližšej nižšej úrovne (dávka na úrovni -2 alebo -3) jedenkrát denne. Nepodávať dávku
nižšiu ako 5 mg jedenkrát denne.  Neutropénia
NeutropéniaKeď neutrofily Odporúčaný postup

Prvýkrát klesnú na < 0,5 x 109/l Prerušenie liečby lenalidomidom

Vrátia sa na ≥ 0,5 x 109/l, keď je neutropénia jedinou pozorovanou toxicitou
Vrátia sa na ≥ 0,5 x 109/l, keď sa pozorujú iné, od dávky závislé hematologické toxicity ako
neutropénia
Pokračovanie liečby lenalidomidom v začiatočnej dávke jedenkrát denne Pokračovanie liečby lenalidomidom v dávke na úrovni -1 jedenkrát denne

Každý ďalší pokles pod < 0,5 x 109/l Prerušenie liečby lenalidomidom
Vrátia sa na ≥ 0,5 x 109/l Pokračovanie liečby lenalidomidom v dávke najbližšej nižšej úrovne (dávka na úrovni -1, -2

alebo -3) jedenkrát denne. Nepodávať dávku nižšiu ako 5 mg jedenkrát denne.
Reakcia vzplanutia nádoruV liečbe lenalidomidom u pacientov s reakciou vzplanutia nádoru (TFR, tumour flare reaction)
1. alebo 2. stupňa sa može pokračovať bez prerušenia alebo úpravy dávkovania po uvážení lekára. U pacientov s TFR 3. alebo 4. stupňa prerušte liečbu lenalidomidom, kým TFR neklesne
na ≤ 1. stupeň a pacienti môžu byť liečení symptomaticky podľa odporúčania pre liečbu TFR 1. a
2. stupňa (pozri časť 4.4).
V prípade iných toxicít 3. alebo 4. stupňa ohodnotených ako súvisiacich s lenalidomidom má byť liečba prerušená a znovu obnovená v najbližšej nižšej úrovni dávky iba keď sa toxicita zmiernila na
≤ 2. stupeň podľa uváženia lekára.
Prerušenie alebo ukončenie liečby lenalidomidom sa má zvážiť pri kožnom výseve 2. alebo 3. stupňa. Liečba lenalidomidom sa musí ukončiť pri angioedéme, výseve 4. stupňa, exfoliatívnom alebo bulóznom výseve alebo pri podozrení na Stevensov-Johnsonov syndróm (SJS), na toxickú epidermálnu nekrolýzu (Toxic epidermal necrolysis, TEN) alebo pri liekovej reakcii s eozinofíliou
a systémovými symptómami (DRESS) a po ukončení kvôli týmto reakciám sa nemá liečba opäť znovu obnoviť.
Osobitné populácieStaršie osobyV súčasnosti dostupné farmakokinetické údaje sú popísané v časti 5.2. Lenalidomid sa v klinických štúdiách používal u pacientov s mnohopočetným myelómom vo veku do 91 rokov (pozri časť 5.1).
Keďže u starších pacientov je pravdepodobnejšia znížená funkcia obličiek, odporúča sa starostlivá voľba dávkovania a sledovanie činnosti obličiek.
Novodiagnostikovaný mnohopočetný myelóm: pacienti nespôsobilí na transplantáciu
Pacienti s novodiagnostikovaným mnohopočetným myelómom vo veku 75 rokov a starší majú byť starostlivo vyšetrení pred začatím liečby (pozri časť 4.4).
U pacientov starších ako 75 rokov liečených lenalidomidom v kombinácii s dexametazónom je začiatočná dávka dexametazónu 20 mg denne v 1., 8., 15. a 22. deň každého 28-dňového cyklu.
Pre pacientov starších ako 75 rokov liečených lenalidomidom v kombinácii s melfalánom a prednizónom nebola navrhnutá úprava dávky.
U pacientov s novodiagnostikovaným mnohopočetným myelómom vo veku 75 rokov a starších, ktorí užívali lenalidomid, bola pozorovaná vyššia incidencia závažných nežiaducich účinkov a nežiaducich účinkov, ktoré viedli k prerušeniu liečby.
Kombinovaná liečba lenalidomidom bola menej tolerovaná u pacientov s novodiagnostikovaným mnohopočetným myelómom starších ako 75 rokov v porovnaní s mladšou populáciou. Títo pacienti prerušovali liečbu vo vyššej miere kvôli intolerancii (3. alebo 4. stupeň nežiaducich účinkov a závažných nežiaducich účinkov), v porovnaní s pacientmi < 75 rokov.
Mnohopočetný myelóm: pacienti s aspoň jednou predchádzajúcou liečbou
Percento pacientov s mnohopočetným myelómom vo veku 65 alebo starších sa výrazne neodlišovalo medzi skupinou liečenou lenalidomidom/dexametazónom a placebom/dexametazónom. Z hľadiska bezpečnosti a účinnosti sa nepozoroval žiadny celkový rozdiel medzi týmito a mladšími pacientmi,
u starších osôb však nemožno vylúčiť väčšiu predispozíciu.
· Pacientisporuchoufunkcieobličiek
Lenalidomid sa vylučuje predovšetkým obličkami; u pacientov s vyšším stupňom poruchy funkcie obličiek môže byť narušená tolerancia liečby (pozri časť 4.4). Odporúča sa starostlivá voľba dávkovania a sledovanie činnosti obličiek.
U pacientov s miernou poruchou funkcie obličiek a s mnohopočetným myelómom nie je potrebná úprava dávky.
Nasledovné úpravy dávky sa odporúčajú na začiatku liečby a po celú dobu liečby u pacientov so
stredne ťažkou alebo ťažkou poruchou funkcie obličiek a v konečnom štádiu ochorenia obličiek. Nie sú skúsenosti z klinických štúdií fázy III s konečným štádiom ochorenia obličiek (End Stage Renal Disease, ESRD) (CLcr <30 ml/min, vyžadujúcich dialýzu).
Mnohopočetný myelóm
Funkcia obličiek (CLcr) Úprava dávky
(1. až 21. deň opakovaných
28-dňových cyklov)
Stredne ťažká porucha funkcie obličiek
(30 ≤ CLcr < 50 ml/min)
Ťažká porucha funkcie obličiek
(CLcr < 30 ml/min, nevyžaduje dialýzu)
Konečné štádium ochorenia obličiek (End Stage Renal Disease, ESRD)
(CLcr < 30 ml/min, vyžaduje dialýzu)
10 mg jedenkrát denne1
7,5 mg jedenkrát denne2
15 mg každý druhý deň
5 mg jedenkrát denne. V deň dialýzy sa má dávka podať po dialýze.

1 Dávku je možné po 2 cykloch zvýšiť na 15 mg jedenkrát denne, ak pacient nereaguje na liečbu a liečbu dobre znáša.
2 V krajinách, v ktorých sú dostupné 7,5 mg kapsuly.
Po začatí liečby lenalidomidom má následná úprava dávky u pacientov s poruchou funkcie obličiek vychádzať zo znášanlivosti liečby individuálneho pacienta, ako je to popísané vyššie.
·
Pacientisporuchoufunkciepečene
Lenalidomid sa neskúmal konkrétne u pacientov s poruchou funkcie pečene a neexistujú žiadne zvláštne odporúčania na dávkovanie.
· Pediatrickápopulácia
Lenalidomid sa nemá používať u detí a dospievajúcich od narodenia do menej ako 18 rokov vzhľadom na bezpečnosť (pozri časť 5.1).
Spôsobpodávania
Perorálne užívanie.
Tvrdé kapsuly Lenalidomide Accord sa majú užívať perorálne približne v rovnaký čas v plánované dni. Kapsuly sa nemajú otvárať, lámať ani hrýzť. Kapsuly sa majú prehĺtať celé, najlepšie je ich zapiť
vodou. Kapsuly sa môžu užívať s jedlom alebo bez jedla.
Pri vyberaní kapsuly z blistra sa odporúča zatlačiť len na jednej strane, aby sa minimalizovalo riziko deformácie alebo rozlomenia kapsuly.
4.3 Kontraindikácie
· Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
· Gravidné ženy.
· Ženy, ktoré môžu otehotnieť, pokiaľ nie sú splnené všetky podmienky Programu prevencie gravidity (pozri časti 4.4 a 4.6).
4.4 Osobitné upozornenia a opatrenia pri používaní
Upozornenietýkajúcesagravidity
Lenalidomid je štrukturálne príbuzný s talidomidom. Talidomid je liečivo so známym teratogénnym účinkom u ľudí, ktoré spôsobuje závažné život ohrozujúce vrodené chyby. U opíc spôsobil lenalidomid malformácie podobné tým, ktoré boli popísané pre talidomid (pozri časti 4.6 a 5.3). Ak sa lenalidomid užíva počas gravidity, u ľudí sa očakáva teratogénny účinok lenalidomidu.
Podmienky Programu prevencie gravidity musia byť splnené u všetkých pacientok, pokiaľ neexistuje spoľahlivý dôkaz, že žena nemôže otehotnieť.
Kritériápreženy,ktorénemôžuotehotnieť
Pacientka alebo partnerka pacienta môže otehotnieť, pokiaľ nespĺňa aspoň jedno z nasledovných kritérií:
· Vek ≥ 50 rokov a prirodzená amenorea ≥ 1 rok (amenorea po liečbe rakoviny alebo počas dojčenia nevylučuje možnosť otehotnenia).
· Špecializovaným gynekológom potvrdené predčasné zlyhanie vaječníkov.
· Predchádzajúca bilaterálna salpingo-ooforektómia alebo hysterektómia.
· Genotyp XY, Turnerov syndróm, agenéza maternice.
Poradenstvo
U žien, ktoré môžu otehotnieť, je lenalidomid kontraindikovaný, pokiaľ nie sú splnené všetky nasledovné podmienky:
· Uvedomuje si očakávané teratogénne riziko pre plod.
· Uvedomuje si potrebu účinnej antikoncepcie používanej bez prerušenia počas 4 týždňov pred začatím liečby, počas celého trvania liečby a počas 4 týždňov po ukončení liečby.
· Aj keď má žena, ktorá môže otehotnieť, amenoreu, musí dodržiavať všetky odporúčania o účinnej antikoncepcii.
· Má byť schopná dodržiavať účinné antikoncepčné opatrenia.
· Je informovaná a uvedomuje si potenciálne dôsledky gravidity a potrebu rýchlej konzultácie v prípade rizika možnej gravidity.
· Uvedomuje si potrebu začatia liečby hneď ako je lenalidomid vydaný po negatívnom tehotenskom teste.
· Uvedomuje si potrebu a súhlasí s vykonaním tehotenských testov každé 4 týždne, s výnimkou prípadu potvrdenej sterilizácie vajíčkovodov.
· Potvrdí, že rozumie rizikám a potrebným preventívnym opatreniam spojeným s užívaním lenalidomidu.
U mužov užívajúcich lenalidomid farmakokinetické údaje preukázali, že lenalidomid je počas liečby prítomný v ľudskej sperme vo veľmi malých množstvách a u zdravých jedincov je nedetekovateľný
v ľudskej sperme 3 dni po ukončení jeho užívania (pozri časť 5.2). V rámci prevencie a vzhľadom na
osobitné populácie s predĺženou elimináciou, ako napr. pri poruche funkcie obličiek, musia všetci pacienti - muži užívajúci lenalidomid spĺňať nasledovné podmienky:
· Uvedomujú si očakávané teratogénne riziko v prípade pohlavného styku s tehotnou ženou alebo so ženou, ktorá môže otehotnieť
· Uvedomujú si potrebu používania kondómov, ak majú pohlavný styk s tehotnou ženou alebo so ženou, ktorá môže otehotnieť a nepoužíva účinnú antikoncepciu (aj keď muž podstúpil vazektómiu), a to počas liečby a ešte 1 týždeň po prerušení a/alebo ukončení liečby.
· Porozumeli tomu, že pacient má okamžite informovať svojho ošetrujúceho lekára, ak jeho partnerka otehotnie, pokiaľ užíva lenalidomid alebo krátko po tom, ako prestal užívať lenalidomid, a že sa odporúča odkázať partnerku na vyšetrenie k lekárovi so špecializáciou alebo skúsenosťami v teratológii na posúdenie a konzultáciu.
Lekár predpisujúci liek musí v prípade ženy, ktorá môže otehotnieť, zabezpečiť aby:
· Pacientka spĺňala podmienky Programu prevencie gravidity vrátane uistenia, že im dostatočne porozumela.
· Pacientka vyššie uvedené podmienky potvrdila.
Antikoncepcia
Ženy, ktoré môžu otehotnieť, musia používať niektorú z účinných metód antikoncepcie počas
4 týždňov pred liečbou, počas liečby a počas 4 týždňov po liečbe lenalidomidom, dokonca i v prípade jej prerušenia, s výnimkou, že sa pacientka zaviaže k úplnej a nepretržitej, mesačne potvrdenej sexuálnej abstinencii. Ak pacientka ešte nepoužíva účinnú antikoncepciu, musí byť odporučená k vyškolenému zdravotníckemu pracovníkovi, ktorý jej poradí s výberom vhodnej antikoncepcie, aby mohla začať s jej používaním.
Nasledovné príklady sa môžu považovať za vhodné metódy antikoncepcie:
· Implantát
· Vnútromaternicový systém (intrauterine system, IUS) uvoľňujúci levonorgestrel
· Depotný medroxyprogesterónacetát
· Sterilizácia vajíčkovodov
· Sexuálny styk výhradne s partnerom, ktorý podstúpil vazektómiu, pričom vazektómia musí byť overená dvomi negatívnymi rozbormi spermy
· Tabletky inhibujúce ovuláciu obsahujúce iba progesterón (t.j. dezogestrel)
Z dôvodu zvýšeného rizika venózneho tromboembolizmu u pacientov s mnohopočetným myelómom užívajúcich lenalidomid v kombinovanej liečbe a v menšej miere u pacientov s mnohopočetným myelómom užívajúcich lenalidomidom ako monoterapiu sa neodporúčajú kombinované perorálne antikoncepčné tabletky (pozri tiež časť 4.5).
Ak pacientka momentálne používa kombinovanú perorálnu antikoncepciu, má prejsť na jednu z vyššie
uvedených účinných metód antikoncepcie. Riziko venózneho tromboembolizmu pokračuje počas 4 až
6 týždňov po prerušení užívania kombinovanej perorálnej antikoncepcie. Účinnosť antikoncepčných steroidov sa počas súbežnej liečby dexametazónom môže znížiť (pozri časť 4.5).
Implantáty a vnútromaternicové systémy uvoľňujúce levonorgestrel sa spájajú so zvýšeným rizikom infekcie v čase zavádzania a nepravidelného vaginálneho krvácania. Antibiotická profylaxia sa má zvážiť najmä u pacientok s neutropéniou.
Vnútromaternicové telieska uvoľňujúce meď sa všeobecne neodporúčajú z dôvodu potenciálnych rizík infekcie v čase zavádzania a straty menštruačnej krvi, čo môže ohroziť pacientky s neutropéniou alebo trombocytopéniou.
Tehotenskétesty
U žien, ktoré môžu otehotnieť, sa musia v súlade s odporúčaniami pod lekárskym dohľadom vykonať tehotenské testy minimálne s citlivosťou 25 mIU/ml, ako sa uvádza nižšie. Táto požiadavka platí aj pre ženy, ktoré môžu otehotnieť a dodržiavajú úplnú a nepretržitú sexuálnu abstinenciu. V ideálnom prípade sa má uskutočniť tehotenský test, predpísanie a vydanie lieku v rovnaký deň. Lenalidomid sa má vydať ženám, ktoré môžu otehotnieť, do 7 dní od jeho predpísania.
Pred začatím liečby
Ak pacientka už aspoň 4 týždne používala účinnú antikoncepciu, má byť počas konzultácie pri predpisovaní lenalidomidu, alebo 3 dni pred návštevou u predpisujúceho lekára, vykonaný tehotenský test pod lekárskym dohľadom. Tento test má zaručiť, že pacientka nie je pri začatí liečby lenalidomidom tehotná.
Sledovanie a ukončenie liečby
Tehotenský test pod lekárskym dohľadom sa má opakovať každé 4 týždne, vrátane 4 týždňov po ukončení liečby, s výnimkou prípadu potvrdenej sterilizácie vajíčkovodov. Tieto tehotenské testy sa majú vykonávať v deň návštevy u lekára pri predpísaní lieku alebo počas 3 dní pred návštevou
u predpisujúceho lekára.
Ďalšiepreventívneopatrenia
Pacienti majú byť poučení o tom, že nikdy nesmú dať tento liek inej osobe, a že po ukončení liečby majú kvôli bezpečnej likvidácii vrátiť všetky nepoužité kapsuly svojmu lekárnikovi.
Pacienti nesmú darovať krv počas liečby a 1 týždeň po ukončení užívania lenalidomidu. Edukačnémateriály,obmedzeniapreskripcieavýdajalieku
V snahe pomôcť pacientom predísť expozícii plodu lenalidomidom, držiteľ rozhodnutia o registrácii
poskytne zdravotníckym pracovníkom edukačné materiály, ktorých cieľom je zdôrazniť upozornenia týkajúce sa očakávaných teratogénnych účinkov lenalidomidu, poskytnúť rady týkajúce sa antikoncepcie pred začatím liečby a poskytnúť návod na potrebné tehotenské testy. Predpisujúci lekár musí informovať pacientov - mužov a ženy - o predpokladanom teratogénnom riziku a o prísnych opatreniach na prevenciu gravidity špecifikovaných v Programe prevencie gravidity a poskytnúť pacientom vhodnú vzdelávaciu brožúru, kartu pacienta a/alebo ekvivalentnú pomôcku v súlade
s národným systémom kariet pacienta. Národný systém kontrolovanej distribúcie bol implementovaný v spolupráci s príslušným národným úradom. Systém kontrolovanej distribúcie zahŕňa používanie karty pacienta a/alebo ekvivalentnej pomôcky na kontrolu predpisovania a/alebo výdaja lieku a zbieranie podrobných údajov o indikácii za účelom dôkladného sledovania používania lieku mimo schválenej indikácie v rámci národného územia. V ideálnom prípade sa má tehotenský test, predpísanie a výdaj lieku uskutočniť v rovnaký deň. Lenalidomid sa má vydať ženám, ktoré môžu otehotnieť, do 7 dní od jeho predpísania, na základe negatívneho tehotenského testu uskutočneného pod lekárskym dohľadom. Pre ženy, ktoré môžu otehotnieť, sa môže predpísať liek na jednom lekárskom predpise na maximálne 4 týždne a pre všetkých ostatných pacientov sa môže predpísať na jednom lekárskom predpise na maximálne 12 týždňov.
Ďalšieosobitnéupozorneniaaopatreniapripoužívaní
Infarkt myokardu
U pacientov užívajúcich lenalidomid, najmä u pacientov so známymi rizikovými faktormi a počas prvých 12 mesiacov pri použití v kombinácii s dexametazónom, bol zaznamenaný infarkt myokardu. Pacientov so známymi rizikovými faktormi – vrátane predchádzajúcej trombózy – je potrebné starostlivo sledovať a prijať opatrenia na minimalizáciu všetkých modifikovateľných rizikových faktorov (napr. fajčenie, hypertenzia a hyperlipidémia).
Venózne a arteriálne tromboembolické príhody
U pacientov s mnohopočetným myelómom je kombinovaná liečba lenalidomidom s dexametazónom spojená so zvýšeným rizikom venóznej tromboembólie (hlavne trombózy hlbokých žíl a pľúcnej embólie) a v menšej miere bola pozorovaná pri lenalidomid v kombinácii s melfalánom
a prednizónom.
U pacientov s mnohopočetným myelómom bola monoterapia lenalidomidom spojená s nižším rizikom venóznej trombembólie (hlavne trombózy hlbokých žíl a pľúcnej embólie), ako u pacientov s mnohopočetným myelómom liečených lenalidomidom v kombinovanej liečbe (pozri časti 4.5 a 4.8).
U pacientov s mnohopočetným myelómom je kombinovaná liečba lenalidomidom s dexametazónom spojená so zvýšeným rizikom arteriálnej tromboembólie (hlavne infarktu myokardu a cerebrovaskulárnej príhody), ktorá bola pozorovaná v menšej miere pri liečbe lenalidomidom v kombinácii s melfalánom a prednizónom. Riziko rozvoja ATE (arteriálnej tromboembólie) je nižšie u pacientov s mnohopočetným myelómom liečených lenalidomidom v monoterapii než u pacientov s mnohopočetným myelómom liečených lenalidomidom v kombinovanej liečbe.
Preto je potrebné pacientov so známymi rizikovými faktormi pre tromboembóliu – vrátane predchádzajúcej trombózy – starostlivo sledovať. Je potrebné prijať opatrenia na minimalizáciu všetkých modifikovateľných rizikových faktorov (napr. fajčenie, hypertenzia a hyperlipidémia). Súbežné podávanie erytropoetických látok alebo predchádzajúca anamnéza tromboembolických príhod môže u týchto pacientov tiež zvyšovať riziko vzniku trombózy. Preto sa erytropoetické látky alebo iné látky, ktoré môžu zvyšovať riziko trombózy, ako napríklad hormonálna substitučná liečba, majú u pacientov s mnohopočetným myelómom, ktorým sa podáva lenalidomid s dexametazónom používať s opatrnosťou. Koncentrácia hemoglobínu nad 12 g/dl má viesť k prerušeniu užívania erytropoetických látok.
Pacientom a lekárom sa odporúča pozorne sledovať prejavy a príznaky tromboembolizmu. Pacientov treba poučiť, aby vyhľadali lekársku pomoc, ak sa u nich vyvinú príznaky, ako je dýchavičnosť, bolesť na hrudi, opuch rúk alebo nôh. Profylaktické antitrombotiká sa odporúčajú najmä u pacientov
s ďalšími rizikovými faktormi pre trombotické problémy. Rozhodnutie o prijatí antitrombotických
profylaktických opatrení sa má uskutočniť po dôkladnom zhodnotení základných rizikových faktorov u jednotlivých pacientov.
Ak sa u pacienta vyskytne akákoľvek tromboembolická príhoda, liečba sa musí prerušiť a musí sa nasadiť štandardná antikoagulačná liečba. Po stabilizácii pacienta antikoagulačnou liečbou a po zvládnutí všetkých komplikácií tromboembolickej príhody sa môže liečba lenalidomidom znovu začať v pôvodnej dávke v závislosti od posúdenia prínosu a rizika. Pacient má pokračovať v antikoagulačnej liečbe počas liečby lenalidomidom.
Neutropénia a trombocytopénia
Hlavné toxicity obmedzujúce dávku (DLT) lenalidomidu zahŕňajú neutropéniu a trombocytopéniu. Na začiatku liečby, každý týždeň počas prvých 8 týždňov liečby lenalidomidom a následne každý mesiac sa má vyšetriť kompletný krvný obraz, vrátane počtu leukocytov a diferenciálneho počtu, počtu trombocytov, hladiny hemoglobínu a hematokritu kvôli sledovaniu cytopénií.
V prípade neutropénie má lekár pri liečbe pacienta zvážiť použitie rastových faktorov. Pacienti majú byť poučení, aby ihneď hlásili febrilné epizódy.
Pacientom a lekárom sa odporúča pozorne sledovať prejavy a príznaky krvácania, vrátane petechií a epistaxy, najmä u pacientov, ktorí súbežne užívajú lieky náchylné na vyvolanie krvácania (pozri časť
4.8, Hemoragické poruchy).
Pri súbežnom podávaní lenalidomidu s inými myelosupresívnymi látkami sa má postupovať s opatrnosťou.
· Novodiagnostikovaný mnohopočetnýmyelóm:pacienti,ktorípodstúpiliASCT,liečeníudržiavacoudávkoulenalidomidu
Nežiaduce reakcie v štúdii CALGB 100104 obsahovali udalosti hlásené po vysokej dávke melfalánu a
ASCT (HDM/ASCT) a tiež udalosti z obdobia udržiavacej liečby. Druhá analýza identifikovala
udalosti, ktoré sa vyskytli po začatí udržiavacej liečby. V štúdii IFM 2005-02 boli nežiaduce reakcie len z obdobia udržiavacej liečby.
Celkovo bola neutropénia 4. stupňa pozorovaná v skupinách s udržiavacou dávkou lenalidomidu vo zvýšenej miere v porovnaní so skupinami s placebom v udržiavacej terapii v dvoch štúdiách hodnotiacich lenalidomid v udržiavacej dávke u pacientov s NDMM, ktorí podstúpili ASCT (32,1 % vs. 26,7% (16,1 % vs 1,8 % po začiatku udržiavacej liečby)) v CALGB 100104 a 16,4 % vs 0,7 % v IFM 2005-02 v uvedenom poradí). Neutropénia ako nežiaduca udalosť súvisiaca s liečbou, vedúca k prerušeniu liečby lenalidomidom, bola hlásená u 2,2 % pacientov v CALGB 100104 a 2,4 % pacientov v IFM 2005-02 v uvedenom poradí. Febrilná neutropénia 4. stupňa bola hlásená s podobnou frekvenciou v skupinách s udržiavacou dávkou lenalidomidu v porovnaní so skupinami s placebom v udržiavacej terapii v oboch štúdiách (0,4 % vs 0,5 % (0,4 % vs 0,5 % po začiatku udržiavacej liečby))
v CALGB 100104 a 0,3 % vs 0 % v IFM 2005-02 v uvedenom poradí). Pacienti majú byť poučení, aby ihneď hlásili febrilné epizódy, môže byť potrebné prerušenie liečby a/alebo zníženie dávky (pozri časť 4.2).
Trombocytopénia 3. alebo 4. stupňa bola pozorovaná so zvýšenou frekvenciou v skupinách s udržiavacou dávkou lenalidomidu v porovnaní so skupinami s placebom v udržiavacej terapii v štúdiách hodnotiacich lenalidomid v udržiavacej dávke u pacientov s NDMM, ktorí podstúpili ASCT (37,5 % vs 30,3 % (17,9 % vs 4,1 % po začiatku udržiavacej liečby)) v CALGB 100104 a 13,0 % vs
2,9 % v IFM 2005-02 v uvedenom poradí). Pacientom a lekárom sa odporúča pozorne sledovať prejavy a symptómy krvácania, vrátane petechií a epistaxy, najmä u pacientov, ktorí súbežne užívajú lieky náchylné na vyvolanie krvácania (pozri časť 4.8, Hemoragické poruchy).
· Novodiagnostikovaný mnohopočetnýmyelóm:pacienti,ktoríniesúspôsobilínatransplantáciu,liečenílenalidomidomvkombináciisnízkoudávkoudexametazónu
Neutropénia 4. stupňa bola pozorovaná v menšej miere v skupinách s lenalidomidom v kombinácii s nízkou dávkou dexametazónu ako v kontrolnej skupine (8,5 % pri Rd [kontinuálna liečba] a Rd18
[liečba počas 18 štvortýždňových cyklov] v porovnaní s 15 % v skupine melfalán/prednizón/talidomid,
pozri časť 4.8). Epizódy febrilnej neutropénie 4. stupňa boli v súlade s kontrolnou skupinov (0,6 % pri Rd a Rd18 u pacientov liečených lenalidomidom/ dexametazónom v porovnaní s 0,7 % v skupine melfalán/prednizón/talidomid, pozri časť 4.8.
Trombocytopénia 3. alebo 4. stupňa bola pozorovaná v menšej miere v skupinách Rd a Rd18 ako v kontrolnej skupine (8,1 % vs 11,1 %, v uvedenom poradí).
· Novodiagnostikovaný mnohopočetnýmyelóm:pacienti,ktoríniesúspôsobilínatransplantáciu,liečenílenalidomidomvkombináciismelfalánomaprednizónom
Kombinácia lenalidomidu s melfalánom a prednizónom v klinických štúdiách u novodiagnostikovaných pacientov s mnohopočetným myelómom je spojená s vyššou incidenciou neutropénie 4. stupňa (34,1 % v skupine melfalán, prednizón a lenalidomid nasledované lenalidomidom [MPR + R] a u pacientov liečených melfalánom, prednizónom a lenalidomidom nasledované placebom [MPR + p], v porovnaní s 7,8 % u pacientov liečených MPp + p; pozri časť
4.8). Febrilné epizódy neutropénie 4. stupňa boli pozorované zriedkavo (1,7 % u pacientov liečených
MPR + R/MPR + p v porovnaní s 0,0 % u MPp + p liečených pacientov; pozri časť 4.8).
Kombinácia lenalidomidu s melfalánom a prednizónom u pacientov s mnohopočetným myelómom je spojená s vyššou incidenciou trombocytopénie 3. a 4. stupňa (40,4 % u pacientov liečených MPR+R/MPR+p v porovnaní s 13,7 % u pacientov liečených MPp+p; pozri časť 4.8).
· Mnohopočetnýmyelóm:pacientisaspoňjednoupredchádzajúcouliečbou
Kombinovaná liečba lenalidomidom s dexametazónom u pacientov s mnohopočetným myelómom
s aspoň jednou predchádzajúcou liečbou sa spája s vyšším výskytom neutropénie 4. stupňa (u 5,1 % pacientov liečených lenalidomidom/dexametazónom v porovnaní s 0,6 % pacientov liečených placebom/dexametazónom; pozri časť 4.8). Prípady febrilnej neutropénie 4. stupňa boli u pacientov pozorované zriedkavo (u 0,6 % pacientov liečených lenalidomidom/dexametazónom v porovnaní
s 0,0 % pacientov liečených placebom/dexametazónom; pozri časť 4.8).
Kombinovaná liečba lenalidomidom s dexametazónom u pacientov s mnohopočetným myelómom sa spája s vyšším výskytom trombocytopénie 3. a 4. stupňa (u 9,9 % a 1,4 % pacientov liečených lenalidomidom/dexametazónom v porovnaní s 2,3 % a 0,0 % pacientov liečených placebom/dexametazónom; pozri časť 4.8).
Poruchy činnosti štítnej žľazy
Pozorovali sa prípady hypotyreózy a hypertyreózy. Pred začatím liečby sa odporúča optimalizovať kontrolu pridružených (komorbidných) ochorení, ktoré ovplyvňujú činnosť štítnej žľazy. Odporúča sa základné počiatočné a potom priebežné monitorovanie činnosti štítnej žľazy.
Periférna neuropatia
Lenalidomid je štrukturálne príbuzný s talidomidom, ktorý je známy spôsobovaním závažnej periférnej neuropatie. Nebol pozorovaný zvýšený výskyt periférnej neuropatie pri dlhodobom užívaní lenalidomidu pri liečbe mnohopočetného myelómu u novodiagnostikovaných pacientov.
Reakcia vzplanutia nádoru a syndróm z rozpadu nádoru
Keďže má lenalidomid antineoplastický účinok, môžu sa vyskytnúť komplikácie spôsobené syndrómom z rozpadu nádoru (TLS, tumour lysis syndrome). TLS a reakcia vzplanutia nádoru (TFR, tumour flare reaction) boli často pozorované u pacientov s chronickou lymfocytovou leukémiou (CLL) a menej často pozorované u pacientov s lymfómami, ktorí boli liečení lenalidomidom. V priebehu liečby lenalidomidom boli pozorované smrteľné prípady TLS. Pacienti s rizikom TLS a TFR sú tí,
ktorí vykazovali pred liečbou vysokú nádorovú záťaž. U týchto pacientov je pri začatí liečby lenalidomidom potrebná opatrnosť. Títo pacienti sa majú dôkladne sledovať, najmä počas prvého cyklu alebo počas zvyšovania dávky a majú byť vykonané vhodné preventívne opatrenia. Zriedkavé prípady TLS boli pozorované u pacientov s MM (mnohopočetným myelómom) liečených lenalidomidom.
Alergické reakcie
Hlásili sa prípady alergických reakcií/reakcií precitlivenosti u pacientov liečených lenalidomidom (pozri časť 4.8). Pacienti, u ktorých sa objavila v minulosti alergická reakcia pri liečbe talidomidom, sa majú starostlivo sledovať, pretože v literatúre bola popísaná možná skrížená reakcia medzi lenalidomidom a talidomidom.
Závažné kožné reakcie
Pri používaní lenalidomidu sa hlásili prípady závažných kožných reakcií vrátane SJS, TEN a DRESS. Predpisujúci lekári majú poučiť pacientov poučiť o prejavoch a príznakoch týchto reakcií a povedať im, aby v prípade rozvoja týchto príznakov, ihneď vyhľadali lekársku starostlivosť. Liečba lenalidomidom sa musí prerušiť, ak sa objaví exfoliatívny alebo bulózny kožný výsev, alebo pri podozrení na SJS, TEN alebo DRESS a pri týchto reakciách sa nemá znovu pokračovať v liečbe. Je potrebné zvážiť prerušenie alebo ukončenie liečby lenalidomidom v prípade inej formy kožnej reakcie v závislosti od jej závažnosti. Pacienti s anamnézou závažného kožného výsevu v súvislosti s liečbou talidomidom sa nemajú liečiť lenalidomidom.
Ďalšie primárne malignity
V klinických štúdiách u pacientov s predchádzajúcou liečbou myelómu užívajúcich lenalidomid/dexametazón (3,98 na 100 osoborokov) bol pozorovaný nárast ďalších primárnych malignít (SPM) v porovnaní s kontrolnou skupinou (1,38 na 100 osoborokov). Neinvazívne SPM predstavovali bazocelulárny alebo spinocelulárny karcinóm kože. Väčšinu invazívnych SPM tvorili solídne tumory.
V klinických štúdiách u pacientov s novodiagnostikovaným mnohopočetným myelómom, ktorí nie sú spôsobilí na transplantáciu, bolo pozorované 4,9-násobné zvýšenie miery incidencie hematologických SPM (prípady akutnej myeloidnej leukémie [AML], myelodysplastického syndrómu [MDS]) u pacientov užívajúcich lenalidomid v kombinácii s melfalánom a prednizónom do progresie (1,75 na
100 osoborokov) v porovnaní s melfalánom v kombinácii s prednizónom (0,36 na 100 osoborokov).
2,12-násobné zvýšenie miery incidencie solídnych tumorov SPM bolo pozorované u pacientov užívajúcich lenalidomid (9 cyklov) v kombinácii s melfalánom a prednizónom (1,57 na 100 osoborokov) v porovnaní s melfalánom v kombinácii s prednizónom (0,74 na 100 osoborokov).
U pacientov užívajúcich lenalidomid v kombinácii s dexametazónom do progresie alebo počas 18 mesiacov nebola miera incidencie hematologických SPM (0,16 na 100 osoborokov) zvýšená v porovnaní s talidomidom v kombinácii s melfalánom a prednizónom (0,79 na 100 osoborokov).
1,3-násobné zvýšenie miery incidencie solídnych tumorov SPM bolo pozorované u pacientov užívajúcich lenalidomid v kombinácii s dexametazónom do progresie alebo počas 18 mesiacov (1,58 na 100 osoborokov) v porovnaní s talidomidom v kombinácii s melfalánom a prednizónom (1,19 na
100 osoborokov).
Zvýšené riziko ďalších primárnych malignít spojené s lenalidomidom je relevantné aj v rámci NDMM po transplantácii kmeňových buniek. Hoci toto riziko nie je ešte úplne charakterizované, musí sa vziať do úvahy pri zvažovaní a používaní lenalidomidu v tomto nastavení.
Incidencia výskytu hematologických malignít, a to najmä AML, MDS a B-bunkových malignít (vrátane Hodgkinovho lymfómu), bola 1,31 na 100 osoborokov v skupinách s lenalinomidom a 0,58 na 100 osoborokov v skupinách s placebom (1,02 na 100 osoborokov u pacientov po ASCT vystavených lenalinomidu a 0,60 na 100 osoborokov u pacientov po ASCT nevystavených lenalidomidu). Incidencia výskytu solídnych tumorov SPM bola 1,36 na 100 osoborokov v skupinách s lenalinomidom a 1,05 na 100 osoborokov v skupinách s placebom (1,26 na 100 osoborokov
u pacientov po ASCT vystavených lenalidomidu a 0,60 na 100 osoborokov u pacientov po ASCT
nevystavených lenalidomidu).
Pred začiatkom liečby lenalidomidom, v kombinácii s melfalánom alebo ihneď po vysokých dávkach melfalánu a ASCT, sa musí zvážiť riziko výskytu hematologických SPM. Lekári majú starostlivo zhodnotiť stav pacientov pred a počas liečby použitím štandardného skríningu pre výskyt SPM a začať liečbu podľa indikácie.
Poruchy pečene
U pacientov liečených lenalidomidom v kombinovanej liečbe sa zaznamenalo zlyhanie pečene vrátane fatálnych prípadov: akútne zlyhanie pečene, toxická hepatitída, cytolytická hepatitída, cholestatická hepatitída a zmiešaná cytolytická/cholestatická hepatitída. Mechanizmus závažnej liekom indukovanej hepatotoxicity zostáva neznámy, hoci v niektorých prípadoch môže byť rizikovým faktorom predošlé vírusové ochorenie pečene, zvýšené východiskové hodnoty pečeňových enzýmov a možno liečba antibiotikami.
Abnormálne výsledky testov funkcie pečene boli hlásené často a boli zvyčajne asymptomatické a po prerušení užívania reverzibilné. Po úprave parametrov na východiskové hodnoty sa môže zvážiť liečba nižšou dávkou.
Lenalidomid sa vylučuje obličkami. Je dôležité upraviť dávku u pacientov s poruchou funkcie obličiek, aby sa predišlo plazmatickým hladinám, ktoré môžu zvýšiť riziko hematologických nežiaducich účinkov alebo hepatotoxicity. Odporúča sa sledovanie funkcie pečene, predovšetkým v prípade prekonanej alebo súbežnej vírusovej infekcie pečene alebo keď sa lenalidomid kombinuje s liekmi,
u ktorých je známa súvislosť s dysfunkciou pečene.
Infekcie s neutropéniou alebo bez neutropénie
Pacienti s mnohopočetným myelómom sú náchylnejší k rozvoju infekcie, vrátane pneumónie. Vyšší výskyt infekcií bol pozorovaný pri lenalidomide v kombinácii s dexametazónom ako pri MPT
u pacientov s NDMM, ktorí nie sú spôsobilí na transplantáciu, a s lenalidomidom v udržiavacej dávke
v porovnaní s placebom u pacientov s NDMM, ktorí podstúpili ASCT. Infekcie ≥ 3. stupňa sa vyskytli v súvislosti s neutropéniou u menej ako jednej tretiny pacientov. Pacienti so známymi rizikovými faktormi pre infekcie majú byť starostlivo sledovaní. Všetci pacienti majú byť poučení, aby vyhľadali
lekársku pomoc ihneď pri prvých prejavoch infekcie (napr. kašeľ, horúčka, atď.), čo umožňuje skoré zvládanie a zmiernenie závažnosti stavu.
U pacientov, ktorí dostávali lenalidomid, boli hlásené prípady reaktivácie vírusu vrátane závažných prípadov reaktivácie vírusu spôsobujúceho herpes zoster alebo vírusu hepatitídy B (HBV).
Niektoré prípady reaktivácie vírusu mali fatálne následky.
Niektoré prípady reaktivácie vírusu spôsobujúceho herpes zoster mali za následok diseminovaný herpes zoster, meningitídu spôsobenú herpes zoster alebo očný herpes zoster, ktoré vyžadovali dočasné pozastavenie alebo trvalé ukončenie liečby lenalidomidom a adekvátnu protivírusovú liečbu.
Reaktivácia hepatitídy B bola hlásená zriedkavo u pacientov, ktorí dostávali lenalidomid a už
v minulosti boli infikovaní vírusom hepatitídy B (HBV). U niektorých z týchto prípadov došlo k progresii do akútneho zlyhania pečene, čo malo za následok prerušenie liečby lenalidomidom
a adekvátnu protivírusovú liečbu. Pred začiatkom liečby lenalidomidom sa má stanoviť stav vírusu hepatitídy B. U pacientov s pozitívnym testom na infekciu HBV sa odporúča konzultácia s lekárom so špecializáciou na liečbu hepatitídy B. Lenalidomid sa má používať s opatrnosťou u pacientov
s predchádzajúcou infekciou HBV, vrátane pacientov pozitívnych na protilátky anti-HBc, ale
negatívnych na HBsAg. U týchto pacientov sa počas liečby majú pozorne sledovať prejavy a príznaky aktívnej HBV infekcie.
1. Pacientisnovodiagnostikovaným mnohopočetnýmmyelómom
Bola pozorovaná vyššia miera intolerancie (3. alebo 4. stupeň nežiaducich účinkov, závažných nežiaducich účinkov, prerušenia liečby) u pacientov vo veku >75 rokov, ISS stupňa III, ECOG PS≤2 alebo CLcr <60 ml/min, keď sa lenalidomid podával v kombinácii. Starostlivo má byť posúdená schopnosť pacientov tolerovať lenalidomid v kombinácii s prihliadnutím na vek, ISS stupeň III, ECOG PS≤2 alebo CLcr <60 ml/min (pozri časti 4.2 a 4.8).
Sivý zákal
Sivý zákal bol hlásený s vyššou frekvenciou u pacientov užívajúcich lenalidomid v kombinácii
s dexametazónom, najmä pri dlhotrvajúcom užívaní. Odporúča sa pravidelné monitorovanie zrakovej schopnosti.
Progresívna multifokálna leukoencefalopatia (PML)
Pri užívaní lenalidomidu boli hlásené prípady progresívnej multifokálnej leukoencefalopatie (PML) vrátane fatálnych prípadov. PML bola hlásená niekoľko mesiacov až niekoľko rokov po začatí liečby lenalidomidom. Prípady boli všeobecne hlásené u pacientov užívajúcich súbežne dexametazón alebo predchádzajúcu liečbu inou imunosupresívnou chemoterapiou. Lekári by mali sledovať pacientov v pravidelných intervaloch a mali by zvážiť možnosť PML v diferenciálnej diagnostike u pacientov s novými alebo zhoršujúcimi sa neurologickými symptómami a s kognitívnymi alebo behaviorálnymi príznakmi alebo prejavmi. Pacientom je ďalej potrebné odporučiť, aby informovali svojho partnera alebo ošetrovateľa o svojej liečbe, pretože si môžu všimnúť príznaky, ktoré si pacient neuvedomuje.
Vyšetrenie na PML by malo zahŕňať neurologické vyšetrenie, zobrazovacie vyšetrenie mozgu magnetickou rezonanciou a analýzu mozgovomiechového moku na DNA vírus JC (JCV) pomocou polymerázovej reťazovej reakcie (PCR) alebo biopsiu mozgu s následným testom na JCV. Negatívny výsledok PCR na JCV nevylučuje PML. Pokiaľ nemožno stanoviť inú diagnózu, môžu byť potrebné ďalšie sledovanie a hodnotenie.
V prípade podozrenia na PML musí byť ďalšie podanie lieku pozastavené, kým nebude PML vylúčená. Pokiaľ bude PML potvrdená, musí byť liečba lenalidomidom trvalo ukončená.
Laktózová intolerancia
Tvrdé kapsuly Lenalidomide Accord obsahujú laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, celkovým deficitom laktázy alebo glukózo-galaktózovou malabsorpciou nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Erytropoetické látky alebo iné látky, ktoré môžu zvýšiť riziko trombózy, ako napríklad hormonálna substitučná liečba, sa majú používať s opatrnosťou u pacientov s mnohopočetným myelómom, ktorým sa podáva lenalidomid s dexametazónom (pozri časti 4.4 a 4.8).
Perorálnaantikoncepcia
Neuskutočnili sa žiadne interakčné štúdie s perorálnou antikoncepciou. Lenalidomid nie je induktor enzýmov. V in vitro štúdii s ľudskými hepatocytmi lenalidomid v rôznych skúmaných koncentráciách neindukoval CYP1A2, CYP2B6, CYP2C9, CYP2C19 ani CYP3A4/5. Preto sa neočakáva indukcia vedúca k zníženej účinnosti liekov vrátane hormonálnej antikoncepcie, ak sa lenalidomid podáva samostatne. Dexametazón je však liečivo známe ako slabý až stredne silný induktor enzýmu CYP3A4 a pravdepodobne pôsobí aj na ďalšie enzýmy aj transportné proteíny. Nemožno vylúčiť zníženie účinnosti perorálnej antikoncepcie počas liečby. Musia sa prijať účinné opatrenia na prevenciu tehotenstva (pozri časti 4.4 a 4.6).
Warfarín
Súbežné podávanie opakovaných 10 mg dávok lenalidomidu nemalo žiadny vplyv na farmakokinetiku jednorazovej dávky R- a S-warfarínu. Súbežné podanie jednorazovej dávky 25 mg warfarínu nemalo žiadny vplyv na farmakokinetiku lenalidomidu. Nie je však známe, či nedochádza k interakcii
v klinickej praxi (kombinovaná liečba s dexametazónom). Dexametazón je slabý až stredne silný induktor enzýmov a jeho účinok na warfarín nie je známy. Počas liečby sa odporúča starostlivé sledovanie koncentrácie warfarínu.
Digoxín
Súbežné podávanie lenalidomidu v dávke 10 mg jedenkrát denne zvýšilo expozíciu digoxínu (0,5 mg, jednorazová dávka) v plazme o 14 % s 90 % intervalom spoľahlivosti (IS) [0,52 % – 28,2 %]. Nie je známe, či bude tento vplyv pri klinickom použití (vyššie dávky lenalidomidu a súbežná liečba dexametazónom) odlišný. Preto sa počas liečby lenalidomidom odporúča sledovať koncentrácie digoxínu.
Statíny
Pri podávaní statínov s lenalidomidom bolo pozorované zvýšené riziko rabdomyolýzy, ktoré je pravdepodobne aditívne. Najmä počas prvých týždňov liečby je preto vhodné zvýšené klinické a laboratórne sledovanie.
Dexametazón
Súbežné podávanie jednorazovej dávky alebo opakovaných dávok dexametazónu (40 mg jedenkrát denne) nemá klinicky významný účinok na farmakokinetiku opakovaných dávok lenalidomidu (25 mg jedenkrát denne).
InterakciesinhibítormiP-glykoproteínu(P-gp)
In vitro je lenalidomid substrátom P-gp, nie je však inhibítorom P-gp. Súbežné podávanie opakovaných dávok silného inhibítora P-gp chinidínu (600 mg, dvakrát denne) alebo mierneho inhibítora/substrátu P-gp temsirolimu (25 mg) nemá klinicky významný účinok na farmakokinetiku lenalidomidu (25 mg). Súbežné podávanie lenalidomidu nemení farmakokinetiku temsirolimu.
4.6 Fertilita, gravidita a laktácia
S ohľadom na teratogénny potenciál sa musí lenalidomid predpisovať v súlade s Programom prevencie gravidity (pozri časť 4.4), pokiaľ neexistuje spoľahlivý dôkaz, že pacientka nemôže otehotnieť.
Ženy,ktorémôžuotehotnieť/Antikoncepcia umužovažien
Ženy, ktoré môžu otehotnieť, musia používať účinnú metódu antikoncepcie. Ak dôjde u ženy liečenej lenalidomidom ku gravidite, liečba sa musí ukončiť a pacientka má byť odporučená k lekárovi so špecializáciou alebo skúsenosťami z odboru teratológie, ktorý poskytne zhodnotenie a poradenstvo.
Ak dôjde ku gravidite u partnerky pacienta liečeného lenalidomidom, jeho partnerka má byť odporučená k lekárovi so špecializáciou alebo skúsenosťami z odboru teratológie, ktorý poskytne zhodnotenie a poradenstvo.
Počas liečby je lenalidomid prítomný v ľudskej sperme vo veľmi malom množstve a u zdravých jedincov je nedetekovateľný v ľudskej sperme 3 dni po ukončení jeho užívania (pozri časť 5.2).
V rámci prevencie a vzhľadom na osobitné populácie s predĺženou elimináciou, ako napr. pri poruche
funkcie obličiek, majú všetci muži užívajúci lenalidomid používať kondómy počas celého trvania liečby, počas jej prerušenia a počas 1 týždňa po ukončení liečby, ak je ich partnerka tehotná alebo môže otehotnieť a nepoužíva antikoncepciu.
Gravidita
Lenalidomid je štrukturálne príbuzný s talidomidom. Talidomid je liečivo so známym teratogénnym účinkom u ľudí, ktoré spôsobuje závažné život ohrozujúce vrodené chyby.
U opíc spôsobil lenalidomid malformácie podobné tým, ktoré boli popísané pre talidomid (pozri časť
5.3). Z tohto dôvodu sa očakáva teratogénny účinok lenalidomidu a lenalidomid je počas gravidity kontraindikovaný (pozri časť 4.3).
Dojčenie
Nie je známe, či sa lenalidomid vylučuje do ľudského materského mlieka. Dojčenie sa má preto počas liečby lenalidomidom prerušiť.
Fertilita
Štúdie fertility u potkanov s lenalidomidom v dávkach až 500 mg/kg (približne 200 až 500- násobok dávok pre človeka, 25 mg a 10 mg, v tomto poradí, podľa povrchu tela) nepreukázali žiadne nežiaduce účinky na fertilitu ani žiadnu rodičovskú toxicitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Lenalidomid má malý alebo mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pri užívaní lenalidomidu sa pozorovali príznaky ako je únava, závrat, ospalosť, vertigo a rozmazané videnie. Preto sa pri vedení vozidiel a obsluhovaní strojov odporúča opatrnosť.
4.8 Nežiaduce účinky
Súhrnprofilubezpečnosti
Novodiagnostikovaný mnohopočetný myelóm: pacienti, ktorí podstúpili ASCT, liečení lenalidomidomv udržiavacej dávke
Na stanovenie nežiaducich reakcií v štúdii CALGB 100104 sa použil konzervatívny prístup. Nežiaduce reakcie uvedené v tabuľke 1 obsahovali udalosti hlásené po liečbe HDM/ASCT a tiež udalosti z obdobia udržiavacej liečby. Z druhej analýzy, ktorá identifikovala udalosti, ktoré sa vyskytli po začiatku udržiavej liečby vyplýva, že frekvencie uvedené v tabuľke 1 môžu byť vyššie ako
skutočne pozorované počas obdobia udržiavacej liečby. V štúdii IFM 2005-02 boli nežiaduce reakcie len z obdobia udržiavacej liečby.
Závažné vedľajšie účinky pozorované častejšie (≥ 5 %) pri udržiavacej dávke lenalidomidu než pri placebe boli:
1. Pneumónie (10,6 %, kombinovaný termín) z IFM 2005-02,
2. pľúcne infekcie (9,4 % (9,4 % po začiatku udržiavacej liečby)) z CALGB 100104.
Nežiaduce účinky pozorované v štúdii IFM 2005-02 častejšie pri udržiavacej dávke lenalidomidu než pri placebe boli neutropénia (60,8 %), bronchitída (47,4 %), hnačka (38,9 %), nazofaryngitída
(34,8 %), svalové kŕče (33,4 %), leukopénia (31,7 %), asténia (29,7 %), kašeľ (27,3 %), trombocytopénia (23,5 %), gastroenteritída (22,5 %) a horúčka (20,5 %).
Nežiaduce účinky pozorované v štúdii CALGB 100104 častejšie pri udržiavacej dávke lenalidomidu než pri placebe boli neutropénia (79,0 % (71,9 % po začiatku udržiavacej liečby)), trombocytopénia (72,3 % (61,6 %)), hnačka (54,5 % (46,4 %)), vyrážky (31,7 % (25,0 %)), infekcie horných dýchacích ciest (26,8 % (26,8 %)), únava (22,8 % (17,9 %)), leukopénia (22,8 % (18,8 %)) a anémia (21,0 % (13,8 %)).
Novodiagnostikovaný mnohopočetný myelóm: pacienti, ktorí nie sú spôsobilí na transplantáciu,liečení lenalidomidom v kombinácii s nízkou dávkou dexametazónu
Závažné vedľajšie účinky pozorované častejšie (≥5 %) s lenalidomidom v kombinácii s nízkou dávkou
dexametazónu (Rd a Rd18), než s melfalánom, prednizónom a talidomidom (MPT) boli:
1. pneumónia (9,8 %)
2. zlyhanie obličiek (vrátane akútneho) (6,3 %)
Nežiaduce účinky pozorované častejšie pri Rd alebo Rd18 než pri MPT boli: hnačka (45,5 %), únava (32,8 %), bolesť chrbta (32,0 %), asténia (28,2 %), nespavosť (27,6 %), výsev (24,3 %), zníženie chuti do jedla (23,1 %), kašeľ (22,7 %), horúčka (21,4 %), a svalové kŕče (20,5 %).
Novodiagnostikovaný mnohopočetný myelóm: pacienti, ktorí nie sú spôsobilí na transplantáciu,liečení lenalidomidom v kombinácii s melfalánom a prednizónom
Závažné vedľajšie účinky pozorované častejšie (≥5 %) pri melfaláne, prednizóne a lenalidomide
nasledované udržiavacou dávkou lenalidomidu (MPR + R), alebo pri melfaláne prednizóne a lenalidomide nasledované placebom (MPR + p) než pri melfaláne, prednizóne a placebe nasledované placebom (MPp + p) boli:
· febrilná neutropénia (6,0%)
· anémia (5,3%)
Nežiaduce účinky pozorované častejšie pri MPR + R alebo pri MPR + p než pri MPp + p boli: neutropénia (83,3 %), anémia (70,7 %), trombocytopénia (70,0 %), leukopénia (38,8 %), zápcha (34,0 %), hnačka (33,3 %), výsev (28,9 %), horúčka (27,0 %), periférny edém (25,0 %), kašeľ (24,0 %), zníženie chuti do jedla (23,7 %), a asténia (22,0 %).
Mnohopočetný myelóm: pacienti s aspoň jednou predchádzajúcou liečbou
V dvoch štúdiách fázy III kontrolovaných placebom, bolo 353 pacientov s mnohopočetným myelómom vystavených kombinácii lenalidomidu/dexametazónu a 351 kombinácii placeba/dexametazónu.
Najzávažnejšie nežiaduce účinky pozorované častejšie pri kombinácii lenalidomid/dexametazón ako pri kombinácii placebo/dexametazón boli:
· Venózny tromboembolizmus (trombóza hlbokých žíl a pľúcna embólia); (pozri časť 4.4)
· Neutropénia 4. stupňa (pozri časť 4.4)
Pozorované nežiaduce účinky, ktoré sa častejšie vyskytli pri kombinácii lenalidomidu a dexametazónu, než pri kombinácii placeba a dexametazónu v súhrne klinických štúdií s mnohopočetným myelómom (MM-009 a MM-010), boli únava (43,9 %), neutropénia (42,2 %), zápcha (40,5 %), hnačka (38,5 %), svalové kŕče (33,4 %), anémia (31,4 %), trombocytopénia (21,5 %) a kožný výsev (21,2 %).
Prehľadnežiaducichúčinkovvtabuľke
Nežiaduce účinky pozorované u pacientov liečených lenalidomidom sú uvedené nižšie podľa tried orgánových systémov a frekvencie. V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti. Frekvencie výskytu sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1000 až < 1/100), zriedkavé (≥ 1/10 000 až
< 1/1000), veľmi zriedkavé (< 1/10 000); neznáme (z dostupných údajov).
Nežiaduce účinky sú zhrnuté do príslušnej kategórie v tabuľke nižšie na základe najvyššej frekvencie pozorovanej v niektorej z hlavných klinických štúdií.
Tabuľkový prehľad pre monoterapiu mnohopočetného myelómu
Nasledujúca tabuľka vychádza z údajov získaných počas štúdií s NDMM u pacientov, ktorí podstúpili ASCT, liečených udržiavacou dávkou lenalidomidu. Údaje neboli upravené pre dlhšie trvanie liečby v skupinách s lenalidomidom, pokračujúcich až do progresie ochorenia, v porovnaní so skupinami s placebom v kľúčových štúdiách s mnohopočetným myelómom (pozri časť 5.1).
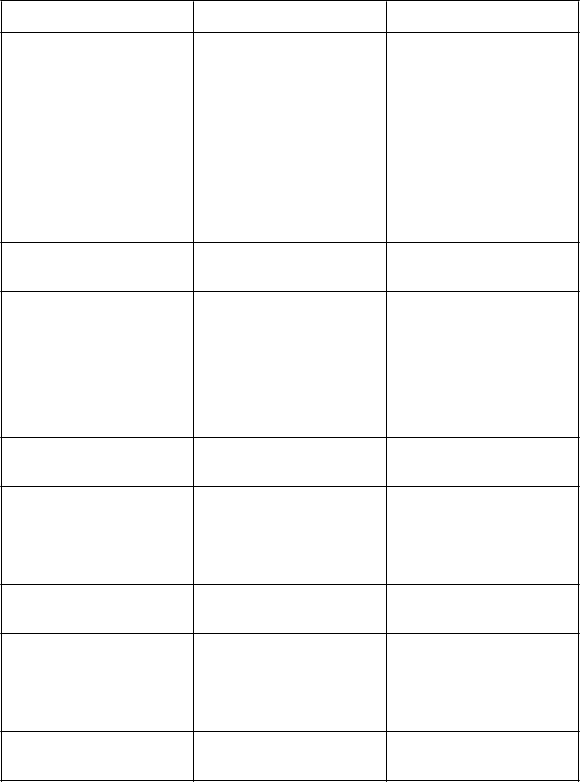 Tabuľka 1. Nežiaduce reakcie zaznamenané v klinických štúdiách u pacientov s mnohopočetným myelómom liečených udržiavacou dávkou lenalidomidu
Tabuľka 1. Nežiaduce reakcie zaznamenané v klinických štúdiách u pacientov s mnohopočetným myelómom liečených udržiavacou dávkou lenalidomidu
Trieda orgánových systémov/Prednostný názov Infekcie a nákazy
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)
Poruchy krvi a lymfatického
Všetky nežiaduce reakcie/Frekvencia
Veľmi
časté
Pneumónie◊,a, infekcia horných dýchacích ciest, neutropenická infekcia, bronchitída◊, chrípka◊, gastroenteritída◊, sínusitída, nazofaryngitída, nádcha
Časté
Infekcia◊, infekcia močových ciest◊,*, infekcia dolných
dýchacích ciest, pľúcna infekcia◊
Časté
Myelodysplastický syndróm◊,*
Nežiaduce reakcie 3.− 4. stupňa/Frekvencia
Veľmičasté
Pneumónie◊,a, neutropenická infekcia
Časté
Sepsa◊,b, bakterémia, pľúcna infekcia◊, bakteriálne infekcia
dolných dýchacích ciest, bronchitída◊, chrípka◊, gastroenteritída◊, herpes zoster◊, infekcia◊
systému
Veľmi časté
Neutropénia^,◊, febrilná neutropénia^,◊, trombocytopénia^,◊, anémia, leukopénia◊, lymfopénia
Poruchy metabolizmu a
výživy Veľmi časté
Hypokalémia
Veľmičasté
Neutropénia^,◊, febrilná neutropénia^,◊, trombocytopénia^,◊, anémia, leukopénia◊, lymfopénia
Časté
Pancytopénia◊
Časté
Hypokalémia, dehydratácia
P
o
ru
chy nervového systému
P
o
r
uchy ciev
P
o
r
uchy dýchacej sústavy,
Veľmi
časté
Parestézia
Časté
Periférna neuropatiac
Časté
Pľúcna embólia◊,*
Časté
Bolesť hlavy
Časté
Hlboká žilná trombóza^,◊,d
hrudníka a mediastína
Veľmi časté
Kašeľ
Časté
Dyspnoe◊
P
o
ruchy gastrointestinálneho
Časté
Dyspnoe◊, rinorea
t
raktu
Veľmi časté
Hnačka, zápcha, bolesť brucha,
Časté
Hnačka, vracanie, nauzea
nauzea
P
o
ru
chy pečene a žlčových
Časté
Vracanie, bolesť hornej časti brucha
ciest
Veľmi časté
Abnormálne výsledky testov funkcie pečene
Časté
Abnormálne výsledky testov funkcie pečene
Poruchy kože a podkožného
tk
a
niva
Veľmi časté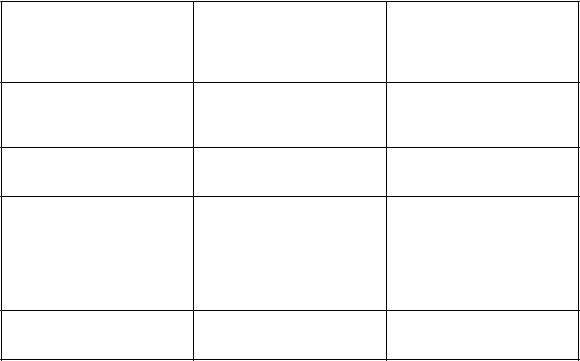
Vyrážky, suchá koža
ČastéVyrážky, pruritus
P
o
ruchy kostrovej a svalovej
sústavy a spojivového tkaniva
Veľmi časté
Svalové kŕče
C
elkové poruchy a reakcie v
Časté
Myalgia, muskuloskeletálna bolesť
mieste podania
Veľmi časté
Únava, asténia, pyrexia
Časté
Únava, asténia
◊ Nežiaduce príhody hlásené ako závažné v klinických štúdiách u pacientov s NDMM, ktorí podstúpili ASCT
* Týka sa len vážnych nežiaducich účinkov lieku
^ Pozri časť 4.8. Popis vybraných nežiaducich účinkov.
a „Pneumónie“ kombinovaný termín pre skupinu nežiaducich účinkov zahrňujúci nasledujúce prednostné názvy: bronchopneumónia, lobárna pneumónia, pneumónia spôsobená Pneumocystis jiroveci, pneumónia, pneumónia spôsobená klebsielou, pneumónia spôsobená legionelou,
pneumónia spôsobená mykoplazmou, pneumónia spôsobená pneumokokom, pneumónia spôsobená streptokokom, vírusová pneumónia, pľúcne poruchy, pneumonitída
b „Sepsa“ kombinovaný termín pre skupinu nežiaducich účinkov zahrňujúci nasledujúce prednostné názvy: bakteriálna sepsa, pneumokoková
sepsa, septický šok, stafylokoková sepsa
c „Periférna neuropatia“ kombinovaný termín pre skupinu nežiaducich účinkov zahrňujúci nasledujúce prednostné názvy: periférna neuropatia, periférna senzorická neuropatia, polyneuropatia
d „Hlboká venózna trombóza“ kombinovaný termín pre skupinu nežiaducich účinkov zahrňujúci nasledujúce prednostné názvy: hlboká venózna trombóza, trombóza, venózna trombóza
Tabuľkový prehľad pre kombinovanú liečbu pri MMNasledujúca tabuľka vychádza z údajov získaných počas štúdií s mnohopočetným myelómom
v kombinovanej liečbe. Údaje neboli upravené pre dlhšie trvanie liečby v skupinách s lenalidomidom, pokračujúcich až do progresie ochorenia v porovnaní s kontrolnými skupinami v kľúčových štúdiách s mnohopočetným myelómom (pozri časť 5.1).
Tabuľka 2. Nežiaduce reakcie zaznamenané v klinických štúdiách u pacientov s mnohopočetným myelómom liečených lenalidomidom v kombinácii s dexametazónom, alebo s melfalánom a prednizónom
s mnohopočetným myelómom liečených lenalidomidom v kombinácii s dexametazónom, alebo s melfalánom a prednizónom
Trieda orgánových systémov/Prednostný názov
Všetky nežiaduce reakcie/Frekvencia
Ne
ž
i
adu
c
e reakcie 3.− 4. stupňa/Frekvencia
Infekcie a nákazy
Veľmi
časté
Pneumónia◊, infekcie horných dýchacích ciest, bakteriálne,
vírusové a mykotické infekcie (vrátane oportúnnych infekcií)◊, nazofaryngitída, faryngitída, bronchitída◊
Časté
Sepsa◊, sinusitída◊
Časté
Pneumónia◊, bakteriálne, vírusové a mykotické infekcie (vrátane
oportúnnych infekcií)◊, celulitída◊,
sepsa◊, bronchitída◊
Trieda orgánových systémov/Prednostný názov
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)
Poruchy krvi a lymfatického systému
P
o
r
uchy imunitného systému
Poruchy endokrinného systému
P
o
r
uchy metabolizmu a výživy
Všetky nežiaduce reakcie/Frekvencia
M
enej
časté
Bazocelulárny karcinóm^,◊, spinocelulárny karcinóm kože^,◊,*
Veľmičasté Neutropénia^,◊, trombocytopénia^,◊, anémia◊, hemoragická porucha^, leukopénie
ČastéFebrilná neutropénia^,◊, pancytopénia◊
MenejčastéHemolýza, autoimunitná hemolytická anémia, hemolytická anémia
Menejčasté Hypersenzitivita^
Časté Hypotyreóza
VeľmičastéHypokaliémia◊, hyperglykémia,
hypokalciémia◊, znížená chuť do jedla, zníženie telesnej hmotnosti
ČastéHypomagneziémia, hyperurikémia, dehydratácia◊, hyperkalciémia+
Nežiaduce reakcie 3.− 4. stupňa/FrekvenciaČastéAkútna myeloidná leukémia, myelodysplastický syndróm, spinocelulárny karcinóm kože^,◊,**
MenejčastéT-bunková akútna leukémia, bazocelulárny karcinóm^,◊, syndróm z rozpadu nádoru
VeľmičastéNeutropénia^,◊, trombocytopénia^,◊, anémia◊, leukopénie
ČastéFebrilná neutropénia^,◊, pancytopénia◊, hemolytická anémia
MenejčastéHyperkoagulácia, koagulopatia
 Časté
ČastéHypokaliémia◊, hyperglykémia, hypokalciémia◊, diabetes melitus◊,
hypofosfatémia, hyponatriémia◊, hyperurikémia, dna, znížená chuť do
jedla, zníženie telesnej hmotnosti
Psychické poruchy
Veľmi
časté
Depresia, nespavosť
Časté
Depresia, nespavosť
P
o
ru
chy nervového systému
M
enej
časté
Strata libida
Veľmičasté
Periférna neuropatia (okrem motorickej neuropatie), závrat, tremor, dysgeúzia, bolesť hlavy
Časté
Ataxia, porucha rovnováhy
Časté
Cerebrovaskulárna príhoda◊, závrat, synkopa
Menejčasté
Intrakraniálne krvácanie, tranzitórny ischemický atak, cerebrálna ischémia
P
o
r
uchy oka
Veľmi
časté
Katarakta, rozmazané videnie
Časté
Znížená ostrosť videnia
Časté
Katarakta
Menejčasté
Slepota
Trieda orgánových systémov/Prednostný názov
P
o
ru
chy ucha a labyrintu
P
o
r
uchy srdca a srdcovej činnosti
Všetky nežiaduce reakcie/Frekvencia
Časté
Hluchota (vrátane hypoakúzie), tinnitus
Časté
Atriálna fibrilácia◊, bradykardia
Menejčasté
Arytmia, predĺženie QT intervalu, atriálny flutter, ventrikulárne extrasystoly
Nežiaduce reakcie 3.− 4. stupňa/Frekvencia
Časté
Infarkt myokardu (vrátane akútneho)^,◊, atriálna fibrilácia◊, kongestívne zlyhanie srdca◊, tachykardia, zlyhanie srdca◊, ischémia myokardu◊
P
o
r
uchy ciev
Veľmi
časté
Venózne tromboembolické príhody, predovšetkým trombóza hlbokých žíl a pľúcna embólia^,◊
Veľmičasté
Venózne tromboembolické príhody, predovšetkým trombóza hlbokých žíl a pľúcna embólia^,◊
P
o
r
uchy dýchacej sústavy, hrudníka a mediastína
P
o
ru
chy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Časté
Hypotenzia◊, hypertenzia, ekchymóza^
VeľmičastéDyspnoe◊, epistaxa^
VeľmičastéHnačka◊, zápcha◊, bolesť brucha◊, nauzea, vracanie, dyspepsia
ČastéGastrointestinálne krvácanie (vrátane rektálneho krvácania, hemoroidálneho krvácania, krvácania z peptického vredu a gingiválneho krvácania)^, sucho v ústach, stomatitída, dysfágia
MenejčastéKolitída, zápal slepého čreva
ČastéAbnormálne výsledky testov funkcie pečene◊
MenejčastéZlyhanie pečene^
ČastéVaskulitída
MenejčastéIschémia, periférna ischémia, trombóza intrakraniálneho venózneho sínusu
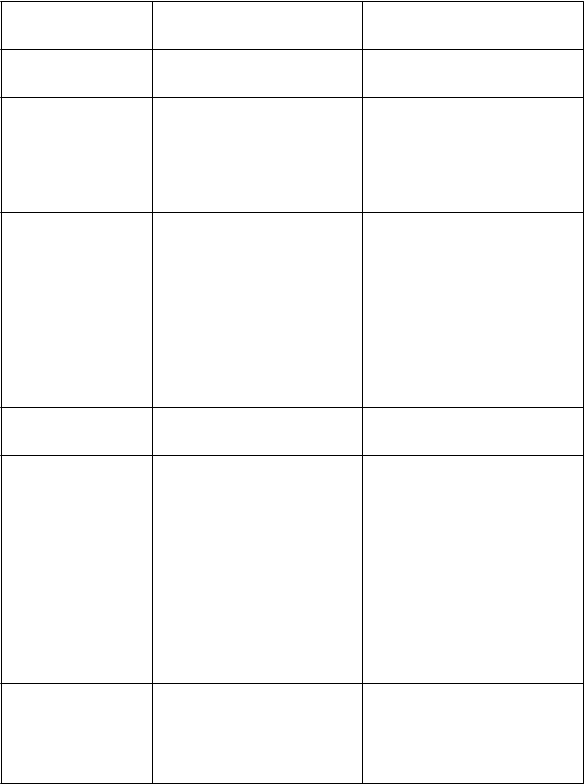 Časté
ČastéRespiračná tieseň◊, dyspnoe◊
ČastéHnačka◊, zápcha◊, bolesť brucha◊, nauzea, vracanie
ČastéCholestáza◊, abnormálne výsledky testov funkcie pečene◊
MenejčastéZlyhanie pečene^
Trieda orgánových systémov/Prednostný názov
P
o
r
uchy kože a podkožného tkaniva
P
o
r
uchy kostrovej a svalovej sústavy a spojivového tkaniva
P
o
r
uchy obličiek a močových ciest
P
o
ru
chy reprodukčného systému a prsníkov Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné
v
yš
etrenia
Úrazy, otravy a komplikácie liečebného postupu
Všetky nežiaduce reakcie/Frekvencia
Veľmi
časté
Výsev, pruritus
ČastéUrtikária, hyperhidróza, suchá koža, hyperpigmentácia kože, ekzém, erytém
MenejčastéZmena sfarbenia kože, fotosenzitívna reakcia
VeľmičastéSvalové kŕče, bolesť v kostiach◊, bolesť a diskomfort kostrovej
a svalovej sústavy a spojivového tkaniva (vrátane bolesti chrbta◊), artralgia◊
ČastéSvalová slabosť, edém kĺbov, myalgia
Veľmičasté
Renálne zlyhanie (vrátane akútneho)◊
ČastéHematúria^, retencia moču, inkontinencia moču
MenejčastéZískaný Fanconiho syndróm
ČastéErektilná dysfunkcia
VeľmičastéÚnava◊, edém (vrátane periférneho edému), pyrexia◊, asténia, syndróm
podobný chrípke (vrátane pyrexie, kašľa, myalgie, muskuloskeletálnej bolesti, bolesti hlavy a zimnice)
ČastéBolesť na hrudi, letargia
ČastéZvýšený C-reaktívny proteín
ČastéPády, kontúzia^
Nežiaduce reakcie 3.− 4. stupňa/FrekvenciaČastéVýsev
ČastéSvalová slabosť, bolesť v kostiach◊, bolesť a dyskomfort kostrovej
a svalovej sústavy a spojivového tkaniva (vrátane bolesti chrbta◊)
MenejčastéEdém kĺbov
MenejčastéRenálna tubulárna nekróza
ČastéÚnava◊, pyrexia◊, asténia
^Pozri časť 4.8. Popis vybraných nežiaducich účinkov.
◊ Nežiaduce reakcie označené ako závažné v klinických skúšaniach u pacientov s mnohopočetným myelómom liečených lenalidomidom v kombinácii s dexametazónom, alebo melfalánom a prednizónom
+ Platí len pre závažné nežiaduce reakcie
*Spinocelulárny karcinóm kože bol hlásený v klinických štúdiách u pacientov s mnohopočetným myelómom predtým liečených lenalidomidom/dexametazónom v porovnaní s kontrolnými skupinami
** Spinocelulárny karcinóm kože bol hlásený v klinických štúdiách u pacientov s novodiagnostikovaným mnohopočetným myelómom liečených lenalidomidom/dexametazónom v porovnaní s kontrolnými skupinami
Tabuľkový prehľad z hlásení nežiaducich reakcií po uvedení lieku na trhOkrem vyššie uvedených nežiaducich účinkov zaznamenaných z kľúčových klinických štúdií, nasledujúca tabuľka vychádza z údajov získaných po uvedení lieku na trh.
 Tabuľka 3. Nežiaduce reakcie zaznamenané po uvedení lieku na trhu pacientov liečených lenalidomidom
Tabuľka 3. Nežiaduce reakcie zaznamenané po uvedení lieku na trhu pacientov liečených lenalidomidom
Trieda orgánových systémov/Prednostný názov
Všetky nežiaduce reakcie/Frekvencia Nežiaduce reakcie 3.− 4. stupňa/Frekvencia
Infekcie a nákazy
Neznáme
Vírusové infekcie vrátane reaktivácie vírusu spôsobujúceho herpes zoster
a vírusu hepatídy B
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)
Neznáme
Vírusové infekcie vrátane reaktivácie vírusu spôsobujúceho herpes zoster a vírusu hepatídy B Zriedkavé
Syndróm z rozpadu nádoru
P
o
ru
chy krvi
a lymfatického systému
P
o
r
uchy imunitného systému
Poruchy endokrinného systému
P
o
r
uchy dýchacej sústavy, hrudníka a mediastína Poruchy
gastrointestinálneho
t
raktu
P
o
ru
chy pečene a žlčových ciest
P
o
r
uchy kože a podkožného tkaniva
Neznáme
Získaná hemofília
Neznáme
Odmietnutie transplantovaných pevných orgánov
Časté
Hypertyreóza
Neznáme
Akútne zlyhanie pečene^, toxická hepatitída^, cytolytická hepatitída^, cholestatická hepatitída^, zmiešaná cytolytická/cholestatická hepatitída^
Neznáme
Intersticiálna pneumónia
Neznáme Pankreatitída, gastrointestinálne perforácie (vrátane perforácií divertikula, tenkého a hrubého čreva)^ Neznáme
Akútne zlyhanie pečene^,
toxická hepatitída^
Menejčasté
Angioedém
Zriedkavé
Stevensov-Johnsonov syndróm^, toxická epidermálna nekrolýza^
Neznáme Leukocytoklastická vaskulitída, lieková reakcia
s eozinofíliou a systémovými symptómami^
^Pozri časť 4.8. Popis vybraných nežiaducich účinkov.
PopisvybranýchnežiaducichúčinkovTeratogenicitaLenalidomid je štrukturálne príbuzný s talidomidom. Talidomid je liečivo so známym teratogénnym účinkom u ľudí, ktoré spôsobuje závažné život ohrozujúce vrodené chyby. U opíc spôsobil lenalidomid malformácie podobné tým, ktoré boli popísané pre talidomid (pozri časti 4.6 a 5.3). Ak sa lenalidomid užíva počas gravidity, u ľudí sa očakáva teratogénny účinok lenalidomidu.
Neutropénia a trombocytopéniaNovodiagnostikovaný mnohopočetný myelóm: pacienti, ktorí podstúpili ASCT, liečení lenalidomidomv udržiavacej dávkeUdržiavacia dávka lenalidomidu po ASCT je spájaná so zvýšeným výskytom neutropénie 4. stupňa v porovnaní s udržiavacou dávkou placeba (32,1 % vs 26,7 % (16,1 % vs 1,8 % po začiatku udržiavacej liečby)) v CALGB 100104 a 16,4 % vs 0,7 % v IFM 2005-02 v uvedenom poradí). Neutropénia ako nežiaduca udalosť súvisiaca s liečbou, vedúca k prerušeniu liečby lenalidomidom, bola hlásená u
2,2 % pacientov v CALGB 100104 a 2,4 % pacientov v IFM 2005-02 v uvedenom poradí. Febrilná neutropénia 4. stupňa bola hlásená s podobnou frekvenciou v skupinách s udržiavacou dávkou lenalidomidu v porovnaní so skupinami s placebom v udržiavacej terapii v oboch štúdiách (0,4 % vs
0,5 % (0,4 % vs 0,5 % po začiatku udržiavacej liečby)) v CALGB 100104 a 0,3 % vs 0 % v IFM
2005-02 v uvedenom poradí).
Udržiavacia dávka lenalidomidu po ASCT je spájaná so zvýšeným výskytom trombocytopénie 3. alebo 4. stupňa v porovnaní s udržiavacou dávkou placeba v (37,5 % vs 30,3 % (17,9 % vs 4,1 % po začiatku udržiavacej liečby)) v CALGB 100104 a 13,0 % vs 2,9 % v IFM 2005-02 v uvedenom poradí).
Novodiagnostikovaný mnohopočetný myelóm: pacienti, ktorí nie sú spôsobilí na transplantáciu,liečení lenalidomidom v kombinácii s nízkou dávkou dexametazónuKombinácia lenalidomidu s nízkou dávkou dexametazónu u novodiagnostikovaných pacientov
s mnohopočetným myelómom je spojená so zníženým výskytom neutropénie 4. stupňa (8,5 % pri Rd a
Rd18), v porovnaní s MPT (15%). Febrilná neutropénia 4. stupňa bola pozorovaná zriedkavo (0,6 %
pri Rd a Rd18 v porovnaní s 0,7 % pri MPT).
Kombinácia lenalidomidu s nízkou dávkou dexametazónu u novodiagnostikovaných pacientov
s mnohopočetným myelómom je spojená so zníženým výskytom trombocytopénie 3. a 4. stupňa
(8,1 % pri Rd a Rd18) v porovnaní s MPT (11 %).
 Novodiagnostikovaný mnohopočetný myelóm: pacienti, ktorí nie sú spôsobilí na transplantáciu, liečení lenalidomidom v kombinácii s melfalánom a prednizónom
Novodiagnostikovaný mnohopočetný myelóm: pacienti, ktorí nie sú spôsobilí na transplantáciu, liečení lenalidomidom v kombinácii s melfalánom a prednizónomKombinácia lenalidomidu s melfalánom a prednizónom u novodiagnostikovaných pacientov s mnohopočetným myelómom je spojená s vyšším výskytom neutropénie 4. stupňa (34,1 % pri MPR + R / MPR + p) v porovnaní s MPp + p (7,8 %). Bol pozorovaný vyšší výskyt febrilnej neutropénie 4. stupňa (1,7 % pri MPR + R / MPR + p v porovnaní s 0,0 % pri MPp + p).
Kombinácia lenalidomidu s melfalánom a prednizónom u novodiagnostikovaných pacientov s mnohopočetným myelómom je spojená s vyšším výskytom trombocytopénie 3. a 4. stupňa (40,4 % pri MPR + R / MPR + p) v porovnaní s MPp + p (13,7 %).
Mnohopočetný myelóm: pacienti s aspoň jednou predchádzajúcou liečbouKombinovaná liečba lenalidomidom s dexametazónom sa u pacientov s mnohopočetným myelómom spája s vyšším výskytom neutropénie 4. stupňa (5,1 % u pacientov liečených lenalidomidom/dexametazónom v porovnaní s 0,6 % u pacientov liečených placebom/dexametazónom). Prípady febrilnej neutropénie 4. stupňa boli u pacientov pozorované zriedkavo (0,6 % u pacientov liečených lenalidomidom/dexametazónom v porovnaní s 0,0 % u pacientov liečených placebom/dexametazónom).
Kombinovaná liečba lenalidomidom s dexametazónom sa u pacientov s mnohopočetným myelómom spája s vyšším výskytom trombocytopénie 3. a 4. stupňa (9,9 % a 1,4 % u pacientov liečených lenalidomidom/dexametazónom v porovnaní s 2,3 % a 0,0 % u pacientov liečených placebom/dexametazónom).
Venózny tromboembolizmus
Zvýšené riziko trombózy hlbokých žíl a pľúcnej embólie je spojené s užívaním kombinácie lenalidomidu s dexametazónom u pacientov s mnohopočetným myelómom a v menšom rozsahu u pacientov liečených lenalidomidom v kombinácii s melfalánom a prednizónom alebo u pacientov
s mnohopočetným myleónom liečených lenalidomidom v monoterapii (pozri časť 4.5).
Súbežné podávanie erytropoetických látok alebo trombóza hlbokých žíl v anamnéze môže u týchto pacientov tiež zvyšovať riziko vzniku trombózy.
Infarkt myokardu
U pacientov užívajúcich lenalidomid, najmä u pacientov so známymi rizikovými faktormi, bol zaznamenaný infarkt myokardu.
Hemoragické poruchy
Hemoragické poruchy sú vymenované vo viacerých triedach orgánových systémov: Poruchy krvi
a lymfatického systému; poruchy nervového systému (intrakraniálne krvácanie); poruchy dýchacej sústavy, hrudníka a mediastína (epistaxa); poruchy gastrointestinálneho traktu (gingiválne krvácanie, hemoroidálna hemorágia, rektálna hemorágia); poruchy obličiek a močových ciest (hematúria); úrazy, otravy a komplikácie liečebného postupu (kontúzia) a poruchy ciev (ekchymóza).
Alergické reakcie
Hlásili sa prípady alergických reakcií/reakcií precitlivenosti. V literatúre bola popísaná možná skrížená reakcia medzi lenalidomidom a talidomidom.
Závažné kožné reakcie
Pri používaní lenalidomidu sa hlásili prípady závažných kožných reakcií vrátane SJS, TEN a DRESS. Pacienti so závažným kožným výsevom v anamnéze v súvislosti s liečbou talidomidom sa nemajú liečiť lenalidomidom (pozri časť 4.4).
Ďalšie primárne malignity
*V klinických štúdiách u pacientov s predchádzajúcou liečbou myelómu užívajúcich lenalidomid/dexametazón v porovnaní s kontrolnou skupinou, sa vyskytuje hlavne bazocelulárny alebo spinocelulárny karcinóm kože.
Akútna myeloidná leukémia
Mnohopočetný myelóm
V klinických štúdiách s novodiagnostikovaným mnohopočetným myelómom u pacientov užívajúcich lenalidomid v kombinácii s melfalánom alebo bezprostredne po HDM/ASCT sa pozorovali prípady AML (pozri časť 4.4). Tento nárast nebol pozorovaný v klinických štúdiách u pacientov s novodiagnostikovaným mnohopočetným myelómom užívajúcich lenalidomid v kombinácii s nízkou dávkou dexametazónu v porovnaní s talidomidom v kombinácii s melfalánom a prednizónom.
Poruchy pečene
Zaznamenali sa nasledovné hlásenia nežiaducich účinkov po uvedení lieku na trh (frekvencia neznáma): akútne zlyhanie pečene a cholestáza (obe potenciálne fatálne), toxická hepatitída, cytolytická hepatitída a zmiešaná cytolytická/cholestatická hepatitída.
Rabdomyolýza
Pozorovali sa zriedkavé prípady rabdomyolýzy, niektoré z nich súviseli so súbežným podávaním lenalidomidu so statínom.
Poruchy činnosti štítnej žľazy
Boli hlásené prípady hypotyreózy a hypertyreózy (pozri časť 4.4, Poruchy činnosti štítnej žľazy).
Poruchy gastrointestinálneho traktuPočas liečby lenalidomidom boli hlásené gastrointestinálne perforácie. Gastrointestinálne perforácie môžu viesť k septickým komplikáciám a môžu byť spojené s fatálnym výsledkom.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v Prílohe V.
4.9 PredávkovanieNeexistujú žiadne špecifické skúsenosti s liečbou predávkovania lenalidomidom u pacientov, aj keď v štúdiách na určenie dávky boli niektorí pacienti vystavení až 150 mg lenalidomidu a v štúdiách
s jednorazovou dávkou boli niektorí pacienti vystavení až 400 mg. DLT v týchto štúdiách bola hlavne hematologická. V prípade predávkovania sa odporúča podporná starostlivosť.
5. FARMAKOLOGICKÉ VLASTNOSTI'
5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Imunosupresíva, iné imunosupresíva. ATC kód: L04AX04.
MechanizmusúčinkuMechanizmus účinku lenalidomidu zahŕňa antineoplastické, antiangiogenetické, erytropoetické a imunomodulačné vlastnosti. Lenalidomid inhibuje proliferáciu určitých hematopoetických nádorových buniek (vrátane plazmatických nádorových buniek mnohopočetného myelómu (MM)
a nádorových buniek s deléciami na chromozóme 5), zlepšuje imunitu sprostredkovanú T-bunkami
a prirodzenými zabíjačmi (
Natural Killer Cells, NK) a zvyšuje počet NK T-buniek, inhibuje angiogenézu blokovaním migrácie a adhézie endotelových buniek a tvorbu mikrociev, zvyšuje produkciu fetálneho hemoglobínu CD34+ hematopoetickými kmeňovými bunkami
a inhibuje produkciu prozápalových cytokínov v monocytoch (napríklad TNF-α a IL-6).
Lenalidomid sa viaže priamo na cereblon, zložku cullínového kruhu, ktorý je súčasťou E3 ubikvitín ligázového enzýmového komplexu. E3 ubikvitín ligázový enzýmový komplex ďalej zahŕňa proteín viažuci poškodenú deoxyribonukleovú kyselinu 1 (DNA damage-binding protein 1, DDB1), cullín 4 (CUL4), a regulátor cullínov 1 (Roc1). V prítomnosti lenalidomidu sa cereblon viaže na substrátové proteíny Aiolos a Ikaros, ktoré sú lymfoidné transkripčné faktory, a to vedie k ich ubikvitinácii a následnej degradácii, dôsledkom čoho sú cytotoxické a imunomodulačné účinky.
KlinickáúčinnosťabezpečnosťÚčinnosť a bezpečnosť lenalidomidu boli hodnotené v piatich štúdiách fázy III pre novodiagnostikovaný mnohopočetný myelóm a v dvoch štúdiách fázy III relabovaného refraktérného mnohopočetného myelómu, ako je popísané nižšie.
Novodiagnostikovaný mnohopočetný myelómUdržiavacia dávka lenalidomidu u pacientov, ktorí podstúpili ASCTÚčinnosť a bezpečnosť lenalidomidu v udržiavacej dávke bola hodnotená v dvoch multicentrických, randomizovaných, dvojito zaslepených, dvojramenných, placebom kontrolovaných štúdiách fázy III s paralelnými skupinami: CALGB 100104 a IFM 2005-02.
CALGB 100104Do štúdie boli zaradení pacienti vo veku 18 až 70 rokov s aktívnym MM vyžadujúcim liečbu a bez predchádzajúcej progresie po začiatočnej liečbe.
V priebehu 90 – 100 dní po ASCT boli pacienti randomizovaní v pomere 1:1 do skupín, ktorým boli podávané lenalidomid alebo placebo v udržiavacej terapii. Udržiavacia dávka bola 10 mg jedenkrát denne v 1. – 28. deň opakovaných 28-dňových cyklov (zvýšená na 15 mg jedenkrát denne po 3 mesiacoch bez výskytu toxicity limitujúcej dávku), a v liečbe sa pokračovalo až do progresie ochorenia.
Primárnym ukazovateľom účinnosti v štúdii bolo prežívanie bez progresie (PFS) od randomizácie do dátumu progresie alebo úmrtia, podľa toho, čo nastalo skôr; v štúdii nebol stanovený ukazovateľ celkového prežitia. Celkovo bolo randomizovaných 460 pacientov: 231 pacientov na lenalidomid a
229 pacientov na placebo. Demografické údaje a charakteristiky ochorenia boli v oboch skupinách
vyvážené.
Štúdia bola odslepená na základe odporúčaní monitorovacej komisie po prekročení prahovej hodnoty pre vopred naplánovanú predbežnú analýzu PFS. Po odslepení bolo pacientom v skupine s placebom umožnené prejsť pred progresiou ochorenia na lenalidomín.
Výsledky PFS pri odslepení a vopred naplánovanej predbežnej analýze s uzávierkou 17. decembra
2009 (15,5 mesačné sledovanie) preukázali 62 % zníženie rizika progresie ochorenia alebo smrti
v prospech lenalidomidu (HR = 0,38; 95 % IS 0,27, 0,54; p < 0,001). Medián celkového PFS bol 33,9
mesiacov (95 % IS NE, NE) v skupine s lenalidomidom v porovnaní s 19 mesiacmi (95 % IS 16,2,
25,6) v skupine s placebom.
V oboch podskupinách pacientov s kompletnou odpoveďou a v skupine pacientov, ktorí nedosiahli kompletnú odpoveď, bolo pozorovaný prínos z hľadiska PFS.
Výsledky štúdie, s uzávierkou údajov 1. februára 2016, sú uvedené v tabuľke 4.
Tabuľka 4: Súhrn údajov o celkovej účinnosti
PFS hodnotené skúšajúcim
Lenalidomid

(N = 231)
Placebo
(N = 229)
Mediána času PFS, mesiace (95 % IS) 56,9 (41,9, 71,7) 29,4 (20,7, 35,5)
HR (95 % IS)c; p-hodnotad 0,61 (0,48, 0,76); <0.001
PFS2e
Mediána času PFS2, mesiace (95 % IS)b 80,2 (63,3, 101,8) 52,8 (41,3, 64,0)
HR (95 % IS)c; p-hodnotad 0,61 (0,48; 0,78); < 0,001
Celkové prežívanie
Mediána času OS, mesiace (95 % IS)b 111,0 (101,8; NE) 84,2 (71,0; 102,7)
8 ročné prežívanie, % (SE) 60,9 (3,78) 44,6 (3,98)
HR (95 % IS)c ; p-hodnotad 0,61 (0,46; 0,81); < 0,001
Sledovanie
Mediánf (min, max), mesiace: všetci prežívajúci pacienti 81,9 (0,0; 119,8) 81,0 (4,1; 119,5) IS = interval spoľahlivosti; HR = miera rizika; max = maximum; min = minimum; NE = nestanoviteľné; OS = celkové prežívanie; PFS = prežívanie bez progresie;
a Medián je založený na Kaplanovom-Meierovom odhade.
b 95 % IS okolo mediánu.
c Založené na Coxovom modeli proporcionálnych rizík porovnajúcom funkcie rizík spojených s liečebnými skupinami.
d P-hodnota je založená na nestratifikovanom log-rank teste Kaplan-Meierovej krivky rozdielov medzi liečebnými skupinami.
e Predbežný koncový ukazovateľ (PFS2). Užívanie lenalidomidu pacientmi v skupine s placebom, ktorí prešli na užívanie lenalidomidu pred progresiou pri odslepení štúdie, sa nepovažoval za druholíniovú liečbu.
f Medián sledovania všetkých prežívajúcich pacientov po ASCT.
Datúmy uzávierky údajov: 17. dec. 2009 a 01. feb. 2016
IFM 2005-02
Do štúdie boli zaradení pacienti vo veku < 65 rokov v čase diagnózy, ktorí podstúpili ASCT a ktorí dosiahli odpoveď aspoň v podobe stabilizácie ochorenia počas obnovy hematologických parametrov. Po dvoch cykloch konsolidáciácie lenalidomidom (25 mg/deň, dni v 1. – 21. deň 28-dňového cyklu) boli pacienti randomizovaní v pomere 1:1 do skupín, ktorým boli podávané lenalidomid alebo placebo v udržiavacej terapii (10 mg jedenkrát denne v 1. – 28. deň opakovaných 28-dňových cyklov, dávka zvýšená na 15 mg jedenkrát denne po 3 mesiacoch bez výskytu toxicity limitujúcej dávku). V liečbe sa pokračovalo až do progresie ochorenia.
Primárnym koncovým ukazovateľom bolo PFS definované od randomizácie do dátumu progresie alebo úmrtia, podľa toho, čo nastalo skôr; v štúdii nebol stanovený koncový ukazovateľ celkového prežitia. Celkovo bolo randomizovaných 614 pacientov: 307 pacientov na lenalidomid a 307 pacientov na placebo.
Štúdia bola odslepená na základe odporúčaní monitorovacej komisie po prekročení prahovej hodnoty pre vopred naplánovanú predbežnú analýzu PFS. Po odslepení neprešli pacienti dostávajúci placebo pred progresiou ochorenia na liečbu lenalidomidom. Ako proaktívne bezpečnostné opatrenie bola skupina s lenalidomidom po zistení nerovnováhy SPM zrušené (pozri časť 4.4).
Výsledky PFS pri odslepení po vopred naplánovanej predbežnej analýze s uzávierkou 7. júla 2010 (31,4 mesačné sledovanie) preukázali 48 % zníženie rizika progresie ochorenia alebo smrti v prospech lenalidomidu (HR = 0,52; 95 % IS 0,41, 0,66; p < 0,001). Medián celkového PFS bol 40,1 mesiacov (95 % IS 35,7, 42,4) v skupine s lenalidomidom v porovnaní s 22,8 mesiacmi (95 % IS 20,7, 27,4) v skupine s placebom.
Prínos z hľadiska PFS bolo v podskupine pacientov s kompletnou odpoveďou menšie ako v podskupine pacientov, ktorí nedosiahli kompletnú odpoveď.
Aktualizované PSF s uzávierkou 1. februára 2016 (96,7 mesačné sledovanie) aj naďalej zobrazuje prínos z hľadiska PFS: HR = 0,57 (95 % IS 0,47, 0,68; p < 0,001). Medián celkového PFS bol 44,4 mesiacov (39,6, 52,0) v skupine s lenalidomidom v porovnaní s 23,8 mesiacmi (95 % IS 21,2, 27,3) v skupine s placebom. V prípade PFS2 bolo pre lenalidomid v porovnaní s placebom pozorované HR
0,80 (95 % IS 0,66, 0,98; p = 0,026). Medián celkového PFS2 bol 69,9 mesiacov (95 % IS 58,1, 80,0) v skupine s lenalidomidom v porovnaní s 58,4 mesiacmi (95 % IS 51,1, 65,0) v skupine s placebom. Pre OS bolo pre lenalidomid v porovnaní s placebom pozorované HR 0,90: (95 % IS 0,72, 1,13; p =
0,355). Medián celkového času prežívania bol 105,9 mesiacov (95 % IS 88,8, NE) v skupine s
lenalidomidom v porovnaní s 88,1 mesiacmi (95 % IS 80,7, 108,4) v skupine s placebom.
Lenalidomid v kombinácii s dexametazónom u pacientov, ktorí nie sú spôsobilí na transplantáciukmeňových buniek.
Bezpečnosť a účinnosť lenalidomidu sa vyhodnocovala vo fáze III, multicentrického,
randomizovaného, otvoreného, 3 ramenného klinického skúšania (MM-020) u pacientov, ktorí boli vo veku aspoň 65 rokov alebo starší, alebo ak boli mladší ako 65 rokov, neboli kandidátmi pre transplantáciu kmeňových buniek, pretože sa odmietli podrobiť transplantácii kmeňových buniek
alebo transplantácia kmeňových buniek nebola pre pacienta dostupná kvôli cene alebo z iného dôvodu.
Štúdia (MM-020) porovnávala lenalidomid a dexametazón (Rd) počas 2 rôznych období (t.j. až do progresie ochorenia [skupina Rd] alebo až do osemnástich 28-dňových cyklov [72 týždňov, skupina Rd18]) s melfalánom, prednizónom a talidomidom (MPT) počas maximálne dvanástich 42-dňových cyklov (72 týždňov). Pacienti boli randomizovaní (1: 1: 1) do 1 z 3 ramien liečby. Pacienti boli rozdelení v náhodnom výbere podľa veku (≤75 oproti >75 rokov), štádia ochorenia (ISS štádia I a II, oproti štádiu III), a krajiny.
Pacienti v skupinách Rd a Rd18 užívali lenalidomid 25 mg jedenkrát denne v 1. až 21. deň počas
28-dňových cyklov podľa protokolu daných ramien. Dexametazón 40 mg bol podávaný jedenkrát denne, v 1., 8., 15. a 22. deň počas každého 28-dňového cyklu. Začiatočná dávka a režim pre Rd a Rd18 boli upravené v závislosti od veku a funkcie obličiek (pozri časť 4.2). Pacienti >75 rokov dostali dexametazón v dávke 20 mg jedenkrát denne v 1., 8., 15. a 22. deň počas každého 28-dňového cyklu.
Všetci pacienti dostávali profylaktickú antikoagulačnú liečbu (nízko molekulárny heparín, warfarín, heparín, nízke dávkyacetylsalicylovej kyseliny) v priebehu štúdie.
Primárnym koncovým ukazovateľom účinnosti v klinickej štúdii bolo prežívanie bez progresie (PFS). Celkovo 1623 pacientov bolo zaradených do štúdie, s 535 pacientov randomizovaných do skupiny Rd,
541 pacientov randomizovaných do skupiny Rd18 a 547 pacientov randomizovaných do skupiny MPT. Demografické údaje a východisková charakteristika súvisiaca s chorobou pacientov boli dobre
vyvážené vo všetkých 3 skupinách. Všeobecne platí, že jedinci v štúdii mali pokročilé štádium ochorenia: z celkovej populácie v štúdii malo 41% ISS štádium III, 9% malo ťažkú renálnu insuficienciu (klírens kreatinínu [CLcr] <30 ml / min). Priemerný vek v 3 skupinách bol 73skupinách.
Výsledky aktualizovanej analýzy PFS, PFS2 a OS s uzávierkou pre údaje 3. marca 2014, kde bol medián sledovania všetkých prežívajúcich jedincov 45,5 mesiacov, sú výsledky štúdie uvedené v tabuľke 5:
Tabuľka 5. Súhrn údajov o celkovej účinnosti
PFS hodnotené skúšajúcim-
(mesiace) Rd(N = 535)Rd18 (N = 541)MPT (N = 547)
Rd(N = 535)Rd18 (N = 541)MPT (N = 547)
Mediána PFS, mesiace (95% IS)b 26,0 (20,7; 29,7) 21,0 (19,7; 22,4) 21,9 (19,8; 23,9) HR [95% IS]c; p-hodnotad
Rd vs MPT 0,69 (0,59; 0,80); <0,001
Rd vs Rd18 0,71 (0,61; 0,83); <0,001
Rd18 vs MPT 0,99 (0,86; 1,14); 0,866
PFS2e - (mesiace)
Mediána PFS2, mesiace (95% IS)b 42,9 (38,1; 47,4) 40,0 (36,2; 44,2) 35,0 (30,4; 37,8) HR [95% IS]c; p-hodnotad
Rd vs MPT 0,74 (0,63; 0,86); <0,001
Rd vs Rd18 0,92 (0,78; 1,08); 0,316
Rd18 vs MPT 0,80 (0,69; 0,93); 0,004
Celkové prežívanie (mesiace)
Mediána OS, mesiace (95% IS)b 58,9 (56,0, NE) 56,7 (50,1; NE) 48,5 (44,2; 52,0) HR [95% IS]c; p-hodnotad
Rd vs MPT 0,75 (0,62; 0,90); 0,002
Rd vs Rd18 0,91 (0,75; 1,09); 0,305
Rd18 vs MPT 0,83 (0,69; 0,99); 0,034
Sledovanie (mesiace)
Mediánf (min, max): všetci pacienti 40,8 (0,0, 65,9) 40,1 (0,4; 65,7) 38,7 (0,0; 64,2)
Odpoveď na liečbu myelómug n (%)
CR 81 (15,1) 77 (14,2) 51 (9,3) VGPR 152 (28,4) 154 (28,5) 103 (18,8) PR 169 (31,6) 166 (30,7) 187 (34,2) Celková odpoveď: CR, VGPR, alebo PR 402 (75,1) 397 (73,4) 341 (62,3)
Trvanie odpovede - (mesiace)
Mediána (95% IS)b 35,0 (27,9; 43,4) 22,1 (20,3;24,0) 22,3 (20,2; 24,9)
AMT = antimyelómova liečba; IS = interval spoľahlivosti; CR = kompletná odpoveď; d = nízkodávkovaný dexametazón; HR = miera rizika; IMWG = Mezinárodná myelómová pracovná skupina (International Myeloma Working Group); IRAC = Nezávislá komisia pre posuzovanie odpovede (Independent Response Adjudication Committee); M = melfalán; max = maximum; min = minimum; NE = nestanoviteľné; OS = celkové prežívanie; P = prednizón; PFS = prežívanie bez progresie; PR = čiastočná odpoveď; R = lenalidomid; Rd = Rd podávané po zdokumentovanú progresiu ochorenia; Rd18 = Rd podávané 18 cyklov; SE = štandardná chyba; T = talidomid; VGPR = veľmi dobrá čiastočná odpoveď; vs = versus.
a Medián je založený na Kaplanovom-Meierovom odhade.
b 95% IS okolo mediánu.
c Založené na Coxovom modeli proporcionálnych rizík porovnajúcom funkcie rizík spojených s liečebnými skupinami.
d P-hodnota je založená na nestratifikovanom log-rank teste Kaplanovej-Meierovej krivky rozdielov medzi liečebnými skupinami.
e Predbežný koncový ukazovateľ (PFS2)
f Medián je jednorozmerná štatistika bez úpravy pre cenzurovanie.
g Najlepší odhad posudzovanej odpovede počas liečebnej fázy klinického skúšania (pre definíciu každej kategórie odpovede, dátum uzávierky pre údaje = 24. máj 2013).
Lenalidomid v kombinácii s melfalánom a prednizónom nasledovaný udržiavacou liečbou u pacientov,ktorí nie sú spôsobilí na transplantáciu
Bezpečnosť a účinnosť lenalidomidu bola hodnotená vo fáze III multicentrickej, randomizovanej,
dvojito zaslepenej, 3-ramennej štúdii (MM-015) u pacientov, ktorí mali 65 rokov alebo boli starší a mali hodnotu kreatinínu v sére <2,5 mg / dl. Štúdia porovnávala lenalidomid v kombinácii
s melfalánom a prednizónom (MPR) s udržiavacou liečbou lenalidomidom alebo bez nej do progresie ochorenia s melfalánom a prednizónom počas maximálne 9 cyklov. Pacienti boli randomizovaní
v pomere 1: 1: 1 do jednej z 3 liečebných skupín. Pacienti boli randomizovaní podľa veku (£ 75 vs. >
75 rokov) a štádia ochorenia (ISS; štádiá I a II vs. štádium III).
Toto klinické skúšanie skúmalo použitie kombinovanej liečby MPR (melfalán 0,18 mg/kg perorálne v dňoch 1 až 4 opakovaných 28-dňových cyklov, prednizón v dávke 2 mg/kg perorálne v dňoch 1 až 4 opakovaných 28-dňových cyklov a lenalidomid 10 mg denne perorálne v dňoch 1 až 21 opakovaných
28-dňových cyklov) ako indukčnú liečbu, až 9 cyklov. Pacienti, ktorí absolvovali 9 cyklov, alebo ktorí
nemohli dokončiť 9 cyklov z dôvodu intolerancie, pristúpili k udržiavacej liečbe lenalidomidom so začiatočnou dávkou 10 mg perorálne v dňoch 1 až 21 opakovaných v 28-dňových cykloch až do progresie ochorenia.
Primárnym koncovým ukazovateľom účinnosti v klinickom skúšaní bolo prežívanie bez progresie (PFS). Celkovo bolo 459 pacientov zaradených do štúdie, so 152 pacientmi randomizovanými do skupiny MPR + R, 153 pacientov bolo randomizovaných do skupiny MPR + p a 154 pacientov bolo randomizovaných do skupiny MPp + p. Demografické údaje a vychodisková charakteristika súvisiaca s chorobou boli vyvážené vo všetkých 3 skupinách; predovšetkým, približne 50% pacientov zaradených do každé skupiny malo nasledujúce charakteristiky; ISS štádium III a klírens kreatinínu
<60 ml / min. Priemerný vek bol 71 v skupinách MPR + R a MPR + p a 72 v MPp + p skupine.
Výsledky analýzy PFS, PFS2, OS s uzávierkou údajov v apríli 2013 bol medián sledovania všetkých prežívajúcich jedincov 62,4 mesiacov, výsledky štúdie sú uvedené v tabuľke 6:
Tabuľka 6. Súhrn údajov o celkovej účinnosti
PFS hodnotený skúšajúcim-
(mesiace) MPR+R (N = 152)MPR+p(N = 153)MPp +p(N = 154)
MPR+R (N = 152)MPR+p(N = 153)MPp +p(N = 154)
Mediána PFS, mesiace (95% IS) 27,4 (21,3; 35,0) 14,3 (13,2; 15,7) 13,1 (12,0; 14,8) HR [95% IS]; p-hodnota
MPR+R vs MPp+p 0,37 (0,27; 0,50); <0,001
MPR+R vs MPR+p 0,47 (0,35; 0,65); <0,001
MPR+p vs MPp +p 0,78 (0,60; 1,01); 0,059
PFS2 - (mesiace) ¤
Mediána PFS2, mesiace (95% IS) 39,7 (29,2; 48,4) 27,8 (23,1; 33,1) 28,8 (24,3; 33,8) HR [95% IS]; p-hodnota
MPR+R vs MPp+p 0,70 (0,54; 0,92); 0,009
MPR+R vs MPR+p 0,77 (0,59; 1,02); 0,065
MPR+p vs MPp +p 0,92 (0,71; 1,19); 0,051
Celkové prežívanie (mesiace)
Mediána OS, mesiace (95% IS) 55,9 (49,1; 67,5) 51,9 (43,1; 60,6) 53,9 (47,3; 64,2) HR [95% IS]; p-hodnota
MPR+R vs MPp+p 0,95 (0,70; 1,29); 0,736
MPR+R vs MPR+p 0,88 (0,65; 1,20); 0,43
MPR+p vs MPp +p 1,07 (0,79; 1,45); 0,67
Sledovanie (mesiace)
 MPR+R
(N = 152)
MPR+p
(N = 153)
MPp +p
(
N = 154)
MPR+R
(N = 152)
MPR+p
(N = 153)
MPp +p
(
N = 154)
Medián (min, max): všetci pacienti 48,4 (0,8; 73,8) 46,3 (0,5; 71,9) 50,4 (0,5; 73,3)
Odpoveď na liečbu myelómu hodnotená skúšajúcim n (%)
CR 30 (19,7) 17 (11,1) 9 (5,8) PR 90 (59,2) 99 ( 64,7) 75 (48,7) Stabilné ochorenie (SD) 24 (15,8) 31 (20,3) 63 (40,9) Odpoveď nehodnotiteľná (NE) 8 (5,3) 4 (2,6) 7 (4,5)
Trvanie odpovede hodnotené skúšajúcim
(CR+PR) - (mesiace)
Mediána (95% IS) 26,5 (19,4; 35,8) 12,4 (11,2; 13,9) 12,0 (9,4; 14,5) IS = interval spoľahlivosti; CR = kompletná odpoveď; HR = miera rizika; M = melfalán; NE = nestanoviteľné; OS = celkové prežívanie; p = placebo; P = prednizón;
PD = progresia ochorenia; PR = parciálna odpoveď; R = lenalidomid; SD = stabilné ochorenie; VGPR = veľmi dobrá čiastočná odpoveď.
ª Medián je založený na Kaplanovom-Meierovom odhade.
¤PFS2 (predbežný koncový ukazovateľ) bol definovaný pre všetkých pacientov (ITT) ako čas od randomizácie do začiatku 3. línie antimyelómovej liečby (AMT) alebo úmrtia všetkých randomizovaných pacientov
Podporné štúdie novodiagnostikovaného mnohopočetného myelómu
Otvorené, randomizované, multicentrické klinické skúšanie fázy III (ECOG E4A03) bolo uskutočnené u 445 pacientov s novodiagnostikovaným mnohopočetným myelómom; 222 pacientov bolo randomizovaných do skupiny lenalidomid / nízkodávkovaný dexametazón, a 223 pacientov bolo randomizovaných do skupiny lenalidomid / štandardne dávkovaný dexametazón. Pacienti randomizovaní do skupiny lenalidomid / štandardne dávkovaný dexametazón užívali lenalidomid
25 mg denne v 1. až 21. deň každých 28 dní spolu s nízkodávkovaným dexametazónom 40 mg denne v dňoch 1 až 4, 9 až 12 a 17 až 20 každých 28 dní, prvé štyri liečebné cykly. Pacienti randomizovaní do skupiny lenalidomid / nízkodávkovaný dexametazón užívali lenalidomid 25 mg denne v 1. až 21. deň každých 28 dní spolu s nízkodávkovaným dexametazónom 40 mg denne v dňoch 1, 8, 15, a 22 každých 28 dní. V skupine lenalidomid / nízkodávkovaný dexametazón 20 pacientov (9,1 %) malo aspoň jedno prerušenie liečby v porovnaní so 65 pacientmi (29,3 %) v skupine lenalidomid / štandardne dávkovaný dexametazón.
V post-hoc analýze bola pozorovaná nižšia mortalita v skupine lenalidomid/ nízkodávkovaný dexametazón 6,8 % (15/220) v porovnaní so skupinov lenalidomid / štandardne dávkovaný dexametazón 19,3% (43/223) u pacientov s novodiagnostikovaným mnohopočetným myelómom, s mediánom sledovania 72,3 týždňa.
Avšak, po dlhšej dobe sledovania, sa rozdiel v celkovom prežívaní v prospech lenalidomidu/nízko dávkovaného dexametazónu znižuje.
Mnohopočetný myelóm s aspoň jednou predchádzajúcou liečbou
Účinnosť a bezpečnosť lenalidomidu sa vyhodnocovala v dvoch multicentrických, randomizovaných, dvojito zaslepených, placebom kontrolovaných, štúdiách fázy III (MM-009 a MM-010). Štúdie boli vykonávané u pacientov s mnohopočetným myelómom, ktorí v minulosti už podstúpili inú liečbu.
V štúdiách boli pacienti zadelení do dvoch paralelných kontrolných skupín a porovnávala sa liečba lenalidomidom plus dexametazónom oproti liečbe samotným dexametazónom. Z 353 pacientov v štúdiách MM-009 a MM-010, ktorým sa podával lenalidomid/dexametazón, bolo 45,6 % vo veku 65 rokov a starších. Zo 704 pacientov vyhodnocovaných v štúdiách MM-009 a MM-010 bolo 44,6 % vo veku 65 rokov a starších.
V oboch štúdiách užívali pacienti v skupine lenalidomid/dexametazón (len/dex) 25 mg lenalidomidu perorálne jedenkrát denne v 1. až 21. deň a zodpovedajúcu kapsulu placeba jedenkrát denne v 22. až
28. deň každého 28-dňového cyklu. Pacienti v skupine placebo/dexametazón (placebo/dex) užívali
1 kapsulu placeba denne v 1. až 28. deň každého 28-dňového cyklu. Pacienti v oboch liečebných skupinách užívali 40 mg dexametazónu perorálne jedenkrát denne v 1. až 4., 9. až 12. a 17. až 20. deň každého 28-dňového cyklu počas prvých 4 cyklov liečby. Po prvých 4 cykloch liečby bola dávka dexametazónu znížená na 40 mg perorálne jedenkrát denne v 1. až 4 deň každého 28-dňového cyklu.
V oboch štúdiách sa s liečbou pokračovalo až do progresie ochorenia. V oboch štúdiách bola povolená úprava dávkovania na základe klinických a laboratórnych nálezov.
Primárnym koncovým ukazovateľom účinnosti v rámci hodnotenia účinnosti v oboch štúdiách bol čas do progresie (Time To Progression, TTP). Celkove sa v štúdii MM-009 vyhodnotilo 353 pacientov;
177 v skupine len/dex a 176 v skupine placebo/dex a v štúdii MM-010 sa celkove vyhodnotilo
351 pacientov; 176 v skupine len/dex a 175 v skupine placebo/dex.
V oboch štúdiách boli východiskové demografické vlastnosti a charakteristika súvisiaca s chorobou pacientov medzi skupinami len/dex a placebo/dex porovnateľné. Obe skupiny pacientov predstavovali vekový medián 63 rokov, s porovnateľným pomerom mužov k ženám. Stav podľa kritérií ECOG (Eastern Cooperative Oncology Group), ako aj počet a druh predchádzajúcich terapií, bol medzi oboma skupinami porovnateľný.
Predbežná analýza oboch štúdií preukázala, že vzhľadom na primárny koncový ukazovateľ, čas do progresie ochorenia TTP (medián sledovania 98,0 týždňov), bol len/dex štatisticky signifikantne lepší (p < 0,00001) ako samotným dexametazón. Pomer kompletnej odpovede a celkovej odpovede bol v oboch štúdiách v skupine len/dex tiež signifikantne vyšší ako v skupine placebo/dex. Výsledky týchto analýz následne viedli k odslepeniu oboch štúdií, aby pacientom zo skupiny placebo/dex mohla byť podávaná kombinovaná liečba len/dex.
Vykonala sa rozšírená analýza účinnosti s mediánom sledovania 130,7 týždňov. Tabuľka 7 súhrnne uvádza výsledky analýz účinnosti pokračovacej liečby – súhrnné štúdie MM-009 a MM-010.
V tejto súhrnnej rozšírenej analýze pokračovacej liečby bol medián TTP 60,1 týždňov (95 % IS: 44,3;
73,1) u pacientov liečených len/dex (N = 353) oproti 20,1 týždňom (95 % IS: 17,7; 20,3) u pacientov liečených placebom/dex (N = 351). Medián prežitia bez progresie bol 48,1 týždňov (95 % IS: 36,4;
62,1) u pacientov liečených len/dex oproti 20,0 týždňom (95 % IS: 16,1; 20,1) u pacientov liečených
placebom/dex. Medián trvania liečby bol 44,0 týždňov (min: 0,1; max: 254,9) pri len/dex a 23,1 týždňov (min: 0,3 max: 238,1) pri placebe/dex. Hodnoty kompletnej odpovede (Complete Response, CR), čiastočnej odpovede (Partial Response, PR) a celkovej odpovede (CR+PR) v skupine len/dex zostali v oboch štúdiách signifikantne vyššie ako v skupine placebo/dex. Medián celkového prežívania (Overall Survival, OS) v rozšírenej analýze pokračovacej liečby súhrnných štúdií bol 164,3 týždňov (95 % IS: 145,1; 192,6) u pacientov liečených len/dex oproti 136,4 týždňom (95 % IS: 113,1; 161,7) u pacientov liečených placebom/dex. Napriek tomu, že 170 z 351 pacientov randomizovaných pre placebo/dex užilo lenalidomid po progresii ochorenia alebo po otvorení štúdií, súhrnná analýza celkového prežívania preukázala štatisticky signifikantne lepšie prežívanie pri len/dex v porovnaní s placebom/dex (pomer rizika [Hazard Ratio, HR] = 0,833; 95 % IS = [0,687; 1,009], p = 0,045).
Tabuľka 7. Súhrn výsledkov analýzy účinnosti od dátumu ukončenia rozšírenej pokračovacej liečby — súhrnné štúdie MM-009 a MM-010 (ukončenie 23. júla 2008 a 2. marca 2008,
v uvedenom poradí)
C
ieľový ukazovateľ len/dex
(N=353)
placebo/dex
(
N=351)
Čas do udalosti HR [95 % IS], p-hodnota a
Čas do progresie
Medián [95 % IS], týždne Obdobie bez progresie Medián [95 % IS], týždne Celkové prežívanie Medián [95 % IS], týždne
1-ročné celkové prežívanie
60,1 [44,3;
73,1]

48,1
[36,4; 62,1]
164,3 [145,1;
192,6]
82 %
20,1 [17,7;
20,3]
20,0 [16,1;
20,1]
136,4 [113,1;
161,7]
75 %
0,350 [0,287; 0,426],
p < 0,001
0,393 [0,326; 0,473]
p < 0,001
0,833 [0,687; 1,009]
p = 0,045
Miera odpovede Pomer pravdepodobnosti
[95 % IS], p-hodnota b
C
ieľový ukazovateľ len/dex
 (N=353)
placebo/dex
(
N=351)
(N=353)
placebo/dex
(
N=351)
Celková odpoveď [n, %] Kompletná odpoveď [n, %]
212 (60,1)
58 (16,4)
75 (21,4)
11 (3,1)
5,53 [3,97; 7,71], p < 0,001
6,08 [3,13; 11,80], p < 0,001
a: Dvojstranný (two-tailed) log rank test porovnávajúci krivky prežívania medzi liečenými skupinami b: Dvojstranný (two-tailed) chi-kvadrát test korigovaný pre spojitosť
Pediatrickápopulácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s lenalidomidom vo všetkých podskupinách pediatrickej populácie s mnohopočetným myelómom (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Lenalidomid má asymetrický atóm uhlíka a môže preto existovať v opticky aktívnych formách S(-) a R(+). Lenalidomid sa produkuje ako racemická zmes. Lenalidomid je všeobecne lepšie rozpustný v organických rozpúšťadlách, ale najvyššiu rozpustnosť vykazuje v pufrovom roztoku 0,1N HCl.
Absorpcia
Lenalidomid sa po perorálnom podaní zdravým dobrovoľníkom nalačno rýchlo absorbuje a dosahuje maximálne koncentrácie v plazme 0,5 až 2 hodiny po podaní. U pacientov, rovnako ako u zdravých dobrovoľníkov, sa maximálna koncentrácia (Cmax) a plocha pod krivkou závislosti času a koncentrácie (AUC) zvyšujú úmerne so zvyšovaním dávky. Opakované dávky nespôsobujú značnú akumuláciu lieku. Relatívna expozícia S- a R- stereoizomérom lenalidomidu v plazme je približne 56 % a 44 %.
Súbežné podávanie s vysokokalorickým jedlom s vysokým obsahom tukov u zdravých dobrovoľníkov znižuje mieru absorpcie, čo má za následok zníženie plochy pod krivkou závislosti koncentrácie a času (AUC) približne o 20 % a zníženie Cmax v plazme o 50 %. V hlavných registračných štúdiách
s mnohopočetným myelómom, v ktorých sa stanovila bezpečnosť a účinnosť lenalidomidu, bol však
liek podávaný bez ohľadu na príjem jedla. A tak sa môže lenalidomid podávať s jedlom alebo bez jedla.
Distribúcia
In vitro bolo viazanie (14C)-lenalidomidu na proteíny v plazme nízke, s priemerným viazaním na proteíny v plazme na úrovni 23 % u pacientov s mnohopočetným myelómom a 29 % u zdravých
dobrovoľníkov.
Lenalidomid je prítomný v ľudskej sperme (< 0,01 % dávky) po podaní 25 mg/deň a 3 dni po ukončení užívania je liek nedetekovateľný v sperme zdravých osôb (pozri časť 4.4).
Biotransformáciaaeliminácia
Výsledky metabolických štúdií ľudí in vitro preukázali, že lenalidomid nie je metabolizovaný prostredníctvom enzýmov cytochrómu P450, čo naznačuje, že podávanie lenalidomidu s liekmi, ktoré inhibujú enzýmy cytochrómu P450, pravdepodobne nevedie k metabolickým liekovým interakciám
u ľudí. In vitro štúdie naznačujú, že lenalidomid nemá inhibičný účinok na CYP1A2, CYP2C9,
CYP2C19, CYP2D6, CYP2E1, CYP3A alebo UGT1A1. Preto je pravdepodobné, že lenalidomid nespôsobí klinicky významné liekové interakcie pri súbežnom podávaní so substrátmi týchto enzýmov.
Štúdie uskutočnené in vitro naznačujú, že lenalidomid nie je substrátom proteínu rezistencie karcinómu prsníka (breast cancer resistance protein, BCRP) u ľudí, transportných proteínov vyvolávajúce rezistenciu na viaceré lieky MRP1, MRP2 alebo MRP3 (multidrug resistance protein, MRP), transportérov OAT1 a OAT3 pre organické anióny (organic anion transporters, OAT), polypeptidového transportéru 1B1 pre organické anióny (organic anion transporting polypeptide 1B1, OATP1B1), transportérov OCT1 a OCT2 pre organické katióny (organic cation transporter, OCT), proteínu vylučujúceho viaceré lieky a toxíny MATE1 (multidrug and toxin extrusion protein, MATE) a neobvyklých transportérov OCTN1 a OCTN2 pre organické katióny (organic cation transporters novel, OCTN).
In vitro štúdie naznačujú, že lenalidomid nemá inhibičný účinok na exportnú pumpu žlčových solí
u ľudí (human bile salt export pump, BSEP), BCRP, MRP2, OAT1, OAT3, OATP1B1, OATP1B3 a
OCT2.
Väčšia časť lenalidomidu sa vylúči renálnym vylučovaním. Podiel renálneho vylučovania v celkovom klírense u osôb s normálnou funkciou obličiek bol 90 %, pričom 4 % lenalidomidu sa vylúčilo stolicou.
Lenalidomid sa slabo metabolizuje, nakoľko 82 % dávky sa vylúči v nezmenenej forme močom. Hydroxy-lenalidomid predstavuje 4,59 % a N-acetyl-lenalidomid 1,83 % vylúčenej dávky. Renálny klírens lenalidomidu prevyšuje mieru glomerulárnej filtrácie a preto je aspoň do určitej miery aktívne vylučovaný.
V dávkach 5 až 25 mg/deň je polčas v plazme u zdravých dobrovoľníkov približne 3 hodiny a u pacientov s mnohopočetným myelómom sa pohybuje od 3 do 5 hodín.
Staršieosoby
Nevykonali sa žiadne klinické štúdie na hodnotenie farmakokinetiky lenalidomidu u starších osôb. Populačné farmakokinetické analýzy zahŕňali pacientov vo veku 39 až 85 rokov a naznačujú, že vek neovplyvňuje klírens lenalidomidu (prítomnosť v plazme). Keďže je u starších osôb pravdepodobnejšia znížená funkcia obličiek, pri voľbe dávkovania sa odporúča opatrnosť a je vhodné sledovať funkciu obličiek.
Poruchafunkcieobličiek
Farmakokinetika lenalidomidu sa skúmala u osôb s poruchou funkcie obličiek z dôvodu iných ako malígnych ochorení. V tejto štúdii sa na klasifikáciu funkcie obličiek použili dve metódy: klírens kreatinínu v moči meraný počas 24 hodín a klírens kreatinínu stanovený pomocou Cockcroftovho- Gaultovho vzorca. Výsledky naznačujú, že so znížením funkcie obličiek (< 50 ml/min) úmerne klesá celkový klírens lenalidomidu, čo má za následok zvýšenie AUC. AUC sa zvýšilo približne 2,5, 4 a 5- násobne u osôb so stredne ťažkou poruchou funkcie obličiek, s ťažkou poruchou funkcie obličiek
a s terminálnym štádiom obličkového ochorenia, v uvedenom poradí, v porovnaní so skupinou zahrňujúcou osoby s normálnou funkciou obličiek a osoby s miernou poruchou funkcie obličiek. Polčas lenalidomidu sa z približne 3,5 hodín u pacientov s klírensom kreatinínu > 50 ml/min zvyšuje na viac ako 9 hodín u pacientov so zníženou funkciou obličiek s klírensom kreatinínu < 50 ml/min. Porucha funkcie obličiek však nezmenila vstrebávanie lenalidomidu po perorálnom podaní. Hodnota Cmax je u zdravých jedincov a pacientov s poruchou funkcie obličiek podobná. Približne 30 % liečiva v tele sa vylúčilo počas jednej 4-hodinovej dialýzy. Odporúčaná úprava dávkovania u pacientov s poruchou funkcie obličiek je opísaná v časti 4.2.
Poruchafunkciepečene
Populačné farmakokinetické analýzy zahŕňali pacientov s miernou poruchou funkcie pečene (N=16, celkový bilirubín > 1 až ≤ 1,5 x hornej hranice normálneho rozmedzia alebo AST > horná hranica normálneho rozmedzia) a naznačujú, že mierna porucha funkcie pečene neovplyvňuje klírens lenalidomidu (prítomnosť v plazme). Nie sú dostupné žiadne údaje u pacientov so stredne ťažkou až ťažkou poruchou funkcie pečene.
Inévnútornéfaktory
Populačné farmakokinetické analýzy naznačujú, že telesná hmotnosť (33 – 135 kg), pohlavie, rasa a typ hematologickej malignity nemajú klinicky významný účinok na klírens lenalidomidu
u dospelých pacientov.
5.3 Predklinické údaje o bezpečnosti
Štúdia embryofetálneho vývoja sa vykonala na opiciach, ktorým sa podával lenalidomid v dávkach od
0,5 a až do 4 mg/kg/deň. Pozorovania tejto štúdie naznačujú, že lenalidomid spôsobil externé malformácie, vrátane nepriechodnosti anusu a malformácie horných a dolných končatín (skrivená,
skrátená, deformovaná, zle otočená a/alebo chýbajúca časť končatiny, oligodaktýlia a/alebo polydaktýlia) u potomstva samíc opíc, ktoré dostávali liečivo počas gravidity.
U jednotlivých plodov sa pozorovali aj rôzne viscerálne zmeny (zmena farby, červené ložiská
v rozličných orgánoch, malé množstvo bezfarebného tkaniva nad atrioventrikulárnou chlopňou, malý žlčník, deformovaná bránica).
Lenalidomid môže mať akútny toxický účinok; minimálna smrteľná dávka po perorálnom podaní bola u hlodavcov > 2000 mg/kg/deň. Opakované perorálne podanie dávky 75, 150 a 300 mg/kg/deň potkanom po dobu až 26 týždňov spôsobilo v prípade všetkých 3 dávok a najvýraznejšie u samíc, zvratné, s liečbou súvisiace zvýšenie mineralizácie v obličkovej panvičke. Za hodnotu dávky bez pozorovaného nepriaznivého účinku (no observed adverse effect level, NOAEL) sa považovala hodnota do 75 mg/kg/deň, ktorá je približne 25-násobne vyššia ako denná expozícia u ľudí na základe expozície AUC. Opakované perorálne podávanie 4 a 6 mg/kg/deň opiciam po dobu až 20 týždňov viedlo k úmrtnosti a významnej toxicite (výrazná strata hmotnosti, znížený počet erytrocytov, leukocytov a trombocytov, krvácanie početných orgánov, zápal gastrointestinálneho traktu, lymfoidná atrofia a atrofia kostnej drene). Opakované perorálne podávanie v dávke 1 a 2 mg/kg/deň opiciam po dobu až 1 rok spôsobilo zvratné zmeny v bunkovej štruktúre kostnej drene a mierny pokles pomeru myeloidných/erytroidných buniek a atrofiu týmusu. Mierny pokles počtu leukocytov sa pozoroval pri dávke 1 mg/kg/deň, ktorá približne zodpovedá rovnakej dávke u ľudí na základe porovnaní AUC.
In vitro (bakteriálna mutácia, ľudské lymfocyty, lymfóm myší, transformácia embryonálnych buniek škrečka zlatého) a in vivo (mikronukleus potkanov) štúdie mutagenity neodhalili žiadne účinky súvisiace s liekom na úrovni génov ani chromozómov. Štúdie karcinogenity s lenalidomidom sa neuskutočnili.
Štúdie vývojovej toxicity sa uskutočnili predtým na králikoch. V týchto šúdiách sa podávali králikom perorálne dávky 3, 10 a 20 mg/kg/deň. Pri dávkach 10 a 20 mg/kg/deň bola v závislosti od dávky pozorovaná absencia stredného laloka pľúc a narušenie polohy obličiek sa pozorovalo pri
20 mg/kg/deň. Aj keď sa tieto účinky pozorovali pri hladinách toxických pre matku, môžu byť
pripísané priamemu účinku. Zmeny mäkkých tkanív a kostry sa tiež pozorovali u plodov pri dávkach
10 a 20 mg/kg/deň.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly laktóza
mikrokryštalická celulóza
sodná soľ kroskarmelózy koloidný bezvodý oxid kremičitý stearan horečnatý
Obal kapsuly
LenalidomideAccord2,5mgtvrdékapsuly želatína
čierny oxid železitý (E172)
oxid titaničitý (E171)
LenalidomideAccord5mgaLenalidomideAccord25mgtvrdékapsuly želatína
oxid titaničitý (E171)
Lenalidomide
Accord
7
,5
m
g
t
v
rdé
kapsuly želatína
červený oxid železitý (E172)
oxid titaničitý (E171)
indigokarmín (E132)
LenalidomideAccord10mgaLenalidomideAccord20mgtvrdékapsuly želatína
indigokarmín (E132)
žltý oxid železitý (E172)
oxid titaničitý (E171)
LenalidomideAccord15mgtvrdékapsuly želatína
červený oxid železitý (E172)
žltý oxid železitý (E172)
oxid titaničitý (E171) Potlačový atrament
šelak propylénglykol
čierny oxid železitý (E172) žltý oxid železitý (E172) hydroxid draselný
oxid titaničitý (E171)
indigokarmín (E132)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah balenia
Lenalidomide Accord tvrdé kapsuly sú dostupné v perforovaných jednodávkových blistroch z OPA- AL-PVC/hliníkovej fólie.
Lenalidomide Accord 2,5 mg, Lenalidomide Accord 5 mg, Lenalidomide Accord 10 mg a
Lenalidomide Accord 15 mg tvrdé kapsuly
Veľkosť balenia 7 x 1 alebo 21 x 1 kapsúl.
Na trh nemusia byť uvedené všetky veľkosti balenia.
Lenalidomide Accord 7,5 mg, Lenalidomide Accord 20 mg a Lenalidomide Accord 25 mg tvrdé kapsuly
Veľkosť balenia 21 x 1 kapsúl.
6.6 Špeciálne opatrenia na likvidáciu
Kapsuly sa nemajú otvárať ani drviť. Ak sa prášok z lenalidomidu dostane do kontaktu s kožou, koža sa má okamžite a dôkladne umyť mydlom a vodou. Ak sa lenalidomid dostane do kontaktu so sliznicami, majú sa dôkladne opláchnuť vodou.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare S.L.U.
World Trade Center, Moll de Barcelona, s/n, Edifici Est 6ª planta,
08039 Barcelona, Španielsko
8. REGISTRAČNÉ ČÍSLO(A)LenalidomideAccord2,5mgtvrdékapsulyEU/1/18/1316/001
EU/1/18/1316/002
LenalidomideAccord5mgtvrdékapsulyEU/1/18/1316/003
EU/1/18/1316/004
LenalidomideAccord7,5mgtvrdékapsulyEU/1/18/1316/005
LenalidomideAccord10mgtvrdékapsulyEU/1/18/1316/006
EU/1/18/1316/007
LenalidomideAccord15mgtvrdékapsulyEU/1/18/1316/008
EU/1/18/1316/009
LenalidomideAccord20mgtvrdékapsulyEU/1/18/1316/010
LenalidomideAccord25mgtvrdékapsulyEU/1/18/1316/011
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. septembra 2018
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu/.