
predchádzajúcom rannom užití levodopy plus objem potrebný na naplnenie trubice. Kontinuálna udržiavacia dávka sa konvertuje 1: 1 a je založená na dennom príjme levodopy pacientom (s výnimkou rannej dávky). Dávky sa potom postupne titrujú na základe klinických príznakov, až kým sa nedosiahne požadovaný účinok.
Prechod z kombinovanej liečby levodopa/inhibítor DDC/tolkapón na Lecigon sa neskúmal.
Prechod z terapie dopamínovými agonistami na Lecigon
Pri prechode z liečby dopamínovými agonistami na monoterapiu Lecigonom je potrebné vziať do úvahy riziko abstinenčných príznakov z vysadenia dopamínových agonistov a vyhnúť sa náhlemu
ukončeniu liečby dopamínovými agonistami.
Monitorovanie liečby
Po úvodnej titrácii sa ranná dávka a udržiavacia dávka doladia v priebehu niekoľkých týždňov.
Lecigon sa na úvod podáva ako monoterapia. V prípade potreby sa môžu súčasne užívať aj ďalšie antiparkinsoniká (o súčasne podávanej liečbe Parkinsonovej choroby pozri tiež časti 4.3 a 4.5). Ak sa liečba inými antiparkinsonikami preruší alebo sa zmení, bude možno potrebné upraviť dávky Lecigonu.
Pri náhlom zhoršení odpovede na liečbu s rekurentnými motorickými fluktuáciami treba myslieť na možnosť dislokácie distálnej časti sondy z duodena/jejuna do žalúdka. Presná poloha sondy sa má určiť RTG vyšetrením a koncová časť sondy premiestniť do duodena/jejuna.
Liečba v súvislosti s demenciou
V prípade suspektnej alebo diagnostikovanej demencie so zníženým prahom zmätenosti má pacientovu pumpu obsluhovať ošetrujúci personál alebo opatrovateľ.
Zneužívanie lieku
V prípade podozrenia na zneužitie lieku je v pumpe použitej s Lecigonom (Crono LECIG) funkcia blokovania. Táto funkcia bráni pacientovi v zmene nastavení pumpy.
Osobitné populácie
Pediatrická populácia
Neexistuje opodstatnenie pre použitie Lecigonu v pediatrickej populácii v indikácii pokročilej
Parkinsonovej choroby odpovedajúcej na liečbu levodopou so závažným kolísaním motoriky a hyperkinézou/dyskinézou.
Starší ľudia
Existuje veľké množstvo skúseností s používaním levodopy/karbidopy/entakapónu u starších
pacientov. Dávkovanie sa u všetkých pacientov, vrátane starších, upravuje individuálne titráciou.
Porucha funkcie pečene
Dávkovanie Lecigonu sa individuálne upravuje titráciou na dávku, ktorá poskytuje optimálny účinok
(čo zodpovedá individuálne optimalizovanej expozícii levodopy, karbidopy a entakapónu v plazme). Pri titrácii dávky sa teda berú do úvahy všetky účinky poškodenia pečene na expozíciu levodope, karbidope a entakapónu. Nie sú k dispozícii žiadne farmakokinetické štúdie s karbidopou a levodopou u pacientov s poruchou funkcie pečene. Eliminácia entakapónu je znížená u pacientov s ľahkou až stredne ťažkou poruchou funkcie pečene. U pacientov s ľahkou až stredne ťažkou poruchou funkcie pečene sa preto odporúča titrovať dávku opatrne. Môže byť potrebné znížiť dávku (pozri časť 5.2). Lecigon sa nemá používať u pacientov s ťažkou poruchou funkcie pečene; pozri časť 4.3.
Porucha funkcie obličiek
Dávkovanie Lecigonu sa individuálne upravuje titráciou na dávku, ktorá poskytuje optimálny účinok
(ktorý zodpovedá individuálne optimalizovanej expozícii levodope, karbidope a entakapónu) v plazme. Pri titrácii dávky sa teda berú do úvahy všetky účinky poškodenia obličiek na expozíciu levodope, karbidope a entakapónu. Porucha funkcie obličiek neovplyvňuje farmakokinetiku entakapónu. Neexistujú žiadne špecifické farmakokinetické štúdie s levodopou a karbidopou u pacientov s poruchou funkcie obličiek. Preto sa odporúča titrovať dávku opatrne u pacientov s ťažkou poruchou funkcie obličiek, vrátane tých, ktorí dostávajú dialýzu (pozri časť 5.2).
Prerušenie liečby
Liečbu Lecigonom je možné kedykoľvek prerušiť odstránením hadičky a umožnením hojenia rany.
Pacientov je potrebné starostlivo sledovať v prípade, že je potrebné náhle znížiť dávku alebo ak je nevyhnutné prerušiť liečbu Lecigonom, najmä ak pacient užíva antipsychotiká; pozri časť 4.4.
Ak sa liečba preruší, pacient má dostať alternatívnu liečbu.
Spôsob podávania
Lecigon je gél na kontinuálne intestinálne podávanie (podávanie do dvanástnika alebo hornej časti
jejuna). Na podávanie Lecigonu sa môže použiť iba pumpa Crono LECIG (CE 0476). K pumpe sa
dodáva príručka s pokynmi na používanie prenosnej pumpy.
Pred zavedením permanentnej jejunálnej sondy (PEG-J) perkutánnou endoskopickou gastrostómiou sa má zvážiť použitie dočasnej nazoduodenálnej/nazojejunálnej sondy, aby sa zistilo, či pacient pozitívne reaguje na túto metódu liečby. V prípadoch, kedy lekár zváži, že to nie je potrebné, nazojejunálnu (NJ) testovaciu fázu možno vynechať a liečbu začať priamo zavedením PEG-J.
Pri dlhodobom podávaní sa má gél aplikovať pomocou prenosnej pumpy priamo do duodena alebo hornej časti jejuna permanentnou sondou, ktorá je zavedená perkutánnou endoskopickou gastrostómiou s vonkajšou transabdominálnou a vnútornou intestinálnou trubicou. Pokiaľ perkutánna endoskopická gastrostómia z akéhokoľvek dôvodu nie je vhodná, alternatívou môže byť rádiologická gastrojejunostómia. Zavedenie transabdominálneho prístupu a titrácia dávky sa má realizovať
v spolupráci s neurologickou klinikou.
Výmena náplne
Aby ste mohli použiť novú náplň, táto má byť pripojená k prenosnej pumpe a systém pripojený k
trubici na podanie podľa uvedených pokynov.
Náplň je určená iba na jednorazové použitie a nemá sa používať dlhšie ako 24 hodín.
Dávkovaciu pumpu s nainštalovanou náplňou je možné nosiť na tele až 16 hodín. Počas liečby cez noc
sa pumpa nemá nosiť na tele, ale môže sa napríklad nachádzať na nočnom stolíku.
Po prvom otvorení sa náplň môže použiť do nasledujúceho dňa, t. j. do 24 hodín po prvom otvorení. Náplň sa vyberie z pumpy po 24 hodinách používania alebo po spotrebovaní, podľa toho, čo nastane
skôr.
Na konci času použiteľnosti môže byť gél mierne žltý / červenkastý. Toto nemá vplyv na koncentráciu lieku alebo na účinok liečby.
4.3 Kontraindikácie
· Precitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
· Glaukóm so zatvoreným uhlom.
· Ťažké srdcové zlyhávanie.
· Ťažká srdcová arytmia.
· Akútna cievna mozgová príhoda.
· Ťažká porucha funkcie pečene.
· Použitie neselektívnych inhibítorov MAO a selektívnych inhibítorov MAO typu A je pri použití
Lecigonu kontraindikované. Podávanie týchto inhibítorov sa musí prerušiť minimálne dva týždne pred začatím liečby Lecigonom. Lecigon sa môže podávať súbežne so
selektívnymi inhibítormi MAO typu B v dávkach odporúčaných výrobcom (napr. selegilín
hydrochlorid) (pozri časť 4.5);
· Stavy, pri ktorých sú adrenergiká kontraindikované, napr. feochromocytóm, hypertyreóza
a Cushingov syndróm.
· Predošlá anamnéza neuroleptického malígneho syndrómu (NMS) a/alebo netraumatickej rabdomyolýzy.
· Podozrenie na nediagnostikované kožné lézie alebo melanóm v anamnéze (levodopa môže aktivovať malígny melanóm).
4.4 Osobitné upozornenia a opatrenia pri používaní
Lecigon sa neodporúča na liečbu extrapyramidálnych reakcií vyvolaných liekmi. Lecigon sa musí podávať opatrne pacientom s ischemickou chorobou srdca, ťažkým
kardiovaskulárnym alebo pľúcnym ochorením, bronchiálnou astmou, ochorením obličiek alebo žliaz s
vnútorným vylučovaním, s peptickým vredom alebo kŕčmi v anamnéze.
U pacientov s anamnézou myokardiálneho infarktu, ktorí majú pretrvávajúce atriálne uzlové alebo ventrikulárne arytmie; musia byť kardiálne funkcie obzvlášť pozorne sledované v období začiatočných úprav dávky.
Všetci pacienti liečení liekom Lecigonom musia byť pozorne sledovaní pre prípad vývoja mentálnych zmien, depresie so samovražednými tendenciami a iných závažných mentálnych zmien. Pacienti s psychózami pozorovanými v minulosti alebo súčasnosti musia byť liečení s opatrnosťou.
Súčasné podávanie antipsychotík s blokujúcimi účinkami na dopamínové receptory, obzvlášť antagonistov receptora D2, sa musí vykonávať s obozretnosťou a pacient musí byť pozorne sledovaný pre prípad straty antiparkinsonických účinkov alebo zhoršenia parkinsonických príznakov, pozri časť
4.5.
Pacientov s chronickým glaukómom s otvoreným uhlom je možné liečiť Lecigonom s opatrnosťou za predpokladu, že je vnútroočný tlak dobre kontrolovaný a pacient je pozorne sledovaný pre prípad zmien vnútroočného tlaku.
Lecigon môže vyvolať ortostatickú hypotenziu. Preto sa Lecigon musí podávať opatrne pacientom užívajúcim iné lieky, ktoré môžu spôsobiť ortostatickú hypotenziu, pozri časť 4.5.
Liečivá lieku Lecigon sa spájali s výskytom ospalosti a/alebo príhod náhleho upadnutia do spánku u pacientov s Parkinsonovou chorobou, a preto sa pri vedení vozidiel a obsluhe strojov musí postupovať obozretne (pozri čast 4.7 a 4.8).
Komplex symptómov pripomínajúci neuroleptický malígny syndróm (NMS), vrátane svalovej rigidity, zvýšenej telesnej teploty, mentálnych zmien (napr. agitovanosť, zmätenosť, kóma) a zvýšenej hladiny kreatín-fosfokinázy bol opísaný v niekoľkých prípadoch náhleho vysadenia antiparkinsonickej liečby. U pacientov s Parkinsonovou chorobou sa zriedkavo pozorovala rabdomyolýza ako vedľajší dôsledok neuroleptického malígneho syndrómu alebo ťažká dyskinéza. Od uvedenia entakapónu na trh boli hlásené izolované prípady NMS, zvlášť po náhlom znížení alebo vysadení entkaponu alebo iných súčasne podávaných dopaminergných liekov.Preto musia byť pacienti pri náhlom znížení dávky alebo ukončení podávania kombinovanej dávky levodopy/karbidopy dôsledne kontrolovaní, najmä ak súbežne užívajú antipsychotiká/neuroleptiká.
Pacientov je potrebné pravidelne sledovať kvôli vzniku poruchy kontroly impulzov. Pacientov a ich ošetrovateľov je potrebné upozorniť, že pri liečbe dopamínovými agonistami a/alebo pri inej dopamínergickej liečbe s obsahom levodopy vrátane Lecigonu sa môžu v správaní vyskytnúť prejavy poruchy kontroly impulzov, vrátane patologického hráčstva, zvýšeného libida a hypersexuality, nutkavého utrácania alebo nakupovania, záchvatovitého prejedania a impulzívneho jedenia. V prípade výskytu týchto príznakov sa odporúča prehodnotenie liečby.
Epidemiologické štúdie preukázali, že u pacientov s Parkinsonovou chorobou je riziko vývoja melanómu vyššie ako v bežnej populácii. Je nejasné, či pozorované zvýšené riziko vzniká v dôsledku Parkinsonovej choroby alebo z iných príčin, ako sú napr. lieky používané v liečbe Parkinsonovej choroby. Preto sa pri používaní Lecigonu odporúča pacientom a ich ošetrujúcim lekárom robiť
pravidelné kontroly na odhalenie melanómu. Je ideálne, aby pacienti absolvovali pravidelné vyšetrenie
kože lekármi so zodpovedajúcou špecializáciou (napr. dermatológmi).
Ak sa vyžaduje celková anestézia, v liečbe Lecigonom je možné pokračovať kým je pacientovi dovolené perorálne prijímať tekutiny a lieky. Pokiaľ musí byť liečba dočasne prerušená, Lecigon možno opäť podať v rovnakej dávke ako predtým, len čo môže pacient prijímať tekutiny perorálne.
Aby sa znížilo riziko dyskinéz vyvolaných levodopou, môže byť potrebné znížiť dávku Lecigonu. Pri dlhodobej liečbe Lecigonom sa odporúča pravidelné hodnotenie hepatálnej, hematopoetickej,
kardiovaskulárnej a renálnej funkcie.
Lecigon obsahuje hydrazín, degradačný produkt rozkladu karbidopy, ktorý môže byť genotoxický
a pravdepodobne karcinogénny. Priemerná odporúčaná denná dávka Lecigonu je 46 ml (zodpovedá
1,6 mg hydrazínu/deň) a odporúčaná maximálna denná dávka Lecigonu je 100 ml ml (zodpovedá 3,5
mg hydrazínu/deň). Klinicky význam expozície hydrazínu nie je známy.
Predchádzajúca operácia hornej časti gastrointestinálneho traktu môže spôsobiť problémy
s gastrostómiou alebo jejunostómiou.
V klinických štúdiách s levodopou/karbidopou a po uvedení lieku na trh boli hlásené komplikácie liečby, ako je absces, bezoár, ileus, erózie/vredy v mieste implantácie, intestinálne krvácanie, ischémia čreva, obštrukcia čreva, perforácia čreva, intususcepcia, pankreatitída, peritonitída, pneumónia
(vrátane aspiračnej pneumónie), pneumoperitoneum, pooperačná infekcia rany a sepsa. Bezoáre sú zhutnené zvyšky nestráviteľného materiálu (ako sú napríklad rastlinné alebo ovocné nestráviteľné
vlákniny) v gastrointestinálnom trakte. Väčšina bezoárov sa tvorí v žalúdku, ale môžu sa vyskytnúť aj
inde v črevnom trakte. Bezoár okolo špičky jejunálnej sondy môže byť hlavnou príčinou vzniku
črevnej obštrukcie alebo vzniku intususcepcie. Príznakom vyššie spomenutých komplikácií môže byť bolesť brucha. Niektoré prípady môžu mať závažné dôsledky, ako je napr. chirurgický zákrok a/alebo úmrtie. Pacientov je potrebné upozorniť, aby informovali svojho lekára, ak spozorujú niektorý
z príznakov súvisiaci so stavmi uvedenými vyššie.
Znížená schopnosť obsluhovať aplikačný systém (pumpa, koncovky sondy) môže viesť ku komplikáciám. U takýchto pacientov je nutná asistencia opatrovateľa (zdravotná sestra, ošetrovateľ alebo blízky príbuzný).
Náhle alebo postupné zhoršenie bradykinézy môže poukazovať na nepriechodnosť v systéme sondy z akéhokoľvek dôvodu a musí byť vyšetrené.
Úbytok telesnej hmotnosti sa spájal s liečivami obsiahnutými v Lecigone, a preto si ošetrovatelia majú byť vedomí tohto úbytku telesnej hmotnosti. Monitorovanie hmotnosti sa odporúča, aby sa zabránilo veľkému úbytku hmotnosti. Týka sa to najmä pacientov s hnačkou. Dlhodobá alebo pretrvávajúca hnačka, ktorá sa objaví počas používania entakapónu, môže byť znakom kolitídy. V prípade dlhotrvajúcej alebo pretrvávajúcej hnačky sa má liečba týmto liekom prerušiť a má sa zvážiť ďalšie vhodné lekárske ošetrenie a vyšetrenie.
Ak je to potrebné, nahradenie Lecigonu buď levodopou a DDC inhibítorom bez entakapónu alebo inej dopamínergnej liečby sa má robiť pomaly. Môže byť potrebné zvýšiť dávku levodopy.
U pacientov, u ktorých sa v priebehu relatívne krátkeho obdobia vyskytne progresívna anorexia, asténia a úbytok hmotnosti, je potrebné zvážiť všeobecné lekárske vyšetrenie vrátane zhodnotenia funkcie pečene.
Levodopa / karbidopa môže spôsobiť falošne pozitívne výsledky, keď sa na meranie obsahu ketónov v moči použije lakmusový papierik, a táto reakcia sa nezmení varením vzorky moču. Použitie metód glukózooxidázy môže viesť k falošne negatívnym výsledkom pre glykozúriu.
Syndróm dopamínovej dysregulácie (DDS) je návyková porucha pozorovaná u niektorých pacientov liečených karbidopou/levodopou, ktorá vedie k nadmernému užívaniu lieku. Pred začatím liečby majú byť pacienti a opatrovatelia upozornení na možné riziko vzniku DDS (pozri tiež časť 4.8).
V prípade podozrenia na zneužitie lieku je v pumpe použitej s Lecigonom (Crono LECIG) funkcia
blokovania.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie s Lecigonom. Nasledujúce interakcie sú známe z kombinácii levodopa/karbidopa a entakapón/levodopa/karbidopa.
Opatrnosť je potrebná pri súbežnom podávaní Lecigonu s nasledovnými liekmi:
Antihypertenzíva
U pacientov užívajúcich antihypertenzíva sa po pridaní liečby kombináciou levodopa a inhibítor dekarboxylázy vyskytla symptomatická posturálna hypotenzia. Je možné, že bude potrebné upraviť dávku antihypertenzíva.
Antidepresíva
Podávanie neselektívnych inhibítorov MAO a selektívnych inhibítorov MAO typu A je kontraindikované na použitie s Lecigonom. Liečba týmito inhibítormi musí byť prerušená najmenej dva týždne pred začatím liečby Lecigonom (pozri časť 4.3).
Zriedkavo boli hlásené nežiaduce reakcie vrátane hypertenzie a dyskinézy, ktoré sú výsledkom súčasného podávania tricyklických antidepresív a karbidopy / levodopy.
Značný počet pacientov s Parkinsonovou chorobou bol liečený kombináciou levodopy, karbidopy, entakaponu a tricyklických antidepresív a farmakodynamické interakcie sa nepozorovali. Pri súčasnom užívaní antidepresív s Lecigonom je však potrebná opatrnosť.
Anticholinergiká
Anticholinergiká môžu pôsobiť synergicky s levodopou na zníženie trasu. Kombinované použitie však môže zhoršiť abnormálne mimovoľné pohyby. Anticholinergiká môžu znižovať účinky levodopy spomalením jej absorpcie. Môže byť potrebné upraviť dávku Lecigonu.
Ostatnéantiparkinsoniká
Lecigon sa môže užívať súbežne s odporúčanou dávkou inhibítora MAO so selektivitou pre MAO
typu B, napr. selegilínium-chlorid. Súbežné užívanie selegilínu a levodopy / karbidopy bolo spojené so závažnou ortostatickou hypotenziou. Pri pridávaní selektívneho inhibítora MAO-B môže byť preto
potrebné zníženie dávky Lecigonu.
Amantadín a agonisty dopamínu, ako je piribedil, majú synergický účinok s levodopou a môžu zvyšovať nežiaduce účinky súvisiace s levodopou. Môže byť potrebné upraviť dávku Lecigonu.
Inélieky
Antagonisty dopamínových receptorov (niektoré antipsychotiká, napr. fenotiazíny, butyrofenóny,
risperidón a antiemetiká, napr. metoklopramid), benzodiazepíny, izoniazid, fenytoín a papaverín môžu znížiť terapeutický účinok levodopy. Pacienti užívajúci tieto lieky spolu s Lecigonom majú byť dôkladne sledovaní kvôli riziku straty terapeutickej odpovede.
Sympatomimetiká môžu zvýšiť riziko kardiovaskulárnych nežiaducich účinkov súvisiacich
s levodopou.
Levodopa tvorí v gastrointestinálnom trakte cheláty so železom, čo vedie k zníženiu absorpcie levodopy. Lecigon a perorálne prípravky obsahujúce železo sa preto majú užívať s odstupom najmenej
2–3 hodín. Napríklad prípravok so železom sa môže užiť pred spaním, ak pacient pumpu počas noci nepoužíva.
Vzhľadom na afinitu entakapónu k P450 2C9 in vitro (pozri časť 5.2) môže Lecigon ovplyvňovať lieky, ktorých metabolizmus závisí od tohto izoenzýmu, ako je S-warfarín. V interakčnej štúdii so zdravými dobrovoľníkmi však entakapón nezmenil plazmatické hladiny S-warfarínu, zatiaľ čo plocha pod krivkou (AUC) pre R-warfarín sa zvýšila v priemere o 18% (90% interval spoľahlivosti: 11-26%). Hodnoty INR sa zvýšili v priemere o 13% (90% interval spoľahlivosti: 6–19%). Preto sa pri začatí liečby Lecigonom u pacientov užívajúcich warfarín odporúča kontrola INR.
Účinok podávania antacíd a Lecigonu na biologickú dostupnosť levodopy sa neskúmal.
Interakcie s potravinami
Pretože levodopa je kompetitívna s určitými aminokyselinami, absorpcia levodopy môže byť narušená u pacientov, ktorí držia diétu bohatú na bielkoviny.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne, resp. sú k dispozícii iba obmedzené údaje o použití levodopy/karbidopy/entakapónu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Potenciálne riziko pre ľudí nie je známe. Lecigon sa neodporúča počas gravidity ani u žien vo fertilnom veku, ktoré nepoužívajú antikoncepciu, pokiaľ prínos pre matku neprevýši potenciálne riziko pre plod.
Dojčenie
Levodopa a pravdepodobne aj metabolity levodopy sa vylučujú do ľudského mlieka. Existujú dôkazy, že laktácia je počas liečby levodopou potlačená.
Nie je známe, či sa karbidopa a entakapón alebo ich metabolity vylučujú do ľudského mlieka. Štúdie na zvieratách potvrdili vylučovanie karbidopy a entakapónu do materského mlieka.
Nie sú k dispozícii dostatočné informácie o účinkoch levodopy/karbidopy/entakapónu alebo ich metabolitov u novorodencov/dojčiat. V priebehu liečby Lecigonom je potrebné prerušiť dojčenie.
Fertilita
V predklinických štúdiách s karbidopou, levodopou alebo entakapónom ako jednotlivými liečivami neboli zaznamenané žiadne nežiaduce účinky na fertilitu. S kombináciou levodopy, karbidopy a entakapónu sa štúdie zamerané na fertilitu u zvierat nevykonali.
4.7 Ovplyvnenie schopností viesť vozidlá a obsluhovať stroje
Lecigon môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Levodopa, karbidopa a entakapón môžu spôsobiť ortostatickú hypotenziu a závrat. Preto je nutná zvýšená opatrnosť pri vedení vozidiel alebo obsluhe strojov.
Pacienti liečení Lecigonom, u ktorých sa objavila ospalosť alebo náhle epizódy spánku, musia byť upozornení, aby sa zdržali vedenia vozidiel alebo vykonávania aktivít, pri ktorých by ich znížená bdelosť mohla ich alebo iné osoby vystaviť nebezpečenstvu vážnych úrazov alebo smrti (napr. obsluhovanie strojov), a to dovtedy, kým takéto opakované epizódy a ospalosť neustúpia, pozri tiež časti 4.4 a 4.8.
4.8 Nežiaduce účinky
Zhrnutiebezpečnostnéhoprofilu
Očakávaný bezpečnostný profil Lecigonu je založený na dostupných údajoch z klinických štúdií a skúsenostiach po uvedení lieku na trh s intestinálnym gélom levodopa / karbidopa a perorálnou formou levodopa / karbidopa / entakapón.
Medzi nežiaduce účinky súvisiace s liekom, ktoré sa často vyskytujú pri použití intestinálneho gélu levodopa / karbidopa a ktoré by sa preto mohli vyskytnúť pri liečbe Lecigonom, patria nevoľnosť a dyskinéza. Medzi nežiaduce účinky súvisiace s pomôckou a procedúrou, ktoré sa často vyskytujú pri použití intestinálneho gélu levodopa / karbidopa, a ktoré by sa preto mohli vyskytnúť pri liečbe Lecigonom, patria bolesti brucha, komplikácie zavedenia sondy, nadmerné množstvo granulačného tkaniva, erytém v mieste rezu, pooperačná infekcia rany, post-procedúrny výtok, súvisiace bolesti a reakcie v mieste rezu. Väčšina z týchto nežiaducich reakcií bola hlásená na začiatku štúdií, po ukončení perkutánnej endoskopickej gastrostómie, a vyskytla sa počas prvých 28 dní.
Najčastejšie hlásenými nežiaducimi reakciami po perorálnom podaní levodopy / karbidopy / entakapónu sú dyskinézy (postihujúce približne 19% pacientov); gastrointestinálne príznaky vrátane nauzey a hnačky (postihujúce približne 15%, 12% pacientov v uvedenom poradí); poruchy svalov a spojivového tkaniva (postihujúce približne 12% pacientov); a neškodné gaštanové sfarbenie moču (chromatúria) (postihujúce približne 10% pacientov). Závažné nežiaduce reakcie na gastrointestinálne krvácanie (menej časté) a angioedém (zriedkavé) boli zistené z klinických štúdií s perorálnou levodopou / karbidopou / entakapónom alebo entakapónom v kombinácii s levodopou / inhibítorom DDC.
Pri perorálnom podávaní levodopy / karbidopy / entakapónu sa môže vyskytnúť závažná hepatitída, ktorá obsahuje hlavne cholestatické prvky, rabdomyolýzu a neuroleptický malígny syndróm, aj keď z
klinických štúdií nebol zistený žiadny prípad.
Uskutočnila sa farmakokinetická štúdia s Lecigonom, ktorá zahŕňala 11 pacientov s pokročilou Parkinsonovou chorobou. Nežiaduce reakcie považované za súvisiace s Lecigonom boli bolesť hlavy, nevoľnosť a závrat. V tejto dvojdňovej štúdii neboli hlásené žiadne závažné nežiaduce reakcie. Počas podávania Lecigonu sa žiadne nežiaduce reakcie nesúviseli s pumpou.
TabuľkanežiaducichreakciíNežiaduce reakcie súvisiace s liekom, pomôckou a nežiaducimi reakciami súvisiacimi s procedúrou pozorované v klinických štúdiách a počas postmarketingového používania intestinálneho gélu
levodopa / karbidopa a perorálnou formou levodopy / karbidopy / entakapónu sú zhrnuté v tabuľke 1
nižšie podľa triedy orgánových systémov a frekvencie. .
Pri perorálnom podaní levodopy / karbidopy / entakapónu boli nežiaduce reakcie uvedené v tabuľke 1 zhromaždené z dvojito zaslepených klinických štúdií a údajov zhromaždených počas postmarketingového používania entakapónu na kombinovanú liečbu s levodopou / inhibítorom DDC.
Tabuľka 1. Nežiaduce reakcie z klinických štúdií a postmarketingových skúseností s intestinálnym gélom levodopa / karbidopa a / alebo perorálnou levodopou / karbidopou / entakapónom.Trieda orgánových systémov
| Veľmi časté
(≥ 1/10)
| Časté
(≥ 1/100 až
< 1/10)
| Menej časté
(> 1/1 000 až
< 1/100)
| Zriedkavé
(> 1/10 000 až
< 1/1 000)
| Frekvencia neznáma (z dostupných
údajov)
|
Nežiaduce reakcie súvisiace s liekom
|
Poruchy krvi
a lymfatického systému
|
| anémia
| leukopénia
trombocytopénia
|
| agranulocytóza
|
Poruchy
imunitného
systému
|
|
|
|
| anafylaktická
reakcia
|
Poruchy
metabolizmu a výživy
| úbytok
hmotnosti
| zvýšenie hladín
aminokyselín
(zvýšenie
|
|
|
|
|
|
kyseliny
metylmalónovej), zvýšenie hladiny homocysteínu
v krvi, zníženie chuti do jedla, zvýšenie telesnej
hmotnosti,
deficit vitamínu B6, deficit vitamínu B12
|
|
|
|
Psychické poruchy
|
nepokoj,
úzkosť, depresia, nespavosť
|
nočná mora,
agitovanosť,
stav zmätenosti, halucinácie, porucha kontroly impulzov, psychotické poruchy, epizódy spánku, poruchy spánku
|
dokonané
suicidium,
dezorientovanosť
, euforická nálada, strach, zvýšenie libida (pozri časť 4.4),
suicidálny pokus,
suicidálne správanie
|
neobvyklé
myšlienky
|
syndróm
dopamínovej dysreguláciea
|
Poruchy nervového
systému
|
dyskinéza,
Parkinsonova choroba, exacerbácia parkinsonizmu (napr. bradykinéza)
|
závrat,
dystónia, bolesť hlavy, hypoastézia, On a Off fenomén, parestézia,
polyneuropatia, somnolencia, synkopa,
tras, hyperkinéza
|
ataxia,
kŕč
|
|
neuroleptický
malígny syndróm, porucha pamäti, demencia
|
Poruchy oka
|
|
zahmlené videnie
|
glaukóm
s uzavretým uhlom, blefarospasmus, diplopia, optická ischemická neuropatia,
|
|
|
Poruchy srdca
a srdcovej činnosti
|
|
nepravidelný
srdcový rytmus, ischemická choroba srdca iná ako infarkt myokardu (napr.
angína pektoris)
|
palpitácie, infarkt
myokardu
|
|
|
Poruchy ciev
|
ortostatická
hypotenzia
|
hypertenzia,
hypotenzia
|
flebitída
|
|
|
Poruchy dýchacej
sústavy, hrudníka
a mediastína
|
|
dyspnoe,
bolesť
v orofaryngu, aspiračná pneumónia
|
dysfónia
|
respiračné
abnormality
|
|
Poruchy
gastrointestinálneh
o traktu
|
nevoľnosť,
zápcha, hnačka
|
distenzia brucha,
bolesť brucha, nepríjemné pocity v bruchu,
suchosť v ústach, dysgeúzia, dyspepsia, dysfágia,
|
kolitída,
gastrointestinálna hemorágia, zvýšené vylučovanie slín
|
bruxizmus,
glosodýnia, čkanie, zmeny sfarbenia slín
|
|
|
|
flatulencia,
vracanie
|
|
|
|
Poruchy pečene a
žlčových ciest
|
|
|
abnormálne
hodnoty pečeňových funkčných testov
|
|
hepatitída s
prevažne cholestatickými charakterom
|
Poruchy kože
a podkožného
tkaniva
|
|
kontaktná
dermatitída, hyperhidróza, pruritus, vyrážka
|
alopécia,
erytém,
žihľavka, zmerna sfarbenia kože, vlasov, nechtov a potenie
|
malígny
melanóm (pozri časť 4.3), angioedém
|
|
Poruchy kostrovej
a svalovej sústavy a spojivového tkaniva
|
bolesť svalov,
muskuloskeletál
neho
a spojivového
tkaniva
|
artralgia, svalové
spazmy, bolesti v oblasti šije
|
|
|
Rabdomyolýza
|
Poruchy obličiek
a močových ciest
|
chromatúria
|
inkontinencia
moču,
retencia moču, infekcie močových ciest
|
|
|
|
Poruchy
reprodukčného systému a prsníkov
|
|
|
|
priapizmus
|
|
Celkové poruchy
a reakcie v mieste podania
|
|
asténia, bolesť na
hrudníku, vyčerpanosť, poruchy chôdze, bolesť, periférny edém
|
malátnosť
|
|
|
Úrazy, otravy
a komplikácie liečebného postupu
|
pád
|
|
|
|
|
N
ežiaduce reakcie súvisiace s pomôckou na podanie gélu a s jeho zavedením do organizmu
|
Infekcie a nákazy
|
pooperačná
infekcia rany
|
celulitída
v mieste incízie, infekcia po výkone
|
pooperačný
absces
|
|
|
Poruchy
gastrointesti-
nálneho traktu
|
bolesť brucha
|
nepríjemné
pocity v bruchu,
bolesť
v epigastriu, peritonitída, pneumoperito- neum
|
bezoár,
ischemická kolitída, gastrointestinálna ischémia, gastrointestinálna obštrukcia,
pakreatitída,
krvácanie
z tenkého čreva, vred tenkého čreva, perforácia hrubého čreva, intususcepcia
|
|
perforácia'
žalúdka, gastrointestinálna perforácia, ischémia tenkého čreva,
perforácia tenkého čreva
|
Poruchy kože a
podkožného
tkaniva
|
nadmerná tvorba
granulačného
tkaniva
|
|
|
|
|
Celkové poruchy
a reakcie
v mieste podania
|
komplikácie
spojené so zavedením
|
dislokácia
pomôcky na podanie lieku,
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
systému na podávanie liekub
|
oklúzia pomôcky
na podávanie
lieku
|
|
|
|
Úrazy, otravy
a komplikácie liečebného postupu
|
erytém v mieste
incízie, pooperačný výtok,
bolesť spojená s výkonom, reakcia v mieste výkonu
|
komplikácia
gastrointesti- nostómie, bolesť v mieste incízie,
pooperačný ileus, komplikácia po výkone, nepríjemné
pocity po
výkone, krvácanie po výkone
|
|
|
|
a Syndróm dopamínovej dysregulácie (DDS) je návyková porucha pozorovaná u niektorých pacientov liečených
levodopou/karbidopou. U pacientov s touto poruchou dochádza ku kompulzívnemu zneužívaniu dopamínergných liekov v dávkach vyšších, ako sú dávky primerané na kontrolu motorických príznakov, čo môže mať v niektorých prípadoch za následok závažné dyskinézy (pozri tiež časť 4.4).
b Komplikácia spojená so zavedením pomôcky na podávanie lieku bola hlásená pomerne často tak v prípade
nazojejunálnej sondy, ako aj u PEG-J. Tento nežiaduci účinok bol hlásený súčasne s 1 alebo viacerými
z nasledujúcich nežiaducich účinkov, pozorovaných u nazojejunálnej sondy: bolesť orofarynxu, distenzia brucha, bolesť brucha, nepríjemné pocity v bruchu, bolesť, podráždenie hrdla, gastrointestinálne poranenie, krvácanie z pažeráku, úzkosť, dysfágia a vracanie. U PEG-J sondy bol tento nežiaduci účinok hlásený spolu s 1 alebo viacerými z nasledujúcích nežiaducich účinkov: bolesť brucha, nepríjemné pocity v bruchu, distenzia brucha, flatulencia alebo pneumoperitoneum. Ďalšie nezávažné nežiaduce reakcie, ktoré boli hlásené súčasne
s komplikáciami pri zavedení systému na podávanie lieku, zahŕňali nepríjemné pocity v bruchu, bolesť v epigastriu, vred duodena, krvácanie z duodenálneho vredu, erozívnu duodenitídu, erozívnu gastritídu, gastrointestinálne krvácanie, peritonitídu, pneumoperitoneum, vred v tenkom čreve.
Dislokácia jejunálnej sondy späť do žalúdka alebo blokáda sondy vedie k opätovnému výskytu výkyvov motoriky.
Nasledovné ďalšie nežiaduce reakcie boli pozorované u perorálne podávanej levodopy/karbidopy a boli klasifikované ako zriedkavé (≥ 1/10 000 až< 1/1 000): hemolytická anémia, kŕč žuvacieho svalstva, Hornerov syndróm, mydriáza, okulogyrická kríza a Henochova-Schönleinova purpura. Nasledovné nežiaduce reakcie boli hlásené veľmi zriedkavo (< 1/10 000): agranulocytóza.
Laboratórne parametre:Pri používaní levodopy/karbidopy boli opísané nasledovné laboratórne abnormality: zvýšenie dusíka v moči, zvýšenie alkalickej fosfatázy, AST, ALT, LDH, bilirubínu, krvného cukru, kreatinínu, kyseliny močovej a pozitívny Coombsov test, zníženie hodnôt hemoglobínu a hematokritu. Bola zaznamená prítomnosť leukocytov, baktérií a krvi v moči.
OpisvybranýchnežiaducichreakciíPridanie entakapónu do existujúcej liečby levodopou / inhibítorom DDC môže spôsobiť počiatočné zvýšenie dopamínergnej aktivity (napr. dyskinéza, nevoľnosť a vracanie). Zníženie dávky levodopy
znižuje závažnosť a frekvenciu týchto dopamínergných reakcií.
Poruchy kontroly impulzovU pacientov liečených agonistami dopamínu a / alebo inými dopamínergnými terapiami obsahujúcimi levodopu vrátane Lecigonu sa môže vyskytnúť kompulzívne hráčstvo, zvýšené libido, hypersexualita,
kompulzívne míňanie a nakupovanie, hltavé prejedanie sa a kompulzívne prejedanie sa (pozri časť
4.4).
Ospalosť a náhle záchvaty spánkuEntakapón v kombinácii s levodopou bol spájaný s ospalosťou a náhlymi záchvatmi spánku u pacientov s Parkinsonovou chorobou. Pri vedení vozidiel a obsluhe strojov je preto potrebná opatrnosť (pozri časti 4.4 a 4.7).
H
l
ásenie
podozrení
na
nežiaduce
r
eakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieNajvýznamnejšími klinickými symptómami predávkovania levodopou/karbidopou sú dystónia
a dyskinéza. Blefarospazmus môže byť prvotným znakom predávkovania. Pyridoxín však nemá žiaden
vplyv na zvrátenie účinku Lecigonu. Má sa monitorovať EKG a pacient má byť starostlivo pozorovaný pre možnosť vzniku arytmií, a ak je potrebné, má sa podať adekvátna antiarytmická liečba. Je potrebné zobrať do úvahy možnosť, že pacient okrem Lecigonu užíva aj iné lieky. Účinnosť dialýzy v liečbe predávkovania nie je známa. Vyskytli sa jednotlivé prípady predávkovania, v ktorých boli hlásené najvyššie denné dávky levodopy najmenej 10 000 mg a entakapónu najmenej 40 000 mg. Akútne symptómy a prejavy v týchto prípadoch predávkovania zahŕňali vzrušenie, stav zmätenosti, kómu, bradykardiu, ventrikulárnu tachykardiu, Cheynovo-Stokesovo dýchanie, zmenu sfarbenia pokožky, jazyka a očnej spojovky a zmenu sfarbenia moču.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Antiparkinsoniká, dopa a jej deriváty, ATC kód: N04BA03
Lecigon je kombinácia levodopy, monohydrátu karbidopy a entakapónu (pomer 4: 1: 4) v géli na kontinuálnu intestinálnu infúziu pri pokročilej Parkinsonovej chorobe so závažnými motorickými výkyvmi a hyperkinézou / dyskinézou.
Podľa súčasných poznatkov príznaky Parkinsonovej choroby súvisia s nedostatkom dopamínu v
corpus striatum. Dopamín neprechádza hematoencefalickou bariérou.
Levodopa, metabolický prekurzor dopamínu, prechádza hematoencefalickou bariérou a zmierňuje príznaky choroby. Pretože levodopa sa extenzívne metabolizuje periférne v tkanivách, iba malá časť podanej dávky sa dostane do centrálneho nervového systému, keď sa levodopa podáva bez inhibítorov metabolických enzýmov.
Karbidopa je periférny inhibítor DDC, ktorý znižuje periférny metabolizmus levodopy na dopamín, čím sprístupňuje viac levodopy pre mozog. Ak sa dekarboxylácia levodopy zníži súbežným podávaním DDC inhibítora, môže sa použiť nižšia dávka levodopy a môže sa znížiť výskyt nežiaducich účinkov, ako je nauzea.
Keď je dekarboxyláza inhibovaná DDC inhibítorom, stáva sa COMT dominantnou periférnou metabolickou cestou. Entakapon je reverzibilný, špecifický a hlavne periférne pôsobiaci inhibítor COMT určený na súčasné podávanie s levodopou. Entakapón znižuje klírens levodopy z krvi, čo vedie k zvýšeniu AUC vo farmakokinetickom profile levodopy. V dôsledku toho sa klinická odpoveď levodopy predlžuje.
Intestinálna infúzia jednotlivo testovaných dávok Lecigonu udržuje plazmatickú koncentráciu levodopy na rovnomernej úrovni v rámci individuálneho terapeutického okna.
5.2 Farmakokinetické vlastnostiAbsorpciaLecigon sa podáva zavedenou sondou priamo do dvanástnika alebo horného jejuna. V absorpcii
levodopy, karbidopy a entakapónu existujú veľké inter- a intraindividuálne rozdiely. Levodopa aj
levodopa. Ak sa podáva oddelene bez ďalších dvoch liečiv, perorálna biologická dostupnosť je 15-
33% pre levodopu, 40-70% pre karbidopu a 29-46% pre entakapón. Jedlá bohaté na veľké neutrálne aminokyseliny môžu spomaliť a znížiť absorpciu levodopy. Jedlo významne neovplyvňuje absorpciu
entakapónu.
V otvorenej randomizovanej klinickej štúdii so skríženým dizajnom, ktorá obsahovala Duodopu ako komparátor, viedlo intestinálne podávanie Lecigonu rýchlo k terapeutickým plazmatickým hladinám levodopy. Porovnateľné hladiny levodopy sa udržiavali počas infúzie tak pre Lecigon, ako aj pre Duodopu, ale počas dňa sa pozorovala postupne sa zvyšujúca plazmatická koncentrácia levodopy pre Lecigon v porovnaní s duodopou. Lecigon mal štatisticky významne vyššiu biologickú dostupnosť levodopy v porovnaní s duodopou vypočítanou počas infúzie, AUC014h / dávka (pomer: 1,38; 95% interval spoľahlivosti [CI]: 1,26–1,51). Po ukončení infúzie hladiny levodopy rýchlo poklesli. Variabilita plazmatických koncentrácií levodopy u jednotlivca bola malá (13,8%) v rozmedzí 3 až 14 hodín po začiatku infúzie Lecigonu.
Príklad očakávaného profilu plazmatickej koncentrácie / času s konštantnou udržiavacou dávkou je uvedený na obrázku 1. V prípade potreby je možné použiť viac udržovacích dávok denne / 24 hodín (popísané v časti 4.2 Dávkovanie).
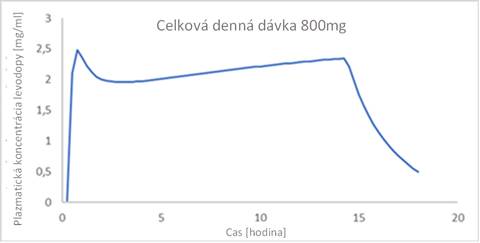 Obrázok 1:
Obrázok 1: Príklad profilu plazmatickej koncentrácie / času levodopy pre celkovú dennú dávku 800 mg levodopy s rannou dávkou (176 mg) a kontinuálnou udržiavacou dávkou (45 mg/h) počas dňa.
DistribúciaDistribučný objem tak v prípade levodopy (0,36-1,6 l/kg), ako aj entakapónu (0,27 l/kg) v
rovnovážnom stave je pomerne malý, zatiaľ čo údaje o karbidope nie sú k dispozícii.
Levodopa sa viaže v malej miere na bielkoviny plazmy (približne 10-30%) a karbidopa sa viaže na približne 36%, zatiaľ čo entakapón sa silno viaže (približne 98%) - hlavne na sérový albumín. V terapeutických koncentráciách entakapón neinterferuje s inými vysoko účinnými látkami viazanými na
bielkoviny (napr. warfarín, kyselina salicylová, fenylbutazón alebo diazepam), ani nie je významne ovplyvnený žiadnym z týchto liekov pri terapeutických alebo vyšších koncentráciách.
Biotransformáciaaeliminácia
Levodopa sa vo veľkej miere metabolizuje na rôzne metabolity: hlavnými metabolickými cestami sú dekarboxylácia pomocou dopadekarboxylázy (DDC) a O-metylácia pomocou COMT.
Karbidopa sa metabolizuje na dva hlavné metabolity, ktoré sa primárne vylučujú močom ako glukuronidy alebo nekonjugované zlúčeniny. Nezmenená karbidopa predstavuje 30% z celkového vylučovania močom.
Entakapón je takmer úplne metabolizovaný a metabolity sa vylučujú močom (10-20%) a žlčou / stolicou (80-90%). Primárnou metabolickou cestou je glukuronidácia entakapónu a jeho aktívneho metabolitu, cis-izoméru. Cis-izomér predstavuje približne 5% z celkového množstva v plazme.
Celkový klírens je v rozmedzí 0,55-1,38 l/kg / hodinu pre levodopu a približne 0,70 l/kg/hodinu pre entakapón. Polčas je 0,6-1,3 hodiny pre levodopu, 2-3 hodiny pre karbidopu a 0,4-0,7 hodiny pre entakapón, ak sa podáva osobitne. Priemerný odhadovaný polčas levodopy počas liečby Lecigonom bol 2,0 hodiny.
Údaje zo štúdií in vitro s prípravkami mikrozómov ľudskej pečene naznačujú, že entakapón inhibuje cytochróm P450 2C9 (IC50 ~ 4 uM). Entakapón vykazoval malú alebo žiadnu inhibíciu iných typov izoenzýmov P450 (CYP1A2, CYP2A6, CYP2D6, CYP2E1, CYP3A a CYP2C19).
Osobitné populácie
Starší ľudia
Ak sa levodopa podáva bez karbidopy a entakapónu, absorpcia levodopy je u starších osôb vyššia a eliminácia pomalšia ako u mladších osôb. Po podaní levodopy v kombinácii s karbidopou je však absorpcia levodopy u starších a mladších jedincov podobná, ale AUC je u starších ľudí stále 1,5-krát vyššia v dôsledku poklesu aktivity a klírensu DDC súvisiaceho s vekom. Nie sú žiadne významné rozdiely AUC pre karbidopu alebo entakapón medzi mladšími (45-64 rokov) a staršími (65-75 rokov) jedincami.
Pohlavie
Biologická dostupnosť levodopy je významne vyššia u žien ako u mužov, a to aj v prítomnosti entakapónu. Tento rozdiel je spôsobený hlavne rozdielom v telesnej hmotnosti. Nie je rozdiel medzi pohlavím, pokiaľ ide o biologickú dostupnosť karbidopy alebo entakapónu.
Porucha funkcie pečene
Metabolizmus entakapónu je spomalený u pacientov s miernou až stredne ťažkou poruchou funkcie pečene (trieda A a B podľa Childa-Pugha), čo vedie k zvýšeniu plazmatickej koncentrácie entakaponu v absorpčnej aj eliminačnej fáze (pozri časti 4.2, 4.3 a 4.4). Nie sú k dispozícii žiadne špecifické farmakokinetické štúdie s levodopou a karbidopou u pacientov s poruchou funkcie pečene. Lecigon sa však odporúča podávať opatrne pacientom s ľahkou až stredne ťažkou poruchou funkcie pečene. Lecigon sa nemá používať u pacientov s ťažkou poruchou funkcie pečene; pozri časť 4.3.
Porucha funkcie obličiek
Porucha funkcie obličiek neovplyvňuje farmakokinetiku entakaponu. Neexistujú žiadne špecifické farmakokinetické štúdie s levodopou a karbidopou u pacientov s poruchou funkcie obličiek. Preto sa
odporúča titrovať dávku opatrne u pacientov s ťažkou poruchou funkcie obličiek, vrátane tých, ktorí dostávajú dialýzu (pozri časť 4.2).
5.3 Predklinické údaje o bezpečnosti
Konvenčné štúdie levodopy, karbidopy a entakapónu skúmané samotné alebo v kombinácii s ohľadom na farmakologickú bezpečnosť, všeobecnú toxicitu, genotoxicitu a karcinogenitu neodhalili žiadne osobitné riziká pre ľudí.
V štúdiách všeobecnej toxicity pri opakovaných dávkach entakapónu sa predpokladalo, že anémia je pravdepodobne spôsobená schopnosťou entakapónu vytvárať cheláty so železom. Pokiaľ ide o reprodukčnú toxicitu entakapónu, bolo u králikov pozorované zníženie hmotnosti plodu a mierne oneskorený vývoj skeletu pri systémových hladinách expozície v terapeutickom rozmedzí.
Levodopa aj kombinácie karbidopy a levodopy spôsobili u králikov viscerálne a skeletálne malformácie.
Hydrazín je degradačný produkt karbidopy. V štúdiách na zvieratách vykazoval hydrazín významnú systémovú toxicitu, najmä pri vdýchnutí. Tieto štúdie uviedli, že hydrazín je hepatotoxický, má toxicitu pre CNS (aj keď to nie je opísané po perorálnom podávaní) a je genotoxický a karcinogénny (pozri tiež časť 4.4).
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
sodná soľ karmelózy
kyselina chlórovodíková (na úpravu pH)
hydroxid sodný (na úpravu pH)
voda
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
16 týždňov
Otvorená náplň: Použite okamžite. Liek je možné používať až 24 hodín po vybratí z chladničky. Dávkovaciu pumpu s nainštalovanou náplňou je možné nosiť pri tele až 16 hodín. Počas liečby v noci sa pumpa nemá nosiť pri tele, ale môže sa napríklad nachádzať na nočnom stolíku. Akúkoľvek nepoužitú dávku zlikvidujte.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C - 8 °C). Neuchovávajte v mrazničke. Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
47 ml gélu v polypropylénovej náplni. Široký koniec je utesnený gumovým uzáverom vyrobeným z polyizoprénovej gumy a otvor je utesnený uzáverom vyrobeným z polypropylénu alebo akrylonitrilbutadiénstyrénu.
Škatuľa so 7 náplňami.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Náplne sú určené len na jednorazové použitie. Nepoužívajte opakovane už otvorenú náplň.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIILobSor Pharmaceuticals AB
Kålsängsgränd 10 D SE-753 19 Uppsala Švédsko
info@lobsor.se8. REGISTRAČNÉ ČÍSLO27/0199/21-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU07/2021