
o, že by vek a porucha funkcie obličiek ovplyvňovali elimináciu trastuzumabu.
Pediatrická populácia
Neexistuje žiadne relevantné použitie trastuzumabu v pediatrickej populácii.
Spôsob podávania
KANJINTI je určený iba na intravenózne použitie. Nasycovacia dávka lieku KANJINTI sa podáva
formou intravenóznej infúzie, ktorá trvá 90 minút. Podávanie formou intravenóznej injekcie push alebo bolus je zakázané. Intravenóznu infúziu lieku KANJINTI má podávať zdravotnícky pracovník
pripravený zvládnuť anafylaxiu a má byť k dispozícii pohotovostná súprava. Pacienti sa majú sledovať najmenej šesť hodín po začatí prvej infúzie a dve hodiny po začatí nasledujúcich infúzií na príznaky
ako horúčka a triaška alebo iné príznaky súvisiace s infúziou (pozri časti 4.4 a 4.8). Prerušenie alebo spomalenie rýchlosti podávania infúzie môže pomôcť pri kontrole týchto príznakov. Po ústupe ťažkostí sa môže pokračovať v infúzii.
V prípade dobrej znášanlivosti začiatočnej nasycovacej dávky sa môžu podávať udržiavacie dávky
formou 30-minútovej infúzie.
Pokyny na rekonštitúciu lieku KANJINTI na intravenózne podanie pred podaním pozri v časti 6.6.
4.3 Kontraindikácie
• Precitlivenosť na trastuzumab, myšie bielkoviny alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
• Závažná dýchavičnosť v pokoji v dôsledku komplikácií pokročilého nádorového ochorenia alebo pacienti vyžadujúci doplnkovú oxygenoterapiu.
4.4 Osobitné upozornenia a opatrenia pri používaní
Na zlepšenie sledovanosti biologických liekov sa má v zázname pacienta zreteľne zaznamenávať
(alebo uvádzať) obchodný názov a číslo šarže podaného lieku.
Vyšetrenie receptora HER2 sa musí vykonať v špecializovanom laboratóriu, ktoré dokáže zaručiť primeranú validitu testovacích postupov (pozri časť 5.1).
V súčasnosti nie sú dostupné žiadne údaje z klinických štúdií o opakovanej liečbe u pacientov s
predchádzajúcou expozíciou trastuzumabu v adjuvantnom režime.
Srdcová dysfunkcia
Všeobecné f akt ory
Pacienti liečení liekom KANJINTI sú vystavení zvýšenému riziku rozvoja kongestívneho srdcového
zlyhania (triedy II – IV Newyorkskej srdcovej asociácie [NYHA]) alebo asymptomatickej srdcovej dysfunkcie. Tieto udalosti sa pozorovali u pacientov liečených trastuzumabom samotným alebo v
kombinácii s paklitaxelom alebo docetaxelom, predovšetkým po chemoterapii obsahujúcej antracyklín
(doxorubicín alebo epirubicín). Môžu mať stredne závažný až závažný priebeh a môžu byť spojené s úmrtím (pozri časť 4.8). Okrem toho sa odporúča opatrnosť pri liečbe pacientov so zvýšeným rizikom srdcového poškodenia, napr. hypertenzia, zdokumentovaná choroba koronárnych artérií, kongestívne srdcové zlyhanie, LVEF < 55 %, vyšší vek.
Všetci kandidáti na liečbu liekom KANJINTI, najmä pacienti, ktorým predtým podávali antracyklíny a cyklofosfamid (AC), sa musia zúčastniť vstupného vyšetrenia srdca, vrátane anamnézy a fyzikálneho vyšetrenia, elektrokardiogramu (EKG), echokardiogramu a/alebo scintigrafického vyšetrenia (MUGA) alebo vyšetrenia magnetickou rezonanciou. Sledovanie môže pomôcť pri identifikácii pacientov, u ktorých sa vyvinie srdcová dysfunkcia. Vyšetrenie srdca, uskutočnené pred začiatkom liečby, sa má opakovať každé 3 mesiace počas liečby a každých 6 mesiacov po vysadení liečby až do 24 mesiacov
po poslednom podaní lieku KANJINTI. Pred rozhodnutím o liečbe liekom KANJINTI sa má starostlivo zvážiť pomer rizika a prínosu tejto liečby.
Trastuzumab, ako ukazujú všetky dostupné údaje získané z populačných farmakokinetických (FK) analýz (pozri časť 5.2), môže pretrvávať v obehu až 7 mesiacov po ukončení podávania lieku KANJINTI. U pacientov, ktorí dostávajú antracyklíny, po ukončení liečby liekom KANJINTI existuje vyššie riziko srdcovej dysfunkcie. Lekári sa majú podľa možnosti vyhnúť podávaniu antracyklínov najmenej 7 mesiacov po ukončení liečby liekom KANJINTI. Ak sa antracyklíny použijú, má sa u pacientov pozorne sledovať funkcia srdca.
Kardiologické vyšetrenie sa má zvážiť u pacientov, u ktorých existujú obavy z kardiovaskulárneho ochorenia po základnom skríningu. Počas liečby sa má u všetkých pacientov sledovať funkcia srdca (napr. každých 12 týždňov). Uvedené sledovanie môže pomôcť identifikovať pacientov, u ktorých sa rozvíja porucha funkcie srdca. Pacienti, u ktorých sa rozvíja asymptomatická dysfunkcia srdca, môžu mať úžitok z častejšieho sledovania (napr. každých 6 až 8 týždňov). U asymptomatických pacientov s progresívnym zhoršovaním funkcie ľavej komory musí lekár zvážiť ukončenie liečby liekom KANJINTI, ak liečba nemá žiadny klinický prínos.
Bezpečnosť pokračujúcej alebo znovu začatej liečby trastuzumabom u pacientov, ktorí prekonali srdcovú dysfunkciu, nebola prospektívne študovaná. Ak percento ejekčnej frakcie (EF) LVEF poklesne o ≥ 10 bodov od vstupnej hodnoty A pod 50 %, liečba sa má zastaviť a približne do 3 týždňov sa má vykonať opakované hodnotenie LVEF. Ak sa LVEF nezlepší alebo ak sa ešte viac zhorší alebo sa vyvinie symptomatické chronické srdcové zlyhanie (SZ), má sa dôkladne zvážiť ukončenie liečby liekom KANJINTI, ak prínos z liečby pre pacienta neprevýši jej riziká. Všetci takíto pacienti sa majú odporučiť na vyšetrenie u kardiológa a naďalej sledovať.
Ak počas liečby liekom KANJINTI dôjde k symptomatickému srdcovému zlyhávaniu, má sa liečiť štandardnými liekmi na SZ. Väčšina pacientov, u ktorých sa vyvinulo chronické SZ alebo asymptomatická srdcová dysfunkcia v pivotných štúdiách, dosiahla zlepšenie štandardnou liečbou SZ pozostávajúcou z inhibítora angiotenzín-konvertujúceho enzýmu (ACE) alebo z blokátora angiotenzínového receptora (ARB) a betablokátora. Väčšina pacientov s kardiálnymi príznakmi
a preukázateľným klinickým prínosom liečby trastuzumabom naďalej pokračovala v liečbe bez toho, že by sa u nich objavili ďalšie klinicky významné srdcové príhody.
Metastatický karcinóm prsníka
KANJINTI a antracyklíny sa nemajú podávať súčasne v kombinácii v prípade MKP.
Pacienti s MKP, ktorí dostávali predtým antracyklíny, sú tiež vystavení riziku kardiálnej dysfunkcie pri liečbe liekom KANJINTI, hoci riziko je nižšie ako pri súčasnom používaní lieku KANJINTI a antracyklínov.
Včasný kar ci nóm prs ní ka
U pacientov s VKP sa má vyšetrenie srdca, ktoré sa robilo na začiatku liečby, opakovať každé 3
mesiace počas liečby a každých 6 mesiacov po ukončení liečby, až do 24 mesiacov od posledného
podania lieku KANJINTI. U pacientov, ktorí dostávajú atracyklínovú chemoterapiu, sa odporúča
ďalšie sledovanie jedenkrát ročne počas 5 rokov od posledného podania lieku KANJINTI alebo dlhšie,
ak je pozorovaný kontinuálny pokles LVEF.
U pacientov s infarktom myokardu (IM) v anamnéze, s anginou pectoris, vyžadujúcou liečbu, s existujúcim kongestívnym srdcovým zlyhaním (triedy II – IV NYHA) alebo s týmto ochorením v anamnéze, LVEF < 55 %, s inou kardiomyopatiou, srdcovou arytmiou, vyžadujúcou liečbu, klinicky významným ochorením srdcových chlopní, slabo kontrolovanou hypertenziou (hypertenzia kontrolovaná štandardnou liečbou) a hemodynamicky významným perikardiálnym výpotkom, boli vylúčení z adjuvantných a neoadjuvantných pivotných štúdií VKP s trastuzumabom, a preto nie je možné u týchto pacientov odporúčať liečbu.
Adjuvantná liečba
KANJINTI a antracyklíny sa nemajú podávať súčasne v kombinácii v prípade adjuvantnej liečby.
U pacientov s VKP bol pozorovaný zvýšený výskyt symptomatických a asymptomatických srdcových udalostí, keď sa trastuzumab podával po chemoterapii, ktorá obsahovala antracyklíny, v porovnaní s podaním v režime docetaxel a karboplatina bez antracyklínov a bol výraznejší, keď sa trastuzumab podával súbežne s taxánmi, než keď sa podával sekvenčne. Bez ohľadu na použitý režim sa väčšina symptomatických srdcových udalostí vyskytla počas prvých 18 mesiacov. V jednej z 3 pivotných klinických štúdií, v ktorej bol medián sledovania 5,5 roka (BCIRG 006), bol pozorovaný kontinuálny nárast kumulatívnej miery výskytu symptomatických srdcových alebo LVEF udalostí u pacientov, ktorým bol trastuzumab podávaný súbežne s taxánmi po liečbe antracyklínmi, až 2,37 % v porovnaní s približne 1 % v dvoch porovnávacích skupinách (antracyklíny plus cyklofosfamid nasledované
taxánmi a taxány, karboplatina a trastuzumab).
Rizikové faktory pre srdcové príhody, identifikované v štyroch veľkých adjuvantných štúdiách, zahŕňali vyšší vek (> 50 rokov), nízku východiskovú hodnotu LVEF (< 55 %), pred začiatkom liečby paklitaxelom alebo po jej začatí, zníženie LVEF o 10 – 15 bodov a predchádzajúce alebo súbežné používanie antihypertenzív. U pacientov liečených trastuzumabom po skončení adjuvantnej chemoterapie, bolo riziko srdcovej dysfunkcie spojené s vyššou kumulatívnou dávkou antracyklínu, podanou pred začatím liečby trastuzumabom a indexom telesnej hmotnosti (BMI) > 25 kg/m2.
Neoadjuvantná-adjuvantná liečba
U pacientov s VKP vhodných na neoadjuvantnú-adjuvantnú liečbu sa KANJINTI môže používať súčasne s antracyklínmi len u pacientov bez predchádzajúcej chemoterapie a len s nízko dávkovými antracyklínovými režimami, napr. maximálne kumulatívne dávky doxorubicínu 180 mg/m2 alebo epirubicínu 360 mg/m2.
Ak boli pacienti liečení súčasne kompletným režimom s nízkodávkovými antracyklínmi a liekom KANJINTI v neoadjuvantnej liečbe, po operácii sa nemá podávať žiadna ďalšia cytotoxická chemoterapia. V ostatných prípadoch sa rozhodnutie o potrebe ďalšej cytotoxickej chemoterapie stanovuje na základe individuálnych faktorov.
Skúsenosti so súčasným podávaním trastuzumabu s nízkymi dávkami antracyklínov sú v súčasnosti
limitované na 2 klinické skúšania (MO16432 a BO22227).
V pivotnom klinickom skúšaní MO16432 sa trastuzumab podával súčasne s neoadjuvantnou
chemoterapiou, obsahujúcou tri cykly doxorubicínu (kumulatívna dávka 180 mg/m2).
Incidencia symptomatickej srdcovej dysfunkcie bola v skupinách s trastuzumabom 1,7 %.
V pivotnom klinickom skúšaní BO22227 bol trastuzumab podávaný súbežne s neoadjuvantou chemoterapiou, ktorá zahŕňala 4 cykly epirubicínu (kumulatívna dávka 300 mg/m2); incidencia kongestívneho srdcového zlyhávania priemerne pri 40-mesačnom následnom sledovaní (follow-up) bola v skupine s trastuzumabom podávaným intravenózne 0,0 %.
Klinické skúsenosti u pacientov starších ako 65 rokov sú obmedzené.
Reakcie súvisiace s infúziou (infusion-related reactions, IRR) a precitlivenosť
Hlásené boli závažné IRR na infúziu trastuzumabu, zahŕňajúce dýchavičnosť, hypotenziu, sipot,
hypertenziu, bronchospazmus, supraventrikulárnu tachyarytmiu, nižšiu saturáciu krvi kyslíkom, anafylaxiu, respiračnú tieseň, urtikáriu a angioedém (pozri časť 4.8). Na zníženie rizika výskytu týchto udalostí sa môže použiť premedikácia. Väčšina z uvedených udalostí sa objavuje počas prvej infúzie alebo do 2,5 hodiny od začiatku prvej infúzie. Ak dôjde k takejto reakcii na infúziu, infúzia trastuzumabu sa má ukončiť a pacienta je potrebné sledovať až do vymiznutia sledovaných príznakov (pozri časť 4.2). Tieto príznaky môžu byť liečené analgetikami/antipyretikami, napr. meperidín alebo paracetamol alebo antihistaminikami, napr. difenhydramín. U väčšiny pacientov príznaky ustúpili a následne im boli podané ďalšie infúzie trastuzumabu. Závažné reakcie sa úspešne zvládli pomocou podpornej liečby kyslíkom, beta-agonistami a kortikosteroidmi. V zriedkavých prípadoch mali tieto reakcie fatálny koniec. U pacientov s dýchavičnosťou v pokoji, v dôsledku komplikácií pokročilého nádorového ochorenia a pridružených ochorení, existuje zvýšené riziko fatálnej reakcie na infúziu. Z toho dôvodu nesmú byť títo pacienti liečení liekom KANJINTI (pozri časť 4.3).
Takisto sa opísali prípady úvodného zlepšenia, po ktorom nasledovalo zhoršovanie klinického stavu, pričom sa zaznamenali aj oneskorené reakcie s rýchlym zhoršovaním klinického stavu. K úmrtiam pacientov došlo v priebehu niekoľkých hodín, až jedného týždňa, po začatí podávania infúzie. Vo veľmi zriedkavých prípadoch sa u pacientov objavili príznaky z podania infúzie a pľúcne príznaky po viac ako šestich hodinách od začiatku infúzie trastuzumabu. Pacienti sa majú upozorniť na možnosť vzniku týchto neskorších reakcií a na nutnosť vyhľadať lekára v prípade spozorovania uvedených príznakov.
Pľúcne príhody
V rámci postmarketingového sledovania sa zaznamenali prípady ťažkých pľúcnych príhod v súvislosti
s používaním trastuzumabu (pozri časť 4.8). Príležitostne boli tieto príhody fatálne. Okrem toho sa zaznamenali prípady intersticiálnej choroby pľúc, vrátane pľúcnych infiltrátov, akútneho syndrómu respiračnej tiesne, pneumónie, pneumonitídy, pleurálnych výpotkov, respiračnej tiesne, akútneho edému pľúc a respiračnej insuficiencie. Rizikové faktory spájané s intersticiálnou chorobou pľúc zahŕňajú predchádzajúcu alebo konkomitantnú liečbu s inými antineoplastickými terapiami ako taxány, gemcitabín, vinorelbín a radiačná liečba. Tieto príhody môžu byť súčasťou reakcie na infúziu alebo sa môžu objaviť neskôr. U pacientov s dýchavičnosťou v pokoji v dôsledku komplikácií pokročilého nádorového ochorenia a pridružených ochorení existuje zvýšené riziko pľúcnych príhod. Preto sa nemajú títo pacienti liečiť liekom KANJINTI (pozri časť 4.3). Obozretnosť je potrebná pri pneumonitíde, a to zvlášť u pacientov, ktorí sa liečia súbežne s taxánmi.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne oficiálne interakčné štúdie. V klinických skúšaniach neboli pozorované
klinicky významné interakcie medzi trastuzumabom a súčasne užívanými liekmi.
Vplyv trastuzumabu na farmakokinetiku iných antineoplastických látok
Farmakokinetické údaje zo štúdií BO15935 a M77004 u žien s HER2-pozitívnym MKP naznačili, že
expozícia paklitaxelu a doxorubicínu (a ich hlavným metabolitom 6-α hydroxyl-paklitaxelu, POH, a doxorubicinolu, DOL) nebola zmenená za prítomnosti trastuzumabu (pri nasycovacej dávke 8 mg/kg
intravenózne s udržiavacou dávkou 6 mg/kg intravenózne každé 3 týždne alebo pri nasycovacej dávke
4 mg/kg intravenózne s udržiavacou dávkou 2 mg/kg intravenózne raz týždenne). Trastuzumab však môže zvýšiť celkovú expozíciu jedného metabolitu doxorubicínu (7-deoxy-13 dihydro-
doxorubicinónu, D7D). Biologická aktivita D7D a klinický vplyv zvýšenia tohto metabolitu neboli
známe.
Údaje zo štúdie JP16003 s jednou skupinou s trastuzumabom (4 mg/kg intravenózne nasycovacia dávka a 2 mg/kg intravenózne raz týždenne) a docetaxelom (60 mg/m2 intravenózne) u japonských žien s HER2-pozitívnym MKP naznačili, že súbežné podávanie trastuzumabu nemalo žiadny vplyv na farmakokinetiku docetaxelu po jednorazovej dávke. Štúdia JP19959 bola podštúdia štúdie BO18255 (ToGA) u mužských a ženských japonských pacientov s pokročilým karcinómom žalúdka, v ktorej sa sledovala farmakokinetika kapecitabínu a cisplatiny, používaných s trastuzumabom alebo bez trastuzumabu. Výsledky tejto podštúdie naznačili, že expozícia biologicky aktívnym metabolitom (napr. 5-FU) kapecitabínu nebola ovplyvnená súbežným používaním cisplatiny ani súbežným používaním cisplatiny s trastuzumabom. Samotný kapecitabín však preukázal vyššie koncentrácie a dlhší polčas pri kombinovaní s trastuzumabom. Údaje tiež naznačili, že farmakokinetika cisplatiny nebola ovplyvnená súbežným používaním kapecitabínu ani súbežným používaním kapecitabínu s trastuzumabom.
Farmakokinetické údaje zo štúdie H4613g/GO01305 u pacientov s metastatickým alebo lokálne pokročilým neoperovateľným HER2-pozitívnym karcinómom naznačili, že trastuzumab nemal žiadny vplyv na farmakokinetiku karboplatiny.
Vplyv antineoplastických látok na farmakokinetiku trastuzumabu
Porovnaním simulovaných sérových koncentrácií trastuzumabu po monoterapii trastuzumabom
(4 mg/kg nasycovacia dávka/2 mg/kg raz týždenne intravenózne) a pozorovaných sérových koncentrácií u japonských žien s HER2-pozitívnym MKP (štúdia JP16003) sa nezistil žiadny dôkaz o FK vplyve súbežného podávania docetaxelu na farmakokinetiku trastuzumabu.
Porovnanie FK výsledkov z dvoch štúdií fázy II (BO15935 a M77004) a jednej štúdie fázy III (H0648g), v ktorých boli pacienti liečení súčasne s trastuzumabom a paklitaxelom, a z dvoch štúdií fázy II, v ktorých bol trastuzumab podávaný v monoterapii (WO16229 a MO16982), u žien s HER2- pozitívnym MKP naznačuje, že individuálne a priemerné minimálne sérové koncentrácie trastuzumabu sa odlišujú v rámci štúdií a medzi jednotlivými štúdiami, nezistil sa však žiadny jednoznačný vplyv súbežného podávania paklitaxelu na farmakokinetiku trastuzumabu. Porovnanie FK údajov o trastuzumabe zo štúdie M77004, v ktorej boli ženy s HER2-pozitívnym MKP liečené súbežne trastuzumabom, paklitaxelom a doxorubicínom, s FK údajmi trastuzumabu v štúdiách, kde bol trastuzumab podávaný ako monoterapia (H0649g) alebo v kombinácii s antracyklínom a cyklofosfamidom alebo paklitaxelom (štúdia H0648g), naznačili, že doxorubicín a paklitaxel nemali na farmakokinetiku trastuzumabu žiadny vplyv.
Farmakokinetické údaje zo štúdie H4613g/GO01305 nasvedčujú tomu, že karboplatina nemala žiadny
vplyv na FK trastuzumabu.
Nezdá sa, že súbežné podávanie anastrozolu ovplyvňuje farmakokinetiku trastuzumabu.
4.6 Fertilita, gravidita a laktácia
Ž
eny vofertilnomveku
Ženám vo fertilnom veku sa má odporučiť, aby používali účinnú antikoncepciu počas liečby liekom
KANJINTI a 7 mesiacov po ukončení liečby (pozri časť 5.2).
Gravidita
Štúdie reprodukčnej toxicity sa vykonali na opiciach rodu Cynomolgus, ktoré dostávali až 25-násobok
týždennej udržiavacej dávky trastuzumabu na intravenózne použitie u ľudí 2 mg/kg. Pri exponovaných opiciach sa nezistila žiadna porucha fertility ani žiadny škodlivý vplyv na plod. Počas včasného
(gestačné dni: 20 až 50) a neskorého (gestačné dni: 120 až 150) obdobia vývoja plodu bol pozorovaný
prestup trastuzumabu cez placentu. Nie je známe, či trastuzumab ovplyvňuje schopnosť reprodukcie. Keďže na základe reprodukčných štúdií uskutočnených na zvieratách nie je vždy možné predvídať
odpoveď u ľudí, KANJINTI sa má podávať počas gravidity iba vtedy, ak jeho možný úžitok pre matku
prevýši jeho riziko pre plod.
V postmarketingovom období boli u tehotných žien používajúcich trastuzumab hlásené prípady poruchy fetálneho renálneho rastu a/alebo funkcie obličiek v súvislosti s oligohydramniou, niektoré spojené s fatálnou pľúcnou hypopláziou plodu. Ženy, ktoré otehotnejú, treba informovať o možnosti poškodenia plodu. Ak je tehotná žena liečená liekom KANJINTI alebo ak pacientka, ktorá je liečená liekom KANJINTI alebo do 7 mesiacov po poslednej dávke lieku KANJINTI otehotnie, je potrebná prísna kontrola multidisciplinárnym tímom.
Dojčenie
V štúdii uskutočnenej na dojčiacich opiciach rodu Cynomolgus, ktoré dostávali 25-násobok týždennej
udržiavacej dávky trastuzumabu na intravenózne použitie u ľudí 2 mg/kg, sa ukázalo, že trastuzumab sa vylučuje do materského mlieka. Prítomnosť trastuzumabu v sére opičích mláďat nemala negatívny
vplyv na ich rast alebo vývoj v období medzi narodením a prvým mesiacom života. Nie je známe, či sa
trastuzumab vylučuje do materského mlieka u ľudí. Keďže ľudský imunoglobulín IgG1 sa vylučuje do materského mlieka u ľudí a možnosť negatívneho ovplyvnenia plodu nie je známa, ženy nesmú dojčiť počas liečby liekom KANJINTI a ešte 7 mesiacov po poslednej dávke.
Fertilita
Nie sú dostupné žiadne údaje.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Trastuzumab nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacientom, u ktorých sa objavili reakcie súvisiace s infúziou (pozri časť 4.4), sa neodporúča viesť vozidlá a obsluhovať stroje až do ústupu ťažkostí.
4.8 Nežiaduce účinky
Súhrn profilubezpečnosti
Medzi najzávažnejšie a/alebo najčastejšie nežiaduce reakcie doteraz hlásené v súvislosti s používaním
trastuzumabu patria srdcová dysfunkcia, reakcie súvisiace s infúziou, hematotoxicita (najmä
neutropénia), infekcie a pľúcne nežiaduce reakcie.
T
abuľkový súhrn nežiaducichreakcií
V tejto časti boli použité nasledujúce kategórie frekvencie výskytu: veľmi časté (≥ 1/10), časté
(≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100), zriedkavé (≥ 1/10 000 až < 1/1 000), veľmi zriedkavé (< 1/10 000), neznáme (frekvencia nie je známa a nemožno ju odhadnúť z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce reakcie usporiadané v poradí klesajúcej závažnosti.
V tabuľke 1 sú uvedené nežiaduce reakcie, ktoré boli hlásené v súvislosti s používaním intravenózneho trastuzumabu formou monoterapie alebo v kombinácii s chemoterapiou v pivotných klinických skúšaniach a počas postmarketingového sledovania.
Všetky názvy sú uvedené podľa najvyššieho percenta výskytu v pivotných klinických skúšaniach.
Tabuľka 1 Nežiaduce účinky hlásené v súvislosti s trastuzumabom na intravenózne použitie
v monoterapii alebo v kombinácii s chemoterapiou v pivotných klinických štúdiách (N = 8 386)
a v sledovaní po uvedení lieku na trh
T
rieda orgánových
systémov podľa MedDRA
N
ežiaduca reakcia Frekvencia
Infekcie a nákazy Infekcia Veľmi časté Nazofaryngitída Veľmi časté Neutropenická sepsa Časté Cystitída Časté Herpes zoster Časté Chrípka Časté Sinusitída Časté Infekcia kože Časté Rinitída Časté Infekcia horných dýchacích ciest Časté Infekcia močových ciest Časté Eryzipel Časté Celulitída Časté Faryngitída Časté
Sepsa Menej časté
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy) Poruchy krvi a lymfatického systému
Progresia malígneho nádoru Neznáme
Progresia nádorového ochorenia Neznáme
Febrilná neutropénia Veľmi časté Anémia Veľmi časté Neutropénia Veľmi časté Znížený počet bielych krviniek/leukopénia Veľmi časté Trombocytopénia Veľmi časté Hypoprotrombinémia Neznáme Imunitná trombocytopénia Neznáme
Poruchy imunitného systému Precitlivenosť Časté
+Anafylaktická reakcia Neznáme
+Anafylaktický šok Neznáme
Poruchy metabolizmu a
výživy
Zníženie /úbytok telesnej hmotnosti Veľmi časté Anorexia Veľmi časté Hyperkaliémia Neznáme
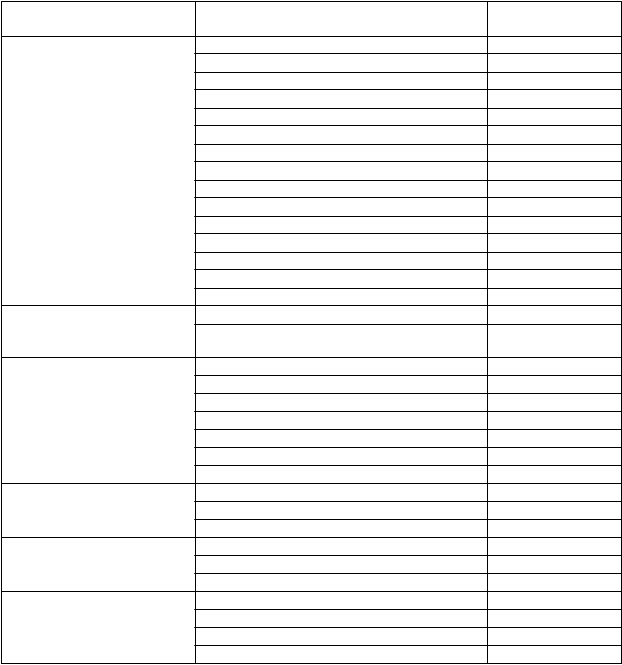
Psychické poruchy Insomnia Veľmi časté Úzkosť Časté Depresia Časté Neobvyklé myslenie Časté
T
rieda orgánových systémov podľa MedDRA
N
ežiaduca reakcia Frekvencia
Poruchy nervového systému 1Tremor Veľmi časté Závrat Veľmi časté Bolesť hlavy Veľmi časté Parestézia Veľmi časté Dysgeuzia Veľmi časté Periférna neuropatia Časté Hypertónia Časté Somnolencia Časté
Ataxia Časté
Paréza Zriedkavé
Edém mozgu Neznáme
Poruchy oka Konjunktivitída Veľmi časté Zvýšené slzenie Veľmi časté Suchosť oka Časté
Edém papily Neznáme
Krvácanie do sietnice Neznáme
Poruchy ucha a labyrintu Hluchota Menej časté
Poruchy srdca a srdcovej
činnosti
1Znížený krvný tlak Veľmi časté
1Zvýšený krvný tlak Veľmi časté
1Nepravidelný tep Veľmi časté
1Palpitácie Veľmi časté
1Srdcový flutter Veľmi časté
Znížená ejekčná frakcia* Veľmi časté
+Kongestívne zlyhanie srdca Časté
+1Supraventrikulárna tachyarytmia Časté Kardiomyopatia Časté Perikardiálny výpotok Menej časté Kardiogénny šok Neznáme Perikarditída Neznáme Bradykardia Neznáme Prítomnosť galopového rytmu Neznáme
Poruchy ciev Návaly horúčavy Veľmi časté
+1Hypotenzia Časté
Vazodilatácia Časté
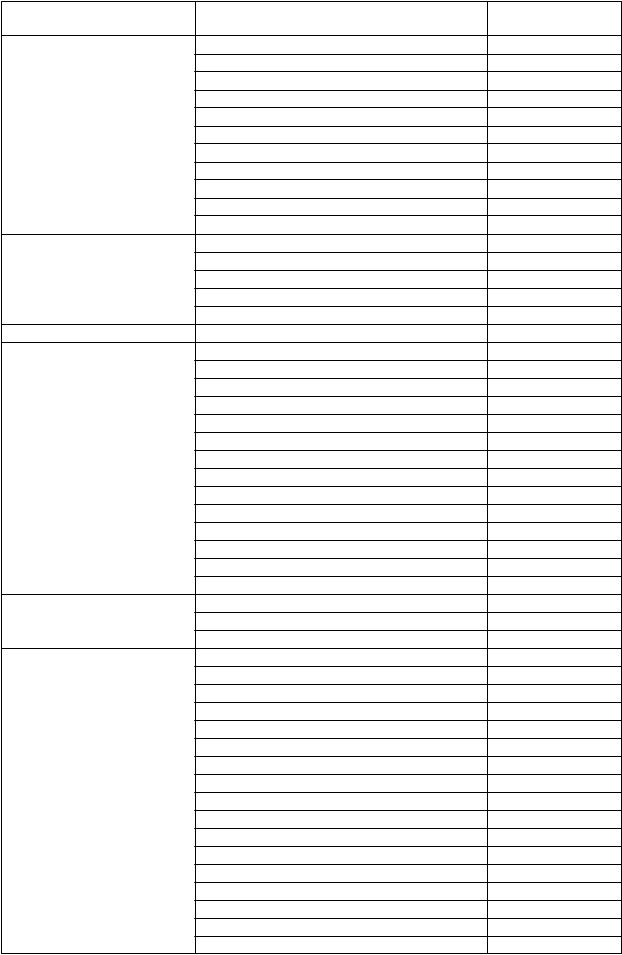
Poruchy dýchacej sústavy, hrudníka a mediastína
+1Sipot Veľmi časté
+Dýchavičnosť Veľmi časté Kašeľ Veľmi časté Epistaxa Veľmi časté Rinorea Veľmi časté
+Pneumónia Časté
Astma Časté
Ochorenie pľúc Časté
+Pľúcny výpotok Časté
Pneumonitída Zriedkavé
+Pľúcna fibróza Neznáme
+Respiračná tieseň Neznáme
+Zlyhávanie dýchania Neznáme
+Infiltrácia pľúc Neznáme
+Akútny edém pľúc Neznáme
+Akútny syndróm respiračnej tiesne Neznáme
+Bronchospazmus Neznáme
 T
rieda orgánových systémov podľa MedDRA
T
rieda orgánových systémov podľa MedDRA
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Poruchy kože a podkožného
tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových
ciest
Nežiaduca reakcia Frekvencia+Hypoxia Neznáme
+Znížená saturácia kyslíkom Neznáme Laryngeálny edém Neznáme Ortopnoe Neznáme Pľúcny edém Neznáme Intersticiálna choroba pľúc Neznáme Hnačka Veľmi časté Vracanie Veľmi časté Nauzea Veľmi časté
1Opuch pier Veľmi časté
Bolesť brucha Veľmi časté Dyspepsia Veľmi časté Zápcha Veľmi časté Stomatitída Veľmi časté Pankreatitída Časté Hemoroidy Časté
Sucho v ústach Časté
Hepatocelulárne poškodenie Časté Hepatitída Časté Citlivosť pečene Časté Žltačka Zriedkavé Zlyhávanie pečene Neznáme Erytém Veľmi časté Vyrážka Veľmi časté
1Opuch tváre Veľmi časté
Alopécia Veľmi časté Ochorenie nechtov Veľmi časté Syndróm palmárno-plantárnej erytrodyzestézie Veľmi časté Akné Časté
Suchá koža Časté Ekchymóza Časté Hyperhidróza Časté Makulopapulárna vyrážka Časté Pruritus Časté Lámavosť nechtov Časté Dermatitída Časté Urtikária Menej časté Angioedém Neznáme Artralgia Veľmi časté
1Svalová napätosť Veľmi časté
Myalgia Veľmi časté
Artritída Časté Bolesť chrbta Časté Bolesť kostí Časté Svalové kŕče Časté Bolesť šije Časté Bolesť v končatinách Časté Ochorenie obličiek Časté Membranózna glomerulonefritída Neznáme Glomerulonefropatia Neznáme Zlyhávanie obličiek Neznáme
T
rieda orgánových systémov podľa MedDRA Stavy v gravidite, v šestonedelí a perinatálnom období
Poruchy reprodukčného
systému a prsníkov
Celkové poruchy a reakcie v mieste podania
Úrazy, otravy a komplikácie
liečebného postupu
Nežiaduca reakcia Frekvencia
Oligohydramnión Neznáme Hypoplázia obličky Neznáme Hypoplázia pľúc Neznáme Zápal prsníka/mastitída Časté
Asténia Veľmi časté Bolesť na hrudníku Veľmi časté Triaška Veľmi časté Únava Veľmi časté Príznaky podobné chrípke Veľmi časté Reakcia súvisiaca s infúziou Veľmi časté Bolesť Veľmi časté Pyrexia Veľmi časté Zápal slizníc Veľmi časté Periférny edém Veľmi časté Malátnosť Časté
Edém Časté
Modriny Časté
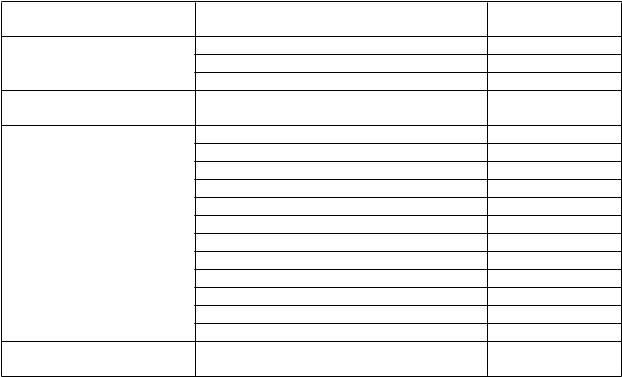
+ Označuje nežiaduce reakcie, ktoré boli hlásené v súvislosti s úmrtím.
1 Označuje nežiaduce reakcie, ktoré boli prevažne hlásené v súvislosti s reakciami na infúziu. Presné percento
nie je k dispozícii.
* Pozorované pri kombinovanej liečbe antracyklínmi a v kombinácii s taxánmi.
Opis vybraných nežiaducichreakciíSrdcová dysfunkciaKongestívne zlyhanie srdca ( triedy II – IV NYHA) je častá nežiaduca reakcia súvisiaca s používaním
trastuzumabu a bola spojená s úmrtím (pozri časť 4.4). U pacientov liečených trastuzumabom sa pozorovali prejavy a príznaky srdcovej dysfunkcie, ako sú dyspnoe, ortopnoe, zhoršenie kašľa, pľúcny
edém, S3 galop alebo znížená ejekčná frakcia ľavej komory (pozri časť 4.4).
V 3 pivotných klinických skúšaniach adjuvantne podávaného trastuzumabu v kombinácii s chemoterapiou bol výskyt stupňa 3/4 srdcovej dysfunkcie (hlavne symptomatického kongestívneho srdcového zlyhania) podobný u pacientov, ktorým bola podávaná samotná chemoterapia (t. j. nedostali trastuzumab), a u pacientov, ktorým bol trastuzumab podávaný následne po taxáne (0,3 – 0,4 %). Výskyt bol najvyšší u pacientov, ktorým bol trastuzumab podávaný súbežne s taxánom (2,0 %). O súčasnom podávaní trastuzumabu s nízkou dávkou antracyklínu v neoadjuvancii sú obmedzené údaje (pozri časť 4.4).
Keď sa trastuzumab podával po ukončení adjuvantnej chemoterapie, bolo pozorované srdcové zlyhanie triedy III – IV NYHA u 0,6 % pacientov v skupine s podávaním jeden rok pri mediáne sledovania 12 mesiacov. V štúdii BO16348 bola pri mediáne sledovania 8 rokov incidencia závažného kongestívneho srdcového zlyhania (triedy III a IV NYHA) v skupine s 1-ročnou liečbou trastuzumabom 0,8 % a výskyt symptomatickej a asymptomatickej dysfunkcie ľavej komory miernej intenzity bol 4,6 %.
Reverzibilita závažného chronického SZ (definovaná ako postupnosť aspoň dvoch po sebe idúcich hodnôt LVEF ≥ 50 % po príhode) sa pozorovala u 71,4 % pacientov liečených trastuzumabom. Reverzibilita symptomatickej a asymptomatickej dysfunkcie ľavej komory miernej intenzity bola preukázaná u 79,5 % pacientov. Približne 17 % príhod súvisiacich so srdcovým zlyhaním sa vyskytlo po ukončení liečby trastuzumabom.
V pivotných metastatických skúšaniach s trastuzumabom na intravenózne použitie sa výskyt srdcovej dysfunkcie pohybuje medzi 9 % a 12 % v kombinácii s paklitaxelom v porovnaní s 1 % – 4 % s paklitaxelom samotným. Pre monoterapiu bol výskyt 6 % – 9 %. Najvyšší výskyt srdcovej dysfunkcie bol pozorovaný u pacientov liečených trastuzumabom súbežne s antracyklínom/cyklofosfamidom
(27 %) a predstavoval signifikatne vyšší výskyt ako pri liečbe antracyklínom/cyklofosfamidom
samostatným (7 % – 10 %). V následnej štúdii, s prospektívnym sledovaním srdcovej funkcie, bola incidencia symptomatického chronického SZ 2,2 % u pacientov liečených trastuzumabom a docetaxelom v porovnaní s 0 % u pacientov, ktorým sa podával len docetaxel samotný. U väčšiny pacientov (79 %), u ktorých sa vyvinula srdcová dysfunkcia v týchto skúšaniach, došlo k zlepšeniu po podaní bežnej liečby na chronické SZ.
I nf úzne re akci e, re akci e podobné al ergi cký m reak ci ám a pre ci tli ve nosť
Pri metastatickom ochorení sa predpokladá, že približne u 40 % pacientov liečených trastuzumabom
sa vyskytne určitá forma reakcie súvisiacej s infúziou. Väčšina reakcií súvisiacich s infúziou je však miernej až stredne závažnej intenzity (systém odstupňovania NCI-CTC) a obyčajne sa vyskytujú v
počiatočnej fáze liečby, t. j. počas podávania prvej, druhej a tretej infúzie, a pri ďalších infúziách ich
frekvencia klesá. Reakcie zahŕňajú triašku, horúčku, dyspnoe, hypotenziu, sipot, bronchospazmus, tachykardiu, zníženú saturáciu krvi kyslíkom, respiračnú tieseň, vyrážku, nauzeu, vracanie a bolesť
hlavy (pozri časť 4.4). Výskyt reakcií všetkých stupňov súvisiacich s infúziou sa líšil medzi
klinickými skúšaniami v závislosti od indikácie, metódy zberu údajov a podľa toho, či bol trastuzumab podávaný súbežne s chemoterapiou alebo ako monoterapia.
Závažné anafylaktické reakcie, vyžadujúce okamžitý dodatočný zákrok, sa vyskytujú veľmi zriedkavo, a to zvyčajne počas podávania prvej alebo druhej infúzie trastuzumabu (pozri časť 4.4) a boli spojené
s úmrtím. V izolovaných prípadoch sa pozorovali anafylaktoidné reakcie.
Hematotoxicita
Febrilná neutropénia, leukopénia, anémia, trombocytopénia a neutropénia sa vyskytujú veľmi často.
Frekvencia výskytu hypoprotrombinémie nie je známa. Môže byť mierne zvýšené riziko neutropénie, keď sa podáva trastuzumab s docetaxelom po antracyklínovej liečbe.
Pľúcne prí hody
Závažné pľúcne nežiaduce reakcie sa vyskytujú v súvislosti s používaním trastuzumabu a boli spojené
s úmrtím. Okrem iného zahŕňajú: pľúcne infiltráty, akútny syndróm respiračnej tiesne, pneumóniu,
pneumonitídu, pleurálne výpotky, respiračnú tieseň, akútny edém pľúc a respiračnú insuficienciu
(pozri časť 4.4).
Podrobné opatrenia na minimalizáciu rizika, ktoré sú v súlade s plánom riadenia rizík EÚ, sú uvedené v „Osobitných upozorneniach a opatreniach pri používaní“ (pozri časť 4.4).
Imunogenicita
V neoadjuvantnej a adjuvantnej liečbe VKP sa u 8,1 % (24/296) pacientov, ktorí boli liečení
trastuzumabom intravenózne, vyvinuli protilátky proti trastuzumabu (bez ohľadu na prítomnosť protilátok na začiatku liečby). U 2 z 24 pacientov liečených trastuzumabom intravenózne, bola vo
vzorkách po začatí liečby zistená prítomnosť neutralizujúcich protilátok proti trastuzumabu.
Klinický význam týchto protilátok nie je známy; avšak farmakokinetika, účinnosť (stanovená patologickou kompletnou odpoveďou [pCR]) a bezpečnosť stanovená výskytom reakcií súvisiacich s podaním (ARR) trastuzumabu intravenózne, nepreukázali nepriaznivé ovplyvnenie týmito protilátkami.
Nie sú k dispozícii žiadne údaje o imunogenicite týkajúce sa trastuzumabu podávaného pri karcinóme
žalúdka.
H
l
ásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieV klinických skúšaniach u ľudí sa nezískali žiadne skúsenosti s predávkovaním liekom. V rámci klinických skúšaní neprekročili jednotlivé dávky trastuzumabu hodnotu 10 mg/kg telesnej hmotnosti; udržiavacia dávka 10 mg/kg podaná každé 3 týždne po nasycovacej dávke 8 mg/kg sa skúmala v klinických skúšaniach u pacientov s MKŽ. Dávky v uvedených hodnotách boli dobre tolerované.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Cytostatiká, monoklonálne protilátky, ATC kód: L01XC03
KANJINTI je podobný biologický liek. Podrobné informácie sú dostupné na internetovej stránke
Európskej agentúry pre lieky
http://www.ema.europa.eu.Trastuzumab je rekombinantná humanizovaná monoklonálna protilátka typu IgG1 proti receptoru 2
ľudského epidermálneho rastového faktora (HER2). Nadmerná expresia receptora HER2 sa pozoruje pri 20 až 30 % primárnych nádorov prsníka. V štúdiách určujúcich HER2-pozitivitu pri karcinóme žalúdka (KŽ) s použitím imunohistochemickej metódy (IHC) a fluorescenčnej
in situ hybridizácie (FISH) alebo chromogénnej
in situ hybridizácie (CISH) sa zistilo, že jestvuje široká variabilita HER2- pozitivity v rozsahu od 6,8 % do 34,0 % pri IHC a od 7,1 % do 42,6 % pri FISH. V štúdiách sa zistilo, že u pacientov s karcinómom prsníka s nadmernou expresiou receptora HER2 je v porovnaní s pacientmi s tumormi bez nadmernej expresie tohto receptora skrátená doba prežívania bez prejavov ochorenia. Extracelulárna doména receptora (ECD, p105) sa môže dostať do krvi, a preto je možné stanoviť ju vo vzorkách séra.
Mechanizmus účinkuTrastuzumab sa s vysokou afinitou a špecifickosťou viaže na subdoménu IV, juxtamembránovú oblasť
extracelulárnej domény receptora HER2. Väzba trastuzumabu na receptor HER2 inhibuje ligandovo
nezávislú signálnu dráhu receptora HER2 a bráni proteolytickému odštiepeniu jeho extracelulárnej domény, čo je mechanizmus aktivácie receptora HER2. V dôsledku toho sa v štúdiách na zvieratách aj
v pokusoch
in vitro zistilo, že trastuzumab inhibuje proliferáciu ľudských nádorových buniek s
nadmernou expresiou receptora HER2. Okrem toho je trastuzumab silným mediátorom bunkami sprostredkovanej cytotoxicity závislej od protilátky (ADCC). V pokusoch
in vitro sa zistilo, že trastuzumabom sprostredkovaná ADCC je zameraná viac na nádorové bunky s nadmernou expresiou receptora HER2 ako na nádorové bunky bez nadmernej expresie receptora HER2.
Stanovenie nadmernej expresie receptora HER2 alebo amplifikácie HER2 génuStanovenie nadmernej expresie receptora HER2 alebo amplifikácie HER2 génu pri karcinóme prsníkaKANJINTI sa má použiť iba u pacientov, ktorých tumory vykazujú nadmernú expresiu receptora
HER2 alebo amplifikáciu HER2 génu, ak je stanovené presnou a validovanou metódou. Nadmerná
expresia receptora HER2 sa má stanoviť imunohistochemicky (IHC) – na základe hodnotenia fixovaných blokov s nádorom (pozri časť 4.4). Amplifikácia HER2 génu sa má stanoviť použitím fluorescenčnej
in situ hybridizácie (FISH) alebo chromogénnej
in situ hybridizácie (CISH) fixovaných blokov nádoru. Pacienti sú vhodní na liečbu liekom KANJINTI, ak vykazujú nadmernú expresiu
receptora HER2, vyjadrenú ako skóre 3+ pomocou IHC alebo majú pozitívne výsledky FISH alebo
CISH.
Kvôli zaručeniu presných a opakovateľných výsledkov sa má vyšetrenie vykonať v špecializovanom laboratóriu, ktoré dokáže zabezpečiť validitu vyšetrovacích postupov.
Odporúčaný systém vyhodnocovania zafarbenia vzoriek na základe imunohistochemického vyšetrenia je v tabuľke 2.
Tabuľka 2 Odporúčaný systém vyhodnocovania imunohistochemického farbenia pri karcinóme
prsníka
Skóre Spôsob sfarbenia Hodnotenie nadmernej expresie receptora HER2
0 Sfarbenie neprítomné, prípadne sfarbenie membrány je prítomné v < 10 % nádorových buniek.
1+ Slabé/ťažko pozorovateľné sfarbenie membrány je prítomné vo
> 10 % nádorových buniek. Farbí sa iba časť membrány
nádorových buniek.
2+ Slabé až mierne sfarbenie celej membrány je prítomné vo
> 10 % nádorových buniek.
3+ Silné sfarbenie celej membrány je prítomné vo > 10 %
nádorových buniek.
Negatívny výsledok
Negatívny výsledok
Neurčitý výsledok
Pozitívny výsledok

Všeobecne sa FISH považuje za pozitívne, ak pomer počtu kópií HER2 génu na nádorovú bunku k
počtu kópií chromozómu 17 je väčší ako alebo rovný 2 alebo ak sú viac než 4 kópie HER2 génu na nádorovú bunku, pričom sa nepoužije kontrola chromozóm 17.
Všeobecne sa CISH považuje za pozitívne, ak je viac než 5 kópií HER2 génu na jadro viac než v 50 %
nádorových buniek.
Podrobné návody na vykonanie testov a ich interpretáciu si pozrite v písomných informáciách pre stanovenie FISH a CISH. Môžu sa tiež použiť oficiálne odporúčania na testovanie HER2.
Pre ostatné metódy hodnotenia HER2 proteínu alebo génovej expresie musia byť použité analýzy vykonávané v laboratóriách, ktoré poskytujú adekvátnu úroveň techniky vykonávanej validovanými metódami. Tieto metódy musia bezpodmienečne presne, správne a dostatočne preukázať nadmernú expresiu HER2 a musia byť schopné rozoznávať medzi miernou (zodpovedá 2+) a silnou (zodpovedá
3+) nadmernou expresiou HER2.
Stanovenie nadmernej expresie receptora HER2 alebo amplifikácie HER2 génu pri karcinóme žalúdka Na stanovenie nadmernej expresie receptora HER2 alebo amplifikácie HER2 génu sa má použiť len presná a validovaná metóda. Ako prvá testovacia metóda sa odporúča IHC a v prípadoch, kde sa vyžaduje aj stav amplifikácie HER2 génu, sa musí použiť buď metóda striebrom značenej
in situ hybridizácie (SISH) alebo FISH. SISH technológia sa však odporúča preto, lebo umožňuje paralelne hodnotiť histológiu a morfológiu nádoru. Kvôli zaručeniu validity testovacích postupov a získaniu presných a opakovateľných výsledkov musí HER2 testovanie prebiehať v laboratóriu so zaškoleným personálom. Podrobné návody na vykonanie testov a interpretáciu výsledkov sa majú prevziať z písomnej informácie pre používateľa, kde sú opísané použité metódy na testovanie HER2.
V klinickom skúšaní ToGA (BO18255) pacienti, ktorých karcinómy boli buď IHC3+ alebo FISH pozitívne, boli definovaní ako HER2 pozitívni, a teda boli zaradení do klinického skúšania. Na základe výsledkov klinického skúšania boli priaznivé účinky obmedzené na pacientov s najvyššou úrovňou nadmernej expresie proteínu HER2, vyjadrenou ako skóre 3+ pomocou IHC alebo ako skóre
2+ pomocou IHC a pozitívnym výsledkom FISH.
V štúdii porovnávajúcej metódy (D008548) bol pozorovaný vysoký stupeň zhody (> 95 %) medzi SISH a FISH technikami používanými na účel detekcie amplifikácie HER2 génu u pacientov s karcinómom žalúdka.
Nadmerná expresia receptora HER2 sa má stanoviť imunohistochemicky (IHC) − na základe hodnotenia fixovaných blokov s nádorom; amplifikácia génu HER2 sa má stanoviť použitím in situ hybridizácie, použitím buď SISH alebo FISH z nádoru fixovaného v blokoch.
Odporúčaný skórovací systém na vyhodnocovanie vzoriek označených imunohistochemicky je v tabuľke 3.
Tabuľka 3 Odporúčaný systém vyhodnocovania imunohistochemického farbenia pri karcinóme žalúdka
Skóre Chirurgické vzorky – spôsob
označenia
V
z
orky biopsie – spôsob označenia Hodnotenie
nadmernej expresie receptora
H
ER
2
Žiadna reaktivita alebo reaktivita
0 membrány v < 10 % nádorových buniek
Slabá/ťažko pozorovateľná
reaktivita membrány vo ≥ 10 %
1+ nádorových buniek; bunky sú
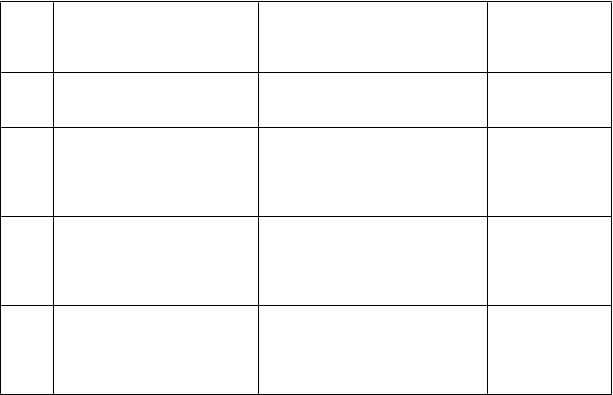
reaktívne iba v časti bunkovej
membrány
Slabá až mierna reaktivita celej,
bazolaterálnej alebo laterálnej
2+ membrány vo ≥ 10 %
nádorových buniek
Silná reaktivita celej, bazolaterálnej alebo laterálnej
3+ membrány vo ≥ 10 %
nádorových buniek
Žiadna reaktivita alebo reaktivita membrány ani v jednej nádorovej bunke
Zhluk nádorových buniek so slabou/ťažko pozorovateľnou reaktivitou membrány bez ohľadu na percento zafarbených nádorových buniek
Zhluk nádorových buniek so slabou až miernou reaktivitou celej, bazolaterálnej alebo laterálnej membrány bez ohľadu na percento zafarbených nádorových buniek
Zhluk nádorových buniek so silnou reaktivitou celej, bazolaterálnej alebo laterálnej membrány bez ohľadu na percento zafarbených nádorových buniek
Negatívny výsledok
Negatívny výsledok
Neurčitý výsledok
Pozitívny výsledok
Všeobecne sa SISH alebo FISH považuje za pozitívnu, ak pomer počtu kópií HER2 génu na nádorovú
bunku k počtu kópií chromozómu 17 je väčší ako alebo rovný 2.
Klinická účinnosťabezpečnosť
Metastatický karcinóm prsníka
V klinických skúšaniach bol trastuzumab použitý v rámci monoterapie pacientov s MKP, ktorých
nádory vykazovali nadmernú expresiu receptora HER2 a u ktorých nebol úspešný jeden alebo viac režimov chemoterapie metastatického ochorenia (samotný trastuzumab).
Trastuzumab bol tiež použitý v kombinácii s paklitaxelom alebo docetaxelom na liečbu pacientov, ktorí ešte nedostali chemoterapiu kvôli metastatickému nádorovému ochoreniu. Pacienti, ktorí boli predtým liečení adjuvantnou chemoterapiou na báze antracyklínu, boli liečení paklitaxelom
(175 mg/m2, aspoň 3-hodinová infúzia) v kombinácii s trastuzumabom alebo bez trastuzumabu. V
pivotnej štúdii s docetaxelom (100 mg/m2 aspoň 1-hodinová infúzia) s trastuzumabom alebo bez trastuzumabu dostávalo 60 % pacientov predtým adjuvantnú antracyklínovú chemoterapiu. Pacienti
boli liečení trastuzumabom až do progresie ochorenia.
Účinnosť trastuzumabu v kombinácii s paklitaxelom nebola študovaná u pacientov, ktorí predtým nedostávali adjuvantnú antracyklínovú chemoterapiu. Trastuzumab s docetaxelom bol však účinný u pacientov nezávisle od toho, či dostávali alebo nedostávali antracyklíny v adjuvancii.
Na stanovenie vhodnosti pacientov na účasť v pivotnej klinickej štúdii s trastuzumabom v monoterapii a v klinických štúdiách trastuzumabu s paklitaxelom zameraných na nadmernú expresiu receptora HER2 sa použila metóda imunohistochemického farbenia receptora HER2 vo fixovanej vzorke nádoru prsníka pomocou myších monoklonálnych protilátok CB11 a 4D5. Tkanivá sa fixovali vo formalíne alebo v Bouinovom fixačnom roztoku. Pri hodnotení výsledkov v centrálnom laboratóriu sa používala stupnica od 0 do 3+. Pacienti s intenzitou sfarbenia 2+ alebo 3+ boli zaradení do štúdie, kým pacienti s hodnotením 0 alebo 1+ boli zo štúdie vylúčení. Viac ako 70 % z pacientov zaradených do štúdie vykazovalo nadmernú expresiu 3+. Na základe zistených údajov je možné povedať, že priaznivejšie účinky liečby sa pozorovali u pacientov s vyšším stupňom nadmernej expresie receptora HER2 (3+).
Imunohistochémia bola hlavná testovacia metóda na stanovenie HER2 pozitivity v pivotnej klinickej štúdii s docetaxelom s trastuzumabom alebo bez trastuzumabu. Menšina pacientov bola testovaná použitím fluorescenčnej in-situ hybridizácie (FISH). V týchto skúškach 87 % pacientov, ktorí vstúpili do štúdie, malo ochorenie, ktoré bolo IHC3+, a 95 % pacientov, ktorí vstúpili do štúdie, malo ochorenie IHC3+ a/alebo FISH pozitívne.
Týždenné dávkovanie pri metastatickom karcinóme prsníka
V tabuľke 4 sú zhrnuté výsledky účinnosti zo štúdií v monoterapii a v kombinovanej terapii.
Tabuľka 4 Výsledky účinnosti zo štúdií v monoterapii a kombinovanej terapii
Parameter Monoterapia Kombinovaná liečba
V
yhodnotenie odpovede
(
95 % CI)
Stredná dĺžka odpovede (mesiace)
(
95 % CI)
Stredný čas TTP (mesiace) (95 % CI)
Stredná doba prežívania (mesiace)
(
95 % CI)
T
rastuzumab
1
N = 172
18 % (13 – 25)
9,1
(5,6 – 10,3)
3,2
(2,6 – 3,5)
16,4 (12,3 – ne)
Trastuzumab apaklitaxel2N = 6849 % (36 – 61)
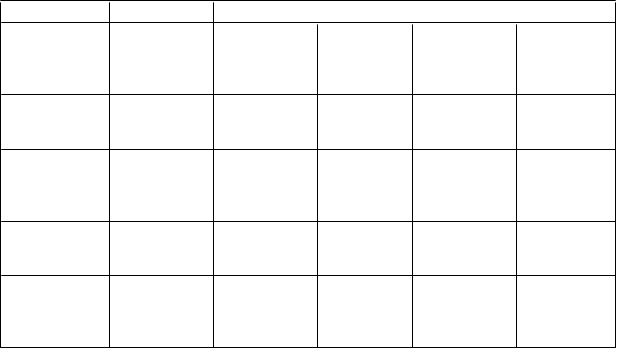
8,3
(7,3 – 8,8)
7,1
(6,2 – 12,0)
24,8 (18,6 – 33,7)
Paklitaxel2N = 7717 % (9 – 27)
4,6
(3,7 – 7,4)
3,0
(2,0 – 4,4)
17,9 (11,2 – 23,8)
Trastuzumab adocetaxel3N = 9261 % (50 – 71)
11,7
(9,3 – 15,0)
11,7
(9,2 – 13,5)
31,2 (27,3 – 40,8)
Docetaxel3N = 9434 % (25 – 45)
5,7
(4,6 – 7,6)
6,1
(5,4 – 7,2)
22,74 (19,1 – 30,8)
TTP = čas trvajúci do progresie, „ne“ – nebolo možné určiť alebo ešte pokračuje
1 Štúdia H0649g: IHC3+ podsúbor pacientov
2 Štúdia H0648g: IHC3+ podsúbor pacientov
3 Štúdia M77001: Plne analyzovaný súbor (zameraný na liečbu), výsledky po 24 mesiacoch
Kombinovaná liečba s trastuzumabom a anastrozolom
Trastuzumab sa študoval v kombinácii s anastrozolom v prvej línii liečby MKP s nadmernou expresiou HER2 a s pozitivitou hormonálneho receptora (t. j. pacienti s pozitivitou estrogénového receptora (ER) a/alebo progesterónového receptora (PR)). Prežívanie bez progresie bolo dvojnásobné v skupine trastuzumab plus anastrozol v porovnaní s anastrozolom samotným (4,8 mesiaca oproti 2,4 mesiaca). Iné parametre ukazujúce zlepšenie pri kombinácii boli celková odpoveď (16,5 % oproti
6,7 %); klinický prínos (42,7 % oproti 27,9 %); čas do progresie (4,8 mesiaca oproti 2,4 mesiaca).
Nebol zaznamenaný žiadny rozdiel medzi skupinami, pokiaľ ide o odpoveď a trvanie odpovede. Medián celkového prežívania bol predĺžený na 4,6 mesiaca u pacientov v skupine s kombinovanou liečbou. Rozdiel nebol štatisticky významný, ale viac ako polovica pacientov v skupine so samotným anastrozolom po progresii choroby prešla na režim s trastuzumabom.
Trojtýždenné dávkovanie pri MKP
V tabuľke 5 sú zhrnuté výsledky účinnosti z nekomparatívnych štúdií v monoterapii a v kombinovanej
terapii:
Tabuľka 5 Výsledky účinnosti z nekomparatívnych štúdií v monoterapii a v kombinovanej
terapii
Parameter Monoterapia Kombinovaná liečba
V
yhodnotenie odpovede
(
95 % CI)
Stredná dĺžka odpovede (mesiace) (rozsah)
Stredný čas TTP (mesiace) (95 % CI)
Trastuzumab
1
N = 105
24 % (15 – 35)
10,1
(2,8 – 35,6)
3,4
(2,8 – 4,1)
Trastuzumab2
N = 72
27 % (14 – 43)
7,9
(2,1 – 18,8)
7,7
(4,2 – 8,3)
Trastuzumab a paklitaxel3
N = 32
59 % (41 – 76)
10,5 (1,8 – 21)
12,2 (6,2 – ne)
Trastuzumab a docetaxel4
N = 110
73 % (63 – 81)
13,4
(2,1 – 55,1)
13,6 (11 – 16)
Stredná doba prežívania (mesiace)
(
95 % CI)
ne ne ne 47,3 (32 – ne)
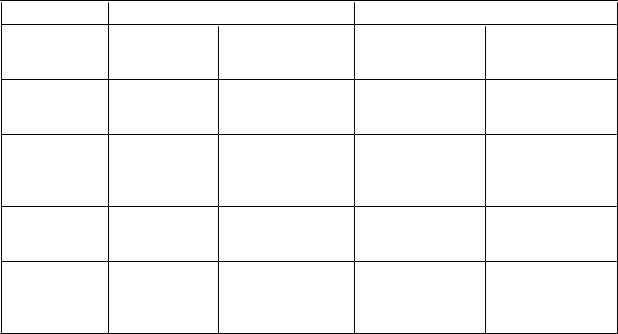
TTP = čas trvajúci do progresie, „ne“ – nebolo možné určiť alebo ešte pokračuje
1 Štúdia WO16229: úvodná dávka 8 mg/kg telesnej hmotnosti, pokračuje v 3-týždňových intervaloch dávkou
6 mg/kg telesnej hmotnosti
2 Štúdia MO16982: úvodná dávka 6 mg/kg telesnej hmotnosti týždenne x 3; pokračuje v 3-týždňových
intervaloch dávkou 6 mg/kg telesnej hmotnosti
3 Štúdia BO15935
4 Štúdia MO16419
Miesta progresie ochoreniaU pacientov liečených trastuzumabom v kombinácii s paklitaxelom sa v porovnaní s pacientmi
liečenými samotným paklitaxelom významne znížil výskyt progresie ochorenia do pečene (21,8 %
oproti 45,7 %; p = 0,004). Progresia ochorenia do centrálneho nervového systému bola častejšia u pacientov liečených trastuzumabom a paklitaxelom ako u pacientov liečených samotným paklitaxelom (12,6 % oproti 6,5 %, p = 0,377).
Včasný kar ci nóm prs ní ka (adj uvant ná li eč ba)
VKP sa definuje ako nemetastatický primárny invazívny karcinóm prsníka.
Trastuzumab použitý v adjuvantnej terapii sa skúmal v 4 rozsiahlych multicentrických randomizovaných štúdiách.
- Štúdia BO16348 bola zameraná na porovnanie jednoročnej a dvojročnej liečby trastuzumabom, ktorý sa podával každé tri týždne, oproti pozorovaniu u pacientov s VKP s pozitivitou HER2 po
operácii, overenej chemoterapii a rádioterapii (ak je to aplikovateľné). Navyše sa vykonalo
porovnanie liečby trastuzumabom po dobu dvoch rokov oproti liečbe trastuzumabom po dobu jedného roka. Pacienti randomizovaní na liečbu trastuzumabom dostali úvodnú nasycovaciu
dávku 8 mg/kg, po ktorej dostávali dávku 6 mg/kg každé tri týždne buď počas jedného roka
alebo dvoch rokov.
- Štúdie NSABP B-31 a NCCTG N9831, ktoré obsahovali aj spojenú analýzu (tzv. joint analysis) boli zamerané na zhodnotenie klinického významu kombinovanej liečby trastuzumabom s paklitaxelom po AC chemoterapii; okrem toho sa v štúdii NCCTG N9831 hodnotilo sekvenčné podanie trastuzumabu po chemoterapii AC→P u pacientov s VKP s pozitivitou HER2 po operácii.
- Štúdia BCIRG 006 bola zameraná na preskúmanie kombinovanej liečby trastuzumabom s docetaxelom buď následne po AC chemoterapii alebo v kombinácii s docetaxelom a karboplatinou u pacientov s VKP s pozitivitou HER2 po operácii.
V klinickom skúšaní HERA bol VKP definovaný ako operabilný, primárny, invazívny adenokarcinóm
prsníka s pozitívnymi alebo negatívnymi axilárnymi uzlinami, ak bol priemer nádoru minimálne 1 cm.
V spojenej analýze štúdií NSABP B-31 a NCCTG N9831 bol včasný karcinóm prsníka definovaný na pacientky s operabilným karcinómom prsníka s vysokým rizikom, definovaným ako pozitivita HER2 a pozitívna axilárna lymfatická uzlina alebo pozitivita HER2 a negatívna lymfatická uzlina so známkami vysokého rizika (veľkosť nádoru > 1 cm a negativita ER alebo veľkosť nádoru > 2 cm, bez ohľadu na hormonálny status).
V štúdii BCIRG 006 VKP s pozitivitou HER2 bol definovaný buď ako pozitívna lymfatická uzlina alebo ako vysokorizikové pacientky s negatívnou lymfatickou uzlinou (bez postihnutia lymfatických uzlín (pN0) a najmenej 1 z nasledujúcich faktorov: veľkosť nádoru viac než 2 cm, negativita estrogénového a progesterónového receptora, histologický stupeň a/alebo jadrový stupeň 2 – 3 alebo vek < 35 rokov).
Výsledky účinnosti zo štúdie BO16348 po mediáne sledovania 12 mesiacov* a 8 rokov** sú zhrnuté v tabuľke 6:
Tabuľka 6 Výsledky účinnosti zo štúdie BO16348
M
edián sledovania
1
2 mesiacov*
M
edián sledovania
8 rokov**
Parameter Pozorovanie
N = 1 693
Prežívanie bez prejavov ochorenia
Trastuzumab
1 rok
N = 1 693
Pozorovanie
N = 1 697***
Trastuzumab
1 rok
N = 1 702***
- Počet pacientov s príhodou
- Počet pacientov bez príhody
219 (12,9 %)
1 474 (87,1 %)
127 (7,5 %)
1 566 (92,5 %)
570 (33,6 %)
1 127 (66,4 %)
471 (27,7 %)
1 231 (72,3 %)
Hodnota p oproti pozorovaniu
Pomer rizík oproti pozorovaniu
Prežívanie bez recidívy
< 0,0001
0,54
< 0,0001
0,76
- Počet pacientov s príhodou
- Počet pacientov bez príhody
208 (12,3 %)
1 485 (87,7 %)
113 (6,7 %)
1 580 (93,3 %)
506 (29,8 %)
1 191 (70,2 %)
399 (23,4 %)
1 303 (76,6 %)

Hodnota p oproti pozorovaniu
Pomer rizík oproti pozorovaniu
< 0,0001
0,51
< 0,0001
0,73
M
edián sledovania
1
2 mesiacov*
M
edián sledovania
8 rokov**
Parameter Pozorovanie
N = 1 693
Prežívanie bez vzdialených
metastáz
Trastuzumab
1 rok
N = 1 693
Pozorovanie
N = 1 697***
Trastuzumab
1 rok
N = 1 702***
- Počet pacientov s príhodou
- Počet pacientov bez príhody
184 (10,9 %)
1 508 (89,1 %)
99 (5,8 %)
1 594 (94,6 %)
488 (28,8 %)
1 209 (71,2 %)
399 (23,4 %)
1 303 (76,6 %)
Hodnota p oproti pozorovaniu
Pomer rizík oproti pozorovaniu
Celkové prežívanie (úmrtie)
< 0,0001
0,50
< 0,0001
0,76
- Počet pacientov s príhodou
- Počet pacientov bez príhody
40 (2,4 %)
1 653 (97,6 %)
31 (1,8 %)
1 662 (98,2 %)
350 (20,6 %)
1 347 (79,4 %)
278 (16,3 %)
1 424 (83,7 %)
Hodnota p oproti pozorovaniu
Pomer rizík oproti pozorovaniu
0,24
0,75
0,0005
0,76
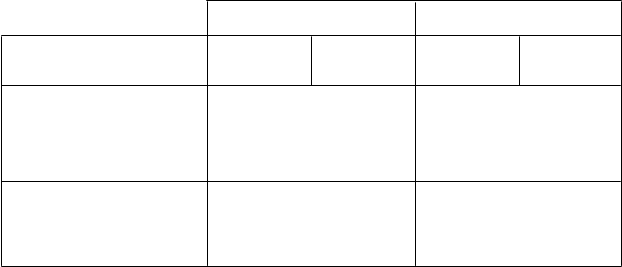
*Spoločný primárny cieľ prežívania bez prejavov ochorenia pri liečbe 1 rok oproti pozorovaniu dosiahol preddefinovanú
štatistickú hodnotu.
**Záverečná analýza (vrátane prechodu 52 % pacientov z pozorovania do skupiny liečby trastuzumabom).
*** Je nesúlad v celkovej veľkosti hodnotenej vzorky kvôli nízkemu počtu pacientov, ktorí boli randomizovaní po dátume
„cut-off“ analýzy pri mediáne sledovania 12 mesiacov.
Účinnosť z predbežnej analýzy prekročila protokolom predšpecifikovanú štatistickú hodnotu pre porovnanie 1-ročnej liečby trastuzumabom oproti pozorovaniu. Pri mediáne sledovania 12 mesiacov bol pomer rizík (HR) 0,54 (95 % CI 0,44; 0,67) pre prežívanie bez prejavov ochorenia, ktorý je interpretovaný z hľadiska 2-ročného prežívania bez prejavov ochorenia ako absolútny prínos
7,6 percentuálneho bodu (85,8 % oproti 78,2 %) v prospech skupiny s trastuzumabom.
Finálna analýza bola vykonaná pri mediáne sledovania 8 rokov a ukázala, že jeden rok liečby
trastuzumabom je spojený s 24 % znížením rizika v porovnaní so samotnou observáciou (HR = 0,76,
95 % CI 0,67, 0,86). Pri 8-ročnom prežívaní bez prejavov ochorenia sa to premieta do absolútneho
prínosu 6,4 percentuálneho bodu v prospech 1-ročnej liečby trastuzumabom.
V tejto záverečnej analýze predĺženie liečby trastuzumabom na dva roky nepreukázalo ďalší prínos oproti jednoročnej liečbe [HR pre prežívanie bez prejavov ochorenia v ITT (intent to treat) populácii 2 roky oproti 1 roku = 0,99 (95 % CI: 0,87; 1,13), p-hodnota = 0,90 a HR pre celkové
prežívanie = 0,98 (0,83; 1,15), p-hodnota = 0,78]. Výskyt asymptomatickej srdcovej dysfunkcie sa
zvýšil v skupine s 2-ročnou liečbou (8,1 % oproti 4,6 % v skupine s 1-ročnou liečbou). Viac pacientov
v skupine s 2-ročnou liečbou malo aspoň jednu nežiaducu reakciu stupňa 3 alebo 4 (20,4 %)
v porovnaní so skupinou s 1-ročnou liečbou (16,3 %).
V štúdiách NSABP B-31 a NCCTG N9831 sa trastuzumab podával v kombinácii s paklitaxelom po
AC chemoterapii.
Doxorubicín a cyklofosfamid boli podávané súbežne takto:
- intravenózny doxorubicín, 60 mg/m2, podávaný každé 3 týždne v 4 cykloch,
- intravenózny cyklofosfamid, 600 mg/m2, viac ako 30 minút, podávaný každé 3 týždne
v 4 cykloch.
Paklitaxel v kombinácii s trastuzumabom bol podávaný takto:
- intravenózny paklitaxel – 80 mg/m2 v kontinuálnej intravenóznej infúzii podávanej každý týždeň po obdobie 12 týždňov
alebo
- intravenózny paklitaxel – 175 mg/m2 v kontinuálnej intravenóznej infúzii podávanej každé
3 týždne v 4 cykloch (v 1. deň každého cyklu).
Výsledky účinnosti zo spojenej analýzy klinických štúdií NSABP B-31 a NCCTG N9831 v čase definitívnej analýzy DFS* sú zhrnuté v tabuľke 7. Medián ďalšieho sledovania bol 1,8 roka u pacientov v skupine AC→P a 2,0 roka u pacientov v skupine AC→PH.
Tabuľka 7 Súhrn výsledkov účinnosti zo spoločnej analýzy štúdií NSABP B-31 a NCCTG N9831
v čase definitívnej analýzy DFS*
P
arameter AC→P
(
n = 1 679)
Prežívanie bez prejavov ochorenia
AC→PH
(n = 1 672)
Pomer rizík oproti
AC→P (95 % CI)
p-hodnota
Počet pacientov s príhodou (%)
Vzdialená recidíva
Počet pacientov
Úmrtie (príhoda OS)
Počet pacientov s príhodou
261 (15,5)
193 (11,5)
92 (5,5)
133 (8,0)
96 (5,7)
62 (3,7)
0,48 (0,39; 0,59)
p < 0,0001
0,47 (0,37; 0,60)
p < 0,0001
0,67 (0,48; 0,92)
p = 0,014**
A: doxorubicín; C: cyklofosfamid; P: paklitaxel; H: trastuzumab
* pri mediáne ďalšieho sledovania 1,8 roka u pacientov v skupine AC→P a 2,0 roka u pacientov v skupine
AC→PH
** p-hodnota pre OS neprekročila predurčenú štatistickú hranicu na porovnanie AC→PH oproti AC→P
Pre primárny cieľový ukazovateľ, prežívanie bez prejavov ochorenia, pridanie trastuzumabu ku chemoterapii paklitaxelom znížilo riziko recidívy ochorenia o 52 %. Pomer rizík sa premieta do absolútneho prínosu 3-ročného prežívania bez prejavov ochorenia 11,8 percentuálneho bodu (87,2 % oproti 75,4 %) v prospech skupiny s AC→PH (trastuzumabom).
V čase aktualizácie údajov o bezpečnosti po mediáne 3,5 – 3,8 roka ďalšieho sledovania analýza DFS opätovne potvrdila jeho prínos preukázaný v definitívnej analýze. Napriek „cross-over“ na trastuzumab v kontrolnej skupine viedlo pridanie trastuzumabu k chemoterapii paklitaxelom k 52 % zníženiu rizika návratu ochorenia. Pridanie trastuzumabu k chemoterapii paklitaxelom tiež viedlo k'
37 % zníženiu rizika úmrtia.
Plánovaná finálna analýza OS zo spoločnej analýzy štúdií NSABP B-31 a NCCTG N9831 bola vykonaná po 707 úmrtiach (medián sledovania 8,3 roka v skupine AC→PH). V skupine AC→PH sa dosiahlo štatisticky významné zlepšenie OS v porovnaní s AC→P (stratifikovaný HR = 0,64; 95 % CI
[0,55; 0,74]; log-rank p-hodnota < 0,0001). Po 8 rokoch bolo odhadované prežívanie 86,9 % v skupine
AC→PH a 79,4 % v skupine AC→P, s absolútnym rozdielom 7,4 % (95 % CI 4,9 %; 10,0 %).
Finálne výsledky OS zo spoločnej analýzy štúdií NSABP B-31 a NCCTG N9831 sú zhrnuté v tabuľke
8:
Tabuľka 8 Finálna analýza celkového prežívania zo spoločnej analýzy štúdií NSABP B-31 a
NCCTG N9831
P
arameter AC→P
 (
N = 2 032)
(
N = 2 032)
Úmrtie (OS udalosť):
AC→PH(N = 2 031)p-hodnotaoprotiAC→PPomer rizíkoprotiAC→P(95 % CI)
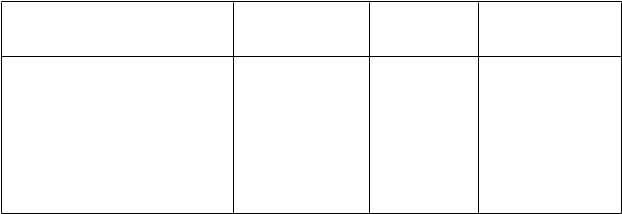
Počet pacientov s príhodou (%) 418 (20,6 %) 289 (14,2 %) < 0,0001 0,64 (0,55; 0,74)
A: doxorubicín; C: cyklofosfamid; P: paklitaxel; H: trastuzumab
Analýza DFS bola tiež vykonaná pri finálnej analýze OS zo spoločnej analýzy štúdií NSABP B-31 a
NCCTG N9831. Aktualizované výsledky analýzy DFS (stratifikované HR = 0,61; 95 % CI [0,54;
0,69]) potvrdili podobný prínos DFS porovnateľný s definitívnou primárnou analýzou DFS, a to napriek 24,8 % pacientov v skupine AC → P, ktorí prešli na trastuzumab. Po 8 rokoch bolo odhadované prežívanie bez známok ochorenia 77,2 % (95 % CI: 75,4; 79,1) v skupine AC→PH, s absolútnym prínosom 11,8 % v porovnaní so skupinou AC→P.
V štúdii BCIRG 006 sa trastuzumab podával buď v kombinácii s docetaxelom po AC chemoterapii
(AC→DH) alebo v kombinácii s docetaxelom a karboplatinou (DCarbH).
Docetaxel sa podával takto:
- intravenózny docetaxel 100 mg/m2 ako 1-hodinová intravenózna infúzia podávaná každé
3 týždne v 4 cykloch (v deň 2 prvého cyklu a v deň 1 každého nasledujúceho cyklu)
alebo
- intravenózny docetaxel – 75 mg/m2 ako 1-hodinová intravenózna infúzia podávaná každé
3 týždne v 6 cykloch (v deň 2 prvého cyklu, v deň 1 každého nasledujúceho cyklu);
po čom nasledovala:
- karboplatina – v cieľovej hodnote AUC = 6 mg/ml/min, podávaná v intravenóznej infúzii počas
30 – 60 minút, opakovane každé 3 týždne, celkovo v šiestich cykloch.
Trastuzumab sa podával raz týždenne s chemoterapiou a následne každé 3 týždne, celkovo počas 52
týždňov.
Výsledky účinnosti zo štúdie BCIRG 006 sú zhrnuté v tabuľkách 9 a 10. Medián ďalšieho sledovania
bol 2,9 roka v AC→D skupine a 3,0 roka v skupinách AC→DH a DCarbH.
Tabuľka 9 Prehľad analýz účinnosti v štúdii BCIRG 006 AC→D oproti AC→DH
P
arameter AC→D
(
N = 1 073)
Prežívanie bez prejavov ochorenia
AC→DH
(N = 1 074)
Pomer rizík
oproti AC→D
(95 % CI)
p-hodnota
Počet pacientov s príhodou 195 134 0,61 (0,49; 0,77)
p < 0,0001
Vzdialená recidíva
Počet pacientov s príhodou 144 95 0,59 (0,46; 0,77)
p < 0,0001
Celkové prežívanie (úmrtie)
Počet pacientov s príhodou 80 49 0,58 (0,40; 0,83)
p = 0,0024
AC→D = doxorubicín plus cyklofosfamid, po ktorých nasleduje docetaxel; AC→DH = doxorubicín plus cyklofosfamid, po ktorých nasleduje docetaxel plus trastuzumab; CI = interval spoľahlivosti
T
abuľka 10 Prehľad analýz účinnosti v štúdii BCIRG 006 AC→D oproti DCarbH
P
arameter AC→D
(
N = 1 073)
Prežívanie bez prejavov ochorenia
DCarbH
(N = 1 074)
Pomer rizík oproti
AC→D
(95 % CI)
Počet pacientov s príhodou 195 145 0,67 (0,54; 0,83)
p = 0,0003
Vzdialená recidíva
Počet pacientov s príhodou 144 103 0,65 (0,50; 0,84)
p = 0,0008
Úmrtie (príhoda OS)
Počet pacientov s príhodou 80 56 0,66 (0,47; 0,93)
p = 0,0182
AC→D = doxorubicín plus cyklofosfamid, po ktorých nasleduje docetaxel; DCarbH = docetaxel, karboplatina a trastuzumab; CI = interval spoľahlivosti
V klinickej štúdii BCIRG 006 pre primárny cieľový ukazovateľ, DFS (prežívanie bez prejavov ochorenia), sa pomer rizík premieta do absolútneho prínosu 3-ročného prežívania bez prejavov ochorenia 5,8 percentuálneho bodu (86,7 % oproti 80,9 %) v prospech skupiny s AC→DH (trastuzumabom) a 4,6 percentuálneho bodu (85,5 % oproti 80,9 %) v prospech skupiny s DCarbH (trastuzumabom) v porovnaní s AC → D.
V klinickej štúdii BCIRG 006 malo 213/1 075 pacientov v skupine DCarbH (TCH), 221/1 074 pacientov v skupine AC → DH (AC → TH) a 217/1 073 v skupine AC → D (AC → T) stav výkonnosti podľa Karnofského ≤ 90 (buď 80 alebo 90). V tejto podskupine pacientov nebol zaznamenaný žiaden prínos prežívania bez prejavov ochorenia (DFS) (pomer rizík = 1,16; 95 % CI
[0,73; 1,83] v DCarbH (TCH) oproti AC → D (AC → T), pomer rizík 0,97; 95 % CI [0,60; 1,55], v
AC → DH (AC → TH) oproti AC → D).
V ďalšej post-hoc exploračnej analýze bola uskutočnená združená analýza súboru údajov z klinických štúdií NSABP B-31/NCCTG N9831* a BCIRG 006 spájajúcich DFS príhody a symptomatické srdcové príhody, ktoré sú zhrnuté v tabuľke 11.
Tabuľka 11 Výsledky post-hoc exploračnej analýzy z klinických štúdií NSABP B-
31/NCCTG N9831* a BCIRG 006 spájajúcich DFS príhody a symptomatické srdcové príhody


Primárna analýza účinnosti
DFS Pomer rizík
(95 % CI)
p-hodnota
Analýza účinnosti dlhodobého následného sledovania (follow-up)** DFS Pomer rizík
(95 % CI)
p-hodnota
AC→PH(oproti AC→P) (NSABP B-31 a NCCTG N9831)*0,48 (0,39; 0,59) p < 0,0001
0,61 (0,54; 0,69) p < 0,0001
AC→DH(oproti AC→D) (BCIRG 006)0,61 (0,49; 0,77) p < 0,0001
0,72 (0,61; 0,85) p < 0,0001
DCarbH(oproti AC→D) (BCIRG 006)0,67 (0,54; 0,83) p = 0,0003
0,77 (0,65; 0,90) p = 0,0011
Post-hoc exploračná analýza s DFS a symptomatickými kardiálnymi príhodami
Dlhodobé následné sledovanie follow-up**
Pomer rizík
(95 % CI)
AC→PH (oproti AC→P) (NSABP B-31 a NCCTG N9831)*
0,67 (0,60; 0,75)
AC→DH (oproti AC→D) (BCIRG 006)
0,77 (0,66; 0,90)
DCarbH (oproti AC→D) (BCIRG 006)
0,77 (0,66; 0,90)

A: doxorubicín; C: cyklofosfamid; P: paklitaxel; D: docetaxel; Carb: karboplatina; H: trastuzumab CI = interval
spoľahlivosti
* V čase definitívnej analýzy DFS. Medián ďalšieho sledovania bol 1,8 roka u pacientov v skupine
AC→P a 2,0 roka u pacientov v skupine AC→PH.
** Medián trvania dlhodobého následného sledovania v spojenej analýze klinických štúdií bol u pacientov v skupine AC→PH 8,3 roka (rozsah 0,1 až 12,1) a 7,9 roka (rozsah 0,0 až 12,2) v skupine AC→P; medián trvania dlhodobého následného sledovania v štúdii BCIRG 006 bol 10,3 roka v skupine AC→D (rozsah 0,0 – 12,6) aj v skupine DCarbH (rozsah 0,0 – 13,1) a 10,4 roka (rozsah 0,0 – 12,7) v skupine AC→DH.
Včasný kar ci nóm prs ní ka (neoadjuvant ná-adjuvant ná l i ečba)Zatiaľ nie sú dostupné výsledky porovnávajúce účinnosť trastuzumabu podávaného s chemoterapiou v
adjuvantnej liečbe s výsledkami získanými v neoadjuvantnej/adjuvantnej liečbe.
V neoadjuvantnej-adjuvantnej liečbe bola štúdia MO16432, multicentrické randomizované klinické skúšanie, navrhnutá na skúmanie klinickej účinnosti súbežného podávania trastuzumabu s neoadjuvantnou chemoterapiou vrátane antracyklínu aj taxánu, po ktorých nasledovalo adjuvantné podávanie trastuzumabu, až do celkového trvania liečby 1 rok. Do štúdie boli zaradení pacienti s novodiagnostikovaným lokálne pokročilým (štádium III) alebo inflamatórnym VKP. Pacienti s HER2+ nádormi boli randomizovaní tak, aby dostávali buď neoadjuvantnú chemoterapiu súčasne s neoadjuvantnou-adjuvantnou liečbou trastuzumabom alebo samotnú neoadjuvantnú chemoterapiu.
V štúdii MO16432 sa trastuzumab (nasycovacia dávka 8 mg/kg nasledovaná udržiavacou dávkou
6 mg/kg každé 3 týždne) podával súbežne s 10 cyklami neoadjuvantej chemoterapie takto:
• doxorubicín 60 mg/m2 a paklitaxel 150 mg/m2 podávané každé 3 týždne počas 3 cyklov,
po ktorých nasledoval
• paklitaxel 175 mg/m2 podávaný každé 3 týždne počas 4 cyklov,
po ktorých nasledovalo
• CMF (cyklofosfamid/metotrexát/fluóruracil) v 1. a 8. deň každé 4 týždne počas 3 cyklov,
po ktorých po operácii nasledovalo
• podávanie ďalších cyklov adjuvantného trastuzumabu (na dokončenie 1 roka liečby).
Výsledky účinnosti zo štúdie MO16432 sú zhrnuté v tabuľke 12. Medián trvania následného sledovania v skupine s trastuzumabom bol 3,8 roka.
T
abuľka 12 Výsledky účinnosti zo štúdie MO16432
P
arameter Chemo +
t
rastuzumab
(
n = 115)
Prežívanie bez príhody
Len chemo
(n = 116)
Pomer rizík
(95 % CI)
Počet pacientov s príhodou 46 59
0,65 (0,44; 0,96)
p = 0,0275
Celková patologická kompletná
odpoveď* (95 % CI)
Celkové prežívanie
40 % (31,0; 49,6)
20,7 % (13,7; 29,2)
p = 0,0014
Pomer rizík
(95 % CI)
Počet pacientov s príhodou 22 33
* definovaná ako žiadny invazívny karcinóm v prsníku a axilárnych uzlinách
0,59 (0,35; 1,02)
p = 0,0555

Absolútny prínos 13 percentuálnych bodov v prospech skupiny s trastuzumabom bol odhadovaný z
hľadiska 3-ročného prežívania bez príhody (65 % oproti 52 %).
M etastati cký k arc inóm žal údkaTrastuzumab sa skúmal v randomizovanom, otvorenom klinickom skúšaní fázy III ToGA (BO18255)
v kombinácii s chemoterapiou oproti chemoterapii samotnej.
Chemoterapia sa podávala takto:
- kapecitabín – 1 000 mg/m2 perorálne dvakrát denne počas 14 dní každé tri týždne, 6 cyklov (od večera 1. dňa do rána 15. dňa každého cyklu)
alebo
- intravenózne 5-fluóruracil – 800 mg/m2/deň vo forme kontinuálnej intravenóznej infúzie počas
5 dní, podávanej každé 3 týždne, 6 cyklov (1. až 5. deň každého cyklu). Každý druh chemoterapie sa podával spolu:
- s cisplatinou – 80 mg/m2 každé 3 týždne, 6 cyklov, v 1. deň každého cyklu. Výsledky účinnosti z klinickej štúdie BO18225 sú zhrnuté v tabuľke 13:
T
abuľka 13 Výsledky účinnosti z klinickej štúdie BO18225
P
arameter FP
 N = 290
FP + H
N = 294
P
o
m
er rizík
(
95 % CI)
p-hodnota
N = 290
FP + H
N = 294
P
o
m
er rizík
(
95 % CI)
p-hodnota
Celkové prežívanie, medián v mesiacoch 11,1 13,8 0,74 (0,60 – 0,91) 0,0046
Prežívanie bez progresie ochorenia,
medián v mesiacoch
Čas do progresie ochorenia, medián v
mesiacoch
5,5 6,7 0,71 (0,59 – 0,85) 0,0002
5,6 7,1 0,70 (0,58 – 0,85) 0,0003
Celkový počet odpovedí, % 34,5 % 47,3 % 1,70a (1,22; 2,38) 0,0017
Trvanie odpovede, medián v mesiacoch 4,8 6,9 0,54 (0,40 – 0,73) < 0,0001
FP + H: fluórpyrimidín/cisplatina + trastuzumab
FP: fluórpyrimidín/cisplatina
a Pomer pravdepodobnosti
Do klinického skúšania boli zaradení pacienti, ktorí neboli predtým liečení pre HER2-pozitívny inoperabilný lokálne pokročilý alebo rekurentný a/alebo metastatický adenokarcinóm žalúdka alebo gastroezofageálneho spojenia a neboli vhodní na kuratívnu liečbu. Primárnym koncovým ukazovateľom bolo celkové prežívanie, ktoré bolo definované ako čas od dátumu randomizácie do dátumu úmrtia z akejkoľvek príčiny. V čase analýzy zomrelo celkovo 349 randomizovaných pacientov: 182 pacientov (62,8 %) v kontrolnej skupine a 167 pacientov (56,8 %) v liečebnej skupine. Väčšina úmrtí súvisela so základným nádorovým ochorením.
Post-hoc analýzy podskupín naznačujú, že pozitívne liečebné účinky sú obmedzené na tumory s vyššou hladinou HER2 proteínu (IHC 2+/FISH+ alebo IHC 3+). Medián celkového prežívania v skupine s vysokou expresiou receptora HER2 bol 11,8 mesiaca oproti 16 mesiacom, HR 0,65
(95 % CI 0,51 – 0,83) a medián prežívania bez známok ochorenia bol 5,5 mesiaca oproti 7,6 mesiaca, HR 0,64 (95 % CI 0,51 − 0,79) pri FP oproti FP + H v tomto poradí. Pri celkovom prežívaní bol HR
0,75 (95 % CI 0,51 − 1,11) v skupine IHC 2+/FISH+ a v skupine IHC 3+/FISH bol HR 0,58 (95 % CI 0,41 − 0,81).
V exploračnej analýze podskupiny, ktorá sa uskutočnila v klinickom skúšaní TOGA (BO18255), sa
nezistil zjavný benefit na celkové prežívanie pri pridaní trastuzumabu do liečby pacientom s ECOG PS
2 pri zaradení do štúdie [HR 0,96 (95 % CI 0,51 − 1,79), s nemerateľným ochorením [HR 1,78 (95 % CI 0,87 − 3,66)] a lokálne pokročilým ochorením [HR 1,20 (95 % CI 0,29 − 4,97)].
Pediatrická populácia
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií s trastuzumabom vo
všetkých vekových podskupinách pediatrickej populácie pre karcinóm prsníka a žalúdka (informácie o
použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Farmakokinetika trastuzumabu sa hodnotila analýzou populačného farmakokinetického modelu za použitia skupiny údajov od 1 582 subjektov vrátane pacientov s HER2 pozitívnym MKP, VKP, MKŽ a iných typov karcinómov a zdravých dobrovoľníkov v 18 klinických skúšaniach fázy I, II a III
s trastuzumabom intravenózne. Dvojkompartmentový model s paralelnou lineárnou a nelineárnou elimináciou z centrálneho kompartmentu popísal profil trastuzumabu koncentrácia-čas. Pre nelineárnu elimináciu sa celkový klírens zvýšil pri znížených koncentráciách. Z toho dôvodu nemôže byť vyvodená hodnota konštanty biologického polčasu trastuzumabu. T1/2 sa znižuje so znižujúcimi sa koncentráciami v rámci dávkovacieho intervalu (pozri tabuľku 16). Pacienti s MKP a VKP mali podobné farmakokinetické parametre (napr. klírens (CL), objem centrálneho kompartmentu (Vc))
a predpokladané populačné expozície v rovnovážnom stave (Cmin, Cmax a AUC). Lineárny klírens pre
MKP bol 0,136 l/deň; 0,112 l/deň pre VKP a 0,176 l/deň pre MKŽ. Nelineárne hodnoty parametrov
eliminácie pre MKP, VKP a MKŽ pacientov boli 8,81 mg/deň pre maximálnu mieru eliminácie (Vmax)
a 8,92 µg/ml pre konštantu Michaelis-Menten (Km). Objem centrálnych kompartmentov bol 2,62 l pre pacientov s MKP a VKP a 3,63 l pre pacientov s MKŽ. Vo finálnych populačných FK modeloch boli okrem primárneho typu karcinómu ako štatisticky signifikantné kovariáty ovplyvňujúce expozíciu trastuzumabu navyše identifikované telesná hmotnosť, sérová aspartát-aminotransferáza a albumín. Magnitúda účinku týchto kovariátov na expozíciu trastuzumabu však v každom prípade poukazuje na to, že je nepravdepodobné, aby tieto kovariáty mali klinicky významný účinok na koncentrácie trastuzumabu.
Predpokladané populačné FK hodnoty expozície (stredná hodnota s 5. – 95. percentilami) a FK hodnoty parametrov pri klinicky relevantných koncentráciách (Cmax a Cmin) pre pacientov s MKP, VKP a MKŽ liečených schváleným dávkovacím režimom q1w (raz týždenne) a q3w (raz za tri týždne) sú zobrazené v tabuľke 14 (cyklus 1), v tabuľke 15 (rovnovážny stav) a v tabuľke 16 (FK parametre) nižšie.
Tabuľka 14 FK hodnoty expozície (stredná hodnota s 5. – 95. percentilami) pre trastuzumab intravenózne v predpokladanom populačnom cykle 1, dávkovací režim u pacientov s MKP, VKP a MKŽ
R
ežim Primárny typ
karcinómu
N C
m
i
n
(
µg/ml)
C
m
a
x
(
µg/ml)
AU
C
0-21 dní
(
µg.deň/ml)

8 mg/kg +
6 mg/kg q3w
4 mg/kg +
2 mg/kg qw
MKP 805 28,7
(2,9 – 46,3)
VKP 390 30,9 (18,7 – 45,5)
MKŽ 274 23,1
(6,1 – 50,3)
MKP 805 37,4
(8,7 – 58,9)
VKP 390 38,9 (25,3 – 58,8)
182 (134 – 280)
176 (127 – 227)
132 (84,2 – 225)
76,5 (49,4 – 114)
76,0 (54,7 – 104)
1 376 (728 – 1 998)
1 390 (1039 – 1 895)
1 109 (588 – 1 938)
1 073 (597 – 1 584)
1 074 (783 – 1 502)
T
abuľka 15 FK hodnoty expozície pre rovnovážny stav (stredná hodnota s 5. – 95. percentilami)
pre trastuzumab intravenózne, dávkovací režim u pacientov s MKP, VKP a MKŽ
R
ežim Primárny
t
yp karcinómu
N C
m
i
n
,ss
*
(
µg/ml)
C
m
a
x
,ss
**
(
µg/ml)
AUC
ss
, 0-21 dní
(
µg.deň/ml)
Č
as do
rovnovážne ho stavu
***
(t
ýždeň)
8 mg/kg +
6 mg/kg q3w
MKP 805 44,2
(1,8 – 85,4)
VKP 390 53,8 (28,7 – 85,8)
MKŽ 274 32,9
179
(123 – 266)
184 (134 – 247)
131
1 736
(618 – 2 756) 12
1 927
(1 332 – 2 771) 15
1 338
(6,1 – 88,9)
(72,5 – 251)
(557 – 2 875) 9
4 mg/kg +
2 mg/kg
MKP 805
63,1
(11,7 – 107)
107
(54,2 – 164)
1 710
(581 – 2 715) 12
qw VKP 390 72,6
(46 – 109)
115
(82,6 – 160)
1 893
(1 309 – 2 734) 14
*Cmin,ss – Cmin v rovnovážnom stave
**Cmax,ss = Cmax v rovnovážnom stave
*** čas do 90 % rovnovážneho stavu
Tabuľka 16 Predpokladané populačné FK hodnoty pri rovnovážnom stave trastuzumabu intravenózne, dávkovací režim u pacientov s MKP, VKP a MKŽ
R
ežim Primárny
t
yp karcinómu
N Celkové CL rozsah z
C
m
a
x
,s
s
do C
m
i
n
,s
s
(
l
/
deň)
R
ozsah t
1/2
z C
m
a
x
,s
s
do
C
m
i
n
,s
s
(
deň)
8 mg/kg +
6 mg/kg q3w
4 mg/kg +
2 mg/kg qw
MKP 805 0,183 – 0,302 15,1 – 23,3
VKP 390 0,158 – 0,253 17,5 – 26,6
MKŽ 274 0,189 – 0,337 12,6 – 20,6
MKP 805 0,213 – 0,259 17,2 – 20,4
VKP 390 0,184 – 0,221 19,7 – 23,2

 V
y
plavenie
účinku (washout) trastuzumabu
V
y
plavenie
účinku (washout) trastuzumabuVyplavenie účinku (washout) trastuzumabu sa hodnotilo po jeho intravenóznom podaní v režime q1w
alebo q3w za použitia FK populačného modelu. Výsledky týchto simulácií naznačujú, že najmenej
95 % pacientov dosiahne koncentrácie < 1 μg/ml (približne 3 % z predpokladanej populácie Cmin,ss
alebo približne 97 % washout) do 7 mesiacov.
HER2-ECD uvoľnený do obehuVýskumné analýzy kovariátov s informáciou z podskupiny pacientov naznačujú, že pacienti s vyšším
stupňom koncentrácie HER2-ECD dosiahli rýchlejší nelineárny klírens (nižší Km) (P < 0,001). Zistila sa súvislosť medzi koncentráciou antigénu a hladinou SGOT/AST, účinok koncentrácie antigénu na klírens môže byť čiastočne vysvetlený hladinami SGOT/AST.
Východiskové hladiny HER2-ECD pozorované u pacientov s MKŽ boli porovnateľné s hladinami u pacientov s MKP a VKP, nebol pozorovaný žiaden evidentný účinok na klírens trastuzumabu.
5.3 Predklinické údaje o bezpečnosti
V štúdiách trvajúcich až 6 mesiacov, v teratologických štúdiách reprodukčnej toxicity, štúdiách fertility u žien a v štúdiách zameraných na neskorú gestačnú toxicitu a prestup liečiva cez placentu neboli získané žiadne dôkazy o jednorazovej, resp. opakovanej toxicite liečiva. Trastuzumab nie je genotoxický. Štúdia s trehalózou, hlavnou pomocnou látkou lieku, nevykazovala žiadne známky toxicity.
Nevykonali sa žiadne dlhodobé štúdie na zvieratách na stanovene karcinogénneho potenciálu trastuzumabu alebo na zistenie jeho vplyvu na plodnosť samcov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
histidín
L-histidíniumchlorid monohydrát dihydrát trehalózy
polysorbát 20
6.2 Inkompatibility
Tento liek sa nesmie miešať alebo riediť s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
KANJINTI sa nesmie riediť roztokom glukózy, pretože dochádza k vyzrážaniu bielkoviny.
6.3 Čas použiteľnosti
30 mesiacov.
Po rekonštitúcii sterilnou vodou na injekcie je rekonštituovaný roztok fyzikálne a chemicky stabilný
počas 48 hodín pri 2 °C – 8 °C. Nepoužitý rekonštituovaný roztok sa musí zlikvidovať.
Infúzne roztoky lieku KANJINTI v polyvinylchloridových, polyetylénových alebo polypropylénových vakoch, obsahujúcich 9 mg/ml (0,9 %) injekčného roztoku chloridu sodného, sú fyzikálne a chemicky stabilné počas 24 hodín pri teplote neprevyšujúcej 30 °C.
Z mikrobiologického hľadiska sa má rekonštituovaný roztok a infúzny roztok lieku KANJINTI použiť okamžite. Po rekonštituovaní a zriedení je možné liek uchovávať iba za kontrolovaných a aseptických podmienok. Ak sa liek nepoužije okamžite, používateľ je zodpovedný za dĺžku a podmienky jeho uchovávania.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
Podmienky na uchovávanie rekonštituovaného lieku, pozri v častiach 6.3 a 6.6.
6.5 Druh obalu a obsah balenia
K
A
N
J
I
N
T
I 150 mg prášok na infúzny koncentrát
Injekčná liekovka z číreho skla typu I s obsahom 20 ml s butylovou gumovou zátkou potiahnutou
fluóro-živicovým filmom a s hliníkovým viečkom s protiprachovým krytom, obsahujúca 150 mg trastuzumabu.
Každá škatuľka obsahuje jednu injekčnú liekovku.
KANJINTI 420 mg prášok na infúzny koncentrát
Injekčná liekovka z číreho skla typu I s obsahom 50 ml s butylovou gumovou zátkou potiahnutou
fluóro-živicovým filmom a s hliníkovým viečkom s protiprachovým krytom, obsahujúca 420 mg trastuzumabu.
Každá škatuľka obsahuje jednu injekčnú liekovku.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Počas rekonštituovania sa má s liekom KANJINTI manipulovať opatrne. Nadmerné spenenie počas riedenia alebo trasenie nariedeným roztokom môže spôsobiť ťažkosti s natiahnutím potrebného množstva lieku KANJINTI z injekčnej liekovky.
Rekonštituovaný roztok nezmrazujte.
KANJINTI 150 mg prášok na infúzny koncentrát
Za príslušných aseptických podmienok sa každá injekčná liekovka so 150 mg lieku KANJINTI
rekonštituuje pomocou 7,2 ml sterilnej vody na injekcie (ktorá nie je súčasťou balenia). Na
rekonštituovanie lieku sa nesmú použiť iné rozpúšťadlá.
Po rekonštituovaní získame 7,4 ml roztoku, ktorý slúži na jednorazové podanie. V 1 ml
rekonštituovaného roztoku sa nachádza približne 21 mg trastuzumabu, pH roztoku je približne 6,1.
4 % rezerva objemu umožňuje natiahnuť vyznačenú dávku 150 mg z každej injekčnej liekovky.
KANJINTI 420 mg prášok na infúzny koncentrát
Za príslušných aseptických podmienok sa každá injekčná liekovka so 420 mg lieku KANJINTI
rekonštituuje pomocou 20 ml sterilnej vody na injekcie (ktorá nie je súčasťou balenia). Na rekonštituovanie lieku sa nesmú použiť iné rozpúšťadlá.
Po rekonštituovaní získame 21 ml roztoku, ktorý slúži na jednorazové podanie. V 1 ml
rekonštituovaného roztoku sa nachádza približne 21 mg trastuzumabu, pH roztoku je približne 6,1.
5 % rezerva objemu umožňuje natiahnuť vyznačenú dávku 420 mg z každej injekčnej liekovky.
Injekčná liekovka s
liekom KANJINTI
Objem sterilnej vody na
injekcie
Výsledná koncentrácia

150 mg injekčná
liekovka
420 mg injekčná
liekovka
+ 7,2 ml = 21 mg/ml
+ 20 ml = 21 mg/ml
N
ávod na rekonštituovanie
1) Pomocou sterilnej injekčnej striekačky pomaly vstreknite príslušný objem (ako je uvedené vyššie)
sterilnej vody na injekcie do injekčnej liekovky obsahujúcej lyofilizovaný prášok KANJINTI. Prúd vody na injekcie nasmerujte na lyofilizovanú hrudku lieku.
2) Pri rekonštituovaní si môžete pomôcť jemným krúžením injekčnou liekovkou. NETRASTE.
Po rekonštituovaní často dochádza k miernemu speneniu lieku. Injekčnú liekovku nechajte voľne stáť približne 5 minút. Rekonštituovaný roztok lieku KANJINTI má číru až svetložltú farbu a nesmie obsahovať žiadne viditeľné čiastočky.
Potrebný objem roztoku sa vypočíta:
• na základe úvodnej nasycovacej dávky 4 mg trastuzumabu/kg telesnej hmotnosti alebo nasledujúcej týždennej dávky 2 mg trastuzumabu/kg telesnej hmotnosti pomocou nasledujúceho vzorca:
Objem (ml) = telesná hmotnosť(kg) x dávka (4 mg/kg –úvodná alebo 2 mg/kg –udržiavacia)
21 (mg/ml, koncentrácia rekonštituovaného roztoku)
• na základe úvodnej nasycovacej dávky 8 mg trastuzumabu/kg telesnej hmotnosti alebo nasledujúcej dávky 6 mg/kg telesnej hmotnosti podanej každé tri týždne pomocou nasledujúceho vzorca:
Objem (ml) = telesnáhmotnosť(kg) x dávka (8 mg/kg –úvodná alebo 6 mg/kg –udržiavacia)
21 (mg/ml, koncentrácia rekonštituovaného roztoku)
Príslušné množstvo roztoku sa má natiahnuť z injekčnej liekovky a pridať do infúzneho vaku s obsahom 250 ml injekčného roztoku chloridu sodného s koncentráciou 9 mg/ml (0,9 %). Nepoužívajte roztoky s obsahom glukózy (pozri časť 6.2). Vak zľahka prevracajte, aby sa roztok premiešal a
nedošlo pritom k speneniu. Po príprave sa má infúzia okamžite podať. Ak sa liek nariedi za aseptických podmienok, môže sa skladovať 24 hodín (pri teplote neprevyšujúcej 30 °C).
Parenterálne lieky sa majú pred podaním skontrolovať voľným okom, či neobsahujú nejaké čiastočky a či nedošlo k zmene sfarbenia.
Medzi liekom KANJINTI a polyvinylchloridovými, polyetylénovými alebo polypropylénovými vakmi
sa nepozorovali žiadne inkompatibility.
KANJINTI je určený len na jednorazové použitie, pretože liek neobsahuje žiadne konzervačné látky. Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Amgen Europe B.V. Minervum 7061
NL-4817 ZK Breda
Holandsko
8. REGISTRAČNÉ ČÍSLA
EU/1/18/1281/001
EU/1/18/1281/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.