
/>
Úrazy, otravy a komplikácie liečebného postupu
Menej časté zníženie absolútneho počtu neutrofilov, zvýšenie
alkalickej fosfatázy, zníženie albumínu v krvi, zvýšenie amylázy v krvi, zvýšenie bilirubínu v krvi, zvýšenie cholesterolu v krvi, zvýšenie kreatinínu v krvi, zvýšenie glukózy v krvi, zvýšenie močovinového dusíka v krvi, zvýšenie kreatínfosfokinázy, zvýšenie krvnej glukózy nalačno, prítomnosť glukózy v moči, zvýšenie vysokodenzitného lipoproteínu, zvýšenie medzinárodného normalizovaného pomeru, zvýšenie nízkodenzitného lipoproteínu, zníženie počtu trombocytov, prítomnosť erytrocytov v moči, zväčšenie obvodu pása, zvýšenie hmotnosti, zníženie počtu leukocytov
Menej časté náhodné predávkovanie
 Popis vybraných nežiaducich reakcií
Popis vybraných nežiaducich reakcií
U pacientov, ktorí už mali skúsenosť s liečbou, aj u predtým neliečených pacientov, a ktorým bol
nasadený raltegravir spolu s inými antiretrovírusovými liečivami, bola hlásená rakovina. Jednalo sa
o špecifické typy a výskyty rakoviny, aké sa očakávajú u vysoko imunodeficientnej populácie. Riziko vzniku rakoviny bolo v týchto štúdiách podobné v skupinách dostávajúcich raltegravir a v skupinách dostávajúcich porovnávané liečivá.
U osôb liečených raltegravirom sa pozorovali abnormálne laboratórne hodnoty kreatínkinázy stupňa 2-
4. Bola hlásená myopatia a rabdomyolýza. U pacientov, ktorí v minulosti mali myopatiu alebo rabdomyolýzu alebo majú akékoľvek predurčujúce faktory vrátane iných liekov spojených s týmito stavmi, je potrebné používať s opatrnosťou (pozri časť 4.4).
Boli hlásené prípady osteonekrózy, najmä u pacientov so všeobecne uznávanými rizikovými faktormi, pokročilým HIV ochorením alebo dlhodobou expozíciou kombinovanej antiretrovírusovej terapii (CART). Frekvencia osteonekrózy nie je známa (pozri časť 4.4).
U pacientov infikovaných HIV s ťažkou imunodeficienciou môže v čase nasadenia kombinovanej antiretrovírusovej terapie (CART) vzniknúť zápalová reakcia na asymptomatické alebo reziduálne oportúnne infekcie. Boli zaznamenané aj autoimunitné poruchy (ako je Gravesova choroba); avšak zaznamenaný čas do ich nástupu je rôznorodejší a tieto udalosti sa môžu vyskytnúť mnoho mesiacov po začatí liečby (pozri časť 4.4).
Pri každej z nasledovných klinických nežiaducich reakcií sa objavil minimálne jeden závažný výskyt:
genitálny herpes, anémia, syndróm imunitnej reaktivácie, depresia, mentálna porucha, pokus o suicídium, gastritída, hepatitída, zlyhanie obličiek, náhodné predávkovanie.
V klinických štúdiách pacientov, ktorí už mali skúsenosť s liečbou, sa v režimoch obsahujúcich raltegravir a darunavir v porovnaní s režimami obsahujúcimi raltegravir bez darunaviru alebo darunavir bez raltegraviru častejšie pozorovala vyrážka, bez ohľadu na príčinu jej vzniku. Vyrážka,
ktorá sa podľa názoru skúšajúceho považovala za súvisiacu s liekom, sa objavila v podobných mierach výskytu. Miery výskytu vyrážky upravené na expozíciu (všetky príčiny) boli 10,9 pri raltegravire +
darunavire, 4,2 pri raltegravire bez darunaviru a 3,8 pri darunavire bez raltegraviru na 100 pacientorokov (PYR) a miery výskytu vyrážky súvisiacej s liekom boli 2,4 pri raltegravire + darunavire, 1,1 pri raltegravire bez darunaviru a 2,3 pri darunavire bez raltegraviru na 100 PYR.
Vyrážky pozorované v klinických štúdiách boli mierne až stredne závažné a neviedli k vysadeniu liečby (pozri časť 4.4).
Pacienti súbežne infikovaní vírusom hepatitídy B a/alebo hepatitídy C
Pacientom, ktorí už mali skúsenosť s liečbou (N=114/699 alebo 16 %; HBV=6 %, HCV=9 %, HBV+HCV=1 %), aj predtým neliečeným pacientom (N=34/563 alebo 6 %; HBV=4 %, HCV=2 %,
HBV+HCV=0,2 %), a ktorí mali chronickú (ale nie akútnu) aktívnu koinfekciu hepatitídou B a/alebo
hepatitídou C, bolo povolené zaradiť sa do štúdií fázy III za predpokladu, že testy východiskovej funkcie pečene neprekročili 5-násobok hornej hranice normálneho rozpätia. Vo všeobecnosti bol bezpečnostný profil raltegraviru u pacientov súbežne infikovaných vírusom hepatitídy B a/alebo hepatitídy C podobný profilu u pacientov bez koinfekcie vírusom hepatitídy B a/alebo hepatitídy C, hoci miery abnormalít AST a ALT boli v oboch liečebných skupinách o niečo vyššie v podskupine
s koinfekciou vírusom hepatitídy B a/alebo hepatitídy C. U pacientov, ktorí už mali skúsenosť
s liečbou, sa abnormálne laboratórne hodnoty stupňa 2 alebo vyššieho, čo vyjadruje stupeň zhoršenia oproti východiskovým hodnotám AST, ALT alebo celkového bilirubínu, vyskytli v 96. týždni u 29 %,
34 %, resp. 13 % súbežne infikovaných pacientov liečených raltegravirom, oproti 11 %, 10 %, resp.
9 % všetkých ostatných pacientov liečených raltegravirom. U predtým neliečených pacientov sa abnormálne laboratórne hodnoty stupňa 2 alebo vyššieho, čo vyjadruje stupeň zhoršenia oproti
východiskovým hodnotám AST, ALT alebo celkového bilirubínu, vyskytli v 240. týždni u 22 %,
44 %, resp. 17 % súbežne infikovaných pacientov liečených raltegravirom, oproti 13 %, 13 %, resp.
5 % všetkých ostatných pacientov liečených raltegravirom.
Pediatrická populácia
Deti a dospievajúci vo veku od 2 do 18 rokov
Raltegravir sa skúmal u 126 detí a dospievajúcich infikovaných HIV-1 vo veku od 2 do 18 rokov so skúsenosťou s antiretrovírusovou liečbou v kombinácii s inými antiretrovírusovými liečivami v štúdii
IMPAACT P1066 (pozri časti 5.1 a 5.2). 96 zo 126 pacientov dostávalo odporúčanú dávku raltegraviru.
U týchto 96 detí a dospievajúcich boli frekvencia, typ a závažnosť nežiaducich reakcií súvisiacich s liekom do 48. týždňa porovnateľné s nežiaducimi reakciami, ktoré sa pozorovali u dospelých.
U jedného pacienta sa vyskytli klinické nežiaduce reakcie psychomotorickej hyperaktivity 3. stupňa, abnormálne správanie a insomnia, ktoré súviseli s liekom; u jedného pacienta sa objavila závažná alergická vyrážka 2. stupňa súvisiaca s liekom.
U jedného pacienta sa objavili laboratórne abnormality, hladiny AST 4. stupňa a hladiny ALT 3. stupňa, ktoré súviseli s liekom a ktoré sa považovali za závažné.
Dojčatá a batoľatá vo veku 4 týždne do menej ako 2 roky
Raltegravir sa tiež skúmal u 26 dojčiat a batoliat infikovaných HIV-1 vo veku 4 týždne do menej ako 2
roky v kombinácii s inými antiretrovírusovými liečivami v štúdii IMPAACT P1066 (pozri časti 5.1
a 5.2).
U týchto 26 dojčiat a batoliat boli frekvencia, typ a závažnosť nežiaducich reakcií súvisiacich s liekom do 48. týždňa porovnateľné s nežiaducimi reakciami, ktoré sa pozorovali u dospelých.
U jedného pacienta sa vyskytla závažná alergická vyrážka 3. stupňa súvisiaca s liekom, ktorá viedla k ukončeniu liečby.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieO liečbe predávkovania raltegravirom nie sú k dispozícii žiadne špecifické informácie.
V prípade predávkovania sa odporúča vykonať štandardné podporné opatrenia, napr. odstrániť neabsorbovaný materiál z gastrointestinálneho traktu, zaviesť klinické monitorovanie (vrátane vyhotovenia elektrokardiogramu) a ak je to potrebné, nasadiť podpornú liečbu. Treba vziať do úvahy, že raltegravir je na klinické použitie vo forme draselnej soli. Nie je známe, do akej miery je raltegravir dialyzovateľný.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antivirotiká na systémové použitie, iné antivirotiká, ATC kód: J05AX08
Mechanizmus účinkuRaltegravir je inhibítor prenosu reťazcov integrázou účinný proti vírusu ľudskej imunodeficiencie
(HIV-1). Raltegravir inhibuje katalytickú aktivitu integrázy, enzýmu kódovaného HIV, ktorý je potrebný na vírusovú replikáciu. Inhibícia integrázy zabraňuje kovalentnému vloženiu alebo integrácii
genómu HIV do genómu hostiteľskej bunky. Genómy HIV, ktoré sa nedokážu včleniť, nemôžu riadiť tvorbu nových infekčných vírusových častíc, takže inhibícia integrácie zabraňuje šíreniu vírusovej
infekcie.
Antivírusová aktivita in vitroRaltegravir v koncentráciách 31 ± 20 nmol/l viedol k 95 % inhibícii (IC95) replikácie HIV-1
(v porovnaní s neliečenou kultúrou infikovanou vírusom) v ľudských T-lymfoidných bunkových
kultúrach infikovaných na bunkovú líniu adaptovaným HIV-1 variantom H9IIIB. Okrem toho raltegravir inhiboval vírusovú replikáciu v kultúrach mitogénom aktivovaných ľudských
mononukleárov z periférnej krvi infikovaných rôznymi primárnymi klinickými izolátmi HIV-1 vrátane izolátov z 5 podtypov non-B a izolátov rezistentných voči inhibítorom reverznej transkriptázy
a inhibítorom proteázy. V teste s jedným cyklom infekcie raltegravir inhiboval infekciu 23 izolátmi HIV reprezentujúcimi 5 podtypov non-B a 5 cirkulujúcich rekombinantných foriem s hodnotami IC50 v rozsahu od 5 do 12 nmol/l.
Rezistencia
Väčšina vírusov izolovaných od pacientov, u ktorých raltegravir zlyhal, mala vysokú úroveň
rezistencie voči raltegraviru vyplývajúcu z prítomnosti dvoch alebo viacerých mutácií. Väčšina mala charakteristickú mutáciu 155. aminokyseliny (N155 zamenená za H), 148. aminokyseliny (Q148 zamenená za H, K alebo R) alebo 143. aminokyseliny (Y143 zamenená za H, C alebo R), popri jednej alebo viacerých ďalších mutáciách integrázy (napr. L74M, E92Q, T97A, E138A/K, G140A/S, V151I, G163R, S230R). Charakteristické mutácie znižovali citlivosť vírusu voči raltegraviru a prítomnosť ďalších mutácií mala za následok ďalší pokles citlivosti voči raltegraviru. Faktory, ktoré znižovali pravdepodobnosť vzniku rezistencie, zahŕňali nižšiu základnú vírusovú záťaž a použitie iných účinných antiretrovírusových liečiv. Mutácie spôsobujúce rezistenciu na raltegravir vo všeobecnosti spôsobujú aj rezistenciu na elvitegravir, inhibítor prenosu reťazcov integrázou. Mutácie 143. aminokyseliny spôsobujú väčšiu rezistenciu na raltegravir ako na elvitegravir a mutácia E92Q spôsobuje väčšiu rezistenciu na elvitegravir ako na raltegravir. Pri vírusoch s mutáciou 148. aminokyseliny spolu s jednou alebo viacerými inými mutáciami rezistencie na raltegravir sa môže vyskytovať aj klinicky významná rezistencia na dolutegravir.
Klinická skúsenosť
Dôkaz účinnosti raltegraviru bol založený na analýzach 96-týždňových údajov z dvoch
randomizovaných, dvojito zaslepených, placebom kontrolovaných skúšaní (BENCHMRK 1
a BENCHMRK 2, Protokoly 018 a 019) u dospelých pacientov infikovaných HIV-1, ktorí už mali skúsenosť s antiretrovírusovou liečbou a na analýze 240-týždňových údajov z randomizovaného,
dvojito zaslepeného, aktívnym komparátorom kontrolovaného skúšania (STARTMRK, Protokol 021)
u dospelých pacientov infikovaných HIV-1 predtým neliečených antiretrovírusovou liečbou.
Účinnosť
Dospelí pacienti, ktorí už mali skúsenosť s liečbou
BENCHMRK 1 a BENCHMRK 2 (multicentrické randomizované dvojito zaslepené placebom kontrolované skúšania) hodnotili bezpečnosť a antiretrovírusovú aktivitu raltegraviru 400 mg dvakrát
denne oproti placebu v kombinácii s optimalizovanou základnou terapiou (optimised background
therapy, OBT) u pacientov infikovaných HIV vo veku 16 rokov a starších s dokumentovanou rezistenciou na minimálne jeden liek v každej z 3 tried (NRTI, NNRTI, PI) antiretrovírusovej terapie. Pred randomizáciou zvolil skúšajúci OBT na základe pacientovej doterajšej liečebnej anamnézy, ako aj na základe východiskového testovania genotypovej a fenotypovej vírusovej rezistencie.
Demografia (pohlavie, vek a rasa) a východiskové charakteristiky pacientov boli medzi skupinami dostávajúcimi raltegravir 400 mg dvakrát denne a placebo porovnateľné. Pacienti boli v minulosti vystavení mediánu 12 antiretrovirotík počas mediánu 10 rokov. V rámci OBT sa použil medián 4
ART.
Výsledky 48-týždňových a 96-týždňových analýz
Stále výsledky (48. týždeň a 96. týždeň) u pacientov s odporúčanou dávkou raltegraviru 400 mg dvakrát denne zo zlúčených štúdií BENCHMRK 1 a BENCHMRK 2 sú znázornené v tabuľke 2.
Tabuľka 2
Výsledky účinnosti v 48. a 96. týždni
BENCHMRK 1 a 2 zlúčené
48. týždeň 96. týždeň
Parameter
Percento HIV-RNA <400 kópií/ml (95 % IS)
R
altegravir
400 mg dvakrát
denne + OBT
(N=462)
Placebo + OBT (N=237)
R
altegravir
400 mg dvakrát
denne + OBT
(N=462)
Placebo + OBT (N=237)





Všetci pacienti† 72 (68, 76) 37 (31, 44) 62 (57, 66) 28 (23, 34) Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 62 (53, 69) 17 (9, 27) 53 (45, 61) 15 (8, 25)
≤100 000 kópií/ml 82 (77, 86) 49 (41, 58) 74 (69, 79) 39 (31, 47) Počet CD4 ≤50 buniek/mm3 61 (53, 69) 21 (13, 32) 51 (42, 60) 14 (7, 24)
>50 a ≤200 buniek/mm3 80 (73, 85) 44 (33, 55) 70 (62, 77) 36 (25, 48)
>200 buniek/mm3 83 (76, 89) 51 (39, 63) 78 (70, 85) 42 (30, 55) Skóre citlivosti (GSS)§
0 52 (42, 61) 8 (3, 17) 46 (36, 56) 5 (1, 13)
1 81 (75, 87) 40 (30, 51) 76 (69, 83) 31 (22, 42)
2 a vyššie 84 (77, 89) 65 (52, 76) 71 (63, 78) 56 (43, 69)
Percento HIV-RNA <50 kópií/ml (95 % IS)Všetci pacienti† 62 (57, 67) 33 (27, 39) 57 (52, 62) 26 (21, 32) Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 48 (40, 56) 16 (8, 26) 47 (39, 55) 13 (7, 23)
≤100 000 kópií/ml 73 (68, 78) 43 (35, 52) 70 (64, 75) 36 (28, 45) Počet CD4 ≤50 buniek/mm3 50 (41, 58) 20 (12, 31) 50 (41, 58) 13 (6, 22)
>50 a ≤200 buniek/mm3 67 (59, 74) 39 (28, 50) 65 (57, 72) 32 (22, 44)
>200 buniek/mm3 76 (68, 83) 44 (32, 56) 71 (62, 78) 41 (29, 53) Skóre citlivosti (GSS)§
0 45 (35, 54) 3 (0, 11) 41 (32, 51) 5 (1, 13)
1 67 (59, 74) 37 (27, 48) 72 (64, 79) 28 (19, 39)
2 a vyššie 75 (68, 82) 59 (46, 71) 65 (56, 72) 53 (40, 66)
BENCHMRK 1 a 2 zlúčené
48. týždeň 96. týždeň
Parameter
Priemerná zmena počtu CD4 buniek (95 % IS), bunky/mm
3
R
altegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)
R
altegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)
Všetci pacienti‡ 109 (98,
121)
45 (32, 57) 123 (110,
137)
49 (35, 63)
Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 126 (107,
144)
≤100 000 kópií/ml 100 (86,
115) Počet CD4 ≤50 buniek/mm3 121 (100,
142)
>50 a ≤200 buniek/mm3 104 (88,
119)
>200 buniek/mm3 104 (80,
129)
36 (17, 55) 140 (115,
165)
49 (33, 65) 114 (98,
131)
33 (18, 48) 130 (104,
156)
47 (28, 66) 123 (103,
144)
54 (24, 84) 117 (90,
143)
40 (16, 65)
53 (36, 70)
42 (17, 67)
56 (34, 79)
48 (23, 73)
Skóre citlivosti (GSS)§
0 81 (55, 106) 11 (4, 26) 97 (70, 124) 15 (-0, 31)
1 113 (96,
130)
2 a vyššie 125 (105,
144)
44 (24, 63) 132 (111,
154)
76 (48, 103) 134 (108,
159)
45 (24, 66)
90 (57, 123)





† Pacient, ktorý nedokončil štúdiu, sa posudzuje ako zlyhanie: pacienti, ktorí predčasne prerušili, sú následne pokladaní za neúspešných.
Hlásené je percento pacientov s odpoveďou a príslušný 95 % interval spoľahlivosti (IS).
‡ Na analýzu podľa prognostických faktorov sa pre percentá <400 a 50 kópií/ml virologické zlyhania prenášali (carried forward). Pre priemerné zmeny počtu CD4 sa na virologické zlyhania použila metóda prenosu východiskovej hodnoty (baseline-carry-forward).
§ Skóre genotypovej citlivosti (GSS) bolo definované ako súčet perorálnych ART v optimalizovanej základnej terapii (OBT), na ktoré
vírusový izolát pacienta vykazoval genotypovú citlivosť na základe testu genotypovej rezistencie. Použitie enfuvirtidu v OBT
u pacientov, ktorí nemali predchádzajúcu skúsenosť s enfuvirtidom, sa počítalo ako jeden účinný liek v OBT. Podobne sa použitie darunaviru v OBT u pacientov doposiaľ neliečených darunavirom počítalo ako jeden účinný liek v OBT.
Raltegravir dosiahol virologické odpovede (pri použití prístupu: pacient, ktorý nedokončil=zlyhanie)
HIV RNA <50 kópií/ml v 16. týždni u 61,7 % pacientov, v 48. týždni u 62,1 % pacientov a v 96. týždni u 57,0 %. U niektorých pacientov došlo medzi 16. a 96. týždňom k opätovnému vírusovému
nárastu. Faktory spojené so zlyhaním zahŕňajú vysokú počiatočnú vírusovú záťaž a OBT, ktorá
nezahŕňala minimálne jedno účinné liečivo.
Prechod na raltegravirŠtúdie SWITCHMRK 1 a 2 (Protokoly 032 a 033) hodnotili pacientov infikovaných HIV, ktorí dostávali supresívnu (skríning HIV RNA <50 kópií/ml; stabilný režim >3 mesiace) terapiu
s lopinavirom 200 mg (+) ritonavirom 50 mg 2 tablety dvakrát denne plus najmenej 2 nukleozidové inhibítory reverznej transkriptázy, a randomizovali ich v pomere 1:1 tak, aby pokračovali v užívaní
lopinaviru (+) ritonaviru 2 tablety dvakrát denne (n=174, resp. n=178) alebo sa lopinavir (+) ritonavir nahradili raltegravirom 400 mg dvakrát denne (n=174, resp. n=176). Pacienti s virologickým zlyhaním v anamnéze neboli vylúčení a počet predchádzajúcich antiretrovírusových terapií nebol obmedzený.
Tieto štúdie boli ukončené po primárnej analýze účinnosti v 24. týždni, pretože sa im nepodarilo preukázať neinferioritu raltegraviru oproti lopinaviru (+) ritonaviru. V oboch štúdiách sa v 24. týždni supresia HIV RNA na menej ako 50 kópií/ml udržala u 84,4 % pacientov v skupine s raltegravirom oproti 90,6 % v skupine s lopinavirom (+) ritonavirom (pacienti, ktorí nedokončili štúdiu = zlyhanie). O potrebe podávať raltegravir s dvoma ďalšími účinnými liečivami pozri časť 4.4.
Predtým neliečení dospelí pacienti
V STARTMRK (multicentrické randomizované, dvojito zaslepené, aktívnym komparátorom kontrolované skúšanie) sa hodnotila bezpečnosť a antiretrovírusová aktivita raltegraviru 400 mg dvakrát denne oproti efavirenzu 600 mg večer pred spaním, v kombinácii s emtricitabínom (+) tenofovir-dizoproxilfumarátom, u predtým neliečených pacientov infikovaných HIV s HIV
RNA >5 000 kópií/ml. Randomizácia bola stratifikovaná podľa skríningu hladiny HIV RNA (≤50 000 kópií/ml a >50 000 kópií/ml) a podľa infekcie hepatitídou B alebo C (pozitívna alebo negatívna).
Demografia (pohlavie, vek a rasa) a východiskové charakteristiky pacientov boli medzi skupinou užívajúcou raltegravir 400 mg dvakrát denne a skupinou, ktorá užívala efavirenz 600 mg večer pred spaním, porovnateľné.
Výsledky 48-týždňových a 240-týždňových analýzPokiaľ ide o primárny cieľový ukazovateľ účinnosti, podiel (%) pacientov, ktorí dosiahli HIV RNA
< 50 kópií/ml v 48. týždni, bol 241/280 (86,1 %) v skupine užívajúcej raltegravir a 230/281 (81,9 %)
v skupine užívajúcej efavirenz. Terapeutický rozdiel (raltegravir – efavirenz) bol 4,2 % s príslušným
95 % IS (-1,9, 10,3), čo potvrdzuje, že raltegravir nie je inferiórny oproti efavirenzu (p-hodnota pre neinferioritu <0,001). Terapeutický rozdiel (raltegravir – efavirenz) v 240. týždni bol 9,5 %,
s príslušným 95 % IS (1,7, 17,3). Výsledky v 48. týždni a 240. týždni u pacientov užívajúcich

odporúčanú dávku raltegraviru 400 mg dvakrát denne zo štúdie STARTMRK sú uvedené v tabuľke 3.
Tabuľka 3Výsledky účinnosti v 48. a 240. týždni
Štúdia STARTMRK
48. týždeň 240. týždeň
Parameter
 Percento HIV-RNA <50 kópií/ml (95 % IS)
Raltegravir
Percento HIV-RNA <50 kópií/ml (95 % IS)
Raltegravir
 400 mg dvakrát
denne
(N=281)
Efavirenz
600 mg večer pred spaním
(N=282)
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
600 mg večer pred spaním
(N=282)
400 mg dvakrát
denne
(N=281)
Efavirenz
600 mg večer pred spaním
(N=282)
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
600 mg večer pred spaním
(N=282)
Všetci pacienti† 86 (81, 90) 82 (77, 86) 71 (65, 76) 61 (55, 67) Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 91 (85, 95) 89 (83, 94) 70 (62, 77) 65 (56, 72)
≤100 000 kópií/ml 93 (86, 97) 89 (82, 94) 72 (64, 80) 58 (49, 66) Počet CD4 ≤50 buniek/mm3 84 (64, 95) 86 (67, 96) 58 (37, 77) 77 (58, 90)
>50 a ≤200 buniek/mm3 89 (81, 95) 86 (77, 92) 67 (57, 76) 60 (50, 69)

>200 buniek/mm3 94 (89, 98) 92 (87, 96) 76 (68, 82) 60 (51, 68) Vírusový podtyp vetvy B 90 (85, 94) 89 (83, 93) 71 (65, 77) 59 (52, 65) nepatriaci do vetvy B 96 (87, 100) 91 (78, 97) 68 (54, 79) 70 (54, 82)
Priemerná zmena počtu CD4 buniek (95 % IS), bunky/mm3 Všetci pacienti‡ 189 (174,
204)
163 (148,
178)
374 (345,
403)
312 (284,
339)
Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 196 (174,
219)
≤100 000 kópií/ml 180 (160,
200) Počet CD4 ≤50 buniek/mm3 170 (122,
218)
>50 a ≤200 buniek/mm3 193 (169,
217)
>200 buniek/mm3 190 (168,
212)
192 (169,
214)
134 (115,
153)
152 (123,
180)
175 (151,
198)
157 (134,
181)
392 (350,
435)
350 (312,
388)
304 (209,
399)
413 (360,
465)
358 (321,
395)
329 (293,
364)
294 (251,
337)
314 (242,
386)
306 (264,
348)
316 (272,
359)
 Štúdia STARTMRK
48. týždeň 240. týždeň
Štúdia STARTMRK
48. týždeň 240. týždeň
Parameter
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
600 mg večer pred spaním
(N=282)
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
 600 mg večer pred spaním
(N=282)
600 mg večer pred spaním
(N=282)

Vírusový podtyp vetvy B 187 (170,
204)
nepatriaci do vetvy B 189 (153,
225)
164 (147,
181)
156 (121,
190)
380 (346,
414)
332 (275,
388)
303 (272,
333)
329 (260,
398)

† Pacient, ktorý nedokončil štúdiu, sa posudzuje ako zlyhanie: pacienti, ktorí predčasne prerušili, sú následne pokladaní za neúspešných.
Hlásené je percento pacientov s odpoveďou a príslušný 95 % interval spoľahlivosti (IS).
‡ Na analýzu podľa prognostických faktorov sa pre percentá <50 a 400 kópií/ml virologické zlyhania prenášali (carried forward). Pre priemerné zmeny počtu CD4 sa na virologické zlyhania použila metóda prenosu východiskovej hodnoty (baseline-carry-forward).
Poznámky: Analýza vychádza zo všetkých dostupných údajov.

Raltegravir a efavirenz sa podávali s emtricitabínom (+) tenofovir-dizoproxilfumarátom.
Pediatrická populáciaDeti a dospievajúci vo veku od 2 do 18 rokovIMPAACT P1066 je otvorené multicentrické skúšanie fázy I/II na zhodnotenie farmakokinetického profilu, bezpečnosti, znášanlivosti a účinnosti raltegraviru u detí infikovaných HIV. Do tejto štúdie bolo zaradených 126 detí a dospievajúcich vo veku od 2 do 18 rokov so skúsenosťou s liečbou. Pacienti boli rozdelení podľa veku, zaraďovali sa najprv dospievajúci a následne potom mladšie deti. Pacienti dostávali buď 400 mg v liekovej forme tabliet (vek od 6 do 18 rokov) alebo liekovú formu žuvacie tablety (vek od 2 do menej ako 12 rokov). Raltegravir sa podával s optimalizovaným základným režimom.
Úvodné obdobie hľadania dávky zahŕňalo intenzívne farmakokinetické hodnotenie. Výber dávky vychádzal z dosiahnutia podobnej plazmatickej expozície a minimálnej koncentrácie raltegraviru, aké sa pozorovali u dospelých a z akceptovateľnej krátkodobej bezpečnosti. Po výbere dávky boli na posúdenie dlhodobej bezpečnosti, znášanlivosti a účinnosti zaradení ďalší pacienti. 96 zo 126 pacientov dostávalo odporúčanú dávku raltegraviru (pozri časť 4.2).
 Tabuľka 4
Tabuľka 4
 Východiskové charakteristiky a výsledky účinnosti v 24. a 48. týždni štúdie IMPAACT P1066 (vo veku 2 až 18 rokov)
Východiskové charakteristiky a výsledky účinnosti v 24. a 48. týždni štúdie IMPAACT P1066 (vo veku 2 až 18 rokov)
Parameter
 Demografia
Populácia užívajúca konečnú dávku
N = 96
Demografia
Populácia užívajúca konečnú dávku
N = 96
Vek (roky), medián [rozsah] 13 [2 – 18]
Mužské pohlavie 49 %
RasaKaukazský typ 34 %
Černosi 59 %
Východiskové charakteristikyPlazmatická HIV-1 RNA (log10 kópie/ml), priemer
[rozsah] 4,3 [2,7 - 6]
Počet CD4 buniek (bunky/mm3), medián [rozsah] 481 [0 – 2 361]
Percento CD4, medián [rozsah] 23,3 % [0 – 44]
HIV-1 RNA > 100 000 kópií /ml 8 %
Kategória B alebo C CDC HIV 59 %
Predchádzajúce použitie ART podľa triedyNNRTI 78 % PI 83 %
 Odpoveď 24. týždeň 48. týždeň
Odpoveď 24. týždeň 48. týždeňDosiahnutý ≥ 1 log10 pokles HIV RNA oproti
východiskovej hodnote alebo < 400 kópií/ml 72 % 79 %
Dosiahnutá HIV RNA < 50 kópií/ml 54 % 57 %
Priemerné zvýšenie počtu CD4 buniek (%) oproti východiskovým hodnotám
119 buniek/mm3
(3,8 %)
156 buniek/mm3
(4,6 %)
Dojčatá a batoľatá vo veku 4 týždne do menej ako 2 roky
Štúdia IMPAACT P1066 tiež zahŕňala dojčatá a batoľatá vo veku 4 týždne do menej ako 2 roky infikované HIV, ktoré predtým dostávali antiretrovírusovú liečbu buď ako profylaxiu na prevenciu
prenosu z matky na dieťa (PMTCT) a/alebo v kombinovanej antiretrovírusovej liečbe na liečbu infekcie HIV. Raltegravir sa podával vo forme granulátu na perorálnu suspenziu bez ohľadu na jedlo
v kombinácii s optimalizovaným základným režimom, ktorý u dvoch tretín pacientov zahŕňal lopinavir plus ritonavir.
Tabuľka 5
Východiskové charakteristiky a výsledky účinnosti v 24. a 48. týždni štúdie IMPAACT P1066 (vo veku 4 týždne do menej ako 2 roky)
Parameter N = 26
Demografia
Vek (týždne), medián [rozsah] 28 [4 – 100]
Mužské pohlavie 65 %
Rasa
Kaukazský typ 8 % Černosi 85 %
Východiskové charakteristiky
Plazmatická HIV-1 RNA (log10 kópie/ml), priemer
[rozsah] 5,7 [3,1 – 7]
Počet CD4 buniek (bunky/mm3), medián [rozsah] 1 400 [131 – 3 648]
Percento CD4, medián [rozsah] 18,6 % [3,3 – 39,3]
HIV-1 RNA > 100 000 kópií /ml 69 %
Kategória B alebo C CDC HIV 23 %
Predchádzajúce použitie ART podľa triedy
NNRTI 73 % NRTI 46 %
PI 19 %
Odpoveď 24. týždeň 48. týždeň
Dosiahnutý ≥ 1 log10 pokles HIV RNA oproti
východiskovej hodnote alebo < 400 kópií/ml 91 % 85 %
Dosiahnutá HIV RNA < 50 kópií/ml 43 % 53 %
Priemerné zvýšenie počtu CD4 buniek (%) oproti východiskovým hodnotám
500 buniek/mm3
(7,5 %)
492 buniek/mm3
(7,8 %)



 Virologické zlyhanie
24. týždeň 48. týždeň
Virologické zlyhanie
24. týždeň 48. týždeň
Pacient bez odpovede 0 0
Rebounder 0 4
Počet s dostupným genotypom* 0 2
*U jedného pacienta sa vyskytla mutácia v polohe 155.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s raltegravirom v jednej alebo vo viacerých podskupinách pediatrickej populácie s infekciou ľudskej imunitnej nedostatočnosti (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaU zdravých dobrovoľníkov, ktorým sa podali jednotlivé perorálne dávky raltegraviru nalačno, sa
preukázalo, že sa raltegravir rýchlo absorbuje s tmax približne 3 hodiny po podaní dávky. AUC a Cmax raltegraviru sa zvyšujú úmerne dávke v rozmedzí dávok 100 mg až 1 600 mg. C12 h raltegraviru sa zvyšuje úmerne dávke v rozmedzí dávok 100 až 800 mg a zvyšuje sa o niečo menej, ako je úmerné dávke v rozmedzí dávok 100 mg až 1 600 mg. Dávková proporcionalita nebola stanovená u pacientov.
Pri dávkovaní dvakrát denne sa farmakokinetický rovnovážny stav dosahuje rýchlo, približne
v priebehu prvých 2 dní užívania lieku. Dochádza len k malej až žiadnej kumulácii v AUC a Cmax a dokázaná je mierna kumulácia v C12 h. Absolútna biologická dostupnosť raltegraviru nebola stanovená.
Raltegravir sa môže podávať s jedlom alebo bez jedla. V pivotných štúdiách bezpečnosti a účinnosti u pacientov infikovaných HIV sa raltegravir podával bez ohľadu na jedlo. Podanie viacnásobných
dávok raltegraviru po jedle s miernym obsahom tuku neovplyvnilo AUC raltegraviru v klinicky významnej miere, AUC stúpla o 13 % v porovnaní s podaním nalačno. Po podaní po jedle s miernym obsahom tuku bola C12 h raltegraviru o 66 % vyššia a Cmax o 5 % vyššia ako po podaní nalačno. Podanie raltegraviru po jedle s vysokým obsahom tuku zvýšilo AUC a Cmax približne dvojnásobne
a C12 h 4,1-násobne. Podanie raltegraviru po jedle s nízkym obsahom tuku znížilo AUC o 46 % a Cmax
o 52 %, C12 h sa v podstate nezmenila. Zdá sa, že v porovnaní so stavom nalačno potrava zvyšuje
farmakokinetickú variabilitu.
Vo farmakokinetike raltegraviru sa celkovo pozorovala značná variabilita. V skúšaniach
BENCHMRK 1 a 2 sa variačný koeficient (CV) pozorovanej C12 h pre interindividuálnu variabilitu
= 212 % a CV pre intraindividuálnu variabilitu = 122 %. Zdroje variability môžu zahŕňať rozdiely
v podaní spolu s jedlom a súbežne podávanými liekmi.
Distribúcia
V rozsahu koncentrácie 2 až 10 µmol/l sa na ľudské plazmatické proteíny viaže približne 83 %
raltegraviru.
Raltegravir rýchlo prechádzal cez placentu u potkanov, ale do mozgu v zreteľnom rozsahu neprenikol.
V dvoch štúdiách pacientov infikovaných HIV-1, ktorí dostávali raltegravir 400 mg dvakrát denne, sa raltegravir ľahko detegoval v cerebrospinálnej tekutine. V prvej štúdii (n = 18) bol medián koncentrácie v cerebrospinálnej tekutine 5,8 % (rozsah od 1 do 53,5 %) zodpovedajúcej plazmatickej koncentrácie. V druhej štúdii (n = 16) bol medián koncentrácie v cerebrospinálnej tekutine 3 %
(rozsah od 1 do 61 %) zodpovedajúcej plazmatickej koncentrácie. Tieto mediány podielov sú približne
3- až 6-násobne nižšie ako voľná frakcia raltegraviru v plazme.
Biotransformácia a vylučovanie
Zjavný terminálny polčas raltegraviru je približne 9 hodín s kratším polčasom fázy alfa (~1 hodina)
zodpovedným za veľkú časť AUC. Po podaní perorálnej dávky rádioaktívne značeného raltegraviru sa približne 51 % dávky vylúčilo v stolici a 32 % dávky v moči. V stolici bol prítomný iba raltegravir,
z ktorého väčšina je pravdepodobne derivovaná z hydrolýzy raltegravir-glukuronidu vylúčeného
žlčou, ako sa pozorovalo u predklinických druhov. V moči boli zistené dva komponenty, a to raltegravir a raltegravir-glukuronid, a tvorili približne 9 % (raltegravir) a 23 % (raltegravir-glukuronid) dávky. Hlavnou cirkulujúcou látkou bol raltegravir a predstavoval približne 70 % celkovej rádioaktivity; zostávajúcu rádioaktivitu v plazme predstavoval raltegravir-glukuronid. Štúdie
s izoformnými selektívnymi chemickými inhibítormi a cDNA exprimovanými UDP- glukuronozyltransferázami (UGT) ukazujú, že hlavným enzýmom zodpovedným za tvorbu raltegravir-
glukuronidu je UGT1A1. Údaje teda poukazujú na to, že hlavným mechanizmom klírensu raltegraviru
u ľudí je glukuronidácia sprostredkovaná UGT1A1.
Polymorfizmus UGT1A1
Pri porovnaní 30 osôb s *28/*28 genotypom s 27 osobami s genotypom divokého typu bol pomer geometrických priemerov (90 % IS) AUC 1,41 (0,96, 2,09) a pomer geometrických priemerov C12 h
1,91 (1,43, 2,55). U osôb, u ktorých je z dôvodu genetického polymorfizmu aktivita UGT1A1 znížená,
sa nepovažuje za potrebné upravovať dávku.
Osobitné populácie
Pediatrická populácia
Na základe štúdie porovnávajúcej liekovú formu u zdravých dospelých dobrovoľníkov mali žuvacia tableta a granulát na perorálnu suspenziu vyššiu perorálnu biologickú dostupnosť v porovnaní
so 400 mg tabletou. V tejto štúdii viedlo podávanie žuvacej tablety s jedlom s vysokým obsahom tuku v priemere k 6 % poklesu AUC, 62 % poklesu Cmax a 188 % zvýšeniu C12hod v porovnaní s podaním nalačno. Podávanie žuvacej tablety s jedlom s vysokým obsahom tuku nemá klinicky významný vplyv na farmakokinetiku raltegraviru a žuvacia tableta sa môže podávať bez ohľadu na jedlo. Účinok jedla na liekovú formu granulát na perorálnu suspenziu sa neskúmal.
Tabuľka 6 uvádza farmakokinetické parametre pri 400 mg tablete, žuvacej tablete a granuláte na perorálnu suspenziu podľa telesnej hmotnosti.
Tabuľka 6: Farmakokinetické parametre raltegraviru IMPAACT P1066
po podaní dávok v časti 4.2
Telesná hmotnosť
Lieková
forma Dávka N*
filmom
Geometrický
priemer (% CV†) AUC0-12hod (μmol/l●hod)
Geometrický priemer (%CV†)
C12 hod (nmol/l)
≥ 25 kg
obalená tableta 400 mg dvakrát denne 18 14,1 (121 %) 233 (157 %) Dávkovanie na
základe telesnej
hmotnosti, pozri tabuľky s dávkovaním
≥ 25 kg žuvacia tableta
pre žuvaciu tabletu 9 22,1 (
36 %) 113 (
80 %)

Dávkovanie na základe telesnej hmotnosti, pozri
11 do menej ako 25 kg
3 do menej ako 20 kg
žuvacia tabletat
perorálna suspenzia
tabuľky s dávkovaním
pre žuvaciu tabletu 13 18,6 (68 %) 82 (123 %)
Dávkovanie na základe telesnej hmotnosti, pozri tabuľky s dávkovaním pre granulát na
perorálnu suspenziu 19 24,5 (43 %) 113 (69 %)
*Počet pacientov s intenzívnymi farmakokinetickými (FK) výsledkami pri konečnej odporúčanej dávke.
†Geometrický koeficient zmeny.
Farmakokinetika raltegraviru u dojčiat mladších ako 4 týždne nebola stanovená.
Staršie osoby
V rámci študovaného vekového rozsahu (19 až 84 rokov, s niekoľkými osobami staršími ako 65
rokov) nemal vek klinicky významný vplyv na farmakokinetiku raltegraviru.
Pohlavie, rasa a BMI
V súvislosti s pohlavím, rasou alebo indexom telesnej hmotnosti (BMI) u dospelých sa nevyskytli žiadne klinicky významné farmakokinetické rozdiely.
Porucha funkcie obličiek
Renálny klírens nezmeneného liečiva je menšinovou dráhou eliminácie. U dospelých sa medzi pacientmi s ťažkou renálnou insuficienciou a zdravými osobami nevyskytli žiadne klinicky významné
farmakokinetické rozdiely (pozri časť 4.2). Pretože nie je známe, do akej miery je raltegravir
dialyzovateľný, je potrebné vyhnúť sa podávaniu pred dialýzou.
Porucha funkcie pečene
Raltegravir je primárne eliminovaný glukuronidáciou v pečeni. U dospelých sa medzi pacientmi so stredne ťažkou hepatálnou insuficienciou a zdravými osobami nevyskytli žiadne klinicky významné farmakokinetické rozdiely. Vplyv ťažkej hepatálnej insuficiencie na farmakokinetiku raltegraviru sa neskúmal (pozri časti 4.2 a 4.4).
5.3 Predklinické údaje o bezpečnosti
Predklinické štúdie toxicity vrátane obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, vývojovej toxicity a juvenilnej toxicity sa s raltegravirom vykonali na myšiach, potkanoch, psoch a králikoch. Účinky pri expozíciách dostatočne presahujúcich klinické expozičné hladiny nepoukazujú na žiadne osobitné riziko pre ľudí.
Mutagenita
V in vitro testoch mikrobiálnej mutagenézy (Ames), in vitro metódach alkalického vymývania na
detekciu zlomov DNA a in vitro a in vivo štúdiách chromozómovej aberácie sa nepozoroval dôkaz mutagenity ani genotoxicity.
Karcinogenita
Štúdia karcinogenity raltegraviru u myší nepreukázala žiadny karcinogénny potenciál. Pri najvyšších
úrovniach dávok, 400 mg/kg/deň u samíc a 250 mg/kg/deň u samcov, bola systémová expozícia podobná expozícii pri klinickej dávke 400 mg dvakrát denne. U potkanov sa pri dávkach 300
a 600 mg/kg/deň u samíc a 300 mg/kg/deň u samcov zistili tumory (karcinóm skvamóznych buniek)
nosa/nosohltana. Táto neoplázia môže byť následkom lokálneho ukladania a/alebo vdychovania liečiva na sliznicu nosa/nosohltana počas perorálneho podávania dávky sondou do žalúdka
a následného chronického dráždenia a zápalu. Je pravdepodobné, že pre zamýšľané klinické použitie
má obmedzený význam. Pri najvyššej dávke bez pozorovateľných nežiaducich účinkov (NOAEL -„no observable adverse effect level“) bola systémová expozícia podobná expozícii pri klinickej dávke
400 mg dvakrát denne. Štandardné štúdie genotoxicity hodnotiace mutagenitu a klastogenitu boli
negatívne.
Vývojová toxicita
V štúdiách vývojovej toxicity na potkanoch a králikoch nebol raltegravir teratogénny. U mláďat samíc
potkanov, ktoré boli vystavené raltegraviru v dávkach približne 4,4-násobne vyšších, ako je expozícia u ľudí pri dávke 400 mg dvakrát denne na základe AUC0-24 h, sa pozorovalo mierne zvýšenie incidencie nadpočetných rebier. Na základe AUC0-24 h neboli pri 3,4-násobku ľudskej expozície pri dávke 400 mg dvakrát denne pozorované žiadne účinky na vývoj (pozri časť 4.6). Podobné zistenia neboli pozorované u králikov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
- mikrokryštalická celulóza
- monohydrát laktózy
- bezvodý hydrogenfosforečnan vápenatý
- hypromelóza 2208
- poloxamér 407
- stearylfumaran sodný
- stearan horečnatý
Filmový obal
- polyvinylalkohol
- oxid titaničitý
- polyetylénglykol 3350
- mastenec
- červený oxid železitý
- čierny oxid železitý
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti30 mesiacov
6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaFľaša z vysokodenzitného polyetylénu (HDPE) s polypropylénovým detským bezpečnostným uzáverom.
Dostupné sú dve veľkosti balenia: 1 fľaša po 60 tabliet a 3 fľaše po 60 tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMerck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU
Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/07/436/001
EU/1/07/436/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. decembra 2007
Dátum posledného predĺženia registrácie: 14. mája 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ISENTRESS 600 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá filmom obalená tableta obsahuje 600 mg raltegraviru (ako draselnú soľ). Pomocná látka so známym účinkom
Každá 600 mg tableta obsahuje 5,72 mg laktózy (ako monohydrát).
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalená tableta.
Žltá oválna tableta s rozmermi 19,1 mm x 9,7 mm x 6,1 mm, na jednej strane s logom Merck a označením „242“ a bez označenia na druhej strane.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
ISENTRESS 600 mg filmom obalené tablety sú indikované v kombinácii s inými antiretrovírusovými liekmi na liečbu infekcie vírusom ľudskej imunodeficiencie (human immunodeficiency virus, HIV-1) dospelým a pediatrickým pacientom s telesnou hmotnosťou minimálne 40 kg (pozri časti 4.2, 4.4, 5.1 a 5.2).
4.2 Dávkovanie a spôsob podávania
S liečbou má začať lekár, ktorý je skúsený v liečbe infekcie HIV. Dávkovanie
ISENTRESS sa má používať v kombinácii s inými účinnými antiretrovírusovými liečbami
(antiretroviral therapies, ART) (pozri časti 4.4 a 5.1).
Dospelí a pediatrickí pacienti
U dospelých a pediatrických pacientov (s telesnou hmotnosťou minimálne 40 kg) je odporúčané dávkovanie 1 200 mg (dve 600 mg tablety) jedenkrát denne u predtým neliečených pacientov alebo u pacientov vo virologickej supresii pri úvodnom režime lieku ISENTRESS 400 mg dvakrát denne.
Ďalšie dostupné liekové formy a sily
ISENTRESS je tiež dostupný ako 400 mg tablety na použitie dvakrát denne u dospelých alebo detí a dospievajúcich infikovaných HIV s telesnou hmotnosťou minimálne 25 kg. 400 mg tablety sa nemajú používať na podávanie režimu 1 200 mg jedenkrát denne (prosím oboznámte sa so súhrnom charakteristických vlastností pre 400 mg tablety).
ISENTRESS je tiež dostupný v liekovej forme žuvacie tablety pre deti s telesnou hmotnosťou minimálne 11 kg a v liekovej forme granulát na perorálnu suspenziu pre dojčatá a batoľatá staršie ako
4 týždne a s telesnou hmotnosťou minimálne 3 kg do menej ako 20 kg. Ďalšie informácie týkajúce sa dávkovania si prečítajte v súhrne charakteristických vlastností pre žuvacie tablety a granulát na perorálnu suspenziu.
Maximálna dávka žuvacích tabliet je 300 mg dvakrát denne. Pretože liekové formy majú odlišné farmakokinetické profily, ani žuvacie tablety a ani granulát na perorálnu suspenziu sa nemajú zamieňať za 400 mg alebo 600 mg tablety (pozri časť 5.2). Žuvacie tablety a granulát na perorálnu suspenziu sa neskúmali u dospievajúcich (12 až 18 rokov) alebo dospelých infikovaných HIV.
Staršie osoby
O použití raltegraviru u starších osôb sú k dispozícii obmedzené informácie (pozri časť 5.2). ISENTRESS sa má preto v tejto populácii používať s opatrnosťou.
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek nie je potrebná úprava dávkovania (pozri časť 5.2).
Porucha funkcie pečene
U pacientov s miernou až stredne ťažkou poruchou funkcie pečene nie je potrebná úprava dávkovania. U pacientov s ťažkými základnými poruchami pečene nebola bezpečnosť a účinnosť raltegraviru
stanovená. Preto sa má ISENTRESS u pacientov s ťažkou poruchou funkcie pečene používať
s opatrnosťou (pozri časti 4.4 a 5.2).
Pediatrická populácia
Bezpečnosť a účinnosť raltegraviru u dojčiat mladších ako 4 týždne neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Lieková forma ISENTRESS 600 mg filmom obalené tablety sa nemá používať u detí s telesnou hmotnosťou menej ako 40 kg.
Spôsob podávania
Perorálne použitie.
ISENTRESS 600 mg tablety sa môžu podávať s jedlom alebo bez jedla v dávke 1 200 mg jedenkrát denne.
Vzhľadom na predpokladané zmeny vo farmakokinetickom profile sa tablety nemajú žuť, drviť alebo
deliť.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
Pacientov je potrebné informovať, že súčasná antiretrovírusová terapia nelieči infekciu HIV a nebolo
dokázané, že bráni prenosu HIV na iné osoby krvou. Hoci sa preukázalo, že účinná vírusová supresia dosiahnutá pri antiretrovírusovej terapii značne znižuje riziko prenosu HIV pohlavným stykom,
reziduálne riziko nie je možné vylúčiť. Je potrebné prijať opatrenia na zabránenie prenosu HIV
v súlade s národnými odporúčaniami.
Raltegravir má pomerne nízku genetickú bariéru voči rezistencii. Preto sa má raltegravir vždy, keď je to možné, podávať s dvoma ďalšími účinnými ART, aby sa minimalizovala možnosť virologického zlyhania a vzniku rezistencie (pozri časť 5.1).
U predtým neliečených pacientov sú údaje z klinických štúdií o použití raltegraviru obmedzené na použitie v kombinácii s dvoma nukleotidovými inhibítormi reverznej transkriptázy (nucleotide reverse transcriptase inhibitors, NRTI) (emtricitabín a tenofovir-dizoproxilfumarát).
Depresia
Bola hlásená depresia vrátane samovražedných myšlienok a správania, najmä u pacientov s depresiou
alebo psychickým ochorením v anamnéze. U pacientov s depresiou alebo psychickým ochorením v anamnéze sa má postupovať s opatrnosťou.
Porucha funkcie pečene
Bezpečnosť a účinnosť raltegraviru nebola stanovená u pacientov s ťažkými základnými poruchami
pečene. Preto sa má raltegravir u pacientov s ťažkou poruchou funkcie pečene používať s opatrnosťou
(pozri časti 4.2 a 5.2).
Pacienti s už prítomným ochorením pečene vrátane chronickej hepatitídy majú počas kombinovanej antiretrovírusovej terapie zvýšenú frekvenciu abnormalít pečeňovej funkcie a majú byť monitorovaní podľa štandardnej praxe. Ak u takýchto pacientov existuje dôkaz zhoršenia ochorenia pečene, má sa zvážiť prerušenie alebo ukončenie liečby.
U pacientov s chronickou hepatitídou B alebo C liečených kombinovanou antiretrovírusovou terapiou je zvýšené riziko ťažkých a potenciálne fatálnych hepatálnych nežiaducich reakcií.
Osteonekróza
Aj keď sa etiológia považuje za mnohofaktorovú (vrátane používania kortikosteroidov, konzumácie
alkoholu, ťažkej imunosupresie, vyššieho indexu telesnej hmotnosti), boli hlásené prípady osteonekrózy, najmä u pacientov s pokročilým HIV ochorením a/alebo dlhodobou expozíciou kombinovanej antiretrovírusovej terapii. Pacientom sa má odporučiť, aby vyhľadali lekársku pomoc, ak budú mať bolesť kĺbov, stuhnutosť kĺbov alebo ťažkosti s pohybom.
Syndróm imunitnej reaktivácie
U pacientov infikovaných HIV s ťažkou imunodeficienciou môže v čase nasadenia kombinovanej
antiretrovírusovej terapie (combination antiretroviral therapy, CART) vzniknúť zápalová reakcia na asymptomatické alebo reziduálne oportúnne patogény a spôsobiť závažné klinické stavy alebo
zhoršenie príznakov. Takéto reakcie sa typicky pozorovali počas prvých týždňov alebo mesiacov po
nasadení CART. Relevantnými príkladmi sú cytomegalovírusová retinitída, generalizované a/alebo fokálne mykobakteriálne infekcie a pneumónia spôsobená Pneumocystis jiroveci (predtým známa ako
Pneumocystis carinii). Akékoľvek príznaky zápalu sa majú zhodnotiť a v prípade potreby sa má
nasadiť liečba.
Boli zaznamenané aj autoimunitné poruchy (ako je Gravesova choroba) objavujúce sa v dôsledku imunitnej reaktivácie; avšak zaznamenaný čas do ich nástupu je rôznorodejší a tieto udalosti sa môžu vyskytnúť mnoho mesiacov po začatí liečby.
Atazanavir
Súbežné podávanie raltegraviru v dávke 1 200 mg jedenkrát denne s atazanavirom viedlo k zvýšeným
plazmatickým hladinám raltegraviru; súbežné podávanie sa preto neodporúča (pozri časť 4.5).
Tipranavir/ritonavir
Súbežné podávanie raltegraviru v dávke 1 200 mg jedenkrát denne s tipranavirom/ritonavirom môže
viesť k zníženým minimálnym plazmatickým hladinám raltegraviru; súbežné podávanie sa preto neodporúča (pozri časť 4.5).
A
ntacidá
Súbežné podávanie raltegraviru v dávke 1 200 mg jedenkrát denne s antacidami obsahujúcimi
uhličitan vápenatý a hliník/horčík viedlo k zníženým plazmatickým hladinám raltegraviru; súbežné podávanie sa preto neodporúča (pozri časť 4.5).
Silné induktory enzýmov metabolizujúcich liečivá
Silné induktory enzýmov metabolizujúcich liečivá (napr. rifampicín) sa s raltegravirom v dávke
1 200 mg jedenkrát denne neskúmali, ale môžu viesť k zníženým minimálnym plazmatickým hladinám; súbežné podávanie s raltegravirom v dávke 1 200 mg jedenkrát denne sa preto neodporúča.
Myopatia a rabdomyolýza
Bola hlásená myopatia a rabdomyolýza. U pacientov, ktorí v minulosti mali myopatiu alebo
rabdomyolýzu alebo majú akékoľvek predurčujúce faktory vrátane iných liekov spojených s týmito stavmi, je potrebné používať s opatrnosťou (pozri časť 4.8).
Závažné kožné reakcie a reakcie z precitlivenosti
U pacientov užívajúcich raltegravir boli hlásené závažné, potenciálne život ohrozujúce a fatálne kožné
reakcie, vo väčšine prípadov súbežne s inými liekmi spojenými s týmito reakciami. Tieto reakcie zahŕňajú prípady Stevensovho-Johnsonovho syndrómu a toxickej epidermálnej nekrolýzy. Hlásené
boli tiež reakcie z precitlivenosti a boli charakterizované vyrážkou, organickými nálezmi a niekedy poruchou funkcie orgánov vrátane zlyhania pečene. Ak sa objavia prejavy alebo príznaky závažných
kožných reakcií alebo reakcií z precitlivenosti (zahŕňajúce avšak nie obmedzené na závažnú kožnú vyrážku alebo vyrážku sprevádzanú horúčkou, celkovú nevoľnosť, únavu, bolesť svalov a kĺbov,
pľuzgiere, ranky v ústach, konjunktivitídu, opuch tváre, hepatitídu, eozinofíliu, angioedém), okamžite ukončite podávanie raltegraviru alebo iných podozrivých liečiv. Má sa sledovať klinický stav vrátane pečeňových aminotransferáz a má sa začať s vhodnou liečbou. Oddialenie ukončenia liečby
raltegravirom alebo inými podozrivými liečivami po objavení sa závažnej vyrážky môže viesť k život ohrozujúcej reakcii.
Vyrážka
U pacientov predtým liečených režimom obsahujúcim raltegravir a darunavir, sa častejšie vyskytla
vyrážka ako u pacientov dostávajúcich raltegravir bez darunaviru alebo darunavir bez raltegraviru
(pozri časť 4.8).
Laktóza
Filmom obalené tablety ISENTRESS obsahujú laktózu. Pacienti so zriedkavými dedičnými
problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Štúdie in vitro ukazujú, že raltegravir nie je substrátom enzýmov cytochrómu P450 (CYP), neinhibuje CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 alebo CYP3A, neinhibuje UDP glukurónozyltransferázy (UGT) 1A1 a 2B7, neindukuje CYP3A4 a neinhibuje transport sprostredkovaný P-glykoproteínom. Na základe týchto údajov sa neočakáva, že raltegravir bude mať vplyv na farmakokinetiku liekov, ktoré sú substrátmi týchto enzýmov alebo P-glykoproteínu.
Na základe in vitro a in vivo štúdií je raltegravir eliminovaný najmä metabolizáciou cez glukuronidačnú dráhu sprostredkovanú UGT1A1.
Vo farmakokinetike raltegraviru sa pozorovala značná inter- a intraindividuálna variabilita.
Vplyv raltegraviru na farmakokinetiku iných liečiv
V liekových interakčných štúdiách vykonaných s použitím raltegraviru 400 mg dvakrát denne, nemal
raltegravir klinicky významný vplyv na farmakokinetiku etravirínu, maraviroku, tenofovir- dizoproxilfumarátu, hormonálnych kontraceptív, metadónu, midazolamu alebo bocepreviru. Tieto
zistenia je možné rozšíriť na raltegravir 1 200 mg jedenkrát denne a pri týchto liečivách sa nevyžaduje
žiadna úprava dávkovania.
V niektorých štúdiách viedlo súbežné podávanie tabliet s obsahom 400 mg raltegraviru dvakrát denne s darunavirom k miernemu, ale klinicky nevýznamnému zníženiu plazmatických koncentrácií darunaviru. Na základe rozsahu účinku pozorovaného pri podávaní tabliet obsahujúcich 400 mg raltegraviru dvakrát denne sa predpokladá, že vplyv raltegraviru v dávke 1 200 mg jedenkrát denne na plazmatické koncentrácie darunaviru je pravdepodobne klinicky nevýznamný.
Vplyv iných liečiv na farmakokinetiku raltegraviru
Induktory enzýmov metabolizujúcich lieky
Vplyv liečiv, ktoré sú silnými induktormi UGT1A1, ako je napr. rifampicín, na raltegravir v dávke
1 200 mg jedenkrát denne nie je známy, ale súbežné podávanie pravdepodobne znižuje minimálne hladiny raltegraviru na základe zníženia minimálnych koncentrácií pozorovaných pri raltegravire
v dávke 400 mg dvakrát denne; súbežné podávanie s raltegravirom v dávke 1 200 mg jedenkrát denne
sa preto neodporúča. Vplyv iných silných induktorov enzýmov metabolizujúcich liečivá, ako je fenytoín a fenobarbital, na UGT1A1 nie je známy; súbežné podávanie s raltegravirom v dávke
1 200 mg jedenkrát denne sa preto neodporúča. V liekových interakčných štúdiách efavirenz nemal
klinicky významný vplyv na farmakokinetiku raltegraviru v dávke 1 200 mg jedenkrát denne; preto sa ostatné menej silné induktory (napr. efavirenz, nevirapín, rifabutín, glukokortikoidy, ľubovník bodkovaný, pioglitazón) môžu používať s odporúčanou dávkou raltegraviru.
Inhibítory UGT1A1
Súbežné podávanie atazanaviru s raltegravirom v dávke 1 200 mg jedenkrát denne významne zvýšilo plazmatické hladiny raltegraviru; súbežné podávanie raltegraviru v dávke 1 200 mg jedenkrát denne
a atazanaviru sa neodporúča.
Antacidá
Súbežné podávanie raltegraviru v dávke 1 200 mg jedenkrát denne s antacidami obsahujúcimi hliník/horčík a uhličitan vápenatý pravdepodobne vedie ku klinicky významným zníženiam minimálnych plazmatických hladín raltegraviru. Na základe týchto zistení sa súbežné podávanie antacíd obsahujúcich hliník/horčík a uhličitan vápenatý s raltegravirom v dávke 1 200 mg jedenkrát denne neodporúča.
Liečivá, ktoré zvyšujú hodnotu pH v žalúdku
Analýza populačnej farmakokinetiky zo štúdie ONCEMRK (Protokol 292) preukázala, že súbežné podávanie raltegraviru v dávke 1 200 mg jedenkrát denne s inhibítormi protónovej pumpy alebo blokátormi H2-receptora neviedlo k štatisticky významným zmenám vo farmakokinetike raltegraviru. Porovnateľné výsledky účinnosti a bezpečnosti sa získali za neprítomnosti alebo prítomnosti týchto liečiv meniacich hodnotu pH v žalúdku. Na základe týchto údajov sa inhibítory protónovej pumpy
a blokátory H2-receptora môžu súbežne podávať s raltegravirom v dávke 1 200 mg jedenkrát denne.
Ďalšie úvahy
Na vyhodnotenie liekových interakcií ritonaviru, tipranaviru/ritonaviru, bocepreviru alebo etravirínu
s raltegravirom v dávke 1 200 mg (2 x 600 mg) jedenkrát denne sa nevykonali žiadne štúdie. Zatiaľ čo rozsahy zmeny na expozíciu raltegraviru pri raltegravire v dávke 400 mg dvakrát denne spôsobené
ritonavirom, boceprevirom alebo etravirínom boli malé, vplyv tipranaviru/ritonaviru bol väčší (GMR
Cmin=0,45; GMR AUC=0,76). Súbežné podávanie raltegraviru v dávke 1 200 mg jedenkrát denne a tipranaviru/ritonaviru sa neodporúča.
Predchádzajúce štúdie raltegraviru v dávke 400 mg dvakrát denne preukázali, že súbežné podávanie tenofovir-dizoproxilfumarátu (zložka emtricitabín/tenofovir-dizoproxilfumarátu) zvyšuje expozíciu raltegraviru. Zistilo sa, že emtricitabín/tenofovir-dizoproxilfumarát zvyšuje biologickú dostupnosť raltegraviru v dávke 1 200 mg jedenkrát denne o 12 %, tento vplyv však nie je klinicky významný. Súbežné podávanie emtricitabínu/tenofovir-dizoproxilfumarátu a raltegraviru v dávke 1 200 mg jedenkrát denne je preto povolené.
Všetky interakčné štúdie sa vykonali u dospelých.
Komplexné liekové interakčné štúdie sa vykonali s raltegravirom v dávke 400 mg dvakrát denne a obmedzený počet liekových interakčných štúdií sa vykonal pri raltegravire v dávke 1 200 mg jedenkrát denne.
V tabuľke 1 sú uvedené všetky dostupné údaje z interakčných štúdií spolu s odporúčaniami pre súbežné podávanie.
Tabuľka 1
Údaje o farmakokinetických interakciách
Liečivá podľa terapeutickej
oblasti
ANTIRETROVIROTIKÁ
Inhibítory proteázy (PI)
atazanavir/ritonavir (raltegravir 400 mg dvakrát denne)
atazanavir
(raltegravir 1 200 mg jednotlivá
dávka)
Interakcia
(mechanizmus, ak je
známy)
AUC raltegraviru ↑ 41 % C12 h raltegraviru ↑ 77 % Cmax raltegraviru ↑ 24 %
(inhibícia UGT1A1) AUC raltegraviru ↑ 67 % C24 h raltegraviru ↑ 26 % Cmax raltegraviru ↑ 16 %
Odporúčania týkajúce sa
súbežného podávania
Nie je potrebná úprava dávky raltegraviru (400 mg dvakrát denne).
Súbežné podávanie raltegraviru (1 200 mg jedenkrát denne) sa neodporúča.
tipranavir/ritonavir
(raltegravir 400 mg dvakrát
denne)
AUC raltegraviru ↓ 24 %
C12 h raltegraviru ↓ 55 % Cmax raltegraviru ↓ 18 %
Nie je potrebná úprava dávky
raltegraviru (400 mg dvakrát denne).
(indukcia UGT1A1)
Extrapolované zo štúdie s raltegravirom 400 mg dvakrát denne
Nenukleozidové inhibítory reverznej transkriptázy (NNRTI)
Súbežné podávanie raltegraviru (1 200 mg jedenkrát denne) sa neodporúča.
e
f
avirenz
(raltegravir 400 mg jednotlivá
dávka)
AUC raltegraviru ↓ 36 % C12 h raltegraviru ↓ 21 % Cmax raltegraviru ↓ 36 %
(indukcia UGT1A1) Nie je potrebná úprava dávky
 e
f
avirenz
e
f
avirenz
(raltegravir 1 200 mg jednotlivá
dávka)
AUC raltegraviru ↓ 14 % C24 h raltegraviru ↓ 6 % Cmax raltegraviru ↓ 9 %
(indukcia UGT1A1)
raltegraviru (400 mg dvakrát denne a 1 200 mg jedenkrát denne).
Liečivá podľa terapeutickej oblasti
etravirín
(raltegravir 400 mg dvakrát
denne)
Interakcia (mechanizmus, ak je známy)
AUC raltegraviru ↓ 10 % C12 h raltegraviru ↓ 34 % Cmax raltegraviru ↓ 11 %
(indukcia UGT1A1) AUC etravirínu ↑ 10 %
C12 h etravirínu ↑ 17 %
Cmax etravirínu ↑ 4 %
Odporúčania týkajúce sa súbežného podávania
Nie je potrebná úprava dávky raltegraviru ani etravirínu (400 mg dvakrát denne a 1 200 mg jedenkrát denne).
Nukleozidové/nukleotidové inhibítory reverznej transkriptázy
tenofovir-dizoproxilfumarát (raltegravir 400 mg dvakrát denne)
AUC raltegraviru ↑ 49 % C12 h raltegraviru ↑ 3 % Cmax raltegraviru ↑ 64 %
emtricitabín
a tenofovir-dizoproxilfumarát
(raltegravir 1 200 mg
(2 x 600 mg) jedenkrát denne)
(mechanizmus interakcie
neznámy)
AUC tenofoviru ↓ 10 % C24 h tenofoviru ↓ 13 % Cmax tenofoviru ↓ 23 % Analýza populačnej FK preukázala, že vplyv emtricitabínu/tenofovir- dizoproxilfumarátu na farmakokinetiku raltegraviru bol minimálny (12% zvýšenie relatívnej biologickej dostupnosti)
a nebol štatisticky ani klinicky významný.
(mechanizmus interakcie neznámy)
Nie je potrebná úprava dávky raltegraviru (400 mg dvakrát denne a 1 200 mg jedenkrát denne) ani tenofovir-dizoproxilfumarátu.
 Inhibítory CCR5
maravirok
Inhibítory CCR5
maravirok
(raltegravir 400 mg dvakrát denne)
HCV ANTIVIROTIKÁInhibítory proteázy NS3/4A (PI)boceprevir(raltegravir 400 mg jednotlivá
dávka)
AUC raltegraviru ↓ 37 % C12 h raltegraviru ↓ 28 % Cmax raltegraviru ↓ 33 %
(mechanizmus interakcie neznámy)
AUC maraviroku ↓ 14 % C12 h maraviroku ↓ 10 % Cmax maraviroku ↓ 21 %
AUC raltegraviru ↑ 4 % C12 h raltegraviru ↓ 25 % Cmax raltegraviru ↑ 11 %
(mechanizmus interakcie neznámy)
Nie je potrebná úprava dávky raltegraviru (400 mg dvakrát denne a 1 200 mg jedenkrát denne) ani maraviroku.
Nie je potrebná úprava dávky raltegraviru (400 mg dvakrát denne a 1 200 mg jedenkrát denne) ani bocepreviru.
Liečivá podľa terapeutickej oblasti
Interakcia (mechanizmus, ak je známy)
Odporúčania týkajúce sa súbežného podávania
ANTIMIKROBIÁLNE LIEČIVÁ
Antimykobakteriálne liečivá
rifampicín
(raltegravir 400 mg jednotlivá dávka)
SEDATÍVA
midazolam
(raltegravir 400 mg dvakrát
denne)
AUC raltegraviru ↓ 40 % C12 h raltegraviru ↓ 61 % Cmax raltegraviru ↓ 38 %
(indukcia UGT1A1) Extrapolované zo štúdie
s raltegravirom 400 mg
dvakrát denne
AUC midazolamu ↓ 8 % Cmax midazolamu ↑ 3 %
Rifampicín znižuje plazmatické hladiny raltegraviru. Ak sa nedá vyhnúť súbežnému podávaniu
s rifampicínom, môže sa zvážiť zdvojnásobenie dávky raltegraviru
(400 mg dvakrát denne).
Súbežné podávanie raltegraviru (1 200 mg jedenkrát denne) sa neodporúča.
Nie je potrebná úprava dávky raltegraviru (400 mg dvakrát denne a 1 200 mg jedenkrát denne) ani midazolamu.
ANTACIDÁ OBSAHUJÚCE KATIÓN KOVOV
Tieto výsledky ukazujú, že
raltegravir nie je induktor ani inhibítor CYP3A4, a preto sa pri
raltegravire nepredpokladá, že
ovplyvní farmakokinetiku liekov, ktoré sú substrátmi CYP3A4.
antacidum obsahujúce hliník a hydroxid horečnatý (raltegravir 400 mg dvakrát denne)
AUC raltegraviru ↓ 49 % C12 h raltegraviru ↓ 63 % Cmax raltegraviru ↓ 44 %
 2 hodiny pred podanímraltegraviru
2 hodiny pred podanímraltegraviruAUC raltegraviru ↓ 51 %
C12 h raltegraviru ↓ 56 % Cmax raltegraviru ↓ 51 %
2 hodiny po podaníraltegraviruAUC raltegraviru ↓ 30 % C12 h raltegraviru ↓ 57 % Cmax raltegraviru ↓ 24 %
6 hodín pred podanímraltegraviruAUC raltegraviru ↓ 13 %
C12 h raltegraviru ↓ 50 % Cmax raltegraviru ↓ 10 %
6 hodín po podaníraltegraviruAUC raltegraviru ↓ 11 % C12 h raltegraviru ↓ 49 % Cmax raltegraviru ↓ 10 %
(chelácia katiónov kovov)
Antacidá obsahujúce hliník a horčík znižujú plazmatické hladiny raltegraviru. Súbežné podávanie raltegraviru (400 mg dvakrát denne a 1 200 mg jedenkrát denne)
s antacidami obsahujúcimi hliník a/alebo horčík sa neodporúča.
Liečivá podľa terapeutickej oblasti
antacidum obsahujúce hliník a hydroxid horečnatý (raltegravir 1 200 mg jednotlivá dávka)
antacidum obsahujúce uhličitan vápenatý (raltegravir 400 mg dvakrát denne)
Interakcia (mechanizmus, ak je známy)
12 hodín po podaníraltegraviru
AUC raltegraviru ↓ 14 % C24 h raltegraviru ↓ 58 % Cmax raltegraviru ↓ 14 %
(chelácia iónov kovov) AUC raltegraviru ↓ 55 % C12 h raltegraviru ↓ 32 % Cmax raltegraviru ↓ 52 %
(chelácia katiónov kovov)
Odporúčania týkajúce sa súbežného podávania
Nie je potrebná úprava dávky raltegraviru (400 mg dvakrát denne).
antacidum obsahujúce
uhličitan vápenatý
(raltegravir 1 200 mg jednotlivá dávka)
AUC raltegraviru ↓ 72 %
C24 h raltegraviru ↓ 48 % Cmax raltegraviru ↓ 74 %
12 hodín po podaníraltegraviru
AUC raltegraviru ↓ 10 %
C24 h raltegraviru ↓ 57 % Cmax raltegraviru ↓ 2 %
Súbežné podávanie raltegraviru
(1 200 mg jedenkrát denne) sa neodporúča.
(chelácia iónov kovov)
BLOKÁTORY H2-RECEPTORA A INHIBÍTORY PROTÓNOVEJ PUMPY
omeprazol
(raltegravir 400 mg dvakrát
denne)
AUC raltegraviru ↑ 37 %
C12 h raltegraviru ↑ 24 % Cmax raltegraviru ↑ 51 %
 famotidín
famotidín
(raltegravir 400 mg dvakrát denne)
liečivá meniace hodnotu pHv žalúdkuinhibítory protónovej pumpy
(napr. omeprazol), blokátory H2-receptora
(napr. famotidín, ranitidín, cimetidín)
(raltegravir 1 200 mg)
(zvýšená rozpustnosť)
AUC raltegraviru ↑ 44 % C12 h raltegraviru ↑ 6 % Cmax raltegraviru ↑ 60 %
(zvýšená rozpustnosť) Analýza populačnej FK preukázala, že vplyv liečiv meniacich hodnotu pH
v žalúdku na farmakokinetiku raltegraviru bol minimálny
(8,8 % zníženie relatívnej biologickej dostupnosti)
a nebol štatisticky
a klinicky významný.
(zvýšená rozpustnosť liečiva)
Nie je potrebná úprava dávky raltegraviru (400 mg dvakrát denne a 1 200 mg jedenkrát denne).
Liečivá podľa terapeutickej oblasti
Interakcia (mechanizmus, ak je známy)
Odporúčania týkajúce sa súbežného podávania
HORMONÁLN
E KONTRACEPTÍVA
etinylestradiol norelgestromín
(raltegravir 400 mg dvakrát
denne)
OPIOIDNÉ ANALGETIKÁmetadón(raltegravir 400 mg dvakrát denne)
AUC etinylestradiolu
↓ 2 %
Cmax etinylestradiolu ↑ 6 % AUC norelgestromínu
↑ 14 %
Cmax norelgestromínu
↑ 29 %
AUC metadónu ↔ Cmax metadónu ↔
Nie je potrebná úprava dávkovania raltegraviru (400 mg dvakrát denne a 1 200 mg jedenkrát denne) ani hormonálnych kontraceptív (na báze estrogénu a/alebo progesterónu).
Nie je potrebná úprava dávky raltegraviru (400 mg dvakrát denne a 1 200 mg jedenkrát denne) ani metadónu.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii údaje o použití raltegraviru v dávke 1 200 mg jedenkrát denne u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Potenciálne riziko pre ľudí nie je známe. Raltegravir v dávke 1 200 mg jedenkrát denne sa neodporúča počas gravidity.
Register gravidít s antiretrovírusovou liečbou
Aby bolo možné monitorovať účinky na matku-plod u pacientok, u ktorých došlo k neúmyselnému podaniu raltegraviru počas gravidity, bol založený Register gravidít s antiretrovírusovou liečbou.
Lekári sú nabádaní registrovať pacientky v tomto registri.
Ako všeobecné pravidlo pri rozhodovaní o použití antiretrovírusových liečiv na liečbu infekcie HIV
u gravidných žien a následne na zníženie rizika vertikálneho prenosu HIV na novorodenca sa majú na stanovenie bezpečnosti pre plod vziať do úvahy údaje u zvierat, ako aj klinická skúsenosť
u gravidných žien.
Dojčenie
Nie je známe, či sa raltegravir/metabolity vylučujú do ľudského mlieka. Dostupné
farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie raltegraviru/metabolitov do mlieka (podrobné informácie, pozri časť 5:3).
Riziko pre novorodencov/dojčatá nie je možné vylúčiť.
Raltegravir sa nemá používať počas dojčenia. Ako všeobecné pravidlo sa odporúča, aby matky infikované HIV svoje deti nedojčili, aby sa vyhli prenosu HIV.
Fertilita
Pri dávkach do 600 mg/kg/deň, ktoré viedli k 3-násobne vyššej expozícii, ako je expozícia pri
odporúčaných dávkach pre ľudí, sa u samcov a samíc potkana nepozoroval žiadny účinok na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
U niektorých pacientov sa počas liečby režimami obsahujúcimi raltegravir hlásil závrat. Závrat môže ovplyvniť schopnosť niektorých pacientov viesť vozidlá a obsluhovať stroje (pozri časť 4.8).
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Bezpečnostný profil raltegraviru bol stanovený v dvoch randomizovaných klinických štúdiách fázy III
u dospelých pacientov, ktorí už mali skúsenosť s liečbou, a dvoch randomizovaných klinických štúdiách fázy III u predtým neliečených dospelých pacientov. K bezpečnostnému profilu raltegraviru tiež prispeli údaje zo štúdií bezpečnosti po uvedení lieku na trh a zo spontánneho hlásenia.
U pacientov, ktorí už mali skúsenosť s liečbou, sa v dvoch klinických štúdiách používala odporúčaná dávka 400 mg dvakrát denne v kombinácii s optimalizovanou základnou terapiou (optimised background therapy, OBT) u 462 pacientov v porovnaní s 237 pacientmi užívajúcimi placebo
v kombinácii s OBT. Počas dvojito zaslepenej liečby bol celkový čas sledovania 708 pacientorokov v skupine užívajúcej raltegravir 400 mg dvakrát denne a 244 pacientorokov v skupine užívajúcej
placebo.
U predtým neliečených pacientov, sa v jednej štúdii používala odporúčaná dávka 400 mg dvakrát denne v kombinácii s fixnou dávkou emtricitabínu 200 mg (+) tenofovir-dizoproxilfumarátu 245 mg u 281 pacientov v porovnaní s 282 pacientmi užívajúcimi efavirenz (EFV) 600 mg (večer pred spaním) v kombinácii s emtricitabínom (+) tenofovir-dizoproxilfumarátom. Počas dvojito zaslepenej liečby bol celkový čas sledovania 1 104 pacientorokov v skupine užívajúcej raltegravir 400 mg dvakrát denne a 1 036 pacientorokov v skupine užívajúcej efavirenz 600 mg večer pred spaním.
V druhej štúdii sa raltegravir hodnotil u 797 predtým neliečených pacientov infikovaných HIV-1, porovnávajúcej 531 pacientov dostávajúcich raltegravir v dávke 1 200 mg jedenkrát denne
s 266 pacientmi dostávajúcimi raltegravir v dávke 400 mg dvakrát denne, každý v kombinácii s
emtricitabínom (+) tenofovir-dizoproxilfumarátom. Celkový čas sledovania bol 515,6 pacientorokov u pacientov užívajúcich raltegravir 1 200 mg jedenkrát denne a 257,7 pacientorokov u pacientov užívajúcich raltegravir 400 mg dvakrát denne.
Najčastejšie hlásenými nežiaducimi reakciami počas liečby boli bolesť hlavy a nevoľnosť a bolesť brucha, ktorých miera výskytu bola 5 % alebo viac. Najčastejšie hlásenými závažnými nežiaducimi reakciami boli syndróm imunitnej reaktivácie a závažná vyrážka. Pri používaní raltegraviru 400 mg dvakrát denne po uvedení na trh bola menej častou hlásenou závažnou nežiaducou reakciou rabdomyolýza.
V zlúčenej analýze pacientov, ktorí už mali skúsenosť s liečbou, sa vyskytlo prerušenie terapie
z dôvodu nežiaducich reakcií u 3,9 % pacientov užívajúcich raltegravir + OBT a u 4,6 % pacientov užívajúcich placebo + OBT. Prerušenie terapie z dôvodu nežiaducich reakcií u predtým neliečených
pacientov sa vyskytlo u 5,0 % pacientov užívajúcich raltegravir + emtricitabín (+) tenofovir-
dizoproxilfumarát a u 10,0 % pacientov užívajúcich efavirenz + emtricitabín (+) tenofovir- dizoproxilfumarát.
Tabuľkový súhrn nežiaducich reakcií
Nežiaduce reakcie, ktoré považoval skúšajúci za kauzálne súvisiace s raltegravirom (samotným alebo
v kombinácii s inou ART) ako aj nežiaduce reakcie stanovené pri sledovaní lieku po uvedení na trh, sú uvedené nižšie podľa tried orgánových systémov. Frekvencie výskytu sú definované ako časté
(≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100) a neznáme (z dostupných údajov).
Trieda orgánových systémov
Frekvencia Nežiaduce reakcie
Raltegravir (samotný alebo v kombinácii s inou ART)
Infekcie a nákazy Menej časté genitálny herpes, folikulitída, gastroenteritída, herpes simplex, infekcia herpes vírusom, herpes zoster, chrípka, absces lymfatickej uzliny, molluscum contagiosum, nazofaryngitída, infekcia horných dýchacích ciest
Benígne a malígne nádory vrátane nešpecifikovaných novotvarov (cysty a polypy)
Poruchy krvi
a lymfatického systému
Poruchy imunitného systému Poruchy metabolizmu a výživy
Menej časté kožný papilóm
Menej časté anémia, anémia z nedostatku železa, bolesť lymfatickej uzliny, lymfadenopatia, neutropénia, trombocytopénia
Menej časté syndróm imunitnej reaktivácie, precitlivenosť na liečivo, precitlivenosť
Časté znížená chuť do jedla
Menej časté kachexia, diabetes mellitus, dyslipidémia, hypercholesterolémia, hyperglykémia, hyperlipidémia, hyperfágia, zvýšená chuť do jedla, polydipsia, porucha telesného tuku
Psychické poruchy Časté neobvyklé sny, insomnia, nočná mora, abnormálne správanie, depresia
Poruchy nervového systému
Menej časté mentálna porucha, pokus o suicídium, anxieta, stav
zmätenosti, depresívna nálada, veľká depresia, stredná insomnia, zmena nálady, záchvat paniky, porucha spánku,
suicidálne myšlienky, suicidálne správanie (obzvlášť
u pacientov s psychickým ochorením v anamnéze) Časté závrat, bolesť hlavy, psychomotorická hyperaktivita
Menej časté amnézia, syndróm karpálneho tunela, kognitívna porucha, porucha pozornosti, posturálny závrat, porucha chuti, hypersomnia, hypestézia, letargia, porucha pamäti, migréna, periférna neuropatia, parestézia, somnolencia, tenzná bolesť hlavy, tras, slabá kvalita spánku
Poruchy oka Menej časté porucha zraku
Poruchy ucha a labyrintu
Poruchy srdca
a srdcovej činnosti
Časté vertigo
Menej časté tinitus
Menej časté palpitácie, sinusová bradykardia, ventrikulárne extrasystoly
Poruchy ciev Menej časté nával tepla, hypertenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Menej časté dysfónia, epistaxa, nazálna kongescia
Trieda orgánových systémov
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Frekvencia Nežiaduce reakcie
Raltegravir (samotný alebo v kombinácii s inou ART)
Časté abdominálna distenzia, bolesť brucha, hnačka, flatulencia, nauzea, vracanie, dyspepsia
Menej časté gastritída, abdominálny diskomfort, bolesť v hornej časti brucha, citlivosť v oblasti brucha, anorektálny diskomfort, zápcha, sucho v ústach, diskomfort v epigastriu, erozívna duodenitída, eruktácia, gastroezofágová refluxová
choroba, gingivitída, glositída, odynofágia, akútna pankreatitída, peptický vred, krvácanie z rekta
Menej časté hepatitída, hepatálna steatóza, alkoholická hepatitída, zlyhanie pečene
Poruchy kože
a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Poruchy reprodukčného systému a prsníkov Celkové poruchy
a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Časté vyrážka
Menej časté akné, alopécia, akneiformná dermatitída, suchá koža, erytém, ochabnutie tváre, hyperhidróza, lipoatrofia, získaná lipodystrofia, lipohypertrofia, nočné potenie, prurigo, pruritus, generalizovaný pruritus, makulárna vyrážka, makulopapulárna vyrážka, pruritická vyrážka, kožná lézia, urtikária, xeroderma, Stevensov-Johnsonov syndróm, liekový exantém s eozinofíliou a systémovými príznakmi (DRESS)
Menej časté artralgia, artritída, bolesť chrbta, bolesť v boku, muskuloskeletálna bolesť, myalgia, bolesť krku, osteopénia, bolesť v končatine, tendonitída, rabdomyolýza
Menej časté zlyhanie obličiek, nefritída, nefrolitiáza, noktúria, renálna cysta, porucha funkcie obličiek, tubulointersticiálna nefritída
Menej časté erektilná dysfunkcia, gynekomastia, príznaky menopauzy
Časté asténia, únava, pyrexia
Menej časté diskomfort v hrudníku, triaška, opuch tváre, zväčšenie tukového tkaniva, pocit nervozity, nevoľnosť, submandibulárna masa, periférny edém, bolesť
Časté zvýšenie alanínaminotransferázy, atypické lymfocyty, zvýšenie aspartátaminotransferázy, zvýšenie triglyceridov v krvi, zvýšenie lipázy, zvýšená hladina pankreatickej amylázy v krvi
Menej časté zníženie absolútneho počtu neutrofilov, zvýšenie
alkalickej fosfatázy, zníženie albumínu v krvi, zvýšenie amylázy v krvi, zvýšenie bilirubínu v krvi, zvýšenie
cholesterolu v krvi, zvýšenie kreatinínu v krvi, zvýšenie
glukózy v krvi, zvýšenie močovinového dusíka v krvi, zvýšenie kreatínfosfokinázy, zvýšenie krvnej glukózy nalačno, prítomnosť glukózy v moči, zvýšenie vysokodenzitného lipoproteínu, zvýšenie medzinárodného normalizovaného pomeru, zvýšenie nízkodenzitného lipoproteínu, zníženie počtu trombocytov, prítomnosť erytrocytov v moči, zväčšenie obvodu pása, zvýšenie hmotnosti, zníženie počtu leukocytov
Trieda orgánových systémov
Úrazy, otravy a komplikácie liečebného postupu
Frekvencia Nežiaduce reakcie
Raltegravir (samotný alebo v kombinácii s inou ART)
Menej časté náhodné predávkovanie
 Popis vybraných nežiaducich reakcií
Popis vybraných nežiaducich reakcií
V štúdiách raltegraviru v dávke 400 mg dvakrát denne bola u pacientov, ktorí už mali skúsenosť
s liečbou, aj u predtým neliečených pacientov, a ktorým bol nasadený raltegravir spolu s inými antiretrovírusovými liečivami, hlásená rakovina. Jednalo sa o špecifické typy a výskyty rakoviny, aké
sa očakávajú u vysoko imunodeficientnej populácie. Riziko vzniku rakoviny bolo v týchto štúdiách podobné v skupinách dostávajúcich raltegravir a v skupinách dostávajúcich porovnávané liečivá.
U osôb liečených raltegravirom sa pozorovali abnormálne laboratórne hodnoty kreatínkinázy stupňa 2-
4. Bola hlásená myopatia a rabdomyolýza. U pacientov, ktorí v minulosti mali myopatiu alebo rabdomyolýzu alebo majú akékoľvek predurčujúce faktory vrátane iných liekov spojených s týmito stavmi, je potrebné používať s opatrnosťou (pozri časť 4.4).
Boli hlásené prípady osteonekrózy, najmä u pacientov so všeobecne uznávanými rizikovými faktormi, pokročilým HIV ochorením alebo dlhodobou expozíciou kombinovanej antiretrovírusovej terapii (CART). Frekvencia osteonekrózy nie je známa (pozri časť 4.4).
U pacientov infikovaných HIV s ťažkou imunodeficienciou môže v čase nasadenia kombinovanej antiretrovírusovej terapie (CART) vzniknúť zápalová reakcia na asymptomatické alebo reziduálne oportúnne infekcie. Boli zaznamenané aj autoimunitné poruchy (ako je Gravesova choroba); avšak zaznamenaný čas do ich nástupu je rôznorodejší a tieto udalosti sa môžu vyskytnúť mnoho mesiacov po začatí liečby (pozri časť 4.4).
Pri každej z nasledovných klinických nežiaducich reakcií sa objavil minimálne jeden závažný výskyt:
genitálny herpes, anémia, syndróm imunitnej reaktivácie, depresia, mentálna porucha, pokus o suicídium, gastritída, hepatitída, zlyhanie obličiek, náhodné predávkovanie.
V klinických štúdiách pacientov, ktorí už mali skúsenosť s liečbou, sa v režimoch obsahujúcich raltegravir a darunavir v porovnaní s režimami obsahujúcimi raltegravir bez darunaviru alebo darunavir bez raltegraviru častejšie pozorovala vyrážka, bez ohľadu na príčinu jej vzniku. Vyrážka,
ktorá sa podľa názoru skúšajúceho považovala za súvisiacu s liekom, sa objavila v podobných mierach výskytu. Miery výskytu vyrážky upravené na expozíciu (všetky príčiny) boli 10,9 pri raltegravire +
darunavire, 4,2 pri raltegravire bez darunaviru a 3,8 pri darunavire bez raltegraviru na 100
pacientorokov (PYR) a miery výskytu vyrážky súvisiacej s liekom boli 2,4 pri raltegravire +
darunavire, 1,1 pri raltegravire bez darunaviru a 2,3 pri darunavire bez raltegraviru na 100 PYR. Vyrážky pozorované v klinických štúdiách boli mierne až stredne závažné a neviedli k vysadeniu liečby (pozri časť 4.4).
Pacienti súbežne infikovaní vírusom hepatitídy B a/alebo hepatitídy CPacientom, ktorí mali chronickú (ale nie akútnu) aktívnu koinfekciu hepatitídou B a/alebo hepatitídou C, bolo povolené zaradiť sa do štúdií raltegraviru fázy III za predpokladu, že testy východiskovej funkcie pečene neprekročili 5-násobok hornej hranice normálneho rozpätia. V štúdiách pacientov, ktorí už mali skúsenosť s liečbou, bolo v štúdii BENCHMRK 1 a BENCHMRK 2 (Protokol 018
a Protokol 019) súbežne infikovaných 16 % zo všetkých pacientov (114/699); v štúdiách predtým neliečených pacientov bolo v štúdii STARTMRK (Protokol 021) súbežne infikovaných 6 % (34/563)
pacientov a v štúdii ONCEMRK (Protokol 292) bolo súbežne infikovaných 2,9 % (23/797) pacientov.
Vo všeobecnosti bol bezpečnostný profil raltegraviru u pacientov súbežne infikovaných vírusom hepatitídy B a/alebo hepatitídy C podobný profilu u pacientov bez koinfekcie vírusom hepatitídy B a/alebo hepatitídy C, hoci miery abnormalít AST a ALT boli v oboch liečebných skupinách o niečo vyššie v podskupine s koinfekciou vírusom hepatitídy B a/alebo hepatitídy C.
U pacientov, ktorí už mali skúsenosť s liečbou, sa abnormálne laboratórne hodnoty stupňa 2 alebo vyššieho, čo vyjadruje stupeň zhoršenia oproti východiskovým hodnotám AST, ALT alebo celkového bilirubínu, vyskytli v 96. týždni u 29 %, 34 %, resp. 13 % súbežne infikovaných pacientov liečených raltegravirom, oproti 11 %, 10 %, resp. 9 % všetkých ostatných pacientov liečených raltegravirom.
U predtým neliečených pacientov sa abnormálne laboratórne hodnoty stupňa 2 alebo vyššieho, čo vyjadruje stupeň zhoršenia oproti východiskovým hodnotám AST, ALT alebo celkového bilirubínu, vyskytli v 240. týždni u 22 %, 44 %, resp. 17 % súbežne infikovaných pacientov liečených raltegravirom, oproti 13 %, 13 %, resp. 5 % všetkých ostatných pacientov liečených raltegravirom.
Pediatrická populáciaISENTRESS v liekovej forme 600 mg tablety sa neskúmal u detských a dospievajúcich pacientov
(pozri časť 4.2).
Deti a dospievajúci vo veku od 2 do 18 rokovRaltegravir dvakrát denne sa skúmal u 126 detí a dospievajúcich infikovaných HIV-1 vo veku od 2 do
18 rokov so skúsenosťou s antiretrovírusovou liečbou v kombinácii s inými antiretrovírusovými liečivami v štúdii IMPAACT P1066 (pozri časti 5.1 a 5.2). 96 zo 126 pacientov dostávalo odporúčanú
dávku lieku raltegravir dvakrát denne.
U týchto 96 detí a dospievajúcich boli frekvencia, typ a závažnosť nežiaducich reakcií súvisiacich s liekom do 48. týždňa porovnateľné s nežiaducimi reakciami, ktoré sa pozorovali u dospelých.
U jedného pacienta sa vyskytli klinické nežiaduce reakcie psychomotorickej hyperaktivity 3. stupňa, abnormálne správanie a insomnia, ktoré súviseli s liekom; u jedného pacienta sa objavila závažná alergická vyrážka 2. stupňa súvisiaca s liekom.
U jedného pacienta sa objavili laboratórne abnormality, hladiny AST 4. stupňa a hladiny ALT 3. stupňa, ktoré súviseli s liekom a ktoré sa považovali za závažné.
Dojčatá a batoľatá vo veku 4 týždne do menej ako 2 rokyRaltegravir dvakrát denne sa tiež skúmal u 26 dojčiat a batoliat infikovaných HIV-1 vo veku 4 týždne do menej ako 2 roky v kombinácii s inými antiretrovírusovými liečivami v štúdii IMPAACT P1066 (pozri časti 5.1 a 5.2).
U týchto 26 dojčiat a batoliat boli frekvencia, typ a závažnosť nežiaducich reakcií súvisiacich s liekom do 48. týždňa porovnateľné s nežiaducimi reakciami, ktoré sa pozorovali u dospelých.
U jedného pacienta sa vyskytla závažná alergická vyrážka 3. stupňa súvisiaca s liekom, ktorá viedla k ukončeniu liečby.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieO liečbe predávkovania raltegravirom nie sú k dispozícii žiadne špecifické informácie.
V prípade predávkovania sa odporúča vykonať štandardné podporné opatrenia, napr. odstrániť neabsorbovaný materiál z gastrointestinálneho traktu, zaviesť klinické monitorovanie (vrátane vyhotovenia elektrokardiogramu) a ak je to potrebné, nasadiť podpornú liečbu. Treba vziať do úvahy, že raltegravir je na klinické použitie vo forme draselnej soli. Nie je známe, do akej miery je raltegravir dialyzovateľný.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antivirotiká na systémové použitie, iné antivirotiká, ATC kód: J05AX08
Mechanizmus účinku
Raltegravir je inhibítor prenosu reťazcov integrázou účinný proti vírusu ľudskej imunodeficiencie
(HIV-1). Raltegravir inhibuje katalytickú aktivitu integrázy, enzýmu kódovaného HIV, ktorý je potrebný na vírusovú replikáciu. Inhibícia integrázy zabraňuje kovalentnému vloženiu alebo integrácii
genómu HIV do genómu hostiteľskej bunky. Genómy HIV, ktoré sa nedokážu včleniť, nemôžu riadiť tvorbu nových infekčných vírusových častíc, takže inhibícia integrácie zabraňuje šíreniu vírusovej
infekcie.
Antivírusová aktivita in vitro
Raltegravir v koncentráciách 31 ± 20 nmol/l viedol k 95 % inhibícii (IC95) replikácie HIV-1
(v porovnaní s neliečenou kultúrou infikovanou vírusom) v ľudských T-lymfoidných bunkových
kultúrach infikovaných na bunkovú líniu adaptovaným HIV-1 variantom H9IIIB. Okrem toho raltegravir inhiboval vírusovú replikáciu v kultúrach mitogénom aktivovaných ľudských
mononukleárov z periférnej krvi infikovaných rôznymi primárnymi klinickými izolátmi HIV-1 vrátane izolátov z 5 podtypov non-B a izolátov rezistentných voči inhibítorom reverznej transkriptázy
a inhibítorom proteázy. V teste s jedným cyklom infekcie raltegravir inhiboval infekciu 23 izolátmi HIV reprezentujúcimi 5 podtypov non-B a 5 cirkulujúcich rekombinantných foriem s hodnotami IC50 v rozsahu od 5 do 12 nmol/l.
Rezistencia
Analýzy rezistencie boli vykonané v štúdiách raltegraviru dvakrát denne a jedenkrát denne. V štúdiách
s podávaním lieku dvakrát denne mala väčšina vírusov izolovaných od pacientov, u ktorých raltegravir zlyhal, vysokú úroveň rezistencie voči raltegraviru vyplývajúcu z prítomnosti dvoch alebo viacerých
mutácií. Väčšina mala charakteristickú mutáciu 155. aminokyseliny (N155 zamenená za H), 148.
aminokyseliny (Q148 zamenená za H, K alebo R) alebo 143. aminokyseliny (Y143 zamenená za H, C alebo R), popri jednej alebo viacerých ďalších mutáciách integrázy (napr. L74M, E92Q, T97A, E138A/K, G140A/S, V151I, G163R, S230R). Charakteristické mutácie znižovali citlivosť vírusu voči raltegraviru a prítomnosť ďalších mutácií mala za následok ďalší pokles citlivosti voči raltegraviru. Mutácie raltegraviru identifikované v štúdii s podávaním lieku jedenkrát denne boli podobné tým, ktoré sa v minulosti identifikovali v štúdiách s podaním lieku dvakrát denne (N155H, N155H/I203M and L74M/E92Q). Faktory, ktoré znižovali pravdepodobnosť vzniku rezistencie, zahŕňali nižšiu základnú vírusovú záťaž a použitie iných účinných antiretrovírusových liečiv. Mutácie spôsobujúce rezistenciu na raltegravir vo všeobecnosti spôsobujú aj rezistenciu na elvitegravir, inhibítor prenosu reťazcov integrázou. Mutácie 143. aminokyseliny spôsobujú väčšiu rezistenciu na raltegravir ako na elvitegravir a mutácia E92Q spôsobuje väčšiu rezistenciu na elvitegravir ako na raltegravir. Pri vírusoch s mutáciou 148. aminokyseliny spolu s jednou alebo viacerými inými mutáciami rezistencie na raltegravir sa môže vyskytovať aj klinicky významná rezistencia na dolutegravir.
Klinická skúsenosť
Dôkaz účinnosti raltegraviru bol založený na analýzach 96-týždňových údajov z dvoch
randomizovaných, dvojito zaslepených, placebom kontrolovaných skúšaní (BENCHMRK 1
a BENCHMRK 2, Protokoly 018 a 019) u dospelých pacientov infikovaných HIV-1, ktorí už mali skúsenosť s antiretrovírusovou liečbou, analýze 240-týždňových údajov z randomizovaného, dvojito
zaslepeného, aktívnym komparátorom kontrolovaného skúšania (STARTMRK, Protokol 021)
u dospelých pacientov infikovaných HIV-1 predtým neliečených antiretrovírusovou liečbou a analýze
48-týždňových údajov z randomizovaného, dvojito zaslepeného, aktívnym komparátorom kontrolovaného skúšania (ONCEMRK Protokol 292) u dospelých pacientov infikovaných HIV-1 predtým neliečených antiretrovírusovou liečbou.
Účinnosť
Dospelí pacienti, ktorí už mali skúsenosť s liečbou (400 mg dvakrát denne)
BENCHMRK 1 a BENCHMRK 2 (multicentrické randomizované dvojito zaslepené placebom kontrolované skúšania) hodnotili bezpečnosť a antiretrovírusovú aktivitu raltegraviru 400 mg dvakrát
denne oproti placebu v kombinácii s optimalizovanou základnou terapiou (optimised background
therapy, OBT) u pacientov infikovaných HIV vo veku 16 rokov a starších s dokumentovanou rezistenciou na minimálne jeden liek v každej z 3 tried (NRTI, NNRTI, PI) antiretrovírusovej terapie. Pred randomizáciou zvolil skúšajúci OBT na základe pacientovej doterajšej liečebnej anamnézy, ako aj na základe východiskového testovania genotypovej a fenotypovej vírusovej rezistencie.
Demografia (pohlavie, vek a rasa) a východiskové charakteristiky pacientov boli medzi skupinami dostávajúcimi raltegravir 400 mg dvakrát denne a placebo porovnateľné. Pacienti boli v minulosti vystavení mediánu 12 antiretrovirotík počas mediánu 10 rokov. V rámci OBT sa použil medián 4
ART.
Výsledky 48-týždňových a 96-týždňových analýz
Stále výsledky (48. týždeň a 96. týždeň) u pacientov s odporúčanou dávkou raltegraviru 400 mg dvakrát denne zo zlúčených štúdií BENCHMRK 1 a BENCHMRK 2 sú znázornené v tabuľke 2.
Tabuľka 2
Výsledky účinnosti v 48. a 96. týždni
BENCHMRK 1 a 2 zlúčené
48. týždeň 96. týždeň
Parameter
Percento HIV-RNA <400 kópií/ml (95 % IS)
R
altegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)
R
altegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)





Všetci pacienti† 72 (68, 76) 37 (31, 44) 62 (57, 66) 28 (23, 34) Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 62 (53, 69) 17 (9, 27) 53 (45, 61) 15 (8, 25)
≤100 000 kópií/ml 82 (77, 86) 49 (41, 58) 74 (69, 79) 39 (31, 47) Počet CD4 ≤50 buniek/mm3 61 (53, 69) 21 (13, 32) 51 (42, 60) 14 (7, 24)
>50 a ≤200 buniek/mm3 80 (73, 85) 44 (33, 55) 70 (62, 77) 36 (25, 48)
>200 buniek/mm3 83 (76, 89) 51 (39, 63) 78 (70, 85) 42 (30, 55) Skóre citlivosti (GSS)§
0 52 (42, 61) 8 (3, 17) 46 (36, 56) 5 (1, 13)
1 81 (75, 87) 40 (30, 51) 76 (69, 83) 31 (22, 42)
2 a vyššie 84 (77, 89) 65 (52, 76) 71 (63, 78) 56 (43, 69)
Percento HIV-RNA <50 kópií/ml (95 % IS)Všetci pacienti† 62 (57, 67) 33 (27, 39) 57 (52, 62) 26 (21, 32) Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 48 (40, 56) 16 (8, 26) 47 (39, 55) 13 (7, 23)
≤100 000 kópií/ml 73 (68, 78) 43 (35, 52) 70 (64, 75) 36 (28, 45) Počet CD4 ≤50 buniek/mm3 50 (41, 58) 20 (12, 31) 50 (41, 58) 13 (6, 22)
>50 a ≤200 buniek/mm3 67 (59, 74) 39 (28, 50) 65 (57, 72) 32 (22, 44)
>200 buniek/mm3 76 (68, 83) 44 (32, 56) 71 (62, 78) 41 (29, 53) Skóre citlivosti (GSS)§
0 45 (35, 54) 3 (0, 11) 41 (32, 51) 5 (1, 13)
1 67 (59, 74) 37 (27, 48) 72 (64, 79) 28 (19, 39)
2 a vyššie 75 (68, 82) 59 (46, 71) 65 (56, 72) 53 (40, 66)
BENCHMRK 1 a 2 zlúčené
48. týždeň 96. týždeň
Parameter
Priemerná zmena počtu CD4 buniek (95 % IS), bunky/mm
3
R
altegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)
R
altegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)
Všetci pacienti‡ 109 (98,
121)
45 (32, 57) 123 (110,
137)
49 (35, 63)
Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 126 (107,
144)
≤100 000 kópií/ml 100 (86,
115) Počet CD4 ≤50 buniek/mm3 121 (100,
142)
>50 a ≤200 buniek/mm3 104 (88,
119)
>200 buniek/mm3 104 (80,
129)
36 (17, 55) 140 (115,
165)
49 (33, 65) 114 (98,
131)
33 (18, 48) 130 (104,
156)
47 (28, 66) 123 (103,
144)
54 (24, 84) 117 (90,
143)
40 (16, 65)
53 (36, 70)
42 (17, 67)
56 (34, 79)
48 (23, 73)
Skóre citlivosti (GSS)§
0 81 (55, 106) 11 (4, 26) 97 (70, 124) 15 (-0, 31)
1 113 (96,
130)
2 a vyššie 125 (105,
144)
44 (24, 63) 132 (111,
154)
76 (48, 103) 134 (108,
159)
45 (24, 66)
90 (57, 123)





† Pacient, ktorý nedokončil štúdiu, sa posudzuje ako zlyhanie: pacienti, ktorí predčasne prerušili, sú následne pokladaní za neúspešných.
Hlásené je percento pacientov s odpoveďou a príslušný 95 % interval spoľahlivosti (IS).
‡ Na analýzu podľa prognostických faktorov sa pre percentá <400 a 50 kópií/ml virologické zlyhania prenášali (carried forward). Pre priemerné zmeny počtu CD4 sa na virologické zlyhania použila metóda prenosu východiskovej hodnoty (baseline-carry-forward).
§ Skóre genotypovej citlivosti (GSS) bolo definované ako súčet perorálnych ART v optimalizovanej základnej terapii (OBT), na ktoré
vírusový izolát pacienta vykazoval genotypovú citlivosť na základe testu genotypovej rezistencie. Použitie enfuvirtidu v OBT
u pacientov, ktorí nemali predchádzajúcu skúsenosť s enfuvirtidom, sa počítalo ako jeden účinný liek v OBT. Podobne sa použitie darunaviru v OBT u pacientov doposiaľ neliečených darunavirom počítalo ako jeden účinný liek v OBT.
Raltegravir dosiahol virologické odpovede (pri použití prístupu: pacient, ktorý nedokončil=zlyhanie)
HIV RNA <50 kópií/ml v 16. týždni u 61,7 % pacientov, v 48. týždni u 62,1 % pacientov a v 96. týždni u 57,0 %. U niektorých pacientov došlo medzi 16. a 96. týždňom k opätovnému vírusovému
nárastu. Faktory spojené so zlyhaním zahŕňajú vysokú počiatočnú vírusovú záťaž a OBT, ktorá
nezahŕňala minimálne jedno účinné liečivo.
Prechod na raltegravir (400 mg dvakrát denne)Štúdie SWITCHMRK 1 a 2 (Protokoly 032 a 033) hodnotili pacientov infikovaných HIV, ktorí dostávali supresívnu (skríning HIV RNA <50 kópií/ml; stabilný režim >3 mesiace) terapiu
s lopinavirom 200 mg (+) ritonavirom 50 mg 2 tablety dvakrát denne plus najmenej 2 nukleozidové inhibítory reverznej transkriptázy, a randomizovali ich v pomere 1:1 tak, aby pokračovali v užívaní
lopinaviru (+) ritonaviru 2 tablety dvakrát denne (n=174, resp. n=178) alebo sa lopinavir (+) ritonavir nahradili raltegravirom 400 mg dvakrát denne (n=174, resp. n=176). Pacienti s virologickým zlyhaním v anamnéze neboli vylúčení a počet predchádzajúcich antiretrovírusových terapií nebol obmedzený.
Tieto štúdie boli ukončené po primárnej analýze účinnosti v 24. týždni, pretože sa im nepodarilo preukázať neinferioritu raltegraviru oproti lopinaviru (+) ritonaviru. V oboch štúdiách sa v 24. týždni supresia HIV RNA na menej ako 50 kópií/ml udržala u 84,4 % pacientov v skupine s raltegravirom oproti 90,6 % v skupine s lopinavirom (+) ritonavirom (pacienti, ktorí nedokončili štúdiu = zlyhanie). O potrebe podávať raltegravir s dvoma ďalšími účinnými liečivami pozri časť 4.4.
Predtým neliečení dospelí pacienti (400 mg dvakrát denne)
V STARTMRK (multicentrické randomizované, dvojito zaslepené, aktívnym komparátorom kontrolované skúšanie) sa hodnotila bezpečnosť a antiretrovírusová aktivita raltegraviru 400 mg dvakrát denne oproti efavirenzu 600 mg večer pred spaním, v kombinácii s emtricitabínom (+) tenofovir-dizoproxilfumarátom, u predtým neliečených pacientov infikovaných HIV s HIV
RNA >5 000 kópií/ml. Randomizácia bola stratifikovaná podľa skríningu hladiny HIV RNA (≤50 000 kópií/ml a >50 000 kópií/ml) a podľa infekcie hepatitídou B alebo C (pozitívna alebo negatívna).
Demografia (pohlavie, vek a rasa) a východiskové charakteristiky pacientov boli medzi skupinou užívajúcou raltegravir 400 mg dvakrát denne a skupinou, ktorá užívala efavirenz 600 mg večer pred spaním, porovnateľné.
Výsledky 48-týždňových a 240-týždňových analýzPokiaľ ide o primárny cieľový ukazovateľ účinnosti, podiel (%) pacientov, ktorí dosiahli HIV RNA
< 50 kópií/ml v 48. týždni, bol 241/280 (86,1 %) v skupine užívajúcej raltegravir a 230/281 (81,9 %)
v skupine užívajúcej efavirenz. Terapeutický rozdiel (raltegravir – efavirenz) bol 4,2 % s príslušným
95 % IS (-1,9, 10,3), čo potvrdzuje, že raltegravir nie je inferiórny oproti efavirenzu (p-hodnota pre neinferioritu <0,001). Terapeutický rozdiel (raltegravir – efavirenz) v 240. týždni bol 9,5 %,
s príslušným 95 % IS (1,7, 17,3). Výsledky v 48. týždni a 240. týždni u pacientov užívajúcich

odporúčanú dávku raltegraviru 400 mg dvakrát denne zo štúdie STARTMRK sú uvedené v tabuľke 3.
Tabuľka 3Výsledky účinnosti v 48. a 240. týždni
Štúdia STARTMRK
48. týždeň 240. týždeň
Parameter
 Percento HIV-RNA <50 kópií/ml (95 % IS)
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
600 mg večer pred spaním
(N=282)
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
Percento HIV-RNA <50 kópií/ml (95 % IS)
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
600 mg večer pred spaním
(N=282)
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
 600 mg večer pred spaním
(N=282)
600 mg večer pred spaním
(N=282)
Všetci pacienti† 86 (81, 90) 82 (77, 86) 71 (65, 76) 61 (55, 67) Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 91 (85, 95) 89 (83, 94) 70 (62, 77) 65 (56, 72)
≤100 000 kópií/ml 93 (86, 97) 89 (82, 94) 72 (64, 80) 58 (49, 66) Počet CD4 ≤50 buniek/mm3 84 (64, 95) 86 (67, 96) 58 (37, 77) 77 (58, 90)
>50 a ≤200 buniek/mm3 89 (81, 95) 86 (77, 92) 67 (57, 76) 60 (50, 69)

>200 buniek/mm3 94 (89, 98) 92 (87, 96) 76 (68, 82) 60 (51, 68) Vírusový podtyp vetvy B 90 (85, 94) 89 (83, 93) 71 (65, 77) 59 (52, 65) nepatriaci do vetvy B 96 (87, 100) 91 (78, 97) 68 (54, 79) 70 (54, 82)
Priemerná zmena počtu CD4 buniek (95 % IS), bunky/mm3 Všetci pacienti‡ 189 (174,
204)
163 (148,
178)
374 (345,
403)
312 (284,
339)
Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 196 (174,
219)
≤100 000 kópií/ml 180 (160,
200) Počet CD4 ≤50 buniek/mm3 170 (122,
218)
>50 a ≤200 buniek/mm3 193 (169,
217)
>200 buniek/mm3 190 (168,
212)
192 (169,
214)
134 (115,
153)
152 (123,
180)
175 (151,
198)
157 (134,
181)
392 (350,
435)
350 (312,
388)
304 (209,
399)
413 (360,
465)
358 (321,
395)
329 (293,
364)
294 (251,
337)
314 (242,
386)
306 (264,
348)
316 (272,
359)
 Štúdia STARTMRK
48. týždeň 240. týždeň
Štúdia STARTMRK
48. týždeň 240. týždeň
Parameter
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
600 mg večer pred spaním
(N=282)
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
 600 mg večer pred spaním
(N=282)
600 mg večer pred spaním
(N=282)

Vírusový podtyp vetvy B 187 (170,
204)
nepatriaci do vetvy B 189 (153,
225)
164 (147,
181)
156 (121,
190)
380 (346,
414)
332 (275,
388)
303 (272,
333)
329 (260,
398)

† Pacient, ktorý nedokončil štúdiu, sa posudzuje ako zlyhanie: pacienti, ktorí predčasne prerušili, sú následne pokladaní za neúspešných.
Hlásené je percento pacientov s odpoveďou a príslušný 95 % interval spoľahlivosti (IS).
‡ Na analýzu podľa prognostických faktorov sa pre percentá <50 a 400 kópií/ml virologické zlyhania prenášali (carried forward). Pre priemerné zmeny počtu CD4 sa na virologické zlyhania použila metóda prenosu východiskovej hodnoty (baseline-carry-forward).
Poznámky: Analýza vychádza zo všetkých dostupných údajov.

Raltegravir a efavirenz sa podávali s emtricitabínom (+) tenofovir-dizoproxilfumarátom.
Predtým neliečení dospelí pacienti (1 200 mg [2 x 600 mg] jedenkrát denne)V ONCEMRK (multicentrické randomizované, dvojito zaslepené, aktívnym komparátorom kontrolované skúšanie) sa hodnotila bezpečnosť a antiretrovírusová aktivita raltegraviru 1 200 mg
jedenkrát denne + emtricitabínu (+) tenofovir-dizoproxilfumarátu oproti raltegraviru 400 mg dvakrát denne v kombinácii s emtricitabínom (+) tenofovir-dizoproxilfumarátom, u predtým neliečených
pacientov infikovaných HIV s HIV RNA >1 000 kópií/ml. Randomizácia bola stratifikovaná podľa skríningu hladiny HIV RNA (≤ 100 000 kópií/ml a > 100 000 kópií/ml) a podľa infekcie hepatitídou B alebo C (pozitívna alebo negatívna).
Demografia (pohlavie, vek a rasa) a východiskové charakteristiky pacientov boli medzi skupinou užívajúcou raltegravir 1 200 mg jedenkrát denne a skupinou, ktorá užívala raltegravir 400 mg dvakrát denne, porovnateľné.
Výsledky 48-týždňových analýzPokiaľ ide o primárny cieľový ukazovateľ účinnosti, podiel (%) pacientov, ktorí dosiahli HIV RNA
< 40 kópií/ml v 48. týždni, bol 472/531 (88,9 %) v skupine užívajúcej raltegravir 1 200 mg jedenkrát denne a 235/266 (88,3 %) v skupine užívajúcej raltegravir 400 mg dvakrát denne. Terapeutický rozdiel (raltegravir 1 200 mg jedenkrát denne – raltegravir 400 mg dvakrát denne) bol 0,5 % s príslušným
95 % IS (-4,2, 5,2), čo potvrdzuje, že raltegravir 1 200 mg jedenkrát denne nie je inferiórny oproti raltegraviru 400 mg dvakrát denne. Výsledky v 48. týždni zo štúdie ONCEMRK sú uvedené v tabuľke

4.
Tabuľka 4 Výsledky účinnosti v 48. týždni
Výsledky účinnosti v 48. týždni
Štúdia ONCEMRK
Raltegravir
48
. týždeň
Raltegravir
Para
m
eter
 Percento HIV-RNA < 40 kópií/ml (95 % IS)
60
0 mg (1 200 mg Jedenkrát denne) (N = 531)
40
0 mg dvakrát denne (N = 266)
Percento HIV-RNA < 40 kópií/ml (95 % IS)
60
0 mg (1 200 mg Jedenkrát denne) (N = 531)
40
0 mg dvakrát denne (N = 266)
Všetci pacienti† 88,9 (85.9, 91.4) 88,3 (83,9, 91,9)
Východiskové charakteristiky‡
HIV-RNA > 100 000 kópií/ml 86,7 (80,0, 91,8) 83,8 (73,4, 91,3)
≤ 100 000 kópií/ml 97,2 (94,9, 98,7) 97,7 (94,3, 99,4) Počet CD4 buniek ≤ 200 buniek/mm3 85,1 (74,3, 92,6) 87,9 (71,8, 96,6)
> 200 buniek/mm3 95,6 (93,2, 97,3) 94,5 (90,6, 97,1)
Vírusový podtyp vetvy B 94,6 (91,4, 96,8) 93,7 (89,0, 96,8)
nepatriaci do vetvy B 93,6 (89,1, 96,6) 93,2 (84,9, 97,8)
Štúdia ONCEMRK
Raltegravir
48
. týždeň
Raltegravir
Para
m
eter
Priemerná zmena počtu CD4 buniek (95 % IS), bunky/mm
3
60
0 mg (1 200 mg Jedenkrát denne) (N = 531)
40
0 mg dvakrát denne (N = 266)





Všetci pacienti‡ 232 (215, 249) 234 (213, 255)
Východiskové charakteristiky‡
HIV-RNA > 100 000 kópií/ml 276 (245, 308) 256 (218, 294)
≤ 100 000 kópií/ml 214 (194, 235) 225 (199, 251) Počet CD4 buniek ≤ 200 buniek/mm3 209 (176, 243) 209 (172, 245)
> 200 buniek/mm3 235 (216, 255) 238 (214, 262)
Vírusový podtyp vetvy B 232 (209, 254) 240 (213, 266)
nepatriaci do vetvy B 233 (205, 261) 226 (191, 261)
† Pacient, ktorý nedokončil štúdiu, sa posudzuje ako zlyhanie: pacienti, ktorí predčasne prerušili, sú následne pokladaní za neúspešných. Hlásené je percento pacientov s odpoveďou a príslušný 95 % interval spoľahlivosti (IS).
‡ Na analýzu podľa prognostických faktorov sa pre percentá < 40 kópií/ml virologické zlyhania prenášali (carried forward). Pre priemerné zmeny
počtu CD4 sa na virologické zlyhania použila metóda prenosu východiskovej hodnoty (baseline-carry-forward). Raltegravir 1 200 mg QD a raltegravir 400 mg BID sa podávali emtricitabínom (+) tenofovir-dizoproxilfumarátom.
5.2 Farmakokinetické vlastnostiAbsorpciaU zdravých dobrovoľníkov, ktorým sa podali jednotlivé perorálne dávky raltegraviru nalačno, sa
preukázalo, že sa raltegravir rýchlo absorbuje s tmax približne 3 hodiny po podaní dávky. AUC a Cmax raltegraviru sa zvyšujú úmerne dávke v rozmedzí dávok 100 mg až 1 600 mg. C12 h raltegraviru sa zvyšuje úmerne dávke v rozmedzí dávok 100 až 800 mg a zvyšuje sa o niečo menej, ako je úmerné dávke v rozmedzí dávok 100 mg až 1 600 mg.
Pri dávkovaní dvakrát denne sa farmakokinetický rovnovážny stav dosahuje rýchlo, približne
v priebehu prvých 2 dní užívania lieku. Dochádza len k malej až žiadnej kumulácii v AUC a Cmax a dokázaná je mierna kumulácia v C12 h. Absolútna biologická dostupnosť raltegraviru nebola stanovená.
Raltegravir 1 200 mg jedenkrát denne sa tiež rýchlo absorbuje s mediánom tmax približne 1,5 až
2 hodiny nalačno a vytvára vyššie absorpčné maximum s tendenciou k vyššej Cmax v porovnaní
s raltegravirom dvakrát denne (1 x 400 mg tableta dvakrát denne). Okrem toho, s ohľadom na liekovú
formu raltegravru 400 mg, má lieková forma raltegraviru 600 mg používaná v dávkovacom režime
1 200 mg jedenkrát denne (2 x 600 mg) vyššiu relatívnu biologickú dostupnosť (o 21 až 66 %). Po absorpcii obe liekové formy raltegraviru vykazujú podobnú farmakokinetiku. Po podaní dávky raltegraviru 1 200 mg jedenkrát denne bola AUC0-24 v ustálenom stave 53,7 hod·µmol/l, C24 bola
75,6 n µmol/l a medián Tmax bol 1,50 hodín.
Raltegravir 400 mg dvakrát denne sa môže podávať s jedlom alebo bez jedla. V pivotných štúdiách bezpečnosti a účinnosti u pacientov infikovaných HIV sa raltegravir podával bez ohľadu na jedlo. Podanie viacnásobných dávok raltegraviru po jedle s miernym obsahom tuku neovplyvnilo AUC raltegraviru v klinicky významnej miere, AUC stúpla o 13 % v porovnaní s podaním nalačno. Po podaní po jedle s miernym obsahom tuku bola C12 h raltegraviru o 66 % vyššia a Cmax o 5 % vyššia ako po podaní nalačno. Podanie raltegraviru po jedle s vysokým obsahom tuku zvýšilo AUC a Cmax približne dvojnásobne a C12 h 4,1-násobne. Podanie raltegraviru po jedle s nízkym obsahom tuku znížilo AUC o 46 % a Cmax o 52 %, C12 h sa v podstate nezmenila. Zdá sa, že v porovnaní so stavom nalačno potrava zvyšuje farmakokinetickú variabilitu.
Raltegravir 600 mg tablety (2 x 600 mg jedenkrát denne) sa môžu podávať s jedlom alebo bez jedla. V štúdii účinku jedla po podaní jednotlivej dávky sa preukázalo, že vplyv jedla pri dávke 1 200 mg jedenkrát denne bol podobný alebo menší počas skúmania s jedlom s vysokým alebo nízkym obsahom tukov v porovnaní so 400 mg dvakrát denne. Konzumácia jedla s nízkym obsahom tukov
s raltegravirom 1 200 mg jedenkrát denne viedla k 42 % poklesu AUC0-last, 52 % poklesu Cmax a 16 % poklesu C24h. Konzumácia jedla s vysokým obsahom tukov viedla k 1,9 % zvýšeniu AUC0-last, 28 % poklesu Cmax a 12 % poklesu C24 h.
Vo farmakokinetike raltegraviru sa celkovo pozorovala značná variabilita. V skúšaniach
BENCHMRK 1 a 2 sa variačný koeficient (CV) pozorovanej C12 h pre interindividuálnu variabilitu
= 212 % a CV pre intraindividuálnu variabilitu = 122 %. Zdroje variability môžu zahŕňať rozdiely
v podaní spolu s jedlom a súbežne podávanými liekmi.
Distribúcia
V rozsahu koncentrácie 2 až 10 µmol/l sa na ľudské plazmatické proteíny viaže približne 83 %
raltegraviru.
Raltegravir rýchlo prechádzal cez placentu u potkanov, ale do mozgu v zreteľnom rozsahu neprenikol.
V dvoch štúdiách pacientov infikovaných HIV-1, ktorí dostávali raltegravir 400 mg dvakrát denne, sa raltegravir ľahko detegoval v cerebrospinálnej tekutine. V prvej štúdii (n = 18) bol medián koncentrácie v cerebrospinálnej tekutine 5,8 % (rozsah od 1 do 53,5 %) zodpovedajúcej plazmatickej koncentrácie. V druhej štúdii (n = 16) bol medián koncentrácie v cerebrospinálnej tekutine 3 %
(rozsah od 1 do 61 %) zodpovedajúcej plazmatickej koncentrácie. Tieto mediány podielov sú približne
3- až 6-násobne nižšie ako voľná frakcia raltegraviru v plazme.
Biotransformácia a vylučovanie
Zjavný terminálny polčas raltegraviru je približne 9 hodín s kratším polčasom fázy alfa (~1 hodina)
zodpovedným za veľkú časť AUC. Po podaní perorálnej dávky rádioaktívne značeného raltegraviru sa približne 51 % dávky vylúčilo v stolici a 32 % dávky v moči. V stolici bol prítomný iba raltegravir,
z ktorého väčšina je pravdepodobne derivovaná z hydrolýzy raltegravir-glukuronidu vylúčeného žlčou, ako sa pozorovalo u predklinických druhov. V moči boli zistené dva komponenty, a to raltegravir a raltegravir-glukuronid, a tvorili približne 9 % (raltegravir) a 23 % (raltegravir-glukuronid)
dávky. Hlavnou cirkulujúcou látkou bol raltegravir a predstavoval približne 70 % celkovej rádioaktivity; zostávajúcu rádioaktivitu v plazme predstavoval raltegravir-glukuronid. Štúdie
s izoformnými selektívnymi chemickými inhibítormi a cDNA exprimovanými UDP- glukuronozyltransferázami (UGT) ukazujú, že hlavným enzýmom zodpovedným za tvorbu raltegravir- glukuronidu je UGT1A1. Údaje teda poukazujú na to, že hlavným mechanizmom klírensu raltegraviru
u ľudí je glukuronidácia sprostredkovaná UGT1A1.
Polymorfizmus UGT1A1
Pri porovnaní 30 osôb s *28/*28 genotypom s 27 osobami s genotypom divokého typu bol pomer geometrických priemerov (90 % IS) AUC 1,41 (0,96, 2,09) a pomer geometrických priemerov C12 h
1,91 (1,43, 2,55). U osôb, u ktorých je z dôvodu genetického polymorfizmu aktivita UGT1A1 znížená, sa nepovažuje za potrebné upravovať dávku.
Osobitné populácie
Pediatrická populácia
Na základe štúdie porovnávajúcej liekovú formu u zdravých dospelých dobrovoľníkov mali žuvacia tableta a granulát na perorálnu suspenziu vyššiu perorálnu biologickú dostupnosť v porovnaní
so 400 mg tabletou. V tejto štúdii viedlo podávanie žuvacej tablety s jedlom s vysokým obsahom tuku
v priemere k 6 % poklesu AUC, 62 % poklesu Cmax a 188 % zvýšeniu C12hod v porovnaní s podaním nalačno. Podávanie žuvacej tablety s jedlom s vysokým obsahom tuku nemá klinicky významný vplyv na farmakokinetiku raltegraviru a žuvacia tableta sa môže podávať bez ohľadu na jedlo. Účinok jedla na liekovú formu granulát na perorálnu suspenziu sa neskúmal.
Tabuľka 5 uvádza farmakokinetické parametre pri 400 mg tablete, žuvacej tablete a granuláte na perorálnu suspenziu podľa telesnej hmotnosti.
Tabuľka 5: Farmakokinetické parametre raltegraviru IMPAACT P1066
po podaní dávok v časti 4.2
Telesná hmotnosť
Lieková
forma Dávka N*
filmom
Geometrický
priemer (% CV†) AUC0-12hod (μmol/l●hod)
Geometrický priemer (%CV†)
C12 hod (nmol/l)
≥ 25 kg
obalená tableta 400 mg dvakrát denne 18 14,1
(121 %) 233 (
157 %) Dávkovanie na
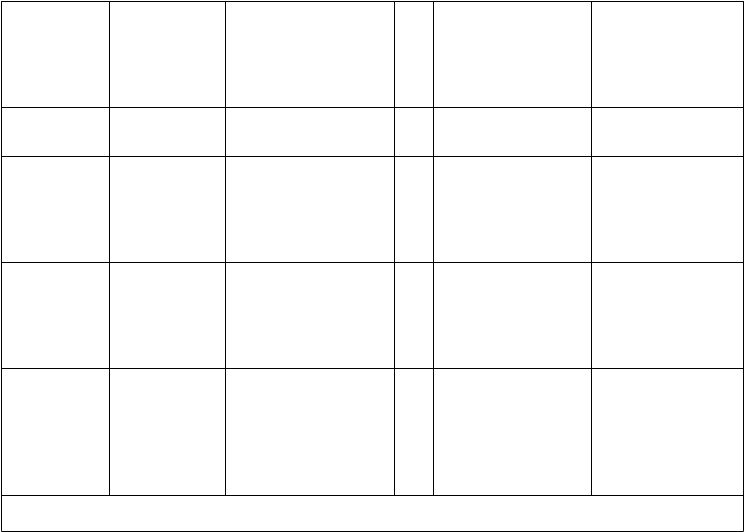
základe telesnej
hmotnosti, pozri tabuľky s dávkovaním
≥ 25 kg žuvacia tableta
11 do menej
ako 25 kg žuvacia tableta
pre žuvaciu tabletu 9 22,1 (36 %) 113 (80 %)
Dávkovanie na základe telesnej hmotnosti, pozri tabuľky s dávkovaním
pre žuvaciu tabletu 13 18,6 (68 %) 82 (123 %)
Dávkovanie na základe telesnej hmotnosti, pozri tabuľky s dávkovaním
3 do menej ako 20 kg
perorálna suspenzia
pre granulát na
perorálnu suspenziu 19 24,5 (43 %) 113 (69 %)
*Počet pacientov s intenzívnymi farmakokinetickými (FK) výsledkami pri konečnej odporúčanej dávke.
†Geometrický koeficient zmeny.
Farmakokinetika raltegraviru u dojčiat mladších ako 4 týždne nebola stanovená.
Staršie osoby
V rámci študovaného vekového rozsahu pri raltegravire 400 mg dvakrát denne nemal vek klinicky významný vplyv na farmakokinetiku raltegraviru. V rámci študovaného vekového rozsahu v Protokole
292 pri raltegravire 1 200 mg (2 x 600 mg) jedenkrát denne nemal vek klinicky významný vplyv na farmakokinetiku raltegraviru.
Pohlavie, rasa, etnický pôvod a telesná hmotnosť
V súvislosti s pohlavím, rasou, etnickým pôvodom alebo telesnou hmotnosťou u dospelých sa pri raltegravire 400 mg dvakrát denne nevyskytli žiadne klinicky významné farmakokinetické rozdiely
a nevyvodil sa žiadny klinicky významný vplyv na farmakokinetiku raltegraviru. Pri raltegravire
1 200 mg (2 x 600 mg) jedenkrát denne analýza populačnej FK tiež preukázala, že vplyvy pohlavia, rasy, etnického pôvodu a telesnej hmotnosti neboli klinicky významné.
Porucha funkcie obličiek
Renálny klírens nezmeneného liečiva je menšinovou dráhou eliminácie. U dospelých sa medzi pacientmi s ťažkou renálnou insuficienciou a zdravými osobami nevyskytli žiadne klinicky významné
farmakokinetické rozdiely (pozri časť 4.2 v súhrne charakteristických vlastností pre 400 mg dvakrát
denne). Pretože nie je známe, do akej miery je raltegravir dialyzovateľný, je potrebné vyhnúť sa podávaniu pred dialýzou. S raltegravirom 1 200 mg jedenkrát denne sa nevykonala žiadna štúdia
poruchy funkcie obličiek, na základe výsledkov so 400 mg tabletou dvakrát denne sa však neočakáva
žiadny klinicky významný účinok.
Porucha funkcie pečene
Raltegravir je primárne eliminovaný glukuronidáciou v pečeni. U dospelých sa medzi pacientmi so stredne ťažkou hepatálnou insuficienciou a zdravými osobami nevyskytli žiadne klinicky významné farmakokinetické rozdiely. Vplyv ťažkej hepatálnej insuficiencie na farmakokinetiku raltegraviru sa
neskúmal (pozri časti 4.2 a 4.4 v súhrne charakteristických vlastností pre 400 mg dvakrát denne).
S raltegravirom 1 200 mg jedenkrát denne sa nevykonala žiadna štúdia poruchy funkcie pečene, na základe výsledkov so 400 mg tabletami dvakrát denne sa však pri miernej a stredne ťažkej poruche funkcie pečene neočakáva žiadny klinicky významný účinok.
5.3 Predklinické údaje o bezpečnosti
Predklinické štúdie toxicity vrátane obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, vývojovej toxicity a juvenilnej toxicity sa s raltegravirom vykonali na myšiach, potkanoch, psoch a králikoch. Účinky pri expozíciách dostatočne presahujúcich klinické expozičné hladiny nepoukazujú na žiadne osobitné riziko pre ľudí.
Mutagenita
V in vitro testoch mikrobiálnej mutagenézy (Ames), in vitro metódach alkalického vymývania na
detekciu zlomov DNA a in vitro a in vivo štúdiách chromozómovej aberácie sa nepozoroval dôkaz mutagenity ani genotoxicity.
Karcinogenita
Štúdia karcinogenity raltegraviru u myší nepreukázala žiadny karcinogénny potenciál. Pri najvyšších
úrovniach dávok, 400 mg/kg/deň u samíc a 250 mg/kg/deň u samcov, bola systémová expozícia podobná expozícii pri klinickej dávke 1 200 mg jedenkrát denne. U potkanov sa pri dávkach 300
a 600 mg/kg/deň u samíc a 300 mg/kg/deň u samcov zistili tumory (karcinóm skvamóznych buniek)
nosa/nosohltana. Táto neoplázia môže byť následkom lokálneho ukladania a/alebo vdychovania liečiva na sliznicu nosa/nosohltana počas perorálneho podávania dávky sondou do žalúdka
a následného chronického dráždenia a zápalu. Je pravdepodobné, že pre zamýšľané klinické použitie
má obmedzený význam. Pri najvyššej dávke bez pozorovateľných nežiaducich účinkov (NOAEL -„no observable adverse effect level“) bola systémová expozícia podobná expozícii pri klinickej dávke
1 200 mg jedenkrát denne. Štandardné štúdie genotoxicity hodnotiace mutagenitu a klastogenitu boli
negatívne.
Vývojová toxicita
V štúdiách vývojovej toxicity na potkanoch a králikoch nebol raltegravir teratogénny. U mláďat samíc
potkanov, ktoré boli vystavené raltegraviru v dávkach približne 4,4-násobne vyšších, ako je expozícia u ľudí pri dávke 1 200 mg jedenkrát denne na základe AUC0-24 h, sa pozorovalo mierne zvýšenie incidencie nadpočetných rebier. Na základe AUC0-24 h neboli pri 3,4-násobku ľudskej expozície pri dávke 1 200 mg jedenkrát denne pozorované žiadne účinky na vývoj (pozri časť 4.6). Podobné zistenia neboli pozorované u králikov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
- mikrokryštalická celulóza
- hypromelóza 2910
- stearan horečnatý
- sodná soľ kroskarmelózy
Filmový obal
- monohydrát laktózy
- hypromelóza 2910
- oxid titaničitý
- triacetín
- žltý oxid železitý
- čierny oxid železitý
Tableta môže tiež obsahovať stopové množstvo karnaubského vosku.
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky
6.4 Špeciálne upozornenia na uchovávanieFľašu uchovávajte dôkladne uzatvorenú s vysušovadlom na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah baleniaFľaša z vysokodenzitného polyetylénu (HDPE) s polypropylénovým detským bezpečnostným uzáverom, pečatnou fóliou a vysušovadlom zo silikagélu.
Dostupná je jedna veľkosť balenia: 1 fľaša po 60 tabliet.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMerck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU
Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/07/436/006
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 20. decembra 2007
Dátum posledného predĺženia registrácie: 14. mája 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
ISENTRESS 25 mg žuvacie tablety
ISENTRESS 100 mg žuvacie tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá žuvacia tableta obsahuje 25 mg raltegraviru (ako draselnú soľ). Každá žuvacia tableta obsahuje 100 mg raltegraviru (ako draselnú soľ).
Pomocné látky so známym účinkom 25 mg
Každá žuvacia tableta obsahuje približne 0,46 mg fruktózy, približne 0,05 mg fenylalanínu (ako súčasť aspartamu) a približne 1,4 mg sorbitolu.
Pomocné látky so známym účinkom 100 mg
Každá žuvacia tableta obsahuje približne 0,93 mg fruktózy, približne 0,10 mg fenylalanínu (ako súčasť aspartamu) a približne 2,8 mg sorbitolu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Žuvacia tableta
25 mg žuvacia tableta
Svetložltá okrúhla žuvacia tableta s logom Merck na jednej strane a „473“ na druhej strane.
100 mg žuvacia tableta
Svetlooranžová žuvacia tableta oválneho tvaru s deliacou ryhou na oboch stranách, s logom Merck a „477“ na jednej strane a bez nápisu na druhej strane.
Tableta sa môže rozdeliť na dve rovnaké 50 mg dávky.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
ISENTRESS je indikovaný v kombinácii s inými antiretrovírusovými liekmi na liečbu infekcie
vírusom ľudskej imunodeficiencie (human immunodeficiency virus, HIV-1) dospelým, dospievajúcim, deťom, batoľatám a dojčatám starším ako 4 týždne (pozri časti 4.2, 4.4, 5.1 a 5.2).
4.2 Dávkovanie a spôsob podávania
S liečbou má začať lekár, ktorý je skúsený v liečbe infekcie HIV. Dávkovanie
ISENTRESS sa má používať v kombinácii s inými účinnými antiretrovírusovými liečbami
(antiretroviral therapies, ART) (pozri časti 4.4 a 5.1). Maximálna dávka žuvacích tabliet je 300 mg dvakrát denne.
Pretože liekové formy majú rôzne farmakokinetické profily, ani žuvacie tablety a ani granulát na perorálnu suspenziu sa nemajú zamieňať za 400 mg alebo 600 mg tablety (pozri časť 5.2). Žuvacie
tablety a granulát na perorálnu suspenziu sa neskúmali u dospievajúcich (12 až 18 rokov) a dospelých infikovaných HIV.
Deti
U detí s telesnou hmotnosťou minimálne 11 kg: žuvacia tableta sa podáva v dávke stanovenej na základe telesnej hmotnosti do maximálnej dávky 300 mg dvakrát denne, ako je uvedené v tabuľkách 1
a 2. Žuvacie tablety sú dostupné v silách 25 mg a 100 mg s deliacou ryhou.
O obmedzených údajoch, na základe ktorých sú založené tieto odporúčania dávkovania, pozri časť 5.2.
Tabuľka 1: Odporúčaná dávka* pre žuvacie tablety ISENTRESS u pediatrických pacientov s telesnou hmotnosťou minimálne 25 kg
Telesná hmotnosť
(kg)
Dávka Počet žuvacích tabliet
25 do menej ako 28 150 mg dvakrát denne 1,5 x 100 mg† dvakrát denne
28 do menej ako 40 200 mg dvakrát denne 2 x 100 mg dvakrát denne minimálne 40 300 mg dvakrát denne 3 x 100 mg dvakrát denne
*Odporúčanie dávkovania pre žuvacie tablety na základe telesnej hmotnosti je založené na dávke približne 6 mg/kg/dávka dvakrát denne (pozri časť 5.2).
†100 mg žuvacia tableta sa môže rozdeliť na rovnaké 50 mg dávky. Vždy, keď je to možné, sa však treba deleniu tablety
vyhnúť.
Pri veku minimálne 4 týždne a telesnej hmotnosti minimálne 3 kg do menej ako 25 kg: podáva sa
dávka na základe telesnej hmotnosti, ako je uvedené v tabuľke 2.
U pacientov s telesnou hmotnosťou v rozmedzí 11 až 20 kg sa môže použiť buď žuvacia tableta, alebo perorálna suspenzia, ako je uvedené v tabuľke 2. Pacienti môžu užívať perorálnu suspenziu dovtedy, kým je ich telesná hmotnosť menej ako 20 kg. Správne dávkovanie pozri v tabuľke 2 (pozri časť 5.1).
Tabuľka 2: Odporúčaná dávka* pre ISENTRESS granulát na perorálnu suspenziu a žuvacie tablety u pediatrických pacientov s telesnou hmotnosťou menej ako 25 kg
Telesná hmotnosť
(kg)
Objem (dávka) suspenzie, ktorý sa
má podať
Počet žuvacích tabliet
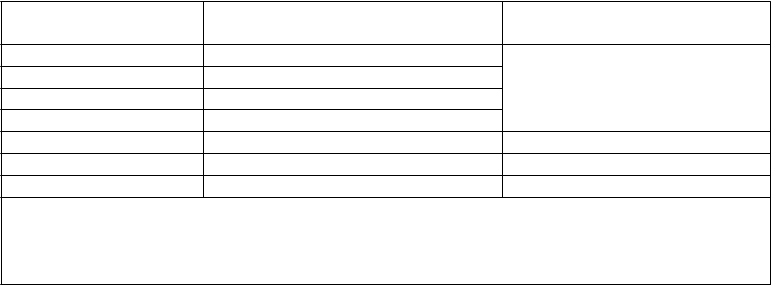
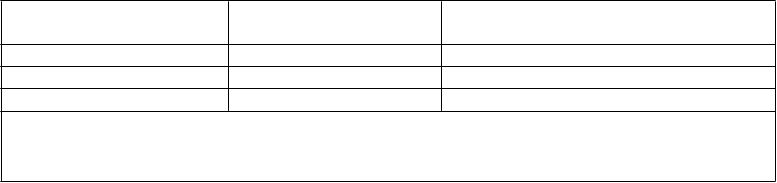
3 do menej ako 4 1 ml (20 mg) dvakrát denne
4 do menej ako 6 1,5 ml (30 mg) dvakrát denne
6 do menej ako 8 2 ml (40 mg) dvakrát denne
8 do menej ako 11 3 ml (60 mg) dvakrát denne
11 do menej ako 14† 4 ml (80 mg) dvakrát denne 3 x 25 mg dvakrát denne
14 do menej ako 20† 5 ml (100 mg) dvakrát denne 1 x 100 mg dvakrát denne
20 do menej ako 25 1,5 x 100 mg‡ dvakrát denne
* Odporúčanie dávkovania pre žuvacie tablety a perorálnu suspenziu na základe telesnej hmotnosti je založené na dávke približne 6 mg/kg/dávka dvakrát denne (pozri časť 5.2).
†Pri telesnej hmotnosti v rozmedzí 11 až 20 kg sa môže použiť ktorákoľvek z liekových foriem.
‡100 mg žuvacia tableta sa môže rozdeliť na rovnaké 50 mg dávky. Vždy, keď je to možné, sa však treba deleniu tablety vyhnúť.
Pacientov je potrebné poučiť, aby dodržiavali naplánované návštevy, pretože dávkovanie lieku
ISENTRESS sa má upraviť podľa toho, ako dieťa rastie.
Ďalšie dostupné liekové formy a sily
ISENTRESS je tiež dostupný ako 400 mg tablety na použitie u dospelých, dospievajúcich a detí
s telesnou hmotnosťou minimálne 25 kg a schopných prehltnúť tabletu ako aj granulát na perorálnu suspenziu na použitie u dojčiat a batoliat starších ako 4 týždne a s telesnou hmotnosťou minimálne
3 kg do menej ako 20 kg. Ďalšie informácie týkajúce sa dávkovania si prečítajte v SPC pre 400 mg
tablety a granulát na perorálnu suspenziu.
ISENTRESS je pre dospelých a deti a dospievajúcich (s telesnou hmotnosťou minimálne 40 kg) tiež dostupný ako 600 mg tablety, ktoré sa podávajú ako 1 200 mg jedenkrát denne (dve 600 mg tablety)
u predtým neliečených pacientov alebo u pacientov vo virologickej supresii pri úvodnom režime lieku
ISENTRESS 400 mg dvakrát denne. Ďalšie informácie týkajúce sa dávkovania si prečítajte v súhrne charakteristických vlastností pre 600 mg tablety.
Staršie osoby
O použití raltegraviru u starších osôb sú k dispozícii obmedzené informácie (pozri časť 5.2). ISENTRESS sa má preto v tejto populácii používať s opatrnosťou.
Porucha funkcie obličiek
U pacientov s poruchou funkcie obličiek nie je potrebná úprava dávkovania (pozri časť 5.2).
Porucha funkcie pečene
U pacientov s miernou až stredne ťažkou poruchou funkcie pečene nie je potrebná úprava dávkovania. U pacientov s ťažkými základnými poruchami pečene nebola bezpečnosť a účinnosť raltegraviru
stanovená. Preto sa má ISENTRESS u pacientov s ťažkou poruchou funkcie pečene používať s opatrnosťou (pozri časti 4.4 a 5.2).
Pediatrická populácia
Bezpečnosť a účinnosť raltegraviru u dojčiat mladších ako 4 týždne neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávania
Perorálne použitie.
Žuvacie tablety ISENTRESS sa môžu podávať s jedlom alebo bez jedla (pozri časť 5.2).
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
Pacientov je potrebné informovať, že súčasná antiretrovírusová terapia nelieči infekciu HIV a nebolo
dokázané, že bráni prenosu HIV na iné osoby krvou. Hoci sa preukázalo, že účinná vírusová supresia dosiahnutá pri antiretrovírusovej terapii značne znižuje riziko prenosu HIV pohlavným stykom, reziduálne riziko nie je možné vylúčiť. Je potrebné prijať opatrenia na zabránenie prenosu HIV
v súlade s národnými odporúčaniami.
Raltegravir má pomerne nízku genetickú bariéru voči rezistencii. Preto sa má raltegravir vždy, keď je to možné, podávať s dvoma ďalšími účinnými ART, aby sa minimalizovala možnosť virologického zlyhania a vzniku rezistencie (pozri časť 5.1).
U predtým neliečených pacientov sú údaje z klinických štúdií o použití raltegraviru obmedzené na použitie v kombinácii s dvoma nukleotidovými inhibítormi reverznej transkriptázy (nucleotide reverse transcriptase inhibitors, NRTI) (emtricitabín a tenofovir-dizoproxilfumarát).
Depresia
Bola hlásená depresia vrátane samovražedných myšlienok a správania, najmä u pacientov s depresiou
alebo psychickým ochorením v anamnéze. U pacientov s depresiou alebo psychickým ochorením v anamnéze sa má postupovať s opatrnosťou.
Porucha funkcie pečene
Bezpečnosť a účinnosť raltegraviru nebola stanovená u pacientov s ťažkými základnými poruchami
pečene. Preto sa má raltegravir u pacientov s ťažkou poruchou funkcie pečene používať s opatrnosťou
(pozri časti 4.2 a 5.2).
Pacienti s už prítomným ochorením pečene vrátane chronickej hepatitídy majú počas kombinovanej antiretrovírusovej terapie zvýšenú frekvenciu abnormalít pečeňovej funkcie a majú byť monitorovaní podľa štandardnej praxe. Ak u takýchto pacientov existuje dôkaz zhoršenia ochorenia pečene, má sa zvážiť prerušenie alebo ukončenie liečby.
U pacientov s chronickou hepatitídou B alebo C liečených kombinovanou antiretrovírusovou terapiou je zvýšené riziko ťažkých a potenciálne fatálnych hepatálnych nežiaducich reakcií.
Osteonekróza
Aj keď sa etiológia považuje za mnohofaktorovú (vrátane používania kortikosteroidov, konzumácie
alkoholu, ťažkej imunosupresie, vyššieho indexu telesnej hmotnosti), boli hlásené prípady osteonekrózy, najmä u pacientov s pokročilým HIV ochorením a/alebo dlhodobou expozíciou
kombinovanej antiretrovírusovej terapii. Pacientom sa má odporučiť, aby vyhľadali lekársku pomoc,
ak budú mať bolesť kĺbov, stuhnutosť kĺbov alebo ťažkosti s pohybom.
Syndróm imunitnej reaktivácie
U pacientov infikovaných HIV s ťažkou imunodeficienciou môže v čase nasadenia kombinovanej
antiretrovírusovej terapie (combination antiretroviral therapy, CART) vzniknúť zápalová reakcia na asymptomatické alebo reziduálne oportúnne patogény a spôsobiť závažné klinické stavy alebo zhoršenie príznakov. Takéto reakcie sa typicky pozorovali počas prvých týždňov alebo mesiacov po nasadení CART. Relevantnými príkladmi sú cytomegalovírusová retinitída, generalizované a/alebo fokálne mykobakteriálne infekcie a pneumónia spôsobená Pneumocystis jiroveci (predtým známa ako Pneumocystis carinii). Akékoľvek príznaky zápalu sa majú zhodnotiť a v prípade potreby sa má nasadiť liečba.
Boli zaznamenané aj autoimunitné poruchy (ako je Gravesova choroba) objavujúce sa v dôsledku imunitnej reaktivácie; avšak zaznamenaný čas do ich nástupu je rôznorodejší a tieto udalosti sa môžu vyskytnúť mnoho mesiacov po začatí liečby.
Antacidá
Súbežné podávanie raltegraviru s antacidami obsahujúcimi hliník a horčík viedlo k zníženým
plazmatickým hladinám raltegraviru. Súbežné podávanie raltegraviru s antacidami obsahujúcimi hliník a/alebo horčík sa neodporúča (pozri časť 4.5).
Rifampicín
Pri súbežnom podávaní raltegraviru so silnými induktormi uridíndifosfátglukuronozyltransferázy
(UGT) 1A1 (napr. rifampicín) je potrebná opatrnosť. Rifampicín znižuje plazmatické hladiny raltegraviru; vplyv na účinnosť raltegraviru nie je známy. Ak sa však nedá vyhnúť súbežnému
podávaniu s rifampicínom, môže sa u dospelých zvážiť zdvojnásobenie dávky raltegraviru. Neexistujú
údaje poskytujúce návod na súbežné podávanie raltegraviru s rifampicínom u pacientov mladších ako
18 rokov (pozri časť 4.5).
Myopatia a rabdomyolýza
Bola hlásená myopatia a rabdomyolýza. U pacientov, ktorí v minulosti mali myopatiu alebo
rabdomyolýzu alebo majú akékoľvek predurčujúce faktory vrátane iných liekov spojených s týmito stavmi, je potrebné používať s opatrnosťou (pozri časť 4.8).
Z
á
važné kožné reakcie a reakcie z precitlivenosti
U pacientov užívajúcich raltegravir boli hlásené závažné, potenciálne život ohrozujúce a fatálne kožné
reakcie, vo väčšine prípadov súbežne s inými liekmi spojenými s týmito reakciami. Tieto reakcie zahŕňajú prípady Stevensovho-Johnsonovho syndrómu a toxickej epidermálnej nekrolýzy. Hlásené
boli tiež reakcie z precitlivenosti a boli charakterizované vyrážkou, organickými nálezmi a niekedy
poruchou funkcie orgánov vrátane zlyhania pečene. Ak sa objavia prejavy alebo príznaky závažných kožných reakcií alebo reakcií z precitlivenosti (zahŕňajúce avšak nie obmedzené na závažnú kožnú
vyrážku alebo vyrážku sprevádzanú horúčkou, celkovú nevoľnosť, únavu, bolesť svalov a kĺbov,
pľuzgiere, ranky v ústach, konjunktivitídu, opuch tváre, hepatitídu, eozinofíliu, angioedém), okamžite ukončite podávanie raltegravirualebo iných podozrivých liekov. Má sa sledovať klinický stav vrátane pečeňových aminotransferáz a má sa začať s vhodnou liečbou. Oddialenie ukončenia liečby raltegravirom alebo inými podozrivými liečivami po objavení sa závažnej vyrážky môže viesť k život ohrozujúcej reakcii.
Vyrážka
U pacientov predtým liečených režimom obsahujúcim raltegravir a darunavir, sa častejšie vyskytla
vyrážka ako u pacientov dostávajúcich raltegravir bez darunaviru alebo darunavir bez raltegraviru
(pozri časť 4.8).
Fruktóza
Žuvacie tablety ISENTRESS obsahujú fruktózu a sorbitol. Pacienti so zriedkavými dedičnými
problémami intolerancie fruktózy nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Štúdie in vitro ukazujú, že raltegravir nie je substrátom enzýmov cytochrómu P450 (CYP), neinhibuje CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 alebo CYP3A, neinhibuje UDP glukurónozyltransferázy (UGT) 1A1 a 2B7, neindukuje CYP3A4 a neinhibuje transport sprostredkovaný P-glykoproteínom. Na základe týchto údajov sa neočakáva, že raltegravir bude mať vplyv na farmakokinetiku liekov, ktoré sú substrátmi týchto enzýmov alebo P-glykoproteínu.
Na základe in vitro a in vivo štúdií je raltegravir eliminovaný najmä metabolizáciou cez glukuronidačnú dráhu sprostredkovanú UGT1A1.
Vo farmakokinetike raltegraviru sa pozorovala značná inter- a intraindividuálna variabilita. Vplyv raltegraviru na farmakokinetiku iných liečiv
V interakčných štúdiách nemal raltegravir klinicky významný vplyv na farmakokinetiku etravirínu,
maraviroku, tenofovir-dizoproxilfumarátu, hormonálnych kontraceptív, metadónu, midazolamu alebo bocepreviru.
V niektorých štúdiách viedlo súbežné podávanie raltegraviru s darunavirom k miernemu zníženiu plazmatických koncentrácií darunaviru; mechanizmus tohto účinku nie je známy. Vplyv raltegraviru na plazmatické koncentrácie darunaviru sa však nezdá byť klinicky významný.
Vplyv iných liečiv na farmakokinetiku raltegraviru
Vzhľadom na to, že sa raltegravir primárne metabolizuje UGT1A1, pri súbežnom podávaní
raltegraviru so silnými induktormi UGT1A1 (napr. rifampicínom) je potrebná opatrnosť. Rifampicín znižuje plazmatické hladiny raltegraviru; vplyv na účinnosť raltegraviru nie je známy. Ak sa však nedá
vyhnúť súbežnému podávaniu s rifampicínom, môže sa u dospelých zvážiť zdvojnásobenie dávky
raltegraviru. Neexistujú údaje poskytujúce návod na súbežné podávanie raltegraviru s rifampicínom
u pacientov mladších ako 18 rokov (pozri časť 4.4). Vplyv iných silných induktorov enzýmov metabolizujúcich liečivá, ako je fenytoín a fenobarbital, na UGT1A1 nie je známy. Menej silné induktory (napr. efavirenz, nevirapín, etravirín, rifabutín, glukokortikoidy, ľubovník bodkovaný, pioglitazón) sa môžu používať s odporúčanou dávkou raltegraviru.
Súbežné podávanie raltegravir s liekmi, o ktorých sa vie, že sú silnými inhibítormi UGT1A1 (napr. atazanavir), môže zvýšiť plazmatické hladiny raltegraviru. Slabšie inhibítory UGT1A1 (napr. indinavir, sachinavir) môžu tiež zvýšiť plazmatické hladiny raltegraviru, ale v menšej miere ako atazanavir. Ďalej môže plazmatické hladiny raltegraviru zvýšiť tenofovir-dizoproxilfumarát, mechanizmus tohto účinku však nie je známy (pozri tabuľku 3). V klinických skúšaniach užívala veľká časť pacientov v rámci optimalizovaných základných režimov atazanavir a/alebo tenofovir- dizoproxilfumarát, liečivá, ktoré vedú k zvýšeniu plazmatických hladín raltegraviru. Bezpečnostný profil pozorovaný u pacientov užívajúcich atazanavir a/alebo tenofovir-dizoproxilfumarát bol vo všeobecnosti podobný bezpečnostnému profilu pacientov, ktorí neužívali tieto liečivá. Preto nie je potrebná úprava dávky.
Súbežné podávanie raltegraviru s antacidami obsahujúcimi dvojmocné katióny kovov môže cheláciou znížiť absorpciu raltegraviru, čo má za následok pokles plazmatických hladín raltegraviru. Užitie antacida obsahujúceho hliník alebo horčík do 6 hodín od podania raltegraviru výrazne znížilo plazmatické hladiny raltegraviru. Súbežné podávanie raltegraviru s antacidami obsahujúcimi hliník a/alebo horčík sa preto neodporúča. Súbežné podávanie raltegraviru s antacidami obsahujúcimi uhličitan vápenatý znižuje plazmatické hladiny raltegraviru; táto interakcia sa však nepovažuje za klinicky významnú. Preto, ak sa raltegravir súbežne podáva s antacidami obsahujúcimi uhličitan vápenatý, nie je potrebná úprava dávky.
Súbežné podávanie raltegraviru s inými liečivami, ktoré zvyšujú pH v žalúdku (napr. omeprazol
a famotidín), môže zvýšiť rýchlosť absorpcie raltegraviru a viesť k zvýšeným plazmatickým hladinám raltegraviru (pozri tabuľku 3). Bezpečnostné profily v podskupine pacientov v skúšaniach fázy III
užívajúcich inhibítory protónovej pumpy alebo blokátory H2-receptora boli porovnateľné
s bezpečnostnými profilmi u pacientov, ktorí tieto antacidá neužívali. Pri užívaní inhibítorov
protónovej pumpy alebo blokátorov H2-receptora sa preto nevyžaduje žiadna úprava dávky. Všetky interakčné štúdie sa vykonali u dospelých.
Tabuľka 3
Údaje o farmakokinetických interakciách u dospelých
Liečivá podľa
terapeutickej oblasti
Interakcia
(mechanizmus, ak je známy)
Odporúčania týkajúce sa súbežného
podávania
ANTIRETROVIROTIKÁ
Inhibítory proteázy (PI)
atazanavir/ritonavir (raltegravir 400 mg dvakrát denne)
tipranavir/ritonavir (raltegravir 400 mg dvakrát denne)
AUC raltegraviru ↑ 41 % C12 h raltegraviru ↑ 77 % Cmax raltegraviru ↑ 24 %
(inhibícia UGT1A1) AUC raltegraviru ↓ 24 % C12 h raltegraviru ↓ 55 % Cmax raltegraviru ↓ 18 %
Nie je potrebná úprava dávky raltegraviru.
Nie je potrebná úprava dávky raltegraviru.
(indukcia UGT1A1)
Nenukleozidové inhibítory reverznej transkriptázy (NNRTI)
 e
f
avirenz
e
f
avirenz (raltegravir 400 mg jednotlivá dávka)
AUC raltegraviru ↓ 36 % C12 h raltegraviru ↓ 21 % Cmax raltegraviru ↓ 36 %
(indukcia UGT1A1)
Nie je potrebná úprava dávky raltegraviru.
Liečivá podľa terapeutickej oblasti
etravirín (raltegravir 400 mg dvakrát denne)
Interakcia
(mechanizmus, ak je známy)
AUC raltegraviru ↓ 10 % C12 h raltegraviru ↓ 34 % Cmax raltegraviru ↓ 11 %
(indukcia UGT1A1)
Odporúčania týkajúce sa súbežného podávania
Nie je potrebná úprava dávky raltegraviru ani etravirínu.
AUC etravirínu ↑ 10 %
C12 h etravirínu ↑ 17 % Cmax etravirínu ↑ 4 %
Nukleozidové/nukleotidové inhibítory reverznej transkriptázy
tenofovir- dizoproxilfumarát (raltegravir 400 mg dvakrát denne)
Inhibítory CCR5 maravirok (raltegravir 400 mg dvakrát denne)
HCV ANTIVIROTIKÁ
AUC raltegraviru ↑ 49 % C12 h raltegraviru ↑ 3 % Cmax raltegraviru ↑ 64 %
(mechanizmus interakcie neznámy)
AUC tenofoviru ↓ 10 % C24 h tenofoviru ↓ 13 % Cmax tenofoviru ↓ 23 %
AUC raltegraviru ↓ 37 % C12 h raltegraviru ↓ 28 % Cmax raltegraviru ↓ 33 %
(mechanizmus interakcie neznámy)
AUC maraviroku ↓ 14 % C12 h maraviroku ↓ 10 % Cmax maraviroku ↓ 21 %
Nie je potrebná úprava dávky raltegraviru ani tenofovir-dizoproxilfumarátu.
Nie je potrebná úprava dávky raltegraviru ani maraviroku.
Inhibítory proteázy NS3/4A (PI)
boceprevir (raltegravir 400 mg jednotlivá dávka)
AUC raltegraviru ↑ 4 % C12 h raltegraviru ↓ 25 % Cmax raltegraviru ↑ 11 %
Nie je potrebná úprava dávky raltegraviru ani bocepreviru.
(mechanizmus interakcie
neznámy)
ANTIMIKROBIÁLNE LIEČIVÁ
Antimykobakteriálne liečivá
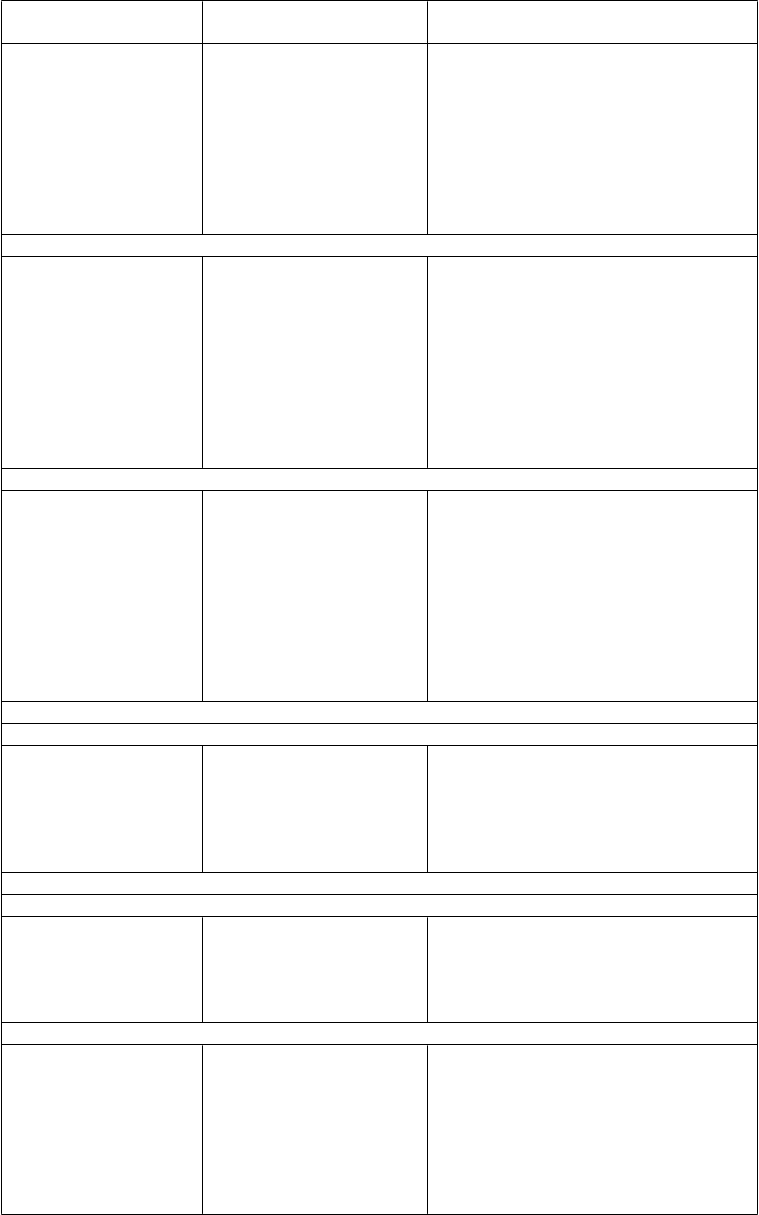 rifampicín
rifampicín (raltegravir 400 mg jednotlivá dávka)
SEDATÍVA midazolam (raltegravir 400 mg dvakrát denne)
AUC raltegraviru ↓ 40 % C12 h raltegraviru ↓ 61 % Cmax raltegraviru ↓ 38 %
(indukcia UGT1A1) AUC midazolamu ↓ 8 %
Cmax midazolamu ↑ 3 %
Rifampicín znižuje plazmatické hladiny raltegraviru. Ak sa nedá vyhnúť súbežnému podávaniu s rifampicínom, môže sa zvážiť zdvojnásobenie dávky raltegraviru(pozri časť 4.4).
Nie je potrebná úprava dávky raltegraviru ani midazolamu.
Tieto výsledky ukazujú, že raltegravir nie je induktor ani inhibítor CYP3A4, a preto sa pri raltegravire nepredpokladá, že ovplyvní farmakokinetiku liekov, ktoré sú substrátmi CYP3A4.
Liečivá podľa terapeutickej oblasti
Interakcia
(mechanizmus, ak je známy)
Odporúčania týkajúce sa súbežného podávania
ANTACIDÁ OBSAHUJÚCE KATIÓN KOVOV
antacidum obsahujúce hliník
a hydroxid horečnatý
(raltegravir 400 mg
dvakrát denne)
antacidum obsahujúce uhličitan vápenatý
(raltegravir 400 mg
dvakrát denne)
AUC raltegraviru ↓ 49 % C12 h raltegraviru ↓ 63 % Cmax raltegraviru ↓ 44 %
2 hodiny pred podanímraltegraviru
AUC raltegraviru ↓ 51 % C12 h raltegraviru ↓ 56 % Cmax raltegraviru ↓ 51 %
2 hodiny po podaníraltegraviru
AUC raltegraviru ↓ 30 %
C12 h raltegraviru ↓ 57 % Cmax raltegraviru ↓ 24 %
6 hodín pred podanímraltegraviru
AUC raltegraviru ↓ 13 % C12 h raltegraviru ↓ 50 % Cmax raltegraviru ↓ 10 %
6 hodín po podaníraltegraviru
AUC raltegraviru ↓ 11 % C12 h raltegraviru ↓ 49 % Cmax raltegraviru ↓ 10 %
(chelácia katiónov kovov) AUC raltegraviru ↓ 55 % C12 h raltegraviru ↓ 32 % Cmax raltegraviru ↓ 52 %
(chelácia katiónov kovov)
Antacidá obsahujúce hliník a horčík znižujú plazmatické hladiny raltegraviru. Súbežné podávanie raltegraviru
s antacidami obsahujúcimi hliník a/alebo horčík sa neodporúča.
Nie je potrebná úprava dávky raltegraviru.
BLOKÁTOR
Y H
2
-
RECEPTOR
A A INHIBÍTORY PROTÓNOVEJ PUMPY
omeprazol
(raltegravir 400 mg dvakrát denne)
famotidín (raltegravir 400 mg dvakrát denne)
AUC raltegraviru ↑ 37 %
C12 h raltegraviru ↑ 24 % Cmax raltegraviru ↑ 51 %
(zvýšená rozpustnosť) AUC raltegraviru ↑ 44 % C12 h raltegraviru ↑ 6 % Cmax raltegraviru ↑ 60 %
Nie je potrebná úprava dávky raltegraviru.
Nie je potrebná úprava dávky raltegraviru.
(zvýšená rozpustnosť)
HORMONÁLNE KONTRACEPTÍVA
 etinylestradiol norelgestromín
etinylestradiol norelgestromín (raltegravir 400 mg dvakrát denne)
AUC etinylestradiolu ↓ 2 % Cmax etinylestradiolu ↑ 6 % AUC norelgestromínu
↑ 14 %
Cmax norelgestromínu
↑ 29 %
Nie je potrebná úprava dávkovania raltegraviru ani hormonálnych kontraceptív (na báze estrogénu a/alebo progesterónu).
Liečivá podľa terapeutickej oblasti
Interakcia
(mechanizmus, ak je známy)
Odporúčania týkajúce sa súbežného podávania
OPIOIDNÉ ANALGETIKÁ
metadón (raltegravir 400 mg dvakrát denne)
AUC metadónu ↔ Cmax metadónu ↔
Nie je potrebná úprava dávky raltegraviru ani metadónu.
 4.6 Fertilita, gravidita a laktácia
Gravidita
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii údaje o použití raltegraviru u gravidných žien. Štúdie na zvieratách preukázali
reprodukčnú toxicitu (pozri časť 5.3). Potenciálne riziko pre ľudí nie je známe. Raltegravir sa neodporúča počas gravidity.
Register gravidít s antiretrovírusovou liečbouAby bolo možné monitorovať účinky na matku-plod u pacientok, u ktorých došlo k neúmyselnému podaniu raltegraviru počas gravidity, bol založený Register gravidít s antiretrovírusovou liečbou. Lekári sú nabádaní registrovať pacientky v tomto registri.
Ako všeobecné pravidlo pri rozhodovaní o použití antiretrovírusových liečiv na liečbu infekcie HIV
u gravidných žien a následne na zníženie rizika vertikálneho prenosu HIV na novorodenca sa majú na stanovenie bezpečnosti pre plod vziať do úvahy údaje u zvierat, ako aj klinická skúsenosť
u gravidných žien.
DojčenieNie je známe, či sa raltegravir/metabolity vylučujú do ľudského mlieka. Dostupné
farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie raltegraviru/metabolitov do mlieka (podrobné informácie, pozri časť 5.3).
Riziko pre novorodencov/dojčatá nie je možné vylúčiť.
Raltegravir sa nemá používať počas dojčenia. Ako všeobecné pravidlo sa odporúča, aby matky infikované HIV svoje deti nedojčili, aby sa vyhli prenosu HIV.
FertilitaPri dávkach do 600 mg/kg/deň, ktoré viedli k 3-násobne vyššej expozícii, ako je expozícia pri
odporúčaných dávkach pre ľudí, sa u samcov a samíc potkana nepozoroval žiadny účinok na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeU niektorých pacientov sa počas liečby režimami obsahujúcimi raltegravir hlásil závrat. Závrat môže ovplyvniť schopnosť niektorých pacientov viesť vozidlá a obsluhovať stroje (pozri časť 4.8).
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluBezpečnostný profil raltegraviru v dávke 400 mg dvakrát denne bol založený na zlúčených údajoch
o bezpečnosti z dvoch klinických štúdií fázy III u dospelých pacientov, ktorí už mali skúsenosť
s liečbou, a jednej klinickej štúdie fázy III u predtým neliečených dospelých pacientov. Počas dvojito zaslepenej liečby bol celkový čas sledovania u pacientov, ktorí už mali skúsenosť s liečbou, 708
pacientorokov v skupine užívajúcej raltegravir 400 mg dvakrát denne a 244 pacientorokov v skupine
užívajúcej placebo; a u predtým neliečených pacientov bol celkový čas sledovania 1 104
pacientorokov v skupine užívajúcej raltegravir 400 mg dvakrát denne a 1 036 pacientorokov v skupine
užívajúcej efavirenz 600 mg večer pred spaním. Počas liečby boli najčastejšie hlásenými nežiaducimi reakciami bolesť hlavy a nauzea, vyskytujúce sa u 5 % alebo viacerých pacientov. Najčastejšie hlásenou závažnou nežiaducou reakciou bol syndróm imunitnej reaktivácie.
V zlúčenej analýze pacientov, ktorí už mali skúsenosť s liečbou, sa vyskytlo prerušenie terapie
z dôvodu nežiaducich reakcií u 3,9 % pacientov užívajúcich raltegravir + OBT a u 4,6 % pacientov užívajúcich placebo + OBT. Prerušenie terapie z dôvodu nežiaducich reakcií u predtým neliečených pacientov sa vyskytlo u 5,0 % pacientov užívajúcich raltegravir + emtricitabín (+) tenofovir- dizoproxilfumarát a u 10,0 % pacientov užívajúcich efavirenz + emtricitabín (+) tenofovir- dizoproxilfumarát.
Tabuľkový súhrn nežiaducich reakcií
Nežiaduce reakcie, ktoré považoval skúšajúci za kauzálne súvisiace s raltegravirom (samotným alebo
v kombinácii s inou ART) ako aj nežiaduce reakcie stanovené pri sledovaní lieku po uvedení na trh, sú uvedené nižšie podľa tried orgánových systémov. Frekvencie výskytu sú definované ako časté
(≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100) a neznáme (z dostupných údajov).
Trieda
orgánových systémov
Frekvencia Nežiaduce reakcie
Raltegravir (samotný alebo v kombinácii s inou
ART)
Infekcie a nákazy Menej časté genitálny herpes, folikulitída, gastroenteritída, herpes simplex, infekcia herpes vírusom, herpes zoster, chrípka, absces lymfatickej uzliny, molluscum contagiosum, nazofaryngitída, infekcia horných dýchacích ciest
Benígne a malígne nádory vrátane nešpecifikovaných novotvarov (cysty a polypy)
Poruchy krvi
a lymfatického systému
Poruchy imunitného systému
Menej časté kožný papilóm
Menej časté anémia, anémia z nedostatku železa, bolesť lymfatickej uzliny, lymfadenopatia, neutropénia, trombocytopénia
Menej časté syndróm imunitnej reaktivácie, precitlivenosť na liečivo, precitlivenosť
Poruchy metabolizmu a výživy
Časté
Menej časté
znížená chuť do jedla
kachexia, diabetes mellitus, dyslipidémia, hypercholesterolémia, hyperglykémia, hyperlipidémia, hyperfágia, zvýšená chuť do jedla, polydipsia, porucha telesného tuku
Psychické poruchy Časté neobvyklé sny, insomnia, nočná mora, abnormálne správanie, depresia
Poruchy nervového systému
Menej časté mentálna porucha, pokus o suicídium, anxieta, stav
zmätenosti, depresívna nálada, veľká depresia, stredná insomnia, zmena nálady, záchvat paniky, porucha
spánku, suicidálne myšlienky, suicidálne správanie
(obzvlášť u pacientov s psychickým ochorením v anamnéze)
Časté závrat, bolesť hlavy, psychomotorická hyperaktivita
Trieda orgánových systémov
Frekvencia Nežiaduce reakcie
Raltegravir (samotný alebo v kombinácii s inou
ART)
Menej časté amnézia, syndróm karpálneho tunela, kognitívna porucha, porucha pozornosti, posturálny závrat, porucha chuti, hypersomnia, hypestézia, letargia, porucha pamäti, migréna, periférna neuropatia,
parestézia, somnolencia, tenzná bolesť hlavy, tras, slabá kvalita spánku
Poruchy oka Menej časté porucha zraku
Poruchy ucha a labyrintu
Poruchy srdca
a srdcovej činnosti
Časté vertigo
Menej časté tinitus
Menej časté palpitácie, sinusová bradykardia, ventrikulárne extrasystoly
Poruchy ciev Menej časté nával tepla, hypertenzia
Poruchy dýchacej sústavy, hrudníka a mediastína Poruchy
gastrointestinálneho
traktu
Poruchy pečene a žlčových ciest
Menej časté dysfónia, epistaxa, nazálna kongescia
Časté abdominálna distenzia, bolesť brucha, hnačka, flatulencia, nauzea, vracanie,dyspepsia
Menej časté gastritída, abdominálny diskomfort, bolesť v hornej časti brucha, citlivosť v oblasti brucha, anorektálny diskomfort, zápcha, sucho v ústach, diskomfort
v epigastriu, erozívna duodenitída, eruktácia, gastroezofágová refluxová choroba, gingivitída,
glositída, odynofágia, akútna pankreatitída, peptický
vred, krvácanie z rekta
Menej časté hepatitída, hepatálna steatóza, alkoholická hepatitída, zlyhanie pečene

Poruchy kože
a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Poruchy reprodukčného systému a prsníkov Celkové poruchy
a reakcie v mieste
Časté vyrážka
Menej časté akné, alopécia, akneiformná dermatitída, suchá koža, erytém, ochabnutie tváre, hyperhidróza, lipoatrofia, získaná lipodystrofia, lipohypertrofia, nočné potenie, prurigo, pruritus, generalizovaný pruritus, makulárna vyrážka, makulopapulárna vyrážka, pruritická vyrážka, kožná lézia, urtikária, xeroderma, Stevensov-Johnsonov syndróm, liekový exantém s eozinofíliou
a systémovými príznakmi (DRESS)
Menej časté artralgia, artritída, bolesť chrbta, bolesť v boku, muskuloskeletálna bolesť, myalgia, bolesť krku, osteopénia, bolesť v končatine, tendonitída, rabdomyolýza
Menej časté zlyhanie obličiek, nefritída, nefrolitiáza, noktúria, renálna cysta, porucha funkcie obličiek, tubulointersticiálna nefritída
Menej časté erektilná dysfunkcia, gynekomastia, príznaky menopauzy
Časté asténia, únava, pyrexia
Trieda orgánových systémov
Frekvencia Nežiaduce reakcie
Raltegravir (samotný alebo v kombinácii s inou
ART)
podania Menej časté diskomfort v hrudníku, triaška, opuch tváre, zväčšenie tukového tkaniva, pocit nervozity, nevoľnosť, submandibulárna masa, periférny edém, bolesť
Laboratórne a funkčné vyšetrenia
Časté zvýšenie alanínaminotransferázy, atypické lymfocyty, zvýšenie aspartátaminotransferázy, zvýšenie triglyceridov v krvi, zvýšenie lipázy, zvýšená hladina pankreatickej amylázy v krvi
Úrazy, otravy a komplikácie liečebného postupu
Menej časté zníženie absolútneho počtu neutrofilov, zvýšenie
alkalickej fosfatázy, zníženie albumínu v krvi, zvýšenie amylázy v krvi, zvýšenie bilirubínu v krvi, zvýšenie
cholesterolu v krvi, zvýšenie kreatinínu v krvi, zvýšenie glukózy v krvi, zvýšenie močovinového dusíka v krvi,
zvýšenie kreatínfosfokinázy, zvýšenie krvnej glukózy nalačno, prítomnosť glukózy v moči, zvýšenie
vysokodenzitného lipoproteínu, zvýšenie medzinárodného normalizovaného pomeru, zvýšenie nízkodenzitného lipoproteínu, zníženie počtu
trombocytov, prítomnosť erytrocytov v moči, zväčšenie obvodu pása, zvýšenie hmotnosti, zníženie počtu
leukocytov
Menej časté náhodné predávkovanie
 Popis vybraných nežiaducich reakcií
Popis vybraných nežiaducich reakcií
U pacientov, ktorí už mali skúsenosť s liečbou, aj u predtým neliečených pacientov, a ktorým bol
nasadený raltegravir spolu s inými antiretrovírusovými liečivami, bola hlásená rakovina. Jednalo sa
o špecifické typy a výskyty rakoviny, aké sa očakávajú u vysoko imunodeficientnej populácie. Riziko vzniku rakoviny bolo v týchto štúdiách podobné v skupinách dostávajúcich raltegravir a v skupinách dostávajúcich porovnávané liečivá.
U osôb liečených raltegravirom sa pozorovali abnormálne laboratórne hodnoty kreatínkinázy stupňa 2-
4. Bola hlásená myopatia a rabdomyolýza. U pacientov, ktorí v minulosti mali myopatiu alebo rabdomyolýzu alebo majú akékoľvek predurčujúce faktory vrátane iných liekov spojených s týmito stavmi, je potrebné používať s opatrnosťou (pozri časť 4.4).
Boli hlásené prípady osteonekrózy, najmä u pacientov so všeobecne uznávanými rizikovými faktormi, pokročilým HIV ochorením alebo dlhodobou expozíciou kombinovanej antiretrovírusovej terapii (CART). Frekvencia osteonekrózy nie je známa (pozri časť 4.4).
U pacientov infikovaných HIV s ťažkou imunodeficienciou môže v čase nasadenia kombinovanej antiretrovírusovej terapie (CART) vzniknúť zápalová reakcia na asymptomatické alebo reziduálne oportúnne infekcie. Boli zaznamenané aj autoimunitné poruchy (ako je Gravesova choroba); avšak zaznamenaný čas do ich nástupu je rôznorodejší a tieto udalosti sa môžu vyskytnúť mnoho mesiacov po začatí liečby (pozri časť 4.4).
Pri každej z nasledovných klinických nežiaducich reakcií sa objavil minimálne jeden závažný výskyt:
genitálny herpes, anémia, syndróm imunitnej reaktivácie, depresia, mentálna porucha, pokus o suicídium, gastritída, hepatitída, zlyhanie obličiek, náhodné predávkovanie.
V klinických štúdiách pacientov, ktorí už mali skúsenosť s liečbou, sa v režimoch obsahujúcich raltegravir a darunavir v porovnaní s režimami obsahujúcimi raltegravir bez darunaviru alebo
darunavir bez raltegraviru častejšie pozorovala vyrážka, bez ohľadu na príčinu jej vzniku. Vyrážka, ktorá sa podľa názoru skúšajúceho považovala za súvisiacu s liekom, sa objavila v podobných mierach výskytu. Miery výskytu vyrážky upravené na expozíciu (všetky príčiny) boli 10,9 pri raltegravire + darunavire, 4,2 pri raltegravire bez darunaviru a 3,8 pri darunavire bez raltegraviru na 100 pacientorokov (PYR) a miery výskytu vyrážky súvisiacej s liekom boli 2,4 pri raltegravire + darunavire, 1,1 pri raltegravire bez darunaviru a 2,3 pri darunavire bez raltegraviru na 100 PYR. Vyrážky pozorované v klinických štúdiách boli mierne až stredne závažné a neviedli k vysadeniu liečby (pozri časť 4.4).
Pacienti súbežne infikovaní vírusom hepatitídy B a/alebo hepatitídy C
Pacientom, ktorí už mali skúsenosť s liečbou (N=114/699 alebo 16 %; HBV=6 %, HCV=9 %, HBV+HCV=1 %), aj predtým neliečeným pacientom (N=34/563 alebo 6 %; HBV=4 %, HCV=2 %, HBV+HCV=0,2 %), a ktorí mali chronickú (ale nie akútnu) aktívnu koinfekciu hepatitídou B a/alebo hepatitídou C, bolo povolené zaradiť sa do štúdií fázy III za predpokladu, že testy východiskovej funkcie pečene neprekročili 5-násobok hornej hranice normálneho rozpätia. Vo všeobecnosti bol bezpečnostný profil raltegraviru u pacientov súbežne infikovaných vírusom hepatitídy B a/alebo hepatitídy C podobný profilu u pacientov bez koinfekcie vírusom hepatitídy B a/alebo hepatitídy C, hoci miery abnormalít AST a ALT boli v oboch liečebných skupinách o niečo vyššie v podskupine
s koinfekciou vírusom hepatitídy B a/alebo hepatitídy C. U pacientov, ktorí už mali skúsenosť
s liečbou, sa abnormálne laboratórne hodnoty stupňa 2 alebo vyššieho, čo vyjadruje stupeň zhoršenia oproti východiskovým hodnotám AST, ALT alebo celkového bilirubínu, vyskytli v 96. týždni u 29 %,
34 %, resp. 13 % súbežne infikovaných pacientov liečených raltegravirom, oproti 11 %, 10 %, resp.
9 % všetkých ostatných pacientov liečených raltegravirom. U predtým neliečených pacientov sa abnormálne laboratórne hodnoty stupňa 2 alebo vyššieho, čo vyjadruje stupeň zhoršenia oproti
východiskovým hodnotám AST, ALT alebo celkového bilirubínu, vyskytli v 240. týždni u 22 %,
44 %, resp. 17 % súbežne infikovaných pacientov liečených raltegravirom, oproti 13 %, 13 %, resp.
5 % všetkých ostatných pacientov liečených raltegravirom.
Pediatrická populácia
Deti a dospievajúci vo veku od 2 do 18 rokov
Raltegravir sa skúmal u 126 detí a dospievajúcich infikovaných HIV-1 vo veku od 2 do 18 rokov so skúsenosťou s antiretrovírusovou liečbou v kombinácii s inými antiretrovírusovými liečivami v štúdii IMPAACT P1066 (pozri časti 5.1 a 5.2). 96 zo 126 pacientov dostávalo odporúčanú dávku raltegraviru.
U týchto 96 detí a dospievajúcich boli frekvencia, typ a závažnosť nežiaducich reakcií súvisiacich s liekom do 48. týždňa porovnateľné s nežiaducimi reakciami, ktoré sa pozorovali u dospelých.
U jedného pacienta sa vyskytli klinické nežiaduce reakcie psychomotorickej hyperaktivity 3. stupňa, abnormálne správanie a insomnia, ktoré súviseli s liekom; u jedného pacienta sa objavila závažná alergická vyrážka 2. stupňa súvisiaca s liekom.
U jedného pacienta sa objavili laboratórne abnormality, hladiny AST 4. stupňa a hladiny ALT
3. stupňa, ktoré súviseli s liekom a ktoré sa považovali za závažné.
Dojčatá a batoľatá vo veku 4 týždne do menej ako 2 roky
Raltegravir sa tiež skúmal u 26 dojčiat a batoliat infikovaných HIV-1 vo veku 4 týždne do menej ako 2
roky v kombinácii s inými antiretrovírusovými liečivami v štúdii IMPAACT P1066 (pozri časti 5.1
a 5.2).
U týchto 26 dojčiat a batoliat boli frekvencia, typ a závažnosť nežiaducich reakcií súvisiacich s liekom do 48. týždňa porovnateľné s nežiaducimi reakciami, ktoré sa pozorovali u dospelých.
U jedného pacienta sa vyskytla závažná alergická vyrážka 3. stupňa súvisiaca s liekom, ktorá viedla k ukončeniu liečby.
Hlásenie podozrení na nežiaduce reakcie

Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieO liečbe predávkovania raltegravirom nie sú k dispozícii žiadne špecifické informácie.
V prípade predávkovania sa odporúča vykonať štandardné podporné opatrenia, napr. odstrániť neabsorbovaný materiál z gastrointestinálneho traktu, zaviesť klinické monitorovanie (vrátane vyhotovenia elektrokardiogramu) a ak je to potrebné, nasadiť podpornú liečbu. Treba vziať do úvahy, že raltegravir je na klinické použitie vo forme draselnej soli. Nie je známe, do akej miery je raltegravir dialyzovateľný.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antivirotiká na systémové použitie, iné antivirotiká, ATC kód: J05AX08
Mechanizmus účinkuRaltegravir je inhibítor prenosu reťazcov integrázou účinný proti vírusu ľudskej imunodeficiencie
(HIV-1). Raltegravir inhibuje katalytickú aktivitu integrázy, enzýmu kódovaného HIV, ktorý je potrebný na vírusovú replikáciu. Inhibícia integrázy zabraňuje kovalentnému vloženiu alebo integrácii genómu HIV do genómu hostiteľskej bunky. Genómy HIV, ktoré sa nedokážu včleniť, nemôžu riadiť tvorbu nových infekčných vírusových častíc, takže inhibícia integrácie zabraňuje šíreniu vírusovej infekcie.
Antivírusová aktivita in vitroRaltegravir v koncentráciách 31 ± 20 nmol/l viedol k 95 % inhibícii (IC95) replikácie HIV-1
(v porovnaní s neliečenou kultúrou infikovanou vírusom) v ľudských T-lymfoidných bunkových
kultúrach infikovaných na bunkovú líniu adaptovaným HIV-1 variantom H9IIIB. Okrem toho raltegravir inhiboval vírusovú replikáciu v kultúrach mitogénom aktivovaných ľudských
mononukleárov z periférnej krvi infikovaných rôznymi primárnymi klinickými izolátmi HIV-1 vrátane
izolátov z 5 podtypov non-B a izolátov rezistentných voči inhibítorom reverznej transkriptázy
a inhibítorom proteázy. V teste s jedným cyklom infekcie raltegravir inhiboval infekciu 23 izolátmi HIV reprezentujúcimi 5 podtypov non-B a 5 cirkulujúcich rekombinantných foriem s hodnotami IC50 v rozsahu od 5 do 12 nmol/l.
RezistenciaVäčšina vírusov izolovaných od pacientov, u ktorých raltegravir zlyhal, mala vysokú úroveň
rezistencie voči raltegraviru vyplývajúcu z prítomnosti dvoch alebo viacerých mutácií. Väčšina mala charakteristickú mutáciu 155. aminokyseliny (N155 zamenená za H), 148. aminokyseliny (Q148
zamenená za H, K alebo R) alebo 143. aminokyseliny (Y143 zamenená za H, C alebo R), popri jednej alebo viacerých ďalších mutáciách integrázy (napr. L74M, E92Q, T97A, E138A/K, G140A/S, V151I,
G163R, S230R). Charakteristické mutácie znižovali citlivosť vírusu voči raltegraviru a prítomnosť ďalších mutácií mala za následok ďalší pokles citlivosti voči raltegraviru. Faktory, ktoré znižovali pravdepodobnosť vzniku rezistencie, zahŕňali nižšiu základnú vírusovú záťaž a použitie iných
účinných antiretrovírusových liečiv. Mutácie spôsobujúce rezistenciu na raltegravir vo všeobecnosti spôsobujú aj rezistenciu na elvitegravir, inhibítor prenosu reťazcov integrázou. Mutácie 143.
aminokyseliny spôsobujú väčšiu rezistenciu na raltegravir ako na elvitegravir a mutácia E92Q spôsobuje väčšiu rezistenciu na elvitegravir ako na raltegravir. Pri vírusoch s mutáciou 148. aminokyseliny spolu s jednou alebo viacerými inými mutáciami rezistencie na raltegravir sa môže vyskytovať aj klinicky významná rezistencia na dolutegravir.
Klinická skúsenosť
Dôkaz účinnosti raltegraviru bol založený na analýzach 96-týždňových údajov z dvoch
randomizovaných, dvojito zaslepených, placebom kontrolovaných skúšaní (BENCHMRK 1
a BENCHMRK 2, Protokoly 018 a 019) u dospelých pacientov infikovaných HIV-1, ktorí už mali skúsenosť s antiretrovírusovou liečbou a na analýze 240-týždňových údajov z randomizovaného,
dvojito zaslepeného, aktívnym komparátorom kontrolovaného skúšania (STARTMRK, Protokol 021)
u dospelých pacientov infikovaných HIV-1 predtým neliečených antiretrovírusovou liečbou.
Účinnosť
Dospelí pacienti, ktorí už mali skúsenosť s liečbou
BENCHMRK 1 a BENCHMRK 2 (multicentrické randomizované dvojito zaslepené placebom kontrolované skúšania) hodnotili bezpečnosť a antiretrovírusovú aktivitu raltegraviru 400 mg dvakrát
denne oproti placebu v kombinácii s optimalizovanou základnou terapiou (optimised background
therapy, OBT) u pacientov infikovaných HIV vo veku 16 rokov a starších s dokumentovanou rezistenciou na minimálne jeden liek v každej z 3 tried (NRTI, NNRTI, PI) antiretrovírusovej terapie. Pred randomizáciou zvolil skúšajúci OBT na základe pacientovej doterajšej liečebnej anamnézy, ako aj na základe východiskového testovania genotypovej a fenotypovej vírusovej rezistencie.
Demografia (pohlavie, vek a rasa) a východiskové charakteristiky pacientov boli medzi skupinami dostávajúcimi raltegravir 400 mg dvakrát denne a placebo porovnateľné. Pacienti boli v minulosti vystavení mediánu 12 antiretrovirotík počas mediánu 10 rokov. V rámci OBT sa použil medián 4
ART.
Výsledky 48-týždňových a 96-týždňových analýz
Stále výsledky (48. týždeň a 96. týždeň) u pacientov s odporúčanou dávkou raltegraviru 400 mg dvakrát denne zo zlúčených štúdií BENCHMRK 1 a BENCHMRK 2 sú znázornené v tabuľke 4.
Tabuľka 4
Výsledky účinnosti v 48. a 96. týždni
BENCHMRK 1 a 2 zlúčené
48. týždeň 96. týždeň
Parameter
Percento HIV-RNA <400 kópií/ml (95 % IS)
Raltegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)
Raltegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)




Všetci pacienti† 72 (68, 76) 37 (31, 44) 62 (57, 66) 28 (23, 34) Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 62 (53, 69) 17 (9, 27) 53 (45, 61) 15 (8, 25)
≤100 000 kópií/ml 82 (77, 86) 49 (41, 58) 74 (69, 79) 39 (31, 47) Počet CD4 ≤50 buniek/mm3 61 (53, 69) 21 (13, 32) 51 (42, 60) 14 (7, 24)
>50 a ≤200 buniek/mm3 80 (73, 85) 44 (33, 55) 70 (62, 77) 36 (25, 48)
>200 buniek/mm3 83 (76, 89) 51 (39, 63) 78 (70, 85) 42 (30, 55) Skóre citlivosti (GSS)§
0 52 (42, 61) 8 (3, 17) 46 (36, 56) 5 (1, 13)
1 81 (75, 87) 40 (30, 51) 76 (69, 83) 31 (22, 42)
2 a vyššie 84 (77, 89) 65 (52, 76) 71 (63, 78) 56 (43, 69)
BENCHMRK 1 a 2 zlúčené
48. týždeň 96. týždeň
Parameter
Percento HIV-RNA <50 kópií/ml (95 % IS)
Raltegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)
Raltegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)
Všetci pacienti† 62 (57, 67) 33 (27, 39) 57 (52, 62) 26 (21, 32) Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 48 (40, 56) 16 (8, 26) 47 (39, 55) 13 (7, 23)
≤100 000 kópií/ml 73 (68, 78) 43 (35, 52) 70 (64, 75) 36 (28, 45) Počet CD4 ≤50 buniek/mm3 50 (41, 58) 20 (12, 31) 50 (41, 58) 13 (6, 22)
>50 a ≤200 buniek/mm3 67 (59, 74) 39 (28, 50) 65 (57, 72) 32 (22, 44)
>200 buniek/mm3 76 (68, 83) 44 (32, 56) 71 (62, 78) 41 (29, 53) Skóre citlivosti (GSS)§
0 45 (35, 54) 3 (0, 11) 41 (32, 51) 5 (1, 13)
1 67 (59, 74) 37 (27, 48) 72 (64, 79) 28 (19, 39)
2 a vyššie 75 (68, 82) 59 (46, 71) 65 (56, 72) 53 (40, 66)
Priemerná zmena počtu CD4 buniek (95 % IS), bunky/mm3
Všetci pacienti‡ 109 (98,
121)
45 (32, 57) 123 (110,
137)
49 (35, 63)
Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 126 (107,
144)
≤100 000 kópií/ml 100 (86,
115) Počet CD4 ≤50 buniek/mm3 121 (100,
142)
>50 a ≤200 buniek/mm3 104 (88,
119)
>200 buniek/mm3 104 (80,
129)
36 (17, 55) 140 (115,
165)
49 (33, 65) 114 (98,
131)
33 (18, 48) 130 (104,
156)
47 (28, 66) 123 (103,
144)
54 (24, 84) 117 (90,
143)
40 (16, 65)
53 (36, 70)
42 (17, 67)
56 (34, 79)
48 (23, 73)
Skóre citlivosti (GSS)§
0 81 (55, 106) 11 (4, 26) 97 (70, 124) 15 (-0, 31)
1 113 (96,
130)
2 a vyššie 125 (105,
144)
44 (24, 63) 132 (111,
154)
76 (48, 103) 134 (108,
159)
45 (24, 66)
90 (57, 123)






† Pacient, ktorý nedokončil štúdiu, sa posudzuje ako zlyhanie: pacienti, ktorí predčasne prerušili, sú následne pokladaní za neúspešných.
Hlásené je percento pacientov s odpoveďou a príslušný 95 % interval spoľahlivosti (IS).
‡ Na analýzu podľa prognostických faktorov sa pre percentá <400 a 50 kópií/ml virologické zlyhania prenášali (carried forward). Pre priemerné zmeny počtu CD4 sa na virologické zlyhania použila metóda prenosu východiskovej hodnoty (baseline-carry-forward).
§ Skóre genotypovej citlivosti (GSS) bolo definované ako súčet perorálnych ART v optimalizovanej základnej terapii (OBT), na ktoré vírusový izolát pacienta vykazoval genotypovú citlivosť na základe testu genotypovej rezistencie. Použitie enfuvirtidu v OBT
u pacientov, ktorí nemali predchádzajúcu skúsenosť s enfuvirtidom, sa počítalo ako jeden účinný liek v OBT. Podobne sa použitie darunaviru v OBT u pacientov doposiaľ neliečených darunavirom počítalo ako jeden účinný liek v OBT.
Raltegravir dosiahol virologické odpovede (pri použití prístupu: pacient, ktorý nedokončil=zlyhanie)
HIV RNA <50 kópií/ml v 16. týždni u 61,7 % pacientov, v 48. týždni u 62,1 % pacientov a v 96. týždni u 57,0 %. U niektorých pacientov došlo medzi 16. a 96. týždňom k opätovnému vírusovému
nárastu. Faktory spojené so zlyhaním zahŕňajú vysokú počiatočnú vírusovú záťaž a OBT, ktorá
nezahŕňala minimálne jedno účinné liečivo.
Prechod na raltegravirŠtúdie SWITCHMRK 1 a 2 (Protokoly 032 a 033) hodnotili pacientov infikovaných HIV, ktorí dostávali supresívnu (skríning HIV RNA <50 kópií/ml; stabilný režim >3 mesiace) terapiu
s lopinavirom 200 mg (+) ritonavirom 50 mg 2 tablety dvakrát denne plus najmenej 2 nukleozidové
inhibítory reverznej transkriptázy, a randomizovali ich v pomere 1:1 tak, aby pokračovali v užívaní lopinaviru (+) ritonaviru 2 tablety dvakrát denne (n=174, resp. n=178) alebo sa lopinavir (+) ritonavir nahradili raltegravirom 400 mg dvakrát denne (n=174, resp. n=176). Pacienti s virologickým zlyhaním v anamnéze neboli vylúčení a počet predchádzajúcich antiretrovírusových terapií nebol obmedzený.
Tieto štúdie boli ukončené po primárnej analýze účinnosti v 24. týždni, pretože sa im nepodarilo preukázať neinferioritu raltegraviru oproti lopinaviru (+) ritonaviru. V oboch štúdiách sa v 24. týždni supresia HIV RNA na menej ako 50 kópií/ml udržala u 84,4 % pacientov v skupine s raltegravirom oproti 90,6 % v skupine s lopinavirom (+) ritonavirom (pacienti, ktorí nedokončili štúdiu = zlyhanie). O potrebe podávať raltegravir s dvoma ďalšími účinnými liečivami pozri časť 4.4.
Predtým neliečení dospelí pacientiV STARTMRK (multicentrické randomizované, dvojito zaslepené, aktívnym komparátorom kontrolované skúšanie) sa hodnotila bezpečnosť a antiretrovírusová aktivita raltegraviru 400 mg
dvakrát denne oproti efavirenzu 600 mg večer pred spaním, v kombinácii s emtricitabínom (+)
tenofovir-dizoproxilfumarátom, u predtým neliečených pacientov infikovaných HIV s HIV RNA >5 000 kópií/ml. Randomizácia bola stratifikovaná podľa skríningu hladiny HIV RNA (≤50 000 kópií/ml a >50 000 kópií/ml) a podľa infekcie hepatitídou B alebo C (pozitívna alebo negatívna).
Demografia (pohlavie, vek a rasa) a východiskové charakteristiky pacientov boli medzi skupinou užívajúcou raltegravir 400 mg dvakrát denne a skupinou, ktorá užívala efavirenz 600 mg večer pred spaním, porovnateľné.
Výsledky 48-týždňových a 240-týždňových analýzPokiaľ ide o primárny cieľový ukazovateľ účinnosti, podiel (%) pacientov, ktorí dosiahli HIV RNA
< 50 kópií/ml v 48. týždni, bol 241/280 (86,1 %) v skupine užívajúcej raltegravir a 230/281 (81,9 %)
v skupine užívajúcej efavirenz. Terapeutický rozdiel (raltegravir – efavirenz) bol 4,2 % s príslušným
95 % IS (-1,9, 10,3), čo potvrdzuje, že raltegravir nie je inferiórny oproti efavirenzu (p-hodnota pre neinferioritu <0,001). Terapeutický rozdiel (raltegravir – efavirenz) v 240. týždni bol 9,5 %,

s príslušným 95 % IS (1,7, 17,3). Výsledky v 48. týždni a 240. týždni u pacientov užívajúcich odporúčanú dávku raltegraviru 400 mg dvakrát denne zo štúdie STARTMRK sú uvedené v tabuľke 5.
Tabuľka 5Výsledky účinnosti v 48. a 240. týždni
Štúdia STARTMRK
48. týždeň 240. týždeň
Parameter
Raltegravir
400 mg dvakrát denne
Efavirenz
600 mg večer pred spaním (N=282)
Raltegravir
400 mg dvakrát denne
Efavirenz
600 mg večer pred spaním (N=282)
 (N=281) (N=281)
Percento HIV-RNA <50 kópií/ml (95 % IS)
(N=281) (N=281)
Percento HIV-RNA <50 kópií/ml (95 % IS)
Všetci pacienti† 86 (81, 90) 82 (77, 86) 71 (65, 76) 61 (55, 67) Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 91 (85, 95) 89 (83, 94) 70 (62, 77) 65 (56, 72)
≤100 000 kópií/ml 93 (86, 97) 89 (82, 94) 72 (64, 80) 58 (49, 66) Počet CD4 ≤50 buniek/mm3 84 (64, 95) 86 (67, 96) 58 (37, 77) 77 (58, 90)
>50 a ≤200 buniek/mm3 89 (81, 95) 86 (77, 92) 67 (57, 76) 60 (50, 69)

>200 buniek/mm3 94 (89, 98) 92 (87, 96) 76 (68, 82) 60 (51, 68) Vírusový podtyp vetvy B 90 (85, 94) 89 (83, 93) 71 (65, 77) 59 (52, 65) nepatriaci do vetvy B 96 (87, 100) 91 (78, 97) 68 (54, 79) 70 (54, 82)
 Štúdia STARTMRK
48. týždeň 240. týždeň
Štúdia STARTMRK
48. týždeň 240. týždeň
 Parameter
Priemerná zmena počtu CD4 buniek (95 % IS), bunky/mm
3
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
600 mg večer pred spaním
(N=282)
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
Parameter
Priemerná zmena počtu CD4 buniek (95 % IS), bunky/mm
3
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
600 mg večer pred spaním
(N=282)
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
 600 mg večer pred spaním
(N=282)
600 mg večer pred spaním
(N=282)
Všetci pacienti‡ 189 (174,
204)
163 (148,
178)
374 (345,
403)
312 (284,
339)
Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 196 (174,
219)
≤100 000 kópií/ml 180 (160,
200) Počet CD4 ≤50 buniek/mm3 170 (122,
218)
>50 a ≤200 buniek/mm3 193 (169,
217)
>200 buniek/mm3 190 (168,
212) Vírusový podtyp vetvy B 187 (170,
204)
nepatriaci do vetvy B 189 (153,
225)
192 (169,
214)
134 (115,
153)
152 (123,
180)
175 (151,
198)
157 (134,
181)
164 (147,
181)
156 (121,
190)
392 (350,
435)
350 (312,
388)
304 (209,
399)
413 (360,
465)
358 (321,
395)
380 (346,
414)
332 (275,
388)
329 (293,
364)
294 (251,
337)
314 (242,
386)
306 (264,
348)
316 (272,
359)
303 (272,
333)
329 (260,
398)

† Pacient, ktorý nedokončil štúdiu, sa posudzuje ako zlyhanie: pacienti, ktorí predčasne prerušili, sú následne pokladaní za neúspešných.
Hlásené je percento pacientov s odpoveďou a príslušný 95 % interval spoľahlivosti (IS).
‡ Na analýzu podľa prognostických faktorov sa pre percentá <50 a 400 kópií/ml virologické zlyhania prenášali (carried forward). Pre priemerné zmeny počtu CD4 sa na virologické zlyhania použila metóda prenosu východiskovej hodnoty (baseline-carry-forward).
Poznámky: Analýza vychádza zo všetkých dostupných údajov.

Raltegravir a efavirenz sa podávali s emtricitabínom (+) tenofovir-dizoproxilfumarátom.
Pediatrická populáciaDeti a dospievajúci vo veku od 2 do 18 rokovIMPAACT P1066 je otvorené multicentrické skúšanie fázy I/II na zhodnotenie farmakokinetického profilu, bezpečnosti, znášanlivosti a účinnosti raltegraviru u detí infikovaných HIV. Do tejto štúdie
bolo zaradených 126 detí a dospievajúcich vo veku od 2 do 18 rokov so skúsenosťou s liečbou. Pacienti boli rozdelení podľa veku, zaraďovali sa najprv dospievajúci a následne potom mladšie deti.
Pacienti dostávali buď 400 mg v liekovej forme tabliet (vek od 6 do 18 rokov) alebo liekovú formu žuvacie tablety (vek od 2 do menej ako 12 rokov). Raltegravir sa podával s optimalizovaným základným režimom.
Úvodné obdobie hľadania dávky zahŕňalo intenzívne farmakokinetické hodnotenie. Výber dávky vychádzal z dosiahnutia podobnej plazmatickej expozície a minimálnej koncentrácie raltegraviru, aké sa pozorovali u dospelých a z akceptovateľnej krátkodobej bezpečnosti. Po výbere dávky boli na posúdenie dlhodobej bezpečnosti, znášanlivosti a účinnosti zaradení ďalší pacienti. 96 zo 126 pacientov dostávalo odporúčanú dávku raltegraviru (pozri časť 4.2).'
 Tabuľka 6
Tabuľka 6
 Východiskové charakteristiky a výsledky účinnosti v 24. a 48. týždni štúdie IMPAACT P1066 (vo veku 2 až 18 rokov)
Východiskové charakteristiky a výsledky účinnosti v 24. a 48. týždni štúdie IMPAACT P1066 (vo veku 2 až 18 rokov)
Parameter
 Demografia
Populácia užívajúca konečnú dávku
N = 96
Demografia
Populácia užívajúca konečnú dávku
N = 96
Vek (roky), medián [rozsah] 13 [2 – 18]
Mužské pohlavie 49 %
RasaKaukazský typ 34 %
Černosi 59 %
Východiskové charakteristikyPlazmatická HIV-1 RNA (log10 kópie/ml), priemer
[rozsah] 4,3 [2,7 - 6]
Počet CD4 buniek (bunky/mm3), medián [rozsah] 481 [0 – 2 361]
Percento CD4, medián [rozsah] 23,3 % [0 – 44]
HIV-1 RNA > 100 000 kópií /ml 8 %
Kategória B alebo C CDC HIV 59 %
Predchádzajúce použitie ART podľa triedyNNRTI 78 % PI 83 %
 Odpoveď 24. týždeň 48. týždeň
Odpoveď 24. týždeň 48. týždeňDosiahnutý ≥ 1 log10 pokles HIV RNA oproti
východiskovej hodnote alebo < 400 kópií/ml 72 % 79 %
Dosiahnutá HIV RNA < 50 kópií/ml 54 % 57 %
Priemerné zvýšenie počtu CD4 buniek (%) oproti východiskovým hodnotám
119 buniek/mm3
(3,8 %)
156 buniek/mm3
(4,6 %)
Dojčatá a batoľatá vo veku 4 týždne do menej ako 2 roky
Štúdia IMPAACT P1066 tiež zahŕňala dojčatá a batoľatá vo veku 4 týždne do menej ako 2 roky infikované HIV, ktoré predtým dostávali antiretrovírusovú liečbu buď ako profylaxiu na prevenciu
prenosu z matky na dieťa (PMTCT) a/alebo v kombinovanej antiretrovírusovej liečbe na liečbu infekcie HIV. Raltegravir sa podával vo forme granulátu na perorálnu suspenziu bez ohľadu na jedlo
v kombinácii s optimalizovaným základným režimom, ktorý u dvoch tretín pacientov zahŕňal lopinavir plus ritonavir.
Tabuľka 7
Východiskové charakteristiky a výsledky účinnosti v 24. a 48. týždni štúdie IMPAACT P1066 (vo veku 4 týždne do menej ako 2 roky)
Parameter N = 26
Demografia
Vek (týždne), medián [rozsah] 28 [4 – 100]
Mužské pohlavie 65 %
Rasa
Kaukazský typ 8 % Černosi 85 %
Východiskové charakteristiky
Plazmatická HIV-1 RNA (log10 kópie/ml), priemer
[rozsah] 5,7 [3,1 – 7]
Počet CD4 buniek (bunky/mm3 ), medián [rozsah] 1 400 [131 – 3 648]
Percento CD4, medián [rozsah] 18,6 % [3,3 – 39,3]
HIV-1 RNA > 100 000 kópií /ml 69 %
Kategória B alebo C CDC HIV 23 %
Predchádzajúce použitie ART podľa triedy
NNRTI 73 % NRTI 46 %
PI 19 %
Odpoveď 24. týždeň 48. týždeň
Dosiahnutý ≥ 1 log10 pokles HIV RNA oproti
východiskovej hodnote alebo < 400 kópií/ml 91 % 85 %
Dosiahnutá HIV RNA < 50 kópií/ml 43 % 53 %
Priemerné zvýšenie počtu CD4 buniek (%) oproti východiskovým hodnotám
500 buniek/mm3
(7,5 %)
492 buniek/mm3
(7,8 %)



 Virologické zlyhanie
24. týždeň 48. týždeň
Virologické zlyhanie
24. týždeň 48. týždeň
Pacient bez odpovede 0 0
Rebounder 0 4
Počet s dostupným genotypom* 0 2
*U jedného pacienta sa vyskytla mutácia v polohe 155.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s raltegravirom v jednej alebo vo viacerých podskupinách pediatrickej populácie s infekciou ľudskej imunitnej nedostatočnosti (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaU zdravých dobrovoľníkov, ktorým sa podali jednotlivé perorálne dávky raltegraviru nalačno, sa
preukázalo, že sa raltegravir rýchlo absorbuje s tmax približne 3 hodiny po podaní dávky. AUC a Cmax raltegraviru sa zvyšujú úmerne dávke v rozmedzí dávok 100 mg až 1 600 mg. C12 h raltegraviru sa zvyšuje úmerne dávke v rozmedzí dávok 100 až 800 mg a zvyšuje sa o niečo menej, ako je úmerné dávke v rozmedzí dávok 100 mg až 1 600 mg. Dávková proporcionalita nebola stanovená u pacientov.
Pri dávkovaní dvakrát denne sa farmakokinetický rovnovážny stav dosahuje rýchlo, približne
v priebehu prvých 2 dní užívania lieku. Dochádza len k malej až žiadnej kumulácii v AUC a Cmax a dokázaná je mierna kumulácia v C12 h. Absolútna biologická dostupnosť raltegraviru nebola stanovená.
Raltegravir sa môže podávať s jedlom alebo bez jedla. V pivotných štúdiách bezpečnosti a účinnosti u pacientov infikovaných HIV sa raltegravir podával bez ohľadu na jedlo. Podanie viacnásobných
dávok raltegraviru po jedle s miernym obsahom tuku neovplyvnilo AUC raltegraviru v klinicky významnej miere, AUC stúpla o 13 % v porovnaní s podaním nalačno. Po podaní po jedle s miernym obsahom tuku bola C12 h raltegraviru o 66 % vyššia a Cmax o 5 % vyššia ako po podaní nalačno. Podanie raltegraviru po jedle s vysokým obsahom tuku zvýšilo AUC a Cmax približne dvojnásobne
a C12 h 4,1-násobne. Podanie raltegraviru po jedle s nízkym obsahom tuku znížilo AUC o 46 % a Cmax
o 52 %, C12 h sa v podstate nezmenila. Zdá sa, že v porovnaní so stavom nalačno potrava zvyšuje
farmakokinetickú variabilitu.
Vo farmakokinetike raltegraviru sa celkovo pozorovala značná variabilita. V skúšaniach
BENCHMRK 1 a 2 sa variačný koeficient (CV) pozorovanej C12 h pre interindividuálnu variabilitu
= 212 % a CV pre intraindividuálnu variabilitu = 122 %. Zdroje variability môžu zahŕňať rozdiely
v podaní spolu s jedlom a súbežne podávanými liekmi.
Distribúcia
V rozsahu koncentrácie 2 až 10 µmol/l sa na ľudské plazmatické proteíny viaže približne 83 %
raltegraviru.
Raltegravir rýchlo prechádzal cez placentu u potkanov, ale do mozgu v zreteľnom rozsahu neprenikol.
V dvoch štúdiách pacientov infikovaných HIV-1, ktorí dostávali raltegravir 400 mg dvakrát denne, sa raltegravir ľahko detegoval v cerebrospinálnej tekutine. V prvej štúdii (n = 18) bol medián koncentrácie v cerebrospinálnej tekutine 5,8 % (rozsah od 1 do 53,5 %) zodpovedajúcej plazmatickej koncentrácie. V druhej štúdii (n = 16) bol medián koncentrácie v cerebrospinálnej tekutine 3 %
(rozsah od 1 do 61 %) zodpovedajúcej plazmatickej koncentrácie. Tieto mediány podielov sú približne
3- až 6-násobne nižšie ako voľná frakcia raltegraviru v plazme.
Biotransformácia a vylučovanie
Zjavný terminálny polčas raltegraviru je približne 9 hodín s kratším polčasom fázy alfa (~1 hodina)
zodpovedným za veľkú časť AUC. Po podaní perorálnej dávky rádioaktívne značeného raltegraviru sa približne 51 % dávky vylúčilo v stolici a 32 % dávky v moči. V stolici bol prítomný iba raltegravir,
z ktorého väčšina je pravdepodobne derivovaná z hydrolýzy raltegravir-glukuronidu vylúčeného
žlčou, ako sa pozorovalo u predklinických druhov. V moči boli zistené dva komponenty, a to raltegravir a raltegravir-glukuronid, a tvorili približne 9 % (raltegravir) a 23 % (raltegravir-glukuronid) dávky. Hlavnou cirkulujúcou látkou bol raltegravir a predstavoval približne 70 % celkovej rádioaktivity; zostávajúcu rádioaktivitu v plazme predstavoval raltegravir-glukuronid. Štúdie
s izoformnými selektívnymi chemickými inhibítormi a cDNA exprimovanými UDP- glukuronozyltransferázami (UGT) ukazujú, že hlavným enzýmom zodpovedným za tvorbu raltegravir-
glukuronidu je UGT1A1. Údaje teda poukazujú na to, že hlavným mechanizmom klírensu raltegraviru
u ľudí je glukuronidácia sprostredkovaná UGT1A1.
Polymorfizmus UGT1A1
Pri porovnaní 30 osôb s *28/*28 genotypom s 27 osobami s genotypom divokého typu bol pomer geometrických priemerov (90 % IS) AUC 1,41 (0,96, 2,09) a pomer geometrických priemerov C12 h
1,91 (1,43, 2,55). U osôb, u ktorých je z dôvodu genetického polymorfizmu aktivita UGT1A1 znížená,
sa nepovažuje za potrebné upravovať dávku.
Osobitné populácie
Pediatrická populácia
Na základe štúdie porovnávajúcej liekovú formu u zdravých dospelých dobrovoľníkov mali žuvacia tableta a granulát na perorálnu suspenziu vyššiu perorálnu biologickú dostupnosť v porovnaní
so 400 mg tabletou. V tejto štúdii viedlo podávanie žuvacej tablety s jedlom s vysokým obsahom tuku v priemere k 6 % poklesu AUC, 62 % poklesu Cmax a 188 % zvýšeniu C12hod v porovnaní s podaním nalačno. Podávanie žuvacej tablety s jedlom s vysokým obsahom tuku nemá klinicky významný vplyv na farmakokinetiku raltegraviru a žuvacia tableta sa môže podávať bez ohľadu na jedlo. Účinok jedla na liekovú formu granulát na perorálnu suspenziu sa neskúmal.
Tabuľka 8 uvádza farmakokinetické parametre pri 400 mg tablete, žuvacej tablete a granuláte na perorálnu suspenziu podľa telesnej hmotnosti.
Tabuľka 8: Farmakokinetické parametre raltegraviru IMPAACT P1066 po podaní dávok v časti 4.2
Telesná
hmotnosť Lieková forma Dávka N*
filmom obalená
Geometrický
priemer (% CV†) AUC0-12hod (μmol/l●hod)
Geometrický priemer (%CV†)
C12 hod (nmol/l)
≥ 25 kg
tableta 400 mg dvakrát denne 18 14,1
(121 %) 233 (
157 %) Dávkovanie na základe
telesnej hmotnosti, pozri
≥ 25 kg žuvacia tableta
11 do menej
ako 25 kg žuvacia tabletat
tabuľku 1 9 22,1 (36 %) 113 (80 %) Dávkovanie na základe
telesnej hmotnosti, pozri
tabuľku 2 13 18,6 (68 %) 82 (123 %)
Dávkovanie na základe telesnej hmotnosti, pozri tabuľky s dávkovaním
3 do menej ako 20 kg
perorálna suspenzia
pre granulát na
perorálnu suspenziu 19 24,5 (43 %) 113 (69 %)
*Počet pacientov s intenzívnymi farmakokinetickými (FK) výsledkami pri konečnej odporúčanej dávke.
†Geometrický koeficient zmeny.
Farmakokinetika raltegraviru u dojčiat mladších ako 4 týždne nebola stanovená.
Staršie osoby
V rámci študovaného vekového rozsahu (19 až 84 rokov, s niekoľkými osobami staršími ako 65
rokov) nemal vek klinicky významný vplyv na farmakokinetiku raltegraviru.
Pohlavie, rasa a BMI
V súvislosti s pohlavím, rasou alebo indexom telesnej hmotnosti (BMI) u dospelých sa nevyskytli žiadne klinicky významné farmakokinetické rozdiely.
Porucha funkcie obličiek
Renálny klírens nezmeneného liečiva je menšinovou dráhou eliminácie. U dospelých sa medzi pacientmi s ťažkou renálnou insuficienciou a zdravými osobami nevyskytli žiadne klinicky významné farmakokinetické rozdiely (pozri časť 4.2). Pretože nie je známe, do akej miery je raltegravir dialyzovateľný, je potrebné vyhnúť sa podávaniu pred dialýzou.
Porucha funkcie pečene
Raltegravir je primárne eliminovaný glukuronidáciou v pečeni. U dospelých sa medzi pacientmi so stredne ťažkou hepatálnou insuficienciou a zdravými osobami nevyskytli žiadne klinicky významné
farmakokinetické rozdiely. Vplyv ťažkej hepatálnej insuficiencie na farmakokinetiku raltegraviru sa
neskúmal (pozri časti 4.2 a 4.4).
5.3 Predklinické údaje o bezpečnosti
Predklinické štúdie toxicity vrátane obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, vývojovej toxicity a juvenilnej toxicity sa s raltegravirom vykonali na myšiach, potkanoch, psoch a králikoch. Účinky pri expozíciách dostatočne presahujúcich klinické expozičné hladiny nepoukazujú na žiadne osobitné riziko pre ľudí.
Mutagenita
V in vitro testoch mikrobiálnej mutagenézy (Ames), in vitro metódach alkalického vymývania na
detekciu zlomov DNA a in vitro a in vivo štúdiách chromozómovej aberácie sa nepozoroval dôkaz mutagenity ani genotoxicity.
Karcinogenita
Štúdia karcinogenity raltegraviru u myší nepreukázala žiadny karcinogénny potenciál. Pri najvyšších
úrovniach dávok, 400 mg/kg/deň u samíc a 250 mg/kg/deň u samcov, bola systémová expozícia podobná expozícii pri klinickej dávke 400 mg dvakrát denne. U potkanov sa pri dávkach 300
a 600 mg/kg/deň u samíc a 300 mg/kg/deň u samcov zistili tumory (karcinóm skvamóznych buniek)
nosa/nosohltana. Táto neoplázia môže byť následkom lokálneho ukladania a/alebo vdychovania liečiva na sliznicu nosa/nosohltana počas perorálneho podávania dávky sondou do žalúdka
a následného chronického dráždenia a zápalu. Je pravdepodobné, že pre zamýšľané klinické použitie
má obmedzený význam. Pri najvyššej dávke bez pozorovateľných nežiaducich účinkov (NOAEL -„no observable adverse effect level“) bola systémová expozícia podobná expozícii pri klinickej dávke
400 mg dvakrát denne. Štandardné štúdie genotoxicity hodnotiace mutagenitu a klastogenitu boli
negatívne.
Vývojová toxicita
V štúdiách vývojovej toxicity na potkanoch a králikoch nebol raltegravir teratogénny. U mláďat samíc
potkanov, ktoré boli vystavené raltegraviru v dávkach približne 4,4-násobne vyšších, ako je expozícia u ľudí pri dávke 400 mg dvakrát denne na základe AUC0-24 h, sa pozorovalo mierne zvýšenie incidencie nadpočetných rebier. Na základe AUC0-24 h neboli pri 3,4-násobku ľudskej expozície pri dávke 400 mg dvakrát denne pozorované žiadne účinky na vývoj (pozri časť 4.6). Podobné zistenia neboli pozorované u králikov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
25 mg žuvacia tableta
- hydroxypropylcelulóza
- sukralóza
- sodná soľ sacharínu
- dihydrát citrónanu sodného
- manitol
- glycyrizinát amónny
- sorbitol (E420)
- fruktóza
- banánová príchuť
- pomarančová príchuť
- chuťové korigens
- aspartam (E951)
- krospovidón, typ A
- stearylfumaran sodný
- stearan horečnatý
- hypromelóza 2910/6cP
- makrogol/PEG 400
- etylcelulóza 20 cP
- hydroxid amónny
- triglyceridy so stredne dlhým reťazcom
- kyselina olejová
- žltý oxid železitý
100 mg žuvacia tableta
- hydroxypropylcelulóza
- sukralóza
- sodná soľ sacharínu
- dihydrát citrónanu sodného
- manitol
- glycyrizinát amónny
- sorbitol (E420)
- fruktóza
- banánová príchuť
- pomarančová príchuť
- chuťové korigens
- aspartam (E951)
- krospovidón, typ A
- stearylfumaran sodný
- stearan horečnatý
- hypromelóza 2910/6cP
- makrogol/PEG 400
- etylcelulóza 20 cP
- hydroxid amónny
- triglyceridy so stredne dlhým reťazcom
- kyselina olejová
- červený oxid železitý
- žltý oxid železitý
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
6.4 Špeciálne upozornenia na uchovávanie
Fľašu udržiavajte dôkladne uzatvorenú s vysúšadlom vo vnútri na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
Fľaša z vysokodenzitného polyetylénu (HDPE) s polypropylénovým detským bezpečnostným uzáverom, tesnením indikujúcim prvé otvorenie a vysúšadlom zo silikagélu: 60 tabliet.
6.6 Špeciálne opatrenia na likvidáciu
Žiadne zvláštne požiadavky na likvidáciu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU
Veľká Británia
8. REGISTRAČNÉ ČÍSLA
EU/1/07/436/003 – 25 mg
EU/1/07/436/004 – 100 mg
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 20. decembra 2007
Dátum posledného predĺženia registrácie: 14. mája 2014
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky http://www.ema.europa.eu.
1. NÁZOV LIEKU
ISENTRESS 100 mg granulát na perorálnu suspenziu
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každé vrecko obsahuje 100 mg raltegraviru (ako draselnú soľ). Po rekonštitúcii má perorálna suspenzia koncentráciu 20 mg na 1 ml.
Pomocné látky so známym účinkom
Každé vrecko obsahuje približne 0,5 mg fruktózy, približne 1,5 mg sorbitolu a približne 4,7 mg sacharózy.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Granulát na perorálnu suspenziu.
Biely až takmer biely granulovaný prášok, ktorý môže obsahovať žlté alebo béžové až svetlohnedé častice vo vrecku na jednorazové použitie.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
ISENTRESS je indikovaný v kombinácii s inými antiretrovírusovými liekmi na liečbu infekcie
vírusom ľudskej imunodeficiencie (human immunodeficiency virus, HIV-1) dospelým, dospievajúcim, deťom, batoľatám a dojčatám starším ako 4 týždne (pozri časti 4.2, 4.4, 5.1 a 5.2).
4.2 Dávkovanie a spôsob podávania
S liečbou má začať lekár, ktorý je skúsený v liečbe infekcie HIV. Dávkovanie
ISENTRESS sa má používať v kombinácii s inými účinnými antiretrovírusovými liečbami
(antiretroviral therapies, ART) (pozri časti 4.4 a 5.1).
Pretože liekové formy majú rôzne farmakokinetické profily, ani granulát na perorálnu suspenziu a ani žuvacie tablety sa nemajú zamieňať za 400 mg alebo 600 mg tablety (pozri časť 5.2). Granulát na perorálnu suspenziu a žuvacie tablety sa neskúmali u dospievajúcich (12 až 18 rokov) a dospelých infikovaných HIV.
Dojčatá a batoľatá vo veku od 4 týždňov
Dávkovanie je založené na veku od 4 týždňov a telesnej hmotnosti 3 kg, ako je uvedené v tabuľke 1. Pacienti môžu užívať perorálnu suspenziu dovtedy, kým je ich telesná hmotnosť menej ako 20 kg.
U pacientov s telesnou hmotnosťou medzi 11 až 20 kg sa môže použiť buď granulát na perorálnu
suspenziu alebo žuvacia tableta, ako je uvedené v tabuľke 1 (pozri časť 5.2). Ďalšie informácie týkajúce sa dávkovania si prečítajte v súhrne charakteristických vlastností žuvacej tablety.
Tabuľka 1: Odporúčaná dávka* pre ISENTRESS granulát na perorálnu suspenziu a žuvacie tablety u pediatrických pacientov s telesnou hmotnosťou menej ako 25 kg
Telesná hmotnosť
(kg)
Objem (dávka) suspenzie, ktorý sa
má podať
Počet žuvacích tabliet

3 do menej ako 4 1 ml (20 mg) dvakrát denne
4 do menej ako 6 1,5 ml (30 mg) dvakrát denne
6 do menej ako 8 2 ml (40 mg) dvakrát denne
8 do menej ako 11 3 ml (60 mg) dvakrát denne
11 do menej ako 14† 4 ml (80 mg) dvakrát denne 3 x 25 mg dvakrát denne
14 do menej ako 20† 5 ml (100 mg) dvakrát denne 1 x 100 mg dvakrát denne
20 do menej ako 25 1,5 x 100 mg‡ dvakrát denne
* Odporúčanie dávkovania pre žuvacie tablety a perorálnu suspenziu na základe telesnej hmotnosti je založené na dávke približne 6 mg/kg/dávka dvakrát denne (pozri časť 5.2).
†Pri telesnej hmotnosti v rozmedzí 11 až 20 kg sa môže použiť ktorákoľvek z liekových foriem.
‡100 mg žuvacia tableta sa môže rozdeliť na rovnaké 50 mg dávky. Vždy, keď je to možné, sa však treba deleniu tablety vyhnúť.
Po podaní požadovaného objemu z 5 ml injekčnej striekačky s rozpustenou suspenziou raltegraviru, sa
zvyšné množstvo lieku vo forme suspenzie nemôže opätovne použiť a má sa zlikvidovať (pozri časť
6.6).
Maximálna dávka perorálnej suspenzie je 100 mg dvakrát denne.
Každé vrecko na jednorazové použitie obsahuje 100 mg raltegraviru, ktoré sa majú suspendovať v 5 ml vody, čím sa dosiahne konečná koncentrácia 20 mg na 1 ml.
U pacienta je potrebné dodržiavať naplánované návštevy, pretože dávkovanie lieku ISENTRESS sa má upraviť podľa toho, ako dieťa rastie.
Ďalšie dostupné liekové formy a sily
ISENTRESS je tiež dostupný ako 400 mg tablety na použitie u dospelých, dospievajúcich a detí s telesnou hmotnosťou minimálne 25 kg a schopných prehltnúť tabletu. U pacientov s telesnou
hmotnosťou menej ako 25 kg, ktorí ale nie sú schopní prehltnúť tabletu, zvážte žuvaciu tabletu. Ďalšie informácie týkajúce sa dávkovania si prečítajte v SPC pre 400 mg tablety a žuvacie tablety.
ISENTRESS je pre dospelých a deti a dospievajúcich (s telesnou hmotnosťou minimálne 40 kg) tiež dostupný ako 600 mg tablety, ktoré sa podávajú ako 1 200 mg jedenkrát denne (dve 600 mg tablety)
u predtým neliečených pacientov alebo u pacientov vo virologickej supresii pri úvodnom režime lieku
ISENTRESS 400 mg dvakrát denne. Ďalšie informácie týkajúce sa dávkovania si prečítajte v SPC pre
600 mg silu.
Staršie osobyO použití raltegraviru u starších osôb sú k dispozícii obmedzené informácie (pozri časť 5.2). ISENTRESS sa má preto v tejto populácii používať s opatrnosťou.
Porucha funkcie obličiekU pacientov s poruchou funkcie obličiek nie je potrebná úprava dávkovania (pozri časť 5.2).
Porucha funkcie pečeneU pacientov s miernou až stredne ťažkou poruchou funkcie pečene nie je potrebná úprava dávkovania. U pacientov s ťažkými základnými poruchami pečene nebola bezpečnosť a účinnosť raltegraviru stanovená. Preto sa má ISENTRESS u pacientov s ťažkou poruchou funkcie pečene používať
s opatrnosťou (pozri časti 4.4 a 5.2).
Pediatrická populáciaBezpečnosť a účinnosť raltegraviru u dojčiat mladších ako 4 týždne neboli doteraz stanovené. K dispozícii nie sú žiadne údaje.
Spôsob podávania
Perorálne použitie.
ISENTRESS granulát na perorálnu suspenziu sa môže podávať s jedlom alebo bez jedla (pozri časť
5.2).
Podrobné informácie týkajúce sa prípravy a podávania suspenzie, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
Všeobecné
Pacientov je potrebné informovať, že súčasná antiretrovírusová terapia nelieči infekciu HIV a nebolo
dokázané, že bráni prenosu HIV na iné osoby krvou. Hoci sa preukázalo, že účinná vírusová supresia dosiahnutá pri antiretrovírusovej terapii značne znižuje riziko prenosu HIV pohlavným stykom, reziduálne riziko nie je možné vylúčiť. Je potrebné prijať opatrenia na zabránenie prenosu HIV
v súlade s národnými odporúčaniami.
Raltegravir má pomerne nízku genetickú bariéru voči rezistencii. Preto sa má raltegravir vždy, keď je to možné, podávať s dvoma ďalšími účinnými ART, aby sa minimalizovala možnosť virologického zlyhania a vzniku rezistencie (pozri časť 5.1).
U predtým neliečených pacientov sú údaje z klinických štúdií o použití raltegraviru obmedzené na použitie v kombinácii s dvoma nukleotidovými inhibítormi reverznej transkriptázy (nucleotide reverse transcriptase inhibitors, NRTI) (emtricitabín a tenofovir-dizoproxilfumarát).
Depresia
Bola hlásená depresia vrátane samovražedných myšlienok a správania, najmä u pacientov s depresiou
alebo psychickým ochorením v anamnéze. U pacientov s depresiou alebo psychickým ochorením v anamnéze sa má postupovať s opatrnosťou.
Porucha funkcie pečene
Bezpečnosť a účinnosť raltegraviru nebola stanovená u pacientov s ťažkými základnými poruchami
pečene. Preto sa má raltegravir u pacientov s ťažkou poruchou funkcie pečene používať s opatrnosťou
(pozri časti 4.2 a 5.2).
Pacienti s už prítomným ochorením pečene vrátane chronickej hepatitídy majú počas kombinovanej antiretrovírusovej terapie zvýšenú frekvenciu abnormalít pečeňovej funkcie a majú byť monitorovaní podľa štandardnej praxe. Ak u takýchto pacientov existuje dôkaz zhoršenia ochorenia pečene, má sa zvážiť prerušenie alebo ukončenie liečby.
U pacientov s chronickou hepatitídou B alebo C liečených kombinovanou antiretrovírusovou terapiou je zvýšené riziko ťažkých a potenciálne fatálnych hepatálnych nežiaducich reakcií.
Osteonekróza
Aj keď sa etiológia považuje za mnohofaktorovú (vrátane používania kortikosteroidov, konzumácie
alkoholu, ťažkej imunosupresie, vyššieho indexu telesnej hmotnosti), boli hlásené prípady osteonekrózy, najmä u pacientov s pokročilým HIV ochorením a/alebo dlhodobou expozíciou
kombinovanej antiretrovírusovej terapii. Pacientom sa má odporučiť, aby vyhľadali lekársku pomoc, ak budú mať bolesť kĺbov, stuhnutosť kĺbov alebo ťažkosti s pohybom.
Syndróm imunitnej reaktivácie
U pacientov infikovaných HIV s ťažkou imunodeficienciou môže v čase nasadenia kombinovanej
antiretrovírusovej terapie (combination antiretroviral therapy, CART) vzniknúť zápalová reakcia na asymptomatické alebo reziduálne oportúnne patogény a spôsobiť závažné klinické stavy alebo
zhoršenie príznakov. Takéto reakcie sa typicky pozorovali počas prvých týždňov alebo mesiacov po nasadení CART. Relevantnými príkladmi sú cytomegalovírusová retinitída, generalizované a/alebo
fokálne mykobakteriálne infekcie a pneumónia spôsobená Pneumocystis jiroveci (predtým známa ako Pneumocystis carinii). Akékoľvek príznaky zápalu sa majú zhodnotiť a v prípade potreby sa má nasadiť liečba.
Boli zaznamenané aj autoimunitné poruchy (ako je Gravesova choroba) objavujúce sa v dôsledku imunitnej reaktivácie; avšak zaznamenaný čas do ich nástupu je rôznorodejší a tieto udalosti sa môžu vyskytnúť mnoho mesiacov po začatí liečby.
Antacidá
Súbežné podávanie raltegraviru s antacidami obsahujúcimi hliník a horčík viedlo k zníženým
plazmatickým hladinám raltegraviru. Súbežné podávanie raltegraviru s antacidami obsahujúcimi hliník a/alebo horčík sa neodporúča (pozri časť 4.5).
Rifampicín
Pri súbežnom podávaní raltegraviru so silnými induktormi uridíndifosfátglukuronozyltransferázy
(UGT) 1A1 (napr. rifampicín) je potrebná opatrnosť. Rifampicín znižuje plazmatické hladiny raltegraviru; vplyv na účinnosť raltegraviru nie je známy. Ak sa však nedá vyhnúť súbežnému podávaniu s rifampicínom, môže sa u dospelých zvážiť zdvojnásobenie dávky raltegraviru. Neexistujú údaje poskytujúce návod na súbežné podávanie raltegraviru s rifampicínom u pacientov mladších ako
18 rokov (pozri časť 4.5).
Myopatia a rabdomyolýza
Bola hlásená myopatia a rabdomyolýza. U pacientov, ktorí v minulosti mali myopatiu alebo
rabdomyolýzu alebo majú akékoľvek predurčujúce faktory vrátane iných liekov spojených s týmito stavmi, je potrebné používať s opatrnosťou (pozri časť 4.8).
Závažné kožné reakcie a reakcie z precitlivenosti
U pacientov užívajúcich raltegravir boli hlásené závažné, potenciálne život ohrozujúce a fatálne kožné
reakcie, vo väčšine prípadov súbežne s inými liekmi spojenými s týmito reakciami. Tieto reakcie zahŕňajú prípady Stevensovho-Johnsonovho syndrómu a toxickej epidermálnej nekrolýzy. Hlásené boli tiež reakcie z precitlivenosti a boli charakterizované vyrážkou, organickými nálezmi a niekedy poruchou funkcie orgánov vrátane zlyhania pečene. Ak sa objavia prejavy alebo príznaky závažných kožných reakcií alebo reakcií z precitlivenosti (zahŕňajúce avšak nie obmedzené na závažnú kožnú vyrážku alebo vyrážku sprevádzanú horúčkou, celkovú nevoľnosť, únavu, bolesť svalov a kĺbov, pľuzgiere, ranky v ústach, konjunktivitídu, opuch tváre, hepatitídu, eozinofíliu, angioedém), okamžite ukončite podávanie raltegraviru alebo iných podozrivých liekov. Má sa sledovať klinický stav vrátane pečeňových aminotransferáz a má sa začať s vhodnou liečbou. Oddialenie ukončenia liečby raltegravirom alebo inými podozrivými liečivami po objavení sa závažnej vyrážky môže viesť k život ohrozujúcej reakcii.
Vyrážka
U pacientov predtým liečených režimom obsahujúcim raltegravir a darunavir, sa častejšie vyskytla
vyrážka ako u pacientov dostávajúcich raltegravir bez darunaviru alebo darunavir bez raltegraviru
(pozri časť 4.8).
Fruktóza/sacharóza
ISENTRESS granulát na perorálnu suspenziu obsahuje fruktózu, sorbitol a sacharózu. Pacienti
so zriedkavými dedičnými problémami intolerancie fruktózy, glukózo-galaktózovej malabsorpcie alebo deficitu sacharázy a izomaltázy nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Štúdie in vitro ukazujú, že raltegravir nie je substrátom enzýmov cytochrómu P450 (CYP), neinhibuje CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 alebo CYP3A, neinhibuje UDP glukurónozyltransferázy (UGT) 1A1 a 2B7, neindukuje CYP3A4 a neinhibuje transport sprostredkovaný P-glykoproteínom. Na základe týchto údajov sa neočakáva, že raltegravir bude mať vplyv na farmakokinetiku liekov, ktoré sú substrátmi týchto enzýmov alebo P-glykoproteínu.
Na základe in vitro a in vivo štúdií je raltegravir eliminovaný najmä metabolizáciou cez glukuronidačnú dráhu sprostredkovanú UGT1A1.
Vo farmakokinetike raltegraviru sa pozorovala značná inter- a intraindividuálna variabilita. Vplyv raltegraviru na farmakokinetiku iných liečiv
V interakčných štúdiách nemal raltegravir klinicky významný vplyv na farmakokinetiku etravirínu,
maraviroku, tenofovir-dizoproxilfumarátu, hormonálnych kontraceptív, metadónu, midazolamu alebo bocepreviru.
V niektorých štúdiách viedlo súbežné podávanie raltegraviru s darunavirom k miernemu zníženiu plazmatických koncentrácií darunaviru; mechanizmus tohto účinku nie je známy. Vplyv raltegraviru na plazmatické koncentrácie darunaviru sa však nezdá byť klinicky významný.
Vplyv iných liečiv na farmakokinetiku raltegraviru
Vzhľadom na to, že sa raltegravir primárne metabolizuje UGT1A1, pri súbežnom podávaní
raltegraviru so silnými induktormi UGT1A1 (napr. rifampicínom) je potrebná opatrnosť. Rifampicín znižuje plazmatické hladiny raltegraviru; vplyv na účinnosť raltegraviru nie je známy. Ak sa však nedá
vyhnúť súbežnému podávaniu s rifampicínom, môže sa u dospelých zvážiť zdvojnásobenie dávky raltegraviru. Neexistujú údaje poskytujúce návod na súbežné podávanie raltegraviru s rifampicínom
u pacientov mladších ako 18 rokov (pozri časť 4.4). Vplyv iných silných induktorov enzýmov metabolizujúcich liečivá, ako je fenytoín a fenobarbital, na UGT1A1 nie je známy. Menej silné induktory (napr. efavirenz, nevirapín, etravirín, rifabutín, glukokortikoidy, ľubovník bodkovaný,
pioglitazón) sa môžu používať s odporúčanou dávkou raltegraviru.
Súbežné podávanie raltegraviru s liekmi, o ktorých sa vie, že sú silnými inhibítormi UGT1A1 (napr. atazanavir), môže zvýšiť plazmatické hladiny raltegraviru. Slabšie inhibítory UGT1A1 (napr. indinavir, sachinavir) môžu tiež zvýšiť plazmatické hladiny raltegraviru, ale v menšej miere ako atazanavir. Ďalej môže plazmatické hladiny raltegraviru zvýšiť tenofovir-dizoproxilfumarát, mechanizmus tohto účinku však nie je známy (pozri tabuľku 2). V klinických skúšaniach užívala veľká časť pacientov v rámci optimalizovaných základných režimov atazanavir a/alebo tenofovir- dizoproxilfumarát, liečivá, ktoré vedú k zvýšeniu plazmatických hladín raltegraviru. Bezpečnostný profil pozorovaný u pacientov užívajúcich atazanavir a/alebo tenofovir-dizoproxilfumarát bol vo všeobecnosti podobný bezpečnostnému profilu pacientov, ktorí neužívali tieto liečivá. Preto nie je potrebná úprava dávky.
Súbežné podávanie raltegraviru s antacidami obsahujúcimi dvojmocné katióny kovov môže cheláciou znížiť absorpciu raltegraviru, čo má za následok pokles plazmatických hladín raltegraviru. Užitie antacida obsahujúceho hliník alebo horčík do 6 hodín od podania raltegraviru výrazne znížilo plazmatické hladiny raltegraviru. Súbežné podávanie raltegraviru s antacidami obsahujúcimi hliník a/alebo horčík sa preto neodporúča. Súbežné podávanie raltegraviru s antacidami obsahujúcimi uhličitan vápenatý znižuje plazmatické hladiny raltegraviru; táto interakcia sa však nepovažuje za klinicky významnú. Preto, ak sa raltegravir súbežne podáva s antacidami obsahujúcimi uhličitan vápenatý, nie je potrebná úprava dávky.
Súbežné podávanie raltegraviru s inými liečivami, ktoré zvyšujú pH v žalúdku (napr. omeprazol
a famotidín), môže zvýšiť rýchlosť absorpcie raltegraviru a viesť k zvýšeným plazmatickým hladinám raltegraviru (pozri tabuľku 2). Bezpečnostné profily v podskupine pacientov v skúšaniach fázy III
užívajúcich inhibítory protónovej pumpy alebo blokátory H2-receptora boli porovnateľné
s bezpečnostnými profilmi u pacientov, ktorí tieto antacidá neužívali. Pri užívaní inhibítorov
protónovej pumpy alebo blokátorov H2-receptora sa preto nevyžaduje žiadna úprava dávky. Všetky interakčné štúdie sa vykonali u dospelých.
Tabuľka 2
Údaje o farmakokinetických interakciách
Liečivá podľa
terapeutickej oblasti
Interakcia
(mechanizmus, ak je známy)
Odporúčania týkajúce sa súbežného
podávania
ANTIRETROVIROTIKÁ
Inhibítory proteázy (PI)
atazanavir/ritonavir (raltegravir 400 mg dvakrát denne)
tipranavir/ritonavir (raltegravir 400 mg dvakrát denne)
AUC raltegraviru ↑ 41 % C12 h raltegraviru ↑ 77 % Cmax raltegraviru ↑ 24 %
(inhibícia UGT1A1) AUC raltegraviru ↓ 24 % C12 h raltegraviru ↓ 55 % Cmax raltegraviru ↓ 18 %
Nie je potrebná úprava dávky raltegraviru.
Nie je potrebná úprava dávky raltegraviru.
(indukcia UGT1A1)
Nenukleozidové inhibítory reverznej transkriptázy (NNRTI)
 e
f
avirenz
e
f
avirenz (raltegravir 400 mg jednotlivá dávka)
etravirín (raltegravir 400 mg dvakrát denne)
AUC raltegraviru ↓ 36 % C12 h raltegraviru ↓ 21 % Cmax raltegraviru ↓ 36 %
(indukcia UGT1A1)
AUC raltegraviru ↓ 10 % C12 h raltegraviru ↓ 34 % Cmax raltegraviru ↓ 11 %
(indukcia UGT1A1) AUC etravirínu ↑ 10 %
C12 h etravirínu ↑ 17 %
Cmax etravirínu ↑ 4 %
Nie je potrebná úprava dávky raltegraviru.
Nie je potrebná úprava dávky raltegraviru ani etravirínu.
Liečivá podľa terapeutickej oblasti
Interakcia
(mechanizmus, ak je známy)
Odporúčania týkajúce sa súbežného podávania
Nukleozidové/nukleotidové inhibítory reverznej transkriptázy
t
enofovir- dizoproxilfumarát (raltegravir 400 mg dvakrát denne)
Inhibítory CCR5 maravirok (raltegravir 400 mg dvakrát denne)
HCV ANTIVIROTIKÁ
AUC raltegraviru ↑ 49 % C12 h raltegraviru ↑ 3 % Cmax raltegraviru ↑ 64 %
(mechanizmus interakcie neznámy)
AUC tenofoviru ↓ 10 % C24 h tenofoviru ↓ 13 % Cmax tenofoviru ↓ 23 %
AUC raltegraviru ↓ 37 % C12 h raltegraviru ↓ 28 % Cmax raltegraviru ↓ 33 %
(mechanizmus interakcie neznámy)
AUC maraviroku ↓ 14 % C12 h maraviroku ↓ 10 % Cmax maraviroku ↓ 21 %
Nie je potrebná úprava dávky raltegraviru ani tenofovir-dizoproxilfumarátu.
Nie je potrebná úprava dávky raltegraviru ani maraviroku.
Inhibítory proteázy NS3/4A (PI)
boceprevir (raltegravir 400 mg jednotlivá dávka)
AUC raltegraviru ↑ 4 % C12 h raltegraviru ↓ 25 % Cmax raltegraviru ↑ 11 %
Nie je potrebná úprava dávky raltegraviru ani bocepreviru.
(mechanizmus interakcie
neznámy)
ANTIMIKROBIÁLNE LIEČIVÁ
Antimykobakteriálne liečivá
 rifampicín
rifampicín (raltegravir 400 mg jednotlivá dávka)
SEDATÍVA midazolam (raltegravir 400 mg dvakrát denne)
AUC raltegraviru ↓ 40 % C12 h raltegraviru ↓ 61 % Cmax raltegraviru ↓ 38 %
(indukcia UGT1A1) AUC midazolamu ↓ 8 %
Cmax midazolamu ↑ 3 %
Rifampicín znižuje plazmatické hladiny raltegraviru. Ak sa nedá vyhnúť súbežnému podávaniu s rifampicínom, môže sa zvážiť zdvojnásobenie dávky raltegraviru (pozri časť 4.4).
Nie je potrebná úprava dávky raltegraviru ani midazolamu.
Tieto výsledky ukazujú, že raltegravir nie je induktor ani inhibítor CYP3A4, a preto sa pri raltegravire nepredpokladá, že ovplyvní farmakokinetiku liekov, ktoré sú substrátmi CYP3A4.
Liečivá podľa terapeutickej oblasti
Interakcia
(mechanizmus, ak je známy)
Odporúčania týkajúce sa súbežného podávania
ANTACIDÁ OBSAHUJÚCE KATIÓN KOVOV
antacidum obsahujúce hliník
a hydroxid horečnatý
(raltegravir 400 mg
dvakrát denne)
antacidum obsahujúce uhličitan vápenatý
(raltegravir 400 mg
dvakrát denne)
AUC raltegraviru ↓ 49 % C12 h raltegraviru ↓ 63 % Cmax raltegraviru ↓ 44 %
2 hodiny pred podanímraltegraviru
AUC raltegraviru ↓ 51 % C12 h raltegraviru ↓ 56 % Cmax raltegraviru ↓ 51 %
2 hodiny po podaníraltegraviru
AUC raltegraviru ↓ 30 %
C12 h raltegraviru ↓ 57 % Cmax raltegraviru ↓ 24 %
6 hodín pred podanímraltegraviru
AUC raltegraviru ↓ 13 % C12 h raltegraviru ↓ 50 % Cmax raltegraviru ↓ 10 %
6 hodín po podaníraltegraviru
AUC raltegraviru ↓ 11 % C12 h raltegraviru ↓ 49 % Cmax raltegraviru ↓ 10 %
(chelácia katiónov kovov) AUC raltegraviru ↓ 55 % C12 h raltegraviru ↓ 32 % Cmax raltegraviru ↓ 52 %
(chelácia katiónov kovov)
Antacidá obsahujúce hliník a horčík znižujú plazmatické hladiny raltegraviru. Súbežné podávanie raltegraviru
s antacidami obsahujúcimi hliník a/alebo horčík sa neodporúča.
Nie je potrebná úprava dávky raltegraviru.
BLOKÁTOR
Y H
2
-
RECEPTOR
A A INHIBÍTORY PROTÓNOVEJ PUMPY
omeprazol
(raltegravir 400 mg dvakrát denne)
famotidín (raltegravir 400 mg dvakrát denne)
AUC raltegraviru ↑ 37 %
C12 h raltegraviru ↑ 24 % Cmax raltegraviru ↑ 51 %
(zvýšená rozpustnosť) AUC raltegraviru ↑ 44 % C12 h raltegraviru ↑ 6 % Cmax raltegraviru ↑ 60 %
Nie je potrebná úprava dávky raltegraviru.
Nie je potrebná úprava dávky raltegraviru.
(zvýšená rozpustnosť)
HORMONÁLNE KONTRACEPTÍVA
 etinylestradiol norelgestromín
etinylestradiol norelgestromín (raltegravir 400 mg dvakrát denne)
AUC etinylestradiolu ↓ 2 % Cmax etinylestradiolu ↑ 6 % AUC norelgestromínu
↑ 14 %
Cmax norelgestromínu
↑ 29 %
Nie je potrebná úprava dávkovania raltegraviru ani hormonálnych kontraceptív (na báze estrogénu a/alebo progesterónu).
Liečivá podľa terapeutickej oblasti
Interakcia
(mechanizmus, ak je známy)
Odporúčania týkajúce sa súbežného podávania
OPIOIDNÉ ANALGETIKÁ
metadón (raltegravir 400 mg dvakrát denne)
AUC metadónu ↔ Cmax metadónu ↔
Nie je potrebná úprava dávky raltegraviru ani metadónu.
 4.6 Fertilita, gravidita a laktácia
Gravidita
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii údaje o použití raltegraviru u gravidných žien. Štúdie na zvieratách preukázali
reprodukčnú toxicitu (pozri časť 5.3). Potenciálne riziko pre ľudí nie je známe. Raltegravir sa neodporúča počas gravidity.
Register gravidít s antiretrovírusovou liečbouAby bolo možné monitorovať účinky na matku-plod u pacientok, u ktorých došlo k neúmyselnému podaniu raltegraviru počas gravidity, bol založený Register gravidít s antiretrovírusovou liečbou. Lekári sú nabádaní registrovať pacientky v tomto registri.
Ako všeobecné pravidlo pri rozhodovaní o použití antiretrovírusových liečiv na liečbu infekcie HIV
u gravidných žien a následne na zníženie rizika vertikálneho prenosu HIV na novorodenca sa majú na stanovenie bezpečnosti pre plod vziať do úvahy údaje u zvierat, ako aj klinická skúsenosť
u gravidných žien.
DojčenieNie je známe, či sa raltegravir/metabolity vylučujú do ľudského mlieka. Dostupné
farmakodynamické/toxikologické údaje u zvierat preukázali vylučovanie raltegraviru/metabolitov do mlieka (podrobné informácie, pozri časť 5.3).
Riziko pre novorodencov/dojčatá nie je možné vylúčiť.
Raltegravir sa nemá používať počas dojčenia. Ako všeobecné pravidlo sa odporúča, aby matky infikované HIV svoje deti nedojčili, aby sa vyhli prenosu HIV.
FertilitaPri dávkach do 600 mg/kg/deň, ktoré viedli k 3-násobne vyššej expozícii, ako je expozícia pri
odporúčaných dávkach pre ľudí, sa u samcov a samíc potkana nepozoroval žiadny účinok na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeU niektorých pacientov sa počas liečby režimami obsahujúcimi raltegravir hlásil závrat. Závrat môže ovplyvniť schopnosť niektorých pacientov viesť vozidlá a obsluhovať stroje (pozri časť 4.8).
4.8 Nežiaduce účinkySúhrn bezpečnostného profiluBezpečnostný profil raltegraviru v dávke 400 mg dvakrát denne bol založený na zlúčených údajoch
o bezpečnosti z dvoch klinických štúdií fázy III u dospelých pacientov, ktorí už mali skúsenosť
s liečbou, a jednej klinickej štúdie fázy III u predtým neliečených dospelých pacientov. Počas dvojito zaslepenej liečby bol celkový čas sledovania u pacientov, ktorí už mali skúsenosť s liečbou, 708
pacientorokov v skupine užívajúcej raltegravir 400 mg dvakrát denne a 244 pacientorokov v skupine
užívajúcej placebo; a u predtým neliečených pacientov bol celkový čas sledovania 1 104
pacientorokov v skupine užívajúcej raltegravir 400 mg dvakrát denne a 1 036 pacientorokov v skupine
užívajúcej efavirenz 600 mg večer pred spaním. Počas liečby boli najčastejšie hlásenými nežiaducimi reakciami bolesť hlavy a nauzea, vyskytujúce sa u 5 % alebo viacerých pacientov. Najčastejšie hlásenou závažnou nežiaducou reakciou bol syndróm imunitnej reaktivácie.
V zlúčenej analýze pacientov, ktorí už mali skúsenosť s liečbou, sa vyskytlo prerušenie terapie
z dôvodu nežiaducich reakcií u 3,9 % pacientov užívajúcich raltegravir + OBT a u 4,6 % pacientov užívajúcich placebo + OBT. Prerušenie terapie z dôvodu nežiaducich reakcií u predtým neliečených pacientov sa vyskytlo u 5,0 % pacientov užívajúcich raltegravir + emtricitabín (+) tenofovir- dizoproxilfumarát a u 10,0 % pacientov užívajúcich efavirenz + emtricitabín (+) tenofovir- dizoproxilfumarát.
Tabuľkový súhrn nežiaducich reakcií
Nežiaduce reakcie, ktoré považoval skúšajúci za kauzálne súvisiace s raltegravirom (samotným alebo
v kombinácii s inou ART) ako aj nežiaduce reakcie stanovené pri sledovaní lieku po uvedení na trh, sú uvedené nižšie podľa tried orgánových systémov. Frekvencie výskytu sú definované ako časté
(≥ 1/100 až < 1/10), menej časté (≥ 1/1 000 až < 1/100) a neznáme (z dostupných údajov).
Trieda
orgánových systémov
Frekvencia Nežiaduce reakcie
Raltegravir (samotný alebo v kombinácii s inou ART)
Infekcie a nákazy Menej časté genitálny herpes, folikulitída, gastroenteritída, herpes simplex, infekcia herpes vírusom, herpes zoster, chrípka, absces lymfatickej uzliny, molluscum contagiosum, nazofaryngitída, infekcia horných dýchacích ciest
Benígne a malígne nádory vrátane nešpecifikovaných novotvarov (cysty a polypy)
Poruchy krvi
a lymfatického systému Poruchy imunitného systému Poruchy metabolizmu
a výživy
Menej časté kožný papilóm
Menej časté anémia, anémia z nedostatku železa, bolesť lymfatickej uzliny, lymfadenopatia, neutropénia, trombocytopénia
Menej časté syndróm imunitnej reaktivácie, precitlivenosť na liečivo, precitlivenosť
Časté znížená chuť do jedla
Menej časté kachexia, diabetes mellitus, dyslipidémia, hypercholesterolémia, hyperglykémia, hyperlipidémia, hyperfágia, zvýšená chuť do jedla, polydipsia, porucha telesného tuku
Psychické poruchy Časté neobvyklé sny, insomnia, nočná mora, abnormálne správanie, depresia
Menej časté mentálna porucha, pokus o suicídium, anxieta, stav zmätenosti, depresívna nálada, veľká depresia, stredná insomnia, zmena nálady, záchvat paniky, porucha spánku, suicidálne myšlienky, suicidálne správanie (obzvlášť u pacientov s psychickým ochorením v anamnéze)
Poruchy nervového systému
Časté závrat, bolesť hlavy, psychomotorická hyperaktivita
Menej časté amnézia, syndróm karpálneho tunela, kognitívna porucha, porucha pozornosti, posturálny závrat, porucha chuti, hypersomnia, hypestézia, letargia, porucha pamäti, migréna, periférna neuropatia, parestézia, somnolencia, tenzná bolesť hlavy, tras, slabá kvalita spánku
Poruchy oka Menej časté porucha zraku
Trieda orgánových systémov
Poruchy ucha a labyrintu
Poruchy srdca
a srdcovej činnosti
Frekvencia Nežiaduce reakcie
Raltegravir (samotný alebo v kombinácii s inou ART)
Časté vertigo
Menej časté tinitus
Menej časté palpitácie, sinusová bradykardia, ventrikulárne extrasystoly
Poruchy ciev Menej časté nával tepla, hypertenzia
Poruchy dýchacej sústavy, hrudníka a mediastína Poruchy
gastrointestinálneho traktu
Poruchy pečene a žlčových ciest Poruchy kože
a podkožného
tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest Poruchy reprodukčného systému a prsníkov Celkové poruchy
a reakcie v mieste
podania
Menej časté dysfónia, epistaxa, nazálna kongescia
Časté abdominálna distenzia, bolesť brucha, hnačka, flatulencia, nauzea, vracanie, dyspepsia
Menej časté gastritída, abdominálny diskomfort, bolesť v hornej časti brucha, citlivosť v oblasti brucha, anorektálny diskomfort, zápcha, sucho v ústach, diskomfort v epigastriu, erozívna duodenitída, eruktácia, gastroezofágová refluxová choroba, gingivitída, glositída, odynofágia, akútna pankreatitída, peptický vred, krvácanie z rekta
Menej časté hepatitída, hepatálna steatóza, alkoholická hepatitída, zlyhanie pečene
Časté vyrážka
Menej časté akné, alopécia, akneiformná dermatitída, suchá koža, erytém, ochabnutie tváre, hyperhidróza, lipoatrofia, získaná lipodystrofia, lipohypertrofia, nočné potenie, prurigo, pruritus, generalizovaný pruritus, makulárna vyrážka, makulopapulárna vyrážka, pruritická vyrážka, kožná lézia, urtikária, xeroderma, Stevensov-Johnsonov syndróm, liekový exantém s eozinofíliou a systémovými príznakmi (DRESS)
Menej časté artralgia, artritída, bolesť chrbta, bolesť v boku, muskuloskeletálna bolesť, myalgia, bolesť krku, osteopénia, bolesť v končatine, tendonitída, rabdomyolýza
Menej časté zlyhanie obličiek, nefritída, nefrolitiáza, noktúria, renálna cysta, porucha funkcie obličiek, tubulointersticiálna nefritída
Menej časté erektilná dysfunkcia, gynekomastia, príznaky menopauzy
Časté asténia, únava, pyrexia
Menej časté diskomfort v hrudníku, triaška, opuch tváre, zväčšenie tukového tkaniva, pocit nervozity, nevoľnosť, submandibulárna masa, periférny edém, bolesť
Trieda orgánových systémov
Laboratórne a funkčné vyšetrenia
Frekvencia Nežiaduce reakcie
Raltegravir (samotný alebo v kombinácii s inou ART)
Časté zvýšenie alanínaminotransferázy, atypické lymfocyty, zvýšenie aspartátaminotransferázy, zvýšenie triglyceridov v krvi, zvýšenie lipázy, zvýšená hladina pankreatickej amylázy v krvi
Úrazy, otravy a komplikácie liečebného postupu
Menej časté zníženie absolútneho počtu neutrofilov, zvýšenie alkalickej
fosfatázy, zníženie albumínu v krvi, zvýšenie amylázy v krvi, zvýšenie bilirubínu v krvi, zvýšenie cholesterolu v krvi, zvýšenie kreatinínu v krvi, zvýšenie glukózy v krvi, zvýšenie močovinového dusíka v krvi, zvýšenie kreatínfosfokinázy, zvýšenie krvnej glukózy nalačno, prítomnosť glukózy v moči, zvýšenie vysokodenzitného lipoproteínu, zvýšenie medzinárodného normalizovaného pomeru, zvýšenie nízkodenzitného lipoproteínu, zníženie počtu trombocytov, prítomnosť erytrocytov v moči, zväčšenie obvodu pása, zvýšenie hmotnosti, zníženie počtu leukocytov
Menej časté náhodné predávkovanie
 Popis vybraných nežiaducich reakcií
Popis vybraných nežiaducich reakcií
U pacientov, ktorí už mali skúsenosť s liečbou, aj u predtým neliečených pacientov, a ktorým bol
nasadený raltegravir spolu s inými antiretrovírusovými liečivami, bola hlásená rakovina. Jednalo sa
o špecifické typy a výskyty rakoviny, aké sa očakávajú u vysoko imunodeficientnej populácie. Riziko vzniku rakoviny bolo v týchto štúdiách podobné v skupinách dostávajúcich raltegravir a v skupinách
dostávajúcich porovnávané liečivá.
U osôb liečených raltegravirom sa pozorovali abnormálne laboratórne hodnoty kreatínkinázy stupňa 2-
4. Bola hlásená myopatia a rabdomyolýza. U pacientov, ktorí v minulosti mali myopatiu alebo rabdomyolýzu alebo majú akékoľvek predurčujúce faktory vrátane iných liekov spojených s týmito stavmi, je potrebné používať s opatrnosťou (pozri časť 4.4).
Boli hlásené prípady osteonekrózy, najmä u pacientov so všeobecne uznávanými rizikovými faktormi, pokročilým HIV ochorením alebo dlhodobou expozíciou kombinovanej antiretrovírusovej terapii (CART). Frekvencia osteonekrózy nie je známa (pozri časť 4.4).
U pacientov infikovaných HIV s ťažkou imunodeficienciou môže v čase nasadenia kombinovanej antiretrovírusovej terapie (CART) vzniknúť zápalová reakcia na asymptomatické alebo reziduálne oportúnne infekcie. Boli zaznamenané aj autoimunitné poruchy (ako je Gravesova choroba); avšak zaznamenaný čas do ich nástupu je rôznorodejší a tieto udalosti sa môžu vyskytnúť mnoho mesiacov po začatí liečby (pozri časť 4.4).
Pri každej z nasledovných klinických nežiaducich reakcií sa objavil minimálne jeden závažný výskyt:
genitálny herpes, anémia, syndróm imunitnej reaktivácie, depresia, mentálna porucha, pokus o suicídium, gastritída, hepatitída, zlyhanie obličiek, náhodné predávkovanie.
V klinických štúdiách pacientov, ktorí už mali skúsenosť s liečbou, sa v režimoch obsahujúcich raltegravir a darunavir v porovnaní s režimami obsahujúcimi raltegravir bez darunaviru alebo darunavir bez raltegraviru častejšie pozorovala vyrážka, bez ohľadu na príčinu jej vzniku. Vyrážka,
ktorá sa podľa názoru skúšajúceho považovala za súvisiacu s liekom, sa objavila v podobných mierach výskytu. Miery výskytu vyrážky upravené na expozíciu (všetky príčiny) boli 10,9 pri raltegravire +
darunavire, 4,2 pri raltegravire bez darunaviru a 3,8 pri darunavire bez raltegraviru na 100
pacientorokov (PYR) a miery výskytu vyrážky súvisiacej s liekom boli 2,4 pri raltegravire +
darunavire, 1,1 pri raltegravire bez darunaviru a 2,3 pri darunavire bez raltegraviru na 100 PYR.
Vyrážky pozorované v klinických štúdiách boli mierne až stredne závažné a neviedli k vysadeniu liečby (pozri časť 4.4).
Pacienti súbežne infikovaní vírusom hepatitídy B a/alebo hepatitídy CPacientom, ktorí už mali skúsenosť s liečbou (N=114/699 alebo 16 %; HBV=6 %, HCV=9 %, HBV+HCV=1 %), aj predtým neliečeným pacientom (N=34/563 alebo 6 %; HBV=4 %, HCV=2 %,
HBV+HCV=0,2 %), a ktorí mali chronickú (ale nie akútnu) aktívnu koinfekciu hepatitídou B a/alebo
hepatitídou C, bolo povolené zaradiť sa do štúdií fázy III za predpokladu, že testy východiskovej funkcie pečene neprekročili 5-násobok hornej hranice normálneho rozpätia. Vo všeobecnosti bol
bezpečnostný profil raltegraviru u pacientov súbežne infikovaných vírusom hepatitídy B a/alebo
hepatitídy C podobný profilu u pacientov bez koinfekcie vírusom hepatitídy B a/alebo hepatitídy C, hoci miery abnormalít AST a ALT boli v oboch liečebných skupinách o niečo vyššie v podskupine
s koinfekciou vírusom hepatitídy B a/alebo hepatitídy C. U pacientov, ktorí už mali skúsenosť
s liečbou, sa abnormálne laboratórne hodnoty stupňa 2 alebo vyššieho, čo vyjadruje stupeň zhoršenia oproti východiskovým hodnotám AST, ALT alebo celkového bilirubínu, vyskytli v 96. týždni u 29 %,
34 %, resp. 13 % súbežne infikovaných pacientov liečených raltegravirom, oproti 11 %, 10 %, resp.
9 % všetkých ostatných pacientov liečených raltegravirom. U predtým neliečených pacientov sa abnormálne laboratórne hodnoty stupňa 2 alebo vyššieho, čo vyjadruje stupeň zhoršenia oproti
východiskovým hodnotám AST, ALT alebo celkového bilirubínu, vyskytli v 240. týždni u 22 %,
44 %, resp. 17 % súbežne infikovaných pacientov liečených raltegravirom, oproti 13 %, 13 %, resp.
5 % všetkých ostatných pacientov liečených raltegravirom.
Pediatrická populáciaDeti a dospievajúci vo veku od 2 do 18 rokovRaltegravir sa skúmal u 126 detí a dospievajúcich infikovaných HIV-1 vo veku od 2 do 18 rokov so skúsenosťou s antiretrovírusovou liečbou v kombinácii s inými antiretrovírusovými liečivami v štúdii
IMPAACT P1066 (pozri časti 5.1 a 5.2). 96 zo 126 pacientov dostávalo odporúčanú dávku
raltegraviru.
U týchto 96 detí a dospievajúcich boli frekvencia, typ a závažnosť nežiaducich reakcií súvisiacich s liekom do 48. týždňa porovnateľné s nežiaducimi reakciami, ktoré sa pozorovali u dospelých.
U jedného pacienta sa vyskytli klinické nežiaduce reakcie psychomotorickej hyperaktivity 3. stupňa, abnormálne správanie a insomnia, ktoré súviseli s liekom; u jedného pacienta sa objavila závažná alergická vyrážka 2. stupňa súvisiaca s liekom.
U jedného pacienta sa objavili laboratórne abnormality, hladiny AST 4. stupňa a hladiny ALT 3. stupňa, ktoré súviseli s liekom a ktoré sa považovali za závažné.
Dojčatá a batoľatá vo veku 4 týždne do menej ako 2 rokyRaltegravir sa tiež skúmal u 26 dojčiat a batoliat infikovaných HIV-1 vo veku 4 týždne do menej ako 2
roky v kombinácii s inými antiretrovírusovými liečivami v štúdii IMPAACT P1066 (pozri časti 5.1
a 5.2).
U týchto 26 dojčiat a batoliat boli frekvencia, typ a závažnosť nežiaducich reakcií súvisiacich s liekom do 48. týždňa porovnateľné s nežiaducimi reakciami, ktoré sa pozorovali u dospelých.
U jedného pacienta sa vyskytla závažná alergická vyrážka 3. stupňa súvisiaca s liekom, ktorá viedla k ukončeniu liečby.
Hlásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
O liečbe predávkovania raltegravirom nie sú k dispozícii žiadne špecifické informácie.
V prípade predávkovania sa odporúča vykonať štandardné podporné opatrenia, napr. odstrániť neabsorbovaný materiál z gastrointestinálneho traktu, zaviesť klinické monitorovanie (vrátane vyhotovenia elektrokardiogramu) a ak je to potrebné, nasadiť podpornú liečbu. Treba vziať do úvahy, že raltegravir je na klinické použitie vo forme draselnej soli. Nie je známe, do akej miery je raltegravir dialyzovateľný.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antivirotiká na systémové použitie, iné antivirotiká, ATC kód: J05AX08
Mechanizmus účinku
Raltegravir je inhibítor prenosu reťazcov integrázou účinný proti vírusu ľudskej imunodeficiencie
(HIV-1). Raltegravir inhibuje katalytickú aktivitu integrázy, enzýmu kódovaného HIV, ktorý je potrebný na vírusovú replikáciu. Inhibícia integrázy zabraňuje kovalentnému vloženiu alebo integrácii
genómu HIV do genómu hostiteľskej bunky. Genómy HIV, ktoré sa nedokážu včleniť, nemôžu riadiť tvorbu nových infekčných vírusových častíc, takže inhibícia integrácie zabraňuje šíreniu vírusovej
infekcie.
Antivírusová aktivita in vitro
Raltegravir v koncentráciách 31 ± 20 nmol/l viedol k 95 % inhibícii (IC95) replikácie HIV-1
(v porovnaní s neliečenou kultúrou infikovanou vírusom) v ľudských T-lymfoidných bunkových
kultúrach infikovaných na bunkovú líniu adaptovaným HIV-1 variantom H9IIIB. Okrem toho raltegravir inhiboval vírusovú replikáciu v kultúrach mitogénom aktivovaných ľudských
mononukleárov z periférnej krvi infikovaných rôznymi primárnymi klinickými izolátmi HIV-1 vrátane izolátov z 5 podtypov non-B a izolátov rezistentných voči inhibítorom reverznej transkriptázy
a inhibítorom proteázy. V teste s jedným cyklom infekcie raltegravir inhiboval infekciu 23 izolátmi HIV reprezentujúcimi 5 podtypov non-B a 5 cirkulujúcich rekombinantných foriem s hodnotami IC50 v rozsahu od 5 do 12 nmol/l.
Rezistencia
Väčšina vírusov izolovaných od pacientov, u ktorých raltegravir zlyhal, mala vysokú úroveň
rezistencie voči raltegraviru vyplývajúcu z prítomnosti dvoch alebo viacerých mutácií. Väčšina mala charakteristickú mutáciu 155. aminokyseliny (N155 zamenená za H), 148. aminokyseliny (Q148 zamenená za H, K alebo R) alebo 143. aminokyseliny (Y143 zamenená za H, C alebo R), popri jednej alebo viacerých ďalších mutáciách integrázy (napr. L74M, E92Q, T97A, E138A/K, G140A/S, V151I, G163R, S230R). Charakteristické mutácie znižovali citlivosť vírusu voči raltegraviru a prítomnosť ďalších mutácií mala za následok ďalší pokles citlivosti voči raltegraviru. Faktory, ktoré znižovali pravdepodobnosť vzniku rezistencie, zahŕňali nižšiu základnú vírusovú záťaž a použitie iných účinných antiretrovírusových liečiv. Mutácie spôsobujúce rezistenciu na raltegravir vo všeobecnosti spôsobujú aj rezistenciu na elvitegravir, inhibítor prenosu reťazcov integrázou. Mutácie 143. aminokyseliny spôsobujú väčšiu rezistenciu na raltegravir ako na elvitegravir a mutácia E92Q spôsobuje väčšiu rezistenciu na elvitegravir ako na raltegravir. Pri vírusoch s mutáciou 148. aminokyseliny spolu s jednou alebo viacerými inými mutáciami rezistencie na raltegravir sa môže vyskytovať aj klinicky významná rezistencia na dolutegravir.
Klinická skúsenosť
Dôkaz účinnosti raltegraviru bol založený na analýzach 96-týždňových údajov z dvoch
randomizovaných, dvojito zaslepených, placebom kontrolovaných skúšaní (BENCHMRK 1
a BENCHMRK 2, Protokoly 018 a 019) u dospelých pacientov infikovaných HIV-1, ktorí už mali skúsenosť s antiretrovírusovou liečbou a na analýze 240-týždňových údajov z randomizovaného,
dvojito zaslepeného, aktívnym komparátorom kontrolovaného skúšania (STARTMRK, Protokol 021)
u dospelých pacientov infikovaných HIV-1 predtým neliečených antiretrovírusovou liečbou.
Účinnosť
Dospelí pacienti, ktorí už mali skúsenosť s liečbou
BENCHMRK 1 a BENCHMRK 2 (multicentrické randomizované dvojito zaslepené placebom kontrolované skúšania) hodnotili bezpečnosť a antiretrovírusovú aktivitu raltegraviru 400 mg dvakrát
denne oproti placebu v kombinácii s optimalizovanou základnou terapiou (optimised background
therapy, OBT) u pacientov infikovaných HIV vo veku 16 rokov a starších s dokumentovanou rezistenciou na minimálne jeden liek v každej z 3 tried (NRTI, NNRTI, PI) antiretrovírusovej terapie. Pred randomizáciou zvolil skúšajúci OBT na základe pacientovej doterajšej liečebnej anamnézy, ako aj na základe východiskového testovania genotypovej a fenotypovej vírusovej rezistencie.
Demografia (pohlavie, vek a rasa) a východiskové charakteristiky pacientov boli medzi skupinami dostávajúcimi raltegravir 400 mg dvakrát denne a placebo porovnateľné. Pacienti boli v minulosti vystavení mediánu 12 antiretrovirotík počas mediánu 10 rokov. V rámci OBT sa použil medián 4
ART.
Výsledky 48-týždňových a 96-týždňových analýz
Stále výsledky (48. týždeň a 96. týždeň) u pacientov s odporúčanou dávkou raltegraviru 400 mg dvakrát denne zo zlúčených štúdií BENCHMRK 1 a BENCHMRK 2 sú znázornené v tabuľke 3.
Tabuľka 3
Výsledky účinnosti v 48. a 96. týždni
BENCHMRK 1 a 2 zlúčené
48. týždeň 96. týždeň
Parameter
Percento HIV-RNA <400 kópií/ml (95 % IS)
Raltegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)
Raltegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)




Všetci pacienti† 72 (68, 76) 37 (31, 44) 62 (57, 66) 28 (23, 34) Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 62 (53, 69) 17 (9, 27) 53 (45, 61) 15 (8, 25)
≤100 000 kópií/ml 82 (77, 86) 49 (41, 58) 74 (69, 79) 39 (31, 47) Počet CD4 ≤50 buniek/mm3 61 (53, 69) 21 (13, 32) 51 (42, 60) 14 (7, 24)
>50 a ≤200 buniek/mm3 80 (73, 85) 44 (33, 55) 70 (62, 77) 36 (25, 48)
>200 buniek/mm3 83 (76, 89) 51 (39, 63) 78 (70, 85) 42 (30, 55) Skóre citlivosti (GSS)§
0 52 (42, 61) 8 (3, 17) 46 (36, 56) 5 (1, 13)
1 81 (75, 87) 40 (30, 51) 76 (69, 83) 31 (22, 42)
2 a vyššie 84 (77, 89) 65 (52, 76) 71 (63, 78) 56 (43, 69)
BENCHMRK 1 a 2 zlúčené
48. týždeň 96. týždeň
Parameter
Percento HIV-RNA <50 kópií/ml (95 % IS)
Raltegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)
Raltegravir
400 mg dvakrát
denne + OBT (N=462)
Placebo + OBT (N=237)
Všetci pacienti† 62 (57, 67) 33 (27, 39) 57 (52, 62) 26 (21, 32) Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 48 (40, 56) 16 (8, 26) 47 (39, 55) 13 (7, 23)
≤100 000 kópií/ml 73 (68, 78) 43 (35, 52) 70 (64, 75) 36 (28, 45) Počet CD4 ≤50 buniek/mm3 50 (41, 58) 20 (12, 31) 50 (41, 58) 13 (6, 22)
>50 a ≤200 buniek/mm3 67 (59, 74) 39 (28, 50) 65 (57, 72) 32 (22, 44)
>200 buniek/mm3 76 (68, 83) 44 (32, 56) 71 (62, 78) 41 (29, 53) Skóre citlivosti (GSS)§
0 45 (35, 54) 3 (0, 11) 41 (32, 51) 5 (1, 13)
1 67 (59, 74) 37 (27, 48) 72 (64, 79) 28 (19, 39)
2 a vyššie 75 (68, 82) 59 (46, 71) 65 (56, 72) 53 (40, 66)
Priemerná zmena počtu CD4 buniek (95 % IS), bunky/mm3
Všetci pacienti‡ 109 (98,
121)
45 (32, 57) 123 (110,
137)
49 (35, 63)
Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 126 (107,
144)
≤100 000 kópií/ml 100 (86,
115) Počet CD4 ≤50 buniek/mm3 121 (100,
142)
>50 a ≤200 buniek/mm3 104 (88,
119)
>200 buniek/mm3 104 (80,
129)
36 (17, 55) 140 (115,
165)
49 (33, 65) 114 (98,
131)
33 (18, 48) 130 (104,
156)
47 (28, 66) 123 (103,
144)
54 (24, 84) 117 (90,
143)
40 (16, 65)
53 (36, 70)
42 (17, 67)
56 (34, 79)
48 (23, 73)
Skóre citlivosti (GSS)§
0 81 (55, 106) 11 (4, 26) 97 (70, 124) 15 (-0, 31)
1 113 (96,
130)
2 a vyššie 125 (105,
144)
44 (24, 63) 132 (111,
154)
76 (48, 103) 134 (108,
159)
45 (24, 66)
90 (57, 123)






† Pacient, ktorý nedokončil štúdiu, sa posudzuje ako zlyhanie: pacienti, ktorí predčasne prerušili, sú následne pokladaní za neúspešných.
Hlásené je percento pacientov s odpoveďou a príslušný 95 % interval spoľahlivosti (IS).
‡ Na analýzu podľa prognostických faktorov sa pre percentá <400 a 50 kópií/ml virologické zlyhania prenášali (carried forward). Pre priemerné zmeny počtu CD4 sa na virologické zlyhania použila metóda prenosu východiskovej hodnoty (baseline-carry-forward).
§ Skóre genotypovej citlivosti (GSS) bolo definované ako súčet perorálnych ART v optimalizovanej základnej terapii (OBT), na ktoré vírusový izolát pacienta vykazoval genotypovú citlivosť na základe testu genotypovej rezistencie. Použitie enfuvirtidu v OBT u pacientov, ktorí nemali predchádzajúcu skúsenosť s enfuvirtidom, sa počítalo ako jeden účinný liek v OBT. Podobne sa použitie darunaviru v OBT
u pacientov doposiaľ neliečených darunavirom počítalo ako jeden účinný liek v OBT.
Raltegravir dosiahol virologické odpovede (pri použití prístupu: pacient, ktorý nedokončil=zlyhanie)
HIV RNA <50 kópií/ml v 16. týždni u 61,7 % pacientov, v 48. týždni u 62,1 % pacientov a v 96. týždni u 57,0 %. U niektorých pacientov došlo medzi 16. a 96. týždňom k opätovnému vírusovému
nárastu. Faktory spojené so zlyhaním zahŕňajú vysokú počiatočnú vírusovú záťaž a OBT, ktorá
nezahŕňala minimálne jedno účinné liečivo.
Prechod na raltegravirŠtúdie SWITCHMRK 1 a 2 (Protokoly 032 a 033) hodnotili pacientov infikovaných HIV, ktorí dostávali supresívnu (skríning HIV RNA <50 kópií/ml; stabilný režim >3 mesiace) terapiu
s lopinavirom 200 mg (+) ritonavirom 50 mg 2 tablety dvakrát denne plus najmenej 2 nukleozidové
inhibítory reverznej transkriptázy, a randomizovali ich v pomere 1:1 tak, aby pokračovali v užívaní lopinaviru (+) ritonaviru 2 tablety dvakrát denne (n=174, resp. n=178) alebo sa lopinavir (+) ritonavir nahradili raltegravirom 400 mg dvakrát denne (n=174, resp. n=176). Pacienti s virologickým zlyhaním v anamnéze neboli vylúčení a počet predchádzajúcich antiretrovírusových terapií nebol obmedzený.
Tieto štúdie boli ukončené po primárnej analýze účinnosti v 24. týždni, pretože sa im nepodarilo preukázať neinferioritu raltegraviru oproti lopinaviru (+) ritonaviru. V oboch štúdiách sa v 24. týždni supresia HIV RNA na menej ako 50 kópií/ml udržala u 84,4 % pacientov v skupine s raltegravirom oproti 90,6 % v skupine s lopinavirom (+) ritonavirom (pacienti, ktorí nedokončili štúdiu = zlyhanie). O potrebe podávať raltegravir s dvoma ďalšími účinnými liečivami pozri časť 4.4.
Predtým neliečení dospelí pacientiV STARTMRK (multicentrické randomizované, dvojito zaslepené, aktívnym komparátorom kontrolované skúšanie) sa hodnotila bezpečnosť a antiretrovírusová aktivita raltegraviru 400 mg
dvakrát denne oproti efavirenzu 600 mg večer pred spaním, v kombinácii s emtricitabínom (+)
tenofovir-dizoproxilfumarátom, u predtým neliečených pacientov infikovaných HIV s HIV RNA >5 000 kópií/ml. Randomizácia bola stratifikovaná podľa skríningu hladiny HIV RNA (≤50 000 kópií/ml a >50 000 kópií/ml) a podľa infekcie hepatitídou B alebo C (pozitívna alebo negatívna).
Demografia (pohlavie, vek a rasa) a východiskové charakteristiky pacientov boli medzi skupinou užívajúcou raltegravir 400 mg dvakrát denne a skupinou, ktorá užívala efavirenz 600 mg večer pred spaním, porovnateľné.
Výsledky 48-týždňových a 240-týždňových analýzPokiaľ ide o primárny cieľový ukazovateľ účinnosti, podiel (%) pacientov, ktorí dosiahli HIV RNA
< 50 kópií/ml v 48. týždni, bol 241/280 (86,1 %) v skupine užívajúcej raltegravir a 230/281 (81,9 %)
v skupine užívajúcej efavirenz. Terapeutický rozdiel (raltegravir – efavirenz) bol 4,2 % s príslušným
95 % IS (-1,9, 10,3), čo potvrdzuje, že raltegravir nie je inferiórny oproti efavirenzu (p-hodnota pre neinferioritu <0,001). Terapeutický rozdiel (raltegravir – efavirenz) v 240. týždni bol 9,5 %,

s príslušným 95 % IS (1,7, 17,3). Výsledky v 48. týždni a 240. týždni u pacientov užívajúcich odporúčanú dávku raltegraviru 400 mg dvakrát denne zo štúdie STARTMRK sú uvedené v tabuľke 4.
Tabuľka 4Výsledky účinnosti v 48. a 240. týždni
Štúdia STARTMRK
48. týždeň 240. týždeň
Parameter
Raltegravir
400 mg dvakrát denne
Efavirenz
600 mg večer pred spaním (N=282)
Raltegravir
400 mg dvakrát denne
Efavirenz
600 mg večer pred spaním (N=282)
 (N=281) (N=281)
Percento HIV-RNA <50 kópií/ml (95 % IS)
(N=281) (N=281)
Percento HIV-RNA <50 kópií/ml (95 % IS)
Všetci pacienti† 86 (81, 90) 82 (77, 86) 71 (65, 76) 61 (55, 67) Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 91 (85, 95) 89 (83, 94) 70 (62, 77) 65 (56, 72)
≤100 000 kópií/ml 93 (86, 97) 89 (82, 94) 72 (64, 80) 58 (49, 66) Počet CD4 ≤50 buniek/mm3 84 (64, 95) 86 (67, 96) 58 (37, 77) 77 (58, 90)
>50 a ≤200 buniek/mm3 89 (81, 95) 86 (77, 92) 67 (57, 76) 60 (50, 69)

>200 buniek/mm3 94 (89, 98) 92 (87, 96) 76 (68, 82) 60 (51, 68) Vírusový podtyp vetvy B 90 (85, 94) 89 (83, 93) 71 (65, 77) 59 (52, 65) nepatriaci do vetvy B 96 (87, 100) 91 (78, 97) 68 (54, 79) 70 (54, 82)
 Štúdia STARTMRK
48. týždeň 240. týždeň
Štúdia STARTMRK
48. týždeň 240. týždeň
Parameter
Priemerná zmena počtu CD4 buniek (95 % IS), bunky/mm
3
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz
600 mg večer pred spaním
(N=282)
Raltegravir
400 mg dvakrát
denne
(N=281)
Efavirenz

 600 mg večer pred spaním
(N=282)
600 mg večer pred spaním
(N=282)
Všetci pacienti‡ 189 (174,
204)
163 (148,
178)
374 (345,
403)
312 (284,
339)
Východisková charakteristika‡
HIV-RNA >100 000 kópií/ml 196 (174,
219)
≤100 000 kópií/ml 180 (160,
200) Počet CD4 ≤50 buniek/mm3 170 (122,
218)
>50 a ≤200 buniek/mm3 193 (169,
217)
>200 buniek/mm3 190 (168,
212) Vírusový podtyp vetvy B 187 (170,
204)
nepatriaci do vetvy B 189 (153,
225)
192 (169,
214)
134 (115,
153)
152 (123,
180)
175 (151,
198)
157 (134,
181)
164 (147,
181)
156 (121,
190)
392 (350,
435)
350 (312,
388)
304 (209,
399)
413 (360,
465)
358 (321,
395)
380 (346,
414)
332 (275,
388)
329 (293,
364)
294 (251,
337)
314 (242,
386)
306 (264,
348)
316 (272,
359)
303 (272,
333)
329 (260,
398)

† Pacient, ktorý nedokončil štúdiu, sa posudzuje ako zlyhanie: pacienti, ktorí predčasne prerušili, sú následne pokladaní za neúspešných.
Hlásené je percento pacientov s odpoveďou a príslušný 95 % interval spoľahlivosti (IS).
‡ Na analýzu podľa prognostických faktorov sa pre percentá <50 a 400 kópií/ml virologické zlyhania prenášali (carried forward). Pre priemerné zmeny počtu CD4 sa na virologické zlyhania použila metóda prenosu východiskovej hodnoty (baseline-carry-forward).
Poznámky: Analýza vychádza zo všetkých dostupných údajov.

Raltegravir a efavirenz sa podávali s emtricitabínom (+) tenofovir-dizoproxilfumarátom.
Pediatrická populáciaDeti a dospievajúci vo veku od 2 do 18 rokovIMPAACT P1066 je otvorené multicentrické skúšanie fázy I/II na zhodnotenie farmakokinetického profilu, bezpečnosti, znášanlivosti a účinnosti raltegraviru u detí infikovaných HIV. Do tejto štúdie
bolo zaradených 126 detí a dospievajúcich vo veku od 2 do 18 rokov so skúsenosťou s liečbou. Pacienti boli rozdelení podľa veku, zaraďovali sa najprv dospievajúci a následne potom mladšie deti.
Pacienti dostávali buď 400 mg v liekovej forme tabliet (vek od 6 do 18 rokov) alebo liekovú formu žuvacie tablety (vek od 2 do menej ako 12 rokov). Raltegravir sa podával s optimalizovaným základným režimom.
Úvodné obdobie hľadania dávky zahŕňalo intenzívne farmakokinetické hodnotenie. Výber dávky vychádzal z dosiahnutia podobnej plazmatickej expozície a minimálnej koncentrácie raltegraviru, aké sa pozorovali u dospelých a z akceptovateľnej krátkodobej bezpečnosti. Po výbere dávky boli na posúdenie dlhodobej bezpečnosti, znášanlivosti a účinnosti zaradení ďalší pacienti. 96 zo 126 pacientov dostávalo odporúčanú dávku raltegraviru (pozri časť 4.2).
 Tabuľka 5
Tabuľka 5
 Východiskové charakteristiky a výsledky účinnosti v 24. a 48. týždni štúdie IMPAACT P1066 (vo veku 2 až 18 rokov)
Východiskové charakteristiky a výsledky účinnosti v 24. a 48. týždni štúdie IMPAACT P1066 (vo veku 2 až 18 rokov)
Parameter
 Demografia
Populácia užívajúca konečnú dávku
N = 96
Demografia
Populácia užívajúca konečnú dávku
N = 96
Vek (roky), medián [rozsah] 13 [2 – 18]
Mužské pohlavie 49 %
RasaKaukazský typ 34 %
Černosi 59 %
Východiskové charakteristikyPlazmatická HIV-1 RNA (log10 kópie/ml), priemer
[rozsah] 4,3 [2,7 - 6]
Počet CD4 buniek (bunky/mm3), medián [rozsah] 481 [0 – 2 361]
Percento CD4, medián [rozsah] 23,3 % [0 – 44]
HIV-1 RNA > 100 000 kópií /ml 8 %
Kategória B alebo C CDC HIV 59 %
Predchádzajúce použitie ART podľa triedyNNRTI 78 % PI 83 %
 Odpoveď 24. týždeň 48. týždeň
Odpoveď 24. týždeň 48. týždeňDosiahnutý ≥ 1 log10 pokles HIV RNA oproti
východiskovej hodnote alebo < 400 kópií/ml 72 % 79 %
Dosiahnutá HIV RNA < 50 kópií/ml 54 % 57 %
Priemerné zvýšenie počtu CD4 buniek (%) oproti východiskovým hodnotám
119 buniek/mm3
(3,8 %)
156 buniek/mm3
(4,6 %)
Dojčatá a batoľatá vo veku 4 týždne do menej ako 2 roky
IMPAACT P1066 tiež zahŕňala dojčatá a batoľatá vo veku 4 týždne do menej ako 2 roky infikované
HIV, ktoré predtým dostávali antiretrovírusovú liečbu buď ako profylaxiu na prevenciu prenosu
z matky na dieťa (PMTCT) a/alebo v kombinovanej antiretrovírusovej liečbe na liečbu infekcie HIV. Raltegravir sa podával vo forme granulátu na perorálnu suspenziu bez ohľadu na jedlo v kombinácii
s optimalizovaným základným režimom, ktorý u dvoch tretín pacientov zahŕňal lopinavir plus ritonavir.
Tabuľka 6
Východiskové charakteristiky a výsledky účinnosti v 24. a 48. týždni štúdie IMPAACT P1066 (vo veku 4 týždne do menej ako 2 roky)
Parameter N = 26
Demografia
Vek (týždne), medián [rozsah] 28 [4 – 100]
Mužské pohlavie 65 %
Rasa
Kaukazský typ 8 % Černosi 85 %
Východiskové charakteristiky
Plazmatická HIV-1 RNA (log10 kópie/ml), priemer
[rozsah] 5,7 [3,1 – 7]
Počet CD4 buniek (bunky/mm3 ), medián [rozsah] 1 400 [131 – 3 648]
Percento CD4, medián [rozsah] 18,6 % [3,3 – 39,3]
HIV-1 RNA > 100 000 kópií /ml 69 %
Kategória B alebo C CDC HIV 23 %
Predchádzajúce použitie ART podľa triedy
NNRTI 73 % NRTI 46 %
PI 19 %
Odpoveď 24. týždeň 48. týždeň
Dosiahnutý ≥ 1 log10 pokles HIV RNA oproti
východiskovej hodnote alebo < 400 kópií/ml 91 % 85 %
Dosiahnutá HIV RNA < 50 kópií/ml 43 % 53 %
Priemerné zvýšenie počtu CD4 buniek (%) oproti východiskovým hodnotám
500 buniek/mm3
(7,5 %)
492 buniek/mm3
(7,8 %)



 Virologické zlyhanie
24. týždeň 48. týždeň
Virologické zlyhanie
24. týždeň 48. týždeň
Pacient bez odpovede 0 0
Rebounder 0 4
Počet s dostupným genotypom* 0 2
*U jedného pacienta sa vyskytla mutácia v polohe 155.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s raltegravirom v jednej alebo vo viacerých podskupinách pediatrickej populácie s infekciou ľudskej imunitnej nedostatočnosti (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiAbsorpciaU zdravých dobrovoľníkov, ktorým sa podali jednotlivé perorálne dávky raltegraviru nalačno, sa
preukázalo, že sa raltegravir rýchlo absorbuje s tmax približne 3 hodiny po podaní dávky. AUC a Cmax raltegraviru sa zvyšujú úmerne dávke v rozmedzí dávok 100 mg až 1 600 mg. C12 h raltegraviru sa zvyšuje úmerne dávke v rozmedzí dávok 100 až 800 mg a zvyšuje sa o niečo menej, ako je úmerné dávke v rozmedzí dávok 100 mg až 1 600 mg. Dávková proporcionalita nebola stanovená u pacientov.
Pri dávkovaní dvakrát denne sa farmakokinetický rovnovážny stav dosahuje rýchlo, približne
v priebehu prvých 2 dní užívania lieku. Dochádza len k malej až žiadnej kumulácii v AUC a Cmax a dokázaná je mierna kumulácia v C12 h. Absolútna biologická dostupnosť raltegraviru nebola stanovená.
Raltegravir sa môže podávať s jedlom alebo bez jedla. V pivotných štúdiách bezpečnosti a účinnosti u pacientov infikovaných HIV sa raltegravir podával bez ohľadu na jedlo. Podanie viacnásobných
dávok raltegraviru po jedle s miernym obsahom tuku neovplyvnilo AUC raltegraviru v klinicky významnej miere, AUC stúpla o 13 % v porovnaní s podaním nalačno. Po podaní po jedle s miernym obsahom tuku bola C12 h raltegraviru o 66 % vyššia a Cmax o 5 % vyššia ako po podaní nalačno. Podanie raltegraviru po jedle s vysokým obsahom tuku zvýšilo AUC a Cmax približne dvojnásobne
a C12 h 4,1-násobne. Podanie raltegraviru po jedle s nízkym obsahom tuku znížilo AUC o 46 % a Cmax
o 52 %, C12 h sa v podstate nezmenila. Zdá sa, že v porovnaní so stavom nalačno potrava zvyšuje
farmakokinetickú variabilitu.
Vo farmakokinetike raltegraviru sa celkovo pozorovala značná variabilita. V skúšaniach
BENCHMRK 1 a 2 sa variačný koeficient (CV) pozorovanej C12 h pre interindividuálnu variabilitu
= 212 % a CV pre intraindividuálnu variabilitu = 122 %. Zdroje variability môžu zahŕňať rozdiely
v podaní spolu s jedlom a súbežne podávanými liekmi.
Distribúcia
V rozsahu koncentrácie 2 až 10 µmol/l sa na ľudské plazmatické proteíny viaže približne 83 %
raltegraviru.
Raltegravir rýchlo prechádzal cez placentu u potkanov, ale do mozgu v zreteľnom rozsahu neprenikol.
V dvoch štúdiách pacientov infikovaných HIV-1, ktorí dostávali raltegravir 400 mg dvakrát denne, sa raltegravir ľahko detegoval v cerebrospinálnej tekutine. V prvej štúdii (n = 18) bol medián koncentrácie v cerebrospinálnej tekutine 5,8 % (rozsah od 1 do 53,5 %) zodpovedajúcej plazmatickej koncentrácie. V druhej štúdii (n = 16) bol medián koncentrácie v cerebrospinálnej tekutine 3 %
(rozsah od 1 do 61 %) zodpovedajúcej plazmatickej koncentrácie. Tieto mediány podielov sú približne
3- až 6-násobne nižšie ako voľná frakcia raltegraviru v plazme.
Biotransformácia a vylučovanie
Zjavný terminálny polčas raltegraviru je približne 9 hodín s kratším polčasom fázy alfa (~1 hodina)
zodpovedným za veľkú časť AUC. Po podaní perorálnej dávky rádioaktívne značeného raltegraviru sa približne 51 % dávky vylúčilo v stolici a 32 % dávky v moči. V stolici bol prítomný iba raltegravir,
z ktorého väčšina je pravdepodobne derivovaná z hydrolýzy raltegravir-glukuronidu vylúčeného
žlčou, ako sa pozorovalo u predklinických druhov. V moči boli zistené dva komponenty, a to raltegravir a raltegravir-glukuronid, a tvorili približne 9 % (raltegravir) a 23 % (raltegravir-glukuronid) dávky. Hlavnou cirkulujúcou látkou bol raltegravir a predstavoval približne 70 % celkovej rádioaktivity; zostávajúcu rádioaktivitu v plazme predstavoval raltegravir-glukuronid. Štúdie
s izoformnými selektívnymi chemickými inhibítormi a cDNA exprimovanými UDP- glukuronozyltransferázami (UGT) ukazujú, že hlavným enzýmom zodpovedným za tvorbu raltegravir-
glukuronidu je UGT1A1. Údaje teda poukazujú na to, že hlavným mechanizmom klírensu raltegraviru
u ľudí je glukuronidácia sprostredkovaná UGT1A1.
Polymorfizmus UGT1A1
Pri porovnaní 30 osôb s *28/*28 genotypom s 27 osobami s genotypom divokého typu bol pomer geometrických priemerov (90 % IS) AUC 1,41 (0,96, 2,09) a pomer geometrických priemerov C12 h
1,91 (1,43, 2,55). U osôb, u ktorých je z dôvodu genetického polymorfizmu aktivita UGT1A1 znížená,
sa nepovažuje za potrebné upravovať dávku.
Osobitné populácie
Pediatrická populácia
Na základe štúdie porovnávajúcej liekovú formu u zdravých dospelých dobrovoľníkov mali žuvacia tableta a granulát na perorálnu suspenziu vyššiu perorálnu biologickú dostupnosť v porovnaní
so 400 mg tabletou. V tejto štúdii viedlo podávanie žuvacej tablety s jedlom s vysokým obsahom tuku v priemere k 6 % poklesu AUC, 62 % poklesu Cmax a 188 % zvýšeniu C12hod v porovnaní s podaním nalačno. Podávanie žuvacej tablety s jedlom s vysokým obsahom tuku nemá klinicky významný vplyv na farmakokinetiku raltegraviru a žuvacia tableta sa môže podávať bez ohľadu na jedlo. Účinok jedla na liekovú formu granulát na perorálnu suspenziu sa neskúmal.
Tabuľka 7 uvádza farmakokinetické parametre pri 400 mg tablete, žuvacej tablete a granuláte na perorálnu suspenziu podľa telesnej hmotnosti.
Tabuľka 7: Farmakokinetické parametre raltegraviru IMPAACT P1066
po podaní dávok v časti 4.2
Telesná
hmotnosť Lieková forma Dávka N*
filmom obalená
Geometrický
priemer (%CV†) AUC0-12 hod
(μmol/l●hod)
Geometrický priemer (%CV†)
C12 hod (nmol/l)
≥ 25 kg
tableta 400 mg dvakrát denne 18 14,1 (121 %) 233 (157 %)
dávkovanie na základe telesnej hmotnosti, pozri tabuľky
s dávkovaním pre
≥ 25 kg žuvacia tableta
11 do menej
ako 25 kg žuvacia tableta
žuvaciu tabletu 9 22,1 (36 %) 113 (80 %)
dávkovanie na základe telesnej hmotnosti, pozri tabuľky s dávkovaním pre
žuvaciu tabletu 13 18,6 (68 %) 82 (123 %)
dávkovanie na základe telesnej hmotnosti,
3 do menej ako 20 kg
perorálna suspenzia
pozri tabuľku 1
s dávkovaním 19 24,5 (43 %) 113 (69 %)

*Počet pacientov s intenzívnymi farmakokinetickými (FK) výsledkami pri konečnej odporúčanej dávke.
†Geometrický koeficient zmeny.
Farmakokinetika raltegraviru u dojčiat mladších ako 4 týždne nebola stanovená.
Staršie osobyV rámci študovaného vekového rozsahu (19 až 84 rokov, s niekoľkými osobami staršími ako 65
rokov) nemal vek klinicky významný vplyv na farmakokinetiku raltegraviru.
Pohlavie, rasa a BMIV súvislosti s pohlavím, rasou alebo indexom telesnej hmotnosti (BMI) u dospelých sa nevyskytli žiadne klinicky významné farmakokinetické rozdiely.
Porucha funkcie obličiekRenálny klírens nezmeneného liečiva je menšinovou dráhou eliminácie. U dospelých sa medzi pacientmi s ťažkou renálnou insuficienciou a zdravými osobami nevyskytli žiadne klinicky významné
farmakokinetické rozdiely (pozri časť 4.2). Pretože nie je známe, do akej miery je raltegravir
dialyzovateľný, je potrebné vyhnúť sa podávaniu pred dialýzou.
Porucha funkcie pečeneRaltegravir je primárne eliminovaný glukuronidáciou v pečeni. U dospelých sa medzi pacientmi so stredne ťažkou hepatálnou insuficienciou a zdravými osobami nevyskytli žiadne klinicky významné farmakokinetické rozdiely. Vplyv ťažkej hepatálnej insuficiencie na farmakokinetiku raltegraviru sa neskúmal (pozri časti 4.2 a 4.4).
5.3 Predklinické údaje o bezpečnostiPredklinické štúdie toxicity vrátane obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, vývojovej toxicity a juvenilnej toxicity sa s raltegravirom
vykonali na myšiach, potkanoch, psoch a králikoch. Účinky pri expozíciách dostatočne presahujúcich klinické expozičné hladiny nepoukazujú na žiadne osobitné riziko pre ľudí.
Mutagenita
V in vitro testoch mikrobiálnej mutagenézy (Ames), in vitro metódach alkalického vymývania na
detekciu zlomov DNA a in vitro a in vivo štúdiách chromozómovej aberácie sa nepozoroval dôkaz mutagenity ani genotoxicity.
Karcinogenita
Štúdia karcinogenity raltegraviru u myší nepreukázala žiadny karcinogénny potenciál. Pri najvyšších
úrovniach dávok, 400 mg/kg/deň u samíc a 250 mg/kg/deň u samcov, bola systémová expozícia podobná expozícii pri klinickej dávke 400 mg dvakrát denne. U potkanov sa pri dávkach 300
a 600 mg/kg/deň u samíc a 300 mg/kg/deň u samcov zistili tumory (karcinóm skvamóznych buniek)
nosa/nosohltana. Táto neoplázia môže byť následkom lokálneho ukladania a/alebo vdychovania liečiva na sliznicu nosa/nosohltana počas perorálneho podávania dávky sondou do žalúdka
a následného chronického dráždenia a zápalu. Je pravdepodobné, že pre zamýšľané klinické použitie
má obmedzený význam. Pri najvyššej dávke bez pozorovateľných nežiaducich účinkov (NOAEL -„no observable adverse effect level“) bola systémová expozícia podobná expozícii pri klinickej dávke
400 mg dvakrát denne. Štandardné štúdie genotoxicity hodnotiace mutagenitu a klastogenitu boli negatívne.
Vývojová toxicita
V štúdiách vývojovej toxicity na potkanoch a králikoch nebol raltegravir teratogénny. U mláďat samíc
potkanov, ktoré boli vystavené raltegraviru v dávkach približne 4,4-násobne vyšších, ako je expozícia u ľudí pri dávke 400 mg dvakrát denne na základe AUC0-24 h, sa pozorovalo mierne zvýšenie incidencie nadpočetných rebier. Na základe AUC0-24 h neboli pri 3,4-násobku ľudskej expozície pri dávke 400 mg dvakrát denne pozorované žiadne účinky na vývoj (pozri časť 4.6). Podobné zistenia neboli pozorované u králikov.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
- hydroxypropylcelulóza
- sukralóza
- manitol
- glycyrizinát amónny
- sorbitol (E420)
- fruktóza
- banánová príchuť
- sacharóza
- krospovidón, typ A
- stearan horečnatý
- hypromelóza 2910/6cP
- makrogol/PEG 400
- etylcelulóza 20 cP
- hydroxid amónny
- triglyceridy so stredne dlhým reťazcom
- kyselina olejová
- mikrokryštalická celulóza
- sodná soľ karmelózy
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky pre neotvorené vrecko
Po rekonštitúcii: 30 minút pri uchovávaní pri 30 °C alebo teplote do 30 °C.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky na uchovávanie. Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
PET/hliníkové/LLDPE vrecká.
Jedna škatuľa obsahuje 60 vreciek, dve 5 ml dávkovacie injekčné striekačky a 2 poháriky na prípravu.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Každé vrecko na jednorazové použitie obsahuje 100 mg raltegraviru, ktoré sa majú suspendovať v 5 ml vody, čím sa dosiahne konečná koncentrácia 20 mg na 1 ml.
· Nasypte obsah celého vrecka do 5 ml vody a premiešajte
· Po premiešaní odmerajte odporúčaný objem (dávku) suspenzie pomocou injekčnej striekačky a dávku podajte perorálne
· Objem (dávka) suspenzie sa má podať perorálne do 30 minút po zmiešaní
· Nepoužitú suspenziu zlikvidujte
· Viac podrobnejších informácií týkajúcich sa prípravy a podávania suspenzie, pozri v časti
Pokyny na použitie v písomnej informácii pre používateľa
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU
Veľká Británia
8. REGISTRAČNÉ ČÍSLO
EU/1/07/436/005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 20. decembra 2007
Dátum posledného predĺženia registrácie: 14. mája 2014
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.