snej hmotnosti/deň vo vyváženej infúzii. Rýchlosť prietoku až do 5 ml/kg telesnej hmotnosti za hodinu, čo zodpovedá 1,7 kvapkám/kg telesnej hmotnosti za minútu.
Pri rýchlom podaní (napr. pri šoku a pod.) sa rýchlosť riadi podľa reakcie krvného tlaku, často v kombinácii s úvodným vazopresorom.
Deti a starší pacienti:Podľa individuálnych požiadaviek.
Spôsob podávaniaIntravenózne podanie.
Poznámky týkajúce sa príjmu tekutín a elektrolytov:
Dávka 30 ml roztoku na kg telesnej hmotnosti denne pokryje základné fyziologické potreby tekutín. U pacientov po operácii a v intenzívnej starostlivosti je zvýšená potreba prísunu tekutín následkom obmedzenej koncentračnej kapacity obličiek a zvyšujúcej sa exkrécie metabolitov, takže je potrebné zvýšiť príjem tekutín na 40 ml/kg telesnej hmotnosti denne. Dodatočné straty (napr. teplota, hnačka, fistula, vracanie atď.) musia byť kompenzované stále vyšším, individuálne prispôsobeným príjmom tekutín. Aktuálna a individuálna potreba tekutín je určená postupným monitorovaním potrebným v každom prípade (napr. exkrécia moču, osmolarita séra a moču, stanovenie vylučovania látok).
Základná substitúcia najdôležitejších katiónov sodíka a draslíka je približne 1,5 - 3 mmol/kg telesnej hmotnosti za deň, resp. 0,8 - 1,0 mmol/kg telesnej hmotnosti za deň. Aktuálna potreba počas infúznej terapie závisí na vhodnom určení elektrolytovej rovnováhy a na laboratórnom monitorovaní plazmatických koncentrácií.
4.3 KontraindikácieHyperhydratácia, renálne zlyhanie (oligúria až anúria), srdcová dekompenzácia, ťažší stupeň hypertenzie (všeobecné obmedzenia infúznej terapie).
4.4 Osobitné upozornenia a opatrenia pri používaníINFUSIO RINGERI IMUNA môže byť s opatrnosťou podávaný v nasledujúcich podmienkach:
- hypertonická dehydratácia
- hypokaliémia
- hypernatriémia
- hyperchlorémia
- renálna insuficiencia s tendenciou k hyperkaliémii
Je nevyhnutné monitorovať iónogram séra a rovnováhu vody.
Pri liečbe dehydratácie, iónových dysbalancií, hypovolémie je nutné sledovať parametre vnútorného prostredia, hlavne iónogramu a korigovať prípadné odchýlky. V závažnejších prípadoch je nutná kombinácia s roztokmi koloidov a vyvážená suplementácia i ostatných iónov. Pri korekcii porúch natriémie (hlavne chronických) by zmeny nemali presiahnuť 10 mmol/l denne. Pri rýchlejších zmenách hrozí nebezpečenstvo edému mozgu.
Liek nesmie byť po prvom odbere znova použitý.
Liek nesmie byť používaný po uplynutí času použiteľnosti vyznačenom na obale.
4.5 Liekové a iné interakcieNie sú uvádzané.
4.6 Fertilita, gravidita a laktáciaLiek sa môže podávať tehotným a dojčiacim ženám za prísnej lekárskej kontroly.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNie je známe.
4.8 Nežiaduce účinkyMožnosť všeobecných nežiaducich účinkov spojených s nezodpovedajúcou infúznou terapiou, hyperhydratácia, hyperchlorémia, kardiálna dekompenzácia s preťažením obehu, vznik edémov (vrátane pľúcneho), ascites, iónový rozvrat.
Ďalej sa môžu vyskytnúť reakcie v mieste vpichu.
Pri výskyte nežiaducej reakcie treba prerušiť podávanie infúzie a za kontinuálneho monitorovania korigovať vnútorné prostredie. Pokiaľ sa objaví nežiaduci účinok spôsobený liekom pridaným do infúzie, je potrebné infúziu prerušiť a liečbu prehodnotiť.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 PredávkovaniePri odborne vedenej terapii, kedy sa priebežne sledujú základné parametre vnútorného prostredia sa predávkovanie neočakáva. Prejavy predávkovania pozri „nežiaduce účinky“.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina
: Náhrady krvi a perfúzne roztoky, roztok ovplyvňujúci rovnováhu elektrolytov.
ATC kód: B05BB01
INFUSIO RINGERI IMUNA má podobné zloženie elektrolytov ako extracelulárna tekutina. Používa sa na úpravu elektrolytov séra a acidobázickej rovnováhy. Elektrolyty sú podávané na dosiahnutie alebo udržanie normálnej osmotickej situácie v extracelulárnom a intracelulárnom priestore. Pre pomerne vysoký obsah chloridov má roztok mierne okysľujúci účinok.
5.2 Farmakokinetické vlastnostiÚplne disociované ióny sa v organizme distribuujú podľa koncentračných gradientov v extracelulárnej tekutine, voľná voda sa distribuuje podľa koncentračného spádu vo všetkých kompartmentoch. Iónová rovnováha závisí od vylučovania iónov obličkami a podlieha hlavne mineralokortikoidnej regulácii. Vodná homeostáza je riadená predovšetkým antidiuretickým hormónom.
5.3 Predklinické údaje o bezpečnostiJedná sa o bezpečný liek bez toxických, mutagénnych, karcinogénnych a teratogénnych účinkov.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokvoda na injekcie
6.2 InkompatibilityK roztoku by sa nemali pridávať žiadne iné lieky alebo substancie, pokiaľ nie je známa ich kompatibilita.
6.3 Čas použiteľnostiSklenená infúzna fľaša v neporušenom obale: 3 roky
PlastovýPVC vak a PP vak s injekčným a infúznym portom v neporušenom obale: 2 roky
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 25°C.
Neuchovávajte v mrazničke.
Len na jednorazové použitie.
6.5 Druh obalu a obsah baleniaa) Sklenená infúzna fľaša s gumovou zátkou a kovovým uzáverom.
Veľkosti balenia: 1 x 100 ml, 1 x 200 ml, 1 x 250 ml, 1 x 400 ml, 1 x 500 ml
b) PVC plastový vak, plastový uzáver z PVC alebo z polykarbonátu uzavretý v PE+PA fólii.
Veľkosti balenia: 1 x 100 ml, 1 x 200 ml, 1 x 250 ml, 1 x 400 ml, 1 x 500 ml, 1 x 1000 ml, 1 x 2000 ml, 1 x 3000 ml, 1 x 5000 ml
c) PP plastový vak ENVIBAG s infúznym a injekčným portom uzavretý v plastovej fólii.
Vaky sa dodávajú nasledovne:
1 x 100 ml, 1 x 250 ml, 1 x 500 ml, 1 x 1000 ml (jednotlivo)
40 x 100 ml, 18 x 250 ml, 10 x 500 ml, 10 x 1000 ml (v kartónovej škatuli)
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomLiek je určený na intravenóznu aplikáciu.
Dávkovanie podľa pokynov lekára.
Pri aplikácii lieku v sklenených fľašiach dodržte tieto zásady:
1. Pred použitím odstráňte poistku.
2. Povrch zátky dezinfikujte.
Použite len v prípade, že je roztok číry, bez viditeľných častíc a ak je obal nepoškodený. Podajte okamžite po napojení na infúzny set.
Nepoužívajte plastové vaky v sériových napojeniach. Takéto použitie môže viesť k vzduchovej embólii spôsobenej natiahnutím zvyšného vzduchu z hlavného vaku pred ukončením podávania tekutiny z vedľajšieho vaku. Stlačenie intravenózneho roztoku v pružnom plastovom obale za účelom zvýšenia rýchlosti prietoku môže zapríčiniť vzduchovú embóliu, ak pred podaním nie je reziduálny objem vzduchu z vaku úplne vyprázdnený.
Roztok sa musí podávať aseptickou metódou pomocou sterilného zariadenia. Aby sa predišlo vniknutiu vzduchu do systému, zariadenie sa musí naplniť roztokom.
Ďalšie lieky sa môžu pridať pred alebo počas podávania infúzie cez venóznu linku.
Keď sa pridáva do roztoku ďalší liek, pred parenterálnym podaním skontrolujte kompatibilitu. Musí sa zaistiť dôkladné a starostlivé aseptické premiešanie všetkých ďalších pridaných liekov. Roztoky obsahujúce aj ďalšie pridané lieky sa musia použiť okamžite a nesmú sa uchovávať.'
Pridanie iného lieku alebo použitie nesprávnej techniky podania môže vyvolať febrilné reakcie spôsobené možným zavedením pyrogénov. V prípade nežiaducej reakcie sa musí infúzia okamžite zastaviť.
Len na jednorazové použitie.
Čiastočne použité vaky už viac nepripájajte.
V prípade, že je vnútorný vak zabalený v sekundárnom obale, vyberte vnútorný vak zo sekundárneho obalu tesne pred použitím. Vnútorný vak udržiava sterilitu lieku.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Návod na manipuláciu s vakom S INJEKČNÝM A INFÚZNYM PORTOMObrázok 1: Vak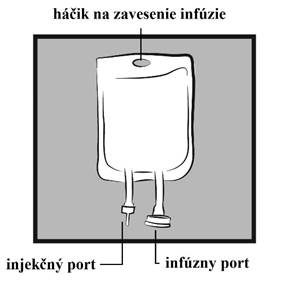
1. KONTROLA PRED PODANÍM
a) Skontrolujte vak, či nedochádza k unikaniu tekutiny. Pokiaľ zistíte narušenie celistvosti vaku, vak s roztokom zlikvidujte, keďže môže byť narušená jeho sterilita.
b) Skontrolujte, či roztok opticky spĺňa charakteristiky uvedené v časti 3. Pokiaľ nie, roztok zlikvidujte. Na prípravu a podávanie používajte sterilný materiál.
2. PRÍPRAVA NA PODANIE
a) Zaveste vak na stojan alebo ho položte na vodorovnú plochu (obrázok 2a).
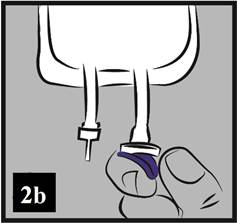
b) Modrý plastový kryt z výstupného portu (infúzneho portu) odstráňte vylomením (obrázok 2b).
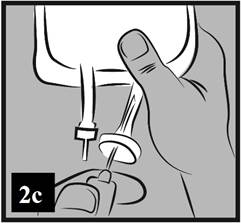
c) Gumená zátka portu je sterilná, preto nie je potrebná jej dezinfekcia. Pripojte hrubú perforačnú ihlu infúzneho setu do infúzneho portu (obrázok 2c).
d) Ďalej postupujte podľa návodu priloženého k infúznemu setu (naplnenie setu a podávanie roztoku).
Obrázok 2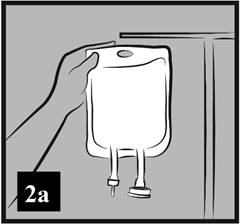
3. PRIDANIE LIEKU DO ROZTOKU
a) Odlomte priesvitný kryt na injekčnom porte. Gumená zátka je sterilná, preto nie je potrebná jej dezinfekcia (obrázok 3a).
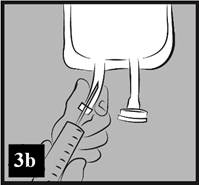
b) Prepichnite injekčný port a pridajte liek. Odporúčaná veľkosť ihly: 19 G (1,10 mm) až 22 G (0,70 mm) (obrázok 3b).
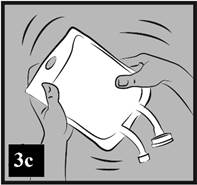
c) Dôkladne premiešajte obsah vaku (obrázok 3c).
Obrázok 3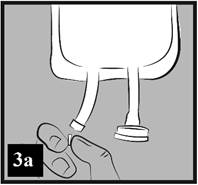
Upozornenie: Riaďte sa pokynmi na likvidáciu vakov v zdravotníctve (obsah pridaného lieku).
Do vaku je možné doplniť maximálne množstvo ďalšieho lieku:
100 ml vak
| max 70 ml
|
250 ml vak
| max 75 ml
|
500 ml vak
| max 115 ml
|
1000 ml vak
| max 130 ml
|
7. Držiteľ rozhodnutia o registráciiIMUNA PHARM, a.s.
Jarková 269/17
082 22 Šarišské Michaľany
Slovenská republika
8. Registračné číslo76/0384/92-S
9. Dátum PRVEJ registrácie/predĺženia registrácieDátum prvej registrácie: 15. júla 1992
Dátum posledného predĺženia registrácie: 29. októbra 2002
10. DÁTUM REVÍZIE TEXTU07/2017