
použitie pre pacientov je zahrnutý v písomnej informácii pre používateľa.
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Glaukóm s úzkym uhlom.
- Feochromocytóm.
- Súbežné podávanie s neselektívnymi inhibítormi monoaminooxidázy (MAO). Liečba týmito inhibítormi má byť ukončená už najmenej dva týždne pred začatím liečby, a to preto, že už je
zavedená základná liečba levodopou (pozri časť 4.5).
- Neuroleptický malígny syndróm (NMS) a/alebo netraumatická rabdomyolýza v anamnéze.
4.4 Osobitné upozornenia a opatrenia pri používaní
Bronchospasmus u pacientovspľúcnymochorením
Kvôli riziku výskytu bronchospasmu sa používanie inhalačného prášku levodopy u pacientov
s astmou, chronickou obštrukčnou chorobou pľúc (CHOCHP) alebo iným chronickým základným pľúcnym ochorením neodporúča. K dispozícii sú len obmedzené údaje o chronických účinkoch Inbrije
u pacientov s poruchou dýchacích ciest.
Účinky nacentrálnynervovýsystém(CNS)amentálneporuchy
Somnolencia a epizódy náhleho upadnutia do spánku
Levodopa sa spájala so somnolenciou a epizódami náhleho upadnutia do spánku (pozri časť 4.7). Veľmi zriedkavo sa hlásili epizódy náhleho upadnutia do spánku počas denných aktivít, v niektorých
prípadoch bez vedomia pacienta alebo varovných prejavov. Pacienti musia byť o tomto informovaní a poučení, aby boli počas liečby pri vedení vozidiel alebo obsluhy strojov opatrní (pozri časť 4.7). Pacienti, u ktorých sa vyskytla somnolencia a/alebo epizódy náhleho upadnutia do spánku, nesmú viesť vozidlá ani obsluhovať stroje. Okrem toho sa môže zvážiť zníženie dávky alebo ukončenie liečby.
Hyperpyrexia a konfúzia vyskytujúce sa pri ukončení liečby
V súvislosti s rýchlym znížením dávky, ukončením liečby alebo zmenami v základnej dopaminergnej liečbe sa hlásil komplex príznakov pripomínajúci neuroleptický malígny syndróm (charakterizovaný
zvýšenou telesnou teplotou, stuhnutosťou svalov, zmenami vedomia a autonómnou nestabilitou) bez
inej zreteľnej etiológie. Preto sa má akékoľvek náhle zníženie dávky alebo ukončenie používania akéhokoľvek lieku s levodopou starostlivo sledovať, a to hlavne u pacientov, ktorí dostávajú aj neuroleptiká.
Mentálne poruchy
U pacientov sa môžu počas liečby levodopou alebo po začatí liečby prípadne zvýšení dávky levodopy vyskytnúť nové alebo zhoršujúce sa zmeny mentálneho stavu a správania, ktoré môžu byť závažné, vrátane správania podobného psychóze a samovražedného správania. Toto abnormálne myslenie
a správanie môže mať jeden alebo viacero rôznych prejavov vrátane úzkosti, depresie, paranoidných myšlienok, preludov, halucinácií, zmätenosti, správania podobného psychóze, dezorientácie,
agresívneho správania, vzrušenia a delíria.
U pacientov s významnými psychotickými poruchami alebo psychotickou poruchou v anamnéze sa musí kvôli riziku zhoršenia psychózy pri liečbe inhibítorom levodopou/dekarboxylázy postupovať
opatrne. Okrem toho môžu niektoré lieky používané na liečbu psychózy zhoršiť príznaky
Parkinsonovej choroby a znížiť účinnosť levodopy. Súbežné používanie antipsychotík sa má starostlivo sledovať ohľadne zhoršenia motorických príznakov Parkinsonovej choroby, a to hlavne pri
používaní antagonistov D2-receptora (pozri časť 4.5).
Impulzívne poruchy
Pacientov je potrebné pravidelne sledovať kvôli vzniku impulzívnych porúch. Pacientov a ich ošetrujúcich je potrebné upozorniť, že pri liečbe levodopou sa môžu v správaní vyskytnúť
behaviorálne príznaky impulzívnych porúch, ktoré zahŕňajú patologické hranie hazardných hier,
zvýšené libido, hypersexualitu, kompulzívne míňanie a nakupovanie, záchvatové prejedanie sa
a kompulzívne prejedanie sa. Ak sa vyskytnú tieto príznaky, odporúča sa prehodnotenie liečby.
Dyskinéza
Inbrija môže spôsobiť dyskinézu. Môže sa zvážiť úprava liečby levodopou alebo iných liekov používaných na liečbu Parkinsonovej choroby.
Kardiovaskulárne ischemické príhody
Inbrija sa má podávať opatrne pacientom so závažným kardiovaskulárnym ochorením. Pri podávaní
Inbrije pacientom s infarktom myokardu v anamnéze, ktorí majú reziduálne atriálne, nodálne alebo ventrikulárne arytmie, sa má postupovať opatrne. Pri začatí liečby Inbrijou sa má u týchto pacientov s osobitnou starostlivosťou sledovať činnosť srdca.
Žalúdočné vredy
Levodopa sa má podávať opatrne pacientom so žalúdočnými vredmi v anamnéze (kvôli možnosti
krvácania horného gastrointestinálneho traktu).
Glaukóm
Levodopa môže u pacientov s glaukómom spôsobiť zvýšený vnútroočný tlak. Pacienti s chronickým
glaukómom sa môžu opatrne liečiť levodopou pod podmienkou, že vnútroočný tlak je dobre kontrolovaný a pacient je počas liečby starostlivo sledovaný ohľadne zmien vnútroočného tlaku.
Melanóm
Epidemiologické štúdie preukázali, že u pacientov s Parkinsonovou chorobou je vyššie riziko (2- až
približne 6-násobne vyššie) rozvoja melanómu v porovnaní s celkovou populáciou. Nie je známe, či je pozorované zvýšené riziko spôsobené Parkinsonovou chorobou alebo inými faktormi, ako sú napríklad lieky používané na liečbu Parkinsonovej choroby.
Na sledovanie melanómu u pacientov dostávajúcich Inbriju sa odporúča vykonávať pravidelné kožné vyšetrenia.
Laboratórne sledovanie
Abnormality laboratórnych testov môžu zahŕňať zvýšenia hodnôt pečeňových testov ako sú hladiny
alkalickej fosfatázy, aspartátaminotransferázy (AST), alanínaminotransferázy (ALT), laktátdehydrogenázy (LDH) a bilirubínu. Hlásili sa tiež abnormality hodnôt krvného močovinového
dusíka (Blood Urea Nitrogen, BUN) a pozitívny výsledok testu Coombs.
Vplyv navýsledkytestov
Pri používaní testovacieho prúžku na stanovenie ketonúrie môže viesť levodopa k falošne pozitívnej
reakcii pre ketónové telieska v moči. Táto reakcia sa nezmení pri prevarení vzorky moču. Pri použití glukózooxidázových metód testovania glykozúrie môžu byť výsledky testov falošne negatívne.
U pacientov liečených levodopou/inhibítorom dopadekarboxylázy sa veľmi zriedkavo hlásili prípady
nesprávne diagnostikovaného feochromocytómu. Pri interpretácii hladín katecholamínov a ich metabolitov v plazme a moči u pacientov liečených levodopou alebo levodopou/inhibítorom
dopadekarboxylázy sa má postupovať s osobitnou pozornosťou.
Ortostatická hypotenzia
Levodopa môže spôsobiť ortostatickú hypotenziu. Inbrija sa má používať opatrne v prípade súbežného
používania liekov, ktoré môžu spôsobiť ortostatickú hypotenziu, napr. antihypertenzív.
Pridružená infekcia dýchacích ciest
K dispozícii je len obmedzené množstvo údajov o používaní Inbrije počas infeckie dýchacích ciest. Na
základe hodnotení závažnosti pridruženej infekcie dýchacích ciest sa môže v používaní Inbrije pokračovať alebo sa jeho používanie môže prerušiť, až kým respiračné príznaky neustúpia (pozri
časť 4.2).
4.5 Liekové a iné interakcie
Neselektívne inhibítory monoaminooxidázy (MAO)
Používanie neselektívnych inhibítorov MAO s levodopou je kontraindikované (pozri časť 4.3).
Používanie akýchkoľvek inhibítorov MAO sa má ukončiť najmenej 14 dní pre začatím liečby levodopou.
Selektívne inhibítory monoaminooxidázy(MAO)
Používanie selektívnych inhibítorov MAO-B (napr. rasagilín, selegilín a safinamid) s levodopou môže
byť spojené s ortostatickou hypotenziou. Pacientov, ktorí užívajú tieto lieky, je potrebné dôkladne sledovať.
Antagonisti dopamínového D2 receptoraaizoniazid
Antagonisti dopanínového D2 receptora (napr. fenotiazíny, butyrofenóny, risperidón, metoklopramid)
a izonoazid môžu znížiť účinnosť levodopy. Pacientov, ktorí užívajú tieto lieky, je potrebné sledovať ohľadne zhoršenia príznakov Parkinsonovej choroby (pozri časť 4.4).
A
ntihypertenzíva
Pri pridaní kombinácií levodopy a inhibítora dopadekarboxylázy k liečbe pacientov, ktorí už dostávajú
niektoré antihypertenzíva, sa vyskytla symptomatická posturálna hypotenzia. Počas súbežného používania Inbrije môže byť potrebná úprava dávky antihypertenzíva.
Anticholinergiká
Anticholinergiká môžu pôsobiť synergisticky s levodopou na zlepšenie príznakov trasu. Súbežné
používanie však môže spôsobiť zhoršenie mimovoľnej motorickej poruchy. Anticholinergiká môžu oslabiť účinok perorálnych liekov s levodopou z dôvodu oneskorenej absorpcie. Môže byť potrebná úprava dávky levodopy.
COMT inhibítory
Pri pridaní entakaponu k levodope/inhibítoru dopadekarboxylázy sa preukázalo zvýšenie biologickej
dostupnosti levodopy o 30 %. Pri súbežnom používaní COMT inhibítorov môže byť potrebná úprava dávky levodopy.
Tricyklické antidepresíva
Zriedkavo sa hlásili nežiaduce reakcie vrátane hypertenzie a dyskinézy spôsobené súbežným
používaním tricyklických antidepresív a levodopy/inhibítora dopadekarboxylázy.
Amantadín
Súbežné podávanie levodopy a amantadínu môže zvýšiť výskyt zmätenosti, halucinácií, nočných môr,
gastrointestinálnych porúch a iných nežiaducich účinkov podobných účinku atropínu. U pacientov dostávajúcich amantadín a levodopu sa pozorovali psychotické reakcie.
Lokálne alebo systémové lieky napľúcneochorenia
Interakcie Inbrije s lokálnymi alebo systémovými liekmi na pľúcne ochorenia sa neskúmali, pretože
používanie Inbrije sa u pacientov s astmou, chronickou obštrukčnou chorobou pľúc (CHOCHP) alebo iným chronickým základným pľúcnym ochorením neodporúča (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii alebo je iba obmedzené množstvo údajov o použití levodopy u gravidných žien.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Inbriju sa neodporúča užívať počas gravidity a u žien vo fertilnom veku nepoužívajúcich antikoncepciu.
Dojčenie
Levodopa sa vylučuje do ľudského mlieka. Nie sú dostatočné informácie o účinkoch levodopy
u novorodencov/dojčiat. Dojčenie má byť počas liečby Inbrijou ukončené.
Fertilita
Nie sú dostupné žiadne údaje o účinkoch levodopy na fertilitu u ľudí. Štúdie na zvieratách
nenaznačujú žiadne účinky na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Levodopa môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Niektoré nežiaduce účinky ako je ospalosť a závrat, ktoré sa hlásili s inými liekovými formami levodopy, môžu ovplyvniť schopnosť niektorých pacientov viesť vozidlá alebo obsluhovať stroje.
Pacienti liečení liekmi s levodopou, u ktorých sa vyskytne somnolencia a/alebo epizódy náhleho spánku, musia byť informovaní o tom, aby neviedli vozidlá a nezúčastňovali sa aktivít, pri ktorých môže znížená pozornosť predstavovať riziko závažného poranenia alebo úmrtia pre nich samotných alebo pre iných ľudí (napr. používanie strojov), a to až dovtedy, kým tieto opakujúce epizódy
a somnolencia neustúpia (pozri tiež časť 4.4).
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hlásenými nežiaducimi reakciami v klinických štúdiách s Inbrijou boli kašeľ (15,6 %),
pád (8,7 %), infekcia horných dýchacích ciest (5,8 %), dyskinéza (5,7 %) a sfarbenie spúta (2,8 %). Pre lieky obsahujúce levodopu sa hlásili závažné nežiaduce reakcie alergického edému, nie však
v klinických štúdiách s Inbrijou. Pri liekoch obsahujúcich levodopu/inhibítor dopadekarboxylázy sa
môže vyskytnúť komplex príznakov pripomínajúci neuroleptický malígny syndróm a rabdomyolýza, aj keď sa v klinických štúdiách s Inbrijou neidentifikovali žiadne prípady. Pre lieky obsahujúce levodopu sa hlásilo gastrointestinálne krvácanie, ktoré sa v klinických štúdiách s Inbrijou pozorovalo jedenkrát.
Tabuľkový zoznamnežiaducichreakcií
V tabuľke 1 nižšie sú uvedené nežiaduce reakcie podľa triedy orgánových systémov a frekvencie.
Kategórie frekvencií sú definované nasledovne: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), neznáme (z dostupných údajov). Stĺpec s neznámou frekvenciou predstavuje nežiaduce reakcie
hlásené s inými perorálnymi liekmi obsahujúcimi levodopu.
T
abuľka 1: Nežiaduce reakcie
N
ežiaduce reakcie v klinických skúšaniach s Inbrijou
N
ežiaduce reakcie hlásené s perorálne podávanou levodopou
T
rieda orgánových systémov
Benígne a malígne nádory, vrátane nešpecifikovaných novotvarov (cysty a polypy)
Poruchy krvi
a lymfatického systému
Poruchy imunitného systému Poruchy metabolizmu a výživy
Veľmi časté Časté Neznáme
malígny melanóm
anémia, agranulocytóza, trombocytopénia, leukopénia alergický edém
znížená chuť do jedla
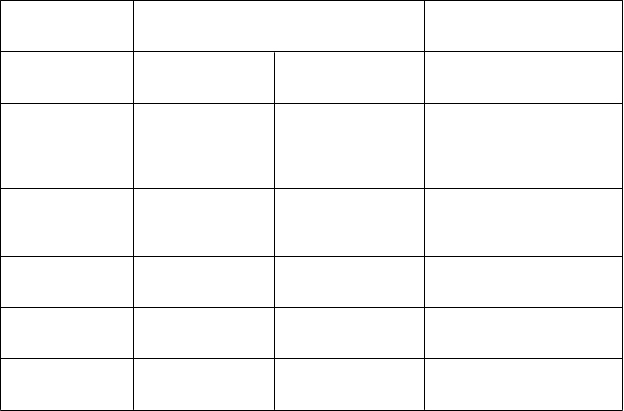
Psychické poruchy stav zmätenosti, halucinácie, depresia,
N
ežiaduce reakcie v klinických skúšaniach s Inbrijou
N
ežiaduce reakcie hlásené s perorálne podávanou levodopou
T
rieda orgánových systémov
Poruchy nervového systému
Veľmi časté Časté Neznáme
úzkosť, abnormálne sny, nespavosť, psychotická porucha,
impulzívne poruchy (pozri časť 4.4),
agitácia,
pokus a samovraždu (pozri časť 4.4),
dezorientácia,
syndróm dopamínovej dysregulácie,
euforická nálada,
zvýšené libido, bruxizmus, paranoja, preludy
dyskinéza, dystónia,
fenomén „on-off“, somnolencia,
závrat,
zhoršenie Parkinsonovej choroby,
parestézia,
bolesť hlavy, tras,
záchvat,
náhle upadnutie do spánku
(pozri časť 4.4),
syndróm nepokojných nôh, neuroleptický malígny
syndróm (pozri časť 4.4),
ataxia, dysgeúzia, kognitívna porucha, Hornerov syndróm, demencia,
Poruchy oka rozmazané videnie, diplopia,
mydriáza, okulogyrická kríza, blefarospazmus,
Poruchy srdca
a srdcovej činnosti
poruchy srdcového rytmua
(pozri časť 4.4), palpitácie
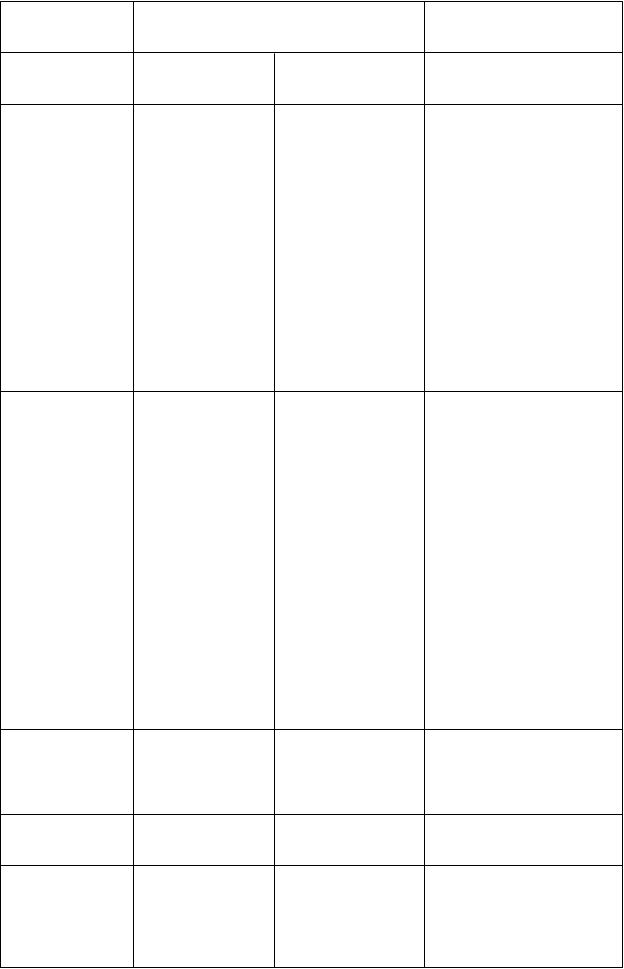
Poruchy ciev ortostatická hypotenzia (pozri časť 4.4),
hypertenzia,
synkopa, tromboflebitída, návaly horúčavy
N
ežiaduce reakcie v klinických skúšaniach s Inbrijou
N
ežiaduce reakcie hlásené s perorálne podávanou levodopou
T
rieda orgánových systémov
V
eľmi časté Časté Neznáme
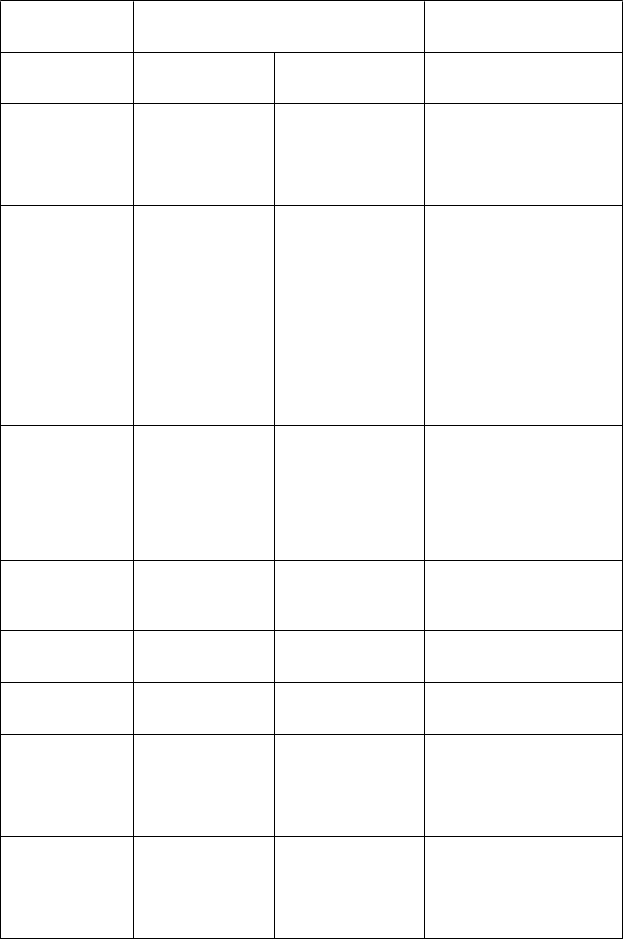
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy kože a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek
a močových ciest
Poruchy reprodukčného systému a prsníkov Celkové poruchy
a reakcie v mieste
podania
Laboratórne a funkčné vyšetrenia
kašeľ, infekcia horných dýchacích ciest, sfarbenie spúta, sfarbenie nosového výtoku, podráždenie hrdla, nevoľnosť, zvracanie,
dýchavičnosť, abnormálne dýchanie, dysfónia,
čkanie,
bolesť brucha, zápcha, hnačka,
sucho v ústach, gastrointestinálne krvácanie,
žalúdočný vred (pozri
časť 4.4), dysfágia, dyspepsia, glosodýnia, flatulencia, sfarbenie slín, hypersekrécia slín, angioedém, hyperhidróza, vyrážka,
pruritus,
Henoch-Schönleinova purpura, urtikária,
alopécia,
sfarbenie potu,
svalové kŕče, trizmus
zadržiavanie moču, chromatúria,
močová inkontinencia
priapizmus
periférny edém, asténia,
únava,
celkový pocit nepohodlia, porucha chôdze,
bolesť v hrudníku,
zvýšená hladina aspartátaminotransferázy, zvýšená hladina alanínaminotransferázy, zvýšená hladina laktátdehydrogenázy v krvi,
N
ežiaduce reakcie v klinických skúšaniach s Inbrijou
N
ežiaduce reakcie hlásené s perorálne podávanou levodopou
T
rieda orgánových systémov
V
eľmi časté Časté Neznáme
zvýšená hladina bilirubínu v krvi,
zvýšená hladina glukózy
v krvi,
zvýšená hladina kreatinínu v krvi,
zvýšená hladina kyseliny močovej v krvi,
znížená hladina hemoglobínu, znížený hematokrit,
prítomnosť krvi v moči, zvýšená hladina močoviny v krvi,
zvýšená hladina alkalickej fosfatázy v krvi,
pozitívny výsledok testu
Coombs,
pozitívny výsledok testu leukocytov v moči,
pozitívny výsledok
bakteriálneho testu, znížená telesná hmotnosť, zvýšená telesná hmotnosť,
Úrazy, otravy a komplikácie liečebného postupu
pád
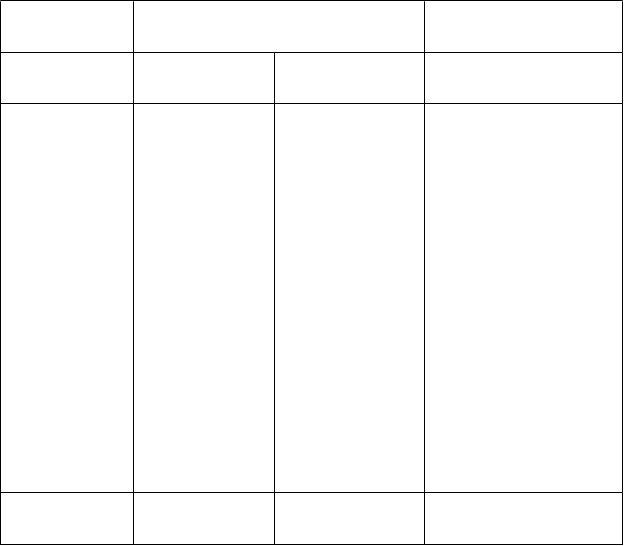
a Porucha srdcového rytmu tu predstavuje kombinovaný termín zastupujúci atriálnu fibriláciu, atriálne chvenie, atrioventrikulárnu blokádu, blokádu Tawarovho ramienka, syndróm chorého sínusu,
bradykardiu a tachykardiu.
Popis vybraných nežiaducich reakciíNáhle upadnutie do spánkuPoužívanie levodopy sa spája so somnolenciou a veľmi zriedkavo sa spájala s nadmernou dennou somnolenciou a epizódami náhleho upadnutia do spánku.
Impulzívne poruchyU pacientov liečených dopamínovými agonistami a/alebo inými dopamínergickými liečbami obsahujúcimi levodopu sa môže vyskytnúť patologické hranie hazardných hier, zvýšené libido, hypersexualita, kompulzívne míňanie a nakupovanie, záchvatové prejedanie sa a kompulzívne prejedanie sa (pozri časť 4.4).
KašeľVäčšina prípadov kašľa hlásených v klinických štúdiách s Inbrijou bolo miernych až stredne závažných a zvyčajne sa hlásili počas prvých 30 dní liečby. Kvôli kašľu ukončili klinické štúdie
s Inbrijou 2 % pacientov.
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v PríloheV.
4.9 Predávkovanie
Akútne príznaky predávkovania levodopou sa môžu očakávať z dôvodu nadmernej dopaminergnej stimulácie. Použitie viac ako jednej dávky Inbrije (2 kapsuly) na liečbu tej istej fázy OFF môže spôsobiť poruchy CNS so zvýšenou pravdepodobnosťou kardiovaskulárnych porúch (napr. hypotenzia, tachykardia) a závažnejšími psychickými problémami pri vyšších dávkach.
Pacientov je potrebné sledovať a poskytnúť im podpornú liečbu. Pacientov treba elektrokardiograficky sledovať ohľadne rozvoja arytmií a v prípade potreby sa má podať antiarytmická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Antiparkinsoniká, dopaminergné látky, ATC kód: N04BA01
Mechanizmus účinku
Levodopa je prekurzorom dopamínu a podáva sa ako náhradná dopamínová liečba pri Parkinsonovej
chorobe.
Klinická účinnosť a bezpečnosť
Účinnosť Inbrije podávaným dodatočne k základnej dopaminergnej liečbe pri liečbe epizód OFF
u pacientov s Parkinsonovou chorobou sa vyhodnocovala v 12-týždňovej, randomizovanej, placebom kontrolovanej, dvojito zaslepenej štúdii. Pacienti museli byť schopní rozpoznať fázu OFF a použiť
pomôcku.
Celkom bolo 114 pacientov randomizovaných na liečbu Inbrijou 66 mg (dve 33 mg kapsuly)
a 112 pacientov dostávalo placebo. Pri výskyte fázy OFF mohli pacienti použiť inhalovanú levodopu podľa potreby až päť krát denne. Apomorfín nebol povolený ako základná liečba. Na začiatku štúdie
mali pacienti najmenej 2 hodiny fázy OFF za deň a liek obsahujúci levodopu/inhibítor
dopadekarboxylázy nepresahoval 1 600 mg levodopy za deň.
Primárnym koncovým ukazovateľom účinnosti bola priemerná zmena od východiskovej hodnoty skóre Zjednotenej hodnotiacej škály pre Parkinsonovu chorobu (Unified Parkinson’s Disease Rating Scale, UPDRS) časť III 30 minút po podaní dávky v 12. týždni. Škála UPDRS časť III je navrhnutá na vyhodnotenie závažnosti hlavných motorických nálezov (napr. tras, stuhnutosť, bradykinéza, posturálna nestabilita) u pacientov s Parkinsonovou chorobou. Tento koncový ukazovateľ sa vyhodnocoval v klinickom prostredí, t.j. pacienti museli užiť svoju zvyčajnú rannú dávku perorálne podávanej levodopy/inhibítora dopadekarboxylázy a následne 2 - 5 hodín po podaní dávky navštíviť kliniku. Ak sa vyskytla fáza OFF, pacienti dostali placebo alebo inhalovanú levodopu. Škála UPDRS- III sa vyhodnocovala 30 minút po podaní dávky. Hlavnými sekundárnymi koncovými ukazovateľmi boli zníženie priemerného denného času fázy OFF a zlepšenie škály Celkového obrazu pacienta'
o zlepšení stavu (Patient Global Impression of Change, PGI-C), čo je výsledok hlásený pacientom o celkovom zlepšení a spokojnosti s liečbou Inbrijou a odpoveď na liečbu týkajúca sa ON fázy.
Výsledky sú uvedené v tabuľke 2.
T
abuľka 2: Východiskové charakteristiky a výsledky koncových ukazovateľov účinnosti
I
nbrija
Parametre Placebo n = 112
66 mg n = 114
C
harakteristiky pacienta
Vek 63 rokov 64 rokov Trvanie Parkinsonovej choroby 97 mesiacov 96 mesiacov Východisková dávka levodopy 841 mg 819 mg
Skóre UPDRS-III počas fázy a
OFF n = 95
n = 94a
Skóre pred podaním dávky 32,1 29,0
Zmena po 30 min. -5,91 -9,83
Rozdiel (95 % IS) - -3,92 (-6,84; -1,00)
hodnota p - 0,009
O
dpoveď na liečbu týkajúca a
sa ON fázyb n = 97
n = 97a
% (n) 36,1 % (35) 57,7 % (56) Rozdiel - 21,6% hodnota p - 0,003
PGI-C n = 97a n = 98a Významné zlepšenie % (n) 7,2 % (7) 11,2 % (11) Zlepšenie % (n) 7,2 % (7) 26,5 % (26) Mierne zlepšenie % (n) 32,0 % (31) 33,7 % (33) Žiadne zlepšenie % (n) 53,6 % (52) 28,6 % (28) hodnota p - < 0,001c Denné trvanie fázy OFF (h) n = 97a n = 95a Priemer na začiatku (SD) 5,59 (2,25) 5,35 (2,26)
Priemerná zmena LS Priemerný rozdiel (95 % IS) hodnota p
-0,48 -0,47
-0,01 (-0,55; 0,56)
0,975
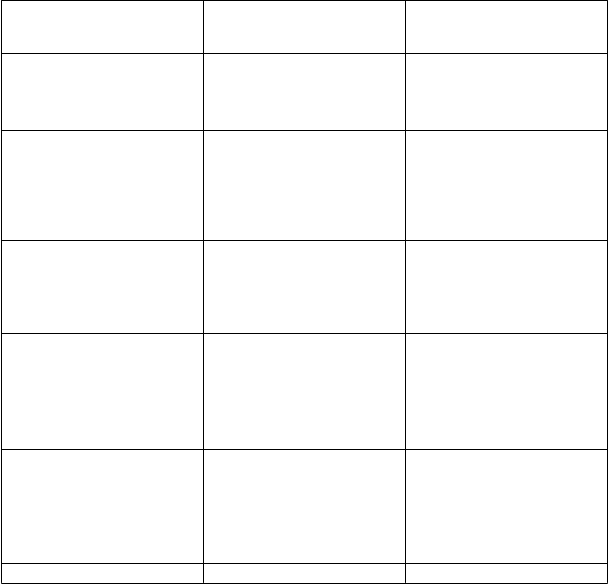
Denné dávky (medián) 2 dávky 2 dávky
a Pozorované prípady.
b Pacient odpovedajúci na liečbu definovaný ako pacient, ktorý prešiel z fázy OFF na fázu ON do
60 minút po podaní dávky a ktorý zostal vo fáze ON v 60. minúte po podaní dávky.
c hodnota p pre PGI-C je nominálna.
Pľúcna bezpečnosťV subpopulácii 12-týždňovej štúdie sa vykonávali sériové spirometrické merania 15, 30 a 60 minút po podaní prvej dávky Inbrije 66 mg alebo placeba. Po prvej dávke sa nepozorovali žiadne významné
rozdiely medzi placebom a Inbrijou v úsilnom expiračnom objeme v 1. sekunde (FEV1).
V 12-mesačnej, randomizovanej, kontrolovanej, otvorenej štúdii sa účinok Inbrije na funkciu pľúc vyhodnocoval aj u pacientov s Parkinsonovou chorobou liečených perorálne podávanou levodopou/inhibítorom dopadekarboxylázy. Celkom 271 pacientov sa liečilo Inbrijou 66 mg (dve
33 mg kapsuly) a 127 pacientov v pozorovacej kontrolnej skupine bolo pozorovaných v rámci ich zvyčajného liečebného režimu s perorálne podávaným liekom na liečbu Parkinsonovej choroby.
Funkcia pľúc sa vyhodnocovala spirometriou a difúznou kapacitou oxidu uhoľnatého (DLCO) každé
3 mesiace u oboch skupín. Po 12 mesiacoch bolo priemerné zníženie hodnoty FEV1 oproti východiskovej hodnote rovnaké u oboch skupín (-0,1 l). Zmena oproti východiskovej hodnote pre
hodnotu DLCO sa porovnávala medzi skupinou liečenou Inbrijou a pozorovacou skupinou. Na konci
12 mesiacov sa nepozoroval žiadny významný rozdiel v zmene oproti východiskovej hodnote DLCO
medzi skupinou s Inbrijou a pozorovacou skupinou.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s Inbrijou vo
všetkých podskupinách pediatrickej populácie pri liečbe idiopatickej Parkinsonovej choroby
(informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Farmakokinetické vlastnosti Inbrije 66 mg (2 x 33 mg kapsuly) a karbidopy/levodopy 25 mg/100 mg
tablety s okamžitým uvoľňovaním sa hodnotili u 24 zdravých dobrovoľníkov v stave nalačno, ktorí dostávali celkom 50 mg karbidopy každých 8 hodín.
Medián času do dosiahnutia maximálnej plazmatickej koncentrácie levodopy je 30 minút po podaní dávky Inbrije 66 mg (2 x 33 mg kapsuly) v porovnaní so 45 minútami po podaní dávky karbidopy/levodopy 25 mg/100 mg tablety s okamžitým uvoľňovaním. Relatívna biologická dostupnosť normalizovaná podľa dávky pre jednorazovú 66 mg dávku Inbrije bola 88,0 % (90 % IS:
80,3; 96,4) v porovnaní s jednorazovou perorálnou dávkou karbidopy/levodopy 25 mg/100 mg.
Priemerná plazmatická koncentrácia po 10 minútach (C10min) a maximálna koncentrácia (Cmax) levodopy po podaní Inbrije 66 mg (2 x 33 mg kapsuly) bola 418 ng/ml a 696 ng/ml, v uvedenom poradí, s expozíciou v priebehu 4 hodín (AUC0-4 h) 1 280 ng●h/ml.
Distribúcia
Zjavný objem distribúcie (Vz/F) bol pre Inbriju 66 mg (2 x 33 mg kapsuly) 168 l.
Biotransformácia
Levodopa sa v rozsiahlej miere metabolizuje na rôzne metabolity. Dve hlavné cesty metabolizmu sú
dekarboxylácia L-aromatickou aminokyselinovou dekarboxylázou a O-metylácia katechol-O-metyltransferázou (COMT).
Farmakokinetické vlastnosti hlavných metabolitov levodopy, 3-O metyldopy (3-OMD), kyseliny
3,4-dihydroxyfenyloctovej (DOPAC) a kyseliny homovanilovej (HVA), sa skúmali po podaní jednorazovej inhalovanej dávky Inbrije a jednorazovej perorálnej dávke karbidopy/levodopy
25 mg/100 mg tablety s okamžitým uvoľňovaním. Metabolický profil po inhalácii Inbrije nebol významne odlišný oproti profilu pozorovanému po perorálnom podaní karbidopy/levodopy. Maximálne koncentrácie metabolitov a celková expozícia dosiahnutá po podaní Inbrije neprevyšovali
hodnoty pozorované po perorálnom podaní dávky karbidopy/levodopy.
Vplyv množstva dopadekarboxylázy v obehu na konci dávkovacieho intervalu karbidopy/levodopy na účinnosť Inbrije sa neskúmal.
Eliminácia
V prítomnosti karbidopy bol zjavný terminálny polčas eliminácie (t1/2) levodopy po jednorazovom podaní Inbrije 66 mg (2 x 33 mg kapsuly) 2,3 hodiny a bol porovnateľný s hodnotou 1,9 hodín po
perorálnom podaní dávky karbidopy/levodopy 25 mg/100 mg tablety s okamžitým uvoľňovaním.
Linearita/nelinearita
Inbrija preukazuje farmakokinetické vlastnosti levodopy priamo úmerné dávke v rozsahu od 13 mg do
122 mg.
Porucha funkcie obličiek
Inbrija nebola špecificky skúšaná u pacientov s poruchou funkcie obličiek. Pacientom so závažným
ochorením obličiek sa odporúča podávať tento liek opatrne (pozri časť 4.2).
Porucha funkcie pečene
Inbrija nebola špecificky skúšaná u pacientov s poruchou funkcie pečene. Pacientom so závažnou
poruchou funkcie pečene sa odporúča podávať tento liek opatrne (pozri časť 4.2).
Pohlavie
U 24 zdravých osôb (13 mužov a 11 žien) sa vykonala klinická štúdia s Inbrijou 66 mg (2 x 33 mg
kapsuly). Po podaní Inbrije boli hodnoty Cmax a AUC0-24 h u žien o 42,2 % a 48,8 % vyššie než
u mužov. Po úprave parametrov pre telesnú hmotnosť už nebol rozdiel medzi pohlaviami po každej
liečbe významný: hodnoty Cmax a AUC0-24 h upravené podľa telesnej hmotnosti boli po podaní dávky Inbrije u žien o 9,7 % a 15,1 % vyššie než u mužov. Väčšina rozdielov medzi pohlaviami sa pripisuje rozdielom v telesnej hmotnosti. Na základe pohlavia nie je potrebná žiadna úprava dávky.
Fajčenie
Vykonala sa klinická štúdia s Inbrijou 66 mg (2 x 33 mg kapsuly) podávaným 56 zdravým osobám
(31 nefajčiarov a 25 fajčiarov). Po podaní Inbrije boli hodnoty Cmax a AUC0-24 h u fajčiarov o 11 % až
12 % vyššie než u nefajčiarov. Na základe stavu fajčenia nie je potrebná žiadna úprava dávky.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity alebo karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
Reprodukčná toxicita
Levodopa spôsobila viscerálne a skeletálne malformácie u králikov.
V štúdiách toxicity po opakovanom podávaní samotnej levodopy u myší, potkanov alebo opíc sa nepozorovali žiadne účinky na samčie alebo samičie reprodukčné orgány.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly
kolfosceril palmitát (DPPC)
chlorid sodný
Obal kapsuly
hypromelóza
oxid titaničitý (E 171)
karagénan
chlorid draselný karnaubský vosk kukuričný škrob
Farbivo
šelak
čierny oxid železitý (E 172)
propylénglykol hydroxid draselný
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 °C. Uchovávajte v pôvodnom obale na ochranu pred svetlom
a vlhkosťou a vyberte len tesne pred použitím.
6.5 Druh obalu a obsah balenia
Tvrdé kapsuly sa dodávajú v hliníkových / PVC / hliníkových sťahovacích blistroch. Každý perforovaný blistrový strip s jednotkou dávky obsahuje 4 tvrdé kapsuly.
Inhalátor Inbrija je vyrobený z polybutyléntereftalátu (PBT), polykarbonátu (PC) a polypropylénu
(PP). Prepichovacie hroty a pružiny sú vyrobené z nehrdzavejúcej ocele.
Škatuľa obsahujúca 60 tvrdých kapsúl (15 blistrových stripov) a jeden inhalátor. Škatuľa obsahujúca 92 tvrdých kapsúl (23 blistrových stripov) a jeden inhalátor.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Acorda Therapeutics Ireland Limited
10 Earlsfort Terrace
Dublin 2, D02 T380
Írsko
Tel: +353 (0)1 231 4609
8. REGISTRAČNÉ ČÍSLA
EU/1/19/1390/001
EU/1/19/1390/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.