e a chcete podporiť ďalší rast do výšky (uzavreté rastové štrbiny na koncoch dlhých kostí). Váš lekár vás vyšetrí, aby zistil, či stále potrebujete Humatrope po tom, čo Vaše kosti prestali rásť
- keď ste
veľmi chorý a potrebujete intenzívnu lekársku starostlivosť z dôvodu závažného srdcového alebo brušného chirurgického zákroku, ste liečený na mnohopočetné zranenia z dôvodu úrazu alebo potrebujete liečbu mechanickým dýchaním po akútnom zlyhaní pľúc.
Buďte zvlášť opatrný pri používaní Humatrope:- ak vás liečilipre nedostatok rastového hormónu v detstve. váš lekár u vás znovu vyšetrí množstvo rastového hormónu a rozhodne, či potrebujete liečbu Humatropom aj v dospelosti
- ak ste skončili predchádzajúcu protirakovinovú liečbu, pred začiatkom liečby Humatropom bude možno potrebné röntgenové vyšetrenie vášho mozgu. Mali by ste byť vyšetrovaný pravidelne, aby sa zabezpečilo, že sa nádor nevráti ani nezačne rásť
- ak ste v detstve prekonali rakovinu. Bolo hlásené zvýšené riziko tvorby sekundárnych novotvarov (benígnych alebo malígnych) u pacientov, ktorí v detstve prekonali rakovinu a boli liečení somatropínom. Najčastejšími sekundárnymi nádormi boli nádory na mozgu.
- ak máte príznaky, ako je častá alebo závažná bolesť hlavy s nevoľnosťou a/alebo problémami s videním, ak sa objavia, oznámte to okamžite svojmu lekárovi. Váš lekár vám vyšetrí oči, aby zistil, či nemáte zvýšený tlak v mozgu. V závislosti od výsledkov tohto vyšetrenia možno bude potrebné prerušiť liečbu s Humatropom
- ak začnete krívať alebo vás bolí bok, poraďte sa, prosím, so svojím lekárom. V období rastu môže dôjsť k rozvoju kostných porúch vo Vašich bedrách
- ak začnete liečbu, Humatrope môže ovplyvňovať množstvo hormónov štítnej žľazy vo Vašej krvi. Ak je hladina vášho hormónu štítnej žľazy nízka, môže to znížiť Vašu odpoveď na Humatrope. Preto musíte pravidelne podstupovať vyšetrenia funkcie štítnej žľazy bez ohľadu na to, či dostávate liečbu hormónom štítnej žľazy alebo nie
- u detských pacientov a uistite sa, že pokračujú v liečbe, až do konca obdobia rastu
- ak dostávate vyššiu dávku Humatropu ako máte predpísanú. Môže sa u vás objaviť nadmerný rast niektorých častí vášho tela, ako sú uši, nos, sánka, ruky a chodidlá. Predávkovanie môže viesť tiež k zvýšeným hladinám cukru v krvi a cukru v moči. Vždy používajte Humatrope tak, ako vám odporučil ošetrujúci lekár.
- ak máte poruchu rastu z dôvodu poškodenia obličiek; liečba s Humatropom sa má ukončiť pred transplantáciou obličky
- ak máte akútne závažné ochorenie; váš ošetrujúci lekár má byť o ňom informovaný. U pacientov, ktorí dostávali somatropín počas závažného ochorenia, boli hlásené úmrtia.
- ak máte nedostatok rastového hormónu a trpíte tiež Praderovým-Williho syndrómom (genetická porucha). Pred začiatkom liečby s Humatropom vás váš lekár vyšetrí, či nemáte problémy s dýchaním a infekcie dýchacích ciest, predovšetkým ak máte nadváhu, ak ste predtým mali závažné problémy s dýchaním (hlavne počas spánku) alebo ak máte infekciu pľúc alebo dýchacích ciest. Ak sa u vás počas liečby objavia príznaky problémov s dýchaním (chrápanie), liečba sa má prerušiť a váš lekár má určiť príčinu.
- ak máte cukrovku (diabetes mellitus), ošetrujúci lekár vám skontroluje množstvo cukru v krvi a môže vám upraviť liečbu cukrovky. Humatrope môže ovplyvňovať spôsob, akým vaše telo zaobchádza s cukrom z jedla a nápojov a to tak, že ovplyvňuje spôsob akým Vaše telo využíva inzulín.
- ak máte poruchu rastu v súvislosti s tým, že ste sa narodili malý vzhľadom na gestačný vek. Pred začiatkom liečby a pravidelne počas nej vám bude kontrolovaný cukor v krvi a hladiny inzulínu..
- ak ste vo vyššom veku (nad 65 rokov), pretože môžete byť citlivejší na Humatrope a môžete byť náchylnejší na vedľajšie účinky.
Používanie iných liekovAk užívate alebo ste v poslednom čase užívali ešte iné lieky, vrátane liekov, ktorých výdaj nie je viazaný na lekársky predpis, oznámte to, prosím, svojmu lekárovi alebo lekárnikovi:
· lieky na liečbu
cukrovky (diabetes mellitus), ktoré sa možno budú musieť upraviť
·
steroidné hormóny kôry nadobličiek (glukokortikoidy), akými sú kortizón alebo prednizolón; váš lekár vám bude možno musieť upraviť dávku, pretože kombinácia týchto liekov s Humatropom môže znížiť účinok obidvoch terapií
·
substitučnú estrogénovú liečbu, pretože môže ovplyvňovať odpoveď na liečbu rastovým hormónom. Ak dôjde k zmene spôsobu užívania estrogénu (napr. z perorálneho na transdermálny cez kožu); dávku Humatropu bude možno potrebné upraviť.
· lieky na prevenciu epileptického záchvatu (
antikonvulzíva) alebo cyklosporín.
Tehotenstvo a dojčenieHumatrope sa nemá používať počas tehotenstva, pokiaľ vám ho nepredpíše váš lekár. Ak otehotniete, oznámte to okamžite svojmu lekárovi.
Nie je známe, či somatropín prechádza do materského mlieka. Ak dojčíte alebo plánujete dojčiť, poraďte sa so svojím lekárom predtým, ako začnete používať Humatrope.
Vedenie vozidla a obsluha strojovHumatrope nemá žiadny známy účinok na schopnosť viesť vozidlo alebo obsluhovať stroje.
Dôležité informácie o niektorých zložkách Humatrope· Humatrope obsahuje menej ako 1 mmol sodíka v dennej dávke, preto sa považuje za liek prakticky bez sodíka.
3. AKO POUŽÍVAŤ HUMATROPEVždy používajte Humatrope presne tak, ako vám povedal váš lekár. Ak si nie ste istý ako používať Humatrope, overte si to u svojho lekára alebo lekárnika.
· Vždy sa uistite, že používate tú silu náplne, ktorú vám predpísal váš lekár (buď silu 6 mg, 12 mg alebo 24 mg) a vhodný injekčný systém pera Humatrope s označením CE. Nikdy nepoužívajte náplne iných liekov vo vašom pere Humatropen.
· Každá náplň Humatropu je dodávaná s injekčnou striekačkou, ktorá obsahuje roztok (rozpúšťadlo na injekčný roztok) na prípravu (zmiešanie a rozpustenie injekčného roztoku).
· Humatrope nesmiete miešať ani injekčne aplikovať, pokiaľ ste nedostali primerané školenie od svojho lekára alebo iného kvalifikovaného zdravotníckeho pracovníka.
· Podrobné pokyny, ako pripraviť a injekčne podať Humatrope sú uvedené v časti „
Ako injekčne podať Humatrope“ na konci tejto písomnej informácie pre používateľov. Humatrope musíte miešať len s priloženým rozpúšťadlom. Nikdy ho nemiešajte s ničím iným, pokiaľ vám to nepovie váš lekár.
· Po príprave sa má Humatrope injekčne podať do tukového tkaniva bezprostredne pod kožu použitím krátkej ihly a injekčného pera.
· Miesto vpichu sa má meniť, aby sa zabránilo miestnemu úbytku a stvrdnutiu tukového tkaniva pod kožou (lipoatrofia).
· Po zmiešaní nenechávajte Humatrope vonku z chladničky dlhšie ako 30 minút denne.
· Pero so zvyšným Humatropom uchovávajte v chladničke. Žiadny zvyšok Humatropu v pere nepoužívajte po uplynutí 28 dní od zmiešania.
DávkovanieVáš lekár vás poučí o dávkovaní a schéme podávania. Nemeňte si dávkovanie bez porady so svojím lekárom.
Liečba Humatropom je zvyčajne dlhodobá; váš lekár vám bude možno musieť upraviť dávku v priebehu liečby v závislosti od Vašej telesnej hmotnosti a odpovede na liečbu. Zvyčajne sa dávka vypočíta podľa nasledujúcich odporúčaní a podáva sa jedenkrát denne:
Deti a mladiství:·
s nedostatkom rastového hormónu:0,025 - 0,035 mg/kg telesnej hmotnosti denne,
·
s Turnerovým syndrómom:0,045 - 0,050 mg/kg telesnej hmotnosti denne,
·
s chronickými problémami s funkciou obličiek:0,045 - 0,050 mg/kg telesnej hmotnosti denne,
·
ktoré sa narodili malé vzhľadom na svoj gestačný vek:0,035 mg/kg telesnej hmotnosti denne. Liečba sa má prerušiť po prvom roku liečby, ak rýchlosť rastu nie je dostatočná,
·
s nedostatkom génu SHOX:0,045 - 0,050 mg/kg telesnej hmotnosti denne.
Nedostatok rastového hormónu u dospelých:Liečba sa má začať nízkou dávkou 0,15 - 0,30 mg denne. U starších pacientov a u pacientov s nadváhou môžu byť potrebné nižšie počiatočné dávky. Počiatočná dávka sa môže zvýšiť postupne podľa Vašich individuálnych požiadaviek. Celková denná dávka zvyčajne nepresahuje 1 mg.
Požiadavky na dávku sa môžu znižovať so zvyšujúcim sa vekom. Ženy, predovšetkým tie, ktoré užívajú perorálnu estrogénovú substitučnú liečbu, môžu potrebovať vyššie dávky ako muži.
Ak použijete viac Humatropu, ako máteAk ste si injekčne podali viac Humatropu, ako ste si mali, poraďte sa, prosím, so svojím lekárom.
· Ak ste si injekčne podali príliš veľa Humatropu, na začiatku sa môže váš cukor v krvi znížiť a môže byť príliš nízky (hypoglykémia) a následne sa zvýšiť a môže byť príliš vysoký (hyperglykémia).
· Ak ste si injekčne podávali príliš veľa Humatropu počas dlhšieho obdobia (roky), môže sa u vás objaviť nadmerný rast niektorých častí vášho tela, ako sú uši, nos, sánka, ruky a chodidlá (akromegália).
Ak zabudnete užiť HumatropeNepodávajte si dvojnásobnú dávku, aby ste nahradili vynechanú dávku. Pokračujte v predpísanom dávkovaní. Ak si zabudnete injekčne podať Humatrope a máte akékoľvek pochybnosti o tom, čo robiť, kontaktujte, prosím, svojho lekára.
Ak prestanete používať HumatropePred ukončením liečby sa, prosím, poraďte so svojím lekárom. Prerušenie alebo včasné skončenie liečby s Humatropom môžu narušiť úspešnú liečbu Humatropom.
4. MOŽNÉ VEDĽAJŠIE ÚČINKYTak ako všetky lieky, aj Humatrope môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
Po injekčnej aplikácii Humatropu sa u vás môže objaviť ktorýkoľvek z nasledujúcich vedľajších účinkov:
Na klasifikáciu nežiaducich reakcií bolo použité nasledujúce pravidlo:
Veľmi časté vedľajšie účinky sa môžu vyskytovať u viac ako 1 z 10 pacientov
Časté vedľajšie účinky sa môžu vyskytovať u menej ako 1 zo 100 ale viac ako 1 z 10 pacientov
Menej časté vedľajšie účinky sa môžu vyskytovať u menej ako 1 z 1 000 ale viac ako 1 zo 100 pacientov
Zriedkavé vedľajšie účinky sa môžu vyskytovať u menej ako 1 z 10 000 ale viac ako 1 z 1 000 pacientov
Veľmi zriedkavé vedľajšie účinky sa môžu vyskytovať u menej ako 1 z 10 000 pacientov, vrátane izolovaných hlásení
Deti
|
Časté
| Menej časté
| Zriedkavé
| Veľmi zriedkavé
|
Bolesť v mieste vpichu
Opuch (edém)
Vysoká hladina cukru v krvi (hyperglykémia)
Precitlivenosť na metakrezol alebo/a glycerol
Nízke hladiny hormónu štítnej žľazy
Rozvoj protilátok proti rastovému hormónu
| Slabosť
| Závažná alebo častá bolesť hlavy s nevoľnosťou a/alebo problémami s videním, to sú príznaky zvýšeného tlaku v mozgu (benígna intrakraniálna hypertenzia). Ak sa u vás objavia, oznámte to okamžite svojmu lekárovi.
Necitlivosť a brnenie (parestézia)
Lokalizovaná bolesť svalu (myalgia)
| Problémy so spánkom (insomnia)
Vysoký krvný tlak (hypertenzia)
Zväčšenie prsníka (gynekomastia)
Cukor v moči (glukozúria)
|
Dospelí
|
Veľmi časté
| Časté
| Menej časté
| Zriedkavé
|
Bolesť hlavy
Bolesť kĺbov (artralgia)
| Bolesť v mieste vpichu
Opuch (edém)
Vysoká hladina cukru v krvi (hyperglykémia)
Precitlivenosť na metakrezol alebo/a glycerol
Nízke hladiny hormónov štítnej žľazy
Problémy so spánkom (insomnia)
Necitlivosť a brnenie (parestézia)
Necitlivosť a brnenie v prstoch a dlani rúk z dôvodu stlačenia nervu v zápästí ruky (syndróm karpálneho tunela)
Lokalizovaná bolesť svalu (myalgia)
Vysoký krvný tlak (hypertenzia)
| Slabosť
Zväčšenie prsníkov (gynekomastia)
| Závažná alebo častá bolesť hlavy s nevoľnosťou a/alebo problémami s videním, to sú príznaky zvýšeného tlaku v mozgu (benígna intrakraniálna hypertenzia). Ak sa u vás objavia, oznámte to okamžite svojmu lekárovi.
Cukor v moči (glukozúria)
|
| | | | | |
Účinok inzulínu sa môže znížiť.
U malého počtu detí, ktoré boli liečené rastovým hormónom, bola hlásená leukémia. Neexistuje však dôkaz, že výskyt leukémie je zvýšený u pacientov liečených rastovým hormónom.
Ak začnete pociťovať akýkoľvek vedľajší účinok ako závažný alebo ak spozorujete vedľajšie účinky, ktoré nie sú uvedené v tejto písomnej informácii pre používateľov, povedzte to, prosím, svojmu lekárovi alebo lekárnikovi.5. AKO UCHOVÁVAŤ HUMATROPE- Uchovávajte mimo dosahu a dohľadu detí.
- Nepoužívajte po dátume exspirácie, ktorý je uvedený na štítku a škatuli. Dátum exspirácie (EXP) sa vzťahuje na posledný deň v uvedenom mesiaci.
- Nepoužívajte Humatrope, ak spozorujete, že roztok je zakalený alebo obsahuje akékoľvek častice.
- Vždy uchovávajte Humatrope v chladničke (2 °C – 8 °C). Neuchovávajte v mrazničke.
- Pripravený Humatrope nenechávajte vonku z chladničky dlhšie ako 30 minút denne.
- Humatrope sa môže používať až 28 dní od zmiešania, ak ho uchovávate v chladničke a nie dlhšie ako 30 minút denne pri izbovej teplote.
- Lieky sa nesmú likvidovať odpadovou vodou alebo domovým odpadom. Nepoužitý liek vráťte do lekárne. Tieto opatrenia pomôžu chrániť životné prostredie.
6. ĎALŠIE INFORMÁCIEČo Humatrope obsahujePrášok v náplniLiečivo je somatropín. Každá náplň obsahuje 6 mg, 12 mg alebo 24 mg v závislosti od sily. Po príprave:
·
Humatrope 18 IU (6 mg) obsahuje 1,9 mg somatropínu v mililitri roztoku
·
Humatrope 36 IU (12 mg) obsahuje 3,8 mg somatropínu v mililitri roztoku
·
Humatrope 72 IU (24 mg) obsahuje 7,6 mg somatropínu v mililitri roztoku
Vyššie uvedené koncentrácie po príprave sú teoretickými hodnotami.
Ďalšie zložky sú: manitol, glycín, hydrogénfosforečnan sodný.
Kyselina fosforečná a/alebo hydroxid sodný môžu byť použité vo výrobnom procese na úpravu kyslosti.
Sterilné rozpúšťadlo v injekčnej striekačkeNaplnená injekčná striekačka s rozpúšťadlom obsahuje: glycerol, metakrezol a vodu na injekcie.
Kyselina fosforečná a/alebo hydroxid sodný môžu byť použité vo výrobnom procese na úpravu kyslosti.
Ako vyzerá Humatrope a obsah balenia Humatrope 18 IU (6 mg):
| · 1 náplň s bielym práškom na injekčný roztok,
· 3,17 ml číreho bezfarebného roztoku rozpúšťadla v naplnenej striekačke
Veľkosť balenia 1
|
Humatrope 36 IU (12 mg):
| · 1 náplň s bielym práškom na injekčný roztok,
· 3,15 ml číreho bezfarebného roztoku rozpúšťadla v naplnenej striekačke
Veľkosť balenia 1
|
Humatrope 72 IU (24 mg):
| · 1 náplň s bielym práškom na injekčný roztok,
· 3,15 ml číreho bezfarebného roztoku rozpúšťadla v naplnenej striekačke.
Veľkosť balenia 1
|
Nie všetky veľkosti balenia musia byť uvedené na trh.
Držiteľ rozhodnutia o registráciiEli Lilly ČR, s.r.o., Praha, Česká republika
VýrobcaLilly France
Rue du Colonel Lilly
F-67640 Fegersheim
Francúzsko
Ak potrebujete akúkoľvek informáciu o tomto lieku, kontaktujte, prosím, držiteľa rozhodnutia o registrácii (alebo miestneho zástupcu):Eli Lilly Slovakia s.r.o.
Panenská 6
811 03 Bratislava
Tel.: +421 2 2066 3111
Liek je schválený v členských štátoch Európskeho hospodárskeho priestoru (EHP) pod nasledovnými názvami:V členských štátoch Európskeho hospodárskeho priestoru (EHP), v ktorých je tento liek registrovaný, je schválený pod názvom „Humatrope“, s výnimkou Francúzska, kde je schválený pod názvom „Umatrope“.
Ako injekčne podaťHumatrope 18 IU (6 mg)/ 36 IU (12 mg)/ 72 IU (24 mg)Nasledujúce pokyny vysvetľujú, ako injekčne podať Humatrope. Pozorne si, prosím, prečítajte pokyny a postupujte podľa nich krok za krokom.
Začíname:
Budete potrebovať päť vecí:
1. náplň Humatrope správnej sily
2. injekčnú striekačku naplnenú rozpúšťadlom
3. pero Humatropen s označením CE
4. sterilnú ihlu na pero a
5. tampón s liehom
Predtým, ako budete pokračovať ďalšími krokmi, umyte si ruky.
| *Poznámka: rozpúšťadlo je bezfarebná tekutina. Na obrázku je zobrazené modrou farbou len pre ilustráciu.
|
|
na prípravu náplne s liekom
používajte len súčasti tejto súpravy
|
|
Striekačka na rozpú-šťadlo
|
|
 
|
Nasledujúce kroky vás budú sprevádzať pri príprave Vašej novej náplne na používanie
|
Krok 1 Rozbalenie
· Humatrope smiete miešať len s pribaleným rozpúšťadlom. Nikdy ho nemiešajte s ničím iným, pokiaľ vám to nepovie váš lekár.
· Prečítajte si, prosím, návod pre používateľov, ktorý je priložený k vášmu peru. Pripomenie vám to, čo vám už povedal váš lekár alebo zdravotnícky pracovník.
· Postupujte, prosím, podľa pokynov pod nákresmi.
Stiahnite kryt ihly a zlikvidujte ho. Ešte NESTLÁČAJTE piest. Nie je prekážkou ak vytečie kvapka tekutiny. Nie je nutné vytláčať vzduch zo striekačky.
|
|
Uchopte kryt ihly, ktorý sa nachádza na spodku striekačky
|
|
Vyberte VŠETKY súčasti súpravy z obalu.
Poznámka: Tento produkt je navrhnutý pre pravákov aj ľavákov. Použite tú ruku, s ktorou je vám manipulácia pohodlnejšia.
|
|

|
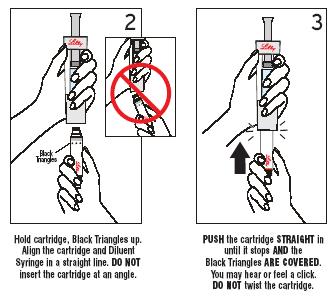
Krok 2 a 3 Pripojenie náplne
Zatlačte náplň PRIAMO dovnútra pokiaľ sa dá TAK, aby čierne trojuholníky BOLI PREKRYTÉ.
Môžete počuť alebo pocítiť cvaknutie. NEOTÁČAJTE náplň.
|
|
Uchopte náplň, tak aby čierne trojuholníky smerovali nahor. Náplň a striekačka s rozpúšťadlom musia byť v jednej priamke.
NEPRIPÁJAJTE náplň zošikma (pod uhlom)
|
|
|
Krok 4 Miešanie Humatropu
Snímte palec z piestu a skontrolujte, či je striekačka rozpúšťadla prázdna (je normálne, ak v striekačke ostanú drobné kvapky rozpúšťadla)
|
|
Držte striekačku s rozpúšťadlom a náplň obidvomi rukami. Zatlačte a uvoľnite piest 2 alebo
3-krát, až kým nie je všetko rozpúšťadlo v náplni.
|
|

|
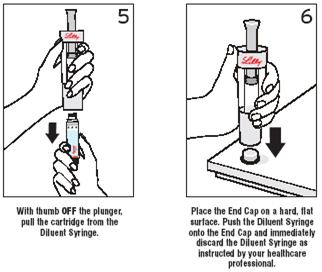
Krok 5 a 6 Uvoľnite náplň a zlikvidujte striekačku rozpúšťadla
Položte koncový uzáver na tvrdú, rovnú podložku. Zatlačte striekačku rozpúšťadla na koncový uzáver a ihneď zlikvidujte ako Vám ukázal lekár alebo zdravotnícky pracovník
|
|
S palcom MIMO piestu vytiahnite náplň zo striekačky rozpúšťadla.
|
|
|
Krok 7 Jemne miešajte
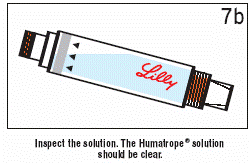
- Premiešajte roztok jemným otáčaním náplne 10-krát. NÁPLŇOU NETRASTE. Nechajte náplň stáť počas 3 minút, a potom starostlivo skontrolujte roztok.
- Ak je roztok zakalený alebo obsahuje častice, opäť jemne 10-krát premiešajte náplň. Náplň nechajte stáť počas ďalších 5 minút. Ak je roztok stále zakalený alebo obsahuje častice, NÁPLŇ NEPOUŽÍVAJTE.
Skontrolujte roztok.
Roztok Humatrope® má byť priehľadný.
|
|
Jemne otáčajte náplň 10-krát a nechajte postáť 3 minúty. Náplňou NETRASTE.
|
|
|
Krok 8 Injekčná aplikácia Humatrope použitím vhodného injekčného pera
- ak je roztok číry, Vaša náplň je teraz pripravená na pripojenie k vhodnému peru Humatropen.
- vložte náplň do pera (pozri návod pre používateľa pera).
- pre každú injekciu vždy použite novú sterilnú ihlu.
- kožu dôkladne utrite tampónom s liehom. Kožu nechajte vyschnúť.
- nastavte správnu dávku (pozri návod pre používateľov pera).
- pomaly injekčne aplikujte pod kožu (subkutánne) tak, ako vás to naučil váš lekár.
- Vytiahnite ihlu z kože a ihlu bezpečne zlikvidujte tak, ako vám ukázal váš lekár alebo zdravotnícky pracovník.
- Vaše pero so zvyšným Humatropom uchovávajte v chladničke. Nepoužívajte nijaký Humatrope, ktorý ostal v pere, po uplynutí 28 dní od zmiešania.
|
Humatrope je ochrannou známkou spoločnosti Eli Lilly and Company Limited.
Táto písomná informácia pre používateľov bola naposledy schválená v 07/2010.