
mú používať tento liek.
4.5 Liekové a iné interakcie
Sympatomimetiká
Súbežné podávanie iných sympatomimetík (samotných alebo ako súčasť kombinovanej liečby) môže potenciovať nežiaduce reakcie na Hirobriz Breezhaler.
Hirobriz Breezhaler sa nemá používať súčasne s inými beta2-adrenergnými agonistami s dlhým
účinkom alebo s liekmi obsahujúcimi beta2-adrenergné agonisty s dlhým účinkom.
Hypokaliemizujúcaliečba
Súbežná hypokaliemizujúca liečba derivátmi metylxantínu, steroidmi alebo diuretikami nešetriacimi draslík môže potenciovať možný hypokaliemizujúci účinok beta2-adrenergných agonistov, preto sa pri nej vyžaduje opatrnosť (pozri časť 4.4).
Beta
-
a
d
r
e
n
e
r
gn
é blokátory
Beta-adrenergné blokátory a beta2-adrenergné agonisty môžu pri súbežnom podávaní navzájom oslabiť alebo antagonizovať svoj účinok. Preto sa indakaterol nemá podávať súčasne s beta- adrenergnými blokátormi (vrátane očných kvapiek), pokiaľ na ich používanie nie je závažný dôvod. Podľa potreby sa majú uprednostniť kardioselektívne beta-adrenergné blokátory, avšak musia sa podávať opatrne.
Metabolické interakcie a interakcie na úrovni transportérov
Inhibícia kľúčových látok podieľajúcich sa na klírense indakaterolu, CYP3A4 a glykoproteínu P (P- gp) zvyšuje systémovú expozíciu indakaterolu až na dvojnásobok. Miera zvýšenia expozície v dôsledku interakcií však nepredstavuje žiadny bezpečnostný problém vzhľadom na skúsenosti s bezpečnosťou liečby liekom Hirobriz Breezhaler počas klinických štúdií trvajúcich až jeden rok pri dávkach až dvojnásobných oproti maximálnej odporúčanej terapeutickej dávke.
Pri indakaterole sa nepreukázali interakcie s inými súbežne podávanými liekmi. Štúdie in vitro ukázali, že indakaterol má zanedbateľný potenciál vyvolávať metabolické interakcie s inými liekmi pri hladinách systémovej expozície, ktoré sa dosahujú v klinickej praxi.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití indakaterolu u gravidných žien. Štúdie na zvieratách nepreukázali priame alebo nepriame účinky z hľadiska reprodukčnej toxicity pri klinicky významných expozíciách (pozri časť 5.3). Indakaterol, tak ako iné beta2-adrenergné agonisty, môže inhibovať pôrodné kontrakcie relaxačným účinkom na hladké svalstvo maternice. Hirobriz Breezhaler sa má používať v gravidite len vtedy, ak očakávaný prínos je väčší ako potenciálne riziká.
Laktácia
Nie je známe, či sa indakaterol/metabolity vylučujú do ľudského mlieka. Dostupné farmakokinetické/toxikologické údaje u zvierat preukázali vylučovanie indakaterolu/metabolitov do mlieka (pozri časť 5.3). Riziko u dojčiat nemôže byť vylúčené. Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu liekom Hirobriz Breezhaler sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Znížený podiel gravidít sa pozoroval u potkanov. Napriek tomu sa nepovažuje za pravdepodobné, že indakaterol po inhalácii maximálnej odporúčanej dávky ovplyvní reprodukciu alebo fertilitu u ľudí (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Hirobriz Breezhaler nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilulieku
Najčastejšími nežiaducimi reakciami pri odporúčaných dávkach boli nazofaryngitída (14,3 %), infekcia horných dýchacích ciest (14,2 %), kašeľ (8,2 %), bolesť hlavy (3,7 %) a svalové kŕče (3,5 %). Tieto reakcie boli vo väčšine prípadov mierne až stredne závažné a vyskytovali sa zriedkavejšie pri pokračujúcej liečbe.


Profil nežiaducich reakcií pri odporúčaných dávkach lieku Hirobriz Breezhaler u pacientov s CHOCHP ukazuje klinicky nevýznamné systémové účinky beta2-adrenergnej stimulácie. Priemerné zmeny frekvencie srdca boli nižšie ako jeden úder za minútu, tachykardia sa nevyskytovala často
a hlásená bola s podobným výskytom ako pri podávaní placeba. V porovnaní s placebom sa nezistili významné predĺženia intervalu QTcF. Frekvencia pozorovateľných predĺžení intervalov QTcF [t.j.
>450 ms (u mužov) a >470 ms (u žien)] a hlásenia o hypokaliémii boli podobné ako pri placebe. Priemer maximálnych zmien hladín glukózy v krvi bol podobný pri lieku Hirobriz Breezhaler a pri placebe.
TabuľkovýsúhrnnežiaducichreakciíDo fázy III programu klinického vývoja lieku Hirobriz Breezhaler boli zaradení pacienti s klinickou diagnózou stredne ťažkej až ťažkej CHOCHP. 4 764 pacientov dostávalo indakaterol do jedného roka v dávkach až do dvojnásobku maximálnej odporúčanej dávky. 2 611 z týchto pacientov dostávalo 150 mikrogramov indakaterolu raz denne a 1 157 pacientov dostávalo 300 mikrogramov
raz denne. Asi 41 % pacientov malo ťažkú CHOCHP. Priemerný vek pacientov bol 64 rokov, pričom
48 % pacientov bolo vo veku 65 rokov a starších a väčšina z nich (80 %) boli belosi.
Nežiaduce reakcie uvedené v Tabuľke č. 1 sú zoradené podľa tried orgánových systémov MedDRA v databáze údajov o bezpečnosti pri CHOCHP. V rámci každej triedy orgánových systémov sú nežiaduce reakcie usporiadané v poradí klesajúcej frekvencie podľa nasledujúcej konvencie: Veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až
<1/1 000); veľmi zriedkavé (<1/10 000); neznáme (z dostupných údajov).
Tabuľka č. 1 Nežiaduce reakcieNežiaduce reakcie Kategória frekvencieInfekcie a nákazyInfekcia horných dýchacích ciest Časté Nazofaryngitída Časté Sínusitída Časté
Poruchy imunitného systémuPrecitlivenosť1 Menej časté
Poruchy metabolizmu a výživyDiabetes mellitus a hyperglykémia Menej časté
Poruchy nervového systémuBolesť hlavy Časté Závraty Časté Parestézie Menej časté
Poruchy srdca a srdcovej činnostiIschemická choroba srdca Menej časté
Fibrilácia predsiení Menej časté Palpitácie Menej časté Tachykardia Menej časté
Poruchy dýchacej sústavy, hrudníka a mediastínaKašeľ Časté
Orofaryngálna bolesť vrátane podráždenia hrdla Časté Rinorea Časté Paradoxný bronchospazmus Menej časté
Poruchy kože a podkožného tkanivaPruritus/exantém Menej časté
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaSvalové kŕče Časté
Myalgia Menej časté

Bolesť svalov a kostí Menej časté
Celkové poruchy a reakcie v mieste podaniaBolesť v hrudníku Časté
Periférny edém Časté
1 Po uvedení lieku Hirobriz Breezhaler na trh sa v súvislosti s jeho použitím vyskytli hlásenia
o precitlivenosti. Hlásenia boli dobrovoľné a pochádzali od populácie neurčenej veľkosti, preto nie je vždy možné spoľahlivo odhadnúť frekvenciu alebo stanoviť príčinnú súvislosť s expozíciou lieku. Frekvencia sa preto vyrátala zo skúseností z klinických skúšaní.
Bezpečnostný profil lieku Hirobriz Breezhaler pri 600 mikrogramoch raz denne bol celkovo podobný
profilu pri odporúčaných dávkach. Ďalšia nežiaduca reakcia bola tremor (častá).
OpisvybranýchnežiaducichreakciíV klinických štúdiách fázy III pozoroval zdravotnícky personál počas klinických návštev, že v priemere u 17-20 % pacientov sa vyskytol sporadický kašeľ, ktorý sa obvykle objavil do 15 sekúnd po inhalácii a zvyčajne trval 5 sekúnd (asi 10 sekúnd u aktívnych fajčiarov). Pozoroval sa častejšie u pacientok než u pacientov a u aktívnych fajčiarov než u bývalých fajčiarov. Tento kašeľ vyskytujúci sa po inhalácii u žiadneho pacienta nemal za následok ukončenie účasti v štúdiách pri odporúčaných dávkach (kašeľ je príznakom CHOCHP a iba 8,2 % pacientov hlásilo kašeľ ako nežiaducu udalosť). Nie sú žiadne dôkazy o tom, že kašeľ objavujúci sa po inhalácii súvisí s bronchospazmom, exacerbáciami, zhoršením ochorenia alebo stratou účinnosti lieku.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 PredávkovanieJednorazové dávky predstavujúce 10-násobok maximálnej odporúčanej terapeutickej dávky u pacientov s CHOCHP vyvolali stredne závažné zvýšenie frekvencie srdca, systolického krvného tlaku a predĺženie intervalu QTc.
Predávkovanie indakaterolom má pravdepodobne za následok zosilnenie účinkov charakteristických pre beta2-adrenergné stimulanty, t.j. tachykardiu, tremor, palpitácie, bolesť hlavy, nauzeu, vracanie, ospalosť, komorové arytmie, metabolickú acidózu, hypokaliémiu a hyperglykémiu.
Indikovaná je podporná a symptomatická liečba. V závažných prípadoch majú byť pacienti hospitalizovaní. Je možné zvážiť podanie kardioselektívnych beta-blokátorov, avšak iba pod lekárskym dohľadom a s mimoriadnou opatrnosťou, pretože použitie beta-adrenergných blokátorov môže vyvolať bronchospazmus.
5
. FARMAKOLOGICKÉ VLASTNOSTI
5
.
1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: liečivá proti obštrukčným chorobám dýchacích ciest, selektívne
agonisty beta2-adrenergných receptorov, ATC kód: R03AC18
Mechanizmus účinku
Farmakologické účinky agonistov beta2-adrenergných receptorov možno aspoň čiastočne pripísať stimulácii intracelulárnej adenylátcyklázy, enzýmu katalyzujúcemu premenu adenozíntrifosfátu (ATP) na cyklický-3’, 5’-adenozínmonofosfát (cyklický monofosfát). Zvýšené hladiny cyklického AMP spôsobujú uvoľnenie hladkého svalstva priedušiek. Štúdie in vitro preukázali, že indakaterol, dlhodobo účinkujúci beta2-adrenergný agonista, vykazuje viac ako 24-násobne vyššiu agonistickú aktivitu na beta2-receptoroch v porovnaní s beta1-receptormi a 20-násobne vyššiu agonistickú aktivitu v porovnaní s beta3-receptormi.
Po inhalácii pôsobí indakaterol lokálne v pľúcach ako bronchodilatancium. Indakaterol je čiastočný agonista na ľudských beta2-adrenergných receptoroch s nanomolárnou potenciou. V izolovanej ľudskej prieduške má indakaterol rýchly nástup účinku a dlhé trvanie účinku.
Hoci sú beta2-receptory prevládajúcimi adrenergnými receptormi v hladkom svalstve priedušiek a beta1-receptory prevládajúcimi receptormi v ľudskom srdci, nachádzajú sa v ľudskom srdci aj beta2- adrenergné receptory, ktoré tvoria 10-50 % z celkového počtu adrenergných receptorov. Presná funkcia beta2-adrenergných receptorov v srdci nie je známa, avšak ich prítomnosť zvyšuje pravdepodobnosť toho, že aj vysoko selektívne beta2-adrenergné agonisty môžu mať účinky na srdce.
Farmakodynamickéúčinky
Hirobriz Breezhaler podávaný raz denne v dávkach 150 a 300 mikrogramov vo viacerých klinických farmakodynamických štúdiách a štúdiách účinnosti zhodne vyvolával klinicky významné zlepšenie funkcie pľúc počas 24 hodín (merané ako úsilný výdych za jednu sekundu, FEV1). Nástup účinku
5 minút od inhalácie bol rýchly, so zvýšením FEV1 o 110-160 ml oproti východiskovej hodnote, porovnateľný s účinkom 200 mikrogramov rýchlo pôsobiaceho beta2-agonistu salbutamolu, a štatisticky významne rýchlejší ako salmeterol/flutikazón 50/500 mikrogramov. Priemerné maximálne zlepšenia FEV1 v rovnovážnom stave oproti východiskovej hodnote boli 250-330 ml.
Bronchodilatačný účinok nezávisel od času podávania, ráno alebo večer.
Preukázalo sa, že Hirobriz Breezhaler znižuje hyperinfláciu pľúc, čo má za následok zvýšenie
vdychovej kapacity pri fyzickej aktivite a v kľude v porovnaní s placebom.
Úč i n k y n a e l e k t ro f y zi o l ó g i u srd c a
Dvojito zaslepená, placebom i aktívne (moxifloxacínom) kontrolovaná štúdia so 404 zdravými dobrovoľníkmi trvajúca 2 týždne preukázala po opakovanom podávaní maximálne priemerné (intervaly spoľahlivosti 90 %) predĺženia intervalu QTcF (v milisekundách) o 2,66 (0,55; 4,77) pri dávke 150 mikrogramov, o 2,98 (1,02; 4,93) pri dávke 300 mikrogramov a o 3,34 (0,86; 5,82) pri dávke 600 mikrogramov. Preto pri odporúčaných terapeutických dávkach alebo pri dvojnásobku maximálnej odporúčanej dávky nie sú obavy z možnosti vyvolania arytmií súvisiacich s predĺžením intervalu QT. V rozmedzí hodnotených dávok sa nepreukázala súvislosť medzi koncentráciou
a delta QTc.
U 605 pacientov s CHOCHP v dvojito zaslepenej, placebom kontrolovanej klinickej štúdii fázy III
trvajúcej 26 týždňov nebol klinicky významný rozdiel vo vzniku arytmií pri monitorovaní počas
24 hodín pred začatím štúdie a až 3-krát počas 26 týždňov liečby medzi pacientmi, ktorí dostávali odporúčané dávky lieku Hirobriz Breezhaler, a pacientmi, ktorí dostávali placebo alebo boli liečení tiotropiom.
K
li
n
ic
k
á
ú
či
nno
s
ť
a
b
ez
p
eč
no
s
ť
Program klinického vývoja zahŕňal randomizované, kontrolované klinické štúdie u pacientov s klinickou diagnózou CHOCHP, z ktorých jedna trvala 12 týždňov, dve 6 mesiacov (jedna z nich bola predĺžená na jeden rok na vyhodnotenie bezpečnosti a znášanlivosti) a jedna 1 rok. V týchto štúdiách bola hodnotená funkcia pľúc a zdravotné ukazovatele, napr. dyspnoe, exacerbácie a kvalita života súvisiaca so zdravotným stavom.
Fu n k c i a p ľú c
Hirobriz Breezhaler podávaný raz denne v dávkach 150 mikrogramov a 300 mikrogramov preukázal klinicky významné zlepšenia funkcie pľúc. Dávka 150 mikrogramov vyvolala zvýšenie primárneho ukazovateľa v 12. týždni (minimálna hodnota FEV1 počas 24 hodín) o 130-180 ml v porovnaní s placebom (p<0,001) a zvýšenie o 60 ml v porovnaní so salmeterolom 50 mikrogramov dvakrát denne (p<0,001). Dávka 300 mikrogramov vyvolala zvýšenie o 170-180 ml v porovnaní s placebom (p<0,001) a zvýšenie o 100 ml v porovnaní s formoterolom 12 mikrogramov dvakrát denne (p<0,001). Obe dávky vyvolali zvýšenie o 40-50 ml v porovnaní s otvoreným podávaním tiotropia
18 mikrogramov raz denne (150 mikrogramov, p=0,004; 300 mikrogramov, p=0,01). Bronchodilatačný účinok lieku Hirobriz Breezhaler trvajúci 24 hodín sa udržal od prvej dávky počas celého jednoročného obdobia liečby bez dôkazov o poklese účinnosti (tachyfylaxia).
Prínosy v zh ľa d o m n a symptómy
Obidve dávky preukázali v porovnaní s placebom štatisticky významné zlepšenie vzhľadom na zmiernenie symptómov dyspnoe a na zdravotný stav (vyhodnotené pomocou indexu prechodného dyspnoe [Transitional Dyspnoea Index, TDI] a St. George’s Respiratory Questionnaire [SGRQ]). Miera odpovede bola spravidla väčšia, než aká sa pozorovala pri aktívnych komparátoroch (Tabuľka č. 2). Okrem toho pacienti liečení liekom Hirobriz Breezhaler potrebovali významne menej záchranných liekov, v porovnaní s placebom mali viac dní, keď nepotrebovali žiadny záchranný liek a mali významne lepší percentuálny podiel dní, keď nemali symptómy cez deň.
Spoločná analýza účinnosti 6-mesačnej liečby ukázala, že výskyt exacerbácií CHOCHP bol
štatisticky významne nižší ako pri placebe. Porovnanie liečby s placebom ukázalo pomer výskytu
0,68 (95% IS [0,47; 0,98]; hodnota p 0,036) pri 150 mikrogramoch a 0,74 (95% IS [0,56; 0,96];
hodnota p 0,026) pri 300 mikrogramoch.
Skúsenosti s liečbou osôb, ktoré sú pôvodom z Afriky, sú obmedzené.
Tabuľka č. 2 Zmiernenie symptómov po 6 mesiacoch liečby
L
i
eče
bn
á
d
ávka
(
m
i
k
r
ogramy)
P
erce
n
t
u
álny
I
nd
a
k
aterol
150
r
az denne
57 a
Indakaterol
300
raz denne
Tiotropium
18
raz denne
Salmeterol
50
dvakrát denne
54 a
Formoterol
12
dvakrát denne
Placebo
45 a
 p
odiel pacientov,
k
t
orí dosiahli
M
C
I
D podľa TDI
†
P
erce
n
t
u
álny podiel pacientov, ktorí dosiahli MCID podľa SGRQ
†
p
odiel pacientov,
k
t
orí dosiahli
M
C
I
D podľa TDI
†
P
erce
n
t
u
álny podiel pacientov, ktorí dosiahli MCID podľa SGRQ
†
62 b 71 b
59 c
53 a
58 b 53 b
55 c
57 b
47 b
49 a
54 c
51 c
47 b
41 c
38 a
46 b
40 c
Z
n
í
že
n
i
e podaní/deň záchranného lieku oproti východiskovej hodnote
P
erce
n
t
u
álny podiel dní bez použitia záchranných liekov
1,3 a
1,5 b 1,6 b 1,0 b
60 a
57 b 58 b 46 b
1,2 a
55 a
n/e
n/e
0,3 a
0,4 b
42 a
42 b
Usporiadanie štúdie s a: indakaterol 150 mikrogramov, salmeterol a placebo; b: indakaterol 150 a
300 mikrogramov, tiotropium a placebo; c: indakaterol 300 mikrogramov, formoterol a placebo
† MCID = minimálny klinicky významný rozdiel (zmena ≥1 bod podľa TDI, zmena ≥4 body podľa
SGRQ)
n/e = nevyhodnotené po šiestich mesiacoch
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom Hirobriz Breezhaler vo všetkých podskupinách pediatrickej populácie pre chronickú obštrukčnú chorobu pľúc (CHOCHP) (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiIndakaterol je chirálna molekula s R-konfiguráciou.
Farmakokinetické údaje sa získali v niekoľkých klinických štúdiách so zdravými dobrovoľníkmi a pacientmi s CHOCHP.
AbsorpciaMedián času do dosiahnutia maximálnych koncentrácií indakaterolu v sére bol približne 15 minút po jednorazovej alebo opakovaných inhalovaných dávkach. Systémová expozícia indakaterolu sa zvyšovala so zvyšujúcou sa dávkou (150 mikrogramov až 600 mikrogramov) úmerne dávke. Absolútna biologická dostupnosť indakaterolu po inhalácii dávky bola v priemere 43 % až 45 %. Systémová expozícia je daná kombináciou pľúcnej a gastrointestinálnej absorpcie; asi 75 % systémovej expozície bolo dôsledkom pľúcnej absorpcie a asi 25 % gastrointestinálnej absorpcie.
Koncentrácie indakaterolu v sére sa zvýšili po opakovanom podávaní raz denne. Rovnovážny stav sa dosiahol do 12 až 14 dní. Priemerný pomer akumulácie indakaterolu, t.j. AUC počas 24-hodinového dávkovacieho intervalu na 14. deň v porovnaní s 1. dňom, bol v rozmedzí od 2,9 do 3,5 pri dávkach medzi 150 mikrogramami a 600 mikrogramami inhalovanými raz denne.
DistribúciaPo intravenóznej infúzii bol distribučný objem indakaterolu vo fáze konečnej eliminácie 2557 litrov, čo naznačuje rozsiahlu distribúciu. Väzba
in vitro na ľudské sérové bielkoviny bola 94,1-95,3 % a na plazmatické bielkoviny 95,1-96,2 %.
BiotransformáciaPo perorálnom podaní rádioaktívne značeného indakaterolu v štúdii ADME (absorpcia, distribúcia, metabolizmus, vylučovanie) u ľudí bol hlavnou zložkou v sére nezmenený indakaterol, na ktorý pripadala približne jedna tretina celkovej AUC súvisiacej s liečivom počas 24 hodín. Najvýznamnejším metabolitom v sére bol hydroxylovaný derivát. Ďalšími významnými metabolitmi boli fenolické O-glukuronidy indakaterolu a hydroxylovaný indakaterol. Diastereoizomér hydroxylovaného derivátu, N-glukuronid indakaterolu, a C- a N-dealkylované produkty boli ďalšími identifikovanými metabolitmi.
Skúmanie in vitro naznačilo, že UGT1A1 je jediná izoforma UGT, ktorá metabolizovala indakaterol na fenolický O-glukuronid. Oxidatívne metabolity sa našli pri inkubáciách s rekombinantnými CYP1A1, CYP2D6 a CYP3A4. Usudzuje sa, že CYP3A4 je hlavný m izoenzýmom zodpovedným za hydroxyláciu indakaterolu. Skúmanie in vitro ďalej naznačilo, že indakaterol je substrát s nízkou afinitou k efluxnej pumpe P-gp.
Eliminácia
V klinických štúdiách, v ktorých sa vykonával zber moču, bolo množstvo nezmeneného indakaterolu vylúčeného do moču spravidla nižšie ako 2 % dávky. Obličkový klírens indakaterolu bol v priemere medzi 0,46 a 1,20 litrov/hodinu. V porovnaní so sérovým klírensom indakaterolu 23,3 litrov/hodinu
je zjavné, že obličkový klírens zohráva pri eliminácii systémovo dostupného indakaterolu malú úlohu
(približne 2 až 5 % systémového klírensu).
V štúdii ADME u ľudí, v ktorej sa indakaterol podával perorálne, vylučovanie do stolice prevládalo nad vylučovaním do moču. Indakaterol sa vylučoval do ľudskej stolice predovšetkým v nezmenenej forme (54 % dávky) a v menšej miere ako hydroxylované metabolity (23 % dávky). Hmotnostná rovnováha bola úplná, vo výlučkoch sa našlo ≥90 % dávky.
Koncentrácie indakaterolu v sére klesali viacfázovo, s priemerným konečným eliminačným polčasom v rozmedzí od 45,5 do 126 hodín. Efektívny biologický polčas vyrátaný z akumulácie indakaterolu po opakovanom podávaní bol v rozmedzí od 40 do 52 hodín, čo je v súlade s pozorovaným časom do dosiahnutia rovnovážneho stavu približne 12-14 dní.
Osobitné populácie
Analýza farmakokinetiky u populácií preukázala, že vek (dospelí do 88 rokov), pohlavie, hmotnosť (32-168 kg), ani rasa klinicky významne neovplyvňujú farmakokinetiku indakaterolu. Analýza u tejto populácie nenaznačuje rozdiely medzi etnickými podskupinami.
U pacientov s ľahkou a stredne ťažkou poruchou funkcie pečene sa neprejavili významné zmeny Cmax alebo AUC indakaterolu, rovnako sa nelíšila väzba na bielkoviny medzi osobami s ľahkou a stredne ťažkou poruchou funkcie pečene a zdravými osobami v kontrolnej skupine. Štúdie u osôb s ťažkou poruchou funkcie pečene sa nevykonali.
Vzhľadom na veľmi nízky podiel vylučovania močom na celkovej eliminácii z tela sa štúdia u osôb s poruchou funkcie obličiek nevykonala.
5.3 Predklinické údaje o bezpečnosti
Účinky na kardiovaskulárny systém, ktoré možno pripísať vlastnostiam indakaterolu ako beta2- agonistu, zahŕňali tachykardiu, arytmie a lézie myokardu u psov. U hlodavcov sa pozorovalo mierne podráždenie nosovej dutiny a hrtanu. Všetky tieto nálezy sa objavili pri expozíciách, ktoré dostatočne presahovali expozíciu predpokladanú u ľudí.
Hoci indakaterol nemal vplyv na celkový reprodukčný výkon v štúdii fertility u potkanov, pokles počtu gravidných samíc v potomstve F1 sa pozoroval v štúdii peri- a postnatálneho vývoja u potkanov pri 14-násobne vyššej expozícii ako u ľudí, ktorým sa podáva Hirobriz Breezhaler. Indakaterol nebol embryotoxický ani teratogénny u potkanov alebo králikov.
V štúdiách genotoxicity sa nezistil žiadny mutagénny ani klastogénny potenciál. Karcinogenita sa hodnotila v dvojročnej štúdii na potkanoch a šesťmesačnej štúdii na transgenických myšiach. Zvýšená incidencia benígneho leiomyómu vaječníkov a fokálna hyperplázia hladkého svalstva vaječníkov u potkanov sa zhodovala s podobnými nálezmi hlásenými u iných beta2-adrenergných agonistov. U myší nebol pozorovaný žiadny dôkaz karcinogenity. Systémové expozície (AUC) u potkanov a myší pri hladinách bez pozorovaných nežiaducich účinkov v týchto štúdiách boli najmenej 7- a 49-násobne vyššie ako u ľudí, ktorým sa podával Hirobriz Breezhaler v dávke
300 mikrogramov denne.
6
. FARMACEUTICKÉ INFORMÁCIE
6
.
1 Zoznam pomocných látok
O
b
s
a
h kapsuly
Monohydrát laktózy
Telo kapsuly
Želatína
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
30 mesiacov.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30°C.
Uchovávajte v blistri na ochranu pred vlhkosťou a vyberte z balenia až bezprostredne pred použitím.
6.5 Druh obalu a obsah balenia
Hirobriz Breezhaler je inhalačná pomôcka na podanie jednorazovej dávky. Spodná časť inhalátora a viečko sú vyrobené z akrylonitryl-butadién-styrénu, tlačidlá sú vyrobené z metylmetakrylát- akrylonitryl-butadién-styrénu. Ihly a pružiny sú vyrobené s nehrdzavejúcej ocele.
Blister PA/Al/PVC - Al obsahujúci 10 tvrdých kapsúl.
Škatuľa obsahujúca 10 kapsúl a jeden inhalátor Hirobriz Breezhaler.
Škatuľa obsahujúca 30 kapsúl a jeden inhalátor Hirobriz Breezhaler.
Spoločné balenie pozostávajúce z 2 balení (každé obsahuje 30 kapsúl a 1 inhalátor). Spoločné balenie pozostávajúce z 3 balení (každé obsahuje 30 kapsúl a 1 inhalátor). Spoločné balenie pozostávajúce z 30 balení (každé obsahuje 10 kapsúl a 1 inhalátor).
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Každý inhalátor sa má zlikvidovať po 30 dňoch používania.
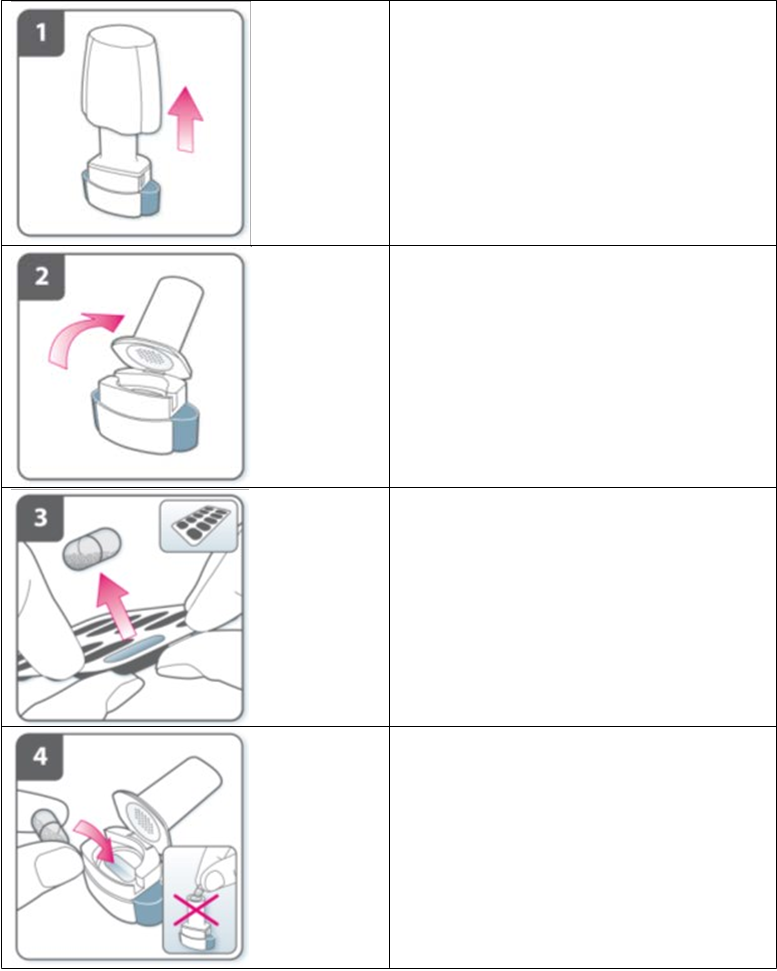 P
o
k
yn
y na zaobchádzanie a použitieOdstráňte viečko.Otvorte inhalátor:
P
o
k
yn
y na zaobchádzanie a použitieOdstráňte viečko.Otvorte inhalátor:Pevne držte spodnú časť inhalátora a odklopte náustok. Týmto sa inhalátor otvorí.
Pripravte kapsulu:Bezprostredne pred použitím suchými rukami vyberte jednu kapsulu z blistra.
Vložte kapsulu:Kapsulu vložte do lôžka na kapsulu.
Kapsulu nikdy nevložte priamo do náustka.
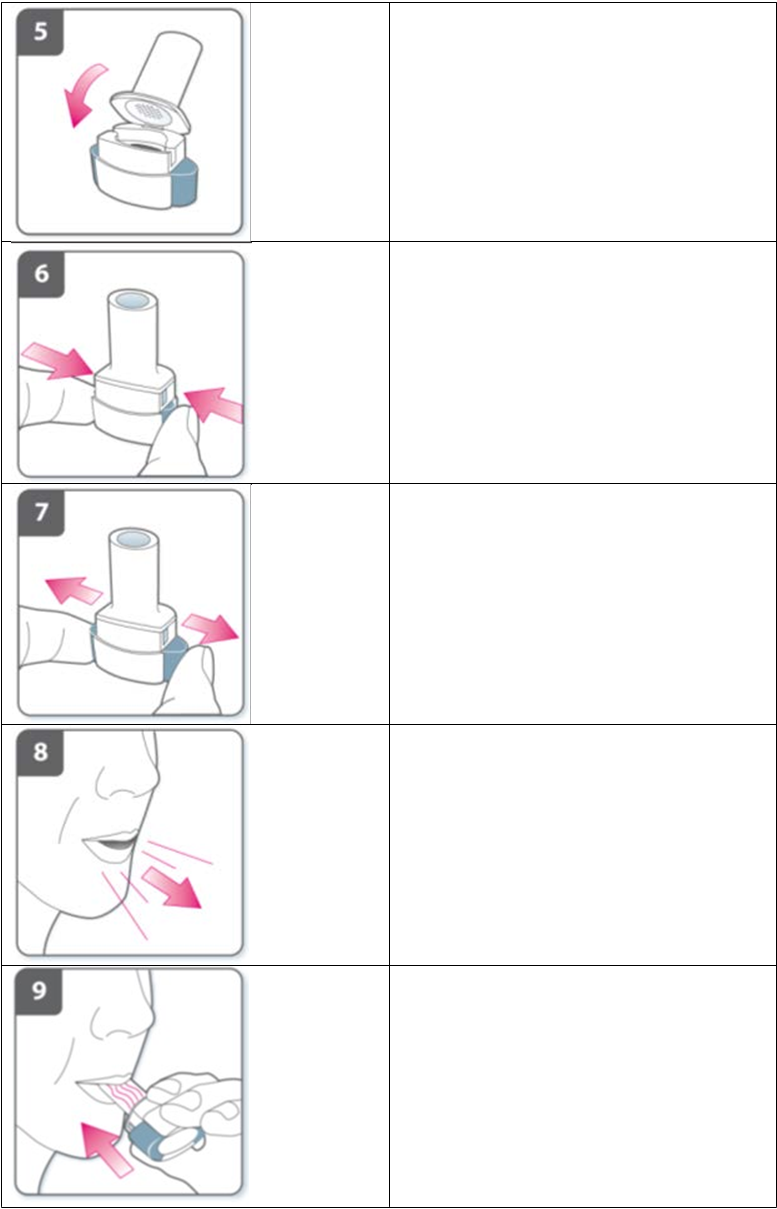 U
z
av
r
i
t
e inhalátor:
U
z
av
r
i
t
e inhalátor:
Uzavrite inhalátor tak, aby bolo počuť
„cvaknutie“.
Prepichnite kapsulu:· Inhalátor držte zvislo, s náustkom obráteným nahor.
· Silným stlačením obidvoch bočných tlačidiel súčasne prepichnite kapsulu.
Urobte to len raz.· Pri prepichnutí kapsuly by ste mali počuť
„cvaknutie“.
Úplne uvoľnite bočné tlačidlá.Vydýchnite:Skôr ako si vložíte do úst náustok, úplne vydýchnite.
Nevydychujte do náustka.Inhalujte liekVdýchnutie lieku hlboko do dýchacích ciest:
· Inhalátor držte tak, ako je to znázornené
na obrázku. Bočné tlačidlá majú smerovať doľava a doprava. Nestláčajte bočné tlačidlá.
· Vložte si náustok do úst a pevne ho obopnite perami.
· Vdýchnite rýchlo, ale rovnomerne a čo najhlbšie.
 Poznámka:
Poznámka:
Počas vdychovania cez inhalátor sa kapsula v lôžku otáča, takže by ste mali počuť vírivý zvuk. Pri prenikaní lieku do pľúc budete cítiť sladkú chuť.
Ďalšie informácieNiekedy sa cez ochrannú mriežku do úst môžu dostať veľmi malé kúsky kapsuly. Ak sa to stane, môžete ich pocítiť na jazyku. Prehltnutie alebo vdýchnutie týchto kúskov nie je nebezpečné. Pravdepodobnosť roztrieštenia kapsuly sa zvýši, ak nechtiac prepichnete kapsulu viac ako raz (krok č. 6).
Ak nepočujete vírivý zvuk:Kapsula môže byť zaseknutá v lôžku. Ak sa to stane:
· Otvorte inhalátor a kapsulu opatrne uvoľnite poklopaním na spodnú časť inhalátora. Nestláčajte bočné tlačidlá.
· Inhalujte liek znovu opakovaním krokov
č. 8 a 9.
Zadržte dych:Po vdýchnutí lieku:
· Zadržte dych minimálne na 5-10 sekúnd alebo aspoň tak dlho, pokiaľ vám to nie je nepríjemné a vyberte pritom inhalátor z úst.
· Potom vydýchnite.
· Otvorte inhalátor a skontrolujte, či v
kapsule neostal zvyšok prášku.
Ak je ešte v kapsule zvyšok prášku:· Uzavrite inhalátor.
· Zopakujte kroky č. 8, 9, 10 a 11.
Väčšina ľudí dokáže obsah kapsuly vyprázdniť
jedným alebo dvoma vdýchnutiami.
Ďalšie informácieNiektorí ľudia môžu ihneď po inhalácii občas krátko kašlať. Ak sa to stane, nemusíte mať obavy. Pokiaľ je kapsula prázdna, použili ste dostatok lieku.
 Po skončení podania
Po skončení podania lieku:
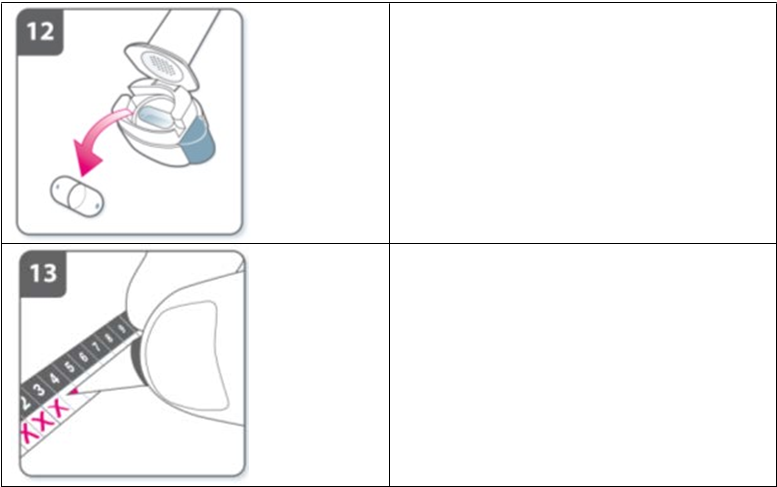
· Znovu odklopte náustok a prázdnu kapsulu odstráňte klopkaním na lôžko kapsuly. Prázdnu kapsulu zahoďte medzi odpadky.
· Zatvorte inhalátor a nasaďte viečko.
Kapsuly neuchovávajte v inhalátore HirobrizBreezhaler.Zaznačte si použitie dennej dávky:Vo vnútri balenia je pomôcka na zaznamenanie dennej dávky. Urobte si značku do dnešného okienka, ak vám to pomôže pripomenúť si, kedy máte použiť ďalšiu dávku.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovartis Europharm Limited Frimley Business Park Camberley GU16 7SR
Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/09/594/001-005
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 30. november 2009
Dátum posledného predĺženia registrácie: 18. september 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1
. NÁZOV LIEKU
Hirobriz Breezhaler 300 mikrogramov inhalačný prášok v tvrdých kapsulách
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEKaždá kapsula obsahuje indakateróliummaleinát zodpovedajúci 300 mikrogramom indakaterolu. Dávka podaná cez náustok inhalátora obsahuje indakateróliummaleinát v množstve zodpovedajúcom
240 mikrogramom indakaterolu.
Pomocné látky soznámymúčinkom:Každá kapsula obsahuje 24,6 mg laktózy.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMAInhalačný prášok v tvrdej kapsule
Priehľadné (nefarbené) kapsuly obsahujúce biely prášok, s označením „IDL 300“ vytlačeným modrou farbou nad modrým prúžkom a logom spoločnosti (
) vytlačeným modrou farbou pod modrým prúžkom.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieHirobriz Breezhaler je indikovaný na udržiavaciu bronchodilatačnú liečbu pri obštrukcii dýchacích
ciest u dospelých pacientov s chronickou obštrukčnou chorobou pľúc (CHOCHP).
4.2 Dávkovanie a spôsob podávaniaDávkovanieOdporúčanou dávkou je inhalácia obsahu jednej 150-mikrogramovej kapsuly raz denne pomocou inhalátora Hirobriz Breezhaler. Dávka sa má zvýšiť iba na pokyn lekára.
Inhalácia obsahu jednej 300-mikrogramovej kapsuly pomocou inhalátora Hirobriz Breezhaler raz denne preukázala ďalší klinický prínos pri dýchavičnosti, predovšetkým u pacientov so závažnou CHOCHP. Maximálna dávka je 300 mikrogramov raz denne.
Hirobriz Breezhaler sa má podávať každý deň v rovnakom čase.
V prípade vynechania dávky sa má ďalšia dávka použiť v obvyklom čase na ďalší deň.
Osobitné populácieStarší pacientiMaximálna koncentrácia v plazme a celková systémová expozícia stúpajú s vekom, úprava dávky u
starších pacientov sa však nevyžaduje.
P
o
rucha funkcie pečene
U pacientov s ľahkou a stredne ťažkou poruchou funkcie pečene nie je úprava dávkovania potrebná. Nie sú dostupné údaje o použití lieku Hirobriz Breezhaler u pacientov s ťažkou poruchou funkcie pečene.
Porucha funkcie obličiekNie je potrebná úprava dávkovania u pacientov s poruchou funkcie obličiek.
Pediatrická populácia
Použitie lieku Hirobriz Breezhaler sa netýka pediatrickej populácie (menej ako 18 rokov).
Spôsob podávaniaLen na inhalačné použitie. Kapsuly Hirobriz Breezhaler sa nesmú prehĺtať.
Kapsuly sa smú vybrať z blistra len bezprostredne pred použitím.
Kapsuly sa musia podávať iba pomocou inhalátora Hirobriz Breezhaler (pozri časť 6.6). Má sa používať inhalátor Hirobriz Breezhaler dodaný pri každom novom predpísaní lieku.
Pacientov je potrebné poučiť, ako majú liek správne používať. Pacientov, ktorých dýchacie ťažkosti sa nezlepšili, sa treba opýtať, či liek namiesto inhalovania neprehĺtajú.
Pokyny na zaobchádzanie s liekom pred podaním, pozri časť 6.6.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníAstmaHirobriz Breezhaler je beta2-adrenergný agonista s dlhým účinkom, ktorý je indikovaný len na CHOCHP a nemá sa používať pri astme, pretože nie sú dostupné údaje o výsledkoch dlhodobého používania pri astme.
Beta2-adrenergné agonisty s dlhým účinkom môžu zvýšiť riziko závažných nežiaducich udalostí
súvisiacich s astmou, vrátane úmrtí súvisiacich s astmou, keď sa používajú na liečbu astmy.
PrecitlivenosťOkamžité reakcie z precitlivenosti boli hlásené po podaní lieku Hirobriz Breezhaler. Ak sa vyskytnú príznaky poukazujúce na alergické reakcie (najmä ťažkosti s dýchaním alebo prehĺtaním, edém jazyka, pier a tváre, urtikária, kožný exantém), Hirobriz Breezhaler sa má okamžite vysadiť a má sa začať alternatívna liečba.
Paradoxný bronchospazmusPodávanie lieku Hirobriz Breezhaler, tak ako aj iná inhalačná liečba, môže spôsobiť paradoxný bronchospazmus, potenciálne ohrozujúci život. V prípade výskytu paradoxného bronchospazmu sa má podávanie lieku Hirobriz Breezhaler okamžite ukončiť a nahradiť alternatívnou liečbou.
ZhoršenieochoreniaHirobriz Breezhaler nie je indikovaný na liečbu akútnych záchvatov bronchospazmu, t.j. ako záchranná liečba. Pri zhoršení CHOCHP počas liečby liekom Hirobriz Breezhaler je potrebné znovu vyhodnotiť stav pacienta a režim liečby CHOCHP. Zvýšenie dennej dávky lieku Hirobriz Breezhaler nad maximálnu dávku 300 mikrogramov nie je vhodné.
S
y
s
té
m
ov
é
ú
či
n
k
y
Hoci sa po podaní odporúčaných dávok lieku Hirobriz Breezhaler obvykle nepozorujú žiadne klinicky významné účinky na kardiovaskulárny systém, tak ako aj iné beta 2-adrenergné agonisty sa má indakaterol podávať s opatrnosťou pacientom s kardiovaskulárnymi ochoreniami (ochorenie koronárnych artérií, akútny infarkt myokardu, srdcové arytmie, hypertenzia), pacientom s konvulzívnymi poruchami alebo tyreotoxikózou, ako i pacientom s neprimeranými reakciami na beta2-adrenergné agonisty.
Účinkynakardiovaskulárnysystém
Indakaterol, tak ako iné beta2-adrenergné agonisty, môže mať u niektorých pacientov klinicky významný účinok na kardiovaskulárny systém, čo sa môže prejaviť ako zvýšená srdcová frekvencia, zvýšený krvný tlak a/alebo iné symptómy. V prípade výskytu tak ýchto účinkov môže byť potrebné liečbu ukončiť. Okrem toho sa zaznamenali zmeny v elektrokardiograme (EKG) vyvolané beta - adrenergnými agonistami, napr. sploštenie vlny T, predĺženie intervalu QT a depresia segmentu ST, klinická významnosť týchto pozorovaní však nie je známa. Preto sa majú beta2-adrenergné agonisty
s dlhým účinkom, napr. Hirobriz Breezhaler, používať opatrne u pacientov so známym alebo
suspektným predĺžením intervalu QT alebo liečených liekmi, ktoré majú účinok na interval QT.
Pri používaní odporúčaných terapeutických dávok sa v klinických štúdiách lieku Hirobriz
Breezhaler nepozorovali klinicky významné účinky na predĺženie intervalu QTc (pozri časť 5.1).
Hypokaliémia
U niektorých pacientov môžu beta2-adrenergné agonisty spôsobiť významnú hypokaliémiu, ktorá môže vyvolať nežiaduce účinky na kardiovaskulárny systém. Zníženie hladiny draslíka v sére je obyčajne prechodné a nevyžaduje suplementáciu. U pacientov s ťažkou CHOCHP môže hypoxia a súčasná liečba ďalšími liekmi potenciovať hypokaliémiu (pozri časť 4.5), čo môže zvýšiť náchylnosť na srdcové arytmie.
Hyperglykémia
Inhalácia vysokých dávok beta2-adrenergných agonistov môže viesť k zvýšeniu hladiny glukózy v plazme. U pacientov s diabetes mellitus sa má dôslednejšie sledovať glykémia na začiatku liečby liekom Hirobriz Breezhaler.
Počas klinických štúdií boli klinicky významné zmeny hladiny glukózy v krvi o 1-2 % spravidla častejšie pri odporúčaných dávkach lieku Hirobriz Breezhaler než pri placebe. Hirobriz Breezhaler sa neskúmal u pacientov s nedostatočne kompenzovaným diabetes mellitus.
Pomocné látky
Kapsuly obsahujú laktózu. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, laponského deficitu laktázy alebo glukózogalaktózovej malabsorpcie nesmú používať tento liek.
4.5 Liekové a iné interakcie
Sympatomimetiká
Súbežné podávanie iných sympatomimetík (samotných alebo ako súčasť kombinovanej liečby) môže potenciovať nežiaduce reakcie na Hirobriz Breezhaler.
Hirobriz Breezhaler sa nemá používať súčasne s inými beta2-adrenergnými agonistami s dlhým
účinkom alebo s liekmi obsahujúcimi beta2-adrenergné agonisty s dlhým účinkom.
Hypokaliemizujúcaliečba
Súbežná hypokaliemizujúca liečba derivátmi metylxantínu, steroidmi alebo diuretikami nešetriacimi draslík môže potenciovať možný hypokaliemizujúci účinok beta2-adrenergných agonistov, preto sa pri nej vyžaduje opatrnosť (pozri časť 4.4).
Beta
-
a
d
r
e
n
e
r
gn
é blokátory
Beta-adrenergné blokátory a beta2-adrenergné agonisty môžu pri súbežnom podávaní navzájom oslabiť alebo antagonizovať svoj účinok. Preto sa indakaterol nemá podávať súčasne s beta- adrenergnými blokátormi (vrátane očných kvapiek), pokiaľ na ich používanie nie je závažný dôvod. Podľa potreby sa majú uprednostniť kardioselektívne beta-adrenergné blokátory, avšak musia sa podávať opatrne.
Metabolické interakcie a interakcie na úrovni transportérov
Inhibícia kľúčových látok podieľajúcich sa na klírense indakaterolu, CYP3A4 a glykoproteínu P (P- gp) zvyšuje systémovú expozíciu indakaterolu až na dvojnásobok. Miera zvýšenia expozície v dôsledku interakcií však nepredstavuje žiadny bezpečnostný problém vzhľadom na skúsenosti s bezpečnosťou liečby liekom Hirobriz Breezhaler počas klinických štúdií trvajúcich až jeden rok pri dávkach až dvojnásobných oproti maximálnej odporúčanej terapeutickej dávke.
Pri indakaterole sa nepreukázali interakcie s inými súbežne podávanými liekmi. Štúdie in vitro ukázali, že indakaterol má zanedbateľný potenciál vyvolávať metabolické interakcie s inými liekmi pri hladinách systémovej expozície, ktoré sa dosahujú v klinickej praxi.
4.6 Fertilita, gravidita a laktácia
Gravidita
Nie sú k dispozícii žiadne údaje o použití indakaterolu u gravidných žien. Štúdie na zvieratách nepreukázali priame alebo nepriame účinky z hľadiska reprodukčnej toxicity pri klinicky významných expozíciách (pozri časť 5.3). Indakaterol, tak ako iné beta2-adrenergné agonisty, môže inhibovať pôrodné kontrakcie relaxačným účinkom na hladké svalstvo maternice. Hirobriz Breezhaler sa má používať v gravidite len vtedy, ak očakávaný prínos je väčší ako potenciálne riziká.
Laktácia
Nie je známe, či sa indakaterol/metabolity vylučujú do ľudského mlieka. Dostupné farmakokinetické/toxikologické údaje u zvierat preukázali vylučovanie indakaterolu/metabolitov do mlieka (pozri časť 5.3). Riziko u dojčiat nemôže byť vylúčené. Rozhodnutie, či ukončiť dojčenie alebo či ukončiť/prerušiť liečbu liekom Hirobriz Breezhaler sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
Znížený podiel gravidít sa pozoroval u potkanov. Napriek tomu sa nepovažuje za pravdepodobné, že indakaterol po inhalácii maximálnej odporúčanej dávky ovplyvní reprodukciu alebo fertilitu u ľudí (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Hirobriz Breezhaler nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrnbezpečnostnéhoprofilulieku
Najčastejšími nežiaducimi reakciami pri odporúčaných dávkach boli nazofaryngitída (14,3 %), infekcia horných dýchacích ciest (14,2 %), kašeľ (8,2 %), bolesť hlavy (3,7 %) a svalové kŕče (3,5 %). Tieto reakcie boli vo väčšine prípadov mierne až stredne závažné a vyskytovali sa zriedkavejšie pri pokračujúcej liečbe.


Profil nežiaducich reakcií pri odporúčaných dávkach lieku Hirobriz Breezhaler u pacientov s CHOCHP ukazuje klinicky nevýznamné systémové účinky beta2-adrenergnej stimulácie. Priemerné zmeny frekvencie srdca boli nižšie ako jeden úder za minútu, tachykardia sa nevyskytovala často
a hlásená bola s podobným výskytom ako pri podávaní placeba. V porovnaní s placebom sa nezistili
významné predĺženia intervalu QTcF. Frekvencia pozorovateľných predĺžení intervalov QTcF [t.j.
>450 ms (u mužov) a >470 ms (u žien)] a hlásenia o hypokaliémii boli podobné ako pri placebe. Priemer maximálnych zmien hladín glukózy v krvi bol podobný pri lieku Hirobriz Breezhaler a pri placebe.
TabuľkovýsúhrnnežiaducichreakciíDo fázy III programu klinického vývoja lieku Hirobriz Breezhaler boli zaradení pacienti s klinickou diagnózou stredne ťažkej až ťažkej CHOCHP. 4 764 pacientov dostávalo indakaterol do jedného roka v dávkach až do dvojnásobku maximálnej odporúčanej dávky. 2 611 z týchto pacientov dostávalo 150 mikrogramov indakaterolu raz denne a 1 157 pacientov dostávalo 300 mikrogramov
raz denne. Asi 41 % pacientov malo ťažkú CHOCHP. Priemerný vek pacientov bol 64 rokov, pričom
48 % pacientov bolo vo veku 65 rokov a starších a väčšina z nich (80 %) boli belosi.
Nežiaduce reakcie uvedené v Tabuľke č. 1 sú zoradené podľa tried orgánových systémov MedDRA v databáze údajov o bezpečnosti pri CHOCHP. V rámci každej triedy orgánových systémov sú nežiaduce reakcie usporiadané v poradí klesajúcej frekvencie podľa nasledujúcej konvencie: Veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až
<1/1 000); veľmi zriedkavé (<1/10 000); neznáme (z dostupných údajov).
Tabuľka č. 1 Nežiaduce reakcieNežiaduce reakcie Kategória frekvencieInfekcie a nákazyNazofaryngitída Veľmi časté Infekcia horných dýchacích ciest Veľmi časté Sínusitída Časté
Poruchy imunitného systémuPrecitlivenosť1 Menej časté
Poruchy metabolizmu a výživyDiabetes mellitus a hyperglykémia Časté
Poruchy nervového systémuBolesť hlavy Časté Závraty Časté Parestézie Menej časté
Poruchy srdca a srdcovej činnostiIschemická choroba srdca Časté
Palpitácie Časté Fibrilácia predsiení Menej časté Tachykardia Menej časté
Poruchy dýchacej sústavy, hrudníka a mediastínaKašeľ Časté
Orofaryngálna bolesť vrátane podráždenia hrdla Časté Rinorea Časté Paradoxný bronchospazmus Menej časté
Poruchy kože a podkožného tkanivaPruritus/exantém Časté
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaSvalové kŕče Časté
Bolesť svalov a kostí Časté

Myalgia Menej časté
Celkové poruchy a reakcie v mieste podaniaBolesť v hrudníku Časté
Periférny edém Časté
1 Po uvedení lieku Hirobriz Breezhaler na trh sa v súvislosti s jeho použitím vyskytli hlásenia
o precitlivenosti. Hlásenia boli dobrovoľné a pochádzali od populácie neurčenej veľkosti, preto nie je vždy možné spoľahlivo odhadnúť frekvenciu alebo stanoviť príčinnú súvislosť s expozíciou lieku. Frekvencia sa preto vyrátala zo skúseností z klinických skúšaní.
Bezpečnostný profil lieku Hirobriz Breezhaler pri 600 mikrogramoch raz denne bol celkovo podobný
profilu pri odporúčaných dávkach. Ďalšia nežiaduca reakcia bola tremor (častá).
OpisvybranýchnežiaducichreakciíV klinických štúdiách fázy III pozoroval zdravotnícky personál počas klinických návštev, že v priemere u 17-20 % pacientov sa vyskytol sporadický kašeľ, ktorý sa obvykle objavil do 15 sekúnd po inhalácii a zvyčajne trval 5 sekúnd (asi 10 sekúnd u aktívnych fajčiarov). Pozoroval sa častejšie u pacientok než u pacientov a u aktívnych fajčiarov než u bývalých fajčiarov. Tento kašeľ vyskytujúci sa po inhalácii u žiadneho pacienta nemal za následok ukončenie účasti v štúdiách pri odporúčaných dávkach (kašeľ je príznakom CHOCHP a iba 8,2 % pacientov hlásilo kašeľ ako nežiaducu udalosť). Nie sú žiadne dôkazy o tom, že kašeľ objavujúci sa po inhalácii súvisí s bronchospazmom, exacerbáciami, zhoršením ochorenia alebo stratou účinnosti lieku.'
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v Prílohe V.
4.9 PredávkovanieJednorazové dávky predstavujúce 10-násobok maximálnej odporúčanej terapeutickej dávky u pacientov s CHOCHP vyvolali stredne závažné zvýšenie frekvencie srdca, systolického krvného tlaku a predĺženie intervalu QTc.
Predávkovanie indakaterolom má pravdepodobne za následok zosilnenie účinkov charakteristických pre beta2-adrenergné stimulanty, t.j. tachykardiu, tremor, palpitácie, bolesť hlavy, nauzeu, vracanie, ospalosť, komorové arytmie, metabolickú acidózu, hypokaliémiu a hyperglykémiu.
Indikovaná je podporná a symptomatická liečba. V závažných prípadoch majú byť pacienti hospitalizovaní. Je možné zvážiť podanie kardioselektívnych beta-blokátorov, avšak iba pod lekárskym dohľadom a s mimoriadnou opatrnosťou, pretože použitie beta-adrenergných blokátorov môže vyvolať bronchospazmus.
5
. FARMAKOLOGICKÉ VLASTNOSTI
5
.
1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: liečivá proti obštrukčným chorobám dýchacích ciest, selektívne agonisty beta2-adrenergných receptorov, ATC kód: R03AC18
Mechanizmus účinku
Farmakologické účinky agonistov beta2-adrenergných receptorov možno aspoň čiastočne pripísať stimulácii intracelulárnej adenylátcyklázy, enzýmu katalyzujúce mu premenu adenozíntrifosfátu (ATP) na cyklický-3’, 5’-adenozínmonofosfát (cyklický monofosfát). Zvýšené hladiny cyklického AMP spôsobujú uvoľnenie hladkého svalstva priedušiek. Štúdie in vitro preukázali, že indakaterol, dlhodobo účinkujúci beta2-adrenergný agonista, vykazuje viac ako 24-násobne vyššiu agonistickú aktivitu na beta2-receptoroch v porovnaní s beta1-receptormi a 20-násobne vyššiu agonistickú aktivitu v porovnaní s beta3-receptormi.
Po inhalácii pôsobí indakaterol lokálne v pľúcach ako bronchodilatancium. Indakaterol je čiastočný agonista na ľudských beta2-adrenergných receptoroch s nanomolárnou potenciou. V izolovanej ľudskej prieduške má indakaterol rýchly nástup účinku a dlhé trvanie účinku.
Hoci sú beta2-receptory prevládajúcimi adrenergnými receptormi v hladkom svalstve priedušiek a beta1-receptory prevládajúcimi receptormi v ľudskom srdci, nachádzajú sa v ľudskom srdci aj beta2- adrenergné receptory, ktoré tvoria 10-50 % z celkového počtu adrenergných receptorov. Presná funkcia beta2-adrenergných receptorov v srdci nie je známa, avšak ich prítomnosť zvyšuje pravdepodobnosť toho, že aj vysoko selektívne beta2-adrenergné agonisty môžu mať účinky na srdce.
Farmakodynamickéúčinky
Hirobriz Breezhaler podávaný raz denne v dávkach 150 a 300 mikrogramov vo viacerých klinických farmakodynamických štúdiách a štúdiách účinnosti zhodne vyvolával klinicky významné zlepšenie funkcie pľúc počas 24 hodín (merané ako úsilný výdych za jednu sekundu, FEV1). Nástup účinku
5 minút od inhalácie bol rýchly, so zvýšením FEV1 o 110-160 ml oproti východiskovej hodnote, porovnateľný s účinkom 200 mikrogramov rýchlo pôsobiaceho beta2-agonistu salbutamolu, a štatisticky významne rýchlejší ako salmeterol/flutikazón 50/500 mikrogramov. Priemerné maximálne zlepšenia FEV1 v rovnovážnom stave oproti východiskovej hodnote boli 250-330 ml.
Bronchodilatačný účinok nezávisel od času podávania, ráno alebo večer.
Preukázalo sa, že Hirobriz Breezhaler znižuje hyperinfláciu pľúc, čo má za následok zvýšenie
vdychovej kapacity pri fyzickej aktivite a v kľude v porovnaní s placebom.
Úč i n k y n a e l e k t ro f y zi o l ó g i u srd c a
Dvojito zaslepená, placebom i aktívne (moxifloxacínom) kontrolovaná štúdia so 404 zdravými dobrovoľníkmi trvajúca 2 týždne preukázala po opakovanom podávaní maximálne priemerné (intervaly spoľahlivosti 90 %) predĺženia intervalu QTcF (v milisekundách) o 2,66 (0,55; 4,77) pri dávke 150 mikrogramov, o 2,98 (1,02; 4,93) pri dávke 300 mikrogramov a o 3,34 (0,86; 5,82) pri dávke 600 mikrogramov. Preto pri odporúčaných terapeutických dávkach alebo pri dvojnásobku maximálnej odporúčanej dávky nie sú obavy z možnosti vyvolania arytmií súvisiacich s predĺžením intervalu QT. V rozmedzí hodnotených dávok sa nepreukázala súvislosť medzi koncentráciou
a delta QTc.
U 605 pacientov s CHOCHP v dvojito zaslepenej, placebom kontrolovanej klinickej štúdii fázy III
trvajúcej 26 týždňov nebol klinicky významný rozdiel vo vzniku arytmií pri monitorovaní počas
24 hodín pred začatím štúdie a až 3-krát počas 26 týždňov liečby medzi pacientmi, ktorí dostávali odporúčané dávky lieku Hirobriz Breezhaler, a pacientmi, ktorí dostávali placebo alebo boli liečení tiotropiom.
K
li
n
ic
k
á
ú
či
nno
s
ť
a
b
ez
p
eč
no
s
ť
Program klinického vývoja zahŕňal randomizované, kontrolované klinické štúdie u pacientov s klinickou diagnózou CHOCHP, z ktorých jedna trvala 12 týždňov, dve 6 mesiacov (jedna z nich bola predĺžená na jeden rok na vyhodnotenie bezpečnosti a znášanlivosti) a jedna 1 rok. V týchto štúdiách bola hodnotená funkcia pľúc a zdravotné ukazovatele, napr. dyspnoe, exacerbácie a kvalita života súvisiaca so zdravotným stavom.
Fu n k c i a p ľú c
Hirobriz Breezhaler podávaný raz denne v dávkach 150 mikrogramov a 300 mikrogramov preukázal klinicky významné zlepšenia funkcie pľúc. Dávka 150 mikrogramov vyvolala zvýšenie primárneho ukazovateľa v 12. týždni (minimálna hodnota FEV1 počas 24 hodín) o 130-180 ml v porovnaní s placebom (p<0,001) a zvýšenie o 60 ml v porovnaní so salmeterolom 50 mikrogramov dvakrát denne (p<0,001). Dávka 300 mikrogramov vyvolala zvýšenie o 170-180 ml v porovnaní s placebom (p<0,001) a zvýšenie o 100 ml v porovnaní s formoterolom 12 mikrogramov dvakrát denne (p<0,001). Obe dávky vyvolali zvýšenie o 40-50 ml v porovnaní s otvoreným podávaním tiotropia
18 mikrogramov raz denne (150 mikrogramov, p=0,004; 300 mikrogramov, p=0,01). Bronchodilatačný účinok lieku Hirobriz Breezhaler trvajúci 24 hodín sa udržal od prvej dávky počas celého jednoročného obdobia liečby bez dôkazov o poklese účinnosti (tachyfylaxia).
Prí n o sy v zh ľa d o m n a sy mp t ó my
Obidve dávky preukázali v porovnaní s placebom štatisticky významné zlepšenie vzhľadom na zmiernenie symptómov dyspnoe a na zdravotný stav (vyhodnotené pomocou indexu prechodného dyspnoe [Transitional Dyspnoea Index, TDI] a St. George’s Respiratory Questionnaire [SGRQ]). Miera odpovede bola spravidla väčšia, než aká sa pozorovala pri aktívnych komparátoroch (Tabuľka č. 2). Okrem toho pacienti liečení liekom Hirobriz Breezhaler potrebovali významne menej záchranných liekov, v porovnaní s placebom mali viac dní, keď nepotrebovali žiadny záchranný liek a mali významne lepší percentuálny podiel dní, keď nemali symptómy cez deň.
Spoločná analýza účinnosti 6-mesačnej liečby ukázala, že výskyt exacerbácií CHOCHP bol štatisticky významne nižší ako pri placebe. Porovnanie liečby s placebom ukázalo pomer výskytu
0,68 (95% IS [0,47; 0,98]; hodnota p 0,036) pri 150 mikrogramoch a 0,74 (95% IS [0,56; 0,96];
hodnota p 0,026) pri 300 mikrogramoch.
Skúsenosti s liečbou osôb, ktoré sú pôvodom z Afriky, sú obmedzené.
Tabuľka č. 2 Zmiernenie symptómov po 6 mesiacoch liečby
L
i
eče
bn
á
d
ávka
(
m
i
k
r
ogramy)
P
erce
n
t
u
álny
I
nd
akaterol
150
r
az denne
57 a
Indakaterol
300
raz denne
Tiotropium
18
raz denne
Salmeterol
50
dvakrát denne
54 a
Formoterol
12
dvakrát denne
Placebo
45 a
p
odiel pacientov,
k
t
orí dosiahli
M
C
I
D podľa TDI
†
P
erce
n
t
u
álny podiel pacientov, ktorí dosiahli MCID podľa SGRQ
†
Z
n
í
že
n
i
e
p
odaní/deň
62 b 71 b
59 c
53 a
58 b 53 b
55 c
1,3 a
57 b
47 b
49 a
1,2 a
54 c
51 c
47 b
41 c
38 a
46 b
40 c
0,3 a
 z
áchranného lieku
oproti východiskovej hodnote
z
áchranného lieku
oproti východiskovej hodnote
1,5 b 1,6 b 1,0 b
n/e
0,4 b
P
erce
n
t
u
álny podiel dní bez použitia záchranných liekov
60 a
57 b 58 b 46 b
55 a
n/e
42 a
42 b

Usporiadanie štúdie s a: indakaterol 150 mikrogramov, salmeterol a placebo; b: indakaterol 150 a
300 mikrogramov, tiotropium a placebo; c: indakaterol 300 mikrogramov, formoterol a placebo
† MCID = minimálny klinicky významný rozdiel (zmena ≥1 bod podľa TDI, zmena ≥4 body podľa
SGRQ)
n/e = nevyhodnotené po šiestich mesiacoch
Pediatrická populáciaEurópska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s liekom Hirobriz Breezhaler vo všetkých podskupinách pediatrickej populácie pre chronickú obštrukčnú chorobu pľúc (CHOCHP) (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnostiIndakaterol je chirálna molekula s R-konfiguráciou.
Farmakokinetické údaje sa získali v niekoľkých klinických štúdiách so zdravými dobrovoľníkmi
a pacientmi s CHOCHP.
AbsorpciaMedián času do dosiahnutia maximálnych koncentrácií indakaterolu v sére bol približne 15 minút po jednorazovej alebo opakovaných inhalovaných dávkach. Systémová expozícia indakaterolu sa zvyšovala so zvyšujúcou sa dávkou (150 mikrogramov až 600 mikrogramov) úmerne dávke. Absolútna biologická dostupnosť indakaterolu po inhalácii dávky bola v priemere 43 % až 45 %. Systémová expozícia je daná kombináciou pľúcnej a gastrointestinálnej absorpcie; asi 75 % systémovej expozície bolo dôsledkom pľúcnej absorpcie a asi 25 % gastrointestinálnej absorpcie.
Koncentrácie indakaterolu v sére sa zvýšili po opakovanom podávaní raz denne. Rovnovážny stav sa dosiahol do 12 až 14 dní. Priemerný pomer akumulácie indakaterolu, t.j. AUC počas 24 -hodinového dávkovacieho intervalu na 14. deň v porovnaní s 1. dňom, bol v rozmedzí od 2,9 do 3,5 pri dávkach medzi 150 mikrogramami a 600 mikrogramami inhalovanými raz denne.
DistribúciaPo intravenóznej infúzii bol distribučný objem indakaterolu vo fáze konečnej eliminácie 2557 litrov, čo naznačuje rozsiahlu distribúciu. Väzba
in vitro na ľudské sérové bielkoviny bola 94,1-95,3 % a na plazmatické bielkoviny 95,1-96,2 %.
BiotransformáciaPo perorálnom podaní rádioaktívne značeného indakaterolu v štúdii ADME (absorpcia, distribúcia, metabolizmus, vylučovanie) u ľudí bol hlavnou zložkou v sére nezmenený indakaterol, na ktorý pripadala približne jedna tretina celkovej AUC súvisiacej s liečivom počas 24 hodín. Najvýznamnejším metabolitom v sére bol hydroxylovaný derivát. Ďalšími významnými metabolitmi boli fenolické O-glukuronidy indakaterolu a hydroxylovaný indakaterol. Diastereoizomér hydroxylovaného derivátu, N-glukuronid indakaterolu, a C- a N-dealkylované produkty boli ďalšími identifikovanými metabolitmi.
Skúmanie
in vitro naznačilo, že UGT1A1 je jediná izoforma UGT, ktorá metabolizovala indakaterol na fenolický O-glukuronid. Oxidatívne metabolity sa našli pri inkubáciách s rekombinantnými CYP1A1, CYP2D6 a CYP3A4. Usudzuje sa, že CYP3A4 je hlavným izoenzýmom zodpovedným za hydroxyláciu indakaterolu. Skúmanie
in vitro ďalej naznačilo, že indakaterol je substrát s nízkou afinitou k efluxnej pumpe P-gp.
Eliminácia
V klinických štúdiách, v ktorých sa vykonával zber moču, bolo množstvo nezmeneného indakaterolu vylúčeného do moču spravidla nižšie ako 2 % dávky. Obličkový klírens indakaterolu bol v priemere medzi 0,46 a 1,20 litrov/hodinu. V porovnaní so sérovým klírensom indakaterolu 23,3 litrov/hodinu
je zjavné, že obličkový klírens zohráva pri eliminácii systémovo dostupného indakaterolu malú úlohu
(približne 2 až 5 % systémového klírensu).
V štúdii ADME u ľudí, v ktorej sa indakaterol podával perorálne, vylučovanie do stolice prevládalo nad vylučovaním do moču. Indakaterol sa vylučoval do ľudskej stolice predovšetkým v nezmenenej forme (54 % dávky) a v menšej miere ako hydroxylované metabolity (23 % dávky). Hmotnostná rovnováha bola úplná, vo výlučkoch sa našlo ≥90 % dávky.
Koncentrácie indakaterolu v sére klesali viacfázovo, s priemerným konečným eliminačným polčasom v rozmedzí od 45,5 do 126 hodín. Efektívny biologický polčas vyrátaný z akumulácie indakaterolu
po opakovanom podávaní bol v rozmedzí od 40 do 52 hodín, čo je v súlade s pozorovaným časom do dosiahnutia rovnovážneho stavu približne 12-14 dní.
Osobitné populácie
Analýza farmakokinetiky u populácií preukázala, že vek (dospelí do 88 rokov), pohlavie, hmotnosť (32-168 kg), ani rasa klinicky významne neovplyvňujú farmakokinetiku indakaterolu. Analýza u tejto populácie nenaznačuje rozdiely medzi etnickými podskupinami.
U pacientov s ľahkou a stredne ťažkou poruchou funkcie pečene sa neprejavili významné zmeny C max alebo AUC indakaterolu, rovnako sa nelíšila väzba na bielkoviny medzi osobami s ľahkou a stredne ťažkou poruchou funkcie pečene a zdravými osobami v kontrolnej skupine. Štúdie u osôb s ťažkou poruchou funkcie pečene sa nevykonali.
Vzhľadom na veľmi nízky podiel vylučovania močom na celkovej eliminácii z tela sa štúdia u osôb
s poruchou funkcie obličiek nevykonala.
5.3 Predklinické údaje o bezpečnosti
Účinky na kardiovaskulárny systém, ktoré možno pripísať vlastnostiam indakaterolu ako beta 2- agonistu, zahŕňali tachykardiu, arytmie a lézie myokardu u psov. U hlodavcov sa pozorovalo mierne podráždenie nosovej dutiny a hrtanu. Všetky tieto nálezy sa objavili pri expozíciách, ktoré dostatočne presahovali expozíciu predpokladanú u ľudí.
Hoci indakaterol nemal vplyv na celkový reprodukčný výkon v štúdii fertility u potkanov, pokles počtu gravidných samíc v potomstve F1 sa pozoroval v štúdii peri- a postnatálneho vývoja u potkanov pri 14-násobne vyššej expozícii ako u ľudí, ktorým sa podáva Hirobriz Breezhaler. Indakaterol nebol embryotoxický ani teratogénny u potkanov alebo králikov.
V štúdiách genotoxicity sa nezistil žiadny mutagénny ani klastogénny pote nciál. Karcinogenita sa hodnotila v dvojročnej štúdii na potkanoch a šesťmesačnej štúdii na transgenických myšiach. Zvýšená incidencia benígneho leiomyómu vaječníkov a fokálna hyperplázia hladkého svalstva vaječníkov u potkanov sa zhodovala s podobnými nálezmi hlásenými u iných beta2-adrenergných agonistov. U myší nebol pozorovaný žiadny dôkaz karcinogenity. Systémové expozície (AUC) u potkanov a myší pri hladinách bez pozorovaných nežiaducich účinkov v týchto štúdiách boli najmenej 7- a 49-násobne vyššie ako u ľudí, ktorým sa podával Hirobriz Breezhaler v dávke
300 mikrogramov denne.
6
. FARMACEUTICKÉ INFORMÁCIE
6
.
1 Zoznam pomocných látok
O
b
s
a
h kapsuly
Monohydrát laktózy
Telo kapsuly
Želatína
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
30 mesiacov.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30°C.
Uchovávajte v blistri na ochranu pred vlhkosťou a vyberte z balenia až bezprostredne pred použitím.
6.5 Druh obalu a obsah balenia
Hirobriz Breezhaler je inhalačná pomôcka na podanie jednorazovej dávky. Spodná časť inhalátora a viečko sú vyrobené z akrylonitryl-butadién-styrénu, tlačidlá sú vyrobené z metylmetakrylát- akrylonitryl-butadién-styrénu. Ihly a pružiny sú vyrobené s nehrdzavejúcej ocele.
Blister PA/Al/PVC - Al obsahujúci 10 tvrdých kapsúl.
Škatuľa obsahujúca 10 kapsúl a jeden inhalátor Hirobriz Breezhaler.
Škatuľa obsahujúca 30 kapsúl a jeden inhalátor Hirobriz Breezhaler.
Spoločné balenie pozostávajúce z 2 balení (každé obsahuje 30 kapsúl a 1 inhalátor). Spoločné balenie pozostávajúce z 3 balení (každé obsahuje 30 kapsúl a 1 inhalátor). Spoločné balenie pozostávajúce z 30 balení (každé obsahuje 10 kapsúl a 1 inhalátor).
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Každý inhalátor sa má zlikvidovať po 30 dňoch používania.
 P
o
k
yn
y na zaobchádzanie a použitieOdstráňte viečko.Otvorte inhalátor:
P
o
k
yn
y na zaobchádzanie a použitieOdstráňte viečko.Otvorte inhalátor:Pevne držte spodnú časť inhalátora a odklopte
náustok. Týmto sa inhalátor otvorí.
Pripravte kapsulu:Bezprostredne pred použitím suchými rukami vyberte jednu kapsulu z blistra.
Vložte kapsulu:Kapsulu vložte do lôžka na kapsulu.
Kapsulu nikdy nevložte priamo do náustka.
 U
z
av
r
i
t
e inhalátor:
U
z
av
r
i
t
e inhalátor:
Uzavrite inhalátor tak, aby bolo počuť
„cvaknutie“.
Prepichnite kapsulu:· Inhalátor držte zvislo, s náustkom obráteným nahor.
· Silným stlačením obidvoch bočných tlačidiel súčasne prepichnite kapsulu.
Urobte to len raz.· Pri prepichnutí kapsuly by ste mali počuť
„cvaknutie“.
Úplne uvoľnite bočné tlačidlá.Vydýchnite:Skôr ako si vložíte do úst náustok, úplne
vydýchnite.
Nevydychujte do náustka.Inhalujte liekVdýchnutie lieku hlboko do dýchacích ciest:
· Inhalátor držte tak, ako je to znázornené
na obrázku. Bočné tlačidlá majú smerovať doľava a doprava. Nestláčajte bočné tlačidlá.
· Vložte si náustok do úst a pevne ho
obopnite perami.
· Vdýchnite rýchlo, ale rovnomerne a čo najhlbšie.
 Poznámka:
Poznámka:
Počas vdychovania cez inhalátor sa kapsula v lôžku otáča, takže by ste mali počuť vírivý zvuk. Pri prenikaní lieku do pľúc budete cítiť sladkú chuť.
Ďalšie informácieNiekedy sa cez ochrannú mriežku do úst môžu dostať veľmi malé kúsky kapsuly. Ak sa to stane, môžete ich pocítiť na jazyku. Prehltnutie alebo vdýchnutie týchto kúskov nie je nebezpečné. Pravdepodobnosť roztrieštenia kapsuly sa zvýši, ak nechtiac prepichnete kapsulu viac ako raz (krok č. 6).
Ak nepočujete vírivý zvuk:Kapsula môže byť zaseknutá v lôžku. Ak sa to
stane:
· Otvorte inhalátor a kapsulu opatrne uvoľnite poklopaním na spodnú časť inhalátora. Nestláčajte bočné tlačidlá.
· Inhalujte liek znovu opakovaním krokov
č. 8 a 9.
Zadržte dych:Po vdýchnutí lieku:
· Zadržte dych minimálne na 5-10 sekúnd alebo aspoň tak dlho, pokiaľ vám to nie je nepríjemné a vyberte pritom inhalátor z úst.
· Potom vydýchnite.
· Otvorte inhalátor a skontrolujte, či v kapsule neostal zvyšok prášku.
Ak je ešte v kapsule zvyšok prášku:· Uzavrite inhalátor.
· Zopakujte kroky č. 8, 9, 10 a 11.
Väčšina ľudí dokáže obsah kapsuly vyprázdniť
jedným alebo dvoma vdýchnutiami.
Ďalšie informácieNiektorí ľudia môžu ihneď po inhalácii občas krátko kašlať. Ak sa to stane, nemusíte mať obavy. Pokiaľ je kapsula prázdna, použili ste dostatok lieku.
 Po skončení podania
Po skončení podania lieku:
· Znovu odklopte náustok a prázdnu kapsulu odstráňte klopkaním na lôžko kapsuly. Prázdnu kapsulu zahoďte medzi odpadky.
· Zatvorte inhalátor a nasaďte viečko.
Kapsuly neuchovávajte v inhalátore HirobrizBreezhaler.Zaznačte si použitie dennej dávky:Vo vnútri balenia je pomôcka na zaznamenanie dennej dávky. Urobte si značku do dnešného okienka, ak vám to pomôže pripomenúť si, kedy máte použiť ďalšiu dávku.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovartis Europharm Limited Frimley Business Park Camberley GU16 7SR
Veľká Británia
8. REGISTRAČNÉ ČÍSLAEU/1/09/594/006-010
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 30. november 2009
Dátum posledného predĺženia registrácie: 18. september 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu