Postup pri vynechaní tabliet sa môže riadiť podľa nasledovných dvoch základných pravidiel:
1. Užívanie tabliet sa nesmie nikdy prerušiť na dlhšie ako 7 dní.
2. Na dosiahnutie zodpovedajúcej supresie osi hypotalamus-hypofýza-ováriá sa vyžaduje nepretržité
sedemdňové užívanie tabliet. V súlade s tým sa v bežnej praxi môžu poskytnúť nasledovné
odporúčania:
1.Týždeň Používateľka musí užiť poslednú vynechanú tabletu hneď ako si spomenie, aj keby to znamenalo užitie dvoch tabliet súčasne. Potom pokračuje v užívaní tabliet vo zvyčajnom čase. Naviac je potrebné používať v nasledujúcich siedmich dňoch bariérovú antikoncepciu, akou je kondóm. Ak došlo v predchádzajúcich siedmich dňoch k pohlavnému styku, musí sa zvážiť možnosť gravidity. Čím viac tabliet sa vynechalo a čím viac sa vynechanie užitia blíži k fáze bez užívania tabliet, tým vyššie je riziko gravidity.
2. Týždeň Používateľka musí užiť poslednú vynechanú tabletu hneď ako si spomenie, aj keby to znamenalo užitie dvoch tabliet súčasne. Potom pokračuje v užívaní tabliet vo zvyčajnom čase. Ak žena užívala tablety počas siedmich dní pred prvou vynechanou tabletou správne, ďalšie antikoncepčné opatrenia nie sú potrebné. Ak to tak nie je, alebo ak vynechala viac ako jednu tabletu, žena musí používať bariérovú metódu, napr. kondóm, počas nasledujúcich siedmich dní.
3.Týždeň Vzhľadom na nastávajúcu fázu bez užívania tabliet je riziko zníženia spoľahlivosti antikoncepcie bezprostredné. Aj tak však možno upravením schémy užívania tabliet predísť zníženiu antikoncepčnej ochrany. Pri dodržaní niektorého z dvoch nasledovných možných postupov, nie je potrebné používať ďalšie antikoncepčné opatrenia za predpokladu, že počas siedmich dní pred vynechaním prvej tablety používateľka užila všetky tablety správne. Ak to tak nie je, musí používateľka zvoliť prvú z nasledovných dvoch možností a použiť navyše ďalšie antikoncepčné opatrenia počas nasledujúcich siedmich dní.
1. Používateľka musí užiť poslednú vynechanú tabletu hneď, ako si spomenie, aj keby to znamenalo
užitie dvoch tabliet súčasne. Potom pokračuje v užívaní tabliet vo zvyčajnom čase. Žena začne
užívať tablety z nasledujúceho blistrového balenia okamžite potom, ako užila poslednú tabletu zo
súčasného balenia; to znamená, že medzi baleniami nie je žiadna prestávka. Krvácanie z vysadenia
sapravdepodobne nedostaví pred doužívaním všetkých tabliet z druhého blistra, ale počasužívania
tabliet môže nastať špinenie alebo medzimenštruačné krvácanie.
2. Používateľke možno tiež poradiť, aby ukončila užívanie tabliet zo súčasne používaného
blistrového balenia. Tým jej vznikne interval bez užívania tabliet, najviac však siedmich dní
vrátane dní, kedy sa tablety vynechali a následne začne užívať tablety z ďalšieho blistrového
balenia.
Ak používateľka zabudne užiť tablety a následne sa nedostaví krvácanie z vysadenia v prvom normálnom intervale bez užívania tabliet, musí sa zvážiť možnosť gravidity.
Postup v prípade gastrointestinálnych ťažkostíV prípade závažných gastrointestinálnych ťažkostí (napr. vracania alebo hnačky) nemusí byť vstrebávanie úplné a musia sa použiť ďalšie antikoncepčné opatrenia. Ak počas 3-4 hodín po užití tablety dôjde k vracaniu, musí sa čo najskôr užiť nová (náhradná) tableta. Ak je to možné, nová tableta sa má užiť do 12 hodín od zvyčajného času užívania tablety. V prípade, že uplynulo viac ako 12 hodín, ohľadom vynechaných tabliet sa postupuje podľa pokynov, uvedených v časti 4.2 „Postup pri vynechaní tabliet“. Ak používateľka nechce meniť zvyčajnú schému užívania tabliet, musí užiť naviac tabletu (tablety) z ďalšieho blistrového balenia.
Ako oddialiť krvácanie z vysadeniaAk si používateľka praje oddialiť menštruáciu, musí pokračovať v užívaní tabliet z ďalšieho blistrového balenia Gentilionu bez prestávky. Oddialiť menštruáciu možno na tak dlhý čas, ako si žena želá, až do doužívania tabliet z druhého balenia. Počas tohto času sa u používateľky môže objaviť medzimenštruačné krvácanie alebo špinenie. Po sedemdňovom intervale bez užívania tabliet sa potom obnoví pravidelné užívanie Gentilionu.
Ak si používateľka praje presunúť menštruáciu na iný deň v týždni, než na aký je zvyknutá v doterajšej schéme užívania, možno jej odporučiť, aby skrátila nasledujúcu fázu bez užívania tabliet o toľko dní, o koľko si praje. Čím kratší bude interval, tým väčšie je riziko, že nedôjde ku krvácaniu z vysadenia a že počas užívania z nasledujúceho blistra sa vyskytne medzimenštruačné krvácanie a špinenie (podobne ako pri oddialení menštruácie).
4.3 KontraindikácieKombinovanú hormonálnu antikoncepciu (combined hormonal contraceptives, CHC) nemožno užívať v prípade výskytu niektorého z nižšie uvedených stavov.
· Prítomnosť alebo riziko vzniku venóznej trombembólie (VTE)
○ Venózna trombembólia - prítomná VTE (liečená antikoagulanciami) alebo v anamnéze (napr. trombóza hlbokých žíl [deep venous thrombosis, DVT] alebo pľúcna embólia [pulmonary embolism, PE]).
○ Známa dedičná alebo získaná predispozícia na vznik venóznej trombembólie, ako napríklad rezistencia voči APC (vrátane faktora V Leiden), deficiencia antitrombínu-III, deficiencia proteínu C, deficiencia proteínu S.
○ Závažný chirurgický zákrok s dlhodobou imobilizáciou (pozri časť 4.4).
○ Vysoké riziko vzniku venóznej trombembólie z dôvodu prítomnosti viacerých rizikových faktorov (pozri časť 4.4).
· Prítomnosť alebo riziko vzniku arteriálnej trombembólie (ATE)
○ Arteriálna trombembólia - prítomná arteriálna trombembólia, arteriálna trombembólia v anamnéze (napríklad infarkt myokardu) alebo stav, ktorý je jej skorým príznakom (napríklad angina pectoris).
○ Cievne mozgové ochorenie - prítomná cievna mozgová príhoda, cievna mozgová príhoda v anamnéze alebo stav, ktorý je jej skorým príznakom (napríklad prechodný ischemický záchvat, TIA).
○ Známa vrodená alebo získaná predispozícia na vznik arteriálnej trombembólie, ako napríklad hyperhomocysteinémia a antifosfolipidové protilátky (antikardiolipínové protilátky, lupusové antikoagulancium).
○ Migréna s ložiskovými neurologickými symptómami v anamnéze.
○ Vysoké riziko vzniku arteriálnej trombembólie z dôvodu viacerých rizikových faktorov (pozri časť 4.4) alebo prítomnosti jedného závažného rizikového faktora, ako napríklad:
- diabetes mellitus s cievnymi symptómami
- závažná hypertenzia
- závažná dyslipoproteinémia
○Pankreatitída alebo jej výskyt v anamnéze v spojení s ťažkou hypertriglyceridémiou
o Diagnostikované malignity závislé od pohlavných steroidov alebo podozrenie na ne (napr. pohlavných orgánov alebo prsníka)
o Závažné ochorenie pečene, prítomné alebo v anamnéze, až do návratu pečeňových funkcií na normálne hodnoty
o Diagnostikované alebo v anamnéze zistené benígne alebo malígne nádory pečene
o Vaginálne krvácanie s nediagnostikovanou príčinou
o Precitlivenosť na liečivá alebo na ktorúkoľvek z pomocných látok.
4.4 Osobitné upozornenia a opatrenia pri používaníUpozorneniaAk je prítomný ktorýkoľvek zo stavov alebo rizikových faktorov uvedených nižšie, vhodnosť užívania Gentilionusa má s danou ženou prekonzultovať.
Ženu treba upozorniť, že ak dôjde k zhoršeniu alebo prvému prejavu ktoréhokoľvek z týchto stavov alebo rizikových faktorov, má sa obrátiť na svojho lekára, ktorý určí, či má ukončiť používanie Gentilionu.
V prípade suspektnej alebo potvrdenej VTE alebo ATE, užívanie kombinovanej hormonálnej antikoncepcie sa má ukončiť. Ak sa začne s antikoagulačnou liečbou, má sa začať s adekvátnou alternatívnou antikoncepciou kvôli teratogenite antikoagulačnej liečby (kumaríny).
Riziko vzniku venóznej trombembólie (VTE)Používanie ktorejkoľvek kombinovanej hormonálnej antikoncepcie (CHC) zvyšuje riziko vzniku venóznej trombembólie (VTE) v porovnaní s jej nepoužívaním.
Lieky, ktoré obsahujú levonorgestrel, norgestimát alebo noretisterón, sú spojené s najnižším rizikom vzniku VTE. Iné lieky, ako je Gentilion, môžu mať toto riziko až dvojnásobne vyššie. Rozhodnutie používať ktorýkoľvek iný liek, ako liek s najnižším rizikom vzniku VTE, sa má urobiť len po konzultácii s danou ženou, aby sa zaručilo, že rozumie riziku vzniku VTE pri používaní Gentilionu, tomu, ako jej aktuálne rizikové faktory ovplyvňujú toto riziko, a že riziko vzniku VTE je najvyššie vždy v prvom roku používania. Sú taktiež aj určité dôkazy o tom, že sa toto riziko zvyšuje pri opätovnom začatí používania kombinovanej hormonálnej antikoncepcie po prerušení používania trvajúcom 4 týždne alebo dlhšie.U približne 2 z 10 000 žien, ktoré nepoužívajú kombinovanú hormonálnu antikoncepciu a nie sú gravidné, vznikne VTE v priebehu jedného roka. Avšak u každej jednej ženy môže byť toto riziko oveľa vyššie v závislosti od prítomných rizikových faktorov (pozri nižšie).
Odhaduje sa
1, že VTE sa vyskytne v priebehu jedného roka u 9 až 12 žien z 10 000 žien, ktoré používajú kombinovanú hormonálnu antikoncepciu obsahujúcu gestodén, v porovnaní s približne
6
2 ženami, ktoré užívajú kombinovanú hormonálnu antikoncepciu obsahujúcu levonorgestrel.
V oboch prípadoch je počet výskytov VTE za rok nižší ako počet očakávaný u žien počas gravidity alebo v období po pôrode.
VTE sa môže v 1 až 2 % prípadov skončiť smrťou.
Počet prípadov VTE na 10 000 žien v priebehu jedného roka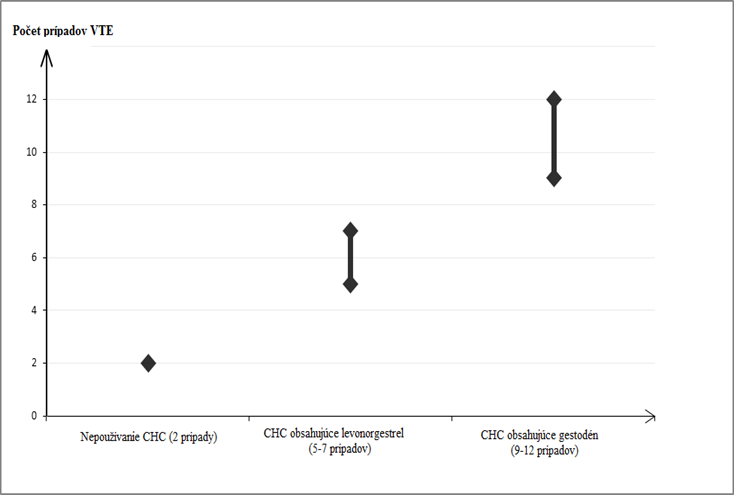
U používateliek kombinovanej hormonálnej antikoncepcie bol mimoriadne zriedkavo hlásený výskyt trombózy v iných krvných cievach, napr. v pečeňových, mezenterických, obličkových alebo sietnicových žilách a tepnách.
1 Tieto incidencie boli odhadnuté zo všetkých dát z epidemiologických štúdií, použitím relatívnych rizík pre rôzne lieky v porovnaní s kombinovanou hormonálnou antikoncepciou obsahujúcou levonorgestrel.
2 Stredný bod rozpätia 5-7 (prípadov) na 10 000 ženských rokov (ŽR), založený na relatívnom riziku
kombinovanej hormonálnej antikoncepcie obsahujúcej levonorgestrel oproti 2,3 až 3,6 u nepoužívateliek.
Rizikové faktory vzniku VTE Riziko vzniku venóznych trombembolických komplikácií u používateliek kombinovanej hormonálnej antikoncepcie sa môže značne zvýšiť v prípade ženy s ďalšími rizikovými faktormi, najmä ak má viacero rizikových faktorov (pozri tabuľku).
Gentilionje kontraindikovaný, ak má žena viacero rizikových faktorov, ktoré ju vystavujú vysokému riziku vzniku venóznej trombózy (pozri časť 4.3). Ak má žena viac ako jeden rizikový faktor, zvýšenie rizika môže byť väčšie ako je súčet jednotlivých faktorov - v takomto prípade sa má zvážiť jej celkové riziko výskytu VTE. Ak sa pomer prínosov a rizík považuje za negatívny, kombinovaná hormonálna antikoncepcia sa nemá predpisovať (pozri časť 4.3).
Tabuľka: Rizikové faktory pre vznik VTERizikový faktor
| Komentár
|
Obezita (index telesnej hmotnosti nad 30 kg/m²)
| Riziko sa výrazne zvyšuje so zvyšovaním BMI.
Obzvlášť dôležité je to zvážiť, ak sú prítomné aj ďalšie rizikové faktory.
|
Dlhodobá imobilizácia, závažný chirurgický zákrok, akýkoľvek chirurgický zákrok na nohách alebo panve, neurochirurgický zákrok alebo závažný úraz.
Poznámka: dočasná imobilizácia vrátane cestovania leteckou dopravou trvajúcou >4 hodiny môže byť tiež rizikovým faktorom pre vznik VTE, najmä u žien s ďalšími rizikovými faktormi.
| V týchto prípadoch sa odporúča ukončiť používanie náplasti/tablety/krúžku (v prípade plánovaného chirurgického zákroku najmenej štyri týždne pred zákrokom) a opätovne začať najskôr dva týždne po
úplnom obnovení pohyblivosti. Má sa používať iný spôsob antikoncepcie, aby sa zabránilo neželanej gravidite.
Ak sa používanie Gentilionu neukončí včas, má sa zvážiť antitrombotická liečba.
|
Pozitívna rodinná anamnéza (akýkoľvek výskyt venóznej trombembólie u súrodenca alebo rodiča, najmä v relatívne skorom veku, napr. do 50 rokov).
| Ak existuje podozrenie na dedičnú predispozíciu, ženu musí pred rozhodnutím o používaní ktorejkoľvek kombinovanej hormonálnej antikoncepcie vyšetriť odborný lekár.
|
Iné zdravotné stavy spojené s VTE
| Rakovina, systémový lupus erythematosus, hemolyticko-uremický syndróm, chronické zápalové ochorenie čriev (Crohnova choroba alebo ulcerózna kolitída) a kosáčikovitá anémia
|
Zvyšujúci sa vek
| Najmä nad 35 rokov
|
Neexistuje žiadna zhoda ohľadom možnej úlohy kŕčových žíl a povrchovej tromboflebitídy pri vzniku alebo progresii venóznej trombózy.
Musí sa zvážiť zvýšené riziko vzniku trombembólie počas gravidity a najmä počas 6-týždňového obdobia šestonedelia (informácie o „Gravidite a laktácii“, pozri časť 4.6).
Príznaky VTE (trombóza hlbokých žíl a pľúcna embólia) Žena má byť poučená, aby v prípade príznakov vyhľadala okamžitú lekársku pomoc a informovala zdravotníckeho pracovníka, že užíva kombinovanú hormonálnu antikoncepciu.
Príznaky trombózy hlbokých žíl (DVT) môžu zahŕňať:
– jednostranný opuch nohy a/alebo chodidla alebo pozdĺž žily v nohe,
– bolesť alebo citlivosť v nohe, ktorú možno pociťovať iba v stoji alebo pri chôdzi,
– zvýšené teplo v postihnutej nohe, sčervenanie alebo zmena sfarbenia pokožky na nohe.
Príznaky pľúcnej embólie (PE) môžu zahŕňať:
– náhly nástup nevysvetliteľnej dýchavičnosti alebo rýchleho dýchania,
– náhly kašeľ, ktorý môže byť spojený s hemoptýzou,
– ostrú bolesť v hrudníku,
– závažný pocit točenia hlavy na odpadnutie alebo závrat,
– rýchly alebo nepravidelný srdcový rytmus.
Niektoré z týchto príznakov (napríklad „dýchavičnosť“, „kašeľ“) sú nešpecifické a môžu byť nesprávne interpretované ako častejšie alebo menej závažné udalosti (napríklad infekcie dýchacích ciest).
Medzi ďalšie prejavy vaskulárnej oklúzie môžu patriť: náhla bolesť, opuch a mierne zmodranie niektorej končatiny.
Ak dôjde k oklúzii v oku, medzi symptómy môžu patriť bezbolestné rozmazané videnie, ktoré môže postupne prechádzať až do straty zraku. Niekedy môže dôjsť k strate zraku takmer okamžite.
Riziko vzniku arteriálnej trombembólie (ATE) Epidemiologické štúdie spájajú používanie kombinovanej hormonálnej antikoncepcie (CHC) so zvýšeným rizikom vzniku arteriálnej trombembólie (infarkt myokardu) alebo cievnej mozgovej udalosti (napr. prechodný ischemický záchvat, cievna mozgová príhoda). Arteriálne trombembolické udalosti sa môžu končiť smrťou.
Rizikové faktory pre vznik ATE Riziko vzniku arteriálnych trombembolických komplikácií alebo cerebrovaskulárnej udalosti u používateliek kombinovanej hormonálnej antikoncepcie sa zvyšuje u žien s rizikovými faktormi (pozri tabuľku). Gentilionje kontraindikovaný, ak má žena jeden závažný alebo viacero rizikových faktorov vzniku ATE, ktoré ju vystavujú vysokému riziku vzniku arteriálnej trombózy (pozri časť 4.3). Ak má žena viac ako jeden rizikový faktor, zvýšenie rizika môže byť väčšie ako je súčet jednotlivých faktorov - v takomto prípade sa má zvážiť jej celkové riziko. Ak sa pomer prínosov a rizík považuje za negatívny, kombinovaná hormonálna antikoncepcia sa nemá predpisovať (pozri časť 4.3).
Tabuľka: Rizikové faktory vzniku ATERizikový faktor
| Komentár
|
Zvyšujúci sa vek
| Najmä nad 35 rokov
|
Fajčenie
| Ženám sa má odporučiť, aby nefajčili, ak chcú používať kombinovanú hormonálnu antikoncepciu. Ženám vo veku nad 35 rokov, ktoré pokračujú vo fajčení, sa má dôrazne odporučiť, aby používali iný spôsob antikoncepcie.
|
Hypertenzia
|
|
Obezita (index telesnej hmotnosti nad 30 kg/m²).
| Riziko sa výrazne zvyšuje so zvyšovaním BMI.
To je dôležité najmä u žien s ďalšími rizikovými faktormi.
|
Pozitívna rodinná anamnéza (akýkoľvek výskyt arteriálnej trombembólie u súrodenca alebo rodiča, najmä v relatívne mladom veku, napr. do 50 rokov).
| Ak existuje podozrenie na dedičnú predispozíciu, ženu musí pred rozhodnutím o používaní akejkoľvek kombinovanej hormonálnej antikoncepcie vyšetriť odborný lekár.
|
Migréna
| Zvýšenie frekvencie alebo závažnosti migrény v priebehu používania kombinovanej hormonálnej antikoncepcie (čo môžu byť skoré príznaky cievnej mozgovej príhody) môže byť dôvodom na okamžité ukončenie jej používania.
|
Ďalšie zdravotné stavy spojené s nežiaducimi vaskulárnymi udalosťami.
| Diabetes mellitus, hyperhomocysteinémia, ochorenie srdcových chlopní a atriálna fibrilácia, dyslipoproteinémia a systémový lupus erythematosus.
|
Príznaky ATE Žena má byť poučená, aby v prípade príznakov vyhľadala okamžitú lekársku pomoc a informovala zdravotníckeho pracovníka, že používa kombinovanú hormonálnu antikoncepciu.
Príznaky cievnej mozgovej príhody môžu zahŕňať:
– náhla strata citlivosti alebo slabosť tváre, ruky alebo nohy, najmä na jednej strane tela,
– náhle problémy s chôdzou, závrat, strata rovnováhy alebo koordinácie,
– náhla zmätenosť, problémy s rečou alebo jej porozumením,
– náhle problémy so zrakom u jedného alebo oboch očí,
– náhla, závažná alebo dlhodobá bolesť hlavy bez známej príčiny,
– strata vedomia alebo mdloba so záchvatmi kŕčov alebo bez nich.
Dočasné príznaky naznačujú, že udalosťou je prechodný ischemický záchvat (TIA).
Príznaky infarktu myokardu (MI) môžu zahŕňať:
– bolesť, dyskomfort, tlak, ťažoba, pocit stláčania alebo plnosti v hrudi, ruke alebo pod hrudnou kosťou,
– dyskomfort vyžarujúci do chrbta, čeľuste, hrdla, ruky, žalúdka,
– pocit plnosti, problémy s trávením alebo dusenie sa,
– potenie, nevoľnosť, vracanie alebo závrat,
– extrémna slabosť, úzkosť alebo dýchavičnosť,
– rýchly alebo nepravidelný srdcový rytmus.
NádoryRakovina krčka materniceV niektorých epidemiologických štúdiách sa hlásilo zvýšené riziko rakoviny krčka maternice u dlhodobých používateliek COC, pretrváva však rozdielnosť názorov na to, do akej miery sa dajú tieto nálezy pripísať následkom sexuálneho správania a iným faktorom, ako je ľudský papiloma vírus (HPV).
Rakovina prsníkaMetaanalýza 54 epidemiologických štúdií uvádza, že sa mierne zvýšilo relatívne riziko (RR = 1,24) rakoviny prsníka diagnostikovanej u žien počas užívania COC. Zvýšené riziko postupne klesá v priebehu 10 rokov po ukončení užívania COC. Pretože výskyt rakoviny prsníka je u žien do 40 rokov zriedkavý, zvýšený počet prípadov diagnostikovanej rakoviny prsníka u žien, ktoré užívajú alebo užívali COC je v pomere k celkovému riziku rakoviny prsníka malý.
Kauzalitu tieto štúdie nedokazujú. Pozorované zvýšenie rizika môže byť zapríčinené skoršou diagnózou rakoviny prsníka u používateliek COC, biologickými účinkami COC alebo ich kombináciou. Rakovina prsníka diagnostikovaná u žien, ktoré niekedy COC užívali, býva klinicky menej rozvinutá ako u žien, ktoré COC neužívali nikdy.
Nádory pečeneU žien užívajúcich COC boli hlásené benígne a malígne nádory pečene, ktoré v ojedinelých prípadoch viedli k život ohrozujúcemu intraabdominálnemu krvácaniu. V prípade výskytu silných abdominálnych bolestí, zväčšenia pečene alebo prejavov intraabdominálneho krvácania u žien užívajúcich COC sa v diferenciálnej diagnóze musí uvažovať o nádore pečene.
Iné stavy U žien s hypertriglyceridémiou, alebo ktoré majú toto ochorenie v rodinnej anamnéze, sa v priebehu užívania COC môže zvýšiť riziko pankreatitídy.
V prípade akútnej alebo chronickej poruchy funkcie pečene sa musí ukončiť užívanie Gentilionu dovtedy, kým sa markery pečeňových funkcií nevrátia na referenčné hodnoty. Steroidné hormóny sa môžu u pacientov s poruchou funkcie pečene metabolizovať nedostatočne.
Aj keď sa u mnohých žien užívajúcich COC zaznamenalo malé zvýšenie krvného tlaku, klinicky významný vzostup je zriedkavý. Ak sa v priebehu užívania COC rozvinie trvalá klinicky významná hypertenzia, užívanie sa má ukončiť a má sa liečiť hypertenzia. Ak sa uzná za vhodné, užívanie COC je možné obnoviť po dosiahnutí normotenzných hodnôt krvného tlaku antihypertenznou liečbou.
V súvislosti s graviditou a v súvislosti s užívaním COC sa vyskytli alebo zhoršili nasledovné stavy, ale potvrdenie súvislosti nie je preukázané: žltačka a/alebo svrbenie súvisiace s cholestázou; tvorba žlčových kameňov; porfýria; systémový
lupus erythematosus; hemolyticko-uremický syndróm; Sydenhamova chorea; herpes gestationis; strata sluchu spôsobená otosklerózou.
COC môžu mať účinok na periférnu inzulínovú rezistenciu a glukózovú toleranciu. Diabetičky počas užívania COC musia byť preto starostlivo sledované.
Počas užívania COC sa hlásilo zhoršenie endogénnej depresie, epilepsie (pozri časť 4.5 interakcie), Crohnovej choroby a ulceróznej kolitídy.
Môže sa objaviť chloazma, najmä u žien, ktoré majú v anamnéze chloasma gravidarum. Používateľky so sklonom ku chloazme sa majú počas užívania COC vyhýbať expozícii slnečnému alebo ultrafialovému žiareniu.
Rastlinné prípravky obsahujúce Ľubovník bodkovaný (
hypericum perforatum) sa nemajú používať súbežne s Gentilionom vzhľadom na riziko zníženia plazmatickej koncetrácie a zníženej klinickej účinnosti Gentilionu (pozri časť 4.5).
Gentilion obsahuje laktózu. Pacientky so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
Lekárske vyšetrenie/konzultáciaPred začatím užívania alebo opätovným nasadením Gentilionu sa má vyšetriť kompletná
zdravotná anamnéza (vrátane rodinnej anamnézy) a musí sa vylúčiť gravidita. Má sa zmerať krvný
tlak a vykonať zdravotná prehliadka na základe kontraindikácií (pozri časť 4.3) a upozornení (pozri
časť 4.4). Je dôležité ženu upozorniť na informácie o venóznej a arteriálnej trombóze vrátane rizika
užívania Gentilionuv porovnaní s inou CHC, o príznakoch VTE a ATE, o známych rizikových
faktoroch a o tom, čo robiť v prípade podozrenia na trombózu.
Žena má byť poučená, aby si pozorne prečítala písomnú informáciu pre používateľku a dodržiavala
odporúčania uvedené v nej. Frekvencia a druh ďalších pravidelných kontrolných vyšetrení sa majú robiť na základe stanovených postupov a majú sa prispôsobiť individuálnym potrebám ženy.
Ženy majú byť upozornené, že hormonálna antikoncepcia nechráni pred infekciami vírusom HIV (AIDS) ani inými ochoreniami prenášanými pohlavným stykom.
Znížená účinnosťÚčinnosť COC môže byť znížená v prípade vynechania tabliet, gastrointestinálnych ťažkostí (pozri časť 4.2) alebo súbežného užívania ďalších liekov (pozri časť 4.5).
Znížená kontrola cykluPri užívaní ktoréhokoľvek COC sa môže objaviť nepravidelné krvácanie (špinenie alebo medzimenštruačné krvácanie), predovšetkým počas prvých mesiacov užívania. Z tohto dôvodu má posúdenie nepravidelného krvácania zmysel až po adaptačnom intervale približne troch cyklov.
Ak nepravidelné krvácanie pokračuje alebo sa vyskytne po období pravidelných cyklov, musí sa zvážiť možnosť nehormonálnej príčiny a indikované sú zodpovedajúce diagnostické kroky na vylúčenie malignity alebo gravidity. Môžu zahŕňať aj kyretáž.
U niektorých žien nemusí dôjsť počas fázy bez užívania tabliet ku krvácaniu z vysadenia. Ak sa COC užívala podľa pokynov popísaných v časti 4.2, je nepravdepodobné, že je používateľka gravidná. Ak sa však COC neužívala pred prvým vynechaným krvácaním podľa týchto pokynov alebo ak nedošlo ku krvácaniu z vysadenia dvakrát, musí sa pred ďalším užívaním COC vylúčiť gravidita.
4.5 Liekové a iné interakciePoznámka: Na identifikovanie potenciálnych interakcií, sa musia zohľadniť odborné informácie o súbežne užívaných liekoch.
Vplyv ďalších liekov na užívanie Gentilionu
Interakcie medzi perorálnou antikoncepciou a inými liekmi môžu viesť k medzimenštruačnému krvácaniu a/alebo zlyhaniu antikoncepcie. V literatúre boli popísané nasledovné interakcie.
Pečeňový metabolizmus
S liekmi, ktoré indukujú pečeňové enzýmy (napr. fenytoín, barbituráty, primidón, karbamazepín, rifampicín, bosentán a lieky na HIV (napr. ritonavir, nevirapín) a možno taktiež oxkarbazepín, topiramát, felbamát, grizeofulvín a rastlinné prípravky s obsahom Ľubovníka bodkovaného (
Hypericum perforatum) sa môžu vyskytnúť interakcie, ktoré môžu mať za následok zvýšený klírens pohlavných hormónov. Maximálna enzýmová indukcia sa zvyčajne prejaví v priebehu 10 dní, ale potom môže pretrvávať minimálne 4 týždne po ukončení liečby.
Interferencia s enterohepatálnou cirkuláciou
Antikoncepčné zlyhanie sa hlásilo aj pri antibiotikách, ako sú penicilíny a tetracyklíny. Mechanizmus tohto účinku nebol objasnený.
Manažment liečby
Používateľky krátkodobo liečené niektorým liekom z vyššie uvedených skupín liečiv, alebo jednotlivými liečivami, musia dočasne t.j. v priebehu súbežného podávania lieku a nasledujúcich 7 dní po ukončení podávania, navyše k COC používať bariérovú antikoncepciu. Používateľky liečené rifampicínom musia počas podávania rifampicínu a 28 dní po jeho vysadení používať k COC naviac bariérovú antikoncepciu.Ak súbežné podávanie lieku trvá aj po doužívaní tabliet z blistrového balenia COC, žena musí začať užívaťďalšie balenie s vynechaním obvyklého intervalu bez užívania tabliet.'
Používateľkám, dlhodobo liečeným liečivami indukujúcimi hepatálne enzýmy sa odporúča iná, spoľahlivá nehormonálna metóda antikoncepcie.
Vplyv Gentilionu na iné lieky
Vplyv COC na iné lieky: Perorálna antikoncepcia môže ovplyvňovať metabolizmus niektorých iných liečiv. Teda môžu ich koncentrácie v plazme a tkanivách buď zvyšovať (napr. cyklosporín) alebo znižovať (napr. lamotrigín).
Laboratórne vyšetreniaUžívanie antikoncepčných steroidov môže ovplyvniť výsledky niektorých laboratórnych testov, vrátane biochemických parametrov pečeňových, tyreoidálnych, adrenálnych a renálnych funkcií, plazmatických koncentrácií (transportných) proteínov napr. globulínu viažuceho kortikosteroidy a lipid/lipoproteínových frakcií, parametrov metabolizmu sacharidov a parametrov koagulácie a fibrinolýzy. Zmeny však zvyčajne zostávajú v rozmedzí referenčných laboratórnych hodnôt.
4.6 Fertilita, gravidita a laktáciaGraviditaGentilionnie je indikovaný počas gravidity (pozri časť 4.3). Ak v priebehu užívania Gentilionu dôjde ku gravidite, liek sa musí okamžite vysadiť.
Rozsiahle epidemiologické štúdie neodhalili zvýšené riziko vrodených chýb u detí narodených ženám, ktoré užívali antikoncepčné tablety pred graviditou, ani teratogénny vplyv po neúmyselnom užití antikoncepčných tabliet v rannej gravidite.
Pri opätovnom začatí užívania Gentilionuv období po pôrode treba vziať do úvahy zvýšené riziko VTE (pozri časti 4.2 a 4.4).
LaktáciaLaktácia môže byť ovplyvnená používaním antikoncepčných steroidov, pretože môžu znižovať množstvo materského mlieka a meniť jeho zloženie. V materskom mlieku dojčiacich matiek boli identifikované malé množstvá antikoncepčných steroidov a/alebo ich metabolitov a bolo hlásených niekoľko nežiaducich účinkov na dieťa, vrátane žltačky a zväčšenia prsníkov. Z tohto dôvodu sa užívanie antikoncepčných steroidov vo všeobecnosti dojčiacim matkám neodporúča, až kým matka úplne neprestane dieťa dojčiť.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeGestodén/etinylestradiol nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinkyPopis vybraných nežiaducich reakcií
U žien používajúcich kombinovanú hormonálnu antikoncepciu sa pozorovalo zvýšené riziko vzniku arteriálnych a venóznych trombotických a trombembolických udalostí vrátane infarktu myokardu, cievnej mozgovej príhody, prechodných ischemických záchvatov, venóznej trombózy a pľúcnej embólie, ktoré sú podrobnejšie uvedené v časti 4.4.
Najčastejšie hlásené nežiaduce účinky (> 1/10)sú nepravidelné krvácanie, nauzea, nárast telesnej hmotnosti, citlivosť prsníkov a bolesť hlavy. Zvyčajne sa vyskytujú na začiatku liečby a sú prechodné.
Trieda orgánového
systému
| Časté (≥1/100
až< 1/10)
| Menej časté
(≥1/1 000 až
< 1/100)
| Zriedkavé
(≥1/10 000 až
< 1 000)
| Veľmi zriedkavé
(<1/10 000)
|
Poruchy nervového systému
| Bolesť hlavy
Nervozita
|
|
| Chorea
|
Poruchy oka
| Podráždenie oka pri používaní kontaktných šošoviek
Poruchy videnia
|
|
|
|
Poruchy ucha a labyrintu
|
|
| Otoskleróza
|
|
Poruchy gastrointesti-nálneho traktu
| Nauzea
| Vracanie
| Cholelitiáza
| Pankreatitída
|
Poruchy kože a podkožného tkaniva
| Akné
|
| Chloazma
|
|
Poruchy metabolizmu a výživy
|
| Hyperlipidémia
|
|
|
Poruchy ciev
| Migréna
| Hypertenzia
| Venózny trombembolizmus
Arteriálne trombembolické poruchy
|
|
Celkové poruchy a reakcie v mieste podania
| Nárast telesnej hmotnosti
Retencia tekutín
|
|
|
|
Poruchy imunitného systému
|
|
| Lupus erythematosus
|
|
Poruchy reprodukčného systému a prsníkov
| Nepravidelné krvácanie
Amenorea
Hypomenorea
Citlivosť prsníkov
|
| Zmeny vaginálnej sekrécie
|
|
Psychické poruchy
| Zmeny libida
Depresia
Podráždenosť
|
|
|
|
Nasledovné závažné nežiaduce udalosti, ktoré sa hlásili u žien užívajúcich COC, pozri časti 4.3 a 4.4.
- Venózny trombembolizmus, napr. trombóza hlbokých žíl nohy alebo panvy a pľúcna embólia
- Arteriálne trombembolické poruchy
- Nádory pečene
- Poruchy kože a podkožného tkaniva: chloazma
U používateliek COC je veľmi mierne zvýšená frekvencia diagnózy rakoviny prsníka. Pretože výskyt rakoviny prsníka je u žien do 40 rokov zriedkavý, zvýšený počet diagnostikovanej rakoviny prsníka je v pomere k celkovému riziku rakoviny prsníka malý. Kauzalita s užívaním COC nie je známa. Ďalšie informácie pozri v častiach 4.3 a 4.4.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.
4.9 PredávkovanieNeexistujú žiadne hlásenia o závažných škodlivých účinkoch predávkovania. Symptómy, ktoré sa pri predávkovaní môžu vyskytnúť sú: nauzea, vracanie a vaginálne krvácanie. Neexistujú žiadne antidotá a liečba má byť symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTIFarmakoterapeutická skupina: Hormonálne kontraceptíva na systémové použitie; gestagény a estrogény, fixné kombinácie, ATC kód: G03AA10
5.1 Farmakodynamické vlastnostiCelkový Pearlov index (gravidity v dôsledku zlyhania metódy + gravidity v dôsledku zlyhania pacientok) pre etinylestradiol/gestodén 20/75 µg je 0,31 (95 % IS: 0,59). Pearlov index pre zlyhanie metódy je 0,16 (95 % IS: 0,36).
Antikoncepčný účinok COC je založený na spolupôsobení viacerých faktorov. Najdôležitejšie z nich sú inhibícia ovulácie a zmeny endometria.
5.2 Farmakokinetické vlastnostiGestodén
AbsorpciaPerorálne podaný gestodén sa rýchlo a úplne absorbuje. Maximálna plazmatická koncentrácia 4 ng/ml sa dosiahne približne 1 hodinu po užití jednorazovej dávky.Absolútna biologická dostupnosť je približne 99 %.
DistribúciaGestodén sa viaže na sérový albumín a na pohlavný hormón viažuci globulín (SHBG). Z celkového množstva gestodénu v sére je len 1-2 % vo forme voľného steroidu a až 50-70 % sa špecificky viaže na SHBG. Etinylestradiolom indukovaný nárast SHBG ovplyvňuje distribúciu sérových proteínov, čo má za následok vzostup frakcie naviazanej na SHBG a pokles frakcie naviazanej na albumín. Zdanlivý distribučný objem gestodénu je 0,7 l/kg.
BiotransformáciaGestodén sa kompletne metabolizuje známou metabolickou dráhou steroidov. Metabolický klírens je približne 0,8 ml/min/kg. Pri súbežnom podaní gestodénu s etinylestradiolom nedochádza k žiadnej interakcii.
ElimináciaSérová koncentrácia gestodénu klesá v dvoch fázach. Konečná vylučovacia fáza je charakterizovaná polčasom eliminácie asi 12-15 hodín.
Gestodén sa nevylučuje v nezmenenej forme. Metabolity sa vylučujú močom a žlčou v pomere asi 6:4. Eliminačný polčas metabolitov je približne 1 deň.
Farmakokinetika/farmakodynamikaFarmakokinetika gestodénu je ovplyvnená koncentráciou SHBG v sére, ktorá je etinylestradiolom trojnásobne zvýšená. Pri každodennom užívaní stúpne koncentrácia gestodénu v sére až na približne štvornásobnú hodnotu ako po jednorazovom podaní, pričom rovnovážny stav sa dosiahne v druhej polovici liečebného cyklu.
Etinylestradiol
AbsorpciaPerorálne podaný etinylestradiol sa absorbuje rýchlo a úplne. Maximálna koncentrácia v sére 80 pg/ml sa dosiahne počas 1 – 2 hodiny. Maximálna biologická dostupnosť, ako výsledok presystémovej konjugácie a prvého priechodu pečeňou, je približne 60 %.
DistribúciaPočas laktácie prechádza do materského mlieka 0,02 % dennej dávky, ktorú užila matka.
Etinylestradiol sa predominantne viaže nešpecificky na albumín (približne 98,5), a vyvoláva vzostup koncentrácie SHBG v sére. Zdanlivý distribučný objem je približne 5 l/kg
BiotransformáciaEtinylestradiol podlieha presystémovej konjugácii v sliznici tenkého čreva a v pečeni. Etinylestradiol sa primárne metabolizuje aromatickou hydroxyláciou, ale vzniká široké spektrum hydroxylovaných a metylovaných metabolitov, ktoré sú prítomné vo voľnej forme, ako aj vo forme glukuronátov a sulfátov. Rýchlosť metabolického klírensu je asi 5 ml/min/kg.
ElimináciaKoncentrácia etinylestradiolu v sére klesá v dvoch fázach, konečná vylučovacia fáza má polčas eliminácie 24 hodín. Nezmenený etinylestradiol sa nevylučuje, ale jeho metabolity sa vylučujú močom a žlčou v pomere 4:6. Eliminačný polčas metabolitov je približne 1 deň.
Farmakokinetika/farmakodynamikaRovnovážny stav sa dosiahne po 3-4 dňoch, koncentrácie etinylestradiolu v sére sú o 30-40 % vyššie ako pri jednorazovom podaní.
5.3 Predklinické údaje o bezpečnostiEtinylestradiol a gestodén nie sú genotoxické. Štúdie karcinogenity so samotným etinylestradiolom alebo v kombinácii s rôznymi gestagénmi neodhalili žiadne osobitné riziko pre ženy pri indikovanom použití na antikoncepciu. Je však potrebné poznamenať, že pohlavné hormóny môžu urýchliť rast určitých tkanív a nádorov závislých od hormónov.
Štúdie reprodukčnej toxicity na fertilitu, vývin plodu alebo reprodukčnú schopnosť so samotným etinylestradiolom alebo v kombinácii s gestagénmi neodhalili žiadne nežiaduce účinky u ľudí pri odporúčanom použití.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látok
Monohydrát laktózy
Mikrokryštalická celulóza
Povidón K-30
Magnéziumstearát
Draselná soľ polakrilínu
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti21 mesiacov.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote do 30 °C. Uchovávajte blister vo vonkajšom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah baleniaPriehľadný až mierne nepriehľadný transparentný PVC/PVdC-Al blister.
Veľkosti balenia:
1 x 21 tabliet
3 x 21 tabliet
6 x 21 tabliet
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomNepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIEGIS Pharmaceuticals PLC
Keresztúri út 30-38
H-1106 Budapešť
Maďarsko
8. REGISTRAČNÉ ČÍSLO17/0130/15-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUApríl 2015