
alergiám, vedúce k srdcovým problémom, sťaženému dýchaniu alebo kožným reakciám. Môžu sa vyskytnúť aj závažné reakcie. Väčšina týchto reakcií sa objaví do pol hodiny po podaní Gadovistu. Preto budete po vyšetrení pozorovaný. Pozorovali sa aj oneskorené reakcie (po hodinách alebo dňoch) (pozri časť 4).
Obličky/Pečeň
Povedzte svojmu lekárovi, ak:
· vaše obličky nepracujú správne,
· vám nedávno transplantovali pečeň alebo očakávate, že vám ju budú čoskoro transplantovať.
Predtým, ako sa lekár rozhodne použiť Gadovist sa môže rozhodnúť vykonať krvné testy, aby preveril,
ako dobre vaše obličky pracujú, najmä ak ste vo veku 65 rokov alebo starší.
Novorodenci a dojčatá
Keďže je funkcia obličiek u novorodencov do 4. týždňa veku a dojčiat do 1.roka nezrelá, Gadovist sa má použiť u týchto pacientov len po starostlivom zvážení lekárom.
Iné lieky a Gadovist
Ak teraz užívate alebo ste v poslednom čase užívali, či práve budete užívať ďalšie lieky, povedzte to
svojmu lekárovi.
Tehotenstvo a dojčenie
Predtým ako začnete užívať akýkoľvek liek, poraďte sa so svojím lekárom.
· Tehotenstvo
Ak si myslíte, že ste alebo že by ste mohli byť tehotná, musíte to oznámiť svojmu lekárovi, pretože ak to
nie je úplne nevyhnutné, Gadovist sa počas tehotenstva nemá používať.
· Dojčenie
Ak dojčíte alebo chcete začať dojčiť, povedzte to svojmu lekárovi. Váš lekár posúdi či máte pokračovať v dojčení alebo ho máte prerušiť na obdobie 24 hodín po podaní Gadovistu.
Gadovist obsahuje sodík
Tento liek obsahuje menej ako 23 mg sodíka v dávke (na základe priemerného množstva podávaného osobám s hmotnosťou 70 kg), t.j. v podstate zanedbateľné množstvo sodíka.
3. Ako vám bude Gadovist podaný
Gadovist podáva zdravotnícky pracovník injekčne do vašej žily cez malú ihlu. Vaše MRI vyšetrenie sa
začne okamžite po jeho podaní.
Po injekčnom podaní vás budú najmenej 30 minút pozorovať.
Zvyčajná dávka
Skutočná dávka Gadovistu, ktorá je pre vás správna, bude závisieť od vašej telesnej hmotnosti a oblasti
vyšetrovanej pomocou MRI.
Pre dospelých zvyčajne stačí jedno injekčné podanie 0,1 mililitra Gadovistu na kg telesnej hmotnosti (to znamená, že pre osobu s hmotnosťou 70 kg by dávka bola 7 mililitrov), avšak do 30 minút po prvej injekcii sa môže podať ďalšia injekcia až do 0,2 ml/kg telesnej hmotnosti. Celkovo možno podať najviac
0,3 mililitra Gadovistu na kg telesnej hmotnosti.
Ďalšie informácie o podávaní Gadovistu a zaobchádzaní s ním sa nachádzajú na konci tejto písomnej informácie.
Dávkovanie u osobitných skupín pacientov
U pacientov so závažnými problémami s obličkami alebo u pacientov, ktorým nedávno transplantovali pečeň alebo u tých, ktorí očakávajú, že im ju budú čoskoro transplantovať sa použitie Gadovistu neodporúča. Ak sa však použitie vyžaduje, máte počas vyšetrenia dostať iba jednu dávku Gadovistu a
v priebehu nasledujúcich aspoň 7 dní nesmiete dostať ďalšiu injekciu.
Novorodenci, dojčatá, deti a dospievajúci
Pre deti každého veku (vrátane donosených novorodencov) sa na všetky vyšetrenia (pozri časť 1)
odporúča podanie jednej dávky 0,1 mililitra Gadovistu na kg telesnej hmotnosti.
Keďže funkcia obličiek je u novorodencov do 4. týždňa veku a dojčiat do 1.roka nezrelá, Gadovist sa má použiť u týchto pacientov len po starostlivom zvážení lekárom. Novorodenci a dojčatá majú počas vyšetrenia dostať iba jednu dávku Gadovistu a v priebehu nasledujúcich aspoň 7 dní nesmú dostať ďalšiu injekciu.
Starší pacienti
Ak máte 65 rokov alebo viac, nie je potrebné upravovať vašu dávku, ale môžu vám vykonať krvné testy, aby sa zistilo, ako dobre vaše obličky pracujú.
Ak dostanete viac Gadovistu, ako máte dostať:
Predávkovanie nie je pravdepodobné. Ak k nemu dôjde, lekár bude liečiť všetky príznaky a na odstránenie
Gadovistu z vášho tela sa môže použiť dialýza obličiek.
Neexistujú dôkazy, ktoré by naznačovali, že táto metóda zabráni vývinu nefrogénnej systémovej fibrózy (NSF, pozri časť 4) a na liečbu tohto stavu sa dialýza nesmie použiť. V niektorých prípadoch sa skontroluje vaše srdce.
Ak máte akékoľvek ďalšie otázky týkajúce sa použitia tohto lieku, opýtajte sa svojho lekára alebo rádiológa.
4. Možné vedľajšie účinky
Tak ako všetky lieky, aj tento liek môže spôsobovať vedľajšie účinky, hoci sa neprejavia u každého.
N
ajzávažnejšie vedľajšie účinky (ktoré sú v niektorých prípadoch smrteľné alebo ohrozujú život) sú:
· srdce prestane tĺcť (zastavenie srdca) a závažné alergii podobné (anafylaktoidné) reakcie (vrátane
zastavenia dýchania a šoku).
Ďalej sa pri výskyte nasledujúcich vedľajších účinkov v niektorých prípadoch pozorovali život ohrozujúce reakcie alebo reakcie so smrteľným následkom:
· ťažkosti s dýchaním (dyspnoe), strata vedomia, závažné alergii podobné reakcie, závažný pokles
krvného tlaku, ktorý môže viesť ku kolapsu, zastavenie dýchania, tekutina v pľúcach, opuch úst a hrdla a nízky krvný tlak.
V zriedkavých prípadoch:
· sa môžu vyskytnúť reakcie podobné alergickým (precitlivenosť a anafylaxia), vrátane závažných reakcií (šok), ktoré si môžu vyžadovať okamžitý zásah lekára.
Ak zaznamenáte:
· opuch tváre, pier, jazyka alebo hrdla,
· kašlanie a kýchanie,
· ťažkosti s dýchaním,
· svrbenie,
· nádchu,
· žihľavku,
okamžite to povedzte personálu MRI centra. Môžu byť prvými prejavmi, ktoré sa vyskytnú
pri závažnej reakcii. Možno bude potrebné ukončiť vaše vyšetrenie a možno budete potrebovať ďalšiu liečbu.
Oneskorené reakcie podobné alergickým sa v zriedkavých prípadoch pozorovali po hodinách až niekoľkých dňoch po podaní Gadovistu. Ak sa vám to stane, povedzte to okamžite svojmu lekárovi alebo rádiológovi.
Najčastejšie pozorované vedľajšie účinky (môžu postihovať 5 alebo viac z 1 000 osôb) sú:
· bolesť hlavy, pocit na vracanie (nauzea) a závrat.
Intenzita väčšiny týchto vedľajších účinkov je mierna až stredne závažná.
Možné vedľajšie účinky, ktoré sa pozorovali v klinických skúšaniach pred schválením Gadovistu sú uvedené nižšie podľa pravdepodobnosti výskytu.
Časté (môžu postihovať menej ako 1 z 10 osôb)
· bolesť hlavy,
· pocit na vracanie (nauzea).
Menej časté (môžu postihovať menej ako 1 zo 100 osôb)
· alergii podobné reakcie, napr.
- nízky krvný tlak,
- žihľavka,
- opuch tváre,
- opuch (edém) očného viečka,
- návaly tepla.
Častosť nasledujúcich reakcií podobných alergickej nie je známa:
- závažná reakcia podobná alergickej (anafylaktoidný šok),
- závažné zníženie krvného tlaku, ktoré môže viesť ku kolapsu (šok),
- zastavenie dýchania,
- tekutina v pľúcach,
- sťažené dýchanie (bronchospazmus),
- zmodrenie pier,
- opuch úst a hrdla,
- opuch hrdla,
- zvýšený tlak krvi,
- bolesť na hrudníku,
- opuch tváre, hrdla, úst, pier a/alebo jazyka (angioedém),
- zápal spojoviek,
- nadmerné potenie,
- kašeľ,
- kýchanie,
- pocit pálenia,
- bledosť tváre.
· závrat, poruchy chuti, mravčenie a brnenie,
· sťažené dýchanie (dyspnoe),
· vracanie,
· sčervenanie kože (erytém),
· svrbenie (pruritus) vrátane celkového svrbenia,
· vyrážka (vrátane celkovej vyrážky, malých plochých červených škvŕn [makulárna vyrážka], malých, vyvýšených, ohraničených lézií [papulárna vyrážka] a svrbiacej [pruritickej] vyrážky),
· rôzne druhy reakcií v mieste podania injekcie (napr. presakovanie do okolitého tkaniva, pálenie,
pocit chladu, tepla, sčervenanie, vyrážka, bolesť alebo tvorba modrín),
· pocit horúčavy.
Zriedkavé (môžu postihovať menej ako 1 z 1 000 osôb)
· mdloby,
· záchvaty,
· porucha čuchu,
· rýchly tep srdca,
· búšenie srdca,
· sucho v ústach,
· celkový pocit choroby (malátnosť),
· pocit chladu.
Dodatočné vedľajšie účinky s neznámou častosťou (častosť sa nedá odhadnúť z dostupných údajov), ktoré sa hlásili po uvedení Gadovistu na trh:
· srdce prestane biť (zastavenie srdca),
· hlásili sa prípady nefrogénnej systémovej fibrózy - NSF (ktorá zapríčiňuje stvrdnutie kože a môže mať vplyv taktiež na mäkké tkanivo a vnútorné orgány).
Po podaní Gadovistu sa pozorovali zmeny v krvných testoch funkcie obličiek (napr. nárast kreatinínu
v sére).
Hlásenie vedľajších účinkov

Ak sa u vás vyskytne akýkoľvek vedľajší účinok, obráťte sa na svojho lekára alebo rádiológa. To sa týka aj akýchkoľvek vedľajších účinkov, ktoré nie sú uvedené v tejto písomnej informácii. Vedľajšie účinky môžete hlásiť aj priamo na národné centrum hlásenia uvedené v
Prílohe V. Hlásením vedľajších účinkov môžete prispieť k získaniu ďalších informácií o bezpečnosti tohto lieku.
5. Ako uchovávať GadovistTento liek uchovávajte mimo dohľadu a dosahu detí.
Nepoužívajte tento liek po dátume exspirácie, ktorý je uvedený na štítku a škatuľke po EXP. Dátum exspirácie sa vzťahuje na posledný deň v danom mesiaci. Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
Chemická, fyzikálna a mikrobiologická stabilita pri používaní bola preukázaná po dobu 24 hodín pri
teplote 20-25°C. Z mikrobiologického hľadiska sa má liek použiť okamžite po otvorení.
Tento liek je číry bezfarebný až bledožltý injekčný roztok. Liek sa nesmie použiť v prípade závažnej
zmeny sfarbenia, prítomnosti častíc alebo ak sa obal zdá byť poškodený.
Lieky sa nesmú likvidovať odpadovou vodou alebo domovým odpadom. Zdravotnícky pracovník zlikviduje tento liek, ak už nie je potrebný. Tieto opatrenia pomôžu chrániť životné prostredie.
6. Obsah balenia a ďalšie informácieČo Gadovist obsahujeLiečivo je gadobutrol.
1 ml injekčného roztoku obsahuje 604,72 mg gadobutrolu (čo zodpovedá 1 mmol gadobutrolu s obsahom
157,25 mg gadolínia).
1 naplnená injekčná striekačka s 5,0 ml obsahuje 3 023,6 mg gadobutrolu.
1 naplnená injekčná striekačka so 7,5 ml obsahuje 4 535,4 mg gadobutrolu.
1 naplnená injekčná striekačka s 10 ml obsahuje 6 047,2 mg gadobutrolu.
1 naplnená injekčná striekačka s 15 ml obsahuje 9 070,8 mg gadobutrolu.
1 naplnená injekčná striekačka s 20 ml obsahuje 12 094,4 mg gadobutrolu.
1 náplň s 15 ml obsahuje 9 070,8 mg gadobutrolu.
1 náplň s 20 ml obsahuje 12 094,4 mg gadobutrolu.
1 náplň s 30 ml obsahuje 18 141,6 mg gadobutrolu.
Ďalšie zložky sú sodná soľ kalkobutrolu (pozri koniec časti 2), trometamol, kyselina chlorovodíková 1N a voda na injekcie.
A
ko vyzerá Gadovist a obsah balenia
Gadovist je číry, bezfarebný až bledožltý injekčný roztok. Obsah balenia:
· 1 alebo 5 naplnených injekčných striekačiek s 5 ml; 7,5 ml; 10 ml injekčného roztoku (v 10 ml sklenenej alebo plastovej naplnenej injekčnej striekačke)
· 1 alebo 5 naplnených injekčných striekačiek s 15 ml injekčného roztoku (v 17 ml sklenenej
naplnenej injekčnej striekačke al ebo 20 ml pl ast ovej napl nenej i nj ekčn ej str iekač ke )
· 1 alebo 5 naplnených injekčných striekačiek s 20 ml injekčného roztoku (v 20 ml sklenenej alebo plastovej naplnenej injekčnej striekačke)
· 1 alebo 5 náplní s 15 ml, 20 ml, 30 ml injekčného roztoku (v 65 ml náplni).
Nemocničné balenie:
· 5 naplnených injekčných striekačiek s 5 ml; 7,5 ml; 10 ml; 15 ml; 20 ml injekčného roztoku
· 5 naplnených náplní s 15 ml; 20 ml; 30 ml injekčného roztoku
Na trh nemusia byť uvedené všetky veľkosti balenia.
Držiteľ rozhodnutia o registráciiBayer AG
Kaiser-Wilhelm-Allee 1
513 73 Leverkusen
Nemecko
Výrobca: Bayer AG Müllerstrasse 178
13353 Berlín, Nemecko
Liek je schválený v členských štátoch Európskeho hospodárskeho priestoru (EHP) pod nasledovnými názvami: Rakúsko, Nemecko
| Gadovist 1,0 mmol/ml Injektionslösung in
Fertigspritzen/Patronen
|
Belgicko, Bulharsko, Cyprus, Dánsko, Estónia, Fínsko, Grécko, Taliansko, Luxembursko, Nórsko, Portugalsko, Švédsko
| Gadovist
|
Chorvátsko
| Gadovist 1,0 mmol/ml otopina za injekciju u napunjenoj štrcaljki/ulošku
|
Francúzsko
| GADOVIST 1,0 mmol/mL, solution injectable
en seringue préremplie
|
Írsko
| Gadovist 1.0 mmol/ml solution for injection in prefilled syringe
Gadovist 1.0 mmol/ml solution for injection in prefilled cartridge
|
Holandsko
| Gadovist 1,0 mmol/ml, oplossing voor injectie in voorgevulde spuit/ patroon
|
Slovensko
|
Gadovist 1 mmol/ ml
|
Slovinsko
|
Gadovist 1,0 mmol/ml raztopina za injiciranje v
napolnjeni injekcijski brizgi/vložku
|
Španielsko
|
Gadovist 1 mmol/ml solución inyectable en
jeringa precargada / cartucho precargado
|
Spojené kráľovstvo (Severné Írsko), Malta
|
Gadovist 1.0 mmol/ml solution for injection pre- filled syringe / cartridge
|
T
áto písomná informácia pre používateľa bola naposledy aktualizovaná v marci 2021.
-----------------------------------------------------------------------------------------------------------------------------
Nasledujúca informácia je určená len pre zdravotníckych pracovníkov:
·
Porucha funkcie obličiekPred podaním Gadovistu sa odporúča, aby sa všetci pacienti podrobili skríningu dysfunkcie obličiek pomocou laboratórnych vyšetrení.U pacientov s akútnou alebo chronickou závažnou poruchou funkcie obličiek (GFR < 30 ml/min/1,73 m2) boli hlásené prípady nefrogénnej systémovej fibrózy (NSF) spojené s používaním niektorých kontrastných látok obsahujúcich gadolínium. Pacienti, ktorí podstupujú transplantáciu pečene sú vystavení osobitnému riziku, pretože výskyt akútneho renálneho zlyhania je v tejto skupine vysoký. Keďže pri používaní Gadovistu existuje možnosť výskytu NSF, u pacientov so závažnou poruchou funkcie obličiek a
u pacientov v perioperačnom období transplantácie pečene sa má preto používať iba po starostlivom
zhodnotení pomeru rizika a prínosu, a ak je diagnostická informácia nevyhnutná a nedá sa získať nekontrastným zobrazovaním MRI. Ak je potrebné použiť Gadovist, dávka nesmie prekročiť 0,1 mmol/kg telesnej hmotnosti. Počas vyšetrenia sa nesmie použiť viac ako jedna dávka. Z dôvodu chýbajúcich informácií o opakovanom podávaní sa injekcie Gadovistu nesmú opakovať pokiaľ nie je interval medzi injekciami minimálne 7 dní.
Keďže u starších pacientov môže byť renálny klírens gadobutrolu zhoršený, je osobitne dôležité pacientov vo veku 65 rokov a starších podrobiť skríningu dysfunkcie obličiek.
Hemodialýza krátko po podaní Gadovistu môže byť prospešná na odstránenie Gadovistu z organizmu.
Neexistujú dôkazy, ktoré podporujú zavedenie hemodialýzy na prevenciu alebo na liečbu NSF
u pacientov, u ktorých sa doposiaľ hemodialýza nevykonávala.
·
Gravidita a dojčenieGadovist sa nemá používať počas gravidity pokiaľ si klinický stav ženy nevyžaduje jeho použitie. Pokračovanie v dojčení alebo prerušenie dojčenia na obdobie 24 hodín po podaní Gadovistu má byť
na uvážení lekára a dojčiacej matky.
·
Hypersenzitívne reakcieRovnako ako pri ostatných intravenóznych kontrastných látkach, aj podanie Gadovistu môže byť spojené s anafylaktoidnými reakciami/hypersenzitívnymi reakciami, alebo ďalšími idiosynkratickými reakciami, ktoré sú charakterizované kardiovaskulárnymi, respiračnými alebo kožnými prejavmi v rozsahu až
po závažné reakcie vrátane šoku. Pacienti s kardiovaskulárnymi ochoreniami sú vo všeobecnosti náchylnejší na závažné alebo až fatálne dôsledky závažných hypersenzitívnych reakcií.
Riziko hypersenzitívnych reakcií môže byť vyššie v prípade:
- predošlej reakcie na kontrastnú látku,
- bronchiálnej astmy v anamnéze,
- alergických stavov v anamnéze.
Rozhodnutiu o použití Gadovistu u pacientov s alergickou predispozíciou musí predchádzať veľmi dôkladné posúdenie pomeru rizika a prínosu.
Väčšina týchto reakcií sa objaví do pol hodiny po podaní lieku. Preto sa po podaní odporúča sledovanie
pacienta.
Potrebné sú lieky na zvládnutie hypersenzitívnych reakcií ako aj pripravenosť na zavedenie urgentných opatrení.
Zriedkavo sa vyskytli oneskorené reakcie (po hodinách až niekoľkých dňoch).
· Záchvaty
Tak ako pri iných kontrastných látkach obsahujúcich gadolínium, aj tu je potrebná mimoriadna opatrnosť
u pacientov s nízkym prahom vzniku záchvatov.
· Predávkovanie
V prípade neúmyselného predávkovania sa z preventívnych dôvodov odporúča monitorovanie kardiovaskulárneho systému (vrátane EKG) a kontrola funkcie obličiek.
U pacientov s insuficienciou obličiek možno v prípade predávkovania Gadovist odstrániť hemodialýzou. Po 3 hemodialýzach sa z organizmu odstráni približne 98 % látky. Neexistujú však dôkazy, že hemodialýza je vhodná na prevenciu nefrogénnej systémovej fibrózy (NSF).
· Pred injekčným podaním
Tento liek je určený len na jednorazové použitie.
Tento liek je číry, bezfarebný až bledožltý roztok. Pred použitím sa musí vizuálne skontrolovať. Gadovist sa nesmie použiť v prípade závažnej zmeny sfarbenia, výskytu častíc alebo poškodenia obalu.
· Návod na použitie
Naplnené injekčné striekačky
Naplnená injekčná striekačka sa musí vybrať z balenia a pripravovať na podanie injekcie až bezprostredne pred použitím.
Kryt hrotu striekačky sa má z naplnenej injekčnej striekačky odstrániť bezprostredne pred použitím.'
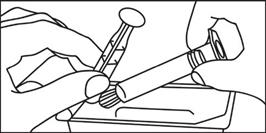
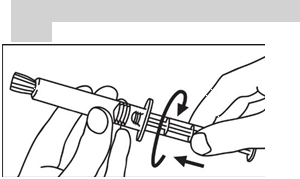
Sklenená naplnená injekčná striekačka: RUČNÉ PODANIE INJEKCIE
1. Otvorte balenie
|
2. Piest zaskrutkujte na injekčnú striekačku
|
3. Odlomte ochranný kryt
|
4. Odstráňte ochranný kryt
|
5. Odstráňte gumový uzáver
|
6. Vytlačte vzduch z injekčnej striekačky
|
Plastová naplnená injekčná striekačka:

RUČNÉ PODANIE INJEKCIE PODANIE INJEKCIE POMOCOU
INJEKTORA
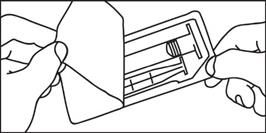
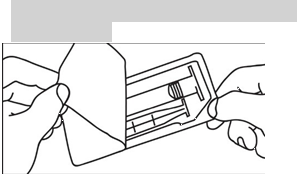
1. Otvorte balenie 1. Otvorte balenie
2. Vyberte injekčnú striekačku a piest z
obalu

3. Zasuňte piest do injekčnej striekačky otáčaním v smere hodinových ručičiek
2. V ybert e i nj ekčnú s tr iekač ku z obal u
3. Odskr ut kuj te uzáver

4. Odskr ut kuj te uzáver 4. Pripojte hrot injekčnej striekačky na
hadičku injektora a pokračujte podľa pokynov výrobcu injektora

5. Vytlačte vzduch z injekčnej
striekačky
N
áplne
Podávanie kontrastnej látky musí vykonávať kvalifikovaný personál s použitím príslušných postupov a vybavenia.
Pri všetkých injekciách vrátane kontrastných látok sa musí používať sterilná technika.
Kontrastná látka sa musí podávať pomocou injektora typu MEDRAD Spectris®. Musia sa dodržiavať pokyny výrobcu zariadenia.
Všetok roztok, ktorý sa nepoužil pri jednom vyšetrení, sa musí zlikvidovať v súlade s národnými požiadavkami.
Čas použiteľnosti po prvom otvorení obalu
Všetok injekčný roztok, ktorý sa nepoužil pri jednom vyšetrení, sa musí zlikvidovať. Chemická, fyzikálna a mikrobiologická stabilita pri používaní bola preukázaná po dobu 24 hodín pri teplote 20 – 25°C.
Z mikrobiologického hľadiska sa má liek použiť okamžite. Ak nie je možné okamžité použitie, za dobu
uskladnenia a podmienky skladovania zodpovedá používateľ.
Na záznam z vyšetrenia pacienta sa má nalepiť odlepovací označovací štítok z injekčných striekačiek/náplní, aby bolo možné presne zaznamenať, ktorá kontrastná látka obsahujúca gadolínium sa použila. Má sa zaznamenať aj použitá dávka. Ak sa používa elektronická zdravotná dokumentácia, má sa do záznamu z vyšetrenia pacienta zaznamenať názov lieku, číslo šarže a použitá dávka.
Dávkovanie
Má sa použiť najnižšia dávka, ktorá poskytne dostatočné zvýšenie kontrastu na diagnostické účely. Dávka sa má vypočítať na základe telesnej hmotnosti pacienta a nemá prekročiť odporúčanú dávku na kilogram telesnej hmotnosti uvedenú v tejto časti.
· Dospe lí
Indi kác i e pr e CNS:
Odporúčaná dávka pre dospelých je 0,1 mmol na kilogram telesnej hmotnosti (mmol/kg telesnej hmotnosti). To zodpovedá 0,1 ml 1,0 M roztoku/kg telesnej hmotnosti.
Ak pretrváva výrazné klinické podozrenie na lézie napriek normálnemu výsledku MRI alebo ak by presnejšie informácie mohli ovplyvniť liečbu pacienta, môže sa do 30 minút od prvej injekcie podať ďalšia injekcia až do 0,2 ml/kg telesnej hmotnosti.
Zobr azovani e c elého t ela pomocou M R I (okrem MRA)
Na zodpovedanie klinickej otázky je vo všeobecnosti postačujúce podanie 0,1 ml Gadovistu na kilogram telesnej hmotnosti.
CE-MRA
Zobrazenie 1 zorného poľa (FOV): 7,5 ml pre telesnú hmotnosť do 75 kg, 10 ml pre telesnú hmotnosť
75 kg a viac (čo zodpovedá 0,1 – 0,15 mmol/kg telesnej hmotnosti).
Zobrazenie >1 zorného poľa (FOV): 15 ml pre telesnú hmotnosť do 75 kg, 20 ml pre telesnú hmotnosť
75 kg a viac (čo zodpovedá 0,2 – 0,3 mmol/kg telesnej hmotnosti).
· Pedi at ri ck á popul áci a
Pre deti každého veku (vrátane donosených novorodencov) sa pre všetky indikácie (pozri časť 1) odporúča
dávka 0,1 mmol gadobutrolu na kilogram telesnej hmotnosti (zodpovedá 0,1 ml Gadovistu na kilogram telesnej hmotnosti).
Z dôvodu nezrelej funkcie obličiek u novorodencov do 4.týždňa veku a dojčiat do 1 roku, sa má Gadovist použiť u týchto pacientov iba po starostlivom zvážení a dávka nesmie prekročiť 0,1 mmol/kg telesnej hmotnosti. Počas vyšetrenia sa nesmie použiť viac ako jedna dávka. Z dôvodu chýbajúcich informácií o opakovanom podávaní sa injekcie Gadovistu nesmú opakovať pokiaľ nie je interval medzi injekciami minimálne 7 dní.
Zobrazenie
Požadovaná dávka sa podáva intravenózne ako bolusová injekcia. MRI s použitím kontrastnej látky sa môže vykonávať okamžite po podaní (krátko po injekčnom podaní v závislosti od použitých impulzných sekvencií a protokolu vyšetrenia).
Optimálne zosilnenie signálu pri CE-MRA sa pozoruje počas prvej pasáže artériami a pri vyšetrení CNS
do približne 15 minút po injekcii Gadovistu (čas závisí od typu lézie/tkaniva).
Na vyšetrenia s použitím kontrastnej látky sú obzvlášť vhodné T1-vážené skenovacie sekvencie. Ďalšie informácie o používaní Gadovistu sú uvedené v časti 3 tejto písomnej informácie.