innosť u tejto skupiny
pacientov nebola stanovená (pozri časť 5.1).
Pomocné látkyTento liek obsahuje 10% w/v etanolu (alkohol), t.j. do 1000 mg v jednej dávke, čo zodpovedá 20 ml piva alebo 8 ml vína v jednej dávke.
Nebezpečné pre ľudí trpiacich alkoholizmom.
Treba brať do úvahy u tehotných alebo dojčiacich žien, detí a vysokorizikových skupín ako sú pacienti s ochorením pečene alebo epilepsiou.
Tento liek obsahuje 100 mg benzylalkoholu v 1 ml. Nesmie sa podávať predčasne narodeným deťom alebo novorodencom. Liek môže spôsobiť toxické a anafylaktické reakcie u novorodencov a detí do 3 rokov.
Tento liek obsahuje 150 mg benzylbenzoátu v 1 ml. Môže zvyšovať riziko vzniku žltačky u novorodencov.
4.5 Liekové a iné interakcieKlinická interakčná štúdia s midazolamom (substrátom CYP3A4) preukázala, že fulvestrant
neinhibuje CYP3A4. Klinické interakčné štúdie s rifampicínom (induktor CYP3A4) a ketokonazolom
(inhibítor CYP3A4) nepreukázali žiadne klinicky významné zmeny klírensu fulvestrantu. Pacientom,
ktorým sa podáva fulvestrant súbežne s inhibítormi alebo induktormi CYP3A4, nie je preto potrebné
upravovať dávku.
4.6 Fertilita, gravidita a laktáciaŽeny vo fertilnom vekuPacientkám vo fertilnom veku sa má odporučiť používanie účinnej antikoncepcie počas liečby.
GraviditaFulvestrant Sandoz je kontraindikovaný v gravidite (pozri časť 4.3). Preukázalo sa, že fulvestrant prechádza
placentou po jednorazovej dávke u potkanov a králikov. Štúdie na zvieratách preukázali reprodukčnú
toxicitu, vrátane zvýšeného výskytu abnormalít a úmrtí plodu (pozri časť 5.3). Ak dôjde ku gravidite
pri užívaní Fulvestrantu Sandoz, musí byť pacientka informovaná o potenciálnom riziku pre plod a potenciálnom riziku potratu.
LaktáciaPočas liečby Fulvestrantom Sandoz sa musí dojčenie ukončiť. Fulvestrant sa u samíc potkanov vylučuje do materského mlieka. Nie je známe, či sa fulvestrant vylučuje do materského mlieka aj u ľudí.
Vzhľadom k možnosti závažných nežiaducich účinkov fulvestrantu u dojčených detí je používanie
počas laktácie kontraindikované (pozri časť 4.3).
FertilitaÚčinky Fulvestrantu Sandoz na plodnosť ľudí sa nehodnotili.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeFulvestrant Sandoz nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá alebo obsluhovať stroje. Vzhľadom na to, že sa počas užívania Fulvestrantu veľmi často vyskytli prípady asténie, musí sa venovať zvýšená opatrnosť pacientkám, u ktorých sa vyskytol tento nežiaduci účinok počas vedenia motorových vozidiel alebo obsluhy strojov.
4.8 Nežiaduce účinkyV tejto časti sa nachádzajú informácie, vychádzajúce zo všetkých nežiaducich udalostí z klinických
skúšaní, postmarketingových skúšaní alebo zo spontánnych hlásení. Najčastejšie hlásené nežiaduce
účinky sú reakcie v mieste podania injekcie, asténia, nauzea a zvýšenie hepatálnych enzýmov (ALT,
AST, ALP).
Boli zistené nasledujúce kategórie frekvencií nežiaducich reakcií (adverse drug reactions, ADRs),
ktoré sú založené na spoločných analýzach bezpečnosti v liečebnej skupine užívajúcej fulvestrant
500 mg v štúdiách CONFIRM (Štúdia D6997C00002), FINDER 1 (Štúdia D6997C00004), FINDER 2
(Štúdia D6997C00006) a NEWEST (Štúdia D6997C00003) porovnávajúcich fulvestrant 500 mg
s fulvestrantom 250 mg. V nasledujúcej tabuľke sú frekvencie založené na všetkých hlásených
udalostiach bez ohľadu na hodnotenie kauzality skúšajúcim.
Nižšie uvedené nežiaduce udalosti sú klasifikované podľa frekvencie a triedy orgánových systémov
(System Organ Class – SOC). Skupiny frekvencií sú definované nasledovne: veľmi časté (≥1/10),
časté (≥1/100 až <1/10), menej časté (≥ 1/1000 až < 1/100). V rámci jednotlivých skupín frekvencií sú
nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Tabuľka 1 Nežiaduce účinkyNežiaduce reakcie podľa orgánových systémov a frekvencie
|
Infekcie a nákazy
| Časté
| Infekcie močového systému
|
Poruchy krvi a lymfatického systému
| Menej časté
| Zníženie počtu krvných dostičiek
|
Poruchy imunitného systému
| Časté
| Hypersenzitívne reakcie
|
Metabolické a nutričné poruchy
| Časté
| Anorexiaa
|
Poruchy nervového systému
| Časté
| Bolesť hlavy
|
Cievne poruchy
| Časté
| Venózna tromboembóliaa, návaly
tepla
|
Poruchy gastrointestinálneho traktu
| Veľmi časté
| Nauzea
|
Časté
| Vracanie, hnačka
|
Poruchy pečene a žlčových ciest
| Veľmi časté
| Zvýšenie hladín pečeňových
enzýmov (ALT, AST, ALP)a
|
Časté
| Zvýšený bilirubína
|
Menej časté
| Zlyhanie pečenec, hepatitídac, zvýšené gama-GT
|
Poruchy kože a podkožných tkanív
| Časté
| Vyrážka
|
Poruchy kostí, svalov a spojivových tkanív
| Časté
| Bolesť chrbtaa
|
Poruchy reprodukčného systému a prsníkov
| Menej časté
| Vaginálna moniliáza, leukorea,
vaginalne krvácanie
|
Celkové poruchy a reakcie v mieste podania
| Veľmi časté
| Asténiaa, reakcie v mieste podania
injekcieb
|
Menej časté
| Krvácanie v mieste vpichu, hematóm v mieste vpichu
|
a Vrátane nežiaducich reakcií, pre ktoré presný rozsah závažnosti užívania Fulvestrantu nemôže byť stanovený vzhľadom na základné ochorenie.
b Termín reakcie v mieste vpichu nezahŕňa podmienky v mieste vpichu a krvácanie v mieste vpichu hematóm.
c Udalosť sa nepozorovala vo veľkých klinických štúdiách (CONFIRM, FINDER 1, FINDER 2. NEWEST). Frekvencia sa vypočítala pomocou hornej hranice 95% intervalu spoľahlivosti pre odhad bodu. Počíta sa ako 3/563 (kde 563 je počet pacientov vo veľkých klinických štúdiách), čo zodpovedá na frekvenciu kategórie "menej časté“.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.*
4.9 PredávkovanieNie sú žiadne skúsenosti s predávkovaním u ľudí. Skúšky na zvieratách udávajú, že okrem účinkov
priamo alebo nepriamo spojených s antiestrogénnou aktivitou, sa pri vyšších dávkach fulvestrantu
nepreukázali žiadne iné účinky (pozri časť 5.3). V prípade predávkovania sa odporúča symptomatická
podporná liečba.
5 FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Endokrinná liečba, Antiestrogény, ATC kód: L02BA03
Mechanizmus účinku a farmakodynamické účinkyFulvestrant je kompetitívny antagonista estrogénového receptora (ER) s afinitou porovnateľnou
s estradiolom. Fulvestrant blokuje trofický účinok estrogénov bez akejkoľvek čiastočnej agonistickej
(estrogénu podobnej) aktivity. Mechanizmus účinku je spojený s potlačením hladín proteínu
estrogénového receptora.
Klinické skúšky u postmenopauzálnych žien s primárnou rakovinou prsníka
preukázali, že fulvestrant významne znižuje ER proteín v ER pozitívnych nádoroch v porovnaní s
placebom. Taktiež sa pozorovalo významné zníženie expresie progesterónového receptora bez
agonistického účinku na vnútorný estrogén. Tiež sa preukázalo, že fulvestrant 500 mg znižuje ER a
proliferáciu markeru Ki67, vo väčšej miere ako fulvestrant 250 mg v nádoroch prsníka v
postmenopauzálnej neoadjuvantnej liečbe.
Klinická bezpečnosť a účinnosť pri pokročilom karcinóme prsníkaKlinickú štúdiu fázy III ukončilo 736 postmenopauzálnych žien s pokročilým karcinómom prsníka,
ktoré mali rekurenciu ochorenia počas alebo po adjuvantnej endokrinnej liečbe alebo progresii
následnej endokrinnej liečby pokročilého ochorenia. Štúdia zahŕňala 423 pacientov, ktorí recidivovali
alebo mali progresiu počas antiestrogénnej liečby (AE podskupina) a 313 pacientov, ktorí recidivovali
alebo mali progresiu počas liečby inhibítorom aromatázy (AI podskupina). Táto štúdia porovnávala
účinnosť a bezpečnosť fulvestrantu 500 mg (n=362) s fulvestrantom 250 mg (n=374). Prežitie progresie
(PFS) bolo primárnym cieľom, kľúčové sekundárne ciele bezpečnosti zahŕňali objektívnu mieru
odpovede (objective response rate, ORR), mieru klinického úžitku (clinical benefit rate, CBR)
a celkové prežívanie (overall survival, OS). Výsledky účinnosti pre CONFIRM štúdiu sú zhrnuté pre
všetkých pacientov a podskupinou pacientov, ktorí mali nedostatočnú liečbu antiestrogén versus
inhibítor aromatázy v tabuľke 2.
Tabuľka 2 Prehľad výsledkov primárneho cieľa účinnosti (PFS - primary efficacy endpoint)a kľúčových sekundárnych cieľov účinnosti v štúdii CONFIRMRôzne
| Typ odhadu;
porovnanie
liečby
| fulvestrant 500 mg
(N=362)
| fulvestrant 250 mg
(N=374)
| Porovnanie medzi skupinami
(fulvestrant 500 mg/fulvestrant 250 mg)
|
Hazard ratio
| 95% CI
| p-hodnota
|
PFS
| KM medián v mesiacoch;
hazard ratio
| | | | | |
Všetci pacienti
| 6,5
| 5,5
| 0,80
| 0,68; 0,94
| 0,006
|
-AE podskupina (n=423)
| 8,6
| 5,8
| 0,76
| 0,62; 0,94
| 0,013
|
-AI podskupina (n=313)a
| 5,4
| 4,1
| 0,85
| 0,67; 1,08
| 0,195
|
OSb
| K-M medián v
mesiacoch; hazard ratio
| | | | | |
Všetci pacienti
| | 26,4
| 22,3
| 0,81
| 0,69; 0,96
| 0,016c
|
-AE podskupina (n=423)
| 30,6
| 23,9
| 0,79
| 0,63; 0,99
| 0,038c
|
-AI podskupina (n=313)a
| 24,1
| 20,8
| 0,86
| 0,67; 1,11
| 0,241c
|
Rôzne
| Typ odhadu;
porovnanie
liečby
| fulvestrant 500 mg
(N=362)
| fulvestrant 250 mg
(N=374)
| Porovnanie medzi skupinami
(fulvestrant 500 mg / fulvestrant 250 mg)
|
Absolútny rozdiel v %
| 95% CI
| |
ORRd
| % pacientov s OR; absolútny
rozdiel v %
| | | | | |
Všetci pacienti
| 13,8
| 14,6
| -0,8
| -5,8; 6,3
| |
-AE podskupina (n=296)
| 18,1
| 19,1
| -1,0
| -8,2; 9,3
| |
-AI podskupina (n=205)a
| 7,3
| 8,3
| -1,0
| -5,5; 9,8
| |
CBRe
| % pacientov s CB; absolútny
rozdiel v %
| | | | | |
Všetci pacienti
| | 45,6
| 39,6
| 6,0
| -1,1; 13,3
| |
-AE podskupina (n=423)
| 52,4
| 45,1
| 7,3
| -2,2; 16,6
| |
-AI podskupina (n=313)a
| 36,2
| 32,3
| 3,9
| -6,1; 15,2
| |
a Fulvestrant je indikovaný u pacientov, ktorí recidivovali alebo mali progresiu počas antiestrogénnej liečby. Výsledky v AI podskupine sú nepresvedčivé.
b OS je uvádzané pre finálnu analýzu celkového prežitia pri 75% úplnosti dát.
c Nominálna hodnota p bez úpravy na opakované hodnoty medzi pôvodnou analýzou celkového prežitia pri 50% úplnosti dát a aktualizovanou analýzou celkového prežitia pri 75% úplnosti dát.
d ORR bol stanovený u pacientov, u ktorých bola dostupná základná odpoveď (t.j., u ktorých bolo
merateľné základné ochorenie: skupina 240 pacientov na Fulvestrante 500 mg a skupina 261 pacientov na Fulvestrante 250 mg).
e Pacienti s najlepšou objektívnou odpoveďou kompletnej odpovedi, čiastočnou odpoveďou alebo stabilizovaným ochorením ≥24 týždňov.
PFS: Voľné prežitie progresie; ORR: Objektívna miera odpovede; OR: Objektívna odpoveď; CBR:Miera klinického úžitku; CB:Klinický úžitok; OS:Celkové prežívanie; K-M:Kaplan-Meier; CI:Interval spoľahlivosti; AI: inhibítor aromatázy; AE: antiestrogén.
Vykonali sa dve klinické štúdie fázy III. Zúčastnilo sa ich 851 postmenopauzálnych žien
s pokročilým karcinómom prsníka, u ktorých došlo k návratu ochorenia počas alebo po adjuvantnej
endokrinnej liečbe, alebo k progresii ochorenia po endokrinnej liečbe pokročilého karcinómu prsníka.
77% populácie v štúdii malo karcinóm prsníka s pozitívnymi estrogénovými receptormi. V týchto
skúškach sa porovnávala bezpečnosť a účinnosť podávania fulvestrantu 250 mg raz do mesiaca s
každodenným podávaním 1 mg anastrozolu (inhibítora aromatázy). Celkovo bol fulvestrant v mesačnej dávke 250 mg minimálne rovnako účinný ako anastrozol, čo sa týka voľného prežitia progresie ochorenia, objektívnej reakcie a doby do úmrtia. Medzi oboma liečenými skupinami neboli v konečných ukazovateľoch zaznamenané žiadne štatisticky významné rozdiely. Primárnym koncovým bodom štúdie bolo voľné prežitie progresie. Kombinovaná analýza obidvoch štúdií preukázala, že k progresii došlo u 83% pacientov, ktorým sa podával fulvestrant, oproti 85% pacientov, ktorí užívali anastrozol. Kombinovaná analýza oboch štúdií poukázala na to, že pomer rizika fulvestrantu 250 mg a anastrozolu vzhľadom na voľné prežitie progresie predstavoval 0,95 (95 % CI 0,82 až 1,10). Podiel objektívnej reakcie bol u fulvestrantu 250 mg 19,2% v porovnaní so 16,5% pre anastrozol. Medián času do úmrtia bol 27,4 mesiacov u pacientov liečených fulvestrantom a 27,6 mesiacov u pacientov liečených anastrozolom. Pomer rizika pre fulvestrant 250 mg k anastrozolu v čase do úmrtia bol 1,01 (95% CI 0,86 až 1,19).
Účinky na endometrium po menopauzePredklinické údaje nenaznačujú stimulačný účinok fulvestrantu na endometrium po menopauze (pozri
časť 5.3). Dvojtýždňová štúdia u zdravých postmenopauzálnych dobrovoľníčok liečených 20 μg
etinylestradiolu denne preukázala, že predliečenie fulvestrantom 250 mg malo za následok signifikantne
redukovanú stimuláciu postmenopauzálneho endometria v porovnaní s predliečením placebom,
hodnotenú na základe ultrasonografického merania hrúbky endometria.
Neoadjuvantná liečba až 16 týždňov u pacientiek s karcinómom prsníka liečených buď fulvestrantom
500 mg alebo 250 mg fulvestrantom neviedla ku klinicky významným zmenám v hrúbke endometria, čo
ukazuje na nedostatočný účinok agonistov. Neexistujú žiadne dôkazy o nepriaznivých účinkoch na endometrium u sledovaných pacientiek s karcinómom prsníka. Nie sú k dispozícii údaje týkajúce sa
endometriálnej morfológie.
V dvoch krátkodobých štúdiách (1 a 12 týždňov) u premenopauzálnych pacientiek s benígnym
gynekologickým ochorením sa nepozorovali žiadne signifikantné zmeny v hrúbke endometria
ultrazvukovým meraním pri porovnaní skupín, ktorým sa podával fulvestrant a placebo.
Účinky na kostiNie sú k dispozícii dlhodobé údaje o účinku fulvestrantu na kosti. Neoadjuvantná liečba až 16 týždňov
u pacientiek s karcinómom prsníka buď fulvestrantom 500 mg alebo 250 mg fulvestrantom neviedla ku
klinicky významným zmenám markerov kostného obratu v sére.
Pediatrická populáciaFulvestrant nie je indikovaný na použitie u detí. Európska lieková agentúra udelila výnimku z povinnosti
predložiť výsledky štúdii pre fulvestrant s ohľadom na všetky vekové podskupiny detí a dospievajúcich
v karcinóme prsníka (pozri časť 4.2 pre informáciu o pediatrickom použití).
Otvorená štúdia fázy II skúmala bezpečnosť, účinnosť a farmakokinetiku fulvestrantu u 30 dievčat vo
veku od 1 do 8 rokov s progresívnou predčasnou pubertou spojenou s McCune Albrightovým
syndrómom (MAS). Detskí pacienti dostali intramuskulárnu dávku fulvestrantu 4 mg/kg mesačne.
Táto 12 mesačná štúdia skúmala škálu cieľov MAS a ukázala zníženie frekvencie vaginálneho
krvácania a zníženie rýchlosti vzostupu kostného veku. V tejto štúdii bol u detí rovnovážny stav
koncentrácie fulvestrantu v súlade s dospelými (pozri časť 5.2). Z tejto malej štúdie sa nezistili žiadne
nové vyplývajúce obavy týkajúce sa bezpečnosti, ale 5-ročné údaje zatiaľ nie sú k dispozícii.
5.2 Farmakokinetické vlastnostiAbsorpciaPo podaní fulvestrantu vo forme dlhodobo pôsobiacej intramuskulárnej injekcie sa fulvestrant pomaly
vstrebáva a maximálne plazmatické koncentrácie (Cmax) sa dosiahnu približne po 5 dňoch. Podaním
fulvestrantu v režime 500 mg sa dosiahnu hladiny expozície zodpovedajúce alebo blízke rovnovážnemu
stavu počas prvého mesiaca dávkovania (priemer [CV]: AUC 475 [33,4%] ng.dní/ml, C
max 25,1
[35,3%] ng/ml, C
min 16,3 [25,9%] ng/ml). V rovnovážnom stave sa plazmatické koncentrácie
fulvestrantu udržiavajú v relatívne úzkom rozmedzí s až približne 3-násobným rozdielom medzi
maximálnou a minimálnou koncentráciou. Po intramuskulárnom podaní je expozícia v rozsahu dávok 50 až 500 mg približne úmerná dávke.
DistribúciaFulvestrant sa extenzívne a rýchlo distribuuje. Zjavný veľký distribučný objem v ustálenom stave
(VdSS) je približne 3 až 5 l/kg, čo naznačuje, že distribúcia je väčšinou extravaskulárna. Fulvestrant sa
vo vysokej miere (99%) viaže na plazmatické bielkoviny. Hlavnými zložkami väzby sú lipoproteínové
frakcie veľmi nízkej denzity (VLDL), nízkej denzity (LDL) a vysokej denzity (HDL). Neboli
uskutočnené žiadne štúdie interakcie ohľadom kompetitívnej väzby na bielkoviny. Úloha globulínu,
ktorý viaže pohlavné hormóny (SHBG), nebola stanovená.
BiotransformáciaMetabolizmus fulvestrantu nebol plne hodnotený, ale zahŕňa kombinácie celého radu možných
biotransformačných ciest, ktoré sú analogické cestám endogénnych steroidov. Identifikované
metabolity (vrátane metabolitov typu 17-ketón, sulfón, 3-síran, 3- a 17-glukuronid) sú v
antiestrogénových modeloch buď menej účinné, alebo vykazujú podobný účinok ako fulvestrant.
Skúšky na preparátoch ľudskej pečene a rekombinantných ľudských enzýmoch udávajú, že na oxidácii
fulvestrantu sa podieľa z P-450 izoenzýmov iba CYP 3A4,
in vivo sa však zdá, že prevládajú cesty'
nevyužívajúce P-450. Údaje
in vitro naznačujú, že fulvestrant neinhibuje izoenzýmy CYP450.
ElimináciaFulvestrant sa eliminuje predovšetkým v metabolizovanej forme. Hlavnou cestou vylučovania je
stolica, močom sa vylučuje menej ako 1%. Fulvestrant má vysoký klírens, 11±1,7ml/min/kg, čo
naznačuje vysoký podiel extrakcie pečeňou. Terminálny polčas (t
1/2) po intramuskulárnom podaní sa
riadi rýchlosťou absorpcie a odhaduje sa na 50 dní.
Špeciálne skupiny pacientovFarmakokinetická analýza populácie, podľa údajov zo štúdií fázy III, nezaznamenala pri fulvestrante
žiadne rozdiely vo farmakokinetickom profile pokiaľ ide o vek (rozsah 33 až 89 rokov), hmotnosť (40-
127 kg) alebo rasu.
Porucha funkcie obličiekĽahká až stredne ťažká porucha funkcie obličiek neovplyvnila v žiadnom klinicky významnom
rozsahu farmakokinetiku fulvestrantu.
Porucha funkcie pečeneFarmakokinetika fulvestrantu bola hodnotená v klinickom skúšaní s podaním jednorazovej dávky
pacientom s miernym až stredne ťažkou poruchou funkcie pečene (v štádiu A a B podľa Child-
Pughovej klasifikácie) . Bola použitá vysoká dávka lieku v krátkodobo pôsobiacej intramuskulárnej
injekcii. U pacientov s poruchou funkcie pečene bolo až 2,5-násobné zvýšenie AUC v porovnaní so
zdravými subjektami. Predpokladá sa, že u pacientov, ktorým sa podáva Fulvestrant, bude takéto
zvýšeni expozície dobre tolerované. Pacienti s ťažkou poruchou funkcie pečene (štádium C podľa
Child-Pughovej klasifikácie) neboli hodnotení.
Pediatrická populáciaFarmakokinetika fulvestrantu sa hodnotila v klinickom skúšaní vykonanom u 30 dievčat s
progresívnou predčasnou pubertou spojenou s McCune Albrightovým syndrómom (pozri časť 5.1).
Detskí pacienti boli vo veku 1 až 8 rokov a dostali intramuskulárnu dávku fulvestrantu 4 mg/kg
mesačne. Geometrický priemer (smerodajná odchýlka) rovnovážneho stavu koncentrácie (C min, ss)
a AUCss bol 4,2 (0,9) ng/ml a 3680 (1020) ng*hod/ml, v uvedenom poradí. Hoci sú zozbierané údaje
obmedzené, rovnovážny stav koncentrácie fulvestrantu u detí sa zdá byť v súlade s dospelými.
5.3 Predklinické údaje o bezpečnostiAkútna toxicita fulvestrantu je nízka.
Fulvestrant a iné formy fulvestrantu sa dobre znášali u všetkých zvieracích druhov v skúškach
s podávaním opakovaných dávok. Miestne reakcie vrátane myozitídy a tvorby granulómov v mieste
podania injekcie sa pripisovali vehikulu, avšak závažnosť myozitídy u králikov sa pri fulvestrante
zvyšovala v porovnaní so skupinou, ktorej bol podávaný fyziologický roztok. V skúškach toxicity s
opakovanými intramuskulárnymi dávkami fulvestrantu potkanom a psom bola antiestrogénová aktivita
fulvestrantu zodpovedná za väčšinu prejavených účinkov, a to predovšetkým na ženský reprodukčný
systém, ale aj na iné orgány, citlivé na hormóny u obidvoch pohlaví.U niektorých psov sa pozorovala
arteritída v rade rôznych tkanív po chronickom (12 mesačnom) dávkovaní.
V skúškach na psoch pri perorálnom a intravenóznom podaní boli pozorované účinky na
kardiovaskulárny systém (mierne zvýšenie S-T segmentu EKG pri perorálnom podaní
a zastavenie sínusového uzla u jedného psa pri intravenóznom podaní). Tieto účinky sa vyskytli pri
koncentrácii fulvestrantu vyššej ako u pacientov (Cmax > 15 krát), a pre bezpečnosť u človeka majú pri
podaní klinickej dávky pravdepodobne len obmedzený význam.
Fulvestrant nepreukázal žiadny genotoxický potenciál.
Účinky fulvestrantu na reprodukciu a vývoj embrya/plodu preukázali pri dávkach podobných dávkam
klinickým jeho antiestrogénny účinok. U potkanov sa pozoroval reverzibilný pokles plodnosti samíc a
prežití embryí, dystokia a zvýšený výskyt abnormalít plodu vrátane tarzálnej flexúry. Fulvestrant
podávaný králikom mal za následok potrat. Bolo pozorované zvýšenie hmotnosti placenty a postimplantačná strata plodov. U králikov došlo k zvýšenému výskytu zmien plodu (dorzálny posun
panvového pletenca a 27. presakrálneho stavca).
Dvojročná štúdia onkogenicity na potkanoch (intramuskulárne podanie fulvestrantu) ukázala zvýšený
výskyt benígnych bunkových nádorov granulózy vaječníkov u potkaních samíc pri vysokých dávkach
10 mg raz za 15 dní a zvýšený výskyt testikulárnych Leydigových bunkových nádorov u samcov. V
dvojročnej štúdii onkogenicity na myšiach (perorálne podanie denne) bola zvýšená incidencia
zväzkových stromálnych nádorov vaječníkov u samíc (benígnych aj malígnych) v dávkach 150
a 500 mg/kg/deň. S ohľadom na tieto nálezy pre úroveň nulového účinku (
'the no-effect level') bola
systémová expozícia (AUC) u potkanov približne 1,5-krát vyššia než očakávaná expozícia u žien
a 0,8-krát vyššia než expozícia u mužov a u myší približne 0,8-krát vyššia než očakávaná expozícia
u mužov či žien. Vyvolanie týchto nádorov zodpovedá farmakologicky vyvolaným endokrinným
spätne väzbovým zmenám v hladinách gonadotropínov spôsobených antiestrogénmi u cyklujúcich
zvierat. Preto tieto poznatky nie sú považované za dôležité pre použitie fulvestrantu
u postmenopauzálnych žien s pokročilým karcinómom prsníka.
6 FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokEtanol (96 percentný)
Benzylalkohol
Benzylbenzoát
Ricínový olej
6.2 InkompatibilityNevykonali sa štúdie kompatibility, preto sa tento liek nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti2 roky
6.4 Špeciálne upozornenia na uchovávanieUchovávajte v chladničke (2 °C – 8 °C).
Uchovávajte naplnenú injekčnú striekačku v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah baleniaFulvestrant Sandoz 250 mg sa dodáva v jednej alebo dvoch naplnených injekčných striekačkách, ktorých telo pozostáva zo silikonovaného skla typu I vybaveného s:
poistnou patentovou uzatváracou spojkou, silikonizovaným brómbutylovým gumeným piestom, brómbutylovým/syntetickým izoprénovým gumeným hrotovým (špicatým) uzáverom, polystyrénovou piestovou tyčinkou a polypropylénovou zadnou poistkou.
Ku každej naplnenej injekčnej striekačke je navyše priložená sterilná ihla.
Na trh nemusia byť uvedené všetky veľkosti balenia.
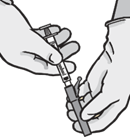
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomNávod na podanieUpozornenie –Bezpečnostnú ihlu pred použitím neautoklávujte. Počas použitia aj pri likvidácii musia byť ruky stále za ihlou.
Striekačky sú vybavené bezpečnostnou ihlou
BD SafetyGlide® or Terumo SurGuard®.Návod pre bezpečnostnú ihlu BD SafetyGlide® Pre každú z oboch striekačiek:
|
· Opatrne vyberte ihlu a striekačku z obalu.
|
|
· Odtrhnite vonkajší obal bezpečnostnej ihly (BD SafetyGlide). Pripojte bezpečnostnú ihlu k luerovej koncovke striekačky
|
|
· Odstráňte ochranný kryt z hrotu tela striekačky
|
|
· Otáčajte, aby ste ihlu zakvačili ku luerovej koncovke striekačky. Otáčajte ňou, kým pevne nezapadne.
|
|
· Priamym pohybom stiahnite z ihly kryt tak, aby sa nepoškodil hrot ihly.
| 
|
· Odstráňte kryt z ihly.
|
|
· Držte striekačku tak, aby ihla ukazovala smerom nahor a pritom jemne stlačte piest, až kým liek nebude v najvrchnejšej časti striekačky. V tele striekačky nesmie ostať žiadny vzduch.
|
|
· Podávajte pomaly, intramuskulárne (1-2 minúty/injekcia) do sedacieho svalu. Na uľahčenie podávania je skosená strana ihly orientovaná k ramenu páčky
| 
|
· Po podaní injekcie ihneď využite ťah jedného prsta na aktiváciu ramena páčky, ktorá aktivuje ochranný mechanizmus
| 
|
POZNÁMKA: Aktivujte mechanizmus smerom od seba a iných. Dávajte pozor na cvaknutie a vizuálne sa presvedčte, že hrot ihly je úplne zakrytý.
|
Návod pre bezpečnostnú ihlu Terumo SurGuard® Pre každú z oboch striekačiek:
|
· Opatrne vyberte ihlu a striekačku z obalu.
|
|
· Odstráňte ochranný kryt z hrotu tela striekačky
|
|
· S použitím aseptickej techniky pritiahnite striekačku k ihle. Uchopte spodnú časť ihly, nie puzdro, a otočte striekačkou v smere hodinových ručičiek.
| 
|
· Odkloňte bezpečnostný kryt od ihly smerom k telu striekačky v uhle tak, ako je to zobrazené. Potom odstráňte kryt ihly.
| 
|
· Držte striekačku tak, aby ihla ukazovala smerom nahor, a pritom jemne stlačte piest, až kým sa liek nebude nachádzať v najvrchnejšej časti striekačky. V tele striekačky nesmie ostať žiadny vzduch.
|
|
· Podávajte pomaly, intramuskulárne (1-2 minúty/injekcia) do sedacieho svalu.
|
|
· Po podaní injekcie vytiahnite ihlu z kože a pomocou jednej ruky aktivujte bezpečnostný mechanizmus za použitia ktorejkoľvek z týchto troch metód:
|
|
o Aktivácia prstom
| 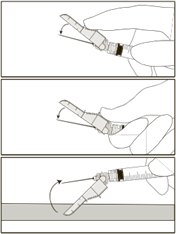
|
o Aktivácia palcom
|
o Aktivácia povrchom
|
Aktivácia sa overí počuteľným a/alebo kontaktným cvaknutím a môže byť skontrolovaná vizuálne.
V prípade pochybností, že je bezpečnostný kryt plne aktivovaný, zopakujte tento krok.
|
LikvidáciaNaplnené striekačky sú určené
len na jednorazové použitie.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7 DRŽITEĽ ROZHODNUTIA O REGISTRÁCIISandoz Pharmaceuticals d.d.
Verovškova 57
SI-1000 Ľubľana
Slovinsko
8 REGISTRAČNÉ ČÍSLA34/0381/15-S
9 DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTUSeptember 2015