
bez jedla (pozri časť 5.2). Kapsuly sa musia prehltnúť celé a zapiť pohárom vody, nesmú sa otvoriť.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Súbežné podávanie s rastlinnými prípravkami obsahujúcimi ľubovník bodkovaný (Hypericum
perforatum) (pozri časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Hypertenzia
V klinických štúdiách s tivozanibom sa vyskytla hypertenzia (vrátane pretrvávajúcej závažnej hypertenzie) (pozri časť 4.8). U približne jednej tretiny pacientov sa hypertenzia vyvinula počas
prvých 2 mesiacov liečby. Krvný tlak musí byť pred začatím liečby tivozanibom dobre kontrolovaný.
Počas liečby musia byť pacienti sledovaní na hypertenziu a podľa potreby liečení antihypertenzívnou liečbou podľa štandardnej lekárskej praxe. V prípade pretrvávajúcej hypertenzie, a to napriek použitiu
antihypertenzívnej liečby, sa má dávka tivozanibu podľa klinického posúdenia znížiť alebo liečba
prerušiť a opäť začať v nižšom dávkovaní, keď je krvný tlak regulovaný (pozri časť 4.2). Prerušenie liečby sa má zvážiť v prípadoch pretrvávajúcej závažnej hypertenzie, syndrómu reverzibilnej posteriórnej encefalopatie (pozri nižšie) alebo iných komplikácií hypertenzie. Pacienti, ktorí dostávajú antihypertenzívnu liečbu musia byť stále kontrolovaní z hľadiska hypotenzie po prerušení aj ukončení liečby tivozanibom.
Arteriálnetromboembolickéudalosti
V klinických štúdiách sa u tivozanibu objavili arteriálne tromboembolické udalosti (ATE, arterial thromboembolic events) (pozri časť 4.8). Rizikové faktory pre ATE zahŕňajú zhubné ochorenie, vek
> 65 rokov, hypertenziu, diabetes mellitus, fajčenie, hypercholesterolémiu a predchádzajúce
tromboembolické ochorenie. Tivozanib sa neskúmal u pacientov, ktorí mali ATE počas predchádzajúcich 6 mesiacov od začiatku klinickej štúdie. Tivozanib sa musí používať s opatrnosťou u pacientov, u ktorých existuje riziko vzniku týchto udalostí alebo, u ktorých sa tieto udalosti vyskytli v minulosti (ako je infarkt myokardu, mozgová príhoda).
Venóznetromboembolickéudalosti
V klinických štúdiách s tivozanibom boli hlásené venózne tromboembolické udalosti (VTE, venous tromboembolic events) vrátane pľúcnej embólie a hlbokej žilovej trombózy (pozri časť 4.8). Rizikové
faktory pre VTE zahŕňajú veľké operácie, viacnásobné traumy, predchádzajúce VTE, pokročilý vek,
obezitu, srdcové alebo respiračné zlyhanie a dlhodobú nehybnosť. Tivozanib sa neskúmal u pacientov, ktorí mali VTE počas predchádzajúcich 6 mesiacov od začiatku klinickej štúdie. Rozhodnutie o liečbe,
najmä u pacientov, u ktorých je riziko VTE, má byť založené na individuálnom posúdení prínosu a
rizika pre pacienta.
Zlyhaniesrdca
V klinických štúdiách s tivozanibom ako monoterapiou na liečbu pacientov s RCC bolo hlásené srdcové zlyhanie (pozri časť 4.8). Počas celého trvania liečby tivozanibom sa majú pravidelne monitorovať prejavy alebo príznaky srdcového zlyhania. Zvládnutie udalostí srdcového zlyhania môže vyžadovať dočasné prerušenie alebo trvalé ukončenie a/alebo zníženie dávky liečby tivozanibom a liečbu potenciálnych základných príčin srdcového zlyhania, napr. hypertenzia.
Hemorágia
V klinických štúdiách s tivozanibom boli hlásené hemoragické udalosti (pozri časť 4.8). Tivozanib sa musí používať opatrne u pacientov, u ktorých existuje riziko krvácania alebo majú krvácanie v anamnéze. Ak krvácanie vyžaduje lekársky zákrok, podanie tivozanibu sa má dočasne prerušiť.
Proteinúria
V klinických štúdiách s tivozanibom bola hlásená proteinúria (pozri časť 4.8). Odporúča sa monitorovať proteinúriu pred začiatkom liečby a pravidelne počas celého trvania liečby. U pacientov, u ktorých sa vyvinula proteinúria 2. stupňa (> 1,0-3,4 g/24 hodín) alebo proteinúria 3. stupňa
(≥ 3,5 g/24 hodín) (Kritériá spoločnej terminológie pre nežiaduce udalosti Národného inštitútu pre liečbu rakoviny [NCI CTCAE], z anglického National Cancer Institute Common Terminology Criteria
for Adverse Events), musí byť dávka tivozanibu znížená alebo liečba dočasne prerušená. Ak sa
u pacienta vyvinie proteinúria 4. stupňa (nefrotický syndróm), musí sa podávanie tivozanibu ukončiť. Medzi rizikové faktory pre proteinúriu patrí vysoký krvný tlak.
Hepatotoxicita
V klinických štúdiách s tivozanibom boli hlásené zvýšenia ALT, AST a bilirubínu (pozri časť 4.8). Väčšina zvýšení AST a ALT nebola sprevádzaná súbežným zvýšením bilirubínu. AST, ALT, bilirubín
a AP sa majú monitorovať pred začatím a periodicky počas celého trvania liečby tivozanibom kvôli potenciálnemu riziku hepatotoxicity (pozri časť 4.2).
Tivozanib sa neodporúča u pacientov s ťažkou poruchou funkcie pečene. Pacienti so stredne ťažkou poruchou funkcie pečene sa majú liečiť len jednou 1 340 mikrogramovou kapsulou tivozanibu každý druhý deň, pretože môžu mať zvýšené riziko nežiaducich účinkov v dôsledku zvýšenej expozície dávkou 1 340 mikrogramov každý deň (pozri časť 5.2). Pri podávaní tivozanibu pacientom s miernou poruchou funkcie pečene nie je potrebná úprava dávkovania. Tivozanib sa má používať opatrne u pacientov s miernou a stredne ťažkou poruchou funkcie pečene a dôsledne sledovať tolerovateľnosť.
Syndrómreverzibilnejposteriórnejencefalopatie
V klinických skúšaniach bol potvrdený po liečbe tivozanibom jeden prípad syndrómu reverzibilnej posteriórnej encefalopatie (posterior reversible encephalopathy syndrome, PRES) (pozri časť 4.8).
PRES je neurologická porucha, ktorá môže byť spojená s bolesťami hlavy, záchvatmi, letargiou,
zmätenosťou, slepotou a inými zrakovými a neurologickými poruchami. Môže sa vyskytnúť mierna až závažná hypertenzia. Magnetická rezonancia je potrebná na potvrdenie diagnózy PRES. Podávanie tivozanibu sa musí ukončiť u pacientov, u ktorých sa vyskytli prejavy alebo príznaky PRES. Bezpečnosť opätovného zahájenia liečby tivozanibom u pacientov, ktorí predtým mali PRES, nie je známa a tivozanib sa má u týchto pacientov používať len s opatrnosťou.
Kožnáreakcianarukáchanohách
V klinických štúdiách s tivozanibom bola hlásená kožná reakcia na rukách na nohách (palmárno-
plantárna erytrodyzestézia). Väčšina udalostí z piatich štúdií monoterapie karcinómu obličkových buniek bola CTC 1. stupňa alebo 2.stupňa (≥ CTC 3. stupňa bol pozorovaný u < 2 % pacientov liečených tivozanibom) a nevyskytli sa žiadne závažné udalosti (pozri časť 4.8). Liečba pacientov s HFSR môže zahŕňať lokálne terapie na zmiernenie symptómov s ohľadom na dočasné prerušenie a/alebo zníženie liečebnej dávky, alebo v závažných alebo pretrvávajúcich prípadoch trvalé ukončenie liečby.
PredĺženieintervaluQT
V klinických štúdiách s tivozanibom bolo hlásené predĺženie intervalu QT / QTc (pozri časť 4.8 a časť
5.1). Predĺženie intervalu QT / QTc môže viesť k zvýšenému riziku ventrikulárnych arytmií. Odporúča sa, aby sa tivozanib používal s opatrnosťou u pacientov s predĺžením QT intervalu v minulosti alebo
iným relevantným pre-existujúcim ochorením srdca a u pacientov užívajúcich iné lieky, o ktorých je
známe, že zvyšujú QT interval. Odporúča sa východiskové a pravidelné monitorovanie elektrokardiogramov a udržiavanie elektrolytov (napr. vápnik, horčík, draslík) v normálnom rozsahu.
Gastrointestinálnaperforácia/fistula
Odporúča sa, aby sa počas celého trvania liečby tivozanibom pravidelne monitorovali príznaky gastrointestinálnej perforácie alebo fistuly. U pacientov s rizikom gastrointestinálnej perforácie alebo
fistuly sa má tivozanib používať s opatrnosťou.
K
omplikácie
pri
hojení
r
án
Z preventívnych dôvodov sa odporúča dočasné prerušenie liečby tivozanibom u pacientov podstupujúcich veľké chirurgické zákroky. Rozhodnutie o obnovení liečby tivozanibom po operácii musí byť založené na klinickom posúdení adekvátneho hojenia rán.
Hypotyreóza
V klinických štúdiách s tivozanibom bola hlásená hypotyreóza (pozri časť 4.8). Hypotyreóza sa vyskytla kedykoľvek počas liečby tivozanibom a vyvíjala sa už v priebehu dvoch mesiacov od
začiatku liečby. Rizikové faktory pre hypotyreózu zahŕňajú anamnézu hypotyreózy a používanie antityroidných liekov. Funkcia štítnej žľazy sa má monitorovať pred začiatkom liečby a pravidelne
počas celého trvania liečby tivozanibom. Hypotyreóza sa má liečiť podľa štandardnej lekárskej praxe.
Staršípacienti
Dysfónia, hnačka, únava, znížená hmotnosť, znížená chuť do jedla a hypotyreóza sa vyskytli častejšie u pacientov vo veku ≥ 65 rokov. Zdravotnícki pracovníci si majú byť vedomí, že starší pacienti môžu mať zvýšené riziko nežiaducich reakcií.
Tartazín
Fotivda 890 mikrogramov tvrdé kapsuly obsahuje tartazín (E102), ktorý môže spôsobiť alergické reakcie.
4.5 Liekové a iné interakcie
Kontraindikáciesúbežnéhopoužitia
Rastlinné prípravky obsahujúce ľubovník bodkovaný (Hypericum perforatum) sú kontraindikované. Ak pacient už užíva ľubovník bodkovaný, jeho užívanie sa musí pred začiatkom liečby tivozanibom
zastaviť. Indukčný účinok ľubovníka bodkovaného môže trvať najmenej 2 týždne po ukončení liečby
ľubovníkom bodkovaným (pozri časť 4.3).
SilnéinduktoryCYP3A4
V klinickej štúdii u zdravých dobrovoľníkov spoločné podanie jednorazovej dávky
1 340 mikrogramov tivozanibu so silným induktorom CYP3A4 v rovnovážnom-stave (rifampicín
600 mg raz denne) znížilo priemerný polčas tivozanibu zo 121 na 54 hodín, čo bolo spojené s poklesom AUC0-∞ jednej dávky o 48 % v porovnaní s AUC0-∞ v neprítomnosti rifampicínu. Priemerné Cmax and AUC0-24hr neboli významne ovplyvnené (8 % nárast a 6 % pokles, v tomto poradí). Klinické účinky silných induktorov CYP3A4 na opakované denné dávkovanie tivozanibu sa neskúmali, ale potenciálne priemerný čas na dosiahnutie rovnováhy a priemerná rovnovážna koncentrácia tivozanibu v sére môžu byť znížené v dôsledku zníženia polčasu. Odporúča sa, aby sa súbežné podávanie tivozanibu so silnými induktormi CYP3A4, ak sa používa, vykonávalo opatrne.
Predpokladá sa, že stredne silné induktory CYP3A4 nemajú klinicky významný vplyv na expozíciu tivozanibu.
InhibítoryCYP3A4
V klinickej štúdii so zdravými dobrovoľníkmi súbežné podávanie tivozanibu so silným inhibítorom
CYP3A4, ketokonazol (400 mg jedenkrát denne), nemalo žiadny vplyv na koncentrácie tivozanibu v sére (Cmax alebo AUC); Preto nie je pravdepodobné, že by bola expozícia tivozanibu zmenená inhibítormi CYP3A4.
Lieky,uktorýchje intestinálnaabsorpciaobmedzenáBCRP
Tivozanib in vitro inhibuje transportnú bielkovinu BCRP, ale klinický význam tohto zistenia nie je
známy (pozri časť 5.2). Opatrnosť je potrebná, ak sa tivozanib podáva súbežne s rosuvastatínom alebo sa má zvážiť alternatívny statín, ktorý nepodlieha obmedzeniu črevnej absorpcie prostredníctvom BCRP. U pacientov, ktorí užívajú perorálne substrát BCRP s klinicky významnou efluxnou
interakciou v čreve je potrebné zaistiť, že medzi podaním tivozanibu a substrátu BCRP bude vhodný časový interval (napr. 2 hodiny).
A
ntikoncepcie
V súčasnosti nie je známe, či tivozanib môže znížiť účinnosť hormonálnej antikoncepcie, a preto ženy používajúce hormonálnu antikoncepciu majú pridať používanie bariérovej metódy (pozri časť 4.6).
4.6 Fertilita, gravidita a laktácia
Ženyvo fertilnomveku/antikoncepciaumužovažien
Ženy vo fertilnom veku sa musia vyhnúť otehotneniu počas užívania tivozanibu. Ženské partnerky mužských pacientov, ktorí užívajú tivozanib, sa tiež musia vyhnúť tehotenstvu. Pacienti a pacientky a
ich partneri musia používať efektívne metódy antikoncepcie počas liečby a najmenej jeden mesiac po
ukončení liečby. V súčasnosti nie je známe, či tivozanib môže znížiť účinnosť hormonálnej antikoncepcie, a preto ženy používajúce hormonálnu antikoncepciu majú používať aj bariérovú metódu.
Gravidita
Nie sú k dispozícii žiadne údaje o použití tivozanibu u gravidných žien. Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3).
Tivozanib sa nesmie používať počas tehotenstva. Ak sa tivozanib používa počas tehotenstva alebo ak pacientka otehotnie počas užívania tivozanibu, musí sa jej vysvetliť potenciálne riziko pre plod.
Dojčenie
Nie je známe, či sa tivozanib vylučuje do ľudského mlieka, ale existuje taká možnosť. Vzhľadom na potenciál nežiaducich účinkov sprostredkovaných tivozanibom na dojčené deti, ženy počas užívania
tivozanibu nesmú dojčiť.
Fertilita
Štúdie na zvieratách naznačujú, že plodnosť mužov a žien môže byť ovplyvnená liečbou tivozanibom
(pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Tivozanib môže mať malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacienti musia byť opatrní pri vedení vozidiel alebo obsluhe strojov, ak počas liečby tivozanibom zaznamenajú asténiu, únavu a/alebo závraty (pozri časť 4.8).
4.8 Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Zhrnuté údaje o 674 pacientoch s pokročilým RCC, ktorí naďalej dostávali tivozanib ako ich
počiatočnú liečbu v piatich hlavných štúdiách RCC monoterapie, boli hodnotené pri celkovom posúdení bezpečnosti a znášanlivosti tivozanibu.
Najdôležitejšou závažnou nežiaducou reakciou je hypertenzia.
Najčastejšie nežiaduce reakcie akéhokoľvek stupňa zahŕňajú hypertenziu (47,6 %), dysfóniu (26,9 %), únavu (25,8 %) a hnačku (25,5 %).
V piatich štúdiách hlavnej RCC monoterapie bolo podávanie tivozanibu prerušené u 20 pacientov (3 %) v dôsledku nežiaducich reakcií, najčastejšie z dôvodu hypertenzie (0,4 %), pretrvávajúcej závažnej hypertenzie (0,3 %) alebo akútneho infarktu myokardu (0,3 %). Najčastejšie nežiaduce reakcie vedúce k zníženiu/prerušeniu dávkovania tivozanibu boli hypertenzia (4,7 %), hnačka (3,1 %), únava (1,8 %).
U pacientov, ktorí dostávali tivozanib ako počiatočnú liečbu, sa vyskytli tri nežiaduce reakcie s výsledným úmrtím; jedna bola nekontrolovaná hypertenzia v prípade podozrenia na predávkovanie (pozri časť 4.9) a dve boli hlásené jednoducho ako smrť.
T
abuľkový prehľad nežiaducichreakcií
Nežiaduce reakcie, ktoré sa vyskytli u pacientov, ktorí naďalej dostávali tivozanib ako ich počiatočnú
liečbu v piatich štúdiách monoterapie RCC, boli združené a sú uvedené nižšie podľa MedDRA do tried orgánových systémov tela (system organ class, SOC) a frekvencie. Frekvencia výskytu je
definovaná nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až
< 1/100) a zriedkavé (≥ 1/10 000 až < 1/1 000) a nie je známe (z dostupných údajov nie je možné určiť). V rámci každej SOC sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Tabuľka 1: Tabuľkový zoznam nežiaducich reakcií (uvedené podľa frekvencií pre nežiaduce udalosti zo všetkých príčin)
T
rieda
o
rgánových systémov
Veľmi časté Časté Menej časté Zriedkavé
Infekcie a nákazy Mykotická infekcia
Pustulárna vyrážka
Poruchy krvi a lymfatického systému
Poruchy endokrinného systému
Poruchy metabolizmu a výživy
Znížená chuť do jedla
Anémia Trombocytopénia
Zvýšená hladina hemoglobínu
Hypotyreóza Hypertyreóza
Struma1
Anorexia
Psychické poruchy Insomnia
Poruchy nervového systému
Bolesť hlavy Periférna neuropatia2
Závraty
Dysgeuzia3
Prechodný ischemický atak
Porucha pamäti4
Syndróm reverzibilnej posteriórnej encefalopatie (PRES)5
Poruchy oka Porucha zraku6 Zvýšená lakrimácia
Poruchy ucha a labyrintu Poruchy srdca a
srdcovej činnosti
Vertigo
Tinitus
Infarkt myokardu
(akútny)/ischémia7
Angína pektoris
Tachykardia8
Upchatie ucha
Pľúcny edém
Nedostatočnosť koronárnych artérií
Predĺženie QT intervalu na elektrokardiograme
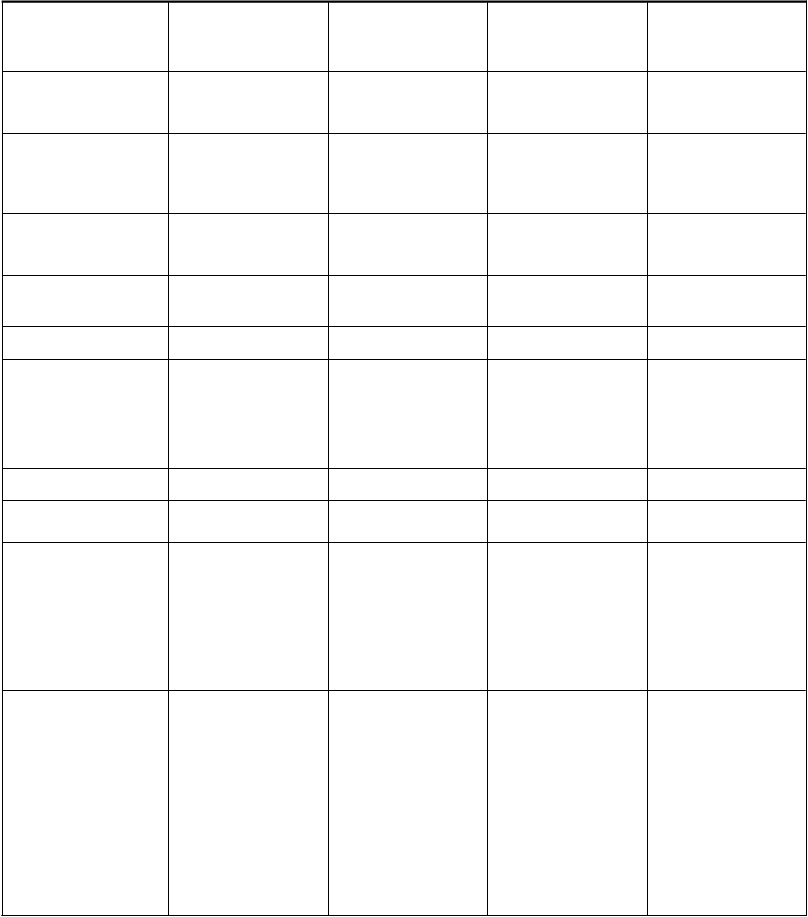
Poruchy ciev Hypertenzia Hemorágia9
Arteriálna
tromboembólia10
Žilová
tromboembólia11
Pretrvávajúca závažná hypertenzia12
Návaly horúčavy13
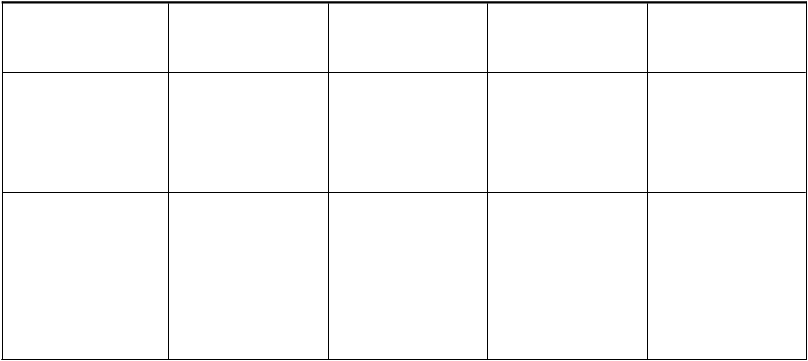
T
rieda orgánových systémov
Veľmi časté Časté Menej časté Zriedkavé
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových ciest
Poruchy kože a podkožného tkaniva
Dyspnoe14
Dysfónia
Kašeľ
Abdominálna bolesť15
Nauzea Hnačka Stomatitída16
Syndróm palmárno- plantárnej erytrodyzestézie/K ožná reakcia ruka- noha (PPE/HFS)
Epistaxa
Rinorea Nazálna kongescia Pankreatitída17
Dysfágia18
Vracanie
Gastroezofágová refluxná choroba
Abdominálna distenzia
Glositída19
Gingivitída20
Dyspepsia
Zápcha Sucho v ústach Flatulencia
Zvýšená hladina
ALT/AST21
Zvýšená hladina gama- glutamyltransferázy
Zvýšená hladina alkalickej fosfatázy v krvi
Exfoliácia kože
Erytém22
Pruritus23
Alopécia
Vyrážka24
Akné25
Suchá koža
Dvanástnikový vred
Urtikária
Dermatitída26
Hyperhidróza
Xerodermia

Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Poruchy obličiek a močových ciest
Bolesť chrbta Artralgia
Myalgia
Muskuloskeletálna bolesť hrudníka
Proteinúria
Zvýšená hladina
kreatinínu v krvi
Svalová slabosť
T
rieda orgánových systémov
Veľmi časté Časté Menej časté Zriedkavé
Celkové poruchy a reakcie v mieste podania
Bolesť27
Asténia
Únava
Bolesť v hrudníku28
Zimnica29
Pyrexia
Periférny edém
Zápal sliznice
Laboratórne a funkčné vyšetrenia
Zníženie hmotnosti Zvýšená hladina amylázy
Zvýšená hladina lipázy
Zvýšená hladina hormónu stimulujúceho štítnu žľazu v krvi
Nežiaduce reakcie z klinických štúdií sú uvedené pomocou frekvencií pre nežiaduce udalosti zo všetkých príčin. Boli kombinované nasledujúce pojmy:
1 Struma vrátane strumy a toxickej nodálej strumy
2 Periférna neuropatia vrátane hyperestézie, hypestézie, mononeuropatie, periférnej neuropatie, periférnej senzorickej neuropatie a parestézie
3 Dysgeuzia vrátane ageuzie, dysgeuzie a hypogeuzie
4 Porucha pamäti vrátane amnézie a poruchy pamäti
5 PRES nebol pozorovaný u pacientov liečených tivozanibom v piatich štúdiách monoterapie RCC. Jeden pacient mal
PRES stupňa 4 a hypertenziu v štúdii AV-951-09-901.
6 Porucha zraku vrátane zníženej zrakovej ostrosti, rozmazaného videnia a poruchy zraku
7 Infarkt myokardu (akútny)/ischémia vrátane akútneho infarktu myokardu, ischémie a infarktu myokardu
8 Tachykardia vrátane sínusovej tachykardie, supraventrikulárnej tachykardie, tachykardie a paroxyzmálnej tachykardie
9 Hemorágia vrátane adrenálnej hemorágie, análnej hemorágie, hemorágie krčka maternice, hemorágie duodenálneho
vredu, krvácania z ďasien, hematemézy, hemoptýzy, hemoragickej anémie, hemoragickej erozívnej gastritídy, hemoragickej cievnej mozgovej príhody, hemorágie úst, pľúcnej hemorágie a hemorágie v respiračnom trakte
10 Arteriálna tromboembólia vrátane akútneho infarktu myokardu, arteriálnej trombózy, trombózy iliakálnej tepny, ischemickej cievnej mozgovej príhody, infarktu myokardu a tranzitórneho ischemického ataku
11 Venózna tromboembólia vrátane hlbokej žilovej trombózy, venóznej embólie a pľúcnej embólie
12 Perzistentná ťažká hypertenzia vrátane hypertenznej krízy
13 Návaly vrátane začervenania a návalov tepla
14 Dyspnoe vrátane dyspnoe a námahového dyspnoe
15 Abdominálna bolesť vrátane abdominálneho diskomfortu, bolesti brucha, bolesti dolnej časti brucha, bolesti hornej časti brucha a stvrdnutia brucha
16 Stomatitída vrátane nepríjemných pocitov v ústach, poruchy úst a stomatitídy
17 Pankreatitída vrátane pankreatitídy a akútnej pankreatitídy
18 Dysfágia vrátane dysfágie, odynofágie a orofaryngeálnej bolesti
19 Glositída vrátane glositídy a glosodýnie
20 Gingivitída vrátane krvácania z ďasien, poruchy ďasien, bolesti ďasien a gingivitídy
21 Zvýšenie hladiny alanínaminotransferázy (ALT) / zvýšenie hladiny aspartátaminotransferázy (AST) vrátane zvýšenia
ALT a AST
22 Erytém vrátane erytému, generalizovaného erytému a palmárneho erytému
23 Pruritus vrátane generalizovaného pruritu a pruritu
24 Vyrážka vrátane vyrážky, erytematóznej vyrážky, generalizovanej vyrážky, makulopapulárnej vyrážky, papulárnej vyrážky a pruritickej vyrážky
25 Akné vrátane akné a akneiformnej dermatitídy
26 Dermatitída vrátane dermatitídy a bulóznej dermatitídy
27 Bolesť vrátane bolesti kostí, nádorovej bolesti (zhubný nádor), bolesti v boku, bolesti v slabinách, bolesti v ústach, bolesti, bolesti končatín a nádorovej bolesti (nezhubný nádor)
28 Bolesť na hrudi vrátane bolesti na hrudi a bolesti na hrudi iného než kardiálneho pôvodu
29 Zimnica vrátane zimnice a hypotermie
Opis vybraných nežiaducichreakciíHypertenziaHypertenzia bola hlásená ako nežiaduca reakcia u 47,6 % pacientov, ktorí dostávali tivozanib ako počiatočnú liečbu; u 23,0 % bola hypertenzia CTC ≥ 3.stupňa. Pretrvávajúca závažná hypertenzia
(„hypertenzná kríza“) bola nežiaduca reakcia u 1,0 %, CTC 3. stupňa alebo vyššia u 0,9 %. Jeden pacient zomrel v dôsledku nekontrolovanej hypertenzie pri podozrení na predávkovanie.
Syndróm reverzibilnej posteriórnej encefalopatie (PRES)PRES (známy aj ako syndróm reverzibilnej posteriórnej leukoencefalopatie (
reversible posterior leukoencephalopathy syndrome, RPLS)) bol potvrdený u jedného pacienta bez RCC po približne 8
týždňoch liečby tivozanibom. PRES je neurologická porucha, ktorá môže byť spojená s bolesťami
hlavy, záchvatmi, letargiou, zmätenosťou, slepotou a inými zrakovými a neurologickými poruchami. Môže byť prítomná mierna až závažná hypertenzia (pozri časť 4.4).
Venózna tromboembóliaPľúcna embólia bola hlásená u jedného pacientov (0,7 %), ktorí dostávali tivozanib ako počiatočnú liečbu v piatich hlavných štúdiách RCC monoterapie, ktoré boli väčšinou CTC ≥ 3 stupňa (pozri časť
4.4). Trombóza hlbokých žíl bola tiež hlásená u dvoch pacientov (0,3 %), u jedného pacienta (0,1 %)
bol CTC stupeň ≥ 3, ktorí dostávali počiatočnú liečbu tivozanibom.
Arteriálne tromboembolické udalostiArteriálne tromboembolické nežiaduce reakcie u pacientov, ktorí dostávali tivozanib ako počiatočnú liečbu, boli ischemická mozgová príhoda (1,0 %), infarkt myokardu (0,7 %), prechodný ischemický
atak (0,7 %) a akútny infarkt myokardu (0,4 %), väčšina bola najmenej CTC 3. stupňa a trombóza
bedrovej artérie (0,1%). Neboli zaznamenané žiadne úmrtia v dôsledku arteriálnych tromboembolických nežiaducich reakcií u pacientov, ktorí dostávali tivozanib ako počiatočnú liečbu, ale infarkt myokardu u pacienta, ktorý dostával tivozanib druhej línie, mal smrteľný následok.
Zlyhanie srdcaPľúcny edém bol hlásený u dvoch pacientov (0,3 %), ktorí dostávali tivozanib ako počiatočnú liečbu v piatich hlavných štúdiách RCC monoterapie. Oba prípady boli 3. stupňa CTC (pozri časť 4.4).
Predĺženie QT / QTcPredĺženie QT intervalu bolo hlásené u dvoch pacientov (CTC 2. a 3. stupeň) v štúdii kardiálnej bezpečnosti pri liečbe tivozanibom, ani jedna reakcia nebola považovaná za závažnú (pozri časť 4.4 a
časť 5.1).
HypotyreózaHypotyreóza bola hlásená ako nežiaduca reakcia u 5,6 % pacientov počas počiatočnej liečby a vo všetkých prípadoch bola CTC 2. stupňa alebo nižšia. Ako závažná bola hlásená u jedného pacienta.
HemorágiaPočas počiatočnej liečby v štúdiách hlavnej monoterapie sa zaznamenali nežiaduce reakcie
súvisiace s hemorágiou (pozri časť 4.4).:
Hláseniepodozrenínanežiaducereakcie Hláseniepodozrenínanežiaduce
Hláseniepodozrenínanežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieDvaja pacienti dostávali nadmerné dávky tivozanibu počas monoterapeutických štúdií. U pacienta s hypertenziou v anamnéze sa vyskytla zhoršená nekontrolovaná hypertenzia, ktorá bola smrteľná po užití 3 dávok 1 340 mikrogramov tivozanibu v jeden deň (celkovo 4 020 mikrogramov). Nebol pozorovaný žiadny nežiaduci účinok u druhého pacienta, ktorý užil 2 dávky 1 340 mikrogramov tivozanibu v jeden deň (celkovo 2 680 mikrogramov).
Krvný tlak má byť pred začatím liečby tivozanibom dobre pod kontrolou a pacienti majú byť počas liečby sledovaní na hypertenziu (pozri časť 4.4).
V prípadoch podozrenia na predávkovanie sa musí liečba tivozanibom prerušiť a pacient sa musí monitorovať kvôli hypertenzii a podľa potreby liečiť štandardnou antihypertenzívnou liečbou.
Neexistuje žiadna špecifická liečba alebo antidotum na predávkovanie tivozanibom.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: cytostatiká, inhibítory-proteinkináz, ATC kód: L01XE34
Mechanizmus účinku
Tivozanib účinne a selektívne blokuje všetky 3 receptory vaskulárneho endotelového rastového
faktora (vascular endothelial growth factor receptor, VEGFR) a bolo preukázané, že in vitro blokuje rôzne biochemické a biologické odpovede vyvolané VEGF, vrátane fosforylácie všetkých troch
VEGFR 1, 2 a 3 indukovanej VEGF-ligandom a proliferácie ľudských endoteliálnych buniek. Ďalšou
najsilnejšie inhibovanou kinázou je c-kit, ktorý je 8-násobne menej citlivý na inhibíciu tivozanibom v porovnaní s VEGFR 1, 2 a 3. VEGF je silný mitogénny faktor, ktorý hrá ústrednú úlohu v angiogenéze a vaskulárnej permeabilite nádorových tkanív. Blokovaním aktivácie VEGFR indukovanej VEGF tivozanib inhibuje angiogenézu a vaskulárnu permeabilitu v nádorových tkanivách, čo vedie k
inhibícii rastu nádoru in vivo.
Klinická účinnosť
Účinnosť tivozanibu pri liečbe pokročilého RCC bola skúmaná v nasledujúcej randomizovanej
klinickej štúdii.
Štúdia AV-951-09-301
Táto kontrolovaná klinická štúdia bola multi-centrická, otvorená, medzinárodná, randomizovaná štúdia fázy 3 porovnávajúca tivozanib so sorafenibom u pacientov s pokročilým RCC. Päťsto sedemnásť (517) pacientov s rekurentným alebo metastatickým RCC s jasnou bunkovou zložkou bolo randomizovaných (1:1), aby dostali buď tivozanib 1 340 mikrogramov jedenkrát denne v schéme
3 týždňovej liečby, po ktorých nasledoval 1 týždeň prerušenie (schéma 3/1) alebo sorafenib 400 mg
dvakrát denne. Štúdia zahŕňala pacientov, ktorí absolvovali predchádzajúcu nefrektómiu a ktorí buď nedostali žiadnu predchádzajúcu liečbu alebo nie viac ako jednu predchádzajúcu systémovú terapiu pri metastázach (imunoterapia/chemoterapia); Predchádzajúca liečba s VEGF alebo mechanisticky zameraná liečba zacielenia rapamycínu (Target of Rapamycin, mTOR,) nebola povolená. Prechod do skupiny s liečbou tivozanibom bol povolený okamžite po progresii definovanej podľa Kritérií hodnotenia reakcie u pevných nádorov (Response Evaluation Criteria In Solid Tumours, RECIST)pri sorafenibe v súlade s protokolom samostatnej rozšírenej štúdie.
Primárnym koncovým ukazovateľom štúdie bolo prežitie bez progresie (progression free survival, PFS) zaslepenou nezávislou rádiologickou kontrolou. Kľúčové sekundárne parametre zahŕňali celkové prežitie (overall survival, OS) a mieru objektívnej odpovede (objective response rate, ORR) nezávislým preskúmaním rádiológie.
V populácii so zámerom liečiť (intent to treat, ITT) bolo zahrnutých 517 pacientov, 260 randomizovaných na tivozanib a 257 randomizovaných na sorafenib. Východiskové demografické charakteristiky a charakteristiky ochorenia boli vo všeobecnosti dobre vyvážené v skupinách s tivozanibom a sorafenibom vzhľadom na vek (priemerný vek 58,2, oproti 58,4 rokov, v tomto poradí), pohlavie (71,2 % oproti 73,5 % muži, v tomto poradí), rasa (95,8 %, oproti 96,9 % belochov, v tomto poradí), geografický región (88,1 % oproti 88,7 % zo strednej a východnej Európy, v tomto poradí) a predchádzajúce liečenie metastatického RCC (69,6 %, oproti 70,8 % predtým neliečení, v tomto poradí). U 30 % pacientov, ktorí dostali predchádzajúcu liečbu, bola prevládajúcou liečbou liečba interferón alfa ako monoterapia, ktorú dostalo 75 pacientov v skupine s tivozanibom a 62 pacientov so sorafenibom.
V nezávislých rádiologických vyšetreniach tivozanib preukázal štatisticky významné zlepšenie PFS a
ORR oproti sorafenibu (tabuľka 2 a obrázok 1).
Obrázok 1: Kaplanova-Meierova krivka prežitia bez progresie, nezávislý rádiologický prieskum (populácia ITT)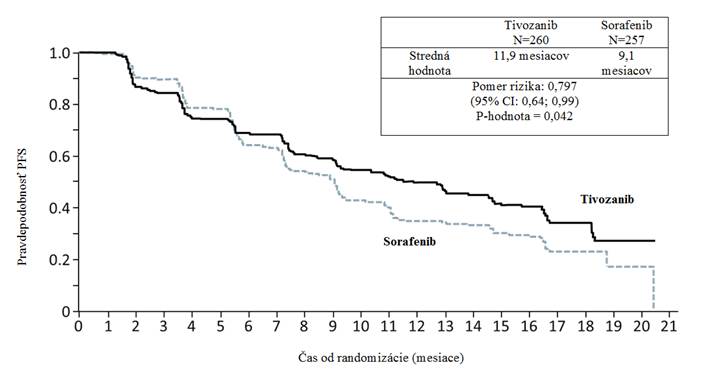
'
T
abuľka 2: Analýza účinnosti nezávislým rádiologickým prieskumom (populácia ITT)
T
ivozanib Sorafenib Pomer rizika
(95
% CI)
P-
hodnota
(
L
o
g rank test)
Prežitie-bez progresie
[stredná hodnota, mesiace (95% CI)], populácia ITT Objektívna miera odpovede (95% CI), ITT populácia
Prežívanie-bez progresie, bez predchádzajúcej liečby metastatickej RCC podskupiny [stredná hodnota, mesiace (95% CI)]
Prežitie-bez progresie, jedna predchádzajúca terapia pre podskupinu metastatických ochorení
[stredná hodnota, mesiace
(95% CI)]
N=260 11,9
(9,3; 14,7)
N=260 33,1% (27,4; 39,2)
N=181 12,7
(9,1; 15,0)
N=78 11,9
(8,0; 16,6)
N=257 9,1
(7,3; 9,5)
N=257 23,3%
(18,3; 29,0)
N=181 9,1
(7,3; 10,8)
N=76 9,1
(7,2; 11,1)
0,797
(0,639; 0,993)a
0,756
(0,580; 0,985)d
0,877
(0,587; 1,309)d
0,042b
0,014c
0,037e
0,520e

a Pomer rizika pre skupinu s tivozanibom v porovnaní so sorafenibom, na základe stratifikovaného modelu proporcionálneho rizika Cox. Faktory stratifikácie sú počet predchádzajúcich terapií (0 alebo 1) a počet zapojených metastatických miest/orgánov (1 alebo ≥ 2). Za predpokladu proporcionálnych rizík, pomer rizika menší ako 1 naznačuje zníženie miery rizika v prospech tivozanibu;
b p-hodnota podľa stratifikovaného log-rank testu. Faktory stratifikácie sú počet predchádzajúcich terapií
(0 alebo 1) a počet zapojených metastatických miest/orgánov (1 alebo ≥ 2);
c p-hodnota podľa stratifikovanej štatistiky Cochran-Mantel-Haenszel (CMH). Faktory stratifikácie sú počet predchádzajúcich terapií (0 alebo 1) a počet zapojených metastatických miest / orgánov (1 alebo ≥ 2);
d Pomer rizika pri analýze podskupín s tivozanibom v porovnaní so sorafenibom, založený na nestratifikovanom modeli proporcionálneho rizika Cox. Za predpokladu proporcionálnych rizík, pomer rizika menší ako 1 naznačuje zníženie miery rizika v prospech tivozanibu;
e Hodnota p pre analýzu podskupín na základe nestratifikovaného log-rank testu.
OS bola kľúčovým sekundárnym koncovým ukazovateľom v pivotnej štúdii a analýza zahŕňala údaje zo všetkých randomizovaných pacientov, vrátane tých, ktorí mali progresiu pri sorafenibe a prešli na tivozanib ako súčasť rozšírenej štúdie. V populácii ITT bol medzi oboma skupinami malý numerický rozdiel z hľadiska celkového prežitia. Stredná hodnota OS bola 28,2 mesiacov (95 % CI 22,5; 33,0) v skupine s tivozanibom v porovnaní s 30,8 mesiaca (95 % CI 28,4; 33,3) v skupine so sorafenibom (HR = 1,147; p = 0,276).
Starší pacientiV kontrolovanej klinickej štúdii (AV-951-09-301), v ktorej 25 % z pacientov, ktorí dostávali
tivozanib, mali ≥ 65 rokov, neboli pozorované žiadne celkové rozdiely v účinnosti medzi staršími a mladšími pacientmi (pozri časť 4.2).
V hlavných štúdiách RCC sa niektoré nežiaduce reakcie vyskytli častejšie u starších pacientov (pozri časť 4.4).
FarmakodynamickéúčinkyV bezpečnostnej kardiálnej štúdii s 50 pacientmi s pokročilými solídnymi nádormi liečenými tivozanibom v dávke 1 340 mikrogramov denne počas 21 dní, priemerná zmena oproti východiskovému stavu v QTcF bola 6,8 ms v 21. deň podávania. Maximálna zmena QTcF oproti východiskovému stavu bola 9,3 ms (90 % CI: 5; 13,6), ktorá sa vyskytla 2,5 hodiny po podaní dávky v
21. deň. Zmena strednej hodnoty pre všetky namerané dni a vo všetkých časových bodoch bola
2,2 ms. Žiadni jedinci nemali novú zmenu > 500 ms v QTcF; 2 pacienti (4 %) mali hodnoty QTcF>
480 ms. Jeden jedinec (2 %) mal zmenu > 60 ms oproti východiskovej hodnote v QTcF a 6 jedincov
(12 %) malo 30 ms až 60 ms zmenu od východiskovej hodnoty (pozri časť 4.4 a časť 4.8).
Pediatrická
populácia
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií s tivozanibom vo všetkých podskupinách pediatrickej populácie s pokročilým karcinómom renálnych buniek
(informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Po perorálnom podaní tivozanibu sa maximálne sérové hladiny dosiahnu po približne 2 až
24 hodinách. Po jednorazovej dávke 1 340 mikrogramov bola priemerná hodnota Cmax 10,2 až
25,2 ng/ml v štúdiách zdravých jedincov a pacientov. Jednorazová dávka AUC0-inf u zdravých
dobrovoľníkov, ktorí dostávali 1 340 mikrogramov tivozanibu, bola 1 950 až 2 491 ng.hr/ml. Po
podaní dávky 1 340 mikrogramov tivozanibu jedenkrát denne počas 21 alebo 28 dní u RCC pacientov, Cmax bolo 67,5 až 94,3 ng/ml a AUC0-24 bolo 1 180 až 1 641 ng.hr/ml. Expozícia je proporcionálna dávke medzi 890 a 1 340 mikrogramami a závislá od dávky pri širšom rozsahu 450 mg
a 1 790 mikrogramov. Akumulácia v rovnovážnom stave je približne 6- až 7-násobok expozície pozorovanej pri hladinách pri jednorazovej dávke. Klírens je podobný medzi akútnym a chronickým dávkovaním, čo naznačuje, že v PK nedochádza k žiadnym časovo závislým zmenám.
Keď bol tivozanib hodnotený v štúdii účinku potravy u zdravých jedincov, jedlo s vysokým obsahom tuku znížilo maximálne sérové koncentrácie (Cmax) o 23,4 % v porovnaní so stavom na lačno. Nebol žiadny vplyv jedla na celkovú expozíciu (AUC). Na základe týchto údajov sa tivozanib môže podávať s jedlom alebo bez jedla (pozri časť 4.2).
Distribúcia
Štúdie väzby na bielkoviny in vitro ukázali, že tivozanib sa viaže na plazmatické bielkoviny > 99 %. Nezaznamenala sa žiadna koncentračná závislosť väzby na plazmatické bielkoviny v rozmedzí 0,1 až
5 μmol/l tivozanibu. Albumín je hlavnou zložkou viažucou tivozanib v ľudskej plazme. Štúdie in vitro
ukázali, že tivozanib nie je ani substrátom, ani inhibítorom efluxnej pumpy pre mnohé lieky, P-glykoproteín. Štúdie in vitro naznačujú, že tivozanib je inhibítorom intestinálneho BCRP.
Biotransformácia
Štúdie metabolizmu in vitro ukázali, že CYP3A4 a CYP1A1 sú schopné metabolizovať tivozanib. Nezmenený tivozanib je hlavnou cirkulujúcou formou molekuly a v sére neboli žiadne hlavné
metabolity detekované pri expozícii rovnajúcej sa alebo väčšej ako 10% celkovej expozície rádioaktivity. Keďže CYP1A1 je primárne exprimovaný v extrahepatálnych tkanivách, ako sú pľúca a
črevá, bolo považované za nepravdepodobné, že by sa táto izoforma intenzívne podieľala na pečeňovom metabolizme.
Štúdie in vitro ukázali, že metabolity tivozanibu môžu podliehať biotransformácii sprostredkovanej UGT prostredníctvom ciest UGT1A1, UGT1A3, UGT1A7, UGT1A8, UGT1A9 a UGT1A10. Priama N-glukuronidácia tivozanibu bola menej významnou cestou metabolizmu in vitro.
Eliminácia
Po chronickom podávaní tivozanibu pacientom s RCC počas 21 dní, po ktorých nasleduje 7 dní bez podania tivozanibu, je Cmin tivozanibu približne 16,0 až 30,9 ng/ml.
V štúdiách, ktoré hodnotili konečnú eliminačnú fázu, mal tivozanib priemerný t½ 4,5 - 5,1 dní. Po jednorazovej dávke perorálnej dávky [14C] tivozanibu sa približne 79 % rádioaktivity izolovalo v stolici a približne 12 % sa zistilo v moči ako metabolity. Nezistil sa nezmenený tivozanib v moči, čo naznačuje, že tivozanib nepodlieha renálnemu vylučovaniu. [14C] Tivozanib bol prevládajúcou látkou súvisiacou s liekmi v stolici. V stolici neboli prítomné žiadne metabolity obsahujúce [14C] v množstve viac ako 10 % dávky.
Špeciálne populácie
Vek,pohlaviearasa
Na základe populačnej farmakokinetickej analýzy neexistuje klinicky významný vplyv veku, pohlavia alebo rasy na farmakokinetiku tivozanibu.
Poruchafunkciepečene
Výsledky štúdie s jednorazovou dávkou na vyhodnotenie farmakokinetiky, bezpečnosti a znášanlivosti
tivozanibu u jedincov s poruchou funkcie pečene ukazujú, že počas celej doby merania bol tivozanib eliminovaný pomalšie u jedincov so stredne ťažkou (trieda B podľa Childa-Pugha) alebo ťažkou (trieda C podľa Childa-Pugha) poruchou funkcie pečene. Expozícia tivozanibu bola zvýšená u
pacientov s ťažkou poruchou funkcie pečene (priemerná AUC0-∞ 4,0-násobne) a u pacientov so stredne ťažkou poruchou funkcie pečene (priemerná hodnota AUC 0-∞ 2,6-násobne). Pri pacientoch s miernou (trieda A podľa Childa-Pugha) poruchou funkcie pečene (priemerná hodnota AUC0-∞ 1,2-násobne) sa nepozoroval žiadny významný nárast expozície. Tivozanib sa má používať s opatrnosťou u pacientov so stredne ťažkou poruchou funkcie pečene a dávka sa má znížiť na jednu kapsulu 1 340 mikrogramov každý druhý deň. Tivozanib sa nesmie používať u pacientov s ťažkou poruchou funkcie pečene (pozri časť 4.2 a časť 4.4).
Poruchafunkcieobličiek
Klinické štúdie s tivozanibom boli vykonané u pacientov s RCC s koncentráciou kreatinínu v sére
≤ 2-násobkom hornej hranice normy, vrátane tých, ktorí mohli mať predtým nefrektómiu. Hoci vplyv ďalšej poruchy funkcie obličiek na celkovú dispozíciu tivozanibu nie je známy, klinická štúdia
ukázala, že močom sa nevylučuje žiadny nezmenený tivozanib, čo naznačuje, že tivozanib nepodlieha renálnej exkrécii. Podľa populačnej farmakokinetickej analýzy expozície tivozanibu sa u pacientov s
miernou alebo stredne ťažkou poruchou funkcie obličiek nevyžaduje úprava dávkovania. Skúsenosti s použitím tivozanibu u pacientov s ťažkou poruchou funkcie obličiek sú obmedzené a odporúča sa
opatrnosť.
CYPaUGTinvitroštúdie
In vitro štúdie s tivozanibom naznačujú, že nie je induktor enzýmu CYP. Štúdie in vitro uskutočnené na mikrozómoch a hepatocytoch ľudskej pečene a hodnotiace aktivitu CYP1A2, CYP2B6, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 a CYP3A4 naznačili, že tivozanib je slabým inhibítorom CYP2B6 a CYP2C8. Na základe in vitro IC50 a in vivo Cmax, neviazaného liečiva nebolo pravdepodobné, že by tivozanib interagoval klinicky významným spôsobom s účinnými látkami, ktoré sú metabolizované týmito enzýmovými cestami.
Štúdie uskutočnené in vitro ukázali, že tivozanib nie je silným inhibítorom UGT
(UDP-glukuronozyltransferázy) metabolických aktivít a klinicky relevantné liekové interakcie sú nepravdepodobné pri liekoch metabolizovaných týmito cestami.
ŠtúdieInvitrotransportéra
Štúdie in vitro ukázali, že tivozanib nie je ani substrátom, ani inhibítorom efluxnej pumpy viacerých liekov, P-glykoproteínu.
Tivozanib inhibuje transportný proteín BCRP in vitro v koncentráciách, ktoré pravdepodobne obmedzujú účinok na aktivitu BCRP v čreve in vivo.
Možnosť, že tivozanib bude substrátom transportérov iných, než je P-glykoproteín, nebola hodnotená.
5.3 Predklinické údaje o bezpečnosti
Nežiaduce reakcie, ktoré neboli pozorované v klinických štúdiách, ale boli pozorované u zvierat v expozičných hladinách podobných klinickým expozičným hladinám a s možným významom pre klinické použitie boli nasledovné.
V štúdiách toxicity po opakovanej dávke u potkanov boli zaznamenané abnormality u rastúcich rezákov (tenké krehké zuby, strata zubov, maloklúzie) v dávkach približne 2-násobne vyšších ako
vypočítaná dávka ekvivalentná u ľudí a hypertrofia rastovej platničky bola pozorovaná v dávkach približne 0,7- a 7-násobne vyšších ako vypočítaná dávka ekvivalentná u ľudí. Ukázalo sa, že tivozanib spôsobuje hypertrofiu rastových platničiek, neprítomnosť aktívneho žltého telieska a žiadne zrejúce folikuly u makakov pri dávkach, ktoré spôsobili expozície ekvivalentné expozíciám pozorovaným pri odporúčanej klinickej dávke.
Reprodukcia,mutagenéza,poruchaplodnosti
Tivozanib môže poškodiť ľudskú plodnosť. V predklinických štúdiách hodnotiacich parametre párenia a plodnosti u samcov potkanov, dávky > 2-násobne vyššie ako odporúčaná klinická dávka spôsobili
zvýšenú hmotnosť nadsemenníka a semenníkov spojenú s neplodnosťou. Zvýšená hmotnosť
semenníkov sa pozorovala pri dávke 7-krát vyššej ako odporúčaná klinická dávka. U samíc potkanov sa pozoroval nárast plodov neschopných života v dávke 0,7-násobku odporúčanej klinickej dávky, zatiaľ čo dávky ≥ 2-násobku odporúčanej klinickej dávky spôsobili neplodnosť.
Ukázalo sa, že tivozanib je u gravidných potkanov teratogénny, embryotoxický a fetotoxický pri dávkach, ktoré sú 5 krát nižšie ako odporúčaná klinická dávka (u 60 kg človeka). Štúdie na gravidných králikoch nepreukázali žiadny vplyv na zdravie matiek alebo embryofetálny vývin v dávkach približne
0,6-násobku expozície v odporúčanej dávke u ľudí.
Karcinogenéza
Štúdie karcinogenity sa pri tivozanibe nevykonali.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Fotivda 890 mikrogramov tvrdé kapsuly
Obsah kapsuly
manitol
stearan horečnatý
Obal kapsuly
želatína
oxid titaničitý (E171) indigo karmín (E132) žltý oxid železitý (E172)
Tlačiarenská farba (žltá)
šelak
propylénglykol
silný roztok amoniaku
oxid titaničitý (E171)
tartrazínový hliníkový lak (E102)
Tlačiarenská farba (modrá)
šelak
propylénglykol
silný roztok amoniaku
indigo karmínový hliníkový lak (E132)
Fotivda 1 340mikrogramovtvrdékapsuly
Obsah kapsuly
manitol
stearan horečnatý
O
bal kapsuly
želatína
oxid titaničitý (E171)
žltý oxid železitý (E172)
Tlačiarenská farba (modrá)
šelak
propylénglykol
silný roztok amoniaku
indigo karmínový hliníkový lak (E132)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
5 rokov.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte fľašu tesne uzavretú na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
Biela HDPE fľaša s detským bezpečnostným uzáverom obsahujúca 21 tvrdých kapsúl. Každé balenie obsahuje 1 fľašu.
6.6 Špeciálne opatrenia na likvidáciu
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má byť zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
EUSA Pharma (UK) Limited Breakspear Park, Breakspear Way Hemel Hempstead, HP2 4TZ Spojené kráľovstvo
8. REGISTRAČNÉ ČÍSLO/ČÍSLA
Fotivda890mikrogramovtvrdékapsuly
EU/1/17/1215/001
Fotivda1340mikrogramovtvrdékapsuly
EU/1/17/1215/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu