
Predkožka musí byť zo žaluďa penisu stiahnutá. Keď je tlaková nádoba v kolmej polohe (ventilom hore), 1 dávka lieku Fortacin sa aplikuje na celý žaluď penisu pomocou 3 strekov. Pri každom streku má byť pokrytá tretina žaluďa penisu. Po 5 minútach, pred sexuálnym stykom, sa nadbytočné množstvo lieku zotrie.
4.3 Kontraindikácie
Precitlivenosť pacienta alebo jeho partnerky na liečivá alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Pacienti alebo ich partnerky so známou anamnézou citlivosti na lokálne anestetiká amidového typu.
4.4 Osobitné upozornenia a opatrenia pri používaní
Stavy spojené s anémiou
Pacienti alebo ich partnerky s deficienciou glukóza-6-fosfátdehydrogenázy alebo s vrodenou či
idiopatickou methemoglobinémiou sú citlivejší na methemoglobinémiu indukovanú liekom (pozri časť 4.5).
Hoci je systémová dostupnosť prilokaínu prostredníctvom kožnej absorpcie lieku Fortacin nízka, opatrnosť je potrebná v prípade pacientov s anémiou, vrodenou alebo získanou methemoglobinémiou alebo v prípade pacientov, ktorí dostávajú súbežnú liečbu, o ktorej je známe, že vyvoláva takéto stavy.
Interakcie
V prípade pacientov užívajúcich antiarytmické lieky triedy III (napr. amiodarón) je pri liečbe potrebná
opatrnosť.
Precitlivenosť
Nepreukázalo sa, že pacienti alergickí na deriváty kyseliny paraaminobenzoovej (prokaín, tetrakaín,
benzokaín atď.) majú skríženú citlivosť na lidokaín a/alebo prilokaín; liek Fortacin sa však musí používať obozretne u pacientov s anamnézou (alebo u partnerky s anamnézou) citlivosti na lieky, najmä ak nie je jasné, ktorý liek spôsobuje alergiu.
Opatrenia pri používaní
Je potrebné dbať na to, aby liek Fortacin neprišiel do styku s očami, pretože to môže zapríčiniť ich
podráždenie. Strata ochranných reflexov môže umožniť podráždenie a možnú abráziu rohovky. Absorpcia lieku Fortacin v spojivkovom tkanive nebola stanovená. Ak príde liek do styku s okom,
ihneď oko vypláchnite vodou alebo roztokom chloridu sodného a chráňte ho, kým sa neobnoví citlivosť.
Liek Fortacin, ktorý sa dostal postrekom na sliznice pacienta alebo jeho partnerky, napríklad do úst, nosa a hrdla, alebo ktorý sa preniesol na genitálie alebo výstelku análneho otvoru partnerky, by sa mohol absorbovať, čo by pravdepodobne mohlo viesť k dočasnej lokálnej necitlivosti/anestézii. Táto hypoestézia môže zastrieť normálne pocity bolesti a zvýšiť tak riziko lokalizovaného poranenia.
Liek Fortacin, ktorý sa dostal postrekom na poškodený ušný bubienok, môže zapríčiniť ototoxicitu stredného ucha.
Pozorovalo sa zhoršenie, keď sa liek Fortacin použil spolu s kondómami pre mužov alebo ženy na báze polyuretánu.
Pri použití lieku Fortacin spolu s kondómom pre mužov sa môže pozorovať vyššia miera erektilnej dysfunkcie a hypoestézia genitálií muža.
Pacienti, ktorí sa pokúšajú o počatie, by vzhľadom na riziko prenosu lieku na partnerku nemali používať liek Fortacin, alebo ak je dôležité dosiahnuť penetráciu, 5 minút po aplikácii tlakovej nádoby, pred sexuálnym stykom, si musia čo najdôkladnejšie umyť žaluď penisu (pozri časť 4.6).
Pacienti so závažnýmpoškodenímfunkciepečene
Pacienti so závažným ochorením pečene majú vzhľadom na neschopnosť normálne metabolizovať
lokálne anestetiká vyššie riziko toxických plazmatických koncentrácií lidokaínu a prilokaínu (pozri časť 4.2).
4.5 Liekové a iné interakcie
Methemoglobinémia sa môže zhoršiť u pacientov, ktorí už užívajú lieky, o ktorých je známe, že indukujú tento stav; patria k nim sulfónamidy, acetanilid, anilínové farbivá, benzokaín, chlorochinón, dapsón, metoklopramid, naftalén, dusičnany a dusitany, nitrofurantoín, nitroglycerín, nitroprusid, pamachín, kyselina paraamínosalicylová, fenobarbital, fenytoín, primachín a chinín (pozri časť 4.4).
Keď sú veľké dávky lieku Fortacin používané pacientmi, ktorí už užívajú iné lokálne anestetiká alebo štrukturálne podobné lieky, napr. antiarytmické lieky triedy I, ako je mexiletín, treba zvážiť riziko ďalšej systémovej toxicity.
Neuskutočnili sa konkrétne interakčné štúdie s lidokaínom/prilokaínom a antiarytmickými liekmi triedy III (napr. amiodarón); odporúča sa však obozretnosť (pozri tiež časť 4.4).
Lieky, ktoré znižujú klírens lidokaínu (napr. cimetidín alebo betablokátory), môžu zapríčiniť potenciálne toxické plazmatické koncentrácie, keď sa lidokaín podáva intravenózne v opakovaných vysokých dávkach dlhšiu dobu (30 hodín).
Interakčné štúdie in vitro s lokálnymi protiplesňovými liekmi (klotrimazol, ekonazol, imidazol, nystatín, mikonazol, ketokonazol), antibakteriálnymi liekmi (klindamycín, metronidazol)
a antivírusovými liekmi (acyklovir) nepreukázali žiadny účinok na antimikrobiálnu aktivitu.
4.6 Fertilita, gravidita a laktácia
Liek Fortacin nie je indikovaný na použitie ženami. U partneriek mužov liečených liekom Fortacin sa však môže pozorovať určitá expozícia.
Ž
eny vo fertilnomveku/Antikoncepciaumužovažien
Pacienti, ktorí sa pokúšajú o počatie, nemajú používať liek Fortacin, alebo ak je dôležité dosiahnuť
penetráciu, pred sexuálnym stykom si musia čo najdôkladnejšie umyť žaluď penisu.
Gravidita
Nie sú k dispozícii žiadne údaje alebo sú k dispozícii len obmedzené údaje o použití lidokaínu
a prilokaínu u gravidných žien. Štúdiami na zvieratách sa nepreukázala reprodukčná toxicita (pozri časť 5.3). V rámci prevencie je vhodné vyhnúť sa použitiu lieku Fortacin počas gravidity, ak sa nepoužíva účinná mužská bariérová antikoncepcia na zabránenie potenciálnej expozície plodu.
Laktácia
Lidokaín a prilokaín sa vylučujú do ľudského mlieka, ale v terapeutických dávkach lieku Fortacin sa
nepredpokladá žiadny účinok na dojčených novorodencov/dojčatá v dôsledku prenosu liečiv z muža na jeho partnerku.
Fertilita
Nie sú k dispozícii dostatočné údaje o vplyve lidokaínu a prilokaínu na fertilitu u ľudí. Štúdiou
na potkanoch sa preukázalo, že liek Fortacin spôsobuje zníženie pohyblivosti spermií. Tento liek môže znížiť pravdepodobnosť počatia, ale nemá sa používať ako antikoncepcia.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Liek Fortacin nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Bezpečnosť lieku Fortacin sa hodnotila na základe 596 pacientov, ktorí si liek aplikovali v rámci
klinických skúšaní. Bezpečnosť sa hodnotila aj u 584 partneriek týchto pacientov.
Nežiaduce reakcie sa vyskytli u 9,6 % mužov a u 6,0 % partneriek mužov. Väčšina prípadov sa klasifikovala ako mierne alebo stredne závažné.
K najčastejším nežiaducim reakciám hláseným pri používaní tohto lieku u mužov patrila lokálna genitálna hypoestézia (4,5 %) a erektilná dysfunkcia (4,4 %). V dôsledku týchto nežiaducich reakcií sa liečba prerušila u 0,2 %, respektíve 0,5 % pacientov.
K najčastejším nežiaducim reakciám hláseným pri používaní tohto lieku u partneriek mužov patril pocit vulvovaginálneho pálenia (3,9 %) a genitálna hypoestézia (1,0 %). V dôsledku vulvovaginálneho diskomfortu alebo pocitu pálenia sa liečba prerušila u 0,3 % pacientov.
Tabuľkový súhrn nežiaducichreakcií
Frekvencia nežiaducich reakcií je definovaná ako: veľmi časté (≥1/10), časté (≥1/100 až <1/10),
menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1000), veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov). V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí podľa klesajúcej závažnosti.
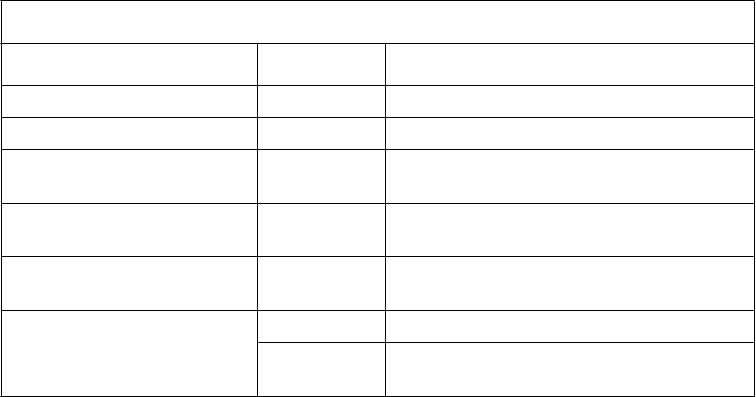
N
ežiaduce reakcie na liek u mužov, ktorí si liek aplikovali na žaluď penisu
T
rieda orgánových systémov Frekvencia Nežiaduce reakcie
Psychické poruchy Menej časté abnormálny orgazmus
Poruchy nervového systému Menej časté bolesť hlavy
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy kože a podkožného tkaniva
Poruchy reprodukčného systému a prsníkov
Celkové poruchy a reakcie v mieste podania
Menej časté podráždenie hrdla
Menej časté podráždenie kože
Časté hypoestézia genitálií u mužov, erektilná dysfunkcia, pocit pálenia v genitáliach
Menej časté genitálny erytém, neúspešná ejakulácia, parestézia genitálií u mužov, bolesť penisu, porucha penisu, genitálny pruritus
Menej časté pyrexia
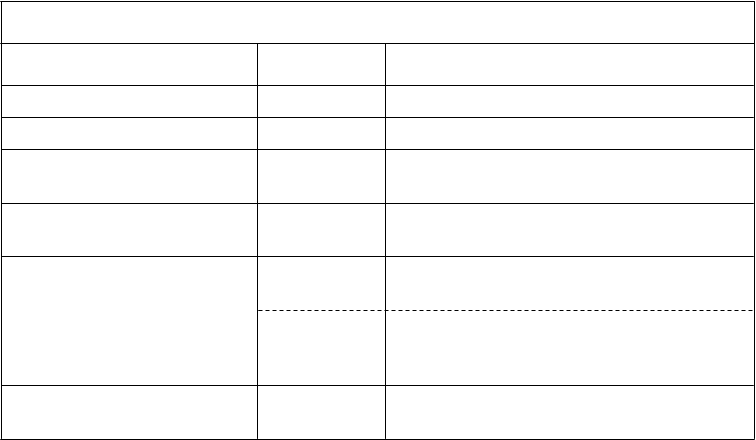
N
ežiaduce reakcie na liek u partneriek pacientov
T
rieda orgánových systémov Frekvencia Nežiaduce reakcie
Infekcie a nákazy Menej časté vaginálna kandidóza
Poruchy nervového systému Menej časté bolesť hlavy
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy obličiek a močových ciest
Poruchy reprodukčného systému a prsníkov
Menej časté podráždenie hrdla
Menej časté anorektálny diskomfort, orálna parestézia
Menej časté dyzúria
Časté pocit vulvovaginálneho pálenia, hypoestézia
Menej časté vulvovaginálny diskomfort, vaginálna bolesť, vulvovaginálny pruritus
 H
l
ásenie
podozrení
na
nežiaduce
reakcie
H
l
ásenie
podozrení
na
nežiaduce
reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V.4.9 PredávkovanieKeďže liek Fortacin sa aplikuje lokálne na žaluď penisu, riziko predávkovania je nízke. Prilokaín vo vysokých dávkach môže zapríčiniť zvýšenie hladiny methemoglobínu, najmä
v kombinácii s liekmi indukujúcimi methemoglobinémiu (napr. sulfónamidy). Klinicky významná
methemoglobinémia sa má liečiť pomalou intravenóznou injekciou metyltioníniumchloridu.
Ak sa vyskytnú ďalšie symptómy systémovej toxicity, predpokladá sa, že príznaky budú podobného charakteru ako po podaní lokálnych anestetík inými cestami. Toxicita zapríčinená lokálnymi anestetikami sa prejavuje symptómami excitácie nervového systému a v závažných prípadoch útlmom centrálneho nervového systému a kardiovaskulárneho systému.
Závažné neurologické symptómy (kŕče, útlm CNS) sa musia liečiť symptomaticky podporou dýchania a podávaním antikonvulzívnych liekov.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: anestetiká, amidy, ATC kód: NO1BB20
Mechanizmus účinku
Liek Fortacin zabezpečuje lokálnu anestéziu žaluďa penisu. Účinné látky lidokaín a prilokaín blokujú
prenos nervových impulzov v žaludi penisu, čím sa znižuje citlivosť žaluďa penisu. To sa premieta do predĺženia času ejakulácie bez nežiaduceho vplyvu na vnímanie ejakulácie.
Farmakodynamické účinky
Klinické skúšania preukázali, že liek Fortacin predlžuje čas ejakulácie vo vnútri vagíny (IELT),
zlepšuje kontrolu ejakulácie a zmierňuje pocity úzkosti u pacientov s predčasnou ejakuláciou na základe indexu predčasnej ejakulácie (IPE). Liek má rýchly nástup účinku a je účinný do 5 minút po aplikácii. Preukázalo sa, že účinnosť lieku pretrváva pri opakovanom použití v priebehu času.
Klinická účinnosť abezpečnosť
Účinnosť lieku Fortacin sa preukázala v dvoch multicentrických, multinárodných, randomizovaných
dvojito zaslepených štúdiách kontrolovaných placebom, po ktorých nasledovala otvorená fáza. Na zaradenie do štúdií boli vhodní muži spĺňajúci kritériá Medzinárodnej spoločnosti pre sexuálnu medicínu (ISSM) pre predčasnú ejakuláciu (PE), ktorí mali vo východiskovom bode hodnotu IELT
≤ 1 minúta v najmenej 2 z prvých 3 sexuálnych stykov počas skríningu.
Účinnosť lieku Fortacin pri liečbe predčasnej ejakulácie sa posudzovala na základe hodnoty IELT a dvoch primárnych parametrov kontroly ejakulácie, sexuálneho uspokojenia a úzkosti pomocou indexu IPE. Počas 3 mesiacov dvojito zaslepenej liečebnej fázy sa geometrický priemer IELT zvýšil z 0,58 na 3,17 minúty v skupine používajúcej liek Fortacin, a z 0,56 na 0,94 minúty v skupine používajúcej placebo.
Priemernú hodnotu IELT > 1 minúta dosiahlo 85,2 % pacientov v skupine používajúcich liek Fortacin počas 3-mesačnej liečby týmto liekom, zatiaľ čo priemernú hodnotu IELT > 1 minúta dosiahlo 46,4 % pacientov používajúcich placebo. Priemernú hodnotu IELT > 2 minúty dosiahlo 66,2 % pacientov liečených liekom Fortacin a 18,8 % pacientov liečených placebom.
Klinicky významné zvýšenia hodnoty IELT boli paralelné s významnými rozdielmi v skóre indexu IPE (p <0,0001). Upravené skóre priemernej zmeny (liek Fortacin vs. placebo) v 3. mesiaci boli 8,2 vs. 2,2 pre skóre kontroly ejakulácie, 7,2 vs. 1,9 pre skóre sexuálneho uspokojenia a 3,7 vs. 1,1 pre skóre úzkosti.
V prípade pacientov liečených liekom Fortacin sa skóre IELT a IPE zvýšili v prvom meranom časovom bode. Skóre IELT a IPE sa naďalej trochu zvyšovali počas zostávajúceho času dvojito zaslepenej fázy. Pozitívne zmeny v skóre IELT a IPE sa zachovali počas otvorenej liečebnej fázy.
V rámci každého z troch mesačných hodnotení všetci pacienti vyplnili dotazník profilu predčasnej ejakulácie (PEP), ktorý sa týkal vnímanej kontroly ejakulácie, osobnej úzkosti spojenej s ejakuláciou, spokojnosti so sexuálnym stykom a partnerských problémov v súvislosti s ejakuláciou. Skóre PEP sledovali podobný vzorec zlepšenia ako skóre IELT a IPE. V prípade všetkých troch mesačných hodnotení pacientmi sa zaznamenal významný rozdiel medzi liekom Fortacin a placebom (p <
0,0001). Partnerky vyplnili dotazník PEP v treťom mesiaci. Na základe odpovedí partneriek sa tiež pozoroval významný rozdiel v porovnaní s placebom vo všetkých oblastiach (p < 0,0001).
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií skúmajúcich liek
Fortacin vo všetkých podskupinách pediatrickej populácie pri predčasnej ejakulácii (informácie o použití v pediatrickej populácii, pozri časť 4.2).'
5.2 Farmakokinetické vlastnosti
Absorpcia
Plazmatické hladiny lidokaínu a prilokaínu u mužov a žien boli nižšie ako hladina spojená s toxicitou
(5000 ng/ml). Muži-dobrovoľníci dosiahli po opakovanom dávkovaní maximálnu plazmatickú koncentráciu lidokaínu, ktorá bola nižšia ako 4 % toxickej hladiny, a maximálnu plazmatickú koncentráciu prilokaínu, ktorá bola nižšia ako 0,4 % toxickej hladiny. Ženy-dobrovoľníčky, ktoré dostali opakovanú dávku priamo do krčku maternice a vagíny, pričom táto dávka bola až päťnásobne vyššia ako odporúčaná dávka pre partnera, dosiahli maximálnu plazmatickú hladinu lidokaínu, ktorá bola nižšia ako 8 % toxickej dávky, a maximálnu plazmatickú hladinu prilokaínu, ktorá bola nižšia ako 1 % toxickej hladiny.
Systémová expozícia lidokaínu a prilokaínu a ich metabolitom (2,6-xylidínu, respektíve o-toluidínu) je nízka po aplikácii na žaluď penisu u mužov a po aplikácii do klenby krčka maternice/vagíny u žien v dávkach vyšších ako je odporúčaná dávka.
Distribúcia
Lidokaín
Distribučný objem v rovnovážnom stave po intravenóznom podaní je 1,1 až 2,1 l/kg. Je hlásené, že
66 % lidokaínu sa viaže na plazmatické proteíny vrátane kyslého alfa-1-glykoproteínu. Lidokaín môže prechádzať cez krvno-mozgovú bariéru a cez placentu a distribuuje sa do materského mlieka.
Prilokaín
Distribučný objem prilokaínu v rovnovážnom stave po intravenóznom podaní je 0,7 až 4,4 l/kg. Je hlásené, že 55 % prilokaínu sa viaže na plazmatické proteíny vrátane kyslého alfa-1-glykoproteínu. Prilokaín prechádza cez krvno-mozgovú bariéru aj cez placentu. Prilokaín sa tiež distribuuje
do materského mlieka.
Biotransformácia
Lidokaín sa metabolizuje prevažne v pečeni prostredníctvom cytochrómu P450 (CYP 3A4)
a pravdepodobne v menšej miere sa metabolizuje v koži. Po podaní perorálnych dávok je metabolizmus pri prvom prechode rýchly a rozsiahly a biologická dostupnosť je približne 35 %.
Prilokaín sa rýchlo metabolizuje v pečeni prostredníctvom cytochrómu P450 a v obličkách prostredníctvom amidáz.
Metabolizmus lidokaínu a prilokaínu vedie k tvorbe 2,6-xylidínu, respektíve o-toluidínu okrem iných metabolitov. Plazmatické hladiny týchto metabolitov zistených po podaní lieku Fortacin v rámci klinických skúšaní boli nízke u mužov a žien aj po podaní dávok lieku, ktoré mnohonásobne prekračovali klinickú dávku. Metabolity 2,6-xylidín alebo o-toluidín sa nezistili v žiadnom časovom bode vo vaginálnych výlučkoch po lokálnej aplikácii lieku u žien-dobrovoľníčok.
Eliminácia
Lidokaín
Terminálny polčas eliminácie z plazmy po intravenóznom podaní je približne 65 - 150 minút
a systémový klírens je 10 - 20 ml/min/kg. Lidokaín sa vylučuje v moči najmä vo forme metabolitov a len malá časť sa vylúči v nezmenenej forme.
Prilokaín
Polčas eliminácie prilokaínu po intravenóznom podaní je približne 10 - 150 minút. Systémový klírens je 18 - 64 ml/min/kg. Prilokaín sa vylučuje v moči najmä vo forme metabolitov a len malá časť sa vylúči v nezmenenej forme.
5.3 Predklinické údaje o bezpečnosti
Reprodukčná toxicita
Lidokaín
V štúdiách embryonálneho/fetálneho vývinu na potkanoch a králikoch, ktoré dostávali dávky lieku počas organogenézy, sa nepozorovali žiadne teratogénne účinky. U králikov sa pozorovala embryotoxicita pri použití dávok toxických pre matku. Preukázalo sa, že čas postnatálneho prežitia potomstva potkanov liečených počas gravidity a laktácie dávkou toxickou pre matku je kratší.
Prilokaín
V štúdii na brezivých potkanoch, ktoré dostávali kombináciu lidokaínu a prilokaínu počas organogenézy, sa nepozorovali žiadne účinky na embryonálny/fetálny vývin. Nie sú však k dispozícii žiadne údaje o systémovej expozícii na porovnanie s klinickou expozíciou.
Genotoxicita a karcinogenita
Lidokaín
Lidokaín nebol genotoxický a karcinogénny potenciál lidokaínu sa neskúmal. Metabolit lidokaínu
2,6-xylidín má in vitro genotoxický potenciál. V štúdii karcinogenity na potkanoch vystavených
2,6-xylidínu in utero, postnatálne a počas celého života sa pozorovali tumory v nosovej dutine, podkožné tumory a tumory pečene. Klinický význam zistenia tumorov vo vzťahu
ku krátkodobému/občasnému používaniu lidokaínu u ľudí nie je známy. Humánna expozícia lieku Fortacin je 20- až 30-násobne nižšia ako minimálna dávka, ktorá neviedla k tumorom a 200-násobne nižšia ako minimálna dávka, ktorá viedla k tumorom.
Prilokaín
Prilokaín nebol genotoxický a karcinogénny potenciál prilokaínu sa neskúmal. Metabolit prilokaínu
o-toluidín má in vitro genotoxický potenciál. V štúdiách karcinogenity skúmajúcich o-toluidín
u potkanov, myší a škrečkov sa pozorovali tumory v niektorých orgánoch. Klinický význam zistenia tumorov vo vzťahu ku krátkodobému/občasnému používaniu prilokaínu u ľudí nie je známy. Humánna expozícia je 1000-násobne nižšia ako minimálna skúmaná dávka. Poznámka: táto dávka
viedla k tumorom.
Účinok na fertilitu
V štúdii in vitro na potkanoch sa preukázalo, že liek Fortacin znižuje pohyblivosť spermií, keď
22,5 mg lidokaínu a 7,5 mg prilokaínu (t. j. množstvo v 1 humánnej dávke) bolo v priamom kontakte so spermiami potkanov. Táto štúdia však nereprodukovala okolnosti klinického použitia, keďže koncentrácia lieku Fortacin v priamom kontakte so spermiami by bola mnohonásobne nižšia. Možnosť zníženia pohyblivosti spermií po klinickom použití lieku sa nedá vylúčiť; preto nie je možné vyvodiť záver, že liek Fortacin zabraňuje počatiu.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Norflurán
6.2 Inkompatibility
Pozorovalo sa zhoršenie, keď sa liek Fortacin použil spolu s kondómami pre mužov alebo ženy na báze polyuretánu (pozri časť 4.4).
6.3 Čas použiteľnosti
18 mesiacov.
Po prvom použití: 12 týždňov.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25° C. Neuchovávajte v mrazničke.
6.5 Druh obalu a obsah balenia
Každé balenie obsahuje jednu hliníkovú tlakovú nádobu s dávkovacím ventilom obsahujúci 6,5 ml alebo 5,0 ml roztoku.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Kovová nádoba je pod tlakom. Nesmie sa prepichovať, zlomiť ani spaľovať, ani keď je zjavne prázdna.
Zvyšný objem kvapaliny, ktorý nie je použiteľný, ostane v nádobe po podaní všetkých dávok. Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Plethora Solutions Limited Hampden House Monument Business Park Chalgrove
OX44 7RW Spojené kráľovstvo
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/13/881/001-002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 15. november 2013
10. DÁTUM REVÍZIE TEXTU{MM/RRRR}
Podrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky:
http://www.ema.europa.eu/