u na tejto hladine až do dosiahnutia hemostázy a nad 0,5 g/l do úplného zahojenia rany.
V prípade chirurgického zákroku alebo liečby epizódy krvácania sa má dávka vypočítať nasledovne:
Dávka (mg/kg telesnej hmotnosti) =
[cieľová hladina (g/l) - stanovená hladina (g/l)]0,018 (g/l na mg/kg telesnej hmotnosti)
Následné podávanie (dávky a frekvencia podávania injekcií) sa má upraviť na základe klinického stavu pacienta a laboratórnych výsledkov.
Biologický polčas fibrinogénu je 3 - 4 dni. Preto sa pri absencii spotreby opakovaná liečba ľudským fibrinogénom zvyčajne nevyžaduje. Vzhľadom na akumuláciu, ku ktorej dochádza v prípade opakovaného podávania pri profylaktickom použití, sa má dávka a frekvencia podávania určiť na základe terapeutických cieľov lekára u daného pacienta.
Dávkovanie u osobitných skupín pacientov
Pediatrickí pacientiV súčasnosti dostupné údaje sú opísané v časti 4.8 a 5.1, ale neumožňujú uviesť odporúčania na dávkovanie u detí.
Starší pacientiKlinické štúdie s Fibrygou nezahŕňali pacientov vo veku 65 rokov a starších, ktorí by poskytli presvedčivý dôkaz, že títo pacienti reagujú alebo nereagujú inak ako mladší pacienti.
2. Liečba krvácania Krvácanie u pacientov s vrodenou hypo- alebo afibrinogenémiouKrvácanie sa má liečiť s cieľom dosiahnuť odporúčanú cieľovú plazmatickú hladinu fibrinogénu 1 g/l. Táto hladina sa má udržiavať dovtedy, kým sa nedosiahne hemostáza.
Spôsob podávaniaIntravenózna infúzia alebo injekcia.
Fibryga sa má podať pomaly intravenózne pri odporúčanej maximálnej rýchlosti 5 ml za minútu.
Pokyny na rekonštitúciu lieku pred podaním, pozri časť 6.6.
4.3 Kontraindikácie Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní TromboembóliaAk sa pacienti s vrodenou deficienciou liečia ľudským fibrinogénom, najmä vysokou dávkou alebo opakovaným podávaním dávok, existuje riziko trombózy. Pacienti, ktorým sa podáva ľudský fibrinogén sa majú pozorne sledovať pre prejavy alebo príznaky trombózy.
U pacientov s koronárnym srdcovým ochorením alebo infarktom myokardu v anamnéze, u pacientov s ochorením pečene, u pacientov pred operáciou alebo po operácii, u novorodencov alebo u pacientov s rizikom tromboembolických udalostí alebo diseminovanou intravaskulárnou koaguláciou sa má zvážiť možný prínos liečby ľudským plazmatickým fibrinogénom oproti riziku tromboembolických komplikácií. Je potrebné postupovať s opatrnosťou a pacienta starostlivo sledovať.
Alergické reakcie alebo reakcie anafylaktického typuAk sa objavia alergické reakcie alebo reakcie anafylaktického typu, podávanie injekcie/ infúzie sa má okamžite ukončiť. V prípade výskytu anafylaktického šoku sa má použiť štandardná lekárska liečba šoku.
Obsah sodíkaFibryga obsahuje menej ako 132 mg (5,8 mmol) sodíka v jeden fľaštičke. To zodpovedá 9,2 mg (0,4 mmol) sodíka na kg telesnej hmotnosti pacienta, ak sa podáva úvodná dávka 70 mg/kg telesnej hmotnosti. Má sa vziať do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
Ochrana pred vírusmiŠtandardné opatrenia na predchádzanie infekciám vzniknutým pri používaní liekov pripravených z ľudskej krvi alebo plazmy zahŕňajú výber darcov, vyšetrenie špecifických markerov infekcií z jednotlivých odberov a zmiešanej plazmy a zavedenie účinných výrobných krokov na inaktiváciu/odstránenie vírusov. Napriek tomu sa pri podávaní liekov pripravených z ľudskej krvi alebo plazmy nedá úplne vylúčiť možnosť prenosu pôvodcov infekcie. Toto sa tiež vzťahuje na neznáme alebo objavujúce sa vírusy a iné patogény.
Vykonané opatrenia sa považujú za účinné proti opuzdreným vírusom, ako je napr. HIV, HBV a HCV a proti neopuzdrenému vírusu HAV. Vykonané opatrenia môžu mať obmedzenú účinnosť proti neopuzdreným vírusom ako napr. parvovírus B19. Infekcia parvovírusom B19 môže byť závažná u tehotných žien (infekcia nenarodeného dieťaťa) a u jedincov s imunodeficienciou alebo zvýšenou erytropoézou (napr.hemolytická anémia).
U pacientov sa pri pravidelnom/opakovanom podávaní liekov pripravených z ľudskej plazmy sa má zvážiť príslušné očkovanie (proti hepatitíde A a B).
Dôrazne sa odporúča, aby pri každom podávaní Fibrygy pacientovi zaznamenal názov a číslo šarže lieku s cieľom zachovať prepojenie medzi pacientom a číslom šarže lieku.
ImunogenicitaV prípade substitučnej liečby koagulačnými faktormi pri iných vrodených deficienciách sa pozorovali reakcie protilátok, ale pre fibrinogénový koncentrát v súčasnosti neexistujú žiadne údaje.
4.5 Liekové a iné interakcie Nie sú známe žiadne interakcie liekov obsahujúcich ľudský fibrinogén s inými liekmi.
4.6 Fertilita, gravidita a laktáciaGraviditaS Fibrygou sa nevykonali žiadne reprodukčné štúdie na zvieratách (pozri časť 5.3). Keďže je liečivo ľudského pôvodu, katabolizuje sa rovnakým spôsobom ako bielkovina vlastná telu pacienta. Pri týchto fyziologických zložkách ľudskej krvi sa neočakáva, že vyvolajú nežiaduce účinky na reprodukciu alebo na plod.
Bezpečnosť používania Fibrygy počas gravidity u ľudí sa v kontrolovaných klinických skúšaniach nestanovila.
Klinická skúsenosť s liekmi obsahujúcimi fibrinogén pri liečbe pôrodných komplikácií naznačuje, že sa neočakávajú žiadne škodlivé účinky na priebeh gravidity alebo na zdravotný stav plodu alebo novorodenca.
DojčenieNie je známe, či sa Fibryga vylučuje do ľudského mlieka. Používanie Fibrygy u žien počas laktácie sa v klinických skúšaniach neskúmalo.
FertilitaK dispozícii nie sú žiadne údaje týkajúce sa fertility.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje Fibryga nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať stroje.
4.8 Nežiaduce účinky Súhrn profilu bezpečnostiK dispozícii nie sú dostatočné údaje týkajúce sa frekvencie nežiaducich reakcií z klinických skúšaní s týmto liekom.
V klinických štúdiách sa hlásili nasledujúce nežiaduce reakcie: mierna pyrexia, hlásená u jedného pacienta a liekový výsev vo forme mierne kožnej reakcie svrbenia a začervenania po podaní lieku tiež hlásený u jedného pacienta.
Nasledujúce vedľajšie účinky boli hlásené pri Fibryge a iných liekoch obsahujúcich koncentráty fibrinogénu:
Trieda orgánových systémov podľa MedDRA
| Nežiaduce účinky
| Frekvencia
|
Poruchy imunitného systému:
| Alergické reakcie alebo reakcie anafylaktického typu
Kožné reakcie
| Neznáme
|
Poruchy ciev:
| Tromboembolické epizódy (vrátane infarktu myokardu a pľúcnej embólie) (pozri časť 4.4)
Tromboflebitída
| Neznáme
|
Celkové poruchy a reakcie v mieste podania:
| Zvýšenie telesnej teploty (pyrexia)
| Neznáme
|
Informácie týkajúce sa bezpečnosti v súvislosti s prenosnými látkami, pozri v časti 4.4.
Pediatrická populácia8 pacientov zahrnutých do analýzy bezpečnosti pri vrodenej deficiencii fibrinogénu bolo vo veku 12 až 18 rokov.
Profil celkovej bezpečnosti sa medzi dospelými a dospievajúcimi nelíši.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie Aby sa predišlo predávkovaniu, je počas liečby nutné pravidelné sledovanie plazmatickej hladiny fibrinogénu (pozri časť 4.2).
V prípade predávkovania je riziko vzniku tromboembolických komplikácií zvýšené.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antihemoragiká (hemostatiká), ľudský fibrinogén, ATC kód: B02BB01
Ľudský fibrinogén (koagulačný faktor I) sa v prítomnosti trombínu, aktivovaného koagulačného faktora XIII (F XIIIa) a iónov vápnika premieňa na stabilnú a elastickú trojdimenzionálnu fibrínovú hemostatickú zrazeninu.
Podávaním ľudského fibrinogénu dochádza k zvýšeniu plazmatickej hladiny fibrinogénu a môže sa ním dočasne upraviť porucha koagulácie u pacientov s deficienciou fibrinogénu.
Otvorená, prospektívna, randomizovaná, kontrolovaná, prekrížená štúdia fázy II s dvoma skupinami skúmajúca farmakokinetiku jednorazovej dávky u 22 pacientov s vrodenou deficienciou fibrinogénu (afibrinogenémiou) (pozri časť 5.2) tiež vyhodnocovali maximálnu pevnosť zrazeniny (maximum clot firmness, MCF) ako náhradný marker pre hemostatickú účinnosť (FORMA-01). MCF sa stanovovala tromboelastometrickým vyšetrením (ROTEM). U každého pacienta sa MCF stanovila pred podaním (východisková hodnota) a jednu hodinu po podaní jednorazovej dávky Fibrygy. Hodnoty MCF boli významne vyššie po podaní Fibrygy ako východisková hodnota (pozri tabuľku nižšie).
Tabuľka 1: Maximálna pevnosť zrazeniny MCF [mm] (popuĺácia ITT) n = 22
Časový bod
| Priemer ± SD
| Medián [rozmedzie]
|
Pred podaním infúzie
| 0 ± 0
| 0 (0 - 0)
|
1 hodina po podaní infúzie
| 9,7 ± 3,0
| 10,0 (4,0 - 16,0)
|
Priemerná zmena (primárna analýza)*
| 9,7 ± 3,0
| 10,0 (4,0 - 16,0)
|
MCF = maximálna pevnosť zrazeniny; ITT = intention to treat, populácia zo zámerom liečiť.
SD = standard deviation, štandardná odchýlka
*p < 0,0001 (95 % interval spoľahlivosti 8,37; 10,99)
Predbežná analýza prebiehajúcej prospektívnej, otvorenej, nekontrolovanej multicentrickej štúdie fázy III (FORMA-02) sa vykonala u 13 pacientov s vrodenou deficienciou fibrinogénu (afibrinogenémiou a hypofibrinogenémiou) vo veku v rozmedzí od 13 do 53 rokov (2 dospievajúci, 11 dospelých). Táto štúdia zahŕňala liečbu 23 epizód krvácania a 4 chirurgické zákroky. Nedošlo k žiadnej významnej zmene od východiskovej hodnoty MCF na základe merania pomocou ROTEM a v plazmatických hladinách fibrinogénu. Všetky zo skúmaných liečených epizód krvácania a chirurgických zákrokov boli skúšajúcim a nezávislou hodnotiacou komisiou s využitím objektívneho skórovacieho systému vyhodnotené ako úspešné (účinnosť hodnotená ako dobrá alebo výborná).
Pediatrická populáciaFibryga sa podávala v dvoch klinických štúdiách u 8 pacientov vo veku od 12 do 18 rokov. Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s Fibrygou pri liečbe vrodenej deficiencie fibrinogénu u pacientov mladších ako 12 rokov (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti Ľudský fibrinogén je prirodzenou zložkou ľudskej plazmy a účinkuje ako endogénny fibrinogén. Biologický polčas fibrinogénu v plazme je 3 - 4 dni. Fibryga sa podáva intravenózne a je okamžite dostupná v plazmatickej koncentrácii zodpovedajúcej podanej dávke.
Otvorená, prospektívna, randomizovaná, kontrolovaná, prekrížená štúdia fázy II s dvomi skupinami u 22 pacientov s vrodenou deficienciou fibrinogénu (afibrinogenémiou) vo veku v rozmedzí od 12 do 53 rokov (6 dospievajúci, 16 dospelých) porovnávala farmakokinetické vlastnosti jednorazovej dávky Fibrygy s dávkami iných komerčne dostupných fibrinogénových koncentrátov u tých istých pacientov (FORMA-01). Každý pacient dostal jednu intravenóznu dávku 70 mg/kg Fibrygy a porovnávacieho lieku. Na stanovenie aktivity fibrinogénu boli odobraté vzorky krvi na začiatku a až do 14 dní po podaní infúzie. Farmakokinetické parametre Fibrygy v analýze definovanej podľa protokolu (PP – per protocol) (n = 21) sú zhrnuté v tabuľke nižšie.
Tabuľka 2: Farmakokinetické parametre (n = 21) pre aktivitu fibrinogénu (populácia PP*)
Parameter
| Priemer ± SD
| Rozmedzie
|
Polčas [h]
| 75,9 ± 23,8
| 40,0 – 157,0
|
Cmax [mg/dl]
| 139,0 ± 36,9
| 83,0 – 216,0
|
AUCnorm pre dávku 70 mg/kg [mg*h/ml]
| 113,7 ± 31,5
| 59,7 – 175,5
|
Klírens [ml/h/kg]
| 0,67 ± 0,2
| 0,4 – 1,2
|
Priemerný čas zotrvania [h]
| 106,3 ± 30,9
| 58,7 – 205,5
|
Distribučný objem v ústálenom stave [ml/kg]
| 70,2 ± 29,9
| 36,9 – 149,1
|
*Jeden pacient bol vylúčený z populácie PP pretože dostal < 90 % plánovanej dávky Fibrygy a porovnávacieho lieku
C
max = maximálna plazmatická koncentrácia; AUC
norm = plocha pod krivkou normalizovaná na podanú dávku; SD = štandardná odchýlka
Prírastok „recovery
in vivo“ (IVR) bol stanovený z hladín získaných až do 4 hodín po podaní infúzie. Mediánom prírastku IVR bolo zvýšenie o 1,8 mg/dl (rozmedzie, 1,08– 2,62 mg/dl) na mg/kg. Medián IVR naznačuje, že dávka 70 mg/kg bude zvyšovať plazmatickú koncentráciu fibrinogénu u pacienta o približne 125 mg/dl.
Farmakokinetika u osobitných skupín pacientov
Medzi účastníkmi štúdie mužského a ženského pohlavia sa nepozoroval žiadny štatisticky významný rozdiel v aktivite fibrinogénu. V analýze PP sa pozoroval malý rozdiel v polčase u pacientov mladších ako 18 rokov (n = 5) s hodnotou 72,8 ± 16,5 hodín v porovnaní s 76,9 ± 26,1 hodinami v skupine s dospelými (n = 16). Klírens bol takmer identický v obidvoch vekových skupinách t. j. 0,68 ± 0,18 ml/h/kg u pacientov mladších ako 18 rokov a 0,66 ± 0,21 ml/h/kg u dospelých.
Pediatrická populáciaU pediatrických pacientov vo veku < 12 rokov nie sú k dispozícii žiadne farmakokinetické údaje.
5.3 Predklinické údaje o bezpečnostiBezpečnosť Fibrygy bola preukázaná v niekoľkých predklinických štúdiách farmakologickej bezpečnosti (kardiovaskulárne účinky, trombogénny potenciál) a toxikológie (akútna toxicita, miestna znášanlivosť). Na základe týchto štúdií predklinické údaje neodhalili žiadne osobitné riziko pre ľudí. V teste venóznej stázy (Wesslerov text) sa preukázalo, že Fibryga nespôsobuje vznik trombov pri dávkach až do 400 mg/kg telesnej hmotnosti.
6. FARMACEUTICKÉ INFORMÁCIE 6.1 Zoznam pomocných látokL-argininíumchlorid
Glycín
Chlorid sodný
Citronan sodný, dihydrát
6.2 InkompatibilityTento liek sa nesmie miešať s inými liekmi.
6.3 Čas použiteľnosti 2 roky
Chemická a fyzikálna stabilita počas používania rekonštituovaného roztoku sa preukázala počas 24 hodín pri izbovej teplote (maximálne 25 °C). Z mikrobiologického hľadiska sa má liek použiť okamžite po rekonštitúcii. Ak sa nepoužije okamžite, za čas uchovávania a podmienky počas používania zodpovedá používateľ. Rekonštituovaný roztok sa nesmie zamraziť alebo uchovávať v chladničke. Čiastočne použité fľaštičky sa majú zlikvidovať.'
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote neprevyšujúcej 25 °C. Neuchovávajte v mrazničke. Fľaštičku uchovávajte vo vonkajšom obale na ochranu pred svetlom.
Podmienky na uchovávanie po rekonštitúcii lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia Bezfarebné fľaštičky zo skla typu II, podľa Ph. Eur., uzatvorené infúznou zátkou (brómbutylová guma) a hliníkovým vyklápacím viečkom.
Balenie s 1 g:1 g ľudského fibrinogénu v 100 ml fľaštičke
Pomôcka na prenášanie Octajet
Časticový filter
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomVšeobecné pokyny· Rekonštituovaný roztok je takmer bezfarebný a mierne opaleskujúci. Roztoky, ktoré sú zakalené alebo obsahujú častice, sa nemajú používať.
Rekonštitúcia 1. Prášok aj injekčnú liekovku s 50 ml vody na injekcie (voda na injekcie sa nedodáva) v zatvorených fľaštičkách zohrejte na izbovú teplotu. Táto teplota sa má počas rekonštitúcie udržiavať. Ak sa na zohrievanie použije vodný kúpeľ, je potrebné dbať na to, aby sa voda nedostala do kontaktu s gumenými zátkami alebo uzávermi fľaštičiek. Teplota vodného kúpeľa nesmie presiahnuť +37 °C (98 °F).
|
2. Odstráňte uzáver z fľaštičky s koncentrátom (Fibryga) a s vodou na injekcie, aby ste odhalili centrálnu časť infúznej zátky. Gumenú zátku očistite tampónom navlhčeným alkoholom a nechajte ju vysušiť.
|
3. Odlepte viečko vonkajšieho obalu pomôcky na prenášanie Octajet. Na zachovanie sterility nechajte pomôcku Octajet v priesvitnom vonkajšom obale.
|
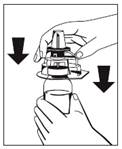
4. Vezmite Octajet v jeho vonkajšom obale a otočte ho nad fľaštičku s koncentrátom (Fibryga). Pomôcku nachádzajúcu sa v jej vonkajšom obale umiestnite do stredu fľaštičky Fibryga kým sa svorky špičky lieku (bezfarebné) neuzamknú. Držiac pomôcku na fľaštičke koncentrátu opatrne odstráňte vonkajší obal z pomôcky Octajet, pričom buďte opatrní, aby ste sa nedotkli špičky pre vodu (modrá) a nechajte pomôcku Octajet pevne nasadenú na fľaštičke s koncentrátom. (Obr. 1)
| 
|
5. Na fľaštičku s koncentrátom (Fibryga) pevne umiestnenú na rovnom povrchu obráťte fľaštičku s vodou na injekcie a umiestnite ju na stred špičky pre vodu. Plastovú kanylu pomôcky Octajet pevne zatlačte cez gumenú zátku fľaštičky s vodou na injekcie. (Obr. 2)
| 
|
6. Odstráňte rozperný krúžok (Obr. 3) a zatlačte fľaštičku s vodou na injekcie smerom nadol (Obr. 4). Voda na injekcie pretečie do fľaštičky s koncentrátom (Fibryga).
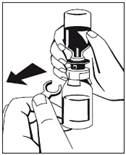 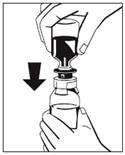
|
7. Po dokončení prenosu vody na injekcie, opatrne zakrúžte s fľaštičkou lieku kým sa prášok úplne nerozpustí. Fľaštičkou netraste, aby ste predišli tvorbe peny. Prášok sa má úplne rozpustiť počas približne 5 minút. Rozpúšťanie prášku nemá trvať dlhšie ako 30 minút. Ak sa prášok do 30 minút nerozpustí, liek sa má zlikvidovať.
|
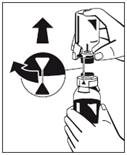
8. Modrý konektor fľaštičky s vodou na injekcie otočte (je to možné do oboch strán), aby ste polohové značky zarovnali a odstráňte fľaštičku na vodu na injekcie spolu so špičkou pre vodu. (Obr. 5)
| 
|
9. Na pribalený filter nasaďte injekčnú striekačku (Obr. 6) a napojte filter na konektor typu Luer Lock pomôcky Octajet na fľaštičku s koncentrátom (Obr. 7). Natiahnite roztok do injekčnej striekačky cez filter. (Obr. 8)
|
10. Naplnenú injekčnú striekačku odpojte od filtra a prázdnu fľaštičku zlikvidujte.
|
| | |
Na intravenózne podávanie rekonštituovaného roztoku pri izbovej teplote sa odporúča štandardná infúzna súprava.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII Octapharma (IP) Limited
The Zenith Building
26 Spring Gardens
Manchester M2 1AB
Spojené kráľovstvo
8. REGISTRAČNÉ ČÍSLO75/0260/17-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie:
10. DÁTUM REVÍZIE TEXTU 09/2017