
valign="top">
|
|
| Prestávka
| Dexametazón
| 1
| 2
|
|
|
|
|
| 8
| 9
|
|
|
|
|
| Prestávka
|
Odporúč ani a pre monitorovanie
Krvný obraz
Pred začiatkom liečby panobinostatom sa musí vyšetriť kompletný krvný obraz. Vstupná hodnota
počtu krvných doštičiek má byť ≥ 100 x 109/l a vstupná hodnota absolútneho počtu neutrofilov (ANC)
≥ 1,0 x 109/l. V priebehu liečby sa má kompletný krvný obraz často kontrolovať (obzvlášť pred
každou injekciou bortezomibu, t.j. v 1., 4., 8. a 11. deň 1. až 8. cyklu a v 1. a 8. deň 9. až 16. cyklu), hlavne kvôli trombocytopénii (pozri časť 4.4). Pred začiatkom každého cyklu liečby panobinostatom v kombinácii s bortezomibom a dexametazónom má byť počet krvných doštičiek najmenej ≥ 100 x 109/l (pozri časť 4.4). Ďalšie vyšetrenie krvného obrazu sa má zvážiť v priebehu „oddychovej fázy“ – napr.
v 15. a/alebo 18. deň, hlavne u pacientov ≥65 rokov a pacientov s počtom krvných doštičiek pri
vstupnom vyšetrení nižším ako 150 x 109/l.
EKG
Panobinostat môže predlžovať QTc interval (pozri časť 4.4). Preto sa má pred začiatkom liečby skontrolovať EKG a vyšetrenie pravidelne opakovať pred každým cyklom liečby. Hodnota QTcF má
byť pred začiatkom liečby panobinostatom < 480 msek (pozri nižšie časť o úprave dávok a časť 4.4).
Krvné elektrolyty
Krvné elektrolyty, hlavne draslík, horčík a fosfor, sa majú vyšetriť pri vstupnom vyšetrení a pravidelne
monitorovať podľa klinickej potreby, hlavne u pacientov s hnačkou. Abnormálne hodnoty sa majú
korigovať podľa klinickej potreby (pozri časť 4.4).
Vyšetrenia funkcie pečene
Funkcia pečene sa má monitorovať pred liečbou a pravidelne počas liečby podľa klinickej potreby, hlavne u pacientov s poškodením funkcie pečene (pozri časť 4.4).
Vyšetrenia funkcie štítnej žľazyMierna hypotyreóza bola hlásená u pacientov liečených panobinostatom + bortezomibom + dexametazónom v štúdii D2308, niektorí pacienti potrebovali liečbu (pozri časť 4.4). Funkcia štítnej žľazy a hypofýzy sa má sledovať meraním hladiny hormónov (napr. voľného T4 a TSH) ako je klinicky indikované.
Úprava dávokNa základe individuálnej znášanlivosti môže byť potrebná úprava liečebnej dávky a/alebo režimu. Ak sa u pacienta objaví nežiaduca reakcia na liek, pri rozhodovaní o pokračovaní v liečbe je potrebné
postupovať podľa klinického úsudku.
Ak je potrebná úprava dávky, dávka panobinostatu sa má znižovať postupne po 5 mg (t.j. z 20 mg na
15 mg alebo z 15 mg na 10 mg). Dávka sa nemá znížiť pod 10 mg a má sa dodržiavať rovnaký režim liečby (3-týždňový cyklus liečby).
TrombocytopéniaPočet krvných doštičiek sa má kontrolovať pred každou dávkou bortezomibu (t.j. v 1., 4., 8. a 11. deň
1.-8. cyklu, pozri tabuľku 1 a v 1. a 8. deň 9.-16. cyklu, pozri tabuľku 2). Ak sa u pacientov vyskytne trombocytopénia, liečbu panobinostatom bude možno potrebné dočasne pozastaviť a nasledujúcu
dávku bude možno potrebné znížiť (pozri tabuľku 3). U pacientov s počtom krvných doštičiek
< 50 x 109/l (komplikované krvácaním) alebo < 25 x 109/l sa má liečba Farydakom prerušiť a má sa obnoviť so zníženou dávkou po zlepšení na počet krvných doštičiek ≥50 x 109/l. Počet krvných
doštičiek sa má sledovať najmenej dvakrát týždenne dovtedy, kým ≥50 x 109/l. Ak je to klinicky
indikované, môžu byť potrebné transfúzie krvných doštičiek (pozri časť 4.4). Ukončenie liečby je potrebné zvážiť v prípade, ak sa trombocytopénia nezlepší napriek úpravám liečby uvedeným nižšie a/alebo ak pacient potrebuje opakované transfúzie krvných doštičiek. Okrem toho sa môže zvážiť aj úprava dávky bortezomibu (pozri SmPC bortezomibu a tabuľku 3).
Tabuľka 3 Odporúčané úpravy dávky pri trombocytopéniiStupeň trombocytopénie v deň liečby
| Úprava počiatočnej dávky panobinostatu
| Dávka panobinostatu pri zlepšení na 2. stupeň trombocytopénie (≥50 x 109/l)
| Úprava počiatočnej dávky bortezomibu
| Dávka bortezomibu pri zlepšení na 2. stupeň trombocytopénie
(≥50 x 109/l)
|
1
vynecha- ná dávka
| Viac ako 1
vynechaná dávka
|
3. stupeň
Krvné doštičky
<50 x 109/l s krvácaním
| Vynechajte
dávku
| Obnovte liečbu so
zníženou dávkou
| Vynechajte
dávku
| Obnovte
liečbu s
rovnakou dávkou
| Obnovte
liečbu so zníženou
dávkou
|
4. stupeň
Krvné doštičky
<25 x 109/l
| Vynechajte
dávku
| Obnovte liečbu so
zníženou dávkou
| Vynechajte
dávku
| Obnovte
liečbu s
rovnakou dávkou
| Obnovte
liečbu so zníženou
dávkou
|
G
astrointestinálna toxicita
Gastrointestinálna toxicita je u pacientov liečených panobinostatom veľmi častá. U pacientov, u ktorých sa vyskytne hnačka a nevoľnosť alebo vracanie, môže byť potrebné dočasné prerušenie dávkovania lieku alebo zníženie dávky ako je to uvedené v tabuľke 4.
Tabuľka 4 Odporúčaná úprava dávky pri gastrointestinálnej toxiciteNežiaduca
reakcia na liek
| Stupeň v deň liečby
| Úprava počiatočnej dávky panobinostatu
| Dávka panobinostatu pri zlepšení
na ≤ 1. stupeň
| Úprava počiatočnej dávky bortezomibu
| Dávka bortezomibu pri zlepšení na
≤ 1. stupeň
|
Hnačka
| 2. stupeň napriek
lieku proti
hnačke
| Vynechajte dávku
| Obnovte
liečbu s
rovnakou dávkou
| Vynechajte
dávku
| Obnovte
liečbu so zníženou
dávkou alebo
zmeňte
dávkovanie na 1x týždenne
|
| 3. stupeň napriek
lieku proti
hnačke
| Vynechajte dávku
| Obnovte
liečbu so zníženou dávkou
| Vynechajte
dávku
| Obnovte
liečbu so zníženou dávkou alebo s rovnakou dávkou, ale s režimom 1x týždenne
|
| 4.stupeň napriek
lieku proti
hnačke
| Natrvalo ukončite
liečbu
|
| Natrvalo
ukončite liečbu
|
|
Pri prvých prejavoch kŕčov v bruchu, riedkej stolice alebo pri nástupe hnačky sa odporúča, aby sa
pacient liečil liekom proti hnačke (napr. loperamid).
V prípade nauzey 3. stupňa alebo vracania 3. či 4. stupňa napriek podávaniu antiemetika sa má podávanie panobinostatu dočasne prerušiť a liečba sa má obnoviť so zníženou dávkou pri zlepšení na
1. stupeň.
Profylaxia antiemetikami sa má podávať na základe rozhodnutia lekára a v súlade s miestnou klinickou praxou (pozrie časť 4.4).
N
eutropénia
Neutropénia môže vyžadovať dočasnú alebo trvalú úpravu dávky. Pokyny na prerušenie dávkovania
a zníženie dávky panobinostatu sú popísané v tabuľke 5.
Tabuľka 5 Odporúčaná úprava dávky pri neutropéniiStupeň neutropénie
v deň liečby
| Úprava
počiatočnej dávky panobinostatu
| Dávka
panobinostatu po zlepšení neutropénie
na 2. stupeň
(< 1,5-1,0 x 109/l)
| Úprava
počiatočnej dávky bortezomibu
| Dávka
bortezomibu pri zlepšení na neutropéniu 2. stupňa
(< 1,5-1,0 x 109/l)
|
Neutropénia 3. stupňa
(< 1,0-0,5 x 109/l)
| Vynechajte
dávku
| Obnovte liečbu s
rovnakou dávkou
| Vynechajte
dávku
| Obnovte liečbu s
rovnakou dávkou
|
Neutropénia 4. stupňa (< 0,5 x 109/l) alebo febrilná neutropénia
(< 1,0 x 109/l a
horúčka ≥ 38,5°C)
| Vynechajte
dávku
| Obnovte liečbu so
zníženou dávkou
| Vynechajte
dávku
| Obnovte liečbu s
rovnakou dávkou
|
V prípade neutropénie 3. alebo 4. stupňa majú lekári v súlade s miestnymi postupmi zvážiť použitie
rastového faktora (napr. G-CSF). Ukončenie liečby sa môže zvážiť v prípade, ak sa neutropénia nezlepší napriek úprave dávky a/alebo napriek pridaniu liečby faktorom stimulujúcim granulocytové kolónie v súlade s miestnou klinickou praxou a liečebnými postupmi a/alebo v prípade závažnej sekundárnej infekcie.
Predĺženie QTc intervaluV prípade dlhého QT intervalu pred začiatkom liečby panobinostatom (QTcF ≥ 480 msek pri
vstupnom vyšetrení) sa má začiatok liečby odložiť dovtedy, kým sa priemerné QTcF pred podaním dávky vráti na hodnotu < 480 msek. Okrem toho sa pred začiatkom liečby Farydakom majú korigovať abnormálne hodnoty sérového draslíka, horčíka alebo fosforu (pozri časť 4.4). V prípade predĺženia QT intervalu počas liečby:
· Dávka sa má vynechať v prípade, ak je QTcF ≥ 480 msek alebo o 60 msek vyšší ako vstupné hodnoty.
· Ak predĺženie QT intervalu ustúpi do 7 dní, obnovte liečbu s predchádzajúcou dávkou pri prvom výskyte alebo so zníženou dávkou, ak je predĺženie QT intervalu opakované.
· Ak predĺženie QT intervalu neustúpi do 7 dní, liečba sa má ukončiť.
· Ak je ktorákoľvek hodnota QTcF vyššia ako 500 msek, liečba Farydakom sa má natrvalo
ukončiť.
Iné nežiaduce účinky liekuOdporúčanie pre pacientov, u ktorých sa vyskytujú závažné nežiaduce reakcie na liek, iné ako trombocytopénia, gastrointestinálna toxicita, neutropénia alebo predĺženie QTc intervalu, je
nasledovné:
· pri opakovanom výskyte toxicity 2. stupňa CTC alebo pri prvom výskyte 3. a 4. stupňa
CTC - vynechajte podávanie dávky lieku až do zlepšenia na CTC stupeň ≤ 1 a obnovte liečbu so
zníženou dávkou.
· pri opakovanom výskyte toxicity 3. alebo 4. stupňa CTC – po zlepšení nežiaduceho účinku na
CTC stupeň
< sa môže zvážiť ďalšie zníženie dávky.
Osobitné populáciePacienti s poškodením funkcie obličiekPlazmatická expozícia panobinostatu sa u onkologických pacientov s miernym až ťažkým poškodením funkcie obličiek nemení. Preto úprava počiatočnej dávky nie je potrebná. Panobinostat sa neskúmal u pacientov s konečným štádiom ochorenia obličiek (ESRD), ani u pacientov, ktorí sú na dialýze (pozri časť 5.2).
P
acienti s poškodením funkcie pečene
Klinické skúšanie u onkologických pacientov s poškodením funkcie pečene ukázalo, že plazmatická expozícia panobinostatu sa zvýšila o 43% (1,4-násobne) u pacientov s miernym poškodením funkcie pečene a o 105% (2-násobne) u pacientov so stredne ťažkým poškodením funkcie pečene. Pacienti
s miernym poškodením funkcie pečene majú počas prvého cyklu liečby začať so zníženou dávkou
panobinostatu 15 mg. Podľa pacientovej znášanlivosti sa môže zvážiť zvýšenie dávky z 15 mg na
20 mg. Pacienti so stredne ťažkým poškodením funkcie pečene majú začať liečbu panobinostatom so
zníženou dávkou 10 mg v priebehu prvého cyklu liečby. Podľa znášanlivosti sa u pacienta môže zvážiť zvýšenie dávky z 10 mg na 15 mg. Frekvencia sledovania týchto pacientov počas liečby
panobinostatom sa má zvýšiť, hlavne vo fáze zvyšovania dávky. Vzhľadom k nedostatku skúseností
a údajov o bezpečnosti z populácie pacientov s ťažkým poškodením funkcie pečene sa panobinostat týmto pacientom nemá podávať. Má sa tiež zvážiť úprava dávky bortezomibu (pozri SmPC bortezomibu a tabuľku 6).
Tabuľka 6 Odporúčaná úprava počiatočnej dávky u pacientov s poruchou funkcie pečeneStupeň poškodenia
funkcie
pečene*
| Hladina bilirubínu
| Hladiny
SGOT (AST)
| Úprava počiatočnej
dávky panobinostatu
| Úprava počiatočnej
dávky bortezomibu
|
Mierne
| ≤ 1,0 x ULN
| >ULN
| V prvom cykle liečby
znížte dávku
panobinostatu na 15 mg. V nasledujúcich cykloch zvážte zvýšenie dávky až na 20 mg podľa znášanlivosti pacienta.
| Žiadna
|
> 1,0 x ULN a
≤ 1,5 x ULN
| všetky
|
Stredne
ťažké
| > 1,5 x ULN a
≤ 3,0 x ULN
| všetky
| V prvom cykle liečby
znížte dávku
panobinostatu na 10 mg. V nasledujúcich cykloch zvážte zvýšenie dávky až na 15 mg podľa znášanlivosti pacienta.
| V prvom cykle liečby
znížte dávku bortezomibu na 0,7 mg/m2.
V nasledujúcich cykloch
zvážte zvýšenie dávky na
1,0 mg/m2 alebo ďalšie zníženie dávky na
0,5 mg/m2 podľa
znášanlivosti pacienta.
|
SGOT = sérum-glutamát-oxalacetát-transamináza;
AST = aspartát transamináza
ULN = horná hranica normálu
*Podľa klasifikácie NCI-CTEP
|
Starší pacientiU pacientov starších ako 65 rokov sa vyskytla vyššia frekvencia vybraných nežiaducich účinkov a
ukončenia liečby kvôli nežiaducim účinkom. Odporúča sa častejšie sledovať pacientov starších ako
65 rokov, hlavne na trombocytopéniu a gastrointestinálnu toxicitu (pozri časti 4.4 a 4.8).
U pacientov > 75 rokov sa môže v závislosti od celkového zdravotného stavu pacienta a jeho komorbidít zvážiť úprava počiatočnej dávky alebo režimu zložiek kombinovanej liečby. Panobinostat sa môže začať podávať v dávke 15 mg a ak bude v prvom cykle dobre znášaný, môže sa jeho dávka v druhom cykle zvýšiť na 20 mg. Bortezomib sa môže začať podávať v dávke 1,3 mg/m2 jedenkrát týždenne v 1. a 8. deň a dexametazón v dávke 20 mg v 1. a 8. deň.
Pediatrická populáciaPoužite panobinostatu sa netýka pediatrických pacientov mladších ako 18 rokov s indikáciou mnohopočetného myelómu (pozri časť 5.2).
Silné inhibítory CYP3A4
U pacientov súbežne užívajúcich lieky, ktoré sú silnými inhibítormi CYP3A a/alebo Pgp vrátane, ale nie výlučne ketokonazol, itrakonazol, vorikonazol, ritonavír, sakvinavír, telitromycín, pozakonazol a nefazodon, sa má dávka panobinostatu znížiť na 10 mg (pozri časť 4.5). Ak je potrebná nepretržitá liečba silným inhibítorom CYP3A4, podľa znášanlivosti pacienta sa môže zvážiť zvýšenie dávky panobinostatu z 10 mg na 15 mg.
U pacientov s poruchou funkcie pečene súbežne užívajúcich lieky, ktoré sú silnými inhibítormi CYP3A4, je potrebné sa vyhnúť liečbe panobinostatom z dôvodu nedostatku skúseností a údajov o bezpečnosti v tejto populácii pacientov.
S liečbou silnými inhibítormi CYP3A sa nesmie začínať u pacientov, ktorí už užívali znížené dávky panobinostatu kvôli nežiaducim účinkom. Ak sa tomu nedá vyhnúť, pacienti majú byť starostlivo sledovaní a podľa klinickej potreby sa môže zvážiť ďalšie zníženie dávky alebo ukončenie liečby (pozri časť 4.5).
Spôsob podávania
Farydak sa má podávať perorálne jedenkrát denne iba v naplánovaných dňoch, každý deň v rovnakom
čase. Kapsuly sa majú prehltnúť celé a zapiť vodou s jedlom alebo bez jedla (pozri časť 5.2) a nesmú
sa otvárať, drviť ani žuvať. Pokiaľ dôjde k vynechaniu dávky, môže sa užiť až do 12 hodín po stanovenom čase na podanie dávky. Ak dôjde k vracaniu, pacient nemá užiť dodatočnú dávku, ale má užiť nasledujúcu obvyklú predpísanú dávku.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Dojčenie (pozri časť 4.6).
4.4 Osobitné upozornenia a opatrenia pri používaní
Panobinostat sa používa v kombinovanej liečbe a preto sa pred začiatkom liečby panobinostatom majú
preveriť preskripčné informácie bortezomibu a dexametazónu.
Zníženie počtukrviniek
U pacientov liečených panobinostatom boli hlásené hematologické nežiaduce reakcie na liek, vrátane
ťažkej trombocytopénie, neutropénie a anémie (3. až 4. stupňa CTC). Preto sa pred začiatkom liečby panobinostatom musí vyšetriť kompletný krvný obraz a v priebehu liečby sa má často kontrolovať (hlavne pred každou injekciou bortezomibu podľa SmPC bortezomibu).
Počet krvných doštičiek pred začiatkom liečby má byť ≥ 100 x 109/l a absolútny počet neutrofilov
≥ 1,0 x 109/l. Počet krvných doštičiek pred začiatkom každého cyklu liečby má byť ≥ 100 x 109/l
(pozri časť 4.2).
V štúdii fázy III sa obvykle do začiatku nasledujúceho 21-dňového cyklu trombocytopénia zlepšila na stav pri vstupnom vyšetrení (pozri obrázok 1). Medián času nástupu nežiaduceho účinku 3. a 4. stupňa trombocytopénie bol jeden mesiac a medián času do ustúpenia bol 12 dní.
O
brázok 1 Medián počtu krvných doštičiek v priebehu času (štúdia D2308, bezpečnostný súbor,
1.-8. cyklus)
500
400
300
200
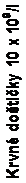
100
0
(BL) 1:4 1:8 1:11 2:1 2:4 2:8 2:11 3:1 3:4 3:8 3:11 4:1 4:4 4:8 4:11 5:1 5:4 5:8 5:11 6:1 6:4 6:8 6:11 7:1 7:4 7:8 7:11 8:1 8:4 8:8 8:11
PAN+BTZ+Dex PBO+BTZ+Dex
Cyklus:Deň
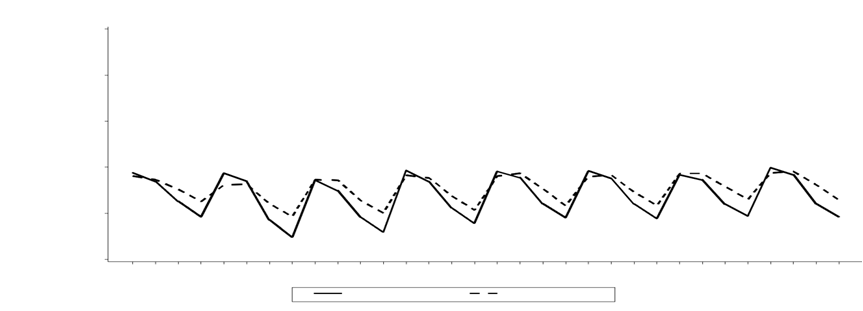
PAN+BTZ+Dex n= 381 370 367 363 351 342 335 320 323 310 298 283 285 265 268 250 253 232 238 225 230 206 206 199 205 183 188 175 185 159 170 155
PBO+BTZ+Dex n= 377 364 368 365 357 349 340 339 335 325 313 302 308 292 292 279 275 255 259 241 251 234 242 203 233 209 217 204 211 192 194 188
PAN=panobinostat
BTZ= bortezomib
Dex = dexametazón
U pacientov s 3. stupňom trombocytopénie podľa CTC (počet krvných doštičiek < 50 x 109/l s krvácaním) môže byť potrebné užívanie panobinostatu dočasne prerušiť a/alebo znížiť jeho nasledujúcu dávku. Podľa klinickej potreby môžu byť potrebné aj transfúzie krvných doštičiek (pozri časti 4.2 a 4.8).
KrvácaniePočas liečby panobinostatom bolo u pacientov hlásené krvácanie. U 4,2% pacientov bolo hlásené
krvácanie 3. alebo 4. stupňa CTC, vrátane prípadov gastrointestinálneho a pľúcneho krvácania
končiaceho smrťou. Preto si lekári a pacienti musia byť vedomí zvýšeného rizika trombocytopénie a možnosti krvácania, hlavne u pacientov s poruchami zrážanlivosti alebo u tých, ktorí užívajú dlhodobú antikoagulačnú liečbu.
InfekciaU pacientov užívajúcich panobinostat boli hlásené lokalizované a systémové infekcie vrátane zápalu
pľúc, iné bakteriálne infekcie, invazívne plesňové infekcie ako napríklad aspergilóza alebo kandidóza a vírusové infekcie vrátane vírusu hepatitídy B a herpes simplex. Niektoré z týchto infekcií (napr. zápal pľúc) boli závažné (napr. infekcie spôsobujúce sepsu, respiračné alebo multiorgánové zlyhanie) a končili smrťou (pozri časť 4.8). Dôležité je, že kým neutropénia 3. stupňa bola pozorovaná u 28% pacientov a neutropénia 4. stupňa u 7% pacientov, febrilná neutropénia bola pozorovaná u 1% pacientov (pozri časť 4.8). Lekári a pacienti by si mali uvedomovať zvýšené riziko infekcie pri liečbe panobinostatom.
S liečbou Farydakom sa nemá začínať u pacientov s aktívnou infekciou. Existujúce infekcie sa majú liečiť pred začiatkom liečby. Počas liečby panobinostatom je potrebné pacientov sledovať na prejavy a príznaky infekcií; ak je stanovená diagnóza infekcie, ihneď sa má začať s vhodnou protiinfekčnou liečbou a má sa zvážiť prerušenie alebo ukončenie užívania Farydaku.
Ak je stanovená diagnóza invazívnej systémovej plesňovej infekcie, liečba panobinostatom sa má
ukončiť a má sa začať s vhodnou antimykotickou liečbou.
Poruchy gastrointestinálneho traktu
U pacientov liečených Farydakom bola hlásená silná nevoľnosť, hnačka, zápcha a vracanie, niekedy
vyžadujúce užívanie liekov proti vracaniu a hnačke (pozri časť 4.8). Počas liečby sa má pravidelne sledovať hladina tekutín a elektrolytov v krvi, hlavne draslíka, horčíka a fosfátu a má sa upravovať podľa klinického stavu, aby sa zabránilo možnej dehydratácii a poruche elektrolytov (pozri časť 4.2).
Podľa rozhodnutia lekára a v súlade s miestnou klinickou praxou sa môže zvážiť preventívne podanie antiemetík (napr. prochlorperezínu). Antiemetické lieky so známym rizikom predĺženia QT intervalu ako napr. dolasetrón, granisetrón, ondansetrón a tropisetrón sa majú používať opatrne (pozri časť 4.5).
Pri prvých známkach žalúdočných kŕčov, riedkej stolice alebo začínajúcej hnačky sa odporúča, aby bol pacient liečený liekmi proti hnačke (napr. loperamidom) alebo akoukoľvek inou liečbou v súlade s miestnymi liečebnými postupmi. V prípade potreby sa má použiť intravenózna náhrada tekutín a elektrolytov. Lieky s laxatívnymi vlastnosťami sa majú užívať opatrne, pretože môžu zhoršovať hnačku. Pacientom sa má odporučiť, aby kontaktovali svojho lekára a prediskutovali s ním užívanie akéhokoľvek laxatívneho lieku.
Elektrokardiografické zmeny
Panobinostat môže predĺžiť repolarizáciu srdcových komôr (QT interval) (pozri časť 5.3).
V klinickom skúšaní fázy III, pri podávaní 20 mg Farydaku v kombinácii s bortezomibom
a dexametazónom, neboli hlásené žiadne prípady predĺženého QTcF >500 msek. Združené klinické údaje od viac ako 500 pacientov liečených panobinostatom samotným vo viacerých indikáciách a
s rôznymi hladinami dávok ukázali, že výskyt 3. stupňa predĺženia QTc (QTcF >500 msek) podľa
CTC bol celkovo približne 1% a pri dávke 60 mg alebo vyššej 5% alebo viac. Neboli pozorované
žiadne prípady torsades de pointes.
Ďalšia analýza naznačuje, že riziko predĺženia QTc intervalu sa časom nezvyšuje (pozri časť 4.2). Hodnota QTcF pred začiatkom liečby Farydakom má byť < 480 msek.
Vhodné monitorovanie elektrolytov (napr. draslíka, horčíka a fosforu) a EKG sa má robiť pri vstupnom vyšetrení a potom opakovane v priebehu liečby, obzvlášť u pacientov so závažnou gastrointestinálnou nežiaducou reakciou na liek (pozri časť 4.2).
Farydak sa má používať opatrne u pacientov, u ktorých sa už vyskytlo alebo vyskytuje významné riziko vzniku predĺženia QTc intervalu. Patria sem pacienti:
· so syndrómom dlhého QT.
· s nekontrolovaným alebo závažným ochorením srdca, vrátane nedávneho infarktu myokardu, kongestívneho zlyhania srdca, nestabilnej anginy pectoris alebo klinicky významnou bradykardiou.
Pri súčasnom podávaní liekov, o ktorých je známe, že spôsobujú predĺženie QTc intervalu, sa má postupovať opatrne (pozri časť 4.5).
V prípade súbežného užívania liekov, ktoré môžu zvyšovať plazmatické koncentrácie panobinostatu, akými sú silné inhibítory CYP3A4, je potrebná úprava dávky (pozri časti 4.5 a 4.2).
Hepatotoxicita
Počas liečby panobinostatom bola u pacientov hlásená hepatálna dysfunkcia, hlavne mierne prechodné
zvýšenie hladín transamináz a celkového bilirubínu.
Funkcia pečene sa má sledovať pred liečbou a pravidelne aj v priebehu liečby. Ak výsledky testov funkcie pečene vykazujú abnormality podľa klasifikácie NCI-CTEP, odporúča sa u pacientov s miernym a stredne ťažkým poškodením funkcie pečene úprava dávky a pacient má byť sledovaný dovtedy, kým sa hodnoty nevrátia do normálu alebo na úroveň pred liečbou. Panobinostat sa nemá podávať pacientom s ťažkým poškodením funkcie pečene pre nedostatok skúseností a údajov
o bezpečnosti v tejto populácii. Má sa tiež zvážiť úprava dávky bortezomibu (pozri SmPC
bortezomibu a tabuľku 6).
Starší pacienti
Odporúča sa častejšie sledovať pacientov starších ako 65 rokov, hlavne na trombocytopéniu
a gastrointestinálnu toxicitu (pozri časť 4.8 a časť 4.2).
U pacientov >75 rokov v závislosti od ich celkového zdravotného stavu a ich komorbidít sa môže zvážiť úprava počiatočnej dávky alebo režimu zložiek kombinovanej liečby (pozri časť 4.2).
Silné induktory CYP3A4
Silné induktory môžu znižovať účinnosť panobinostatu, preto je potrebné vyhýbať sa súbežnému
užívaniu so silnými induktormi CYP3A4 vrátane, ale nie výlučne s karbamazepínom, fenobarbitalom, fenytoínom, rifabutínom, rifampicínom a ľubovníkom bodkovaným (Hypericum perforatum), (pozri časť 4.5).
Ženy vo fertilnom veku
Ženy vo fertilnom veku užívajúce panobinostat v kombinácii s bortezomibom a dexametazónom
musia používať vysoko účinnú antikoncepciu tri mesiace od ukončenia liečby (pozri časti 4.5 a 4.6
a SmPC bortezomibu a dexametazónu). Ženy používajúce hormonálnu antikoncepciu musia navyše používať bariérovú metódu antikoncepcie.
Hypotyreóza
Prípady hypotyreózy boli zaznamenané u 8 zo 381 pacientov liečených kombináciou panobinostat +
bortezomib + dexametazón v štúdii D2308, z toho 2 potrebovali liečbu. Funkcia štítnej žľazy a hypofýzy sa musí monitorovať meraním hladiny hormónov (napr. voľný T4 a TSH) podľa klinickej potreby (pozri časť 4.2).
4.5 Liekové a iné interakcie
Metabolizmus Farydaku prebieha cez non-CYP aj CYP dráhy. Približne 40% panobinostatu sa metabolizuje prostredníctvom CYP3A4. Metabolizmus cez CYP2D6 a 2C19 bol menej významný. Preto môžu lieky, ktoré ovplyvňujú enzymatickú aktivitu CYP3A4, meniť farmakokinetiku panobinostatu. Panobinostat je P-gp substrát.
Lieky, ktoré môžuzvyšovaťkoncentrácie panobinostatu v plazme
Súčasné podávanie jednej 20 mg dávky panobinostatu s ketokonazolom, silným inhibítorom CYP3A,
zvýšilo Cmax panobinostatu 1,6-násobne a AUC 1,8-násobne, v porovnaní s hodnotami, keď bol
panobinostat podávaný samostatne.
U pacientov, ktorí súbežne užívajú lieky, ktoré sú silnými inhibítormi CYP3A a/alebo Pgp, vrátane ale nie výlučne ketokonazolu, itrakonazolu, vorikonazolu, ritonaviru, sakvinaviru, telitromycínu, posakonazolu a nefazodónu, sa má dávka panobinostatu znížiť (pozri časť 4.2).
Pacientom treba odporúčať, aby sa vyhýbali konzumácii karamboly (star fruit), grepov, grepového džúsu, granátových jabĺk a džúsu z granátových jabĺk, pretože je známe, že inhibujú enzýmy cytochrómu P450 3A a môžu zvyšovať biologickú dostupnosť panobinostatu.
Lieky, o ktorých sapredpokladá,žeznižujúkoncentráciu panobinostatu
Frakcia panobinostatu metabolizovaného prostredníctvom CYP3A4 je približne 40%. V klinických
skúšaniach s mnohopočetným myelómom klesla expozícia panobinostatu o približne 20% pri súbežnom užívaní dexametazónu, čo je slabý/stredne silný induktor CYP3A4 závislý od dávky.
Očakáva sa, že silné induktory budú mať silnejší účinok a budú možno znižovať účinnosť
panobinostatu a preto je potrebné vyhnúť sa súbežnému podávaniu silných induktorov CYP3A4, vrátane ale nie výlučne karbamazepínu, fenobarbitalu, fenytoínu, rifabutínu, rifampicínu a ľubovníka
bodkovaného (Hypericum perforatum).
Lieky, ktorých plazmatickú koncentráciu môže panobinostat zvyšovať
Panobinostat zvýšil Cmax dextrometorfanu (substrátu CYP2D6) 1,8-násobne a AUC dextrometorfanu
1,6-násobne a nemožno vylúčiť, že účinok na citlivejší substrát CYP2D6 môže byť silnejší. Vyhnite sa
podávaniu panobinostatu pacientom, ktorí užívajú substráty CYP2D6 s úzkym terapeutickým indexom
(vrátane, ale nie výlučne pimozidu). Ak sa Farydak podáva spolu s citlivými substrátmi CYP2D6 (napr. atomoxetínom, dextrometorfanom, metoprololom, nebivololom, perfenazínom a pimozidom),
titrujte dávku jednotlivých substrátov CYP2D6 podľa znášanlivosti a často sledujte pacientov na
nežiaduce účinky.
Lieky, ktorých plazmatickúkoncentráciumôžepanobinostatznižovať
Hormonálna antikoncepcia
V súčasnosti nie je známe, či panobinostat môže znižovať účinnosť hormonálnej antikoncepcie.
Okrem toho, ak sa panobinostat podáva spolu s dexametazónom, o ktorom je známe, že to je slabý až stredne silný induktor CYP3A4, ako aj ďalších enzýmov a transportérov, je potrebné zvážiť riziko zníženej účinnosti antikoncepcie. Ženy, ktoré užívajú hormonálnu antikoncepciu, musia okrem toho používať aj bariérovú metódu antikoncepcie.
Nie sú dostupné žiadne údaje na vylúčenie rizika, že panobinostat môže byť slabým induktorom enzýmu CYP3A4 v gastrointestinálnom trakte. To by mohlo viesť k miernemu zníženiu expozície citlivých substrátov CYP3A4.
Predpokladané farmakodynamické interakcie
Predĺže ni e QT intervalu
Na základe predklinických a klinických údajov má panobinostat potenciál predĺžiť QT interval.
Súbežné užívanie antiarytmík (vrátane ale nie výlučne amiodarónu, disopyramidu, prokainamidu, chinidínu a sotalolu) a iných látok, o ktorých je známe, že predlžujú QT interval (vrátane ale nie výlučne chlorochínu, halofantrínu, klaritromycínu, metadonu, moxifloxacínu, bepridilu a pimozidu) sa neodporúča. Antiemetiká so známym rizikom predĺženia QT intervalu, ako sú napr. dolasetrón, granisetrón, ondansetrón a tropisetrón, sa majú užívať opatrne (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Ženy vplodnom veku/Antikoncepcia u mužovažien
Na základe výsledkov u zvierat, pravdepodobnosť, že panobinostat bude pri podávaní gravidným
ženám zvyšovať riziko úmrtia plodu aj vývojových abnormalít skeletu, môže byť vysoká. Ženy
vo fertilnom veku užívajúce Farydak musia používať vysoko účinnú metódu antikoncepcie počas liečby a tri mesiace po podaní poslednej dávky Farydaku. Ženy užívajúce hormonálnu antikoncepciu musia okrem toho používať aj bariérovú metódu antikoncepcie.
Vzhľadom na svoj cytostatický/cytotoxický mechanizmus účinku Farydak môže ovplyvniť kvalitu spermií tvoriacich sa počas liečby. Sexuálne aktívni muži užívajúci panobinostat a ich partnerky majú počas mužovej liečby a počas šiestich mesiacov po poslednej dávke Farydaku používať vysoko účinnú metódu antikoncepcie.
Ak sa panobinostat podáva spolu s dexametazónom, o ktorom je známe, že je slabým až miernym induktorom CYP3A4, ako aj iných enzýmov a transportérov, je potrebné zvážiť riziko zníženej účinnosti hormonálnej antikoncepcie. Okrem toho momentálne nie je známe, či panobinostat môže znižovať účinnosť hormonálnej antikoncepcie, a preto ženy používajúce hormonálnu antikoncepciu majú okrem toho používať bariérovú metódu antikoncepcie.
Gravidita
Neuskutočnili sa žiadne klinické skúšania zamerané na použitie Farydaku u gravidných pacientok.
Štúdie na zvieratách preukázali reprodukčnú a embryofetálnu toxicitu (pozri časť 5.3). Vzhľadom na
cytostatický/cytotoxický mechanizmus účinku panobinostatu je možné riziko pre plod vysoké. Farydak sa má používať počas tehotenstva iba vtedy, ak očakávaný prínos preváži možné riziko pre plod. Ak sa používa počas tehotenstva alebo ak pacientka otehotnie počas jeho užívania, pacientka musí byť informovaná o možnom riziku pre plod.
Dojčenie
Nie je známe, či sa panobinostat vylučuje do ľudského mlieka. Vzhľadom na cytostatický/cytotoxický
mechanizmus účinku, laktácia je počas liečby Farydakom kontraindikovaná (pozri časť 4.3).
Fertilita
Na základe predklinických zistení môže byť mužská plodnosť liečbou Farydakom oslabená (pozri
časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Farydak môže mať malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Po podaní Farydaku sa
môžu objaviť závraty (pozri časť 4.8).
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Údaje o bezpečnosti panobinostatu boli vyhodnotené celkom u 451 pacientov s mnohopočetným
myelómom liečených panobinostatom v kombinácii s bortezomibom a dexametazónom a celkom u
278 pacientov liečených panobinostatom ako jediným liekom.
Údaje o bezpečnosti uvedené nižšie pochádzajú z klinického skúšania fázy III (Panorama 1) u
381 pacientov s mnohopočetným myelómom liečených 20 mg panobinostatu jedenkrát denne trikrát za týždeň, v režime 2 týždne s liečbou a 1 týždeň bez liečby, v kombinácii s bortezomibom
a dexametazónom.
Medián dĺžky expozície v štúdii bol 5,0 mesiacov. 15,7% pacientov bolo vystavených liečbe v tejto
štúdii počas ≥48 týždňov.
Najčastejšími nehematologickými nežiaducimi účinkami boli hnačka, únava, nevoľnosť a vracanie. Pri liečbe sa objavujúce hematologické toxicity zahŕňali trombocytopéniu, anémiu, neutropéniu a
lymfopéniu.
Interval QTcF > 480 a < 500 msek bol hlásený u 1,3% pacientov a zmena od východiskových hodnôt
> 60 msek bola pozorovaná u 0,8% pacientov. Ani u jedného pacienta sa nevyskytol absolútny QTcF
> 500 msek.
Srdcové príhody (najčastejšie atriálna fibrilácia, tachykardia, palpitácie a sínusová tachykardia) boli hlásené u 17,6% pacientov liečených panobinostatom + bortezomibom + dexametazónom v porovnaní s 9,8% pacientov liečených placebom + bortezomibom + dexametazónom a prípady synkopy boli hlásené u 6,0% pacientov liečených panobinostatom + bortezomibom + dexametazónom v porovnaní s
2,4% pacientov liečených placebom + bortezomibom + dexametazónom.
Ukončenie liečby v dôsledku nežiaducich účinkov bez ohľadu na kauzalitu bolo pozorované u 36,2% pacientov. Najčastejšími nežiaducimi účinkami (AE) vedúcimi k prerušeniu liečby boli hnačka (4,5%), asténia a únava (každá 2,9%) a zápal pľúc (1,3%).
Úmrtia počas liečby nesúvisiace s indikáciou štúdie (mnohopočetný myelóm) boli hlásené u 6,8% pacientov liečených panobinostatom s bortezomibom a dexametazónom, v porovnaní s 3,2% pacientov liečených placebom s bortezomibom a dexametazónom.
Tabuľkový zoznam nežiaducichúčinkovlieku z klinickýchskúšaní
Nežiaduce účinky lieku z klinického skúšania fázy III (Panorama 1) sú uvedené v tabuľke 7.
Nežiaduce účinky lieku sú uvedené podľa triedy orgánových systémov MedDRA. V každej triede
orgánových systémov sú nežiaduce účinky liekov zoradené podľa frekvencie, pričom ako prvé sú
uvedené najčastejšie účinky. V každej skupine frekvencií sú nežiaduce účinky liekov zoradené podľa klesajúcej závažnosti. Okrem toho kategória frekvencie zodpovedajúca každému nežiaducemu účinku lieku vychádza z nasledujúcej konvencie (CIOMS III): veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000); veľmi zriedkavé (<1/10 000); a neznáme (z dostupných údajov).
Tabuľka 7 Nežiaduce účinky lieku pozorované u pacientov s mnohopočetným myelómom v klinickom skúšaní fázy III
T
rieda orgánových
systémov
F
r
ekvencia Nežiaduce účinky
Infekcie a nákazy Veľmi časté Infekcia horných dýchacích ciest, zápal pľúc
Časté Septický šok, infekcia močových ciest, vírusová infekcia, orálny herpes, kolitída Clostridium difficile, zápal stredného ucha, celulitída, sepsa, gastroenteritída, infekcia dolných dýchacích ciest, kandidóza
Menej časté Mykotická pneumónia, hepatitída B, aspergilóza
Poruchy krvi
a lymfatického systému a
Poruchy endokrinného systému
Poruchy metabolizmu a
výživy
Veľmi časté Pancytopénia, trombocytopénia, anémia, leukopénia, neutropénia, lymfopénia
Časté Hypotyreóza
Veľmi časté Znížená chuť do jedla, hypofosfatémia a, hyponatriémia a, hypokaliémia a
Časté Hyperglykémia, dehydratácia, hypoalbuminémia, zadržiavanie tekutín, hyperurikémia, hypokalciémia, hypomagneziémia
Psychické poruchy Veľmi časté Nespavosť
Poruchy nervového systému
Veľmi časté Závraty, bolesť hlavy
Časté Intrakraniálne krvácanie, synkopa, triaška, dysgeúzia
Poruchy oka Časté Krvácanie do spojovky
Poruchy srdca a srdcovej
činnosti
Časté Bradykardia, atriálna fibrilácia, sínusová tachykardia, tachykardia, palpitácie
Menej časté Infarkt myokardu
Poruchy ciev Veľmi časté Hypotenzia
Časté Hypertenzia, hematóm, ortostatická hypotenzia
Menej časté Hemoragický šok
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy pečene a žlčových
ciest
Poruchy kože
a podkožného tkaniva
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
Poruchy obličiek
a močových ciest
Celkové poruchy a reakcie v mieste podania
Laboratórne a funkčné vyšetrenia
Veľmi časté Kašeľ, dýchavičnosť
Časté Respiračné zlyhanie, šelest, chripot, epistaxa
Menej časté Pľúcne krvácanie, hemoptýza
Veľmi časté Hnačka, nevoľnosť, vracanie, bolesť brucha, dyspepsia
Časté Gastrointestinálne krvácanie, hematochézia, gastritída, cheilitída, abdominálna distenzia, sucho v ústach, nadúvanie
Menej časté Kolitída, hemateméza, gastrointestinálna bolesť
Časté Abnormálna funkcia pečene, hyperbilirubinémia a
Časté Kožné lézie, vyrážka, erytém
Menej časté Petechie
Časté Opuch kĺbov
Časté Zlyhanie obličiek, hematúria, inkontinencia moču
Veľmi časté Únava, periférny edém, pyrexia, asténia
Časté Zimnica, malátnosť
Veľmi časté Úbytok hmotnosti
Časté Zvýšenie močoviny v krvi, zníženie glomelurálnej filtrácie, zvýšenie alkalickej fosfatázy v krvi, predĺženie QT na EKG, zvýšenie kreatinínu
v krvi a, zvýšenie alanín transaminázy SGPT (ALT) a, zvýšenie aspartát transaminázy SGOT
(AST) a
a Frekvencia sa zakladá na laboratórnych hodnotách
Opis vybraných nežiaducich účinkovliekuGastrointestinálneMedzi najčastejšie hlásenými nežiaducimi účinkami je gastrointestinálna toxicita, hlavne hnačka,
nevoľnosť a vracanie. Avšak ukončenie liečby kvôli týmto reakciám bolo hlásené u relatívne malého percenta pacientov, pri hnačke u 4,5%, pri nevoľnosti a vracaní vždy u 0,5%. Pacientom sa má odporúčať, aby v prípade výskytu vážnej gastrointestinálnej toxicity kontaktovali svojho lekára
a možno bude potrebná úprava alebo ukončenie dávkovania (pozri časť 4.4).
TrombocytopéniaVzhľadom k povahe mnohopočetného myelómu a známej hematotoxicite u panobinostatu a súčasne
podávaného lieku bortezomibu bola často pozorovaná trombocytopénia, nezriedka ťažká. Trombocytopénia 3. alebo 4. stupňa CTC sa vyskytla u 256 pacientov, s mediánom času nástupu jeden mesiac. Avšak trombocytopénia je reverzibilná (medián času do zlepšenia je 12 dní) a obvykle sa dá zvládnuť úpravou dávky a prerušením liečby s transfúziou krvných doštičiek alebo bez nej (pozri
časť 4.4). 33,3% pacientov v ramene s panobinostatom + bortezomibom + dexametazónom a 10,3%
pacientov v ramene s placebom + bortezomibom + dexametazónom dostalo počas liečby transfúziu
krvných doštičiek.
Trombocytopénia zriedka vedie k ukončeniu liečby (1,6% pacientov). U väčšiny pacientov s trombocytopéniou sa nevyskytuje krvácanie. U 20,7% pacientov sa vyskytuje krvácanie, najčastejšie epistaxa (4,7%), hematóm (2,6%) a krvácanie do spojovky (2,1%). Krvácanie 3. alebo 4. stupňa CTC bolo hlásené u 4,2% pacientov a najčastejšie zahŕňalo gastrointestinálne krvácanie. Päť pacientov (1,3%) zomrelo na následky príhod spojených s krvácaním. Medzi pacientmi, ktorí zomreli na následky krvácania, bol jeden pacient s trombocytopéniou 4. stupňa, traja pacienti s trombocytopéniou
3. stupňa a 1 pacient s trombocytopéniou 1. stupňa.
Neutropénia
Neutropénia bola často hlásená na základe laboratórnych nálezov zistených v priebehu klinického
skúšania (všetky stupne: 75%). Väčšina prípadov novo sa vyskytujúcej ťažkej neutropénie bola
3. stupňa (28%) a podstatne menej prípadov bolo 4. stupňa (6,6%). Zatiaľ čo u mnohých pacientov sa vyskytla neutropénia, febrilná neutropénia sa vyskytla iba u zlomku liečených pacientov (1,0%, pre
všetky stupne CTC aj pre všetky stupne 3 a 4). U pacientov s neutropéniou je vyššie riziko infekcií, hlavne infekcií horných dýchacích ciest alebo zápalu pľúc. Iba u 0,3% pacientov bola liečba ukončená
kvôli neutropénii.
Únava a asténia
Únava bola hlásená u 41,2% pacientov a asténia u 22,0% pacientov. Únava 3. stupňa CTC bola hlásená u 15,7% pacientov a únava 4. stupňa u 1,3%. Asténia 3. stupňa bola pozorovaná u 9,4% pacientov a u žiadneho pacienta sa nevyskytla asténia 4. stupňa CTC. U 2,9% pacientov bola liečba ukončená kvôli únave a asténii.
Infekcie
Pacienti s relapsujúcim alebo refraktérnym mnohopočetným myelómom sú ohrození infekciou.
K potenciálnym prispievajúcim faktorom môže patriť predchádzajúca chemoterapia, transplantácia kmeňových buniek, povaha ochorenia a neutropénia alebo lymfopénia súvisiaca s liečbou Farydakom. Najčastejšie hlásené infekcie zahŕňajú infekciu horných dýchacích ciest, zápal pľúc a nazofaryngitídu. Hlásené boli smrteľné prípady zahrňujúce zápal pľúc alebo sepsu. Ukončenie liečby kvôli infekcii
bolo hlásené u 5% pacientov.
Predĺže ni e QT a abnormality EKG
Pozorované bolo predĺženie QTc intervalu, väčšinou nízkeho stupňa: QTcF interval > 450 msek a'
≤ 480 ms bol hlásený u 10,8% pacientov, pričom maximálne zvýšenie od východiskovej hodnoty bolo
> 30 ms a ≤ 60 ms u 14,5% pacientov. Hodnota QTcF > 500 msek nebola hlásená u žiadneho pacienta.
U pacientov liečených panobinostatom + bortezomibom + dexametazónom boli hlásené odchýlky EKG (elektrokardiogramu), zahŕňajúce hlavne depresiu segmentu ST-T (21,7%) a zmeny T-vĺn (39,6%). Bez ohľadu na chronológiu udalostí bola synkopa hlásená u 9% pacientov s depresiou ST-T, u 7,2% pacientov so zmenami T-vĺn a u 4,9% pacientov bez týchto EKG odchýlok. Podobne bola ischemická choroba srdca (vrátane infarktu myokardu a ischémie) hlásená u 4,5% pacientov s depresiou ST-T, u 4,8% pacientov so zmenami T-vĺn a u 2,7% pacientov bez týchto EKG odchýlok.
Osobitné skupiny pacientov
St arší pacienti
Miera úmrtia nesúvisiaca s indikáciou klinického skúšania bola 8,8% u pacientov ≥ 65 rokov v porovnaní s 5,4% u pacientov < 65 rokov.
Nežiaduce účinky vedúce k trvalému ukončeniu liečby sa objavili u 30% pacientov vo veku
< 65 rokov, 44% pacientov vo veku < 65-75 rokov a u 47% pacientov vo veku ≥ 75 rokov.
K nežiaducim účinkom 3.-4. stupňa častejšie pozorovaným u starších pacientov patria (percentá
u pacientov < 65 rokov, 65-75 rokov a ≥ 75 rokov, v uvedenom poradí): trombocytopénia (60%, 74%, a 91%), anémia (16%, 17% a 29%), hnačka (21%, 27% a 47%) a únava (18%, 28% and 47%).
H
l
ásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili

akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V.4.9 PredávkovaniePočas klinických skúšaní boli hlásené obmedzené skúsenosti s predávkovaním. Pozorované nežiaduce účinky boli v súlade s bezpečnostným profilom, s prípadmi zahŕňajúcimi hlavne hematologické a gastrointestinálne poruchy ako sú trombocytopénia, pancytopénia, hnačka, nevoľnosť, vracanie a anorexia. V prípade predávkovania sa má vykonať kontrola funkcie srdca, vyšetrenie elektrolytov
a počtu krvných doštičiek a v prípade potreby sa má poskytnúť podporná starostlivosť. Nie je známe,
či je panobinostat dialyzovateľný.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Ostatné protinádorové lieky, ATC kód: L01XX42
Mechanizmus účinkuFarydak je inhibítor histónovej deacetylázy (HDAC), ktorý inhibuje enzymatickú aktivitu HDAC v
nanomolárnych koncentráciách. HDAC katalyzujú odstraňovanie acetylových skupín z lyzínových
zvyškov histónov a niektorých nehistónových proteínov. Inhibícia aktivity HDAC má za následok zvýšenie acetylácie histónových proteínov, epigenetickú zmenu, ktorá má za následok relaxáciu chromatínu vedúcu k transkripčnej aktivácii. Panobistat
in vitro spôsobil akumuláciu acetylovaných histónov a iných proteínov, pričom indukoval zástavu bunkového cyklu a/alebo apoptózu niektorých transformovaných buniek. V xenograftoch od myší, ktoré boli liečené panobinostatom, bola pozorovaná zvýšená hladina acetylovaných histónov. Panobinostat prejavuje vyššiu cytotoxicitu voči nádorovým bunkám než voči normálnym bunkám.
Farmakodynamické účinkyLiečba nádorových buniek panobinostatom mala za následok od dávky závislé zvýšenie acetylácie
histónov H3 a H4
in vitro a v predklinických zvieracích modeloch xenograftov, čím vykazuje cieľovú
inhibíciu. Okrem toho sa expozíciou panobinostatu spustila zvýšená expresia nádorového supresívneho génu p21CDKNIA (inhibítor kinázy závislej od cyklínu 1/p21), kľúčového mediátora
väzby a diferenciácie G1.
Klinická účinnosťabezpečnosť Kl i ni ck á účinnosť u pacientov s relapsujúcim mnohopoče t ným mye lómom a s relapsujúcim arefraktérnym mnohopoče tným myelómom (Št údi a D2308 – Panorama 1)Účinnosť a bezpečnosť panobinostatu v kombinácii s bortezomibom a dexametazónom boli hodnotené v randomizovanom, dvojito zaslepenom, placebom kontrolovanom, multicentrickom klinickom
skúšaní fázy III u pacientov s relapsujúcim alebo s relapsujúcim a refraktérnym mnohopočetným
myelómom, ktorí v minulosti absolvovali 1-3 línie liečby.
Pacientom bol podávaný panobinostat (20 mg užívaný perorálne jedenkrát denne, trikrát za týždeň, v dávkovacom režime 2 týždne s liečbou a 1 týždeň bez liečby), v kombinácii s bortezomibom
(1,3 mg/m2 podávaný v intravenóznej injekcii) a dexametazónom (20 mg). Liečba bola podávaná
maximálne po dobu 16 cyklov (pozri tabuľky 1 a 2).
Celkom 768 pacientov bolo randomizovaných v pomere 1:1 buď do ramena s panobinostatom, bortezomibom a dexametazónom (n=387) alebo do ramena s placebom, bortezomibom a dexametazónom (n=381), pričom boli triedení podľa predchádzajúceho užívania bortezomibu [Áno (n=336 (43,8%)), Nie (n=432 (56,3%))] a počtu predchádzajúcich línií protimyelómovej liečby
[1 predchádzajúca línia (n=352 (45,8%)), 2 až 3 predchádzajúce línie (n=416 (54,2%))]. Demografia a východiskové charakteristiky ochorenia oboch skupín liečby v klinickom skúšaní boli vyrovnané a
porovnateľné.
Medián veku bol 63 rokov, rozpätie 28-84; 42,1% pacientov bolo starších ako 65 rokov. Celkom
53,0% pacientov boli muži. Belosi tvorili 65,0% populácie klinického skúšania, aziati 30,2% a černosi
2,9%. Performačný status ECOG bol u 93% pacientov 0-1. Medián počtu predchádzajúcich terapií bol
1,0. Viac ako polovica (57,2%) pacientov v minulosti podstúpila transplantáciu kmeňových buniek a u
62,8% pacientov sa po predchádzajúcej protinádorovej liečbe vyskytol relaps (napr. melfalan 79,6%, dexametazón 81,1%, talidomid 51,2%, cyklofosfamid 45,3%, bortezomib 43,0%, kombinácia
bortezomibu a dexametazónu 37,8%, lenalidomid 20,4%). U viac ako jednej tretiny (35,8%) pacientov
sa po predchádzajúcej liečbe vyskytli relaps a refraktérnosť.
Medián trvania sledovania bol 28,75 mesiaca v ramene s panobinostatom, bortezomibom a dexametazónom a 29,04 mesiaca v ramene s placebom, bortezomibom a dexametazónom.
Primárnym koncovým ukazovateľom bolo prežívanie bez progresie (PFS) podľa upravených kritérií Európskej skupiny pre transplantáciu kostnej drene (mEBMT) a podľa hodnotenia skúšajúceho lekára. V celkovej populácii pacientov bolo PFS vychádzajúce z celého analyzovaného súboru (FAS)
v ramenách liečby štatisticky významne odlišné (stratifikovaný Log-rank test p< 0,0001, s odhadovaným 37% znížením rizika v ramene s panobinostatom, bortezomibom a dexametazónom,
v porovnaní s ramenom s placebom, bortezomibom a dexametazónom (miera rizika: 0,63 (95% IS:
0,52, 0,76)). Medián PFS (95% IS) bol 12,0 mesiacov (10,3; 12,9) a 8,1 mesiaca (7,6; 9,2), v jednotlivých ramenách.
Kľúčovým sekundárnym koncovým ukazovateľom bolo celkové prežívanie (OS). Konečný počet prípadov OS ešte nebol dosiahnutý. V čase druhej predbežnej analýzy OS, potom ako bolo pozorovaných 359 (86,5%) z cieľových 415 prípadov OS potrebných pre záverečnú analýzu OS, bolo priemerné OS 38,24 mesiaca v ramene s panobinostatom + bortezomibom + dexametazónom
a 35,38 mesiaca v ramene s placebom + bortezomibom + dexametazónom.
Z predšpecifikovanej podskupiny pacientov s predchádzajúcou liečbou bortezomibom a imunomodulačným liekom (N=193), dostalo najmenej 76% pacientov dve predošlé liečby. V tejto podskupine pacientov (N=147) bol medián trvania liečby 4,5 mesiaca v ramene s panobinostatom + bortezomibom + dexametazónom a 4,8 mesiaca v ramene s placebom + bortezomibom + dexametazónom. Medián PFS bol (95% IS) 12,5 mesiaca (7,26; 14,03) v ramene s panobinostatom + bortezomibom + dexametazónom a 4,7 mesiaca (3,71; 6,05) v ramene s placebom + bortezomibom + a dexametazónom [HR: 0,47 (0,31; 0,72]. Títo pacienti mali medián 3 predchádzajúcich terapií. Výsledky účinnosti sú zhrnuté v tabuľke 8 a Kaplan-Meierove krivky PFS sú zobrazené na obrázku 2.
 Tabuľka 8: Prežívanie bez progresie u pacientov, ktorí dostali najmenej dve predchádzajúceliečby vrátane bortezomibu a imunomodulačného lieku
Tabuľka 8: Prežívanie bez progresie u pacientov, ktorí dostali najmenej dve predchádzajúceliečby vrátane bortezomibu a imunomodulačného lieku
F
arydak
bortezomib a dexametazón
Placebo
bortezomib a dexametazón
N=73 N=74
Prežívanie bez progresie

Medián, mesiace [95% IS] 12,5 [7,26; 14,03] 4,7 [3,71; 6,05] Pomer rizika [95% IS]1 0,47 (0,31; 0,72)
1 Miera rizika zo stratifikovaného Coxovho modelu
O
brázok 2: Kaplan-Meierova krivka prežívania bez progresie u pacientov s mnohopočetným myelómom, ktorí dostali najmenej dve predchádzajúce liečby vrátane bortezomibu a imunomodulačného lieku
100
80
60
Pomer rizika= 0.47
95% IS [0,31; 0,72]
Logrank p-hodnota=0,0003
Kaplan Meierove mediány PAN+BTZ+Dex: 12,48 mesiaca PBO+BTZ+Dex: 4,70 mesiaca
40
20
Časy cenzúry
PAN+BTZ+Dex (n/N=44/73)
0 PBO+BTZ+Dex (n/N=54/74)
0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30
Čas (mesiace)
Počet rizikových pacientov
Čas (mesiace) PAN+BTZ+Dex
PBO+BTZ+Dex
0 2 4
73 57 42
74 54 37
6 8 10
36 32 25
23 11 9
12 14
20 15
5 4
16 18 20
10 6 4
2 2 2
22 24 26
3 2 2
2 2 0
28 30
1 0
0 0



PAN= panobinostat
PBO= placebo
BTZ= bortezomib
Dex = dexametazón
V podskupine pacientov, ktorí dostali najmenej dve predchádzajúce liečby vrátane bortezomibu a imunomodulačného lieku (n=147), bola celková miera odpovede pomocou modifikovaných kritérií EBMT 59% v ramene s panobinostatom + bortezomibom + dexametazónom a 39% v ramene s placebom + bortezomibom + dexametazónom. Miera odpovede je zhrnutá v tabuľke 9.
 Tabuľka 9: Miera odpovede u pacientov s mnohopočetným myelómom, ktorí dostali najmenej dve predchádzajúce liečby vrátane bortezomibu a imunomodulačného lieku
Tabuľka 9: Miera odpovede u pacientov s mnohopočetným myelómom, ktorí dostali najmenej dve predchádzajúce liečby vrátane bortezomibu a imunomodulačného lieku
| Farydak bortezomib a dexametazón N=73
| Placebo bortezomib a dexametazón N=74
|
Celková odpoveď
| 43 (59%)
| 29 (39%)
|
[95% IS]
| (46,8; 70,3)
| (28,1; 51,2)
|
Úplná odpoveď
| 6 (8%)
| 0
|
Takmer úplná odpoveď
| 10 (14%)
| 6 (8%)
|
Čiastočná odpoveď
| 27 (37%)
| 23 (31%)
|
Kl i ni ck á účinnosť u pacientov s mnohopočet ným myel ómom refraktérnym na bortezomib(Št údi a DUS71 – Panorama 2)DUS71 bolo otvorené multicentrické klinické skúšanie v dvoch fázach, s jedným ramenom liečby,
fázy II s perorálne podávaným panobinostatom (20 mg) v kombinácii s bortezomibom (1,3 mg/m2)
a dexametazónom (20 mg) u 55 pacientov s relapsujúcim a refraktérnym mnohopočetným myelómom, ktorí boli refraktérni na bortezomib a dostali najmenej dve predchádzajúce línie liečby. Pacienti museli byť vystavení IMiD (lenalidomidu alebo talidomidu). Refraktérnosť na bortezomib bola definovaná
ako progresia ochorenia do 60. dňa, vrátane, poslednej línie liečby obsahujúcej bortezomib.
Primárny koncový ukazovateľ klinického skúšania bolo vyhodnotenie miery celkovej odpovede
(ORR) po 8 cykloch liečby podľa kritérií mEBMT.
Pacienti boli silne predliečení a absolvovali niekoľko predchádzajúcich režimov (medián: 4; rozpätie: 2-11). Všetci 55 pacienti boli v minulosti liečení bortezomibom a najmenej jedným IMiD (lenalidomidom: 98,2%, talidomidom: 69,1%). Väčšina pacientov dostala v minulosti transplantát (63,6%).
Medián trvania expozície skúšanému lieku bol 4,6 mesiaca (rozpätie: 0,1-24,1 mesiaca). Pacienti dosiahli ORR (≥ PR (čiastočná odpoveď)) s hodnotou 34,5% a 52,7% (≥ MR (minimálna odpoveď)). Medián času do odpovede bol 1,4 mesiaca a medián trvania odpovede bol 6,0 mesiacov. Medián OS bol 17,5 mesiacov.
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s mnohopočetným
myelómom vo všetkých podskupinách pediatrickej populácie (informácie o použití v pediatrickej
populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Panobinostat sa rýchlo a takmer úplne absorbuje a dosahuje tmax do 2 hodín po perorálnom podaní
u pacientov s pokročilou rakovinou. Absolútna perorálna biologická dostupnosť panobinostatu bola
približne 21%. Po perorálnom podaní panobinostatu sa farmakokinetika panobinostatu zdá byť
v rozmedzí dávok 10-30 mg lineárna, ale AUC sa pri vyšších dávkach zvyšuje menej ako úmerne dávke.
Celková expozícia panobinostatu a variabilita medzi pacientmi ostala nezmenená pri podávaní
s jedlom aj bez jedla, zatiaľ čo Cmax sa znížila o < 45% a tmax sa predĺžil o 1 až 2,5 hodiny pri podávaní s jedlom (t.j. aj s normálnymi raňajkami aj s raňajkami s vysokým obsahom tuku). Keďže jedlo nezmenilo celkovú biologickú dostupnosť (AUC), panobinostat sa môže pacientom s rakovinou podávať nezávisle od jedla.
Distribúcia
Panobinostat sa stredne (približne 90%) viaže na bielkoviny ľudskej plazmy. Jeho podiel
v erytrocytoch je 0,60 in vitro, nezávisle od koncentrácie. Distribučný objem panobinostatu
v rovnovážnom stave (Vss) je podľa konečných odhadov parametrov vo farmakokinetickej analýze tejto populácie približne 1 000 litrov.
Biotransformácia
Panobinostat je extenzívne metabolizovaný a veľká časť dávky sa metabolizuje predtým, ako dosiahne
systémovú cirkuláciu. Príslušné metabolické dráhy podieľajúce sa na biotransformácii panobinostatu
sú redukcia, hydrolýza, oxidácia a procesy glukuronidácie. Oxidačný metabolizmus panobinostatu hral menej významnú úlohu, pričom približne 40% dávky sa vylúčilo touto cestou. Cytochróm P450 3A4
(CYP3A4) je hlavný oxidačný enzým s možným menej významným zapojením CYP2D6 a 2C19.
Panobinostat predstavoval 6 až 9% s liekom súvisiacej expozície v plazme. Usudzuje sa, že za celkovú
farmakologickú aktivitu panobinostatu zodpovedá materská zlúčenina.
Eliminácia
Po jednej perorálne podanej dávke [14C] panobinostatu pacientom sa 29 až 51% podanej rádioaktivity
vylúči močom a 44 až 77% stolicou. Nezmenený panobinostat predstavoval < 2,5% dávky v moči a
< 3,5% dávky v stolici. Zvyšky sú metabolity. Zistilo sa, že zdanlivý renálny klírens panobinostatu (CLR/F) je v rozpätí 2,4 až 5,5 l/h. Panobinostat má podľa odhadu koncových parametrov farmakokinetickej analýzy tejto populácie terminálny počas eliminácie približne 37 hodín.
Osobitné populácie
Pediatrická populácia
Panobinostat sa neskúmal u pacientov s mnohopočetným myelómom mladších ako 18 rokov.
St arší pacienti
V klinickom skúšaní fázy III bolo 162 z 387 pacientov vo veku 65 rokov alebo starších. Plazmatická expozícia panobinostatu u pacientov vo veku 65 rokov alebo mladších bola podobná ako u pacientov
starších ako 65 rokov v spojených klinických skúšaniach s panobistatom ako jediným liekom s rozpätím dávky 10 mg až 80 mg.
Pacienti s pošk odení m f unkci e peč ene
Vplyv poškodenia funkcie pečene na farmakokinetiku panobinostatu sa hodnotil v klinickom skúšaní fázy I u 24 pacientov so solídnym nádorom a s rôznym stupňom poškodenia funkcie pečene. Mierne poškodenie funkcie pečene podľa klasifikácie NCI-CTEP zvyšovalo plazmatickú expozíciu panobinostatu o 43% a stredne ťažké o 105%. K dispozícii nie sú žiadne farmakokinetické údaje od pacientov s ťažkým poškodením funkcie pečene.
Pacienti s pošk odení m f unkci e obli čiek
Vplyv poškodenia funkcie obličiek na farmakokinetiku panobinostatu sa hodnotil v klinickom skúšaní fázy I u 37 pacientov s pokročilým solidným nádorom s rôznym stupňom poškodenia funkcie obličiek. Mierne, stredne ťažké a ťažké poškodenie funkcie obličiek podľa klírensu kreatinínu v moči pri vstupnom vyšetrení nezvyšovalo plazmatickú expozíciu panobinostatu v skupinách s miernym, stredne ťažkým ani ťažkým poškodením.
5.3 Predklinické údaje o bezpečnosti
Štúdie toxicityopakovanýchdávok
Erytropoetický, myelopoetický a lymfatický systém boli identifikované ako primárne cieľové orgány
toxicity po podávaní panobinostatu u potkanov a psov. Zmeny štítnej žľazy vrátane hormónov u psov
(pokles hladiny trijódotyronínu (T3)) a potkanov (pokles hladiny trijódotyronínu (T3), tetrajodotyronínu (T4) (u samcov) a hormónu stimulujúceho štítnu žľazu (TSH)) boli pozorované pri
expozíciách rovnajúcich sa 0,07-2,2 klinicky pozorovanej ľudskej AUC.
Karcinogenéza a mutagenéza
Neuskutočnili sa žiadne karcinogenetické štúdie s panobinostatom. Panobinostat preukázal mutagénny
potenciál v Amesovom teste, endo-reduplikačné účinky v lymfocytoch ľudskej periférnej krvi in vitro
a poškodenie DNA v bunkách myšieho lymfómu L5178Y in vivo v štúdii COMET, čo sa pripisuje farmakologickému mechanizmu účinku.
Reprodukčná toxicita
U samíc potkanov bolo pozorované zvýšenie skorej resorpcie (dávky ≥30 mg/kg). Pri expozíciách
rovnajúcich sa 0,41-0,69 ľudskej klinickej AUC bola u psov pozorovaná atrofia prostaty spojená so
zníženým množstvom sekrečných granúl, testikulárnou degeneráciou, oligospermiou a zvýšeným
množstvom epididymálneho proteínu a po 4-týždňovom období zotavovania nebola plne reverzibilná.
Na základe údajov od zvierat sa predpokladá, že pravdepodobnosť zvýšeného rizika úmrtia plodu a vzniku skeletálnych abnormalít je u panobinostatu vysoká. Preukázala sa embryofetálna letalita a zvýšenie výskytu skeletálnych odchýlok (stavce navyše, rebrá navyše, zvýšený výskyt menších
skeletálnych odchýlok, oneskorená osifikácia a odchýlky stavcov) pri expozíciách vyšších ako 0,25
ľudskej klinickej AUC.
Účinky panobinostatu na pôrod, postnatálny rast a dozrievanie neboli vo výskumoch na zvieratách skúmané.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly
magnéziumstearát
manitol
mikrokryštalická celulóza predželatínovaný škrob (kukuričný)
Obal kapsuly
Farydak 10 mg tvrdé kapsuly
želatína
oxid titaničitý (E171) brilantná modrá FCF (E133) žltý oxid železitý (E172)
Farydak 15 mg tvrdé kapsuly
želatína
oxid titaničitý (E171)
žltý oxid železitý (E172)
červený oxid železitý (E172)
Farydak 20 mg tvrdé kapsuly
želatína
oxid titaničitý (E171)
červený oxid železitý (E172)
Farbivo napotlač
čierny oxid železitý (E172)
propylénglykol (E1520)
šelaková glazúra
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 30°C.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia PVC/PCTFE/Alu blister obsahujúci 6 kapsúl. Balenia obsahujú 6, 12 alebo 24 kapsúl.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuVšetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými
požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIINovartis Europharm Limited Frimley Business Park Camberley GU16 7SR
Veľká Británia
8. REGISTRAČNÉ ČÍSLOFarydak 10 mg tvrdé kapsulyEU/1/15/1023/001-003
Farydak 15 mg tvrdé kapsulyEU/1/15/1023/004-006
Farydak 20 mg tvrdé kapsulyEU/1/15/1023/007-009
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu