ásobok HHN, podávanie ezetimibu, akéhokoľvek statínu a akýchkoľvek iných týchto látok, ktoré pacient užíva súbežne, sa musí okamžite ukončiť. Všetci pacienti, u ktorých sa začína s terapiou ezetimibom, musia byť informovaní o riziku myopatie a o tom, že majú okamžite hlásiť akúkoľvek nevysvetliteľnú svalovú bolestivosť, citlivosť alebo slabosť (pozri časť 4.8).
V skúšaní IMPROVE-IT bolo 18 144 pacientov s koronárnou chorobou srdca a príhodou AKS v anamnéze randomizovaných na užívanie ezetimibu/simvastatínu v dávke 10/40 mg denne (n = 9 067) alebo simvastatínu 40 mg denne (n = 9 077). Počas mediánu sledovania 6,0 rokov bola incidencia myopatie pri ezetimibe/simvastatíne 0,2 % a pri simvastatíne 0,1 %, pričom myopatia bola definovaná ako nevysvetliteľná svalová slabosť alebo bolesť s hladinou CK v sére ≥ 10-násobok HHN alebo dve konsekutívne pozorovania hladiny CK ≥ 5 a < 10-násobok HHN. Incidencia rabdomyolýzy bola pri ezetimibe/simvastatíne 0,1 % a pri simvastatíne 0,2 %, pričom rabdomyolýza bola definovaná ako nevysvetliteľná svalová slabosť alebo bolesť s hladinou CK v sére ≥ 10-násobok HHN s dôkazom poškodenia obličiek, ≥ 5-násobok HHN a < 10-násobok HHN počas dvoch konsekutívnych udalostí s dôkazom poškodenia obličiek alebo hladinou CK ≥ 10,000 IU/l bez dôkazu poškodenia obličiek. (Pozri časť 4.8).
V klinickom skúšaní, v ktorom bolo viac ako 9 000 pacientov s chronickým ochorením obličiek randomizovaných na užívanie 10 mg ezetimibu v kombinácii s 20 mg simvastatínu denne (n = 4 650) alebo placeba (n = 4 620) (medián sledovaného obdobia 4,9 rokov), bol výskyt myopatie/rabdomyolýzy 0,2 % pri ezetimibe v kombinácii so simvastatínom a 0,1 % pri placebe (pozri časť 4.8).
Pacienti s poruchou funkcie pečeneVzhľadom na neznáme účinky zvýšenej expozície ezetimibu sa u pacientov so stredne ťažkou alebo ťažkou hepatálnou insuficienciou ezetimib neodporúča (pozri časť 5.2).
Pediatrická populácia (vo veku 6 až 17 rokov)Účinnosť a bezpečnosť ezetimibu u pacientov vo veku 6 až 10 rokov s heterozygotnou familiárnou alebo non-familiárnou hypercholesterolémiou boli hodnotené v 12-týždňovom placebom kontrolovanom klinickom skúšaní. Účinky ezetimibu počas obdobia liečby viac ako 12 týždňov neboli v tejto vekovej skupine skúmané (pozri časti 4.2, 4.8, 5.1 a 5.2).
Ezetimib sa neskúmal u pacientov mladších ako 6 rokov (pozri časti 4.2 a 4.8).
Účinnosť a bezpečnosť ezetimibu podávaného spolu so simvastatínom pacientom vo veku 10 až 17 rokov s heterozygotnou familiárnou hypercholesterolémiou sa hodnotila v kontrolovanom klinickom skúšaní u adolescentných chlapcov (Tannerovo štádium II alebo vyššie) a u dievčat, ktoré boli minimálne jeden rok po menarché.
V tejto limitovanej kontrolovanej štúdii nebol u adolescentných chlapcov alebo dievčat vo
všeobecnosti žiadny zistiteľný vplyv na rast alebo sexuálne dospievanie, ani akýkoľvek vplyv na dĺžku
menštruačného cyklu u dievčat. Účinky ezetimibu na rast a sexuálne dospievanie počas liečebného
obdobia dlhšieho ako 33 týždňov sa však neštudovali (pozri časti 4.2 a 4.8).
Bezpečnosť a účinnosť ezetimibu podávaného spolu s dávkami simvastatínu nad 40 mg denne sa
u pediatrických pacientov vo veku 10 až 17 rokov neštudovali.
Bezpečnosť a účinnosť ezetimibu podávaného spolu so simvastatínom sa u pediatrických pacientov vo
veku menej ako 10 rokov neštudovali (pozri časti 4.2 a 4.8).
Dlhodobá účinnosť liečby ezetimibom u pacientov mladších ako 17 rokov na zníženie morbidity
a mortality v dospelosti sa neštudovala.
FibrátyBezpečnosť a účinnosť ezetimibu podávaného s fibrátmi nebola stanovená.
Ak je u pacienta užívajúceho ezetimib a fenofibrát podozrenie na cholelitiázu, indikuje sa vyšetrenie žlčníka a liečba sa má prerušiť (pozri časti 4.5 a 4.8).CyklosporínAk sa ezetimib začína podávať počas liečby cyklosporínom, je potrebná opatrnosť. U pacientov užívajúcich ezetimib a cyklosporín sa má monitorovať koncentrácia cyklosporínu (pozri časť 4.5).
AntikoagulanciáAk sa ezetimib pridáva k warfarínu, k inému kumarínovému antikoagulantu alebo k fluindiónu, je potrebné náležite monitorovať International Normalized Ratio (INR,
medzinárodný normalizovaný index) (pozri časť 4.5).
Pomocná látkaTento liek obsahuje monohydrát laktózy. Pacienti so zriedkavými dedičnými problémami galaktózovej intolerancie, lapónskeho deficitu laktázy alebo glukózo-galaktózovej malabsorpcie nesmú užívať tento liek.
4.5 Liekové a iné interakcieV predklinických štúdiách sa preukázalo, že ezetimib neindukuje enzýmy cytochrómu P450, ktoré metabolizujú lieky. Nepozorovali sa žiadne klinicky významné farmakokinetické interakcie medzi ezetimibom a liekmi, o ktorých je známe, že sú metabolizované cytochrómami P450 1A2, 2D6, 2C8, 2C9 a 3A4 alebo N-acetyltransferázou.
V štúdiách klinických interakcií nemal ezetimib žiadny vplyv na farmakokinetiku súčasne podávaného dapsónu, dextrometorfánu, digoxínu, perorálnych kontraceptív (etinylestradiol a levonorgestrel), glipizidu, tolbutamidu alebo midazolamu. Cimetidín podávaný súbežne s ezetimibom nemal žiadny vplyv na biologickú dostupnosť ezetimibu.
AntacidáSúbežné podávanie antacíd znížilo mieru absorpcie ezetimibu, ale nemalo žiadny vplyv na jeho biologickú dostupnosť. Toto zníženie miery absorpcie sa nepovažuje za klinicky významné.
CholestyramínSúbežné podávanie cholestyramínu znížilo priemernú plochu pod krivkou (AUC) celkového ezetimibu (ezetimib + ezetimib-glukuronid) približne o 55 %. Zníženie prírastku cholesterolu lipoproteínov s nízkou hustotou (LDL-C) v dôsledku pridania ezetimibu k cholestyramínu môže byť touto interakciou znížený (pozri časť 4.2).
FibrátyU pacientov užívajúcich fenofibrát a ezetimib si má byť lekár vedomý možného rizika cholelitiázy
ochorenia žlčníka (pozri časti 4.4 a 4.8).
Ak je u pacienta užívajúceho ezetimib a fenofibrát podozrenie na cholelitiázu, je indikované vyšetrenie žlčníka a táto liečba sa má prerušiť (pozri časť 4.8).
Súbežné podanie fenofibrátu alebo gemfibrozilu mierne zvýšilo celkové koncentrácie ezetimibu (približne 1,5 a 1,7-násobne).
Súbežné podávanie ezetimibu s inými fibrátmi sa neskúmalo.
Fibráty môžu zvýšiť vylučovanie cholesterolu do žlče a tým viesť k cholelitiáze. V štúdiách na zvieratách ezetimib niekedy zvýšil cholesterol v žlčníkovej žlči, nie však u všetkých druhov (pozri časť 5.3). Litogénne riziko spojené s terapeutickým použitím ezetimibu nie je možné vylúčiť.
StatínyPri súbežnom podávaní ezetimibu s atorvastatínom, simvastatínom, pravastatínom, lovastatínom,
fluvastatínom alebo rosuvastatínom sa nepozorovali žiadne klinicky signifikantné farmakokinetické interakcie.
CyklosporínV
štúdii ôsmich pacientov po transplantácii obličky s klírensom kreatinínu > 50 ml/min na stabilnej dávke cyklosporínu mala jednorazová 10 mg dávka ezetimibu za následok 3,4-násobné (rozsah 2,3- až 7,9-násobné) zvýšenie priemernej AUC celkového ezetimibu v porovnaní so zdravou kontrolnou populáciou, ktorá dostávala samotný ezetimib v inej štúdii (n = 17). V inej štúdii mal pacient s transplantovanou obličkou a ťažkou renálnou insuficienciou, ktorý užíval cyklosporín a inú mnohopočetnú liečbu, 12-násobne vyššiu expozíciu k celkovému ezetimibu v porovnaní so súbežnými kontrolami užívajúcimi samotný ezetimib. V skríženej štúdii v dvoch obdobiach s dvanástimi zdravými jedincami viedlo denné podávanie 20 mg ezetimibu počas 8 dní s jednorazovou 100 mg dávkou cyklosporínu na siedmy deň k priemernému 15 % nárastu AUC cyklosporínu (rozmedzie 10 % pokles až 51 % nárast) v porovnaní s jednorazovou 100 mg dávkou samotného cyklosporínu. Kontrolovaná štúdia účinku súčasného podania ezetimibu na expozíciu cyklosporínu u pacientov transplantovanou obličkou sa nevykonala. Ak sa začína podávať ezetimib pri liečbe cyklosporínom, je potrebná opatrnosť. U pacientov užívajúcich ezetimib a cyklosporín sa majú monitorovať koncentrácie cyklosporínu (pozri časť 4.4).
AntikoagulanciáV
štúdii dvanástich zdravých dospelých mužov nemalo súbežné podanie ezetimibu (10 mg raz denne) signifikantný účinok na biologickú dostupnosť warfarínu a protrombínový čas. Po uvedení do praxe však bolo hlásené zvýšenie International Normalized Ratio (INR) u pacientov, ktorým bol ezetimib pridaný k warfarínu alebo fluindiónu. Ak je ezetimib pridaný k warfarínu, k inému kumarínovému antikoagulantu alebo fluindiónu, je potrebné náležite monitorovať INR (pozri časť 4.4).
Pediatrická populáciaInterakčné štúdie sa uskutočnili len u dospelých.
4.6 Fertilita, gravidita a laktáciaSúbežné podávanie ezetimibu so statínom je kontraindikované počas gravidity a dojčenia (pozri časť 4.3); oboznámte sa, prosím, s SPC príslušného statínu.
GraviditaEzetimib sa má podávať gravidným ženám iba v nevyhnutných prípadoch. Nie sú k dispozícii žiadne klinické údaje o použití ezetimibu počas gravidity. Štúdie na zvieratách s ezetimibom v monoterapii nepreukázali žiadne priame alebo nepriame škodlivé účinky na graviditu, embryofetálny vývin, pôrod alebo postnatálny vývin (pozri časť 5.3).
DojčenieEzetimib sa nemá užívať počas dojčenia. Štúdie na potkanoch preukázali, že ezetimib sa vylučuje do materského mlieka potkanov. Nie je známe, či sa ezetimib vylučuje do ľudského materského mlieka.
FertilitaNie sú k dispozícii žiadne údaje z klinického skúšania o účinkoch ezetimibu na fertilitu u ľudí. Ezetimib nemal žiadny účinok na fertilitu u samcov alebo samíc potkanov (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Pri vedení vozidla alebo obsluhovaní strojov sa však má vziať do úvahy, že bol hlásený závrat.
4.8 Nežiaduce účinkyKlinické štúdie a skúsenosti po uvedení lieku na trhV klinických štúdiách trvajúcich do 112 týždňov bolo denne podávaných 10 mg ezetimibu samostatne 2 396 pacientom, so statínom 11 308 pacientom alebo s fenofibrátom 185 pacientom. Nežiaduce reakcie boli zvyčajne mierne a prechodné. Celková incidencia nežiaducich účinkov bola pri ezetimibe a placebe podobná. Podobne, počet prerušení účasti v štúdii z dôvodu nežiaducich účinkov bol pre ezetimib a placebo porovnateľný.
Ezetimib podávaný samostatne alebo spolu so statínom:
U pacientov liečených ezetimibom (n = 2 396) a vo väčšej miere ako pri placebe (n = 1 159), alebo u pacientov liečených ezetimibom podávaným spolu so statínom (n = 11 308) a vo väčšej miere ako pri podávaní samotného statínu (n = 9 361) sa pozorovali nasledujúce nežiaduce reakcie. Nežiaduce reakcie po uvedení lieku na trh boli odvodené z hlásení pri podávaní ezetimibu samostatne alebo so statínom.
Frekvencie sú definované ako: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000) a neznáme (z dostupných údajov).
Monoterapia ezetimibom
|
Trieda orgánových systémov
| Nežiaduce reakcie
| Frekvencia
|
Laboratórne a funkčné vyšetrenia
| zvýšená ALT a/alebo AST;
zvýšená CPK v krvi;
zvýšená gama-
glutamyltransferáza;
abnormálny test pečeňovej funkcie
| menej časté
|
Poruchy dýchacej sústavy, hrudníka
a mediastína
| kašeľ
| menej časté
|
Poruchy gastrointestinálneho traktu
| bolesť brucha
hnačka
flatulencia
| časté
|
dyspepsia
gastroezofageálny reflux
nauzea
| menej časté
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
| artralgia
svalové spazmy
bolesť krku
| menej časté
|
Poruchy metabolizmu a výživy
| znížená chuť do jedla
| menej časté
|
Poruchy ciev
| návaly tepla
hypertenzia
| menej časté
|
Celkové poruchy a reakcie v mieste podania
| únava
| časté
|
bolesť na hrudi
bolesť
| menej časté
|
Ďalšie nežiaduce reakcie pri ezetimibe podávanom súbežne so statínom
|
Trieda orgánových systémov
| Nežiaduce reakcie
| Frekvencia
|
Laboratórne a funkčné vyšetrenia
| zvýšená ALT a/alebo AST
| časté
|
Poruchy nervového systému
| bolesť hlavy
| časté
|
parestézia
| menej časté
|
Poruchy gastrointestinálneho traktu
| sucho v ústach
gastritída
| menej časté
|
Poruchy kože a podkožného tkaniva
| pruritus
vyrážka
urtikária
| menej časté
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
| myalgia
| časté
|
bolesť chrbta
svalová slabosť
bolesť v končatine
| menej časté
|
Celkové poruchy a reakcie v mieste
podania
| asténia
periférny edém
| menej časté
|
Skúsenosti po uvedení lieku na trh (so statínom alebo bez neho)
|
Trieda orgánových systémov
| Nežiaduce reakcie
| Frekvencia
|
Poruchy krvi a lymfatického systému
| trombocytopénia
| neznáme
|
Poruchy nervového systému
| závrat
parestézia
| neznáme
|
Poruchy dýchacej sústavy, hrudníka a mediastína
| dyspnoe
| neznáme
|
Poruchy gastrointestinálneho traktu
| pankreatitída
zápcha
| neznáme
|
Poruchy kože a podkožného tkaniva
| multiformný erytém
| neznáme
|
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
| myalgia
myopatia/rabdomyolýza (pozri časť 4.4)
| neznáme
|
Celkové poruchy a reakcie v mieste podania
| asténia
| neznáme
|
Poruchy imunitného systému
| precitlivenosť vrátane vyrážky,
urtikárie, anafylaxie a angioedému
| neznáme
|
Poruchy pečene a žlčových ciest
| hepatitída
cholelitiáza
cholecystitída
| neznáme
|
Psychické poruchy
| depresia
| neznáme
|
Ezetimib súbežne podaný s fenofibrátom
|
Trieda orgánových systémov
| Nežiaduce reakcie
| Frekvencia
|
Poruchy gastrointestinálneho traktu
| bolesť brucha
| časté
|
V multicentrickej, dvojito zaslepenej, placebom kontrolovanej klinickej štúdii u pacientov so zmiešanou hyperlipidémiou bolo liečených 625 pacientov počas obdobia do 12 týždňov a 576 pacientov počas obdobia do 1 roka. V tejto štúdii 172 pacientov liečených ezetimibom a fenofibrátom dokončilo 12 týždňov liečby a 230 pacientov liečených ezetimibom a fenofibrátom (vrátane 109 pacientov, ktorí počas prvých 12 týždňov dostávali samotný ezetimib) dokončilo 1 rok liečby. Táto štúdia nebola usporiadaná tak, aby porovnávala liečebné skupiny podľa zriedkavých nežiaducich účinkov.
Hodnoty incidencie (95 % IS) klinicky významných zvýšení (> 3 x HHN, po sebe) sérových transamináz upravené na expozíciu liečbe boli 4,5 % (1,9; 8,8) pre monoterapiu fenofibrátom a 2,7 % (1,2; 5,4) pre ezetimib podávaný spolu s fenofibrátom. Zodpovedajúce hodnoty incidencie pre cholecystektómiu boli 0,6 % (0,0; 3,1) pre monoterapiu fenofibrátom a 1,7 % (0,6; 4,0) pre ezetimib podávaný spolu s fenofibrátom (pozri časti 4.4 a 4.5).
Pediatrická populácia (vo veku 6 až 17 rokov)V štúdii zahŕňajúcej pediatrických pacientov (vo veku 6 až 10 rokov) s heterozygotnou familiárnou alebo non-familiárnou hypercholesterolémiou (n = 138) sa zvýšenia ALT a/alebo AST (≥ 3 x HHN, po sebe) pozorovali u 1,1 % pacientov (1 pacient) liečených ezetimibom v porovnaní s 0 % v skupine s placebom. Zvýšenie CPK (≥ 10 x HHN) sa neobjavilo. Neboli hlásené prípady myopatie.
V separátnej štúdii zahŕňajúcej adolescentných pacientov (vo veku 10 až 17 rokov) s heterozygotnou familiárnou hypercholesterolémiou (n = 248) sa zvýšenia ALT a/alebo AST (≥ 3 x HHN, po sebe) pozorovali u 3 % pacientov (4 pacienti) liečených ezetimibom/simvastatínom v porovnaní s 2 % (2 pacienti) v skupine s monoterapiou simvastatínom. Zvýšenie CPK (≥ 10 násobok HHN) sa pozorovalo u 2 % pacientov (2 pacienti) liečených ezetimibom/simvastatínom a u 0 % v skupine s monoterapiou simvastatínom. Neboli hlásené prípady myopatie.
Tieto skúšania neboli vhodné na porovnanie zriedkavých nežiaducich liekových reakcií.
Pacienti s koronárnou chorobou srdca a príhodou AKS v anamnézeV štúdii IMPROVE-IT (pozri časť 5.1) zahŕňajúcej 18 144 pacientov liečených ezetimibom/simvastatínom v dávke 10/40 mg (n = 9 067, z ktorých 6 % bolo vytitrovaných na ezetimib/simvastatín 10/80 mg) alebo simvastatínom 40 mg (n = 9 077, z ktorých 27 % bolo vytitrovaných na simvastatín 80 mg), boli bezpečnostné profily počas mediánu sledovaného obdobia 6,0 rokov podobné. Miery prerušenia liečby z dôvodu nežiaducich účinkov boli 10,6 % u pacientov liečených ezetimibom/simvastatínom a 10,1 % u pacientov liečených simvastatínom. Incidencia myopatie bola u pacientov liečených ezetimibom/simvastatínom 0,2 % a u pacientov liečených simvastatínom 0,1 %, pričom myopatia bola definovaná ako nevysvetliteľná svalová slabosť alebo bolesť s hladinou CK v sére ≥ 10-násobok HHN alebo dve konsekutívne pozorovania hladiny CK ≥ 5 a < 10-násobok HHN. Incidencia rabdomyolýzy bola pri ezetimibe/simvastatíne 0,1 % a pri simvastatíne 0,2 %, pričom rabdomyolýza bola definovaná ako nevysvetliteľná svalová slabosť alebo bolesť s hladinou CK v sére ≥ 10-násobok HHN s dôkazom poškodenia obličiek, ≥ 5-násobok HHN a < 10-násobok HHN počas dvoch konsekutívnych udalostí s dôkazom poškodenia obličiek alebo hladinou CK ≥ 10,000 IU/l bez dôkazu poškodenia obličiek. Incidencia konsekutívnych zvýšení transamináz (≥ 3 x HHN) bola 2,5 % pri ezetimibe/simvastatíne a 2,3 % pri simvastatíne. (Pozri časť 4.4). Nežiaduce účinky súvisiace so žlčníkom boli hlásené u 3,1 % pacientov s ezetimibom/simvastatínom oproti 3,5 % pacientov so simvastatínom. Incidencia hospitalizácií z dôvodu cholecystektómie bola v obidvoch liečebných skupinách 1,5 %. Rakovina (definovaná ako akákoľvek nová malignita) sa počas skúšania diagnostikovala u 9,4 % pacientov s ezetimibom/simvastatínom oproti 9,5 % pacientov so simvastatínom.
Pacienti s chronickým ochorením obličiekV štúdii ochrany srdca a obličiek (
Study of Heart and Renal Protection, SHARP) (pozri časť 5.1), do ktorej bolo zapojených viac ako 9 000 pacientov liečených kombináciou fixných dávok 10 mg ezetimibu s 20 mg simvastatínu denne (n = 4 650) alebo placebom (n = 4 620), boli bezpečnostné profily počas mediánu sledovaného obdobia 4,9 rokov porovnateľné. V tomto skúšaní sa zaznamenávali len závažné nežiaduce udalosti a vysadenia lieku z dôvodu akýchkoľvek nežiaducich udalostí. Miery vysadenia lieku z dôvodu nežiaducich udalostí boli porovnateľné (10,4 % u pacientov liečených ezetimibom v kombinácii so simvastatínom, 9,8 % u pacientov liečených placebom). Výskyt myopatie/rabdomyolýzy bol 0,2 % u pacientov liečených ezetimibom v kombinácii so simvastatínom a 0,1 % u pacientov liečených placebom. Následné zvýšenia transamináz (> 3 x HHN) sa objavili u 0,7 % pacientov liečených ezetimibom v kombinácii so simvastatínom v porovnaní s 0,6 % pacientov liečených placebom. V tomto skúšaní sa neobjavili žiadne štatisticky významné zvýšenia výskytu vopred špecifikovaných nežiaducich udalostí vrátane rakoviny (9,4 % pri ezetimibe v kombinácii so simvastatínom, 9,5 % pri placebe), hepatitídy, cholecystektómie alebo komplikácií žlčových kameňov alebo pankreatitídy.
Laboratórne hodnotyV kontrolovaných klinických skúšaniach monoterapie bola incidencia klinicky významného zvýšenia sérových transamináz (ALT a/alebo AST ≥ 3 x HHN, po sebe) podobná pri ezetimibe (0,5 %) a placebe (0,3 %). V štúdiách súčasného podávania bola incidencia 1,3 % u pacientov liečených ezetimibom v kombinácii so statínom a 0,4 % u pacientov liečených samotným statínom. Tieto zvýšenia boli vo všeobecnosti asymptomatické, neboli spojené s cholestázou a vrátili sa do východiskových hodnôt po prerušení liečby alebo pri jej pokračovaní (pozri časť 4.4).
V klinických skúšaniach bola CPK > 10 x HHN hlásená u 4 z 1 674 (0,2 %) pacientov, ktorí dostávali ezetimib samotný oproti 1 zo 786 (0,1 %) pacientov, ktorí dostávali placebo, a u 1 z 917 (0,1 %) pacientov, ktorí dostávali súčasne ezetimib a statín oproti 4 z 929 (0,4 %) pacientov, ktorí dostávali samotný statín. V porovnaní s príslušným kontrolným ramenom (placebo alebo samotný statín) sa v súvislosti s ezetimibom nevyskytla nadmerná myopatia alebo rabdomyolýza (pozri časť 4.4).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
V klinických štúdiách bolo podávanie ezetimibu 15 zdravým jedincom v dávke 50 mg/deň až po dobu 14 dní alebo 18 pacientom s primárnou hypercholesterolémiou v dávke 40 mg/deň až po dobu 56 dní vo všeobecnosti dobre tolerované. Po jednorazovej perorálnej dávke 5 000 mg/kg ezetimibu u potkanov a myší a 3 000 mg/kg u psov sa u týchto zvierat nepozorovala žiadna toxicita.
Bolo hlásených niekoľko prípadov predávkovania ezetimibom: väčšina nebola spojená s nežiaducimi účinkami. Hlásené nežiaduce účinky neboli závažné. V prípade predávkovania je potrebné použiť symptomatické a podporné opatrenia.
5. Farmakologické vlastnosti5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné látky upravujúce lipidy; ATC kód: C10AX09
Mechanizmus účinku
Ezetimib patrí do novej triedy látok znižujúcich lipidy, ktoré selektívne inhibujú črevnú absorpciu cholesterolu a príbuzných rastlinných sterolov. Ezetimib je aktívny po perorálnom podaní a má mechanizmus účinku, ktorý sa líši od iných skupín látok znižujúcich cholesterol (napr. statínov, sekvestrantov žlčových kyselín [živíc], fibrátov a rastlinných stanolov). Molekulárnym cieľom ezetimibu je sterolový transportér Niemann-Pick C1-Like 1 (NPC1L1), ktorý je zodpovedný za intestinálne vychytávanie cholesterolu a fytosterolov.
Ezetimib sa viaže na kefkovitý lem sliznice tenkého čreva a inhibuje absorpciu cholesterolu, čo vedie k zníženiu dodania črevného cholesterolu do pečene; statíny znižujú syntézu cholesterolu v pečeni, a tieto odlišné mechanizmy účinku spolu poskytujú doplňujúcu redukciu cholesterolu. V dvojtýždňovej klinickej štúdii u 18 hypercholesterolemických pacientov inhiboval ezetimib v porovnaní s placebom absorpciu cholesterolu v čreve o 54 %.
Farmakodynamické účinky
Na určenie selektivity ezetimibu na inhibíciu absorpcie cholesterolu sa vykonali série predklinických štúdií. Ezetimib inhiboval absorpciu [
14C]-cholesterolu, pričom nemal žiadny účinok na absorpciu triglyceridov, mastných kyselín, žlčových kyselín, progesterónu, etinylestradiolu alebo v tukoch rozpustných vitamínov A a D.
Epidemiologické štúdie preukázali, že kardiovaskulárna morbidita a mortalita sa priamoúmerne mení s hladinou celkového-C a LDL-C a nepriamoúmerne s hladinou HDL-C.
Podávanie ezetimibu so statínom je účinné v znižovaní rizika kardiovaskulárnych príhod u pacientov s koronárnou chorobou srdca a príhodou AKS v anamnéze.
KLINICKÁ ÚČINNOSŤ A BEZPEČNOSŤV kontrolovaných klinických skúšaniach ezetimib v monoterapii aj súbežne podávaný so statínom signifikantne znížil celkový cholesterol (celkový-C), cholesterol lipoproteínov s nízkou hustotou (LDL‑C), apolipoproteín B (Apo B), triglyceridy (TG) a zvýšil cholesterol vysokodenzitných lipoproteínov (HDL-C) u pacientov s hypercholesterolémiou.
Primárna hypercholesterolémiaV dvojito zaslepenej, placebom kontrolovanej, 8-týždňovej štúdii u 769 pacientov s hypercholesterolémiou, ktorí už dostávali monoterapiu statínom a nedosiahli cieľovú hladinu LDL-C podľa „National Cholesterol Education Program (NCEP)“ (2,6 až 4,1 mmol/l [100 až 160 mg/dl] v závislosti od vstupných hodnôt) boli pacienti randomizovaní tak, aby dostávali k doterajšej liečbe statínom buď 10 mg ezetimibu alebo placebo.
Spomedzi pacientov liečených statínmi, ktorí pri vstupe do štúdie nespĺňali cieľovú hladinu LDL-C (~82 %), dosiahlo cieľovú hodnotu LDL-C na konci štúdie 72 % pacientov randomizovaných na ezetimib a 19 % pacientov randomizovaných na placebo. Korešpondujúce zníženia LDL-C boli signifikantne rozdielne (25 % pre ezetimib a 4 % pre placebo). Okrem toho, ezetimib pridaný k prebiehajúcej liečbe statínom v porovnaní s placebom signifikantne znížil celkový-C, Apo B, TG a zvýšil HDL-C. Ezetimib alebo placebo pridané k liečbe statínom znížili medián C-reaktívneho proteínu o 10 % a 0 % v tomto poradí, oproti východiskovým hodnotám.
V dvoch dvojito zaslepených, randomizovaných, placebom kontrolovaných, 12-týždňových štúdiách u 1 719 pacientov s primárnou hypercholesterolémiou ezetimibu v dávke 10 mg v porovnaní s placebom signifikantne znížil celkový-C (13 %), LDL-C (19 %), Apo B (14 %) a TG (8 %) a zvýšil HDL-C (3 %). Navyše ezetimib nemal žiadny účinok na plazmatické koncentrácie v tukoch rozpustných vitamínov A, D a E, nemal žiadny účinok na protrombínový čas a tak, ako ostatné látky znižujúce lipidy, neovplyvnil tvorbu adrenokortikálneho steroidného hormónu.
V multicentrickej, dvojito zaslepenej, kontrolovanej klinickej štúdii (ENHANCE) bolo 720 pacientov s heterozygotnou familiárnou hypercholesterolémiou randomizovaných na ezetimib 10 mg v kombinácii so simvastatínom 80 mg (n = 357) alebo na simvastatín 80 mg (n = 363) počas 2 rokov. Primárnym cieľom štúdie bolo preskúmať účinok kombinovanej liečby ezetimib/simvastatín na hrúbku vrstvy intima-média (intima-media thickness, IMT) krčnej tepny v porovnaní s monoterapiou simvastatínom. Vplyv tohto zástupného markera na kardiovaskulárnu morbiditu a mortalitu nie je stále preukázaný.
Primárny cieľový ukazovateľ, zmena priemernej hodnoty IMT všetkých šiestich segmentov krčnej tepny meraná ultrazvukom v B móde, sa medzi dvoma liečebnými skupinami signifikantne nelíšil (p = 0,29). Počas dvojročného trvania štúdie sa hrúbka vrstvy intima-média zväčšila o 0,0111 mm pri ezetimibe 10 mg v kombinácii so simvastatínom 80 mg (východisková priemerná hodnota karotickej IMT 0,68 mm) a o 0,0058 mm pri samotnom simvastatíne 80 mg (východisková priemerná hodnota karotickej IMT 0,69 mm).
Ezetimib 10 mg v kombinácii so simvastatínom 80 mg znížil LDL-C, celkový-C, Apo B a TG signifikantne viac ako simvastatín 80 mg. Percentuálne zvýšenie HDL-C bolo podobné pre obe liečebné skupiny. Nežiaduce účinky hlásené pre ezetimib 10 mg v kombinácii so simvastatínom 80 mg boli zhodné s jeho známym bezpečnostným profilom.
Pediatrická populácia (vo veku 6 až 17 rokov)V multicentrickej, dvojito zaslepenej, kontrolovanej štúdii bolo 138 pacientov (59 chlapcov a 79 dievčat), vo veku 6 až 10 rokov (priemerný vek 8,3 rokov) s heterozygotnou familiárnou alebo non-familiárnou hypercholesterolémiou (HeFH) s východiskovými hladinami LDL-C medzi 3,74 a 9,92 mmol/l, randomizovaných buď na ezetimib 10 mg alebo na placebo počas 12 týždňov.V 12. týždni ezetimib v porovnaní s placebom signifikantne znížil celkový-C (-21 % oproti 0 %), LDL-C (-28 % oproti -1 %), Apo B (-22 % oproti 1 %), a non-HDL-C (-26 % oproti 0 %). Výsledky u týchto dvoch liečebných skupín boli podobné pre TG a HDL-C (‑6 % oproti +8 % a +2 % oproti +1 % v tomto poradí).
V multicentrickej, dvojito zaslepenej, kontrolovanej štúdii bolo 142 chlapcov (Tannerovo štádium II a vyššie) a 106 dievčat po menarché, vo veku 10 až 17 rokov (priemerný vek 14,2 rokov) s heterozygotnou familiárnou hypercholesterolémiou (HeFH) s východiskovými hladinami LDL-C medzi 4,1 a 10,4 mmol/l randomizovaných buď na ezetimib 10 mg podávaný spolu so simvastatínom (10, 20 alebo 40 mg) alebo na samotný simvastatín (10, 20 alebo 40 mg) počas 6 týždňov, ďalej na ezetimib podávaný spolu so simvastatínom 40 mg alebo na samotný simvastatín 40 mg počas ďalších 27 týždňov a následne na otvorené súbežné podávanie ezetimibu a simvastatínu (10, 20 alebo 40 mg) počas ďalších 20 týždňov.
V šiestom týždni ezetimib podávaný spolu so simvastatínom (všetky dávky) v porovnaní so samotným simvastatínom (všetky dávky) signifikantne znížil celkový-C (38 % oproti 26 %), LDL-C (49 % oproti 34 %), Apo B (39 % oproti 27 %), a non-HDL-C (47 % oproti 33 %). Výsledky týchto liečebných skupín boli podobné pre TG (‑17 % oproti ‑12 %) a HDL-C (+7% oproti +6 %). V 33. týždni boli výsledky konzistentné s výsledkami zo šiesteho týždňa a signifikantne viac pacientov užívajúcich ezetimib a simvastatín 40 mg (62 %) dosiahlo ideálny cieľ podľa NCEP APP (< 2,8 mmol/l [110 mg/dl]) pre LDL-C v porovnaní s pacientmi užívajúcimi samotný simvastatín 40 mg (25 %). V 53. týždni, na konci otvoreného predĺženia, boli účinky na lipidové parametre zachované.
Bezpečnosť a účinnosť ezetimibu podávaného spolu s dávkami simvastatínu nad 40 mg denne sa u pediatrických pacientov vo veku 10 až 17 rokov neštudovali. Bezpečnosť a účinnosť ezetimibu podávaného spolu so simvastatínom sa u pediatrických pacientov vo veku do 10 rokov neštudovali. Dlhodobá účinnosť terapie ezetimibom u pacientov mladších ako 17 rokov na zníženie morbidity a mortality v dospelosti sa neštudovala.
Prevencia kardiovaskulárnych príhodSkúšanie IMProved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT) bolo multicentrickou, randomizovanou, dvojito zaslepenou štúdiou s aktívnym komparátorom zahŕňajúcou 18 144 pacientov zaradených v priebehu 10 dní od hospitalizácie z dôvodu akútneho koronárneho syndrómu (AKS, buď akútny infarkt myokardu [IM] alebo nestabilná angína pektoris [NAP]). Pacienti mali v čase AKS LDL‑C ≤ 125 mg/dl (≤ 3,2 mmol/l), ak neužívali liečbu na zníženie tukov alebo ≤ 100 mg/dl (≤ 2,6 mmol/l), ak užívali liečbu na zníženie tukov. Všetci pacienti boli randomizovaní v pomere 1:1 na užívanie ezetimibu/simvastatínu v dávke 10/40 mg (n = 9 067) alebo simvastatínu 40 mg (n = 9 077) a sledovaní počas mediánu 6,0 rokov.
Priemerný vek pacientov bol 63,6 rokov; 76 % bolo mužov, 84 % belochov a 27 % diabetikov. Priemerná hodnota LDL‑C v čase príhody spĺňajúcej podmienky na zaradenie do štúdie bola 80 mg/dl (2,1 mmol/l) u pacientov užívajúcich liečbu na zníženie tukov (n = 6 390) a 101 mg/dl (2,6 mmol/l) u pacientov bez predchádzajúcej liečby na zníženie tukov (n = 11 594). Pred hospitalizáciou z dôvodu príhody AKS spĺňajúcej podmienky na zaradenie do štúdie bolo 34 % pacientov na liečbe statínom. U pacientov pokračujúcich v liečbe bola po jednom roku priemerná LDL-C 53,2 mg/dl (1,4 mmol/l) v skupine užívajúcej ezetimib/simvastatín a 69,9 mg/dl (1,8 mmol/l) v skupine užívajúcej simvastatín v monoterapii. Hodnoty lipidov sa vo všeobecnosti určovali pre pacientov, ktorí pokračovali v skúšanej liečbe.
Primárny cieľový ukazovateľ bol zložený z kardiovaskulárneho úmrtia, veľkých koronárnych príhod (MCE [major coronary events], definované ako nefatálny infarkt myokardu, dokumentovaná nestabilná angína pektoris vyžadujúca hospitalizáciu alebo akýkoľvek koronárny revaskularizačný výkon, ktorý sa uskutočnil aspoň 30 dní po randomizovanom priradení liečby) a nefatálnej cievnej mozgovej príhody. Štúdia preukázala, že liečba ezetimibom súbežne so simvastatínom poskytla dodatočný prínos pri znižovaní primárneho cieľového ukazovateľa zloženého z kardiovaskulárneho úmrtia, MCE a nefatálnej cievnej mozgovej príhody v porovnaní so samotným simvastatínom (zníženie relatívneho rizika 6,4 %, p = 0,016). Primárny cieľový ukazovateľ sa vyskytol u 2 572 z 9 067 pacientov (7-ročná Kaplanova-Meierova [KM] hodnota 32,72 %) v skupine užívajúcej ezetimib/simvastatín a u 2 742 z 9 077 pacientov (7 ročná KM hodnota 34,67 %) v skupine užívajúcej samotný simvastatín. (Pozri obrázok 1 a tabuľku 1). Očakáva sa, že tento dodatočný prínos je podobný pri súbežnom podávaní s inými statínmi, u ktorých bolo preukázané, že sú účinné v znižovaní rizika kardiovaskulárnych príhod. Celková úmrtnosť sa v tejto vysoko rizikovej skupine nezmenila (pozri tabuľku 1).
Pre všetky typy cievnej mozgovej príhody sa pozoroval celkový prínos, avšak v skupine užívajúcej ezetimib so simvastatínom sa pozoroval nesignifikantný nárast hemoragickej cievnej mozgovej príhody v porovnaní so skupinou so samotným simvastatínom (pozri tabuľku 1). Riziko hemoragickej cievnej mozgovej príhody pri podávaní ezetimibu súbežne s účinnejšími statínmi sa v dlhodobých štúdiách nehodnotilo.
Účinok liečby ezetimibom/simvastatínom bol vo všeobecnosti zhodný s celkovými výsledkami medzi mnohými podskupinami zahŕňajúcimi pohlavie, vek, rasu, diabetes mellitus v anamnéze, východiskové hladiny lipidov, predchádzajúcu liečbu statínom, predchádzajúcu cievnu mozgovú príhodu a hypertenziu.
Obrázok 1: Účinok ezetimibu/simvastatínu na primárny zložený cieľový ukazovateľ kardiovaskulárneho úmrtia, veľkej koronárnej príhody alebo nefatálnej cievnej mozgovej príhody
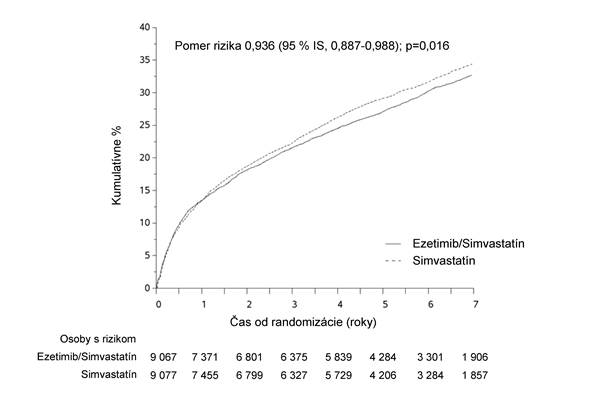
Tabuľka 1
Veľké kardiovaskulárne príhody podľa liečebnej skupiny u všetkých randomizovaných pacientov v štúdii IMPROVE-IT
Výsledok
| Ezetimib/Simvastatín 10/40 mga
(n = 9 067)
| Simvastatín 40 mgb
(n = 9 077)
| Pomer rizika
(95 % IS)
| Hodnota p
|
| n
| K-M %c
| n
| K-M % c
|
|
|
Primárny zložený cieľový ukazovateľ účinnosti
|
(KV úmrtie, veľké koronárne príhody a nefatálna cievna mozgová príhoda)
| 2 572
| 32,72 %
| 2 742
| 34,67 %
| 0,936 (0,887; 0,988)
| 0,016
|
Sekundárny zložený cieľový ukazovateľ účinnosti
|
Úmrtie z dôvodu KCHS, nefatálny IM, naliehavá koronárna revaskularizácia po 30 dňoch
| 1 322
| 17,52 %
| 1 448
| 18,88 %
| 0,912 (0,847; 0,983)
| 0,016
|
MCE, nefatálna cievna mozgová príhoda, úmrtie (všetky príčiny)
| 3 089
| 38,65 %
| 3 246
| 40,25 %
| 0,948 (0,903; 0,996)
| 0,035
|
KV úmrtie, nefatálny IM, nestabilná angína pektoris vyžadujúca hospitalizáciu, akákoľvek revaskularizácia, nefatálna cievna mozgová príhoda
| 2 716
| 34,49 %
| 2 869
| 36,20 %
| 0,945 (0,897; 0,996)
| 0,035
|
Zložky primárneho zloženého cieľového ukazovateľa a vybrané cieľové ukazovatele účinnosti (prvý výskyt špecifikovanej príhody v akomkoľvek čase)
|
Kardiovaskulárne úmrtie
| 537
| 6,89 %
| 538
| 6,84 %
| 1,000 (0,887; 1,127)
| 0,997
|
Veľká koronárna príhoda:'
|
|
|
|
|
|
|
Nefatálny IM
| 945
| 12,77 %
| 1 083
| 14.41 %
| 0,871 (0,798; 0,950)
| 0,002
|
Nestabilná angína pektoris vyžadujúca hospitalizáciu
| 156
| 2,06 %
| 148
| 1,92 %
| 1,059 (0,846; 1,326)
| 0,618
|
Koronárna revaskularizácia po 30 dňoch
| 1 690
| 21.84 %
| 1 793
| 23,36 %
| 0,947 (0,886; 1,012)
| 0,107
|
Nefatálna cievna mozgová príhoda
| 245
| 3.49 %
| 305
| 4,24 %
| 0,802 (0,678; 0,949)
| 0,010
|
IM (fatálny a nefatálny)
| 977
| 13.13 %
| 1 118
| 14,82 %
| 0,872 (0,800; 0,950)
| 0,002
|
Cievna mozgová príhoda (fatálna a nefatálna)
| 296
| 4.16 %
| 345
| 4,77 %
| 0,857 (0,734; 1,001)
| 0,052
|
Nehemoragická cievna mozgová príhodad
| 242
| 3.48 %
| 305
| 4,23 %
| 0,793 (0,670; 0,939)
| 0,007
|
Hemoragická cievna mozgová príhoda
| 59
| 0.77 %
| 43
| 0,59 %
| 1,377 (0,930; 2,040)
| 0,110
|
Úmrtie z akejkoľvek príčiny
| 1 215
| 15.36 %
| 1 231
| 15,28 %
| 0,989 (0,914; 1,070)
| 0,782
|
6 % bolo vytitrovaných na ezetimib/simvastatín 10/80 mg.
b 27 % bolo vytitrovaných na simvastatín 80 mg.
c Odhad v 7.roku podľa Kaplana-Meiera.
d Zahŕňa ischemickú cievnu mozgovú príhodu alebo cievnu mozgovú príhodu neurčeného typu.
Homozygotná familiárna hypercholesterolémia (HoFH)Dvojito zaslepená, randomizovaná, 12-týždňová štúdia zahŕňala 50 pacientov s klinickou a/alebo genotypovou diagnózou HoFH, ktorí dostávali atorvastatín alebo simvastatín (40 mg) so súčasnou LDL aferézou alebo bez nej. Ezetimib podávaný súbežne s atorvastatínom (40 alebo 80 mg) alebo simvastatínom (40 alebo 80 mg) signifikantne znížil LDL-C o 15 % v porovnaní so zvýšením dávky simvastatínu alebo atorvastatínu z 40 mg na 80 mg pri monoterapii.
Prevencia veľkých vaskulárnych príhod pri chronickom ochorení obličiek (Chronic Kidney Disease, CKD)Štúdia ochrany srdca a obličiek (
Study of Heart and Renal Protection, SHARP) bola multinárodná randomizovaná, placebom kontrolovaná, dvojito zaslepená štúdia, ktorá sa vykonala u 9 438 pacientov s chronickým ochorením obličiek, z ktorých tretina bola na začiatku štúdie na hemodialýze. Celkovo bolo 4 650 pacientov zaradených na kombináciu fixných dávok ezetimibu 10 mg a 20 mg simvastatínu a 4 620 na placebo a pacienti boli sledovaní počas mediánu 4,9 rokov. Priemerný vek pacientov bol 62 rokov a 63 % boli muži, 72 % boli pacienti kaukazskej rasy, 23 % boli diabetici a u nehemodialyzovaných pacientov bola priemerná odhadovaná rýchlosť glomerulárnej filtrácie (eGFR) 26,5 ml/min/1,73 m
2. Neexistovali žiadne kritéria na zaradenie, ktoré sa týkali lipidov. Priemerná východisková hladina LDL-C bola 108 mg/dl. Vrátane pacientov, ktorí už viac neužívali skúšaný liek, došlo po jednom roku k zníženiu hladiny LDL-C samotným simvastatínom 20 mg o 26 % a ezetimibom 10 mg v kombinácii s 20 mg simvastatínu o 38 % v porovnaní s placebom.
Primárnym porovnaním špecifikovaným protokolom štúdie SHARP bola analýza podľa zámeru liečiť (
intention to treat) „veľké vaskulárne príhody“ (
major vascular events MVE, definované ako nefatálny IM alebo kardiálna smrť, cievna mozgová príhoda alebo akýkoľvek revaskularizačný výkon) len u tých pacientov, ktorí boli na začiatku randomizovaní do skupiny s ezetimibom v kombinácii so simvastatínom (n = 4 193) alebo do skupiny s placebom (n = 4 191). Sekundárne analýzy zahŕňali rovnaký kompozitný ukazovateľ analyzovaný v celej kohorte randomizovanej (na začiatku štúdie alebo po prvom roku) na ezetimib v kombinácii so simvastatínom (n = 4 650) alebo na placebo (n = 4 620), ako aj zložky tohto kompozitného ukazovateľa.
Analýza primárneho cieľového ukazovateľa preukázala, že ezetimib v kombinácii so simvastatínom signifikantne znížil riziko veľkých vaskulárnych príhod (749 pacientov s príhodami v skupine s placebom oproti 639 v skupine s ezetimibom v kombinácii so simvastatínom) s relatívnym znížením rizika o 16 % (p = 0,001).
Tento dizajn štúdie neumožňoval zistiť separátny prínos samotného ezetimibu k účinnosti signifikantne znížiť riziko veľkých vaskulárnych príhod u pacientov s CKD.
Jednotlivé zložky MVE u všetkých randomizovaných pacientov sú uvedené v tabuľke 1. Ezetimib v kombinácii so simvastatínom signifikantne znížil riziko cievnej mozgovej príhody a akejkoľvek revaskularizácie, s nevýznamnými číselnými odlišnosťami podporujúcimi ezetimib v kombinácii so simvastatínom pri nefatálnom IM a kardiálnej smrti.
Tabuľka 2
Veľké vaskulárne príhody podľa liečebnej skupiny u všetkých randomizovaných pacientov v štúdii SHARP
aVýsledok
| Ezetimib 10 mg v kombinácii s 20 mg simvastatínu
(N = 4 650)
| Placebo
(N = 4 620)
| Pomer rizika
(IS 95 %)
| hodnota P
|
Veľké vaskulárne príhody
| 701 (15,1 %)
| 814 (17,6 %)
| 0,85 (0,77-0,94)
| 0,001
|
Nefatálny IM
| 134 (2,9 %)
| 159 (3,4 %)
| 0,84 (0,66-1,05)
| 0,12
|
Kardiálna smrť
| 253 (5,4 %)
| 272 (5,9 %)
| 0,93 (0,78-1,10)
| 0,38
|
Akákoľvek cievna mozgová príhoda
| 171 (3,7 %)
| 210 (4,5 %)
| 0,81 (0,66-0,99)
| 0,038
|
Nehemoragická cievna mozgová príhoda
| 131 (2,8 %)
| 174 (3,8 %)
| 0,75 (0,60-0,94)
| 0,011
|
Hemoragická cievna mozgová príhoda
| 45 (1,0 %)
| 37 (0,8 %)
| 1,21 (0,78-1,86)
| 0,40
|
Akákoľvek revaskularizácia
| 284 (6,1 %)
| 352 (7,6 %)
| 0,79 (0,68-0,93)
| 0,004
|
Veľké aterosklerotické príhody (Major Atherosclerotic Events, MAE)b
| 526 (11,3 %)
| 619 (13,4 %)
| 0,83 (0,74-0,94)
| 0,002
|
a Analýza podľa zámeru liečiť u všetkých pacientov v štúdii SHARP randomizovaných na ezetimib v kombinácii so simvastatínom alebo na placebo buď na začiatku alebo po prvom roku.
b MAE; definované ako kombinácia nefatálneho infarktu myokardu, koronárnej smrti, nehemoragickej cievnej mozgovej príhody alebo akejkoľvek revaskularizácie.
Absolútne zníženie LDL cholesterolu dosiahnuté ezetimibom v kombinácii so simvastatínom bolo nižšie u pacientov s nižšou východiskovou hladinou LDL-C (< 2,5 mmol/l) a u pacientov na dialýze na začiatku ako u ostatných pacientov a zodpovedajúce zníženia rizika v týchto dvoch skupinách boli zoslabené.
Aortálna stenózaMulticentrická, dvojito zaslepená, placebom kontrolovaná štúdia „Simvastatín a Ezetimib na liečbu aortálnej stenózy“ (Simvastatin and Ezetimibe for the Treatment of Aortic Stenosis, SEAS) s mediánom trvania 4,4 roka sa uskutočnila u 1 873 pacientov s asymptomatickou aortálnou stenózou (AS) zdokumentovanou pomocou Dopplerovho merania maximálnej rýchlosti prúdenia aortou v rozmedzí 2,5 až 4,0 m/s. Do štúdie boli zaradení len tí pacienti, u ktorých sa zvážilo, že nie je potrebná liečba statínmi za účelom zníženia rizika aterosklerotického kardiovaskulárneho ochorenia. Pacienti boli randomizovaní v pomere 1:1 a dostávali placebo alebo im bol denne súbežne podávaný ezetimib 10 mg a simvastatín 40 mg.
Primárnym cieľovým ukazovateľom bola kombinácia veľkých kardiovaskulárnych príhod (major cardiovascular events, MCE) pozostávajúca z kardiovaskulárnej smrti, chirurgickej náhrady aortálnej chlopne (aortic valve replacement, AVR), kongestívneho srdcového zlyhania (congestive heart failure, CHF) v dôsledku progresie AS, nefatálneho infarktu myokardu, bypassu koronárnej artérie (coronary artery bypass grafting, CABG), perkutánnej koronárnej intervencie (percutaneous coronary intervention, PCI), hospitalizácie pre nestabilnú angínu pektoris a nehemoragickej cievnej mozgovej príhody. Kľúčovými sekundárnymi cieľovými ukazovateľmi boli kombinácie podskupín kategórií udalostí primárneho cieľového ukazovateľa.
Ezetimib/simvastatín 10/40 mg v porovnaní s placebom signifikantne neznížili riziko MCE.
Primárny výsledok sa vyskytol u 333 pacientov (35,3 %) v skupine ezetimib/simvastatín a u 355 pacientov (38,2 %) v skupine s placebom (pomer rizika v skupine ezetimib/simvastatín 0,96; 95% interval spoľahlivosti 0,83 až 1,12; p = 0,59). Náhrada aortálnej chlopne sa uskutočnila u 267 pacientov (28,3 %) v skupine ezetimib/simvastatín a u 278 pacientov (29,9 %) v skupine s placebom (pomer rizika 1,00; 95% IS: 0,84 až 1,18; p = 0,97). V skupine ezetimib/simvastatín (n = 148) malo menej pacientov ischemické kardiovaskulárne príhody ako v skupine s placebom (n = 187) (pomer rizika 0,78; 95% IS 0,63 až 0,97; p = 0,02) predovšetkým kvôli menšiemu počtu pacientov, ktorí podstúpili bypass koronárnej artérie.
V skupine ezetimib/simvastatín sa častejšie vyskytovala rakovina (105 oproti 70, p = 0,01). Klinický význam tohto zistenia nie je jasný, pretože vo väčšom skúšaní SHARP sa celkový počet pacientov s akýmkoľvek prípadom rakoviny (438 pri ezetimibe/simvastatíne oproti 439 v skupine s placebom) nelíšil, a preto zistenie skúšania SEAS nie je možné potvrdiť štúdiou SHARP. Okrem toho, v skúšaní IMPROVE-IT sa celkový počet pacientov s akoukoľvek novou malignitou (853 v skupine užívajúcej ezetimib/simvastatín oproti 863 v skupine so simvastatínom) signifikantne nelíšil a preto zistenia zo skúšania SEAS nie je možné potvrdiť skúšaním SHARP alebo IMPROVE-IT.
5.2 Farmakokinetické vlastnostiAbsorpciaPo perorálnom podaní je ezetimib rýchlo absorbovaný a intenzívne konjugovaný na farmakologicky aktívny fenolový glukuronid (ezetimib-glukuronid). Priemerné maximálne plazmatické koncentrácie (C
max) dosiahne ezetimib-glukuronid za 1 až 2 hodiny a ezetimib za 4 až 12 hodín. Absolútna biologická dostupnosť ezetimibu nemôže byť stanovená, pretože zlúčenina je prakticky nerozpustná vo vodných médiách vhodných pre injekciu.
Súčasné podávanie jedla (s vysokým obsahom tuku alebo bez tuku) nemalo žiadny vplyv na perorálnu biologickú dostupnosť ezetimibu podávaného ako 10 mg tablety ezetimibu. Ezetimib sa môže podávať s jedlom alebo bez jedla.
Distribúcia99,7 % ezetimibu a 88 až 92 % ezetimib-glukuronidu sa viaže na ľudské plazmatické proteíny.
BiotransformáciaEzetimib je primárne metabolizovaný v tenkom čreve a v pečeni cez konjugáciu na glukuronid (reakcia fázy II) s následným vylučovaním do žlče. U všetkých vyšetrovaných druhov sa pozoroval minimálny oxidatívny metabolizmus (reakcia fázy I). Ezetimib a ezetimib-glukuronid sú hlavné od liečiva odvodené zlúčeniny detekované v plazme a tvoria približne 10 až 20 % (ezetimib) a 80 až 90 % (ezetimib-glukuronid) celkového liečiva v plazme. Ezetimib aj ezetimib-glukuronid sú pomaly eliminované z plazmy s dokázaným signifikantným enterohepatálnym obehom. Polčas ezetimibu a ezetimib-glukuronidu je približne 22 hodín.
ElimináciaPo perorálnom podaní
14C-ezetimibu (20 mg) ľudským jedincom tvoril celkový ezetimib približne 93 % celkovej rádioaktívne značenej látky. Približne 78 % podanej rádioaktívne značenej látky sa počas 10 dní vylúčilo do stolice a 11 % do moču. Po 48 hodinách neboli v plazme zistiteľné žiadne koncentrácie rádioaktívne značenej látky.
Osobitné skupiny pacientovPediatrická populáciaFarmakokinetika ezetimibu je podobná medzi deťmi od 6 rokov a dospelými. Farmakokinetické údaje pre pediatrickú populáciu menej ako 6 rokov nie sú k dispozícii. Klinická skúsenosť u pediatrických a adolescentných pacientov zahŕňa pacientov s HoFH, HeFH.
Starší ľudiaPlazmatické koncentrácie celkového ezetimibu sú asi dvojnásobne vyššie u starších ľudí (nad 65 rokov) ako u mladých (18 až 45 ročných). Zníženie LDL-C a bezpečnostný profil sú porovnateľné u starších ľudí a mladých jedincov liečených ezetimibom. Preto u starších ľudí nie je nutná úprava dávkovania.
Porucha funkcie pečenePo podaní jednorazovej dávky 10 mg ezetimibu stúpla u pacientov s miernou poruchou funkcie pečene (Childovo-Pughovo skóre 5 alebo 6) v porovnaní so zdravými jedincami priemerná AUC celkového ezetimibu približne 1,7-krát. V 14-dňovej štúdii opakovaných dávok (10 mg denne) u pacientov so stredne ťažkou poruchou funkcie pečene (Childovo-Pughovo skóre 7 až 9) stúpla priemerná AUC celkového ezetimibu v 1. a 14. deň štvornásobne v porovnaní so zdravými jedincami. U pacientov s miernou poruchou funkcie pečene nie je nutná úprava dávkovania. Vzhľadom na neznáme účinky zvýšenej expozície ezetimibu u pacientov so stredne ťažkou a ťažkou poruchou funkcie pečene (Childovo-Pughovo skóre > 9) sa u týchto pacientov ezetimib neodporúča (pozri časť 4.4).
Porucha funkcie obličiekPo podaní jednorazovej 10 mg dávky ezetimibu stúpla priemerná AUC celkového ezetimibu u pacientov s ťažkou poruchou funkcie obličiek (n = 8; priemerný klírens kreatinínu ≤ 30 ml/min/1,73 m
2) v porovnaní so zdravými jedincami (n = 9) približne 1,5-krát. Tento výsledok nie je považovaný za klinicky významný. U pacientov s poruchou funkcie obličiek nie je potrebná úprava dávkovania.
Ďalší pacient v tejto štúdii (príjemca transplantovanej obličky, ktorý dostával mnohopočetnú liečbu vrátane cyklosporínu) mal 12-násobne vyššiu expozíciu k celkovému ezetimibu.
PohlaviePlazmatické koncentrácie celkového ezetimibu sú mierne vyššie (približne 20 %) u žien ako u mužov. Zníženie LDL-C a bezpečnostný profil sú porovnateľné u mužov a žien liečených ezetimibom. Preto nie je vzhľadom na pohlavie nutná úprava dávkovania.
5.3 Predklinické údaje o bezpečnostiTesty toxicity po opakovanom podaní ezetimibu na zvieratách neidentifikovali žiadny cieľový orgán pre toxické účinky. U psov liečených štyri týždne ezetimibom (≥ 0,03 mg/kg/deň) sa koncentrácia cholesterolu v žlčníkovej žlči zvýšila 2,5 až 3,5-krát. V jeden rok trvajúcej štúdii na psoch, ktoré dostávali dávky až do 300 mg/kg/deň, sa však nepozorovalo zvýšenie incidencie cholelitiázy alebo iné hepatobiliárne účinky. Významnosť týchto údajov pre ľudí nie je známa. Riziko litogenity pri terapeutickom použití ezetimibu sa nedá vylúčiť.
V štúdiách súbežného podávania ezetimibu a statínov boli pozorované toxické účinky v podstate tie isté, aké sú typicky spojené s užívaním statínov. Niektoré z toxických účinkov boli výraznejšie ako pozorované pri liečbe samostatnými statínmi. Toto sa pripisuje farmakokinetickým a farmakodynamickým interakciám kombinovanej liečby. V klinických štúdiách sa neobjavili žiadne takéto interakcie. Myopatie sa objavili u potkanov až po vystavení dávkam, ktoré boli niekoľkonásobne vyššie ako ľudské terapeutické dávky (približne 20-násobok AUC pre statíny a 500 až 2 000-násobok AUC pre aktívne metabolity).
V sérii
in vivo a
in vitro analýz ezetimib podávaný samostatne alebo v kombinácii so statínmi neprejavil žiadny genotoxický potenciál.
Dlhodobé testy karcinogenity ezetimibu boli negatívne.
Ezetimib nemal žiadny vplyv na fertilitu samcov a samíc potkanov, ani sa nezistila jeho teratogenicita u potkanov alebo u králikov a nemal ani vplyv na prenatálny alebo postnatálny vývoj. U gravidných potkanov a králikov, ktoré dostali opakované dávky ezetimibu 1 000 mg/kg/deň, prechádzal ezetimib cez placentárnu bariéru. Súčasné podávanie ezetimibu a statínov nebolo teratogénne u potkanov. U gravidných králikov sa pozoroval malý počet deformít skeletu (spojené hrudné a kaudálne stavce, znížený počet kaudálnych stavcov). Podávanie ezetimibu v kombinácii s lovastatínom malo za následok embryoletálne účinky.
6. Farmaceutické informácie6.1 Zoznam pomocných látokmonohydrát laktózy
laurylsíran sodný
sodná soľ kroskarmelózy
povidón K-30
stearan horečnatý
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti2 roky
Len pre balenie vo fľašiach: použite do 200 dní od prvého otvorenia.6.4 Špeciálne upozornenia na uchovávanieTento liek nevyžaduje zvláštne podmienky na uchovávanie.
Len pre balenie vo fľašiach: použite do 200 dní od prvého otvorenia.
6.5 Druh obalu a obsah baleniaPVC/Aclar-hliníkové blistre
Veľkosť balenia: 14, 28, 30, 50, 90, 98 a 100 tabliet.
HDPE fľaša s polypropylénovým viečkom s detskou poistkou a teplom zatavenou fóliou.
Veľkosť balenia: 100 tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIGlenmark Pharmaceuticals s.r.o.
Hvězdova 1716/2b
140 78 Praha 4
Česká republika
8. REGISTRAČNÉ ČÍSLO31/0512/15-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 15. decembra 2015
10. DÁTUM REVÍZIE TEXTU01/2018