
Epiduo Forte sa nemá aplikovať na poškodenú, porušenú kožu (rezné rany alebo odreniny),
slnkom spálenú alebo ekzematóznu kožu.
Liek sa nesmie dostať do kontaktu s očami, perami, ústami, nosovými dierkami ani sliznicami. Ak sa liek zanesie do oka, musí sa oko okamžite vypláchnuť teplou vodou.
Ak sa objaví reakcia naznačujúca citlivosť na ktorúkoľvek zložku, treba liečbu gélom Epiduo Forte
ukončiť.
Je potrebné sa vyhýbať nadmernému pobytu na slnku a UV žiareniu.
Epiduo Forte nemá prísť do kontaktu so žiadnym farebným materiálom vrátane vlasov a farbených tkanín, pretože môže dôjsť k vybieleniu a strate ich farby.
Tento liek obsahuje 40 mg propylénglykolu (E 1520) v každom grame, čo zodpovedá 4 % m/m, ktorý
môže vyvolať podráždenie kože.
Účinnosť a bezpečnosť gélu Epiduo Forte u pacientov s ťažkým nodulárnym alebo hlbokým nodulocystickým akné sa neskúmali. Keďže u pacientov s ťažkým nodulárnym/nodulocystickým akné je zvýšené riziko vzniku trvalých sekundárnych jaziev po léziách akné, použitie gélu Epiduo Forte
sa u týchto pacientov neodporúča z dôvodu rizika nedostatočnej terapeutickej odpovede.
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Z predchádzajúcich skúseností s adapalénom a dibenzoylperoxidom nie sú známe žiadne interakcie
s inými dermálnymi liekmi, ktoré by sa mohli používať súbežne s gélom Epiduo Forte. Napriek tomu sa nemajú súbežne používať iné retinoidy alebo dibenzoylperoxid, ani lieky s podobným
mechanizmom účinku. Pri používaní kozmetických prípravkov s deskvamačným (olupujúcim),
dráždivým alebo vysušujúcim účinkom treba postupovať opatrne, keďže môžu v kombinácii s liekom
vyvolať aditívny dráždivý účinok.
Absorpcia adapalénu ľudskou kožou je nízka (pozri časť 5.2), a preto sú interakcie so systémovo
podávanými liekmi nepravdepodobné.
Perkutánna penetrácia dibenzoylperoxidu kožou je nízka a liečivo sa úplne metabolizuje na kyselinu benzoovú, ktorá je rýchlo eliminovaná. Je preto nepravdepodobné, že by došlo k potenciálnym interakciám kyseliny benzoovej so systémovo podávanými liekmi.
4.6 Fertilita, gravidita a laktácia
Perorálne podávané retinoidy boli spájané s vrodenými poruchami. Všeobecne sa predpokladá, že ak sa lokálne podávané retinoidy používajú v súlade s preskripčnými informáciami, spôsobujú nízku systémovú expozíciu, a to z dôvodu minimálnej absorpcie kožou. Môžu však existovať individuálne faktory (napr. poškodená kožná bariéra, nadmerné použitie), ktoré prispievajú k zvýšeniu systémovej expozície.
Gravidita
Liek Epiduo Forte je kontraindikovaný v tehotenstve (pozri časť 4.3) alebo u žien, ktoré plánujú otehotnieť.
Nie sú k dispozícii žiadne údaje alebo len obmedzené údaje o lokálnom používaní adapalénu u
tehotných žien.
Štúdie na zvieratách preukázali po perorálnom podaní reprodukčnú toxicitu pri vysokej systémovej expozícii (pozri časť 5.3).
Klinické skúsenosti s lokálne používaným adapalénom a dibenzoylperoxidom v gravidite sú
obmedzené.
Ak sa liek používa počas tehotenstva alebo ak pacientka v priebehu liečby otehotnie, liečba sa má ukončiť.
Dojčenie
Neuskutočnili sa žiadne štúdie týkajúce sa vylučovania lieku do mlieka u zvierat alebo ľudí po
dermálnej aplikácii lieku Epiduo Forte.
Dostupné farmakokinetické údaje u potkanov preukázali vylučovanie adapalénu do mlieka po perorálnom alebo intravenóznom podaní adapalénu.
Riziko pre dojčené dieťa sa nedá vylúčiť.
Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu gélom Epiduo Forte, sa má urobiť po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Ak sa Epiduo Forte používa v období dojčenia, je potrebné vyhnúť sa aplikácii gélu na hrudník, aby sa
predišlo kontaktnej expozícii dojčaťa.
Fertilita
S liekom Epiduo Forte sa nevykonali žiadne štúdie týkajúce sa účinku lieku na fertilitu u ľudí.
V reprodukčných štúdiách sa však u potkanov nezistili žiadne účinky adapalénu ani dibenzoylperoxidu na fertilitu (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Epiduo Forte nemá žiadny alebo má zanedbateľný vplyv na schopnosť viesť vozidlá a obsluhovať
stroje.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Možno očakávať, že u približne 10 % pacientov sa vyskytnú nežiaduce kožné reakcie. Nežiaduce
reakcie súvisiace s liečbou, typicky spojené s použitím gélu Epiduo Forte, zahŕňajú mierne až stredne

suchosťou, erytémom a pálením/štípaním. Odporúča sa použiť hydratačný prípravok, dočasne znížiť frekvenciu aplikácie na každý druhý deň alebo dočasne prerušiť jeho používanie, kým nebude možné pokračovať v používaní raz denne.
Tieto reakcie sa zvyčajne vyskytujú na začiatku liečby a majú tendenciu sa časom postupne zmierňovať.
TabuľkovýzoznamnežiaducichreakciíNežiaduce reakcie sú roztriedené podľa triedy orgánových systémov a frekvencie použitím nasledujúcej konvencie: veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000
až < 1/100), zriedkavé (≥ 1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme
(z dostupných údajov) a s Epiduom Forte boli hlásené v klinickej štúdii fázy 3 kontrolovanej vehikulom (pozri tabuľku 1).
Tabuľka 1: Nežiaduce reakcieTrieda orgánových
systémov
| Frekvencia
| Nežiaduce reakcie
|
Poruchy oka
| Menej časté
| Erytém očného viečka
|
| Neznáme*
| Edém očného viečka
|
Poruchy imunitného
systému
| Neznáme*
| Anafylaktická reakcia
|
Poruchy nervového
systému
| Menej časté
| Parestézia (tŕpnutie v mieste aplikácie)
|
Poruchy dýchacej sústavy,
hrudníka a mediastína
| Neznáme*
| Zovretie hrdla, dyspnoe
|
Poruchy kože
a podkožného tkaniva
| Časté
| Atopická dermatitída, ekzém, pocit pálenia na
koži, podráždenie kože
|
| Menej časté
| Suchosť kože, pruritus, vyrážka
|
| Neznáme*
| Alergická kontaktná dermatitída, opuch tváre,
bolesť kože (bodavá bolesť) a pľuzgiere
(vezikuly), zmena farby kože (hyperpigmentácia alebo hypopigmentácia), urtikária, popálenina v mieste aplikácie**
|
*Údaje hlásené po celosvetovom uvedení lieku Epiduo Forte na trh z populácie neznámej veľkosti.
**Väčšinu prípadov „popáleniny v mieste aplikácie“ predstavovali povrchové popáleniny, ale boli
hlásené prípady s popáleninami druhého stupňa alebo so závažnou reakciou na popálenie.
Nežiaduce udalosti súvisiace s kožou sa vyskytovali častejšie pri géle Epiduo Forte než pri géle Epiduo (adapalén 1 mg/g + dibenzoylperoxid 25 mg/g) v porovnaní s vehikulom. V pivotnej štúdii (pozri časť 5.1) malo 9,2 % osôb v kombinovanej populácii liečenej gélom Epiduo Forte nežiaduce účinky súvisiace s kožou a 3,7 % v populácii liečenej gélom Epiduo v porovnaní so skupinou s vehikulovým gélom (2,9 %).
Okremvyššieuvedených boli hlásenéaj ďalšienežiaducereakcienaliekEpiduogél(adapalén1mg/g+ dibenzoylperoxid 25 mg/g), predtým schválenej fixnej kombinácie adapalén + dibenzoylperoxid:
- Klinické štúdie:
Ďalšie nežiaduce reakcie na liek hlásené v klinických štúdiách s gélom Epiduo sú dráždivá kontaktná dermatitída (časté) a spálenie od slnka (menej časté).
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.
4.9 Predávkovanie
Epiduo Forte je určený len na dermálne použitie raz denne. Nadmerné používanie lieku Epiduo Forte môže spôsobiť závažné podráždenie. V takom prípade sa má liečba prerušiť a počkať do zotavenia kože.
V prípade neúmyselného požitia lieku sa musia prijať príslušné symptomatické opatrenia.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: liečivá proti akné na lokálne použitie, D10AD retinoidy na lokálne použitie na akné, ATC kód: D10AD53
Mechanizmusúčinku a farmakodynamickéúčinky
Epiduo Forte je kombináciou dvoch liečiv, ktoré pôsobia rôznymi, ale komplementárnymi mechanizmami účinku.
- Adapalén: Adapalén je chemicky stabilný derivát kyseliny naftalénkarboxylovej s aktivitou podobnou retinoidu. Štúdie biochemického a farmakologického profilu preukázali, že adapalén pôsobí v patológii acne vulgaris: je silným modulátorom bunkovej diferenciácie a keratinizácie a má protizápalové vlastnosti. Mechanisticky sa adapalén viaže na špecifické jadrové receptory kyseliny retinovej. Súčasné dôkazy naznačujú, že lokálne aplikovaný adapalén normalizuje diferenciáciu folikulárnych epitelových buniek s následným znížením tvorby mikrokomedónov. Adapalén
pri testovaní in vitro inhibuje chemotaktické (riadené) a chemokinetické (náhodné) odpovede
polymorfonukleárnych leukocytov u ľudí a inhibuje tiež metabolizmus kyseliny arachidónovej
na mediátory zápalu. Štúdie in vitro preukázali inhibíciu faktorov AP-1 a inhibíciu expresie „toll-like“
receptorov 2. Tento profil naznačuje, že adapalén zmierňuje bunkami sprostredkovanú zápalovú zložku akné.
- Dibenzoylperoxid: Dibenzoylperoxid má preukázaný antimikrobiálny účinok, najmä proti Cutibacterium acnes, ktorý je abnormálne prítomný v pilosebaceóznej jednotke postihnutej akné. Mechanizmus účinku dibenzoylperoxidu sa vysvetľuje jeho vysoko lipofilnou aktivitou, ktorá umožňuje jeho prienik cez epidermis do bakteriálnych a keratinocytových bunkových membrán pilosebaceóznej jednotky. Dibenzoylperoxid je uznávaný ako veľmi účinný širokospektrálny antibakteriálny agens pri liečbe acne vulgaris. Ukázalo sa, že má baktericídny účinok vytváraním voľných radikálov, ktoré oxidujú proteíny a iné základné bunkové zložky v bakteriálnej stene. Minimálna inhibičná koncentrácia dibenzoylperoxidu je baktericídna a preukázala účinnosť na kmene C. acnes citlivé na antibiotiká a rezistentné voči antibiotikám. Dibenzoylperoxid má ďalej preukázané exfoliačné a keratolytické účinky.
Klinickáúčinnosťabezpečnosť
Bezpečnosť a účinnosť gélu Epiduo Forte aplikovaného raz denne na liečbu acne vulgaris sa posudzovala v 12-týždňovej, multicentrovej, randomizovanej, dvojito zaslepenej, kontrolovanej klinickej štúdii porovnávajúcej gél Epiduo Forte s gélovým vehikulom u 503 pacientov s akné. V tejto štúdii bolo 217 pacientov liečených gélom Epiduo Forte, 217 pacientov gélom obsahujúcim adapalén
1 mg/g + dibenzoylperoxid 25 mg/g a 69 pacientov gélovým vehikulom.
Kritériá účinnosti boli:
- Miera úspešnosti definovaná ako percento osôb s hodnotením „bez lézií“ a „takmer bez lézií“ v
12. týždni s aspoň dvojstupňovým zlepšením na základe celkového hodnotenia skúšajúcim (Investigator’s Global Assessment, IGA). Skóre IGA „bez lézií“ zodpovedalo čistej pokožke bez zápalových alebo nezápalových lézií. Skóre IGA „takmer bez lézií“ zodpovedalo zopár rozptýleným komedónom a zopár malým papulám.
- Priemerná absolútna zmena oproti východiskovej hodnote v 12. týždni v počte zápalových aj nezápalových lézií.
Na začiatku štúdie malo 50 % zaradených pacientov závažnosť akné vyhodnotenú ako „stredne závažnú“ (IGA=3) a 50 % malo skóre „závažnú“ (IGA=4). V celkovej skúmanej populácií boli povolené maximálne dva uzly. Pokiaľ ide o počty lézií, mali pacienti v priemere 98 všetkých lézií (rozsah: 51-226), z ktorých priemerný počet zápalových lézií bol 38 (rozsah: 20 – 99) a priemerný počet nezápalových lézií bol 60 (rozsah: 30-149). Vek pacientov sa pohyboval od 12 do 57 rokov (priemerný vek: 19,6 roka), pričom 273 pacientov (54,3 %) bolo vo veku 12 až 17 rokov. Zaradený bol podobný počet mužov (47,7 %) a žien (52,3 %).
V tejto pivotnej štúdii malo 55,2 % pacientov závažný stupeň akné na trupe. Pacienti si ošetrovali tvár a iné miesta postihnuté akné na trupe podľa potreby raz denne večer.
Na porovnanie a interpretáciu výsledkov štúdie sa postupne vykonali štatistické analýzy:
- Epiduo Forte gél oproti gélovému vehikulu u celkovej populácie pacientov so stredne závažným a
závažným akné (IGA=3 a IGA=4).
- Epiduo Forte gél oproti gélovému vehikulu v podskupine pacientov s ťažkým akné (IGA=4).
Výsledky účinnosti sú uvedené v tabuľke 2 pre kombinované populácie so stredne závažným a
závažným akné.
Tabuľka 2: Klinická účinnosť v celkovej populácii: pacienti so stredne závažnou a závažnou formou acne vulgaris v 12. týždni (kombinované IGA = 3 a 4, viacnásobná imputácia (Multiple Imputation, MI), populácia so zámerom liečiť (intent-to-treat, ITT)Parametre účinnosti
| Epiduo Forte gél
(3 mg/g + 25 mg/g)
(N=217)
| Gél
(adapalén 1 mg/g
+dibenzoylperoxid
25 mg/g) (N = 217)a
| Gélové
vehikulum
(N=69)
|
Miera úspešnosti
(zlepšenie o najmenej 2
stupne a IGA hodnotenie
„bez lézií“ alebo „takmer
bez lézií“ )
| 33,7 %b
| 27,3 %
| 11,0 %
|
Zmena v zápalových léziách
Priemerná absolútna
(percentuálna) redukcia
| 27,8 b
(68,7 %)
| 26,5
(69,3 %)
| 13,2
(39,2 %)
|
Zmena v nezápalových
léziách
Priemerná absolútna
(percentuálna) redukcia
| 40,5 b
(68,3 %)
| 40,0
(68,0 %)
| 19,7
(37,4 %)
|
a) Táto štúdia nebola navrhnutá ani zameraná na formálne porovnanie účinnosti liekov Epiduo Forte
(3 mg/g + 25 mg/g) a Epiduo (s nižšou silou adapalén 1 mg/g + dibenzoylperoxid 25 mg/g), ani na
porovnanie nižšej sily prípravku (adapalén 1 mg/g + dibenzoylperoxid 25 mg/g) s gélovým
vehikulom
b) p<0,001 oproti vehikulu
Výsledky analýz primárnej účinnosti u populácie s ťažkým akné sú uvedené v tabuľke 3.
Tabuľka 3: Klinická účinnosť u pacientov so závažným acne vulgaris (IGA=4, MI, populáciaITT)
P
arametre účinnosti
|
E
piduo Forte gél
(
3 mg/g + 25 mg/g)
(
N=
106)
|
G
él
(
adapalén 1 mg/g
+
dibenzoylperoxid
25 mg/g) (N = 112)
|
G
élové
vehikulum
(
N=
34)
|
Miera úspešnosti
(zlepšenie o najmenej 2
stupne a IGA hodnotenie
„bez lézií“ alebo „takmer
bez lézií“)
|
31,9 % a
|
20,5 %
|
11,8 %
|
Z
m
ena v zápalových
l
éziách
P
r
i
e
m
erná absolútna
(
percentuálna) redukcia
|
37,3 b
(74,4 %)
|
30,2
(68 %)
|
14,3
(33,0 %)
|
Z
m
ena v nezápalových
l
éziách
P
r
i
e
m
erná absolútna
(
percentuálna) redukcia
|
46,3 b
(72,1 %)
|
43,9
(68,4 %)
|
17,8
(30,8 %)
|
a) p=0,029 oproti vehikulu
b) p<0,001 oproti vehikulu
Gél adapalén 1 mg/g + dibenzoylperoxid 25 mg/g bol zahrnutý do tejto štúdie ako referenčná liečba. U osôb s akné klasifikovaným ako „stredne závažná forma“ (IGA stupeň 3) gél Epiduo Forte nepreukázal žiadnu výhodu v účinnosti v porovnaní s referenčnou liečbou. V analýze u pacientov so
„závažnou formou“ (IGA stupeň 4), mal gél Epiduo Forte vyššiu účinnosť oproti vehikulu s rozdielom'
v liečbe 20,1 % (31,9 % oproti 11,8 %; 95 % IS: [6,0 % , 34,2 %)], p=0,029), zatiaľ čo referenčná liečba nie (rozdiel v liečbe oproti vehikulu 8,8 %).
Účinok gélu Epiduo Forte na jazvy po akné sa skúmal v štúdii OSCAR. Išlo o multicentrovú, randomizovanú, skúšajúcim zaslepenú, vehikulom kontrolovanú štúdiu s použitím intraindividuálneho porovnávania (pravá polovica tváre oproti ľavej polovici tváre), ktorá skúmala mužov a ženy vo veku
16 až 35 rokov (n=67) so stredne ťažkou až ťažkou formou tvárového acne vulgaris. Pacienti mali v
priemere 40 lézií akné (18 zápalových lézií, 22 nezápalových lézií) na každej strane. Prevažná väčšina osôb mala celkovú strednú závažnosť akné (93 %). Obe strany boli dobre vyvážené, pokiaľ ide o lézie akné, závažnosť jaziev po akné bola 12 jaziev na každej strane, s väčšinou jaziev o veľkosti 2 - 4 mm. Väčšina osôb mala celkovo miernu (63 %) závažnosť jaziev a približne 30 % malo strednú závažnosť. Do tejto štúdie boli zahrnutí muži alebo ženy vo veku 16 až 35 rokov, vrátane a s fototypom kože I až IV na Fitzpatrickovej stupnici.
Zaradenou populáciou boli najmä ženy (65,7 %) a väčšina osôb bola zaradená do kategórie prevažne bielej rasy (86,6 %) a zvyšok ázijskej rasy (13,4 %), etnická príslušnosť nebola zaznamenaná. Najčastejšími fototypmi kože boli II (47,8 %) a III (34,3 %) a zvyšok IV (13,4 %) a I (4,5 %).
Všetky vhodné subjekty boli randomizované tak, aby dostávali Epiduo Forte na jednu polovicu tváre a gélové vehikulum na druhú polovicu, raz denne v noci, počas 24 týždňov. Primárnym koncovým ukazovateľom účinnosti bol počet atrofických jaziev po akné na polovici tváre v 24. týždni.
Analýza primárneho koncového ukazovateľa preukázala, že liečba liekom znížila celkový počet jaziev po akné (pozri tabuľku 4).
Tabuľka 4: Celkový počet jaziev po akné (ITT/posledná pozorovaná hodnota (last observation carried forward, LOCF)Celkový počet jaziev po akné
(ITT/LOCF)
| Epiduo Forte gél
(0,3%/2,5%)
| Gélové
vehikulum
| Rozdiel v
liečbe
| Štatistický
výsledok
|
Priemer ± SD
| 9,5 ± 5,5
| 13,3 ± 7,4
| -3,7 ± 4,4
| p<0,0001
|
Medián
(Q1, Q3) (Min, Max)
|
8,0
(6,0; 12,0) (0, 27)
|
13,0
(8,0; 19,0) (0, 36)
|
-3,0
(-7,0; 0,0) (-16, 3)
|
|
Gél Epiduo Forte primárne redukoval jazvy s veľkosťou 2 - 4 mm (priemerná hodnota pre gél Epiduo
Forte bola 9,0 ± 5,4; priemerná hodnota pre gélové vehikulum bola 12,1 ± 7,0; priemerný rozdiel v liečbe oproti vehikulu bol -3,1 ± 4,1), zatiaľ čo redukcia jaziev > 4 mm bola menšia (priemerná hodnota pre Epiduo Forte bola 0,6 ± 0,8; priemerná hodnota pre gélové vehikulum bola 1,2 ± 1,9; priemerný rozdiel v liečbe oproti vehikulu bol -0,6 ± 1,5).
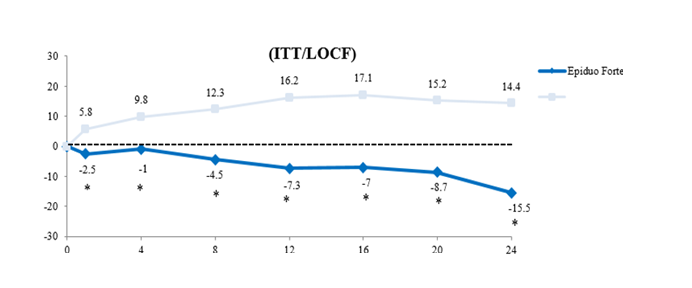
Obrázok 1 znázorňuje percentuálnu zmenu celkového počtu atrofických jaziev oproti východiskovému
stavu pri kontrole na poloviciach tváre, pre gél Epiduo Forte a vehikulum v uvedenom poradí.
Obrázok 1Percentuálna zmena celkového počtu atrofických jaziev oproti východiskovému stavu pri kontroleVehikulum
*nominálna p-hodnota, neupravená pre mnohonásobné skúšanie
Týždeň
*p-hodnota <.001
 5.2 Farmakokinetické vlastnosti
A
bsorpcia
5.2 Farmakokinetické vlastnosti
A
bsorpcia
U 26 dospelých a dospievajúcich osôb (vo veku 12 až 33 rokov) so závažnou formou acne vulgaris sa
vykonala farmakokinetická štúdia s gélom Epiduo Forte. Osoby boli liečené liekom raz denne na všetkých potenciálne postihnutých oblastiach tela počas 4 týždňov, s priemernou dávkou 2,3 gramu/deň (rozsah: 1,6 – 3,1 gramu/deň) gélu Epiduo Forte aplikovaného v tenkej vrstve na tvár, ramená, hornú časť hrudníka a hornú časť chrbta. Po 4 týždňoch liečby malo 16 osôb (62 %) merateľné plazmatické koncentrácie adapalénu nad hranicou merateľnosti (LOQ 0,1 ng/ml), s priemernou Cmax 0,16 ± 0,08 ng/ml a priemernou AUC0-24h 2,49 ± 1,21 ng.h/ml. Najviac exponovaná osoba mala hodnoty Cmax adapalénu 0,35 ng/ml a AUC0-24h 6,41 ng.h/ml.
Farmakokinetické štúdie vykonané s gélmi Epiduo a Epiduo Forte preukázali, že transdermálna absorpcia adapalénu nie je ovplyvnená dibenzoylperoxidom.
Prienik dibenzoylperoxidu cez kožu je nízky. Po aplikácii na kožu sa kompletne mení na kyselinu
benzoovú, ktorá je rýchlo eliminovaná.
5.3 Predklinické údaje o bezpečnostiPredklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, fototoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí.
Štúdie reprodukčnej toxicity s adapalénom podávaným perorálne a dermálne sa uskutočnili
na potkanoch a králikoch. Pri vysokých systémových expozíciách (perorálne dávky od 25 mg/kg/deň) bol preukázaný teratogénny účinok. Pri nižších expozíciách (dermálna dávka 6 mg/kg/deň) boli pozorované zmeny v počte rebier alebo stavcov.
Štúdie na zvieratách s liekom Epiduo alebo Epiduo Forte zahrňujúce štúdie lokálnej znášanlivosti a
štúdie dermálnej toxicity po opakovanom podávaní u potkanov, psov a/alebo miniprasiat v dĺžke až do
13 týždňov preukázali lokálne podráždenie a možnosť senzibilizácie, čo sa v prípade kombinácie obsahujúcej dibenzoylperoxid očakáva. Systémová expozícia adapalénu pri opakovanej dermálnej
aplikácii fixnej kombinácie u zvierat je veľmi nízka, v súlade s klinickými farmakokinetickými údajmi. Dibenzoylperoxid sa v koži rýchlo a kompletne mení na kyselinu benzoovú a po absorpcii sa
vylučuje močom pri obmedzenej systémovej expozícii.
Reprodukčná toxicita adapalénu so zameraním na fertilitu sa u potkanov testovala po perorálnom podaní.
Po liečbe adapalénom podávaným perorálne v dávkach do 20 mg/kg/deň sa nepozorovali žiadne nežiaduce účinky na reprodukčnú schopnosť a fertilitu, prežitie vrhu F1, rast a vývoj do odstavenia a následnú reprodukčnú schopnosť.
Štúdia reprodukčnej a vývojovej toxicity vykonaná na skupinách potkanov vystavených perorálnym dávkam dibenzoylperoxidu do 1 000 mg/kg/deň (5 ml/kg) preukázala, že dibenzoylperoxid pri dávkach do 500 mg/kg/deň nevyvolával teratogenitu a nemal účinky na reprodukčnú schopnosť.
Hodnotenieenvironmentálnehorizika(ERA)
Štúdie hodnotenia environmentálnych rizík ukázali, že adapalén má potenciál byť veľmi perzistentný a toxický pre životné prostredie (pozri časť 6.6).
Štúdie hodnotenia environmentálnych rizík ukázali, že adapalén môže predstavovať riziko pre vodné
prostredie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
edetát disodný dokusát sodný glycerol poloxamér
propylénglykol (E 1520)
simulgel 600 PHA (kopolymér akrylamidu a akryloyldimetyltaurátu sodného, izohexadekán,
polysorbát 80, sorbitan-oleát)
čistená voda
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
Po prvom otvorení: 3 mesiace.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote neprevyšujúcej 25 °C.
6.5 Druh obalu a obsah balenia
Epiduo Forte sa dodáva v dvoch typoch balenia: Tuba:
2 g a 5 g plastové tuby s telom z polyetylénu s vysokou hustotou a hlavicou z polyetylénu s vysokou
hustotou, uzatvorené polypropylénovým skrutkovacím uzáverom.
Viacdávkový obal s odvzdušňovacou pumpou:
15 g, 30 g, 45 g a 60 g viacdávkový obal s odvzdušňovacou pumpou a stláčacím uzáverom vyrobený
z polypropylénu a polyetylénu s vysokou hustotou alebo z polypropylénu, polyetylénu s vysokou
hustotou a polyetylénu s veľmi nízkou hustotou.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Tento liek môže predstavovať riziko pre životné prostredie (pozri časť 5.3).
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Galderma International
Tour Europlaza, 20 avenue André Prothin, La Défense 4
92927 La Défense Cedex, Paríž
Francúzsko
8. REGISTRAČNÉ ČÍSLO
46/0025/23-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
10. DÁTUM REVÍZIE TEXTU
02/2023