
e poliečebná exacerbácia hepatitídy môže viesť k dekompenzácii pečene.
Ochorenie pečene
Bezpečnosť a účinnosť emtricitabínu/tenofovir-dizoproxilu sa nestanovila u pacientov s významnou
poruchou pečene. Farmakokinetika tenofoviru sa študovala u pacientov s poruchou funkcie pečene a u týchto pacientov sa nevyžaduje žiadna úprava dávky. Farmakokinetika emtricitabínu sa neštudovala u pacientov s poruchou funkcie pečene Na základe minimálneho hepatálneho metabolizmu a renálnej cesty eliminácie emtricitabínu je nepravdepodobné, že by sa vyžadovala úprava dávky
Emtricitabinu/Tenofoviru disoproxilu Zentiva u pacientov s poruchou funkcie pečene (pozri časti 4.2 a
5.2).
U HIV-1 infikovaných pacientov s existujúcou pečeňovou dysfunkciou, vrátane chronickej aktívnej hepatitídy je počas kombinovanej antiretrovírusovej terapie (combination antiretroviral therapy, CART) zvýšená frekvencia abnormalít funkcie pečene a majú byť sledovaní podľa štandardného postupu. Ak sa u takýchto pacientov preukáže zhoršenie ochorenia pečene, musí sa zvážiť prerušenie alebo vysadenie liečby.
Účinky na obličky
Emtricitabín a tenofovir sa primárne vylučujú obličkami kombináciou glomerulárnej filtrácie a
aktívnej tubulárnej sekrécie. Počas používania tenofovir-dizoproxilu boli hlásené prípady renálneho zlyhania, porucha funkcie obličiek, zvýšený kreatinín, hypofosfatémia a proximálna tubulopatia
(vrátane Fanconiho syndrómu) (pozri časť 4.8).
Pred začatím liečby infekcie HIV–1 Emtricitabinom/Tenofovirom disoproxilom Zentiva sa u všetkých jedincov odporúča vypočítať klírens kreatinínu.
U jedincov bez rizikových faktorov ochorenia obličiek sa odporúča sledovať renálnu funkciu (klírens kreatinínu a sérové fosfáty) po dvoch až štyroch týždňoch užívania, po troch mesiacoch užívania a následne po každých troch až šiestich mesiacoch.
U jedincov s rizikom ochorenia obličiek sa vyžaduje častejšie sledovanie funkcie obličiek.
Pozri tiež Súbežné podávanie iných liekov nižšie
Ak sú sérové fosfáty < 1,5 mg/dl (0,48 mmol/l) alebo klírens kreatinínu poklesne u niektorých pacientov užívajúcich Emtricitabine/Tenofovir disoproxil Zentiva na < 50 ml/min, treba v priebehu jedného týždňa prehodnotiť renálnu funkciu vrátane meraní koncentrácií krvnej glukózy, krvného draslíka a glukózy v moči (pozri časť 4.8, proximálna tubulopatia). U pacientov s klírensom kreatinínu zníženým na < 50 ml/min alebo so znížením sérových fosfátov na < 1,0 mg/dl (0,32 mmol/l), sa má tiež zvážiť prerušenie liečby Emtricitabinom/Tenofovirom disoproxilom Zentiva. Prerušenie liečby Emtricitabinom/Tenofovirom disoproxilom Zentiva sa má zvážiť aj v prípade progresívneho poklesu renálnej funkcie, pokiaľ sa nezistí žiadna iná príčina.
Renálna bezpečnosť emtricitabínu/tenofovir-dizoproxilu sa skúmala u pacientov infikovaných HIV–1 s poruchou funkcie obličiek (klírens kreatinínu < 80 ml/min) iba vo veľmi obmedzenom rozsahu. Úpravy dávkovacieho intervalu sa odporúčajú pre pacientov infikovaných HIV–1 s klírensom kreatinínu 30-49 ml/min (pozri časť 4.2). Obmedzené údaje z klinických štúdii naznačujú, že predĺžený dávkovací interval nie je optimálny a môže viesť k zvýšenej toxicite a možnej neadekvátnej odpovedi. Okrem toho, v jednej malej klinickej štúdii bola u podskupiny pacientov s klírensom kreatinínu medzi 50 a 60 ml/min, ktorí dostávali tenofovir-dizoproxil v kombinácii s emtricitabínom každých 24 hodín, expozícia tenofoviru 2-4-násobne vyššia a došlo u nich k zhoršeniu činnosti obličiek (pozri časť 5.2). Preto je potrebné dôkladné vyhodnotenie prínosu a rizík pri používaní Emtricitabinu/Tenofoviru disoproxilu Zentiva u pacientov s klírensom kreatinínu < 60 ml/min a musí sa dôkladne sledovať ich renálna funkcia. Okrem toho sa má u pacientov dostávajúcich Emtricitabine/Tenofovir disoproxil Zentiva v predĺženom dávkovacom intervale dôkladne sledovať klinická odpoveď na liečbu. Použitie Emtricitabinu/Tenofoviru disoproxilu Zentiva sa neodporúča u pacientov s ťažkou poruchou funkcie obličiek (klírens kreatinínu < 30 ml/min) a u pacientov,
u ktorých sa vyžaduje hemodialýza, pretože kombinovanou tabletou sa nemôžu dosiahnuť
zodpovedajúce redukcie dávky (pozri časti 4.2 a 5.2).
Účinky na kosti
Abnormality kostí (občas prispievajúce k zlomeninám) sa môžu spájať s proximálnou renálnou
tubulopatiou (pozri časť 4.8). Pri podozrení na abnormality kostí sa má zaistiť vhodná konzultácia.
V 144-týždňovej kontrolovanej klinickej štúdii, ktorá porovnávala tenofovir-dizoproxil so stavudínom v kombinácii s lamivudínom a efavirenzom u predtým neliečených pacientov antiretrovirotikami, sa v oboch liečebných skupinách pozorovali malý pokles hustoty kostných minerálov (bone mineral density, BMD) v bedrových kostiach a kostiach chrbtice. Pokles BMD chrbtice a zmeny kostných biomarkerov oproti počiatočným hladinám boli významne väčšie v skupine liečenej tenofovir- dizoproxilom v 144. týždni. Pokles BMD bedrových kostí bol významne väčší v tejto skupine do 96. týždňa. Počas 144 týždňov sa však riziko fraktúr nezvýšilo a ani sa nepreukázali klinicky relevantné abnormality kostí.
V iných štúdiách (prospektívnych a prierezových) sa najvýraznejšie poklesy BMD pozorovali u pacientov liečených tenofovir-dizoproxilom v rámci režimu liečby obsahujúceho inhibítor proteázy so zosilneným účinkom. U pacientov s osteoporózou, u ktorých existuje vysoké riziko zlomenín, sa majú zvážiť alternatívne režimy liečby.
Telesná hmotnosťametabolicképarametre
Počas antiretrovírusovej liečby môže dôjsť k zvýšeniu telesnej hmotnosti a hladín lipidov a glukózy v
krvi. Takéto zmeny môžu čiastočne súvisieť s kontrolou ochorenia a životným štýlom. Pokiaľ ide o lipidy, v niektorých prípadoch sú dôkazy o vplyve liečby, kým pri prírastku telesnej hmotnosti nie sú
silné dôkazy o tom, že súvisí s niektorou konkrétnou liečbou. Pri monitorovaní hladín lipidov a
glukózy v krvi sa treba riadiť zavedenými odporúčaniami na liečbu infekcie HIV. Poruchy metabolizmu lipidov majú byť klinicky vhodne liečené.
Mitochondriálna dysfunkciapoexpozícii inutero
Nukleoz(t)idové analógy môžu spôsobovať rôzny stupeň ovplyvnenia mitochondriálnej funkcie, čo sa
najviac prejavuje so stavudínom, didanozínom a zidovudínom. Mitochondriálna dysfunkcia bola zaznamenaná u HIV-negatívnych dojčiat vystavených nukleozidovým analógom in utero a/alebo
postnatálne. Tieto hlásenia sa týkali prevažne liečebných režimov obsahujúcich zidovudín. Hlavné zaznamenané nežiaduce reakcie sú hematologické poruchy (anémia, neutropénia) a metabolické
poruchy (hyperlaktatémia, hyperlipazémia). Tieto účinky boli často prechodné. Zriedkavo boli zaznamenané neurologické poruchy s oneskoreným nástupom (hypertónia, konvulzia, abnormálne správanie). V súčasnosti nie je známe, či sú tieto neurologické poruchy prechodné alebo trvalé. Tieto
zistenia sa majú vziať do úvahy pre každé dieťa vystavené nukleoz(t)idovým analógom in utero,
u ktorých sa vyskytnú závažné klinické nálezy neznámej etiológie, a to hlavne neurologické nálezy. Tieto zistenia neovplyvňujú súčasné národné odporúčania pre použitie antiretrovírusovej terapie u
gravidných žien na zabránenie vertikálneho prenosu HIV.
Syndróm imunitnej reaktivácie
U HIV-infikovaných pacientov s ťažkou imunodeficienciou môže v čase nasadenia CART vzniknúť
zápalová reakcia na asymptomatické alebo reziduálne oportúnne patogény a spôsobiť závažné klinické
stavy alebo zhoršenie symptómov. Takéto reakcie sú pozorované počas prvých niekoľkých týždňov
alebo mesiacov po zahájení CART. Relevantnými príkladmi sú cytomegalovírusová retinitída, generalizované a/alebo fokálne mykobakteriálne infekcie a pneumónia spôsobená Pneumocystis
jirovecii. Akékoľvek zápalové symptómy sa musia zhodnotiť a v prípade potreby sa musí nasadiť
liečba.
Boli tiež zaznamenané aj poruchy imunitného systému (ako je Gravesova choroba) objavujúce sa v dôsledku imunitnej reaktivácie; avšak zaznamenaný čas do ich nástupu je rôznorodejší a tieto
udalosti sa môžu vyskytnúť mnoho mesiacov po začatí liečby.
Oportúnne infekcie
U pacientov infikovaných HIV-1, ktorí dostávajú Emtricitabine/Tenofovir disoproxil Zentiva alebo
inú antiretrovírusovú terapiu sa môžu naďalej rozvíjať oportúnne infekcie a iné komplikácie HIV
infekcií a preto musia zostať pod dôkladným klinickým dohľadom lekárov, skúsených v liečbe pacientov s HIV pridruženými chorobami.
Osteonekróza
Aj keď sa etiológia považuje za mnohofaktorovú (vrátane používania kortikosteroidov, konzumácie
alkoholu, ťažkej imunosupresie, vyššieho indexu telesnej hmotnosti), boli hlásené prípady osteonekrózy, najmä u pacientov s pokročilým HIV ochorením a/alebo dlhodobou expozíciou CART. Pacientom sa má odporučiť, aby vyhľadali lekársku pomoc, ak budú mať bolesť kĺbov, stuhnutosť kĺbov alebo ťažkosti s pohybom
Súbežné podávanieinýchliekov
Používaniu Emtricitabinu/Tenofoviru disoproxilu Zentiva sa treba vyhnúť pri súbežnom alebo
nedávnom použití nefrotoxických liekov (pozri časť 4.5). Ak sa súbežnému použitiu
Emtricitabinu/Tenofoviru disoproxilu Zentiva a nefrotoxických látok nedá vyhnúť, má sa týždenne sledovať renálna funkcia.
U pacientov infikovaných HIV–1 liečených tenofovir-dizoproxilom a s rizikovými faktormi pre
renálnu dysfunkciu boli po začatí podávania vysokých dávok alebo viacerých nesteroidných protizápalových liekov (NSAID) hlásené prípady akútneho renálneho zlyhania. Ak sa Emtricitabine/Tenofovir disoproxil Zentiva podáva súbežne s nejakým NSAID, musí sa adekvátne sledovať renálna funkcia.
U pacientov infikovaných HIV–1 dostávajúcich tenofovir-dizoproxil v kombinácii s nejakým proteázovým inhibítorom posilneným ritonavirom alebo kobicistatom bolo hlásené vyššie riziko poruchy funkcie obličiek. U týchto pacientov je potrebné dôkladné sledovanie renálnej funkcie (pozri časť 4.5). U pacientov infikovaných HIV–1 s renálnymi rizikovými faktormi sa má súbežné podávanie tenofovir-dizoproxilu s inhibítorom proteázy so zosilneným účinkom dôkladne vyhodnotiť.
Emtricitabine/Tenofovir disoproxil Zentiva sa nesmie podávať súbežne s inými liekmi obsahujúcimi emtricitabín, tenofovir-dizoproxil, tenofovir-alafenamid alebo inými cytidínovými analógmi, ako je lamivudín (pozri časť 4.5). Emtricitabine/Tenofovir disoproxil Zentiva sa nesmie podávať súbežne s adefovir-dipivoxilom.
Použitie s ledipasvirom a sofosbuvirom
Bolo preukázané, že súbežné podávanie tenofovir-dizoproxilu s ledipasvirom/sofosbuvirom zvyšuje plazmatické koncentrácie tenofoviru, najmä pri použití spoločne s režimom liečby HIV, ktorý zahŕňa
tenofovir-dizoproxil a látku na zlepšenie farmakokinetiky (ritonavir alebo kobicistat).
Bezpečnosť tenofovir-dizoproxilu nebola pri súbežnom podávaní s ledipasviru/sofosbuviru a látky na zlepšenie farmakokinetiky stanovená. Je potrebné zvážiť potenciálne riziká a prínosy spojené so súbežným podávaním, najmä u pacientov so zvýšeným rizikom dysfunkcie obličiek. Pacienti užívajúci ledipasvir/sofosbuvir súbežne s tenofovir-dizoproxilom a inhibítorom HIV proteázy so zosilneným účinkom majú byť sledovaní z dôvodu nežiaducich účinkov spojených s tenofovir-dizoproxilom.
Súbežné podávanie tenofovir-dizoproxilu a didanozínu
Súbežné podávanie sa neodporúča, keďže má za následok 40-60 % zvýšenie systémovej expozície didanozínu, čo môže zvýšiť riziko vzniku nežiaducich účinkov súvisiacich s didanozínom (pozri časť
4.5). Zriedkavo boli hlásené prípady pankreatitídy a laktátovej acidózy, ktoré boli niekedy smrteľné.
Súbežné podávanie tenofovir-dizoproxilu a didanozínu v dávke 400 mg denne bolo spojené s významným poklesom počtu CD4 buniek, pravdepodobne z dôvodu intracelulárnej interakcie zvyšujúcej hladinu fosforylovaného (t. j. aktívneho) didanozínu. Znížené dávkovanie didanozínu
250 mg súbežne podávané s tenofovir-dizoproxilom bolo spojené s hláseniami vysokej miery virologického zlyhania vo viacerých testovaných kombináciách.
Terapia trojkombináciou nukleozidov
Keď bol tenofovir-dizoproxil kombinovaný s lamivudínom a abakavirom ako aj s lamivudínom a
didanozínom v režime jedenkrát denne, bola u HIV-1 infikovaných pacientov hlásená vysoká miera virologického zlyhania a výskytu rezistencie v skorej fáze liečby. Lamivudín a emtricitabín sú si
štrukturálne veľmi podobné a existujú podobnosti vo farmakokinetike a farmakodynamike týchto
dvoch látok. Preto sa môžu pozorovať rovnaké problémy, ak sa Emtricitabine/Tenofovir disoproxil
Zentiva podáva s tretím nukleozidovým analógom.
Starší pacienti
Emtricitabín/tenofovir-dizoproxil sa neštudoval u jedincov starších ako 65 rokov. U jedincov starších
ako 65 rokov je viac pravdepodobné, že budú mať zníženú renálnu funkciu, preto treba pri podávaní
Emtricitabinu/Tenofoviru disoproxilu Zentiva starším ľuďom postupovať opatrne.
4.5 Liekové a iné interakcie
Pretože Emtricitabine/Tenofovir disoproxil Zentiva obsahuje emtricitabín a tenofovir-dizoproxil, akékoľvek interakcie, ktoré boli zistené u týchto liečiv samostatne, sa môžu vyskytnúť
u Emtricitabinu/Tenofoviru disoproxilu Zentiva. Interakčné štúdie sa uskutočnili len u dospelých. Ustálený stav farmakokinetiky emtricitabínu a tenofoviru nebol ovplyvnený, keď bol emtricitabín
podávaný spolu s tenofovir-dizoproxilom oproti ich samostatnému dávkovaniu.
In vitro a klinické farmakokinetické štúdie interakcií ukázali, že pravdepodobnosť pre CYP450
sprostredkované interakcie emtricitabínu a tenofovir-dizoproxilu s inými liekmi je nízka.
Súbežné užívaniesaneodporúča
Emtricitabine/Tenofovir disoproxil Zentiva sa nesmie podávať súbežne s inými liekmi obsahujúcimi
emtricitabín, tenofovir-dizoproxil, tenofovir-alafenamid alebo iné cytidínové analógy, ako je lamivudín (pozri časť 4.4).
Emtricitabine/Tenofovir disoproxil Zentiva sa nesmie podávať súbežne s adefovir dipivoxilom.
Didanozín
Súbežné podávanie Emtricitabinu/Tenofoviru disoproxilu Zentiva a didanozínu sa neodporúča (pozri časť 4.4 a tabuľku 1).
Lieky vylučované renálnou cestou
Keďže sú emtricitabín a tenofovir primárne vylučované obličkami, môže súbežné podávanie
Emtricitabinu/Tenofoviru disoproxilu Zentiva s liekmi znižujúcimi renálnu funkciu alebo konkurujúcimi v aktívnej tubulárnej sekrécii (napr. cidofovir) zvýšiť sérové koncentrácie
emtricitabínu, tenofoviru a/alebo súbežne podávaných liekov.
Treba sa vyhnúť použitiu Emtricitabinu/Tenofoviru disoproxilu Zentiva pri súbežnom alebo nedávnom použití nefrotoxických liekov. Niektoré príklady zahŕňajú aminoglykozidy, amfotericín B, foskarnet, ganciklovir, pentamidín, vankomycín, cidofovir alebo interleukín-2, avšak nie sú obmedzené len na tieto lieky (pozri časť 4.4).
Iné interakcie
Interakcie medzi Emtricitabinom/Tenofovirom disoproxilom Zentiva alebo jeho jednotlivými
zložkami a inými liekmi sú uvedené nižšie v tabuľke 2 (nárast je označený ako „↑“, pokles ako „↓“, žiadna zmena ako „↔“, dvakrát denne ako „b.i.d.“ a jedenkrát denne ako „q.d.“). Ak sú dostupné,
v zátvorkách sú uvedené 90% intervaly spoľahlivosti.
T
abuľka 2: Interakcie medzi Emtricitabinom/Tenofovirom disoproxilom Zentiva alebo jeho
j
ednotlivými zložkami a inými liekmi
L
i
ečivo podľa terapeutickej oblasti
ANT
IINFEKTÍVA Antiretrovirotiká Proteázové inhibítory atazanavir / ritonavir / tenofovir-dizoproxil
(300 mg q.d. / 100 mg q.d. /
245 mg q.d.)
Účinky na hladiny liečivaPriemerná percentuálna zmena AUC, Cmax, Cmin s 90% intervalmi spoľahlivosti, ak sú dostupné(mechanizmus)atazanavir:
AUC: ↓ 25% (↓ 42 – ↓ 3) Cmax: ↓ 28% (↓ 50 – ↑ 5) Cmin: ↓ 26% (↓ 46 – ↑ 10)
tenofovir: AUC: ↑ 37% Cmax: ↑ 34% Cmin: ↑ 29%
Odporúčania týkajúce sasúbežného podávanias Emtricitabinom/Tenofovirom disoproxilom Zentiva(emtricitabín 200 mg,tenofovir-dizoproxil 245 mg)Neodporúčajú sa žiadne úpravy dávok. Zvýšené vystavenie sa tenofoviru môže zosilňovať nežiaduce účinky súvisiace s tenofovirom, vrátane poškodenia obličiek. Renálna funkcia sa má starostlivo sledovať (pozri časť 4.4).
atazanavir/ritonavir/emtricitabín Interakcia sa neštudovala.
darunavir / ritonavir /
tenofovir-dizoproxil
(300 mg q.d. / 100 mg q.d. /
245 mg q.d.)
darunavir: AUC: ↔ Cmin: ↔
tenofovir: AUC: ↑ 22% Cmin: ↑ 37%
Neodporúčajú sa žiadne úpravy dávok. Zvýšené vystavenie sa tenofoviru môže zosilňovať nežiaduce účinky súvisiace s tenofovirom, vrátane poškodenia obličiek. Renálna funkcia sa má starostlivo
darunavir/ritonavir/emtricitabín Interakcia sa neštudovala..
sledovať (pozri časť 4.4).
lopinavir / ritonavir /
tenofovir-dizoproxil
(400 mg b.i.d. / 100 mg b.i.d /
245 mg q.d.)
lopinavir/ritonavir: AUC: ↔
Cmax: ↔ Cmin: ↔
tenofovir:
AUC: ↑ 32% (↑ 25 – ↑ 38) Cmax: ↔
Cmin: ↑ 51% (↑ 37 – ↑ 66)
Neodporúčajú sa žiadne úpravy dávok. Zvýšené vystavenie sa tenofoviru môže zosilňovať nežiaduce účinky súvisiace s tenofovirom, vrátane poškodenia obličiek. Renálna funkcia sa má starostlivo sledovať (pozri časť 4.4).
lopinavir/ritonavir/emtricitabín Interakcia sa neštudovala.
NRT
Is
didanozín /
tenofovir-dizoproxil
Súbežné podávanie tenofovir- dizoproxilu a didanozínu má za následok 40-60%-né zvýšenie systémového vystavenia sa didanozínu, čo môže zvýšiť riziko vzniku nežiaducich účinkov súvisiacich s didanozínom. Zriedkavo boli hlásené prípady pankreatitídy a laktátovej acidózy, ktoré boli niekedy smrteľné.
Súbežné podávanie tenofovir- dizoproxilu a didanozínu v dávke 400 mg denne bolo spojené so značným
poklesom počtu CD4 buniek, pravdepodobne z dôvodu
intracelulárnej interakcie
zvyšujúcej hladinu fosforylovaného (t. j. aktívneho) didanozínu.
Dávka didanozínu znížená na
250 mg súbežne podávaná s tenofovir-dizoproxilom na
liečbu infekcie HIV-1 bola
spojená s hláseniami vysokej miery virologického zlyhania
vo viacerých testovaných
kombináciách.
Súbežné podávanie Emtricitabinu/Tenofoviru disoproxilu Zentiva a
didanozínu sa neodporúča (pozri časť 4.4).
didanozín/emtricitabín Interakcia sa neštudovala.
lamivudín/tenofovir- dizoproxil
lamivudín:
AUC: ↓ 3 % (↓ 8% až ↑ 15) Cmax: ↓ 24 % (↓ 44 až ↓ 12)
Cmin: NC
tenofovir:
AUC: ↓ 4 % (↓ 15 až ↑ 8) Cmax: ↑ 102 % (↓ 96 až ↑
108)
Cmin: NC
Lamivudín a Emtricitabine/Tenofovir disoproxil Zentiva sa nesmú podávať súbežne (pozri časť
4.4).
efavirenz/tenofovir-dizoproxil efavirenz:
AUC: ↓ 4 % (↓ 7 až ↓ 1) Cmax: ↓ 4 % (↓ 9 až ↑ 2) Cmin: NC
Nevyžaduje sa žiadna úprava
dávky efavirenzu.
AN
TIINFEKTÍVA
tenofovir:
AUC: ↓ 1 % (↓ 8 až ↑ 6) Cmax: ↑ 7 % (↓ 6 až ↑ 22) Cmin: NC
A
ntivírusové látky proti vírusu hepatitídy B (HBV)
adefovir-dipivoxil/tenofovir- dizoproxil
adefovir-dipivoxil:
AUC: ↓ 11 % (↓ 14 až ↓ 7) Cmax: ↓ 7 % (↓ 13 až ↓ 0) Cmin: NC
tenofovir:
AUC: ↓ 2 % (↓ 5 až ↑ 0) Cmax: ↓ 1 % (↓ 7 až ↑ 6) Cmin: NC
Adefovir-dipivoxil a Emtricitabine/Tenofovir disoproxil Zentiva sa nesmú podávať súbežne (pozri časť
4.4).
 A
ntivírusové látky proti vírusu hepatitídy C (HCV)
A
ntivírusové látky proti vírusu hepatitídy C (HCV)

ledipasvir/sofosbuvir
(90 mg/400 mg q.d.) +
atazanavir/ritonavir
(300 mg q.d./100 mg q.d.) +
emtricitabín/tenofovir- dizoproxil
(200 mg/245 mg q.d.)1
ledipasvir:
AUC: ↑ 96% (↑ 74 to ↑ 121) Cmax: ↑ 68% (↑ 54 to ↑ 84) Cmin: ↑ 118% (↑ 91 to ↑ 150)
sofosbuvir: AUC: ↔ Cmax: ↔
GS-3310072: AUC: ↔ Cmax: ↔
Cmin: ↑ 42% (↑ 34 až ↑ 49)
atazanavir: AUC: ↔ Cmax: ↔
Cmin: ↑ 63% (↑ 45 až ↑ 84)
ritonavir: AUC: ↔ Cmax: ↔
Cmin: ↑ 45% (↑ 27 až ↑ 64)
emtricitabín: AUC: ↔ Cmax: ↔
Cmin: ↔
tenofovir: AUC: ↔
Cmax: ↑ 47% (↑ 37 až ↑ 58) Cmin: ↑ 47% (↑ 38 až ↑ 57)
Zvýšené plazmatické
koncentrácie tenofoviru vyplývajúce zo súbežného podania tenofovir-dizoproxil, ledipasviru/sofosbuviru a atazanaviru/ritonaviru môžu zvyšovať nežiaduce účinky spojené s tenofovir-dizoproxil, vrátane poruchy funkcie obličiek.
Bezpečnosť tenofovir-dizoproxil nebola stanovená pri použití s
ledipasvirom/sofosbuvirom a
látky na zlepšenie farmakokinetiky (napr. ritonavirom alebo kobicistatom).
Táto kombinácia má byť podávaná s opatrnosťou s častým sledovaním obličiek, ak iné alternatívy nie sú k dispozícii (pozri časť 4.4).

ledipasvir/sofosbuvir
(90 mg/400 mg q.d.) +
darunavir/ritonavir
(800 mg q.d./100 mg q.d.) +
emtricitabín/tenofovir- dizoproxil
(200 mg/245 mg q.d.)1
ledipasvir:
AUC: ↔ Cmax: ↔ Cmin: ↔
sofosbuvir:
AUC: ↓ 27% (↓ 35 až ↓ 18) Cmax: ↓ 37% (↓ 48 až ↓ 25)
GS-3310072: AUC: ↔ Cmax: ↔ Cmin: ↔
darunavir: AUC: ↔ Cmax: ↔ Cmin: ↔
ritonavir: AUC: ↔ Cmax: ↔
Cmin: ↑ 48% (↑ 34 až ↑ 63)
emtricitabín: AUC: ↔ Cmax: ↔ Cmin: ↔
tenofovir:
AUC: ↑ 50% (↑ 42 až ↑ 59) Cmax: ↑ 64% (↑ 54 až ↑ 74)
Cmin: ↑ 59% (↑ 49 až ↑ 70)
Zvýšené plazmatické
koncentrácie tenofoviru vyplývajúce zo súbežného podania tenofovir- dizoproxilu, ledipasviru/sofosbuviru a darunaviru/ritonaviru môžu zvyšovať nežiaduce účinky spojené s tenofovir- dizoproxilom, vrátane poruchy funkcie obličiek. Bezpečnosť tenofovir- dizoproxilu nebola stanovená pri použití s ledipasvirom/sofosbuvirom a látky na zlepšenie farmakokinetiky (napr. ritonavirom alebo kobicistatom).
Táto kombinácia má byť podávaná s opatrnosťou s častým sledovaním obličiek, ak iné alternatívy nie sú k dispozícii (pozri časť 4.4).

ledipasvir/sofosbuvir
(90 mg/400 mg q.d.) + efavirenz/emtricitabín/tenofovir- dizoproxil
(600 mg/200 mg/245 mg q.d.)
ledipasvir:
AUC: ↓ 34% (↓ 41 až ↓ 25) Cmax: ↓ 34% (↓ 41 až ↑ 25) Cmin: ↓ 34% (↓ 43 až ↑ 24)
sofosbuvir: AUC: ↔ Cmax: ↔
GS-3310072: AUC: ↔ Cmax: ↔
Cmin: ↔
efavirenz: AUC: ↔ Cmax: ↔ Cmin: ↔
emtricitabín: AUC: ↔ Cmax: ↔
Cmin: ↔
tenofovir:
AUC: ↑ 98% (↑ 77 až ↑ 123) Cmax: ↑ 79% (↑ 56 až ↑ 104) Cmin: ↑ 163% (↑ 137 až ↑ 197)
Neodporúča sa žiadna úprava
dávky. Zvýšené vystavenie tenofoviru môže zosilňovať nežiaduce účinky spojené s tenofovir-dizoproxilom, vrátane poškodenia obličiek. Funkcia obličiek má byť starostlivo sledovaná (pozri časť 4.4).
ledipasvir/sofosbuvir
(90 mg/400 mg q.d.) + emtricitabín/rilpivirín/tenofovir- dizoproxil
(200 mg/25 mg/245 mg q.d.)
sofosbuvir
(400 mg q.d.) +
efavirenz/emtricitabín/tenofovir- dizoproxil
(600 mg/200 mg/245 mg q.d.)
ledipasvir:
AUC: ↔ Cmax: ↔ Cmin: ↔
sofosbuvir: AUC: ↔ Cmax: ↔
GS-3310072: AUC: ↔ Cmax: ↔ Cmin: ↔
emtricitabín: AUC: ↔ Cmax: ↔ Cmin: ↔
rilpivirín: AUC: ↔ Cmax: ↔ Cmin: ↔
tenofovir:
AUC: ↑ 40% (↑ 31 až ↑ 50
Cmax: ↔
Cmin: ↑ 91% (↑ 74 až ↑ 110)
sofosbuvir: AUC: ↔
Cmax: ↓ 19% (↓ 40 až ↑ 10)
GS-3310072: AUC: ↔
Cmax: ↓ 23% (↓ 30 až ↑ 16)
efavirenz: AUC: ↔ Cmax: ↔ Cmin: ↔
emtricitabín: AUC: ↔ Cmax: ↔
Cmin: ↔
tenofovir: AUC: ↔
Cmax: ↑ 25% (↑ 8 až ↑ 45) Cmin: ↔
Neodporúča sa žiadna úprava
dávky. Zvýšené vystavenie tenofoviru môže zosilňovať nežiaduce účinky spojené s tenofovir-dizoproxilom, vrátane poškodenia obličiek. Funkcia obličiek má byť starostlivo sledovaná (pozri časť 4.4).
Nevyžaduje sa žiadna úprava dávky.
ribavirín/tenofovir-dizoproxil ribavirín:
AUC: ↑ 26 % (↑ 20 až ↑ 32) Cmax: ↓ 5 % (↓ 11 až ↑ 1) Cmin: NC
Antivírusové látky proti vírusu herpes
famciklovir/emtricitabín famciklovir:
AUC: ↓ 9 % (↓ 16 až ↓ 1) Cmax: ↓ 7 % (↓ 22 až ↑ 11) Cmin: NC
Nevyžaduje sa žiadna úprava
dávky ribavirínu.
Nevyžaduje sa žiadna úprava dávky famcikloviru.
A
ntimykobakteriálne lieky
emtricitabín:
AUC: ↓ 7 % (↓ 13 až ↓ 1) Cmax: ↓ 11% (↓ 20 až ↑ 1) Cmin: NC
rifampicín/tenofovir-dizoproxil tenofovir:
AUC: ↓ 12 % (↓ 16 až ↓ 8) Cmax: ↓ 16 % (↓ 22 až ↓ 10) Cmin: ↓ 15 % (↓ 12 až ↓ 9)
PERORÁLNA ANTIKONCEPCIA
Nevyžaduje sa žiadna úprava dávky
norgestimát/etinylestradiol/
tenofovir-dizoproxil
IMUNOSUPRESÍVA takrolimus/tenofovir- dizoproxil/emtricitabín
NARKOTICKÉ ANALGETIKÁ
norgestimát:
AUC: ↓ 4 % (↓ 32 až ↑ 34) Cmax: ↓ 5 % (↓ 27 až ↑ 24) Cmin: NC
etinylestradiol:
AUC: ↓ 4 % (↓ 9 až ↑ 0) Cmax: ↓ 6 % (↓ 13 až ↑ 0) Cmin: ↓ 2 % (↓ 9 až ↑ 6)
takrolimus:
AUC: ↑ 4 % (↓ 3 až ↑ 11) Cmax: ↑ 3 % (↓ 3 až ↑ 9) Cmin: NC
emtricitabín:
AUC: ↓ 5 % (↓ 9 až ↓ 1) Cmax: ↓ 11 % (↓ 17 až ↓ 5) Cmin: NC
tenofovir:
AUC: ↑ 6 % (↓ 1 až ↑ 13) Cmax: ↑13 % (↑ 1 až ↑ 27) Cmin: NC
Nevyžaduje sa žiadna úprava dávky norgestimátu/etinylestradiolu.
Nevyžaduje sa žiadna úprava dávky takrolimu.

metadón/tenofovir-dizoproxil metadón:
AUC: ↑ 5 % (↓ 2 až ↑ 13) Cmax: ↑ 5 % (↓ 3 až ↑ 14) Cmin: NC
Nevyžaduje sa žiadna úprava dávky metadónu.
NC = nevypočítané.
1 Údaje získané zo súbežného podávania s ledipasvirom/sofosbuvirom. Striedavé podávanie (po 12
hodinách) viedlo k podobným výsledkom.
2 Predominantný cirkulujúci metabolit sofosbuviru.
4.6 Fertilita, gravidita a laktácia
Gravidita
Malé množstvo údajov u gravidných žien (300 až 1 000 ukončených gravidít) nepoukazuje na
malformácie alebo fetálnu/neonatálnu toxicitu spojené s emtricitabínom a tenofovir-dizoproxilom. Štúdie na zvieratách s emtricitabínom a tenofovir-dizoproxilom nepoukazujú na reprodukčnú toxicitu
(pozri časť 5.3). Preto sa má o užívaní Emtricitabinu/Tenofoviru disoproxilu Zentiva počas gravidity
uvažovať, iba ak je to nevyhnutné.
Dojčenie
Bolo preukázané, že sa emtricitabín a tenofovir vylučujú do ľudského mlieka. Nie sú dostatočné
informácie o účinkoch emtricitabínu a tenofoviru u novorodencov/dojčiat, preto sa
Emtricitabine/Tenofovir disoproxil Zentiva nemá užívať počas dojčenia.
Ako všeobecné pravidlo sa odporúča, aby ženy infikované HIV za žiadnych okolností nedojčili svoje deti, aby sa zabránilo prenosu HIV na dieťa.
Fertilita
O účinku emtricitabínu/tenofovir-dizoproxilu na ľudí nie sú k dispozícii žiadne údaje. Štúdie na
zvieratách nepreukázali škodlivé účinky emtricitabínu alebo tenofovir-dizoproxilu na fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Jedinci však musia byť informovaní, že počas liečby ako emtricitabínom, tak aj tenofovir-dizoproxilom boli hlásené závraty.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hlásené nežiaduce účinky v otvorenej, randomizovanej klinickej štúdii (GS-01-934, pozri
časť 5.1), považované za možno alebo pravdepodobne súvisiace s emtricitabínom a/alebo tenofovir- dizoproxilom boli nevoľnosť (12%) a hnačka (7%). Profil bezpečnosti emtricitabínu a tenofovir-
dizoproxilu v tejto štúdii bol v súlade s predchádzajúcimi skúsenosťami s týmito látkami, keď bola
každá z nich podávaná s inými antiretrovírusovými látkami.
Tabuľkový súhrn nežiaducichúčinkov
Nežiaduce účinky z klinických štúdií a zo skúseností pacientov infikovaných HIV–1 po uvedení lieku
na trh považované za prinajmenšom možno súvisiace s liečbou so zložkami emtricitabínu/ tenofovir- dizoproxilu sú zoradené v tabuľke 3 nižšie, podľa tried orgánových systémov a frekvencie. V rámci
jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
Frekvencie sú definované ako veľmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), menej časté (≥ 1/1 000
až < 1/100) alebo zriedkavé (≥ 1/10 000 až < 1/1 000).
Tabuľka 3: Tabuľkový súhrn nežiaducuch účinkov spojených s jednotlivými zložkami emtricitabínu/ tenofovir-dizoproxilu založený na skúsenostiach z klinických štúdií a na postmarketingových skúsenostiach
T
rieda orgánových
systémov
F
r
ekvencia
E
mt
r
i
c
it
abín Tenofovir-dizoproxil
Poruchy krvi a lymfatického systému Časté neutropénia Menej časté anémia2
Poruchy imunitného systému
Časté alergická reakcia
Poruchy metabolizmu a výživy
Veľmi časté hypofosfatémia1
Časté hyperglykémia, hypertriglyceridémia
Menej časté hypokaliémia1
Zriedkavé laktátová acidóza
Psychické poruchy
Časté nespavosť, abnormálne sny
Poruchy nervového systému
Veľmi časté bolesť hlavy závraty Časté závraty bolesť hlavy Poruchy gastrointestinálneho traktu
Veľmi časté hnačka, nevoľnosť hnačka, vracanie, nevoľnosť
Č
asté zvýšená amyláza vrátane zvýšenej pankreatickej amylázy,
zvýšená sérová lipáza,
vracanie, bolesť brucha, dyspepsia
bolesť brucha, abdominálna distenzia, flatulencia
M
enej časté pankreatitída
Poruchy pečene a žlčových ciest
 Č
asté
Č
asté zvýšená sérová aspartátaminotransferáza (AST) a/alebo
zvýšená sérová alanínaminotransferáza (ALT), hyperbilirubinémia
zvýšené transaminázy
 Zriedkavé
Zriedkavé steatóza pečene,
hepatitída
Poruchy kože a podkožného tkaniva
Veľmi časté vyrážky
Časté vezikulobulózne vyrážky, pustulárne vyrážky, makulopapulárne vyrážky, vyrážky,
svrbenie, žihľavka,
zmeny sfarbenia kože (zvýšená pigmentácia) 2
Menej časté angioedém3
Zriedkavé angioedém
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva
Veľmi časté zvýšená kreatínkináza
Menej časté rabdomyolýza1, svalová slabosť1
Zriedkavé osteomalácia (prejavuje sa ako bolesť kostí a občas prispieva k zlomeninám)1,3,
myopatia1
Poruchy obličiek a močových ciest
Menej časté zvýšený kreatinín, proteinúria,
proximálna renálna tubulopatia vrátane Fanconiho syndrómu
Zriedkavé renálne zlyhanie (akútne a chronické),
akútna tubulárna nekróza,
nefritída (vrátane akútnej intersticiálnej nefritídy) 3, nefrogénny diabet insipidus
Celkové poruchy a reakcie v mieste podania
Veľmi časté asténia
Časté bolesť, asténia
1 Tento nežiaduci účinok sa môže vyskytnúť ako dôsledok proximálnej renálnej tubulopatie. Bez jej výskytu sa nepovažuje za kauzálne spojený s tenofovir-dizoproxilom.
2 Pri podaní emtricitabínu pediatrickým pacientom sa často vyskytovala anémia a veľmi často zmeny
sfarbenia kože (zvýšená pigmentácia).
3 Tento nežiaduci účinok bol identifikovaný počas postmarketingového sledovania, nepozoroval sa však v randomizovaných kontrolovaných klinických štúdiách s emtricitabínom zahrňujúcich
dospelých pacientov alebo HIV štúdiách s emtricitabínom zahrňujúcich pediatrických pacientov, ani v randomizovaných kontrolovaných klinických štúdiách s tenofovir-dizoproxilom ani v rozšírenom
programe dostupnosti tenofovir-dizoproxilu. Kategória frekvencie bola stanovená zo štatistického výpočtu zakladajúceho sa na celkovom počte pacientov vystavených emtricitabínu
v randomizovaných kontrolovaných klinických štúdiách (n = 1 563) alebo tenofovir-dizoproxilu v randomizovaných kontrolovaných klinických štúdiách a rozšírenom programe dostupnosti
(n = 7 319).
Popis vybraných nežiaducichúčinkov
Porucha funkcie obličiek
Keďže emtricitabín/tenofovir-dizoproxil môže spôsobiť poškodenie obličiek, odporúča sa sledovanie renálnej funkcie (pozri časť 4.4). Proximálna renálna tubulopatia sa vo všeobecnosti vyriešila alebo zlepšila po ukončení podávania tenofovir-dizoproxilu. U niektorých pacientov infikovaných HIV–1 sa však poklesy klírensu kreatinínu úplne nevyriešili napriek vysadeniu tenofovir-dizoproxilu. U pacientov ohrozených poruchou funkcie obličiek (napríklad pacienti s východiskovými renálnymi rizikovými faktormi, pokročilým HIV ochorením alebo pacienti, ktorým sú súbežne podávané nefrotoxické lieky) existuje zvýšené riziko výskytu neúplného obnovenia renálnej funkcie napriek vysadeniu tenofovir-dizoproxilu (pozri časť 4.4).
Interakcia s didanozínom
Súbežné podávanie tenofovir-dizoproxilu a didanozínu sa neodporúča, pretože má za následok 40-
60%-né zvýšenie systémového vystavenia sa didanozínu, čo môže zvýšiť riziko vzniku nežiaducich účinkov súvisiacich s didanozínom (pozri časť 4.5). Zriedkavo boli hlásené prípady pankreatitídy a
laktátovej acidózy, ktoré boli niekedy smrteľné.
Metabolické parametre
Počas antiretrovírusovej liečby sa môže zvýšiť telesná hmotnosť a hladiny lipidov a glukózy v krvi
(pozri časť 4.4).
Syndróm imunitnej reaktivácie
U HIV-infikovaných pacientov s ťažkou imunodeficienciou môže v čase začatia CART vzniknúť zápalová reakcia na asymptomatické alebo reziduálne oportúnne infekcie. Boli tiež zaznamenané aj
poruchy imunitného systému (ako je Gravesova choroba); avšak zaznamenaný čas do ich nástupu je rôznorodejší a tieto udalosti sa môžu vyskytnúť mnoho mesiacov po začatí liečby (pozri časť 4.4).
Osteonekróza
Boli hlásené prípady osteonekrózy, najmä u pacientov so všeobecne uznávanými rizikovými faktormi, pokročilým HIV ochorením alebo dlhodobou expozíciou CART. Frekvencia osteonekrózy nie je
známa (pozri časť 4.4).
Pediatrická populácia
Neodporúča sa používať emtricitabín/tenofovir-dizoproxil u tejto populácie (pozri časť 4.2).
I
né
osobitné
skupiny
pacientov
Jedinci s poruchou funkcie obličiek
Keďže tenofovir-dizoproxil môže spôsobiť renálnu toxicitu, u každého jedinca s poruchou funkcie obličiek, ktorý dostáva Emtricitabine/Tenofovir disoproxil Zentiva sa odporúča dôkladné sledovanie
renálnej funkcie (pozri časti 4.2, 4.4 a 5.2).
Pacienti súbežne infikovaní HIV/HBV alebo HCVProfil nežiaducich účinkov emtricitabínu a tenofovir-dizoproxilu u obmedzeného počtu HIV
infikovaných pacientov v štúdii GS-01-934, súbežne infikovaných HBV (n=13) alebo HCV (n=26), bol podobný, ako sa pozoroval u pacientov infikovaných HIV bez súbežnej infekcie. Zvýšenie AST a ALT sa v tejto populácii pacientov predsa len vyskytlo podľa očakávania častejšie ako u bežnej populácie infikovaných HIV.
Exacerbácie hepatitídy po vysadení liečbyU HBV-infikovaných pacientov bola po vysadení liečby klinicky a laboratórne preukázaná hepatitída
(pozri časť 4.4).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieAk dôjde k predávkovaniu, jedinec sa musí sledovať na symptómy toxicity (pozri časť 4.8) a v prípade potreby musí byť začatá štandardná podporná liečba.
Až do 30% dávky emtricitabínu a približne 10% dávky tenofoviru sa môže odstrániť hemodialýzou.
Nie je známe, či sa emtricitabín alebo tenofovir môže odstrániť peritoneálnou dialýzou.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antivirotiká na systémové použitie; antivirotiká na liečbu HIV infekcií, kombinácie.
ATC kód: J05AR03
Mechanizmus účinkuEmtricitabín je nukleozidový analóg cytidínu. Tenofovir-dizoproxil sa
in vivo konvertuje na tenofovir,
nukleozidomonofosfátový (nukleotidový) analóg adenozínmonofosfátu. Ako emtricitabín, tak aj tenofovir majú špecifickú aktivitu voči vírusu ľudskej imunodeficiencie (HIV-1 a HIV-2) a voči vírusu hepatitídy B.
Emtricitabín a tenofovir sa fosforylujú celulárnymi enzýmami na emtricitabíntrifosfát resp. tenofovirdifosfát.
In vitro štúdie ukázali, že ako emtricitabín, tak aj tenofovir sa môžu úplne'
fosforylovať, keď sa v bunkách kombinujú. Emtricitabíntrifosfát a tenofovirdifosfát kompetitívne
inhibujú HIV-1 reverznú transkriptázu a spôsobujú prerušenie DNA reťazca.
Ako emtricitabíntrifosfát, tak aj tenofovirdifosfát sú slabé inhibítory DNA polymeráz u cicavcov a in vitro a in vivo toxicita voči mitochondriám sa nepreukázala.
Antivírusová in vitro aktivita
Pri kombinovaní emtricitabínu a tenofoviru in vitro sa pozorovala synergická antivírusová aktivita. Aditívne až synergické účinky sa pozorovali v kombinovaných štúdiách s proteázovými inhibítormi a
s nukleozidovými a nenukleozidovými analógovými inhibítormi HIV reverznej transkriptázy.
Rezistencia
In vitro: u niektorých HIV-1 infikovaných pacientov sa pozorovala rezistencia spôsobená vznikom
M184V/I mutácie s emtricitabínom alebo K65R mutácie s tenofovirom. Vírusy rezistentné voči emtricitabínu s M184V/I mutáciou boli skrížene rezistentné voči lamivudínu, ale zachovali si citlivosť
voči didanozínu, stavudínu, tenofoviru a zidovudínu. K65R mutácia sa môže tiež selektovať
abakavirom alebo didanozínom a má za následok redukovanú citlivosť voči týmto látkam a voči lamivudínu, emtricitabínu a tenofoviru. U pacientov s HIV-1 prechovávajúcim K65R mutáciu sa má vyhnúť užívaniu tenofovir-dizoproxilu. Okrem toho bola tenofovirom selektovaná substitúcia K70E v reverznej transkriptáze HIV-1 a má za následok nízkoúrovňovú redukovanú citlivosť voči abakaviru, emtricitabínu, lamivudínu a tenofoviru. HIV-1, pri ktorom sa exprimovali tri alebo viac mutácií spojených s tymidínovými analógmi (thymidine analogue associated mutations, TAMs), ktoré zahŕňali buď M41L alebo L210W mutáciu reverznej transkriptázy, vykazovali redukovanú citlivosť voči tenofovir-dizoproxilu.
In vivo: V otvorenej randomizovanej klinickej štúdii (GS-01-934) u predtým antiretrovírusovo neliečených pacientov sa určovanie genotypu vykonávalo na plazmatických izolátoch HIV-1 všetkých pacientov s potvrdenou HIV RNA > 400 kópií/ml v 48., 96. alebo 144. týždni alebo pri vysadení lieku v počiatočnom štádiu štúdie. Stav od 144. týždňa:
· M184V/I mutácia, ktorá vznikla v 2/19 (10,5%) izolátoch analyzovaných u pacientov zo skupiny emtricitabín/tenofovir-dizoproxil/efavirenz a v 10/29 (34,5%) izolátoch analyzovaných v skupine lamivudín/zidovudín/efavirenz (p-hodnota < 0,05, Fisherov exaktný test porovnávajúci skupinu emtricitabín+tenofovir-dizoproxil so skupinou lamivudín/zidovudín medzi všetkými pacientmi).
· Žiadny z analyzovaných vírusov neobsahoval mutáciu K65R ani K70E.
· Genotypová rezistencia voči efavirenzu, hlavne mutácia K103N, vznikla vo víruse u 13/19 (68%) pacientov v skupine emtricitabín/tenofovir-dizoproxil/efavirenz a vo víruse u 21/29
(72%) pacientov v porovnávacej skupine.
Klinická účinnosťabezpečnosť
V otvorenej randomizovanej klinickej štúdii (GS-01-934) bol predtým antiretrovírusovo neliečeným
pacientom infikovaným HIV-1 podávaný buď v režime jedenkrát denne emtricitabín, tenofovir- dizoproxil a efavirenz (n=255) alebo fixná kombinácia lamivudínu a zidovudínu dvakrát denne a
efavirenz jedenkrát denne (n=254). Pacientom v skupine emtricitabín a tenofovir-dizoproxil boli podávané emtricitabín/tenofovir-dizoproxil a efavirenz od 96. týždňa po 144. týždeň. V
randomizovaných skupinách boli počiatočné hodnoty mediánu plazmatickej HIV-1 RNA (5,02 a 5,00 log10 kópií/ml) a počty CD4 buniek (233 a 241 buniek/ mm3) podobné. Primárnym cieľom účinnosti v tejto štúdii bolo dosiahnutie a udržanie potvrdených koncentrácií HIV-1 RNA < 400 kópií/ml počas 48
týždňov. Sekundárne analýzy účinnosti počas 144 týždňov zahŕňali časť pacientov s koncentráciami
HIV-1 RNA < 400 alebo < 50 kópií/ml a zmeny v počte CD4 buniek oproti počiatočným hodnotám.
48-týždňové údaje ohľadne primárneho cieľa ukázali, že kombinácia emtricitabínu, tenofovir- dizoproxilu a efavirenzu mala vyššiu antivírusovú účinnosť v porovnaní s fixnou kombináciou lamivudínu a zidovudínu s efavirenzom, ako je uvedené v tabuľke 4. 144-týždňové údaje ohľadne sekundárneho cieľa sú tiež uvedené v tabuľke 4.
Tabuľka 4: 48- a 144-týždňové údaje ohľadne účinnosti zo štúdie GS-01-934, v ktorej sa podávali emtricitabín, tenofovir-dizoproxil a efavirenz predtým antiretrovírusovo neliečeným pacientom s HIV-1 infekciou
GS-01-934
48-týždňová liečba
GS-01-934
144-týždňová liečba
Emtricitabín/ tenofovir- dizoproxil / efavirenz
Lamivudín/ zidovudín/ efavirenz
Emtricitabín/ tenofovir - dizoproxil/ efavirenz*
Lamivudín/ zidovudín/ efavirenz
HIV-1 RNA < 400 kópií /ml
(TLOVR)
84% (206/244) 73% (177/243) 71% (161/227) 58% (133/229)
p-hodnota 0,002** 0,004**
% rozdiel (95% IS) 11% (4 až 19%) 13% (4 až 22%)
HIV-1 RNA < 50 kópií /ml
(TLOVR)
80% (194/244) 70% (171/243) 64% (146/227) 56% (130/231)
p-hodnota 0,021** 0,082**
% rozdiel (95% IS) 9% (2 až 17%) 8% (-1 až 17%)
Priemerná zmena v počte CD4 buniek oproti počiatočným hodnotám (počet buniek/ mm3)
+190 +158 +312 +271
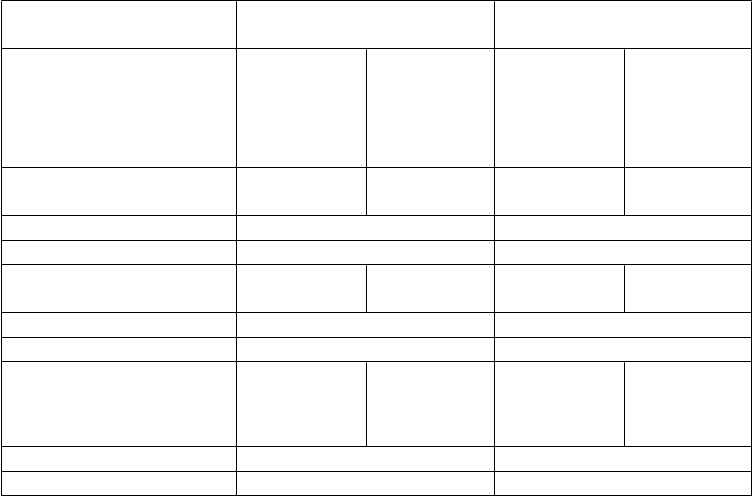
p-hodnota 0,002a 0,089a
% rozdiel (95% IS) 32 (9 až 55) 41 (4 až 79)
* Pacientom dostávajúcim emtricitabín, tenofovir-dizoproxil a efavirenz sa podávali emtricitabín/tenofovir-dizoproxil a efavirenz od 96. do 144. týždňa.
** p-hodnota na základe Cochran-Mantel-Haenszelovho testu rozvrstvená pre počiatočnú hodnotu počtu CD4 buniek
a Van Elterenov test
V randomizovanej klinickej štúdii (M02-418) boli 190, predtým antiretrovírusovo neliečení dospelí liečení emtricitabínom a tenofovir-dizoproxilom podávanými jedenkrát denne v kombinácii s lopinavirom/ritonavirom podávaným jedenkrát alebo dvakrát denne. V 48. týždni sa u 70% a 64% pacientov preukázalo HIV-1 RNA < 50 kópií/ml pri režimoch lopinaviru/ritonaviru podávaných jedenkrát resp. dvakrát denne. Priemerné zmeny v počte CD4 buniek oproti počiatočným hodnotám boli +185 buniek/mm3 a +196 buniek/mm3.
Obmedzené klinické skúsenosti u pacientov súbežne infikovaných HIV a HBV naznačujú, že liečba emtricitabínom alebo tenofovir-dizoproxilom v kombinovanej antiretrovírusovej terapii na kontrolu
HIV infekcie má za následok redukciu HBV DNA (3 log10 redukcia resp. 4 až 5 log10 redukcia) (pozri
časť 4.4).
Pediatrická populácia
Bezpečnosť a účinnosť emtricitabínu/tenofovir-dizoproxilu u detí vo veku do 18 rokov neboli
stanovené. Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s emtricitabínon/tenofovir-dizoproxilom v jednej alebo vo viacerých podskupinách pediatrickej populácie pri liečbe infekcie HIV–1 (informácie o použití v pediatrickej populácii, pozri časť 4.2).
5.2 Farmakokinetické vlastnosti
Absorpcia
Bioekvivalencia jednej filmom obalenej tablety emtricitabín /tenofovir-dizoproxilfosfátu s jednou
tvrdou kapsulou emtricitabínu 200 mg a jednou filmom obalenou tabletou tenofovir-dizoproxilu 245
mg sa stanovila po jednorazovom podaní zdravým jedincom nalačno. Po perorálnom podaní emtricitabínu/tenofovir-dizoproxilu zdravým jedincom sa emtricitabín a tenofovir-dizoproxil rýchlo absorbujú a tenofovir-dizoproxil sa konvertuje na tenofovir. Maximálne koncentrácie emtricitabínu a tenofoviru v sére sa pozorovali 0,5 - 3,0 h od dávkovania nalačno. Podanie emtricitabínu/tenofovir- dizoproxilu s jedlom malo za následok oneskorenie v dosiahnutí maximálnych koncentrácií tenofoviru o približne trištvrte hodiny a zvýšení AUC a Cmax tenofoviru o približne 35% resp. 15% pri podaní jedla s vysokým obsahom tuku alebo ľahkého jedla, v porovnaní s podaním nalačno. Aby sa optimalizovala absorpcia tenofoviru, odporúča sa, aby sa emtricitabín/tenofovir-dizoproxil užíval prednostne s jedlom.
Distribúcia
Po intravenóznom podaní bol distribučný objem emtricitabínu a tenofoviru približne 1,4 l/kg resp. 800
ml/kg. Po perorálnom podaní emtricitabínu alebo tenofovir-dizoproxilu sa emtricitabín a tenofovir distribuujú do celého tela. Väzba emtricitabínu na ľudské plazmatické proteíny in vitro bola < 4% a nezávislá od koncentrácie pri rozmedzí 0,02 - 200 μg/ml. Proteínová väzba tenofoviru na plazmatické alebo sérové proteíny in vitro bola menej ako 0,7 resp. 7,2%, v rozmedzí koncentrácie tenofoviru 0,01 až 25 μg/ml.
Biotransformácia
Metabolizmus emtricitabínu je obmedzený. Biotransformácia emtricitabínu zahŕňa oxidáciu thiolovej
skupiny na formu 3'-sulfoxid diastereomérov (približne 9% dávky) a konjugáciu s kyselinou glukurónovou na formu 2'-O-glukuronidu (približne 4% dávky). In vitro štúdie preukázali, že ani tenofovir-dizoproxil, ani tenofovir nie sú substrátmi pre enzýmy CYP450. Ani emtricitabín a ani tenofovir neinhiboval in vitro metabolizmus lieku sprostredkovaný niektorou z hlavných ľudských CYP450 izoforiem, zúčastňujúcich sa biotransformácie lieku. Emtricitabín taktiež neinhiboval uridín-
5'-difosfoglukuronyltransferázu, enzým zodpovedný za glukuronidáciu.
Eliminácia
Emtricitabín sa primárne vylučuje obličkami s kompletným výťažkom dávky získaným z moču
(približne 86%) a stolice (približne 14%). 13 % dávky emtricitabínu sa znovu získalo v moči vo forme
troch metabolitov. Systémový klírens emtricitabínu je v priemere 307 ml/min. Eliminačný polčas
emtricitabínu je po perorálnom podaní približne 10 hodín.
Tenofovir sa primárne vylučuje obličkami, ako filtráciou tak aj aktívnym tubulárnym transportným systémom, pričom približne 70-80% nezmenenej dávky sa po intravenóznom podaní vylúči do moču. Zrejmý klírens tenofoviru bol v priemere približne 307 ml/min. Renálny klírens, ktorý je v nadbytku hodnoty glomerulárnej filtrácie sa odhaduje na približne 210 ml/min. To poukazuje na skutočnosť, že aktívna tubulárna sekrécia je dôležitou súčasťou eliminácie tenofoviru. Eliminačný polčas tenofoviru je po perorálnom podaní približne 12 - 18 hodín.
Starší pacienti
Farmakokinetické štúdie s emitricitabínom alebo tenofovirom sa neuskutočnili na starších pacientoch
(vo veku nad 65 rokov).
Pohlavie
Farmakokinetika emtricitabínu a tenofoviru u pacientov a pacientiek je podobná.
Etnikum
Pre emtricitabín sa nezistili žiadne klinicky významné farmakokinetické rozdiely v dôsledku etnického
pôvodu. Farmakokinetika tenofoviru nebola špecificky študovaná na rôznych etnických skupinách.
Pediatrická populácia
Farmakokinetické štúdie s emtricitabínom/tenofovir-dizoproxilom sa neuskutočnili s deťmi a
dospievajúcimi (vo veku do 18 rokov). Farmakokinetika tenofoviru v rovnovážnom stave sa hodnotila u 8 dospievajúcich pacientov infikovaných HIV-1 (vo veku 12 až < 18 rokov) s telesnou hmotnosťou
≥ 35 kg a u 23 detí vo veku 2 až < 12 rokov infikovaných HIV-1. Expozícia tenofoviru dosiahnutá u týchto pediatrických pacientov, ktorí dostávali perorálne denné dávky tenofovir-dizoproxilu 245 mg
alebo 6,5 mg/kg telesnej hmotnosti tenofovir-dizoproxilu do maximálnej dávky 245 mg, bola podobná expozícii dosiahnutej u dospelých, ktorí dostávali jedenkrát denne dávky tenofovir-dizoproxilu 245
mg. Farmakokinetické štúdie s tenofovir-dizoproxilom sa nevykonali s deťmi mladšími ako 2 roky. Farmakokinetika emtricitabínu u dojčiat, detí a dospievajúcich (vo veku od 4 mesiacov do 18 rokov) bola vo všeobecnosti podobná tej, ktorá sa zistila u dospelých.
Porucha funkcieobličiek
Pre emtricitabín a tenofovir sú k dispozícii iba obmedzené farmakokinetické údaje po súbežnom
podaní separátnych prípravkov alebo ako emtricitabínu/ tenofovir-dizoproxilu u pacientov s poškodením obličiek. Farmakokinetické parametre u HIV neinfikovaných jedincov s rozdielnymi
stupňami poškodenia obličiek sa stanovili hlavne po jednorazovom podaní dávok emtricitabínu 200
mg alebo tenofovir-dizoproxilu 245 mg. Stupeň poruchy funkcie obličiek sa definoval podľa počiatočného klírensu kreatinínu (CrCl) (normálna renálna funkcia je pri CrCl > 80 ml/min; ľahká porucha funkcie pri CrCl = 50-79 ml/min; stredne ťažká porucha funkcie pri CrCl = 30-49 ml/min a ťažká porucha funkcie pri CrCl = 10-29 ml/min).
Priemerná (koeficient odchýlky v %) expozícia emtricitabínu sa zvýšila z 12 (25%) μg·h/ml u
jedincov s normálnou renálnou funkciou na 20 (6%) μg·h/ml, 25 (23%) μg·h/ml resp. 34 (6%) μg·h/ml u jedincov s ľahkou, stredne ťažkou a ťažkou poruchou funkcie obličiek.
Priemerná (koeficient odchýlky v %) expozícia tenofoviru sa zvýšila z 2 185 (12%) ng·h/ml u jedincov s normálnou renálnou funkciou na 3 064 (30%) ng·h/ml, 6 009 (42%) ng·h/ml resp. 15 985 (45%) ng·h/ml u ľahkou, stredne ťažkou a ťažkou poruchou funkcie obličiek.
Očakáva sa, že predĺžený dávkový interval emtricitabínu/tenofovir-dizoproxilu u pacientov infikovaných HIV–1 so stredne ťažkou poruchou funkcie obličiek má za následok vyšší vrchol plazmatických koncentrácií a nižšie hladiny Cmin v porovnaní s pacientmi s normálnou renálnou funkciou.
U jedincov v poslednej fáze renálneho ochorenia (end-stage renal disease, ESRD), vyžadujúcich hemodialýzu, sa expozícia lieku medzi dialýzou podstatne zvýšila počas 72 hodín na 53 (19%) μg·h/ml emtricitabínu a počas 48 hodín na 42 857 (29%) ng·h/ml tenofoviru.
Na vyhodnotenie bezpečnosti, antivírusovej aktivity a farmakokinetiky tenofovir-dizoproxilu v kombinácii s emtricitabínom sa uskutočnila malá klinická štúdia u HIV-infikovaných pacientov s poškodením obličiek. V podskupine pacientov s počiatočným klírensom kreatinínu medzi 50 a 60 ml/min, dostávajúcich dávku jedenkrát denne bola expozícia tenofoviru 2-4-násobne zvýšená a došlo k zhoršeniu činnosti obličiek.
Porucha funkciepečene
Farmakokinetika emtricitabín/tenofovir-dizoproxilu sa neštudovala u jedincov s poruchou funkcie
pečene.
Farmakokinetika emtricitabínu sa neštudovala u HBV neinfikovaných jedincov s rozdielnymi stupňami hepatálnej insuficiencie. U HBV infikovaných jedincov bola farmakokinetika emtricitabínu vo všeobecnosti podobná tej u zdravých jedincov a HIV-infikovaných pacientov.
Jednorazová dávka 245 mg tenofovir-dizoproxilu bola podaná HIV neinfikovaným jedincom s rozdielnymi stupňami poruchy funkcie pečene definovanými podľa Child-Pugh-Turcotteovej (CPT) klasifikácie. Farmakokinetika tenofoviru bola u jedincov s poruchou funkcie pečene v podstate nezmenená, čo naznačuje, že u týchto jedincov sa nevyžaduje žiadna úprava dávky. Priemerné (koeficient odchýlky v %) hodnoty tenofoviru Cmax a AUC0-∞ boli u zdravých jedincov 223 (34,8%) ng/ml resp. 2 050 (50,8%) ng·h/ml, v porovnaní s 289 (46,0%) ng/ml a 2 310 (43,5%) ng·h/ml u jedincov so stredne ťažkou poruchou pečene a 305 (24,8%) ng/ml a 2 740 (44,0%) ng·h/ml u jedincov s ťažkou poruchou funkcie pečene.
5.3 Predklinické údaje o bezpečnosti
Emtricitabín
Predklinické údaje pre emtricitabín získané na základe obvyklých farmakologických štúdií
bezpečnosti, toxicity po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu a reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
T
enofovir-dizoproxil
Predklinické farmakologické štúdie bezpečnosti s tenofovir-dizoproxilom neodhalili žiadne osobitné
riziko pre ľudí. Nálezy zo štúdií toxicity po opakovanom podávaní u potkanov, psov a opíc pri expozíciách vyšších alebo rovnakých ako sú klinické expozície a s možným významom pre klinické
použitie zahŕňajú renálnu toxicitu a toxicitu voči kostiam a pokles koncentrácie sérových fosfátov.
Toxicita voči kostiam sa diagnostikovala ako osteomalácia (opice) a redukovaná BMD (potkany a psy). Toxicita voči kostiam u mladých dospelých potkanov a psov sa vyskytla pri ≥ 5-násobných expozíciách u detí a dospievajúcich alebo dospelých pacientov. U mladých infikovaných opíc sa toxicita voči kostiam vyskytla pri veľmi vysokých expozíciách po subkutánnom podaní dávky (≥ 40- násobok expozície u pacientov). Výsledky štúdií na potkanoch a opiciach poukázali na pokles intestinálnej absorpcie fosfátov s potenciálnou sekundárnou redukciou BMD súvisiaci s liečivom.
Štúdie genotoxicity preukázali pozitívne výsledky v in vitro skúške s myším lymfómom, nejednoznačné výsledky u jedného z kmeňov používaných v Amesovom teste a slabo pozitívne výsledky v teste neplánovanej syntézy DNA (unscheduled DNA synthesis, UDS) s primárnymi potkaními hepatocytmi. V in vivo skúške s myšími mikrojadrami kostnej drene boli však výsledky negatívne
Perorálne štúdie karcinogenity na potkanoch a myšiach preukázali len nízku incidenciu duodenálnych tumorov u myší pri použití mimoriadne vysokej dávky. Výskyt týchto tumorov pravdepodobne nie je relevantný pre ľudí.
Štúdie reprodukčnej toxicity na potkanoch a králikoch nepreukázali žiadne účinky na párenie, fertilitu, graviditu ani fetálne parametre. V štúdii peri- a postnatálnej toxicity však tenofovir-dizoproxil v dávkach toxických pre matku redukoval index životaschopnosti a hmotnosť mláďat.
Kombinácia emtricitabínuatenofovir-dizoproxilu
V štúdiách genotoxicity a toxicity po opakovanom podávaní, trvajúcou jeden mesiac alebo kratšie, s
použitím kombinácie týchto dvoch zložiek, nebola zistená žiadna exacerbácia toxikologických účinkov v porovnaní so štúdiami so separátnymi zložkami.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
Mikrokryštalická celulóza
Sodná soľ kroskarmelózy
Mastenec
Hydrofóbny koloidný oxid kremičitý
Magnéziumstearát
Filmový obal
Polyvinylalkohol
Oxid titaničitý
Makrogol
Mastenec
Hlinitý lak indigokarmínu (E 132)
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky
Uchovávajte pri teplote do 30 °C po prvom otvorení.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne teplotné podmienky na uchovávanie. Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
Podmienky na uchovávanie po prvom otvorení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Fľaša z polyetylénu s vysokou hustotou (HDPE) s polypropylénovým detským bezpečnostným uzáverom a indukčným tepelným tesnením (s hliníkovou fóliou), s obsahom 30 filmom obalených tabliet a silikagélového vysúšadla
K dispozícii sú nasledujúce veľkosti balenia:
Škatule s 1 fľašou po 30 filmom obalených tabliet a škatule obsahujúce 90 (3 fľaše po 30) filmom obalených tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Fľašu otvoríte stlačením detského bezpečnostného uzáveru smerom nadol a jeho otočením proti smeru hodinových ručičiek.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
Zentiva, k.s.
U Kabelovny 130
102 37 Praha 10
Česká republika
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/16/1148/001
EU/1/16/1148/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.euhttp://www.ema.europa.eu.