
>lieku (pozri časti 4.4 a 6.6). Liek nesmie byť podaný, ak nie je pripravený správne.
Obsah dvoch naplnených sterilných injekčných striekačiek musí byť zmiešaný bezprostredne pred podaním Eligardu 22,5 mg formou podkožnej injekcie.
Ako vyplýva z údajov zo štúdií na zvieratách, je nutné, aby sa injekcia nepodávala intraarteriálne
alebo intravenózne.
Tak ako aj pri iných liekoch podávaných podkožnou injekciou, miesta vpichu sa majú pravidelne
meniť.
4.3 Kontraindikácie
Eligard 22,5 mg je kontraindikovaný u žien a u pediatrickej populácie.
Precitlivenosť na leuprorelíniumacetát, na iné agonisty GnRH alebo na ktorúkoľvek z pomocných
látok uvedených v časti 6.1.
U pacientov, ktorí v minulosti podstúpili orchiektómiu (tak ako iné agonisty GnRH, ani
Eligard 22,5 mg nespôsobuje ďalší pokles sérového testosterónu v prípade chirurgickej kastrácie).
Ako monoterapia u pacientov s karcinómom prostaty s tlakom na miechu alebo preukázanými metastázami v chrbtici (pozri tiež časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaní
Správnarekonštitúcia: Boli hlásené prípady chýb pri zaobchádzaní s liekom, ktoré sa môžu vyskytnúť počas ktoréhokoľvek kroku prípravy lieku a ktoré môžu potenciálne viesť k nedostatočnej účinnosti.
Je potrebné prísne dodržiavať návod na rekonštitúciu a podávanie lieku (pozri časť 6.6). V prípade podozrenia alebo známej chyby pri zaobchádzaní s liekom je potrebné pacientov primerane monitorovať (pozri časť 4.2).
AndrogénovádeprivačnáliečbamôžepredlžovaťQTinterval.
Pred začiatkom liečby Eligardom 22,5 mg má lekár zvážiť pomer prínosu a rizika, vrátane rizika
Torsade de pointes, u pacientov s rizikovými faktory na predĺženie QT intervalu v anamnéze
a u pacientov súbežne užívajúcich lieky, ktoré môžu predlžovať QT interval (pozri časť 4.5).
Kardiovaskulárneochorenia: U mužov bolo v súvislosti s používaním agonistov GnRH hlásené zvýšené riziko vzniku infarktu myokardu, náhlej srdcovej smrti a mŕtvice. Na základe hlásenej miery pravdepodobnosti sa riziko výskytu zdá byť nízke a pri rozhodovaní o liečbe pacientov s karcinómom prostaty sa má hodnotiť dôkladne súčasne s kardiovaskulárnymi rizikovými faktormi.
U pacientov užívajúcich agonisty GnRH sa majú sledovať príznaky a prejavy naznačujúce rozvoj kardiovaskulárnych ochorení a pacienti majú byť manažovaní v súlade so súčasnými klinickými odporúčaniami.
Prechodnézvýšenietestosterónu: Leuprorelíniumacetát, rovnako ako iné agonisty GnRH, spôsobuje počas prvého týždňa liečby prechodné zvýšenie sérových koncentrácií testosterónu, dihydrotestosterónu a kyslej fosfatázy. Pacienti môžu pociťovať zhoršenie existujúcich symptómov alebo objavenie sa nových symptómov, vrátane bolesti v kostiach, neuropatie, hematúrie či obštrukcie močovodu alebo vývodu močového mechúra (pozri časť 4.8). Tieto symptómy zvyčajne ustúpia počas pokračovania v liečbe.
Má sa zvážiť dodatočné podávanie príslušného antiandrogénu tri dni pred začiatkom liečby leuprorelínom a počas prvých dvoch až troch týždňov liečby. Bolo hlásené, že takýto postup predchádza následkom úvodného zvýšenia hladiny sérového testosterónu.
Terapia Eligardom 22,5 mg po chirurgickej kastrácii nevedie u mužských pacientov k ďalšiemu zníženiu hladín sérového testosterónu.
Hustota kostí: Lekárska literatúra uvádza zníženú hustotu kostí u mužov s orchiektómiou alebo u mužov liečených agonistami GnRH (pozri časť 4.8).
Antiandrogénová terapia významne zvyšuje riziko fraktúr z dôvodu osteoporózy. Pre tento jav sú dostupné len obmedzené údaje. Fraktúry z dôvodu osteoporózy boli pozorované u 5 % pacientov po 22 mesiacoch farmakologickej androgénovej deprivačnej liečby a u 4 % pacientov po 5 až
10 rokoch liečby. Riziko fraktúr z dôvodu osteoporózy je zvyčajne vyššie ako riziko patologických fraktúr. Okrem dlhotrvajúcej testosterónovej nedostatočnosti vplývajú na rozvoj osteoporózy aj vyšší
vek, fajčenie, užívanie alkoholických nápojov, obezita a nedostatočná fyzická aktivita.
Apoplexia hypofýzy: Počas sledovania lieku po jeho uvedení na trh bola v zriedkavých prípadoch hlásená apoplexia hypofýzy (klinický syndróm súvisiaci s infarktom hypofýzy), vyskytujúca sa prevažne v priebehu 2 týždňov a v niektorých prípadoch počas prvej hodiny po prvom podaní agonistov GnRH. V týchto prípadoch sa apoplexia hypofýzy prejavila ako prudké bolesti hlavy, vracanie, poruchy videnia, oftalmoplégia, zmenami psychického stavu a v niektorých prípadoch kardiovaskulárnym kolapsom. Vyžaduje sa neodkladná lekárska starostlivosť.
Hyperglykémiaa diabetes: Hyperglykémia a zvýšené riziko vzniku diabetu boli hlásené u mužov, ktorí dostávali agonisty GnRH. Hyperglykémia môže byť prejavom rozvoja diabetes mellitus alebo zhoršenia kontroly glykémie u pacientov s diabetom. U pacientov liečených agonistami GnRH sa majú pravidelne sledovať hladiny glukózy a / alebo glykovaného hemoglobínu (HbA1c) v krvi
a postupovať v súlade so súčasnými odporúčaniami pre liečbu hyperglykémie alebo diabetu.
Kŕče: Po uvedení lieku na trh boli zaznamenané hlásenia o výskyte kŕčov u pacientov liečených leuprorelíniumacetátom, u ktorých boli alebo neboli predispozičné faktory v anamnéze. Pri výskyte kŕčov sa má postupovať podľa aktuálnej klinickej praxe.
Idiopatickáintrakraniálna hypertenzia: U pacientov liečených leuprorelínom sa hlásila idiopatická intrakraniálna hypertenzia (pseudotumor cerebri). Pacientov je potrebné upozorniť na prejavy a príznaky idiopatickej intrakraniálnej hypertenzie, vrátane závažnej a opakujúcej sa bolesti hlavy, porúch videnia a tinitu. Pri výskyte idiopatickej intrakraniálnej hypertenzie sa má zvážiť ukončenie liečby leuprorelínom.
Iné prípady: Pri liečbe agonistami GnRH boli pozorované prípady obštrukcie močovodu a kompresie
miechy, ktoré sa môžu podieľať na paralýze s fatálnymi komplikáciami alebo bez nich. Ak sa objavia komplikácie, ako kompresia miechy alebo porucha funkcie obličiek, má sa začať s ich štandardnou liečbou.
Pacienti s vertebrálnymi metastázami a/alebo metastázami v mozgu rovnako ako pacienti s obštrukciou močových ciest majú byť dôkladne sledovaní počas prvých týždňov liečby.
4.5 Liekové a iné interakcieS Eligardom 22,5 mg sa neuskutočnili žiadne farmakokinetické interakčné skúšania. Neexistujú žiadne hlásenia o interakcii leuprorelíniumacetátu s inými liekmi.
Nakoľko androgénová deprivačná liečba môže predlžovať QT interval, má sa dôkladne zvážiť súbežné používanie Eligardu 22,5 mg s liekmi, o ktorých je známe, že predlžujú QT interval alebo liekmi,
ktoré môžu vyvolať Torsade de pointes, ako antiarytmiká triedy I A (napr. chinidín, disopyramid),
triedy III (napr. amiodarón, sotalol, dofetilid, ibutilid), metadón, moxifloxacín, antipsychotiká a ďalšie
(pozri časť 4.4).
4.6 Fertilita, gravidita a laktáciaNeaplikovateľné, keďže Eligard 22,5 mg je kontraindikovaný u žien.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne klinické skúšania o účinkoch Eligardu 22,5 mg na schopnosť viesť vozidlá
a obsluhovať stroje.
Schopnosť viesť vozidlá a obsluhovať stroje môže byť narušená pre únavu, závraty a poruchy videnia,
čo sú možné vedľajšie účinky liečby alebo následky základného ochorenia.
4.8 Nežiaduce účinkyVedľajšie účinky pozorované počas liečby Eligardom sú väčšinou spôsobené špecifickým farmakologickým pôsobením liečiva leuprorelíniumacetát, ktoré spôsobuje najmä zvýšenie a zníženie hladín určitých hormónov. Veľmi často hlásenými vedľajšími účinkami sú návaly tepla, nauzea, únava, malátnosť, a dočasné lokálne podráždenie v mieste vpichu. Slabé alebo stredne silné návaly tepla sa vyskytujú približne u 58 % pacientov.
Prehľadnežiaducichúčinkovzoradenýchdo tabuľkyPočas klinických skúšaní s Eligardom 22,5 mg boli u pacientov s pokročilým karcinómom prostaty pozorované nasledujúce nežiaduce účinky. Nežiaduce účinky sú klasifikované podľa frekvencie výskytu ako veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až <1/100), zriedkavé (≥1/10 000 až <1/1 000) a veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov).
Tabuľka č. 1: Nežiaduce účinky v klinických skúšaniach s Eligardom
|
Infekcie a nákazy
časté
menej časté
|
zápal sliznice nosohltana
infekcia močovej sústavy, lokálne infekcie kože
|
Poruchy metabolizmu a výživy
menej časté
|
zhoršenie diabetes mellitus
|
Psychické poruchy
menej časté
|
abnormálne sny, depresia, zníženie pohlavnej túžby
|
Poruchy nervového systému
menej časté zriedkavé neznáme
| závrat, bolesť hlavy, hypoestézia, insomnia, poruchy
vnímania chuti, poruchy čuchu, vertigo
abnormálne mimovoľné pohyby
idiopatická intrakraniálna hypertenzia (pseudotumor cerebri)
(pozri časť 4.4)
|
Poruchy srdca a srdcovej činnosti
neznáme
|
predĺženie QT intervalu (pozri časti 4.4 a 4.5)
|
Poruchy ciev
veľmi časté návaly tepla

menej časté hypertenzia, hypotenzia
zriedkavé synkopa, kolaps
Poruchy dýchacej sústavy,
hrudníka a mediastína menej časté neznáme
|
rinorea, dyspnoe
intersticiálne ochorenie pľúc
|
Poruchy gastrointestinálneho
traktu
časté
menej časté zriedkavé
|
nauzea, hnačky, gastroenteritída/kolitída zápcha, sucho v ústach, dyspepsia, vracanie flatulencia, eruktácia
|
Poruchy kože a podkožného
tkaniva
veľmi časté
časté
menej časté zriedkavé
|
ekchymóza, erytém pruritus, nočné potenie lepkavosť, zvýšené potenie alopécia, kožné vyrážky
|
Poruchy kostrovej a svalovej
sústavy a spojivového tkaniva
časté
menej časté
|
artralgia, bolesť končatín, myalgia, zimnica, slabosť bolesť chrbta, svalové kŕče
|
Poruchy obličiek a močových
ciest
časté
menej časté
|
znížená frekvencia močenia, ťažkosti s močením, dyzúria, noktúria, oligúria
spazmus močového mechúra, hematúria, zvýšená
frekvencia močenia, retencia moču
|
Poruchy reprodukčného systému
a prsníkov
časté
menej časté zriedkavé
|
citlivosť prsníkov, atrofia semenníkov, bolesť
v semenníkoch, neplodnosť, hypertrofia prsníkov, erektilná
dysfunkcia, zmenšená veľkosť penisu
gynekomastia, impotencia, porucha semenníkov bolesť v prsníkoch
|
Celkové poruchy a reakcie
v mieste podania veľmi časté časté
menej časté zriedkavé
veľmi zriedkavé
|
únava, pálenie v mieste vpichu, parestézia v mieste vpichu malátnosť, bolesť v mieste vpichu, hematóm v mieste vpichu, štípanie v mieste vpichu
svrbenie v mieste vpichu, zatvrdnutie v mieste vpichu,
letargia, bolesť, pyrexia
ulcerácia v mieste vpichu
nekróza v mieste vpichu
|
Poruchy krvi a lymfatického
systému
časté
|
hematologické zmeny, anémia
|
Laboratórne a funkčné
vyšetrenia
časté
menej časté
|
zvýšená kreatinín-fosfokináza v krvi, predĺžený čas koagulácie
zvýšená alanín-aminotransferáza, zvýšené triacylglyceridy v krvi, predĺžený protrombínový čas, zvýšená hmotnosť
|
Ďalšie nežiaduce účinky zvyčajne hlásené v spojitosti s podávaním liečiva leuprorelíniumacetát
zahŕňajú periférny edém, embóliu pľúc, palpitácie, bolesť svalov, svalovú slabosť, zmenu v citlivosti
kože, triašku, kožný výsev (raš), amnéziu a poruchy videnia. Atrofia svalov bola pozorovaná
pri dlhodobom podávaní liekov tejto skupiny. Zriedkavo bol po podaní krátkodobo alebo dlhodobo
účinných agonistov GnRH pozorovaný infarkt v mieste apoplexie hypofýzy. Zriedkavo sa pozorovala
trombocytopénia a leukopénia. Pozorovali sa zmeny v glukózovej tolerancii.
Po podaní analógu agonistu GnRH boli hlásené kŕče (pozri časť 4.4).
Lokálne nežiaduce účinky hlásené po podaní injekcie Eligardu 22,5 mg sú typické reakcie, často sa vyskytujúce pri rovnakých typoch podkožne injektovaných liekov. Zvyčajne sú tieto lokálne nežiaduce účinky po podaní podkožnej injekcie mierne a majú krátke trvanie.
Anafylaktické/anafylaktoidné reakcie boli zriedkavo hlásené po podaní analógu agonistu GnRH.
Zmeny v hustote kostíZnížená hustota kostí bola v odbornej literatúre hlásená u mužov po orchiektómii alebo u mužov, ktorí
boli liečení analógmi GnRH. Je možné predpokladať, že dlhodobá liečba leuprorelíniumacetátom
môže vykazovať nárast príznakov osteoporózy. Podrobnejšie informácie týkajúce sa zvýšeného rizika
fraktúr z dôvodu osteoporózy (pozri časť 4.4).
Exacerbáciaprejavov a príznakovochoreniaLiečba leuprorelíniumacetátom môže počas prvých týždňov liečby spôsobiť exacerbáciu prejavov a príznakov ochorenia. Ak dôjde k zhoršeniu stavu, napríklad metastáz v chrbtici a/alebo obštrukcii močovej sústavy či hematúrii, môžu nastať neurologické komplikácie, akými sú slabosť a/alebo parestézia dolných končatín alebo zhoršenie symptómov močovej sústavy.
Hláseniepodozrení na nežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieMožnosť zneužitia a úmyselné predávkovanie sú v prípade Eligardu 22,5 mg málo pravdepodobné.
Z klinickej praxe neboli hlásené prípady predávkovania leuprorelíniumacetátom alebo jeho zneužitia,
ak však dôjde k nadmernej expozícii, odporúča sa pozorovanie pacienta a podporná symptomatická liečba.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: Analógy hormónu uvoľňujúceho gonadotropín
ATC kód: L02A E02
Leuprorelíniumacetát je syntetický, nonapeptidový analóg prirodzene sa vyskytujúceho gonadotropín- uvoľňujúceho hormónu (GnRH), ktorý pri kontinuálnom podávaní inhibuje sekréciu gonadotropínov a potláča testikulárnu steroidogenézu u mužov. Po prerušení terapie liekom je tento účinok reverzibilný. Hoci má agonista väčší účinok ako prirodzený hormón, čas obnovenia hladín
testosterónu môže byť u pacientov rôzny.
Podávanie leuprorelíniumacetátu vyvoláva počiatočné zvýšenie cirkulujúcich hladín luteinizačného hormónu (LH) a folikulostimulačného hormónu (FSH), čo vedie k prechodnému zvýšeniu hladín gonádových steroidov, testosterónu a dihydrotestosterónu u mužov. Kontinuálne podávanie leuprorelíniumacetátu vedie k zníženiu hladín LH a FSH. U mužov sa hladina testosterónu zníži
pod hranicu kastrátov (£ 50 ng/dl). K tomuto poklesu dôjde v priebehu 3 až 5 týždňov po začatí liečby. Priemerné hladiny testosterónu sú po 6 mesiacoch 10,1 (± 0,7) ng/dl, čo je porovnateľné s hladinami po bilaterálnej orchiektómii. Všetci pacienti, ktorí v pivotnom klinickom skúšaní dostali plnú dávku 22,5 mg leuprorelínu, dosiahli hladiny kastrátov do 5 týždňov, pričom 99 % pacientov dosiahlo tieto
hladiny do 28. dňa. U prevažnej väčšiny pacientov boli pozorované hodnoty hladiny testosterónu
pod 20 ng/dl, aj keď celkový prínos týchto nízkych hladín ešte nebol stanovený. Hodnoty PSA
poklesli v priebehu 6 mesiacov o 98 %.
Dlhodobé skúšania preukázali, že pokračovanie v liečbe udržuje testosterón pod úrovňou kastrátov až
7 rokov, resp. pravdepodobne neobmedzene.
Počas programu klinických skúšaní nebola priamo meraná veľkosť tumorov, ale zistila sa nepriama
prospešná odozva na liečbu, čo dokazuje 98 % pokles priemerného PSA pri užívaní Eligardu 22,5 mg.
Vo fáze III randomizovaného klinického skúšania zahŕňajúceho 970 pacientov s lokálne pokročilým karcinómom prostaty (najmä pacientov T2c - T4 a niekoľko pacientov T1c až T2b s patologickým ochorením regionálnych uzlín), z ktorých 483 bolo zaradených do skupiny s krátkodobou androgénovou deprivačnou liečbou (6 mesiacov) v kombinácii s rádioterapiou a 487 do dlhodobej liečby (3 roky), analýza non-inferiority porovnávala krátkodobú konkomitantnú a adjuvantnú hormonálnu liečbu agonistom GnRH (triptorelín alebo goserelín) voči dlhodobej liečbe . Celková 5 ročná mortalita bola 19,0 % v krátkodobej skupine a 15,2 % v dlhodobej skupine. Pozorovaný pomer rizík 1,42 s horným jednostranným 95,71 % intervalom spoľahlivosti 1,79 alebo obojstranným
95,71 % intervalom spoľahlivosti 1,09; 1,85 (p = 0,65 pre non-inferioritu), ukazujú, že kombinácia rádioterapie so šesť-mesačnou androgénnou depriváciou poskytuje kratšie prežívanie v porovnaní s
rádioterapiou spolu s 3 roky trvajúcou androgénnou depriváciou. Celkové prežívanie po 5 rokoch
dlhodobej liečby je 84,8 % a prežívanie po krátkodobej liečbe je 81,0 %. Celková kvalita života pri použití dotazníka QLQ-C30 sa významne nelíšila medzi týmito dvoma skupinami (P = 0,37). Výsledky sú dominantné pre skupinu pacientov s lokálne pokročilými nádormi.
Dôkazy pre indikáciu u vysoko rizikového lokalizovaného karcinómu prostaty sú založené na publikovaných štúdiách rádioterapie kombinovanej s analógmi GnRH, vrátane leuprorelíniumacetátu. Boli analyzované klinické dáta z 5 publikovaných skúšaní (EORTC 22863, RTOG 85-31, RTOG 92-02, RTOG 8610 a D'Amico a kolektív, JAMA, 2004), ktoré všetky preukazujú prínos kombinácie analógu GnRH a rádioterapie. Pre indikácie lokálne pokročilého karcinómu prostaty a vysoko rizikového lokalizovaného karcinómu prostaty nebolo možné
v publikovaných štúdiách jasne rozlíšiť príslušné skúšané skupiny.
Klinické údaje ukázali, že rádioterapia a následná 3-ročná androgénna deprivácia je vhodnejšia ako
rádioterapia s následnou 6-mesačnou androgénnou depriváciou.
Podľa štandardných liečebných postupov, je pre pacientov T3 - T4 liečených rádioterapiou odporúčaná dĺžka liečby formou androgénnej deprivácie 2 - 3 roky.
5.2 Farmakokinetické vlastnosti
Absorpcia: U pacientov s pokročilým karcinómom prostaty stúpajú priemerné sérové koncentrácie leuprorelínu po úvodnej injekcii na 127 ng/ml do 4,6 hod. (Cmax) po podaní injekcie. Sérové hladiny zostávali relatívne konštantné (0,2 – 2 ng/ml) po počiatočnom zvýšení, ktoré nasleduje po každej injekcii (plató fáza od 3 – 84 dní po každej dávke). Nie sú žiadne dôkazy o akumulácii
po opakovanom podávaní.
Distribúcia: Priemerný rovnovážny objem distribúcie leuprorelínu po intravenóznom bolusovom podaní bol u zdravých mužských dobrovoľníkov 27 litrov. Väzba in vitro na proteíny ľudskej plazmy sa pohybovala od 43 % do 49 %.
Eliminácia: U zdravých mužských dobrovoľníkov bolus 1 mg leuprorelíniumacetátu podaný intravenózne ukázal, že priemerný systémový klírens je 8,34 l/h s konečným polčasom eliminácie približne 3 hodiny na základe dvojkompartmentového modelu.
Neboli vykonané žiadne skúšania zamerané na exkréciu Eligardu 22,5 mg. Neboli vykonané skúšania zamerané na metabolizmus Eligardu 22,5 mg.
5.3 Predklinické údaje o bezpečnosti
Predklinické skúšania s leuprorelíniumacetátom odhalili u oboch pohlaví účinky na reprodukčný systém, ktoré sa očakávali na základe známych farmakologických vlastností. Ukázalo sa, že tieto
účinky sú reverzibilné po ukončení liečby a náležitom období regenerácie. Leuprorelíniumacetát nevykázal teratogenitu. Embryotoxicita/letalita bola pozorovaná u králikov v súlade
s farmakologickými účinkami leuprorelíniumacetátu na reprodukčný systém.'
Štúdie karcinogenity sa vykonali u potkanov a myší počas 24 mesiacov. U potkanov bol
po podkožnom podaní dávok od 0,6 do 4 mg/kg/deň pozorovaný vyšší výskyt apoplexie hypofýzy
v závislosti od dávky. Takýto účinok nebol pozorovaný u myší.
Leuprorelíniumacetát a príbuzný jednomesačný liek Eligard 7,5 mg nevykázali mutagénny potenciál
v sérii skúšaní in vitro a in vivo.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Rozpúšťadlo (injekčná striekačka A): polyglaktín (75:25) N-metylpyrolidón
Prášok (injekčná striekačka B): Žiadne
6.2 Inkompatibility
Leuprorelín prítomný v injekčnej striekačke B sa smie zmiešať len s rozpúšťadlom v injekčnej striekačke A, nesmie sa zmiešať s inými liekmi.
6.3 Čas použiteľnosti
2 roky
Keď už liek vyberiete z chladničky, môže byť skladovaný v pôvodnom balení pri izbovej teplote (do
25°C) počas štyroch týždňov.
Prášok a rozpúšťadlo na injekčný roztok sa má zmiešať a podať pacientovi ihneď po prvom otvorení vaničky.
Po rekonštitúcii: ihneď použite, keďže viskozita roztoku sa časom zvyšuje.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 ºC – 8 ºC); v pôvodnom obale na ochranu pred vlhkosťou. Liek musí mať pred podaním izbovú teplotu. Vyberte ho z chladničky približne 30 minút pred jeho použitím. Keď už liek vyberiete z chladničky, môže byť skladovaný v pôvodnom balení pri izbovej teplote (do 25°C) počas štyroch týždňov.
6.5 Druh obalu a obsah balenia
Dve naplnené injekčné striekačky, jedna z cyklického olefínového kopolyméru obsahujúca prášok (injekčná striekačka B) a jedna z polypropylénu obsahujúca roztok (injekčná striekačka A). Obe injekčné striekačky tvoria spolu zmiešavací systém.
Injekčná striekačka A má hrot piestu z termoplastovej gumy a je uzavretá polyetylénovým alebo polypropylénovým Luer-Lok viečkom. Hrot viečka injekčnej striekačky je vyrobený z brómbutylovej gumy a dva hroty piestov injekčnej striekačky B sú z chlórbutylovej gumy.
Dostupné sú nasledujúce veľkosti balenia:
· Balenie vo vaničke obsahuje dve zatavené vaničky v papierovom obale. Jedna vanička
obsahuje jednu naplnenú polypropylénovú injekčnú striekačku A, dlhý piest a vrecko
s vysušovadlom. Druhá vanička obsahuje naplnenú injekčnú striekačku B z cyklického
olefínového kopolyméru, sterilnú ihlu s priemerom 20G a vrecko so silikónovým vysušovadlom.
· Balenie obsahujúce súpravu s 2 x 2 injekčnými striekačkami (1x injekčná striekačka A; 1x
injekčná striekačka B).
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomVyberte liek z chladničky približne 30 minút pred jeho použitím a nechajte ho tak zohriaťna izbovú teplotu.Prosím, najskôr pripravte pacienta na podanie injekcie, potom pripravte liek podľa nasledujúcich pokynov. Ak sa pri príprave lieku nepoužije správny postup, liek sa nemá podať, pretože v dôsledku nesprávnej rekonštitúcie lieku môže dôjsť k nedostatočnému klinickému účinku.Krok 1: Otvorte obidve vaničky (odtrhnite fóliu v rohu, kde je možné rozoznať malú bublinu) a vysypte obsah na čistú podložku (2 vaničky obsahujúce injekčnú striekačku A (obr. 1.1) a injekčnú striekačku B (obr. 1.2)). Vrecká s vysušovadlom vyhoďte.
 Krok 2:
Krok 2: Z injekčnej striekačky B
vytiahnite krátky modrý piest spolu so sivou gumenou zátkou; piest
musí zostať neodskrutkovaný na zátke a vyhoďte ho (obr. 2.).
Nezačnite s miešaním, pokiaľ súv striekačke dve sivé zátky.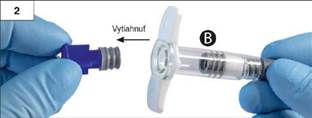 Krok 3:
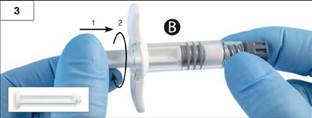
Krok 3: Na sivú gumenú zátku, ktorá zostala v injekčnej striekačke B, jemne naskrutkujte dlhý biely piest (obr. 3).
 Krok 4:
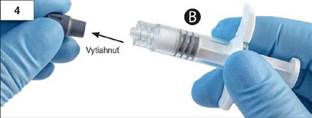
Krok 4: Z injekčnej striekačky B odstráňte sivú gumenú zátku a striekačku položte (obr. 4).
 K
rok 5:
K
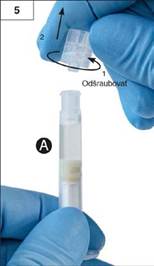
rok 5: Striekačku A držte
vo zvislej polohe, aby jej obsah nemohol vytiecť, a odskrutkujte z nej
priesvitné viečko (obr. 5).
 Krok 6:
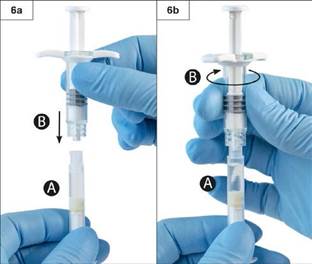
Krok 6: Konce injekčných striekačiek spojte tak, že ich k sebe jemne pritlačíte a priskrutkujete napevno
(obr. 6a a 6b).
Neuťahujte príliš silno.
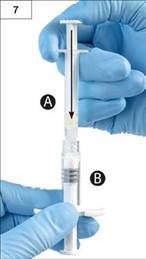
 Krok 7:
Krok 7: Otočte spojené striekačky tak, aby bola striekačka B naspodku a držte ich vo zvislej polohe. Tekutý obsah striekačky A vstreknite do striekačky B, ktorá obsahuje prášok (leuprorelíniumacetát) (obr. 7).
 K
rok 8:
K
rok 8: Striekačky dajte do vodorovnej polohy. Liek dôkladne premiešavajte opatrným striedavým
tlačením na piesty injekčných striekačiek (celkovo asi 60-krát, čo trvá asi 60 sekúnd), aby vznikol
homogénny, viskózny roztok (obr. 8). Spojenými striekačkami netočte (mohlo by dôjsť k čiastočnému
odskrutkovaniu a vytečeniu obsahu).
 Dôkladným premiešaním vznikne viskózny roztok, ktorý môže byť vo farebnej škáleod bezfarebnej, po bielu až svetložltú (prípadne s bielym až svetložltým tieňovaním).Upozornenie: Po zmiešaní okamžite pokračujte v ďalšej fáze prípravy, pretože liek sa stáva časom viskóznejší. Liek po zmiešaní neuchovávajte v chladničke.
Dôkladným premiešaním vznikne viskózny roztok, ktorý môže byť vo farebnej škáleod bezfarebnej, po bielu až svetložltú (prípadne s bielym až svetložltým tieňovaním).Upozornenie: Po zmiešaní okamžite pokračujte v ďalšej fáze prípravy, pretože liek sa stáva časom viskóznejší. Liek po zmiešaní neuchovávajte v chladničke.Poznámka: Liek sa musí premiešať uvedeným spôsobom. Správne premiešanie NEDOSIAHNETE
pretrepávaním.
Krok 9: Injekčné striekačky dajte opäť do zvislej polohy tak, aby bola striekačka B naspodku. Injekčné striekačky musia zostať bezpečne spojené. Natiahnite všetok premiešaný liek do injekčnej striekačky B (krátka, široká striekačka) zatlačením na piest striekačky A a jemným vyťahovaním piesta striekačky B (obr. 9).
K
rok 10: Odskrutkujte striekačku A za stáleho tlaku na piest striekačky A (obr. 10). Zabezpečte, aby
žiaden obsah nevytiekol, inak by ihla po nasadení dobre netesnila.
Poznámka: V tekutine môže zostať jedna veľká bublina alebo niekoľko malých vzduchových bublín, čo
je prijateľné.
Prosím, neodstraňujte vzduchové bubliny v tejto fáze prípravy, lebo môže dôjsť k strate obsahu.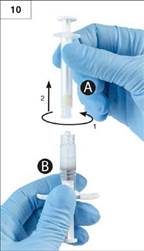 Krok 11
Krok 11:
· Striekačku B držte kolmo nahor a pridržte biely piest, aby ste zabránili úniku lieku.
· Otvorte balenie ihly s ochranným krytom tak, že roztrhnete vonkajší papierový obal a ihlu vyberte. Neodstraňujte pripojený ochranný kryt.
· Nasaďte bezpečnostnú ihlu na koniec striekačky B a jemne pootočte v smere hodinových ručičiek približne tri štvrtiny obrátky, pokým nebude ihla upevnená (obr. 11).
Neuťahujte príliš silno. Môže to spôsobiť prasknutie konektora ihly a následne únik lieku počas
injekčného podania.
Ak konektor ihly praskne, ak sa zdá, že je poškodený alebo ak liek vyteká, liek sa nemá použiť. Poškodená ihla sa nemá vymieňať/nahrádzať a liek sa nemá injekčne podať. Celý liek sa má bezpečne zlikvidovať.
V prípade poškodenia konektora ihly sa má použiť ako náhrada nový liek.
K
rok 12: Odklopte ochranný kryt z ihly a pred podaním injekcie odstráňte ochranné viečko ihly
(obr. 12).
Upozornenie: Neaktivujte ochranný (bezpečnostný) mechanizmus ihly pred podaním injekcie. Krok 13
Krok 13: Pred podaním injekcie, odstráňte niektoré veľké vzduchové bubliny zo striekačky B. Liek podajte subkutánne, ochranný kryt je stále mimo ihly. Prosím, ubezpečte sa, že ste podali celý obsah striekačky B.
Krok 14: Po podaní injekcie uzatvorte ochranný kryt ihly pomocou niektorého z nižšie uvedených spôsobov na aktiváciu ochranného krytu ihly.
1. Uzavretie o rovný povrchPritlačte ohyb ochranného (bezpečnostného) krytu o rovný povrch (obr. 14.1a a b) aby ste zakryli ihlu a zafixovali ochranný kryt.
Správne zafixovaná poloha sa dá overiť počuteľným kliknutím a dotykom, keď bude hrot ihly úplne
zakrytý ochranným (bezpečnostným) krytom (obr. 14.1b).
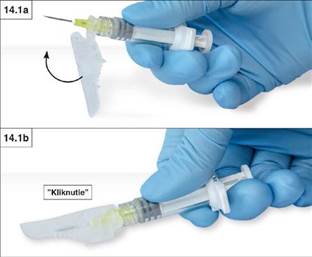 2. Uzavretie palcom
2. Uzavretie palcom
Pritlačte palec na ochranný kryt (obr. 14.2a), zakryte hrot ihly a kryt uzamknite.
Správne zafixovaná poloha sa dá overiť počuteľným kliknutím a dotykom, keď bude hrot ihly úplne zakrytý ochranným (bezpečnostným) krytom (14.2b).
 Krok 15:
Krok 15: Po uzavretí bezpečnostného krytu ihlu a striekačku ihneď vyhoďte do príslušného
kontajnera na ostré predmety.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIRecordati Industria Chimica e Farmaceutica S.p.A. Via Matteo Civitali 1
20148 Miláno
Taliansko
8. REGISTRAČNÉ ČÍSLOReg. č.: 56/0010/05-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE
Dátum prvej registrácie: 4. februára 2005
Dátum posledného predĺženia registrácie: 09. augusta 2011
10. DÁTUM REVÍZIE TEXTU
08/2022