
/>4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
Výrazná respiračná depresia alebo porucha funkcie pľúc.
4.4 Osobitné upozornenia a opatrenia pri používaní
Respiračná depresia
Sufentanil môže spôsobiť respiračnú depresiu, pričom stupeň/závažnosť závisí od dávky. Účinky
sufentanilu na dýchanie je potrebné posúdiť na základe klinického sledovania, napr. dychovej frekvencie, úrovne sedácie a saturácie kyslíkom. Pacienti s vyšším rizikom sú pacienti s poruchou dýchania alebo so zníženou dychovou rezervou. Respiračnú depresiu spôsobenú sufentanilom možno zvrátiť antagonistami opioidov. Možno bude potrebné opakované podanie antagonistu, keďže respiračná depresia môže trvať dlhšie ako účinok antagonistu (pozri časť 4.9).
Riziko vyplývajúce zo súbežného použitia sedatív, ako sú benzodiazepíny alebo podobné lieky
Súbežné použitie sufentanilu a sedatív, ako sú benzodiazepíny, alebo podobných liekov môže viesť k
sedácii, respiračnej depresii, ku kóme a k smrti. Vzhľadom na uvedené riziká má byť súbežné predpisovanie s týmito sedatívami vyhradené pre pacientov, v prípade ktorých nie sú k dispozícii alternatívne možnosti liečby, alebo v prípade, že sufentanil sa používa v naliehavej situácii.
Intrakraniálny tlak
Sufentanil sa má používať obozretne u pacientov, ktorí môžu byť mimoriadne citliví na cerebrálne
účinky zadržiavania CO2 , ako sú pacienti s preukázaným zvýšeným intrakraniálnym tlakom alebo s poruchou vedomia. Sufentanil môže prekrývať klinický priebeh u pacientov s poranením hlavy. Sufentanil sa má používať obozretne u pacientov s nádorom v mozgu.
Kardiovaskulárne účinky
Sufentanil môže spôsobiť bradykardiu. Preto sa má používať obozretne u pacientov s predchádzajúcou
alebo existujúcou bradyarytmiou.
Sufentanil môže spôsobiť hypotenziu, najmä u pacientov s hypovolémiou. Na udržanie stabilného
arteriálneho tlaku je potrebné prijať príslušné opatrenia.
Porucha funkcie pečene alebo obličiek
Sufentanil sa metabolizuje najmä v pečeni a vylučuje sa v moči a stolici. Trvanie účinku môže byť
dlhšie u pacientov so závažnou poruchou funkcie pečene a obličiek. O používaní sufentanilu u
takýchto pacientov sú k dispozícii len obmedzené údaje. Pacientov so stredne závažnou až závažnou
poruchou funkcie pečene alebo so závažnou poruchou funkcie obličiek je potrebné pozorne sledovať na symptómy predávkovania sufentanilom (pozri časť 4.9).
Možnosť zneužitiaatolerancia
Sufentanil možno zneužiť. Je to potrebné vziať do úvahy pri predpisovaní alebo podávaní sufentanilu,
ak existuje obava v súvislosti so zvýšeným rizikom nesprávneho použitia, zneužitia alebo iného použitia.
Pacienti dlhodobo liečení opioidmi alebo osoby závislé od opioidov budú možno potrebovať vyššie
dávky analgetika ako sa nachádzajú v lieku Dzuveo.
Gastrointestinálne účinky
Sufentanil ako agonista μ-opioidných receptorov môže spomaliť gastrointestinálnu motilitu. Sufentanil
sa má preto používať obozretne u pacientov s rizikom ilea.
Sufentanil ako agonista μ-opioidných receptorov môže spôsobiť spazmus Oddiho sfinktra. Sufentanil sa má preto používať obozretne u pacientov s ochorením žlčových ciest vrátane akútnej pankreatitídy.
4.5 Liekové a iné interakcie
Interakcia s enzýmom cytochrómu P450-3A4
Sufentanil sa metabolizuje najmä ľudským enzýmom cytochrómu P450-3A4. Ketokonazol, silný
inhibítor CYP3A4, môže výrazne zvýšiť systémovú expozíciu sublingválnemu sufentanilu (maximálne plazmatické koncentrácie (Cmax ) sa zvýšia o 19 %, celková expozícia liečivu (AUC) sa zvýši o 77 % a čas do dosiahnutia maximálnej koncentrácie sa predĺži o 41 %). Podobné účinky iných silných inhibítorov CYP3A4 (napr. itrakonazol, ritonavir) nemožno vylúčiť. Akákoľvek zmena v účinnosti/tolerovateľnosti súvisiaca so zvýšenou expozíciou by sa v praxi mala vykompenzovať predĺžením času medzi dávkami (pozri časť 4.2).
Interakcia s blokátormi vápnikových kanálov a/alebo s betablokátormi
Výskyt a stupeň bradykardie a hypotenzie pri použití sufentanilu môžu byť vyššie u pacientov
dlhodobo liečených blokátormi vápnikových kanálov a/alebo betablokátormi.
U pacientov súbežne liečených týmito liekmi je potrebná obozretnosť, pričom majú byť pozorne
sledovaní.
Liečivá tlmiace centrálny nervový systém (CNS)
Súbežné použitie liečiv tlmiacich CNS vrátane barbiturátov, benzodiazepínov, neuroleptík alebo iných
opioidov, halogénovaných plynov alebo iných neselektívnych látok tlmiacich CNS (napr. alkohol)
môže zvýšiť respiračnú depresiu.
Ak sa zvažuje použitie sufentanilu u pacienta užívajúceho liečivo tlmiace CNS, je potrebné posúdiť
trvanie používania liečiva tlmiaceho CNS a odpoveď pacienta vrátane stupňa tolerancie, ktorá sa
vyvinula na útlm CNS. Ak sa rozhodne o začatí podávania sufentanilu, pacient má byť pozorne
sledovaný, pričom je potrebné zvážiť nižšiu dávku súbežného liečiva tlmiaceho CNS.
Inhibítory monoaminooxidázy (MAO)
Dva týždne pred začatím liečby sufentanilom sa zvyčajne odporúča vysadiť inhibítory MAO, pretože
v súvislosti s opioidnými analgetikami bolo hlásené závažné a nepredvídateľné zosilnenie účinku
inhibítorov MAO.
Iné lieky
Interakcia s inými sublingválne podávanými liekmi alebo s liekmi, ktoré sa riedia/účinkujú v ústnej
dutine, sa nehodnotila, a preto je potrebné vyhnúť sa súbežnému podávaniu.
4.6 Fertilita, gravidita a laktácia
Gravidita
K dispozícii nie sú žiadne údaje alebo len obmedzené údaje o použití sufentanilu u gravidných žien.
V štúdiách na zvieratách sa preukázala reprodukčná toxicita (pozri časť 5.3). Sufentanil sa nemá
používať v gravidite, pretože prechádza cez placentu a respiračné centrum plodu je citlivé na opiáty. Ak sa sufentanil podáva v tomto období matke, má byť ľahko dostupné antidotum pre dieťa. Sufentanil môže po dlhodobej liečbe spôsobiť u novorodenca abstinenčné príznaky.
Sufentanil sa neodporúča počas gravidity alebo ženám v reprodukčnom veku, ktoré nepoužívajú
antikoncepciu.
Dojčenie
Sufentanil sa vylučuje do ľudského mlieka v takom množstve, že existuje pravdepodobnosť účinkov
na dojčených novorodencov/dojčatá.Rozhodnutie, či ukončiť dojčenie alebo ukončiť/prerušiť liečbu sufentanilom, sa má vykonať po zvážení prínosu dojčenia pre dieťa a prínosu liečby pre ženu.
Fertilita
K dispozícii nie sú žiadne klinické údaje o účinkoch sufentanilu na fertilitu. V štúdiách na potkanoch
sa zistila znížená fertilita a zvýšená mortalita embryí (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Sufentanil má veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Pacientov treba informovať, že ak sa u nich počas liečby alebo po liečbe sufentanilom vyskytne ospalosť, závraty alebo porucha zraku, nemajú viesť vozidlo a obsluhovať stroje. Pacienti by mali viesť vozidlo a obsluhovať stroje len v prípade, že po poslednom podaní sufentanilu uplynul dostatočne dlhý čas.
4.8 Nežiaduce účinky
Zhrnutie bezpečnostného profilu
Najzávažnejšou nežiaducou reakciou sufentanilu je respiračná depresia, ktorá sa v klinických
skúšaniach so sufentanilom vyskytovala v početnosti 0,6 %.
Najčastejšie hlásené nežiaduce reakcie pozorované v klinických skúšaniach a v rámci skúseností s liekmi obsahujúcimi sufentanil po uvedení na trh boli nauzea, vracanie a pyrexia (≥ 1/10 pacientov) (pozri časť 4.4).
Tabuľkovýzoznamnežiaducichreakcií
Nežiaduce reakcie, ktoré sa vyskytli buď v klinických štúdiách, alebo v rámci skúseností s inými liekmi obsahujúcimi sufentanil po uvedení na trh sú zhrnuté v tabuľke nižšie. Frekvencie sú definované ako:
Veľmi časté ≥ 1/10
Časté ≥ 1/100 až < 1/10
Menej časté ≥ 1/1 000 až < 1/100
Zriedkavé ≥ 1/10 000 až < 1/1 000
Veľmi
zriedkavé
< 1/10 000
Neznáme Nemožno odhadnúť z dostupných údajov.
T
rieda orgánových
s
ystémov podľa
databázy MedDRA
V
eľmi
časté
Č
asté Menej časté Neznáme
Infekcie a nákazy bronchitída
infekčná konjunktivitída
faryngitída
Benígne a malígne nádory vrátane nešpecifikovaných novotvarov (cysty a polypy)
Poruchy krvi a lymfatického systému
anémia leukocytóza
lipóm
trombocytopénia
Poruchy imunitného
systému
precitlivenosť anafylaktický
šok
Poruchy metabolizmu a výživy
hypokalciémia hypoalbuminémia hypokaliémia hyponatriémia
hypomagnezémia hypoproteinémia hyperkaliémia diabetes mellitus hyperglykémia hyperlipidémia hypofosfatémia hypovolémia
Psychické poruchy insomnia
úzkosť
stav zmätenosti
agitácia apatia
konverzná porucha
dezorientácia euforická nálada halucinácie
zmeny duševného stavu nervozita

Poruchy nervového systému
bolesť hlavy závraty somnolencia sedácia
tremor ataxia dystónia hyperreflexia tremor
pocit pálenia presynkopa parestézia hypestézia letargia
zhoršenie pamäti migréna
tenzná bolesť hlavy
kŕče
kóma
T
rieda orgánových systémov podľa databázy MedDRA
V
eľmi časté
Č
asté Menej časté Neznáme
Poruchy oka bolesť očí
porucha zraku
mióza
Poruchy srdca
a srdcovej činnosti
tachykardia sínusová tachykardia
bradykardia angína pektoris atriálna fibrilácia ventrikulárne extrasystoly
Poruchy ciev hypotenzia hypertenzia
ortostatická hypertenzia návaly horúčavy diastolická hypotenzia ortostatická hypotenzia
Poruchy dýchacej sústavy, hrudníka a mediastína
Poruchy gastrointestinálneho traktu
Poruchy pečene
a žlčových ciest
nauzea vracanie
hypoxia
bolesť v oblasti hltana a hrtana
respiračná depresia
zápcha dyspepsia flatulencia sucho v ústach
bradypnoe epistaxa singultus apnoe atelektáza
hypoventilácia
pľúcna embólia pľúcny edém
respiračná tieseň
zlyhávanie dýchania sipot
hnačka
eruktácia
napínanie na vracanie abdominálny diskomfort abdominálna distenzia bolesť v hornej časti brucha
diskomfort v epigastriu gastritída gastroezofágová refluxová choroba znížená citlivosť v ústach hyperbilirubinémia
zástava dýchania
Poruchy kože
a podkožného tkaniva
pruritus hyperhidróza znížená citlivosť v oblasti tváre
generalizovaný pruritus
pľuzgier vyrážka suchá koža
erytém
Poruchy kostrovej a svalovej sústavy
a spojivového tkaniva
svalové kŕče
svalové zášklby
bolesť chrbta muskuloskeletálna bolesť muskuloskeletálna bolesť hrudníka bolesť v končatinách
Poruchy obličiek
a močových ciest
retencia moču porucha začať a udržať močenie
oligúria
zlyhávanie obličiek
T
rieda orgánových systémov podľa databázy MedDRA
V
eľmi časté
Č
asté Menej časté Neznáme
bolesť močových ciest
Celkové poruchy
a reakcie v mieste podania
Laboratórne a funkčné
vyšetrenia
pyrexia pocit horúčavy
únava asténia
zimnica lokálny opuch
bolesť v hrudníku nekardiálneho pôvodu diskomfort v hrudníku
zvýšený krvný tlak znížená dychová frekvencia
zvýšená hladina glukózy v krvi
zvýšená hladina
bilirubínu v krvi
znížený výdaj moču
abstinenčné
príznaky
znížená saturácia kyslíkom
zvýšená telesná
teplota
zvýšená hladina aspartátaminotransferázy zvýšená hladina močoviny v krvi abnormálna T vlna na elektrokardiograme abnormálny elektrokardiogram zvýšená hladina pečeňových enzýmov
test funkcie pečene
mimo normy
Úrazy, otravy a komplikácie liečebného postupu
anémia po operácii nauzea v súvislosti s liečbou
pooperačný ileus
vracanie v súvislosti s
liečbou
komplikácie spojené s gastrointestinálnou
stómiou
procedurálna bolesť
 H
l
ásenie podozrení na nežiaduce reakcie
H
l
ásenie podozrení na nežiaduce reakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili
akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
prílohe V.4.9 PredávkovaniePrejavy a symptómyPredávkovanie sufentanilom sa prejavuje zvýšením jeho farmakologických účinkov. Klinický obraz sa
určí v závislosti od individuálnej citlivosti na základe stupňa respiračnej depresie, čo môže byť v rozsahu od hypoventilácie až po zástavu dýchania. K ďalším symptómom, ktoré sa môžu vyskytnúť,
patrí strata vedomia, kóma, kardiovaskulárny šok a stuhnutosť svalov.
L
i
ečba
Liečba predávkovania sufentanilom má byť zameraná na kontrolu symptómov agonizmu μ-opioidných
receptorov vrátane podania kyslíka. Hlavnú pozornosť je potrebné venovať obštrukcii dýchacích ciest
a potrebe asistovanej alebo riadenej ventilácie.
V prípade respiračnej depresie je potrebné podať antagonistu opiátov (napr. naloxón). To nevylučuje cielenejšie protiopatrenia. Je potrebné vziať do úvahy kratšie trvanie účinku antagonistu opiátov v porovnaní s trvaním účinku sufentanilu. V takom prípade sa antagonista opioidov môže podávať opakovane alebo formou infúzie.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Anestetiká, opioidné anestetiká, ATC kód: N01AH03.
Mechanizmus účinku
Sufentanil je silný syntetický opioid s vysoko selektívnou väzbou na μ-opioidné receptory. Sufentanil
pôsobí ako úplný agonista μ-opioidných receptorov. Sufentanil nevyvoláva uvoľňovanie histamínu. Všetky účinky sufentanilu možno okamžite a úplne zablokovať podaním špecifického antagonistu, ako
je naloxón.
Primárne farmakodynamické účinky
Analgézia
Predpokladá sa, že analgézia vyvolaná sufentanilom je sprostredkovaná aktiváciou μ-opioidných receptorov najmä v CNS, čím sa zmenia procesy ovplyvňujúce vnímanie bolesti aj odpoveď na bolesť. U ľudí je sufentanil 7-násobne až 10-násobne silnejší ako fentanyl a 500-násobne až 1 000-násobne silnejší ako morfín (perorálny). Vysoká lipofilnosť sufentanilu umožňuje jeho sublingválne podávanie a dosiahnutie rýchleho nástupu analgetického účinku.
Sekundárne farmakodynamické účinky
Respiračná depresia
Sufentanil môže spôsobiť respiračnú depresiu (pozri časť 4.4) a takisto potláča kašľový reflex.
Ďalšie účinky na CNS
Je známe, že vysoké dávky intravenózne podávaného sufentanilu spôsobujú stuhnutosť svalov, pravdepodobne v dôsledku účinku na štruktúry substantia nigra a nucleus striatum. Hypnotický účinok možno preukázať zmenami v EEG.
Gastrointestinálne účinky
Plazmatické koncentrácie sufentanilu vyvolávajúce analgéziu môžu vyvolať nauzeu a vracanie podráždením chemoreceptorovej spúšťacej zóny.
Gastrointestinálne účinky sufentanilu zahŕňajú zníženú propulzívnu motilitu, zníženú sekréciu a
zvýšený svalový tonus (až do spazmov) sfinktrov gastrointestinálneho traktu (pozri časť 4.4).
Kardiovaskulárne účinky
Nízke dávky intravenózneho sufentanilu súvisiace pravdepodobne s (cholínergickou) aktivitou vágu spôsobujú miernu bradykardiu a mierne zníženú systémovú vaskulárnu rezistenciu bez výrazného zníženia krvného tlaku (pozri časť 4.4).
Kardiovaskulárna stabilita je tiež výsledkom minimálnych účinkov na srdcové predpätie (preload), prietok krvi srdcom a spotrebu kyslíka myokardom. Priame účinky sufentanilu na funkciu myokardu sa nepozorovali.
Klinická účinnosť abezpečnosť
Analgézia
Účinnosť lieku Dzuveo sa hodnotila v dvoch dvojito zaslepených, placebom kontrolovaných
skúšaniach zahŕňajúcich 221 pacientov so stredne silnou až silnou akútnou pooperačnou bolesťou
(intenzita bolesti ≥ 4 na stupnici od 0 do 10) po brušnej operácii (sledovanie maximálne 48 hodín) alebo po ortopedickej operácii (odstránenie hallux valgus) (sledovanie maximálne 12 hodín). Stoštyridsaťsedem z 221 pacientov dostávalo účinnú liečbu a 74 pacientov dostávalo placebo. Pacientmi boli prevažne ženy (63 %) s priemerným vekom 41 rokov (rozsah 18 až 74 rokov) a BMI
15,8 až 53,5 kg/m2, prevažne bielej rasy (69 %), čiernej rasy alebo afroamerickej rasy (21 %).
Priemerná (SEM) východisková intenzita bolesti v týchto skúšaniach bola 6,48 (0,21) v 12-hodinovom skúšaní po odstrání hallux valgus u pacientov liečených sufenatilom a 5,98 (0,30) u pacientov na placebe. V skúšaní po brušnej operácii bola priemerná východisková intenzita bolesti 5,61 (0,13) u pacientov liečených sufentanilom a 5,48 (0,18) u pacientov na placebe.
Primárnym ukazovateľom účinnosti v obidvoch skúšaniach bola časovo vážený súčet rozdielov intenzity bolesti (SPID) oproti východiskovej hodnote (merané na 11-bodovej NRS) v priebehu 12
hodín (SPID12). Pacienti liečení liekom Dzuveo dosiahli priemerné skóre SPID12, ktoré bolo lepšie
ako u pacientov na placebe (25,8 vs. 13,1) v prípade pacientov po brušnej operácii (p < 0,001) a (5,93
vs. -6,7) v prípade pacientov po odstránení hallux valgus (p = 0,005).
V obidvoch štúdiách bola povolená záchranná analgézia, pričom záchrannú liečbu z dôvodu nedostatočnej analgézie (64,8 % brušná operácia, 100 % odstránenie hallux valgus) potrebovalo viac pacientov v skupine na placebe ako v skupine liečenej sufentanilom (27,1 % brušná operácia, 70,0 % odstránenie hallux valgus). Nástup analgézie na základe rozdielu v intenzite bolesti oproti východiskovým skóre bol v prípade sufentanilu v porovnaní s placebom dlhší (p < 0,05) o 15 minút po podaní prvej dávky v štúdii po brušnej operácii a 30 minút v štúdii po odstránení hallux valgus. Väčšina (> 90 %) zdravotníckych pracovníkov považovala použitie lieku Dzuveo za jednoduché.
V dvoch placebom kontrolovaných klinických skúšaniach bol priemerný počet dávok použitých počas prvých 6 hodín dávkovania 2,8 tablety s menej častým dávkovaním v nasledujúcich 6 hodinách (priemer 1,7 tablety). Priemerný počet dávok lieku Dzuveo podaných v priebehu 24 hodín bol 7,0 (210 mikrogramov/deň). Pacienti s vyššou intenzitou bolesti jednu hodinu po začatí liečby liekom Dzuveo potrebovali častejšie opätovné dávkovanie v porovnaní s pacientmi s nižším skóre intenzity bolesti jednu hodinu po začatí liečby.'
Respiračná depresia
Analgetické dávky sufentanilu viedli u niektorých pacientov v klinických skúšaniach k účinkom utlmujúcim dýchanie, žiadny pacient liečený liekom Dzuveo však nepotreboval liek na zvrátenie účinku opiodu (napr. naloxón).
5.2 Farmakokinetické vlastnosti
Absorpcia
Farmakokinetiku sufentanilu po podaní lieku Dzuveo možno opísať ako dvojkompartmentový model s
absorpciou prvého rádu. Táto cesta podávania vedie k vyššej absolútnej biologickej dostupnosti ako perorálne (po prehltnutí) podávanie, pretože sa obíde metabolizmus prostredníctvom enzýmu 3A4 v
čreve a prvý prechod pečeňou. Priemerná absolútna biologická dostupnosť po jednom sublingválnom
podaní tablety sufentanilu v porovnaní s jednominútovou intravenóznou infúziou sufentanilu v rovnakej dávke bola 53 %.
V štúdii, v ktorej sa skúmala sublingválna tableta sufentanilu s dávkou 15 mikrogramov (rovnaká formulácia ako tableta s dávkou 30 mikrogramov), sa po perorálnom príjme (po prehltnutí) pozorovala podstatne nižšia biologická dostupnosť 9 %. Pri bukálnom podávaní sa preukázala zvýšená biologická dostupnosť o 78 %, ak sa tablety umiestnili pred predné dolné zuby.
Maximálne koncentrácie sufentanilu sa dosiahnu približne 60 minút po jednorazovej dávke; tento čas sa skráti na približne 40 minút po opakovanom dávkovaní každú hodinu. Ak sa liek Dzuveo podáva každú hodinu, plazmatické koncentrácie v rovnovážnom stave sa dosiahnu pri použití 7 dávok.
Distribúcia
Centrálny distribučný objem po intravenóznej aplikácii sufentanilu je približne 14 litrov a distribučný
objem v rovnovážnom stave je približne 350 litrov.
Biotransformácia
Biotransformácia prebieha najmä v pečeni a v tenkom čreve. Sufentanil sa u ľudí metabolizuje najmä
enzymatickým systémom cytochrómu P450-3A4 (pozri časť 4.5). Sufentanil sa rýchlo metabolizuje na niekoľko neaktívnych metabolitov, pričom hlavnými cestami eliminácie sú oxidatívna N-dealkylácia a O-dealkylácia.
Eliminácia
Klírens prvej dávky lieku Dzuveo u typického pacienta s hmotnosťou 78,5 kg vo veku 47 rokov je
84,2 l/h. Klírens v rovnovážnom stave je 129,3 l/h. Hlavnými kovariátmi pre klírens sú hmotnosť a
vek pacienta.
Po jednorazovom podaní lieku Dzuveo sa pozoroval priemerný terminálny fázový polčas 13,4 hodiny
(rozsah 2,5 až 34,4 hodiny). Po viacerých podaniach sa pozoroval dlhší priemerný terminálny polčas
15,7 hodiny (rozsah 2,4 až 42,7 hodiny) v dôsledku vyšších plazmatických koncentrácií sufentanilu dosiahnutých po opakovanom podávaní a vďaka možnosti kvantifikovať tieto koncentrácie v priebehu dlhšieho času.
Farmakokinetický/farmakodynamický vzťah
Pri podávaní lieku Dzuveo je klinické trvanie analgézie väčšinou určené časom do poklesu
plazmatickej koncentrácie sufentanilu z Cmax na 50 % Cmax po ukončení dávkovania (kontextový senzitívny polčas alebo CST ½ ) namiesto terminálneho polčasu. Stredný CST ½ ostal buď po jednej dávke alebo po viacerých dávkach podávaných každú hodinu v priebehu 12 hodín na úrovni 2,3 hodiny: sublingválna cesta podania teda podstatne predlžuje trvanie účinku spojeného s intravenóznym podávaním sufentanilu (CST ½ 0,1 hodiny). Podobné hodnoty CST½ sa pozorovali po jednorazovej dávke aj po opakovanom podávaní, čo dokazuje, že trvanie účinku po podaní viacerých sublingválnych tabliet je predvídateľné a stabilné.
Pacienti potrebovali dávky lieku Dzuveo na udržanie plazmatických koncentrácií sufentanilu s priemerom 40 – 50 pg/ml po 12 hodinách, bez účinku na základe veku alebo indexu telesnej hmotnosti (BMI), alebo miernej alebo stredne závažnej poruchy funkcie obličiek alebo pečene.
Osobitné populácie
Porucha funkcie obličiek
Na základe populačnej farmakokinetickej analýzy plazmatických koncentrácií sufentanilu po použití lieku Dzuveo sa neidentifikovala renálna funkcia ako významný kovariát pre klírens. Vzhľadom na obmedzený skúmaný počet pacientov so závažnou poruchou funkcie obličiek sa má však liek Dzuveo používať u takýchto pacientov obozretne (pozri časť 4.4).
P
orucha funkcie pečene
Na základe populačnej farmakokinetickej analýzy lieku Dzuveo sa hepatálna funkcia neidentifikovala ako významný kovariát pre klírens. Vzhľadom na obmedzený počet pacientov so stredne závažnou až závažnou poruchou funkcie pečene sa možno neidentifikoval potenciálny účinok hepatálnej dysfunkcie ako kovariát pre klírens. Liek Dzuveo sa má preto u takýchto pacientov používať obozretne (pozri časť 4.4).
Pediatrická populácia
K dispozícii nie sú žiadne farmakokinetické údaje pre sufentanil u pediatrických pacientov.
Starší pacienti
Neuskutočnili sa žiadne špeciálne populačné štúdie s liekom Dzuveo u starších pacientov. Populačná farmakokinetická analýza lieku Dzuveo preukázala vplyv veku s 18 % znížením klírensu u starších pacientov (starší ako 65 rokov).
Vplyv BMI na dávkovanie
Populačná farmakokinetická analýza s hmotnosťou ako kovariátom preukázala, že pacienti s vyšším
BMI potrebujú častejšie dávkovanie.
5.3 Predklinické údaje o bezpečnosti
Reprodukčná toxicita
U samcov a samíc potkanov sa uskutočnili štúdie fertility a skorého embryonálneho vývinu. Vo
všetkých liečebných skupinách sa zaznamenala zvýšená mortalita.
Po liečbe samcov sa zaznamenala nižšia miera brezivosti, čo naznačuje možný nežiaduci účinok na fertilitu samcov. U samíc, ktorým boli podávané vysoké dávky, sa zaznamenala zvýšená rezorpcia plodov a znížená veľkosť vrhu, z čoho vyplýva možná fetotoxicita, pravdepodobne v dôsledku toxického účinku na matky.
Mutagenita
Amesov test neodhalil mutagénny účinok sufentanilu.
Karcinogenita
So sufentanilom sa neuskutočnili štúdie karcinogenity.
Lokálna tolerancia
Uskutočnili sa dve štúdie lokálnej tolerancie sublingválnych tabliet sufentanilu v lícnom vačku
škrečkov. Na základe týchto štúdií sa dospelo k záveru, že sublingválne tablety sufentanilu nemajú žiadny alebo majú len minimálny potenciál vyvolať lokálne podráždenie.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
manitol-E421 hydrogenfosforečnan vápenatý hypromelóza
sodná soľ kroskarmelózy
indigotín -E132 kyselina stearová stearan horečnatý
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v pôvodnom obale na ochranu pred svetlom a kyslíkom.
6.5 Druh obalu a obsah balenia
Liek Dzuveo je balený v polypropylénovom jednodávkovom aplikátore, ktorý je zabalený vo vrecku s polyesterovým filmom/LDPE/hliníkovou fóliou/LDPE s kyslíkovým absorbérom.
Liek Dzuveo bude k dispozícii v škatuliach obsahujúcich 5 a 10 vreciek. Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pokyny na použitie jednodávkového aplikátora
Liek na jedno použitie/Nepoužívajte opakovane
Nepoužívajte, ak je uzáver na váčiku poškodený Nepoužívajte, ak je jednodávkový aplikátor poškodený Poučte pacienta, aby tabletu nežul ani neprehĺtal.
Poučte pacienta, aby po podaní tablety 10 minút nejedol a nepil a obmedzil rozprávanie.
1. Ak ste pripravený podať liek, odtrhnite váčik v hornej časti s pozdĺžnym vrúbkovaním.
Váčik obsahuje jeden jednodávkový aplikátor z priehľadného plastu s jednou modrou tabletou v špičke aplikátora a vrecko s kyslíkovým absorbérom. Vrecko s kyslíkovým absorbérom sa má zlikvidovať.
Obsah váčika vyzerá takto:
PiestZámok Tableta
Tableta2. Odstráňte biely zámok zo zeleného piestu tak, že ho stlačíte a oddelíte od piestu. Zámok
zlikvidujte.

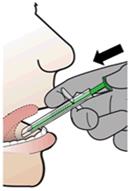
3. Povedzte pacientovi, aby sa jazykom dotkol hornej klenby úst, ak je to možné.
4. Opatrne oprite jednodávkový aplikátor o zuby alebo pery pacienta.
5. Vložte špičku jednodávkového aplikátora pod jazyk a nasmerujte na dolnú klenbu ústa pacienta. POZNÁMKA: Vyhnite sa priamemu kontaktu sliznice so špičkou jednodávkového aplikátora.
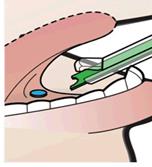
6. Stlačte zelený piest, aby ste zaviedli tabletu do sublingválneho priestoru pacienta a uistite sa, či je
tableta umiestnená.
Jednodávkový aplikátor sa musí zlikvidovať v súlade s postupmi zdravotníckeho zariadenia a
národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIFGK Representative Service GmbH Heimeranstr. 35
80339 Mníchov
Nemecko
8. REGISTRAČNÉ ČÍSLOEU/1/18/1284/001
EU/1/18/1284/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.