príznaky, ale nie častejšie než každých 12 týždňov.
Deti:
Bezpečnosť a účinnosť Dysportu v liečbe spasticity horných končatínu detí nebola preukázaná.
Spôsob podania
Pri liečbe spasticity horných končatín po cievnej mozgovej príhode u dospelých sa Dysport riedi v 1,0 ml 0,9 % roztoku chloridu sodného injekcie, čím vznikne roztok Dysportu obsahujúci 500 U v 1 ml. Dysport sa v tejto indikácii podáva intramuskulárne do vyššie spomínaných piatich svalov.
Dynamická deformita nohy (pes equinus) v dôsledku spasticity pri DMO u detských pacientov, vo veku 2 roky alebo starších:
Dávkovanie:Počiatočná odporúčaná dávka je 20 U/kg telesnej hmotnosti rozdelená do lýtkových svalov oboch končatín. Pokiaľ je postihnuté len jedno lýtko, podáva sa 10 U/kg telesnej hmotnosti. Maximálna podaná dávka nesmie prekročiť 30 U/kg alebo 1000 U podľa toho, čo sa pokladá za nižšie. Použitie elektromyografie (EMG) môže pomôcť pri identifikácii najaktívnejších svalov. Ústup príznakov sa dá očakávať v priebehu dvoch týždňov po injekcii. Injekcie sa majú opakovať približne každých 16 týždňov alebo tak, ako to vyžadujú vracajúce sa príznaky, ale nie častejšie než každých 12 týždňov. Odporúča sa byť opatrný a dávka sa má znížiť, ak sú príznaky, ktoré naznačujú, že táto dávka môže vyústiť do excesívnej slabosti cieľových svalov, ako v prípade pacientov, ktorých cieľové svaly sú malé, alebo pacientov, u ktorých sa musia podať sprievodné injekcie do iných svalových skupín. Na základe vývoja odpovede po úvodnej dávke sa nasledujúca liečba môže titrovať úhrnom v rozmedzí 10 U/kg až 30 U/kg, ktoré sa rozdelí do oboch dolných končatín.
Má sa uprednostňovať cielené podanie do m. gastrocnemius, aj keď sa má zvážiť aj injekcia do m. soleus a m. tibialis posterior.
Spôsob podávaniaPri liečbe pediatrickej spasticity pri DMO sa riedi Dysport v 1,0 ml 0,9 % roztoku chloridu sodného injekcie, čím vznikne roztok Dysportu obsahujúci 500 U v 1 ml. Dysport sa podáva intramuskulárne do lýtkových svalov tak, ako je popísané vyššie.
Liečba spastického torticollis:Dávkovanie:Dávky odporúčané na torticollis sa dajú podať dospelým každého veku za predpokladu, že majú normálnu hmotnosť a žiadne známky zmenšenej krčnej svalovej hmoty. Nižšia dávka je vhodná u pacientov so zmenšenou telesnou hmotnosťou a u starších pacientov, kde môže byť zmenšená svalová hmota.
Iniciálna odporúčaná dávka na liečbu spastického torticollis je 500 U (1 ml) na pacienta, podaná rozdelene do 2 alebo 3 najaktívnejších krčných svalov.
Pri rotačnom torticollis sa rozdelí 500 U podaním 350 U do musculus splenius capitis ipsilaterálne v smere rotácie brady/hlavy a 150 U do musculus sternocleidomastoideus kontralaterálne k rotácii.
Pri laterocollis sa rozdelí 500 U podaním 350 U do ipsilaterálneho musculus splenius capitis a 150 U do ipsilaterálneho musculus sternocleidomastoideus. V prípadoch spojených s eleváciou ramena môže vyžadovať liečbu aj ipsilaterálny musculus trapezoideus alebo musculus levator scapulae, a to pri viditeľnej hypertrofii svalu alebo podľa elektromyografických nálezov (EMG). Pokiaľ je potrebné podať injekciu do 3 svalov, rozdelí sa 500 U podaním 300 U do musculus splenius capitis, 100 U do musculus sternocleidomastoideus a 100 U do tretieho svalu.
Pri retrocollis sa rozdelí 500 U podaním 250 U do každého musculus splenius capitis. Obojstranná injekcia do musculus splenius môže zvýšiť riziko slabosti krčných svalov.
U všetkých ostatných foriem torticollis veľmi závisí na znalosti špecialistu a na EMG, aby boli určené a liečené najaktívnejšie svaly. EMG sa má používať diagnosticky na všetky komplexné formy torticollis, na prehodnotenie po neúspešnej injekcii u nekomplexných prípadov, a na zavádzanie injekcie do hlbokých svalov alebo u pacientov s nadváhou so zle palpovateľnými krčnými svalmi.
Pri opakovanom podaní môže byť dávka prispôsobená klinickej odpovedi a pozorovaným nežiaducim účinkom. Odporúča sa rozmedzie dávok od 250 U do 1000 U. Vyššia dávka už môže byť spojená so zvýšením nežiaducich účinkov, predovšetkým dysfágie. Maximálna podaná dávka nesmie presiahnuť 1000 U.
Ústup symptómov pri torticollis sa dá očakávať v priebehu týždňa po injekcii. Injekcia sa má opakovať približne každých 16 týždňov alebo tak,
ako to vyžadujú vracajúce sa príznaky, ale nie častejšie než každých 12 týždňov.Deti:Bezpečnosť a účinnosť Dysportu u detí v liečbe spastického torticollis nebola preukázaná.
Spôsob podávaniaNa liečbu spastického torticollis sa Dysport pripraví pridaním 1 ml 0,9 % roztoku chloridu sodného injekcie, aby sa získal roztok obsahujúci 500 U v 1 ml Dysportu. Dysport sa podáva intramuskulárnou injekciou do určených miest.
Liečba blefarospazmu a hemifaciálneho spazmu:Dávkovanie:V klinických štúdiách skúmajúcich dávku použitého Dysportu na liečbu benigného esenciálneho blefarospazmu bola dávka 40 U na jedno oko významne účinná. Dávka 80 U na jedno oko mala za následok dlhšie trvanie účinku. Avšak výskyt lokálnych nežiaducich účinkov (najmä ptóza), boli závislé na dávke.
Injekcia 10 U (0,05 ml ) sa má podať mediálne a 10 U (0,05 ml ) laterálne do spojenia medzi preseptálnou a orbitálnou časťou horného (3 a 4) a dolného musculus orbicularis oculi (5 a 6) každého oka.
Za účelom zníženia rizika ptózy, je potrebné sa vyvarovať injekcie blízko musculus levator palpebrae superioris.
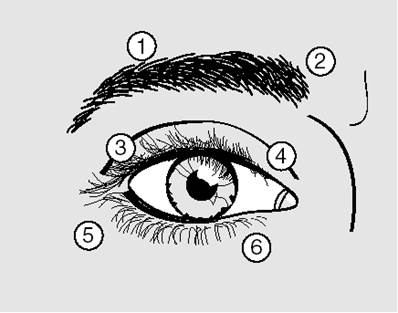
Pri injekcii do horného viečka sa ihla má smerovať von z jeho stredu, aby nebol zasiahnutý musculus levator. Priložený obrázok má pomôcť v umiestnení injekcií. Začiatok ústupu symptómov sa dá očakávať v priebehu 2 až 4 dní s maximálnym efektom za 2 týždne.
Injekcie sa majú opakovať približne každých 12 týždňov alebo podľa potreby k prevencii návratu príznakov, ale nie častejšie než každých dvanásť týždňov. Pri nasledujúcom podaní, ak odpoveď počiatočnej liečby je považovaná za nedostatočnú, potreba dávky môže byť zvýšená na 60 jednotiek: 10 U (0,05 ml) mediálne a 20 U (0,1 ml) laterálne, na 80 jednotiek: 20 U (0,1 ml) mediálne a 20 U (0,1 ml) laterálne alebo až na 120 jednotiek: 20 U (0,1 ml) mediálne a 40 U (0,2 ml) laterálne nad a pod každé oko podľa vyššie popísaného spôsobu. Je možné injikovať rovnaké miesta v musculus frontalis nad obočím (1 a 2), ak spazmus prekáža zraku.
V prípade jednostranného blefarospazmu sa injekcie obmedzia na postihnuté oko.
Pacienti s hemifaciálnym spazmom sa majú liečiť ako pri jednostrannom blefarospazme.
Odporúčané dávky sa dajú podať dospelým každého veku vrátane starších pacientov.
V liečbe blefarospazmu a hemifaciálneho spazmu, maximálna dávka nemá prekročiť celkovú dávku 120 U na jedno oko.
Deti:
Bezpečnosť a účinnosť Dysportu v liečbe blefarospazmu a hemifaciálneho spazmu u detí nebola preukázaná.
Spôsob podávaniaNa liečbu blefarospazmu alebo hemifaciálneho spazmu sa Dysport pripraví pridaním 2,5 ml
0,9 % roztoku chloridu sodného injekcie, aby sa dosiahlo riedenie roztoku obsahujúce 200 U v 1 ml Dysportu. Dysport sa podáva subkutánnou injekciou mediálne a laterálne do spojenia medzi preseptálnou a orbitálnou časťou horného a dolného musculus orbicularis oculi.
Axilárna hyperhidrózaDávkovanie:
Odporúčaná počiatočná dávka je 100 U na podpazušie. Ak požadovaný efekt sa nedostaví, v opakovaných aplikáciách sa môže zvýšiť dávka až na 200 U.
Maximálna podaná dávka nesmie presiahnuť 200 U na axillu.
Oblasť, ktorá sa má ošetriť, sa má určiť dopredu Minorovým „jódamidovým“ testom. Obe axily sa majú očistiť a dezinfikovať. Liek sa má injikovať do 10 bodov intradermálne po 10 U a tak sa dosiahne celková dávka 100 U. Maximálny účinok sa dostaví na druhý týždeň po aplikácii. Vo väčšine prípadov odporúčaná dávka zabezpečí 48 týždňový ústup potenia. Ďalšia aplikácia sa má načasovať individuálne, keď pacientove potenie sa vráti k hodnotám pred aplikáciou, ale nie častejšie ako každých 12 týždňov. Existujú dôkazy komulatívneho efektu opakovaných dávok, a preto tieto sa musia určiť individuálne. U palmárnej hyperhidrózy je celková dávka na jednu dlaň 120 U subkutánne, rozmiestnená do 6 rôznych miest, 20 U na jedno injekčné miesto.
Deti: Bezpečnosť a účinnosť Dysportu v liečbe hyperhidrózy detí nie je dokázaná.
Spôsob podávania
Na liečbu axilárnej hyperhidrózy sa Dysport rekonštituuje s 2, 5 ml 0,9 % roztoku chloridu sodného injekcie, ktorý obsahuje 200 jednotiek na 1 ml Dysportu a podáva sa intradermálnou injekciou tak, ako je popísané vyššie. Dysport sa aplikuje intradermálnou injekciou na desiatich miestach.
Hyperfunkčné línie na tváriDávkovanie:Na liečbu hyperfunkčných línií na tvári sa odporúča použiť elektromyografiu s cieľom získať maximálny terapeutický efekt pri minimálnej možnej použitej dávke lieku.
Dávku musí stanoviť lekár na základe svalovej sily a svalovej kinetiky pacienta.
Aplikácia sa vykonáva intramuskulárne do svalu súvisiaceho s hyperfunkčnou líniou, a to injekčnou striekačkou s inzulínovou ihlou 30 ½ gauge.
Objem sa môže líšiť podľa rekonštitúcie (nariedenia), o ktorom rozhodne lekár podľa toho, aký objem považuje za najvhodnejší pre daného pacienta.
Odlíčte a dezinfikujte pokožku lokálnym antiseptikom v glabelárnej oblasti. Intramuskulárnu injekciu treba aplikovať do pokožky pod pravým uhlom pri použití sterilných ihiel veľkosti 29 – 30.
Odporúčaná dávka 50 jednotiek (0,25 ml) Dysportu sa musí rozdeliť do 5 injekčných miest.
10 jednotiek je nutné intramuskulárne aplikovať do každého z piatich miest: 2 injekcie do zvrašťovača obočia (corrugator supercilii) v 5 mm rozmedzí a jedna injekcia do štíhleho svalu (musculus procerus) blízko nazálno frontálneho oblúka.
Najvnútornejší bod,
corrugator, sa nachádza 8 mm od
procerus a 8 mm od vrchnej strany očnice. Pacient by mal pravidelne zmršťovať čelo, aby sa tieto body dali lepšie určiť.
Aby nedošlo k ptóze, je nutné vyhnúť sa injekciám do oblasti
levator palpebrae superoris. Vpichy do laterálneho
corrugatora musia byť vykonané aspoň 1cm nad oblasťou nadočnicovej kosti.
(obr.:C1- C2: Corrugator supercilii/ P: Musculus procerus).


Injekcie sa musia opakovať približne každých 16 týždňov. Prestávka medzi injekciami nemá byť menej ako 3 mesiace.
Vejáriky vrások: 30 U - 45 U na každej strane, rozmiestnených do troch bodov od 10 U do 15 U v úrovni očného kútika a 1 cm laterálne k laterálnej stene orbity. Ďalší bod leží 1,5 cm pod vyššie uvedeným bodom a mierne mediálne od prvého aplikačného miesta.
Aby sa dosiahol lepší výsledok liečby, môže sa aplikačné miesto jemne masírovať, silnejšie vonkajším smerom. Je možné pridať aplikačné miesta, je však treba mať na pamäti, že účinok toxínu sa obvykle rozšíri v oblasti 1 cm od injekčného miesta. Táto injekcia môže spôsobiť diplopiu, ektropium a asymetrický úsmev z poškodenia hornej časti m. zygomaticus.
Horizontálne línie v oblasti čela: aplikuje sa 30 U - 45 U pre parciálnu liečbu a 60 U - 80 U pre úplnú paralýzu. Zdanlivá čiara sa vedie horizontálne cez čelo medzi obočím a vlasovou čiarou. Do každého bodu sa aplikuje 6 U. Počiatočná čiara môže začínať na vertikálnej čiare prechádzajúcej cez každú pupilu. Medzi tieto dve miesta sa aplikujú dve ďalšie injekcie s rovnakými dávkami, takže celkom sa liek podá na tejto horizontálnej čiare do štyroch rovnako vzdialených miest. Miesta aplikácie sa pevne masírujú.
Pevne masírujte nasledujúce miesta; krk (platyzma) 90 U - 180 U celkom na oboch stranách. Vyššie dávky môžu spôsobiť dysfágiu alebo slabosť krčných svalov z pôsobenia toxínu na svalovú skupinu v blízkosti miesta aplikácie.
Poučte pacienta, aby vyvolal kontrakciu platyzmy, čím sa zreteľne ukážu pruhy platyzmy.
Celková dávka 45 U sa aplikuje do 3 miest (15 U do každého miesta). Normálne sa liek aplikuje pri každej návšteve do 2 - 4 oblastí, celkom teda 90 U - 180 U. Horizontálne línie sa liečia podaním 60 U - 90 U pozdĺž línií vo vzdialenostiach 2-3 cm.
Línie v hornej oblasti pery: aplikuje sa 6 U - 27 U, 3 U - 6 U na líniu. Začína sa s nižšou dávkou a povrchnejšie, aby sa neohrozila činnosť úst. Sulcus nasolabialis – 6 U - 10 U na každej strane za EMG lokalizácie m. levator labii superioris a nosného krídla. Oblasť brady – 15 U - 30 U. Injekcie v tejto oblasti môžu ľahko viesť k poškodeniu funkcie úst. Použite nižšiu počiatočnú dávku. Stupňujte oslabovanie ďalšími aplikáciami pri opakovaných návštevách. Účinok začína obvykle za 4-72 hodín po podaní a trvá 4-6 mesiacov.
Deti: Použitie Dysportu pri liečbe hyperfunkčných línií na tvári sa neodporúča u pacientov mladších ako 18 rokov.
Spôsob podávaniaStredná časť veka (gumová zátka), ktorá je vystavená vplyvu vzduchu, sa musí bezprostredne pred prepichnutím gumovej zátky očistiť alkoholom.
rekonštitúcia LIEku Dysportfyziologický roztok
| jednotky / 0,1 ml
|
1,66 ml
| 30 U
|
2,5 ml
| 20 U
|
3,3 ml
| 15 U
|
4,0 ml
| 12,5 U
|
Pri liečbe hyperfunkčných línií na tvári a hyperhidrózy sa musí urobiť rekonštitúcia (nariedenie) podľa indikácií pomocou tabuľky rekonštitúcia LIEku Dysportu vedenej vyššie. Lekár určí správne dávkovanie na základe klinickej anamnézy pacienta.
Pri liečbe hyperfunkčných línií na tvári sa liek musí rekonštituovať 0,9 % roztokom chloridu sodného pre intravenózne použitie (fyziologický roztok). Liek sa musí aplikovať intramuskulárne, obvykle ihlou 30 G do vopred určených oblastí.
Pri liečbe glabelárnych vrások má byť liek pred injekciou pripravený pomocou 0,6 ml roztoku chloridu sodného 9 mg/ml (0,9 %). Toto poskytne číry roztok obsahujúci 125 Ipsenove jednotky aktívneho roztoku.
Jednotky liečiva (botulotoxín typ A) sú špecifické pre tento liek a nesmú byť použité ako numericky rovnocenné u iných prípravkov obsahujúcich botulotoxín typ A. Štúdie klinickej ekvivalencie ukazujú na pomer jednotiek 1:3 medzi botulotoxínom typu A amerického a európskeho pôvodu. Dávku a riedenie musí určiť odborný lekár, pričom berie do úvahy kinetické svalové rozdiely medzi jednotlivými pacientmi.
4.3 KontraindikáciePrecitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaníHlásené boli nežiaduce účinky súvisiace so šírením toxínu mimo miesta aplikácie (pozri časť 4.8).
U pacientov liečených terapeutickými dávkami sa môže vyskytnúť nadmerná svalová slabosť.
Riziko výskytu týchto nežiaducich účinkov môže byť znížené použitím najnižšej účinnej dávky a neprekročením maximálnej odporučenej dávky.
Dysport sa má použiť s opatrnosťou pod prísnym dohľadom a u pacientov so subklinickými alebo klinickými známkami zistiteľnej poruchy neuromuskulárneho prenosu (napr. myasténia gravis). Títo pacienti môžu mať na lieky ako je Dysport zvýšenú citlivosť, ktorá môže viesť k nadmernej slabosti svalov.
Pri liečbe spasticity súvisiacej s detskou mozgovou obrnou má byť Dysport použitý len u detí starších ako 2 roky.
Odporúčané dávkovanie a frekvencia podávania Dysportu sa nesmie prekročiť.
U pacientov liečených terapeutickými dávkami sa môže vyskytnúť nadmerná svalová slabosť.
U pacientov s primárnymi neurologickými poruchami vrátane ťažkostí s prehĺtaním je zvýšené riziko výskytu týchto nežiaducich účinkov. U týchto pacientov musí byť liečba použitá pod dozorom lekára špecialistu a má sa použiť len vtedy, ak sa zhodnotí, že prínos liečby vyváži riziko.
Dysport sa má podávať s opatrnosťou u pacientov s už existujúcimi problémami s prehĺtaním alebo dýchaním, nakoľko tieto sa môžu zhoršiť a následne rozšíriť účinok toxínu do príslušných svalov. Zriedkavo sa pozorovala ašpirácia a je rizikom pri liečbe pacientov s chronickým respiračným ochorením.
Pacienti a opatrovatelia musia byť poučení tak, aby vyhľadali okamžité lekárske ošetrenie ak sa objavia poruchy prehĺtania, reči alebo dýchania.
Tréning: firma pomôže s tréningom na podávanie injekcií Dysportu.
Dysport sa nesmie používať na liečbu spasticity u pacientov, ktorým sa vyvinula fixovaná kontraktúra.
Je dôležité sledovať pacientovu anatómiu tváre pred podaním Dysportu na reguláciu glabelárnych a laterálnych očných línii. Asymetria tváre, ptóza, neúmerné uvoľňovanie kože, zjazvenie, a hociktoré zmeny tejto anatómie ako výsledok predchádzajúcich chirurgických zákrokov majú byť brané do úvahy.
Tvorba protilátok proti botulínovému toxínu bola vyšetrovaná u malého počtu pacientov liečených Dysportom. Klinicky môžu byť neutralizujúce protilátky zistené významné zníženou odpoveďou a/alebo potrebou trvalého užívania vyšších dávok.
Ako pri každej intramuskulárnej injekcii má byť Dysport používaný iba u tých pacientov, kde je to naozaj nutné - v prípade dlhotrvajúcich krvácaní, infekcií alebo zápalov na príslušnom mieste.
Dysport má byť použitý len na liečbu jedného pacienta. Akékoľvek nepoužité zvyšky lieky majú byť v súlade s časťou 6.6 (inštrukcie na použitie, zaobchádzanie a dispozícia). Špecifické upozornenia musia byť požadované k príprave a spôsobu podania lieku, inaktivácie a likvidácii nepoužitého nariedeného roztoku (pozri časť 6.6).
Tento liek obsahuje malé množstvo albumínu. Riziko prenosu vírusovej infekcie po použití ľudskej krvi alebo prípravkov z krvi sa nemôže vylúčiť s absolútnou istotou.
4.5 Liekové a iné interakcieÚčinky botulotoxínu sa umocňujú u liekov interferovaných priamo alebo nepriamo s neuromuskulárnou funkciou, a takéto lieky sa majú používať s opatrnosťou u pacientov liečených botulotoxínom.
4.6 Fertilita, gravidita a laktáciaExistujú obmedzené údaje o použití komplexu
Clostridium botulinum toxínu typu A - hemaglutinín u tehotných žien. Štúdie na zvieratách nesignalizujú priame a nepriame škodlivé účinky čo sa týka tehotenstva, embryonálneho/fetálneho vývoja, pôrodu alebo popôrodného vývoja, iné ako pri vysokých dávkach spôsobujúcich toxicitu u matiek (pozri časť 5.3).
Dysport má byť použitý počas tehotenstva iba pokiaľ prínos prevýši akékoľvek potenciálne riziko na plod. Pri predpísaní Dysportu tehotnej žene je potrebné ju náležité poučiť.
Nie je známe, či je komplex
Clostridium botulinum toxín A- hemaglutinín vylučovaný do materského mlieka. Exkrécia do mlieka nebola študovaná ani u zvierat. Použitie komplexu botulotoxín A- hemaglutinín počas laktácie sa neodporúča.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeExistuje potenciálne riziko svalovej slabosti alebo poruchy zraku, ktorá, pokiaľ sa vyskytne, môže dočasne narušiť schopnosť viesť vozidlo a obsluhovať stroje.
4.8 Nežiaduce účinkyVeľmi časté: (≥ 1/10).
Časté: (≥ 1/100 až < 1/10).
Menej časté: (≥ 1/1000 až< 1/100).
Zriedkavé: (≥ 1/10000 až< 1/1000).
Veľmi zriedkavé: (< 1/10000)
Všeobecné:
U približne 25% pacientov, ktorí boli liečení Dysportom počas niekoľkých klinických štúdií na blefarospazmus, hemifaciálny spazmus, torticollis, spasticitu spojenú s mozgovým ochrnutím alebo cievnu mozgovú príhodu a bočné vejáriky vrások boli pozorované nežiaduce účinky.
Okrem toho boli objavené nežiaduce účinky špecifické k jednotlivým indikáciám :
Poruchy nervového systému:Zriedkavé: neuralgická amyotrofia
Poruchy kože a podkožného tkaniva:Menej časté: svrbenie
Zriedkavé: vyrážky
Celkové ochorenia a reakcie v mieste podania:Časté: generalizovaná slabosť, únava, syndróm podobný nádche, bolesť a/alebo modrina v mieste vpichu.
Spasticita horných končatín po cievnej mozgovej príhode u dospelých:Nasledujúce nežiaduce účinky, boli hlásené u pacientov liečených Dysportom kvôlispasticite horných končatín u dospelých po cievnej mozgovej príhode:
Poruchy a ochorenia gastrointestinálneho traktu:Časté: dysfágia
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva:Časté: svalová slabosť končatín
Poranenia, otravy a procedurálne komplikácieČasté: náhodné poranenia / pády
Dysfágia bola hlásená, ak dávky presahovali 2700 jednotiek podaných naraz či postupne.
Detská spasticita pri DMO:Nasledujúce nežiaduce účinky, boli hlásené u pacientov liečených Dysportomkvôlidetskej spasticite pri DMO:
Poruchy a ochorenia gastrointestinálneho traktu:Časté: hnačka
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaČasté: svalová slabosť nohy, svalová bolesť
Poruchy obličiek a močovej sústavyČasté: močová inkontinencia
Celkové ochorenia a reakcie v miesta podania:Časté: abnormálna chôdza
Poranenia, otravy a procedurálne komplikácieČasté: náhodné poranenia spôsobené pádom
Úrazy spôsobené pádom a neprirodzenou chôdzou mohli byť zapríčinené preslabnutím svalov a/alebo lokálnym rozšírením Dysportu do iných svalov, ktoré zodpovedajú za pohyb alebo rovnováhu. '
Nežiaduce účinky pri liečbe torticollis:Nasledujúce nežiaduce účinky, boli hlásené u pacientov liečených Dysportompri liečbe torticollis:
Poruchy nervového systému:Časté: bolesť hlavy, závrat, faciálna paréza
Ochorenia očíČasté: zahmlené videnie, zníženie zrakovej ostrosti
Menej časté: diplopia, ptóza
Ochorenia dýchacej sústavy, hrudníka a mediastínaČasté: dysfónia, dýchavičnosť
Zriedkavé: aspirácia
Poruchy a ochorenia gastrointestinálneho traktu:Veľmi časté: dysfágia, sucho v ústach
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaVeľmi časté: Svalová slabosť
Časté: bolesť krku, bolesť kostrovej a svalovej sústavy, myalgia, bolesť rúk a prstov, stuhnutosť kostrovej a svalovej sústavy
Zriedkavé: svalová artrofia, porucha čeľuste
Dysfágia bola spojená s dávkovaním a vyskytla sa najčastejšie po injekcii do svalu kývača hlavy. Je potrebné dodržovať miernu diétu, pokiaľ nepominú príznaky.
Nežiaduce účinky pri liečbe blefarospazmu a hemifaciálneho spazmu:Nasledujúce nežiaduce účinky, boli hlásené u pacientov liečených Dysportompri liečbe blefarospazmu a hemifaciálneho spazmu:
Poruchy nervového systémuČasté: oslabenie faciálnych svalov
Menej časté: faciálna paralýza
Ochorenia očíVeľmi časté: ptóza
Časté: diplópia, vysušenie očí, slzenie
Zriedkavé: oftalmoplégia
Poruchy kože a podkožného tkanivaČasté: edém viečka
Zriedkavé: entropia
Vedľajšie účinky môžu byť spôsobené injekciou Dysportu do nesprávneho miesta alebo hĺbky a následnou paralýzou susedných svalových skupín.
Nežiaduce účinky pri liečbe hyperfunkčných línií na tvári:Nasledujúce nežiaduce účinky, boli hlásené u pacientov liečených Dysportompri liečbe hyperfunkčných línií na tvári:
Ochorenia očíČasté: Astenopia, ptóza, edém viečka, zvýšené slzenie, suché oko, svalové trhanie.
Zriedkavé: porucha videnia, škvrnité videnie, diplopia, porucha pohyblivostí očí.
Poruchy imunitného systému Zriedkavé: hypersenzitivita
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaČasté: slabosť priľahlého svalu v oblasti injekcie. Toto môže zvyčajne viesť k zníženiu očného viečka, astenópii alebo paréze lícneho svalu alebo poruche zraku.
Poruchy nervového systémuVeľmi časté: bolesť hlavy
Časté: paréza lícneho nervu
Poruchy kože a podkožného tkanivaMenej časté: kožná vyrážka, svrbenie
Zriedkavé: žihľavka
Nežiaduce účinky pri liečbe hyperhidrózy:Nasledujúce nežiaduce účinky boli hlásené u pacientov liečených Dysportom pri liečbe hyperhidrózy:
Poruchy nervového systémuMenej časté: závrat, bolesť hlavy, parestézia, mimovoľné svalové sťahy očného viečka
Poruchy cievMenej časté: nával horúčavy
Poruchy dýchacej sústavy, hrudníka a mediastínaČasté: dyspnoe
Menej časté: epistaxa
Poruchy kože a podkožného tkanivaČasté: kompenzačné potenie
Poruchy kostrovej a svalovej sústavy a spojivového tkanivaČasté: bolesť ramena, paže a krku, myalgia ramena a lýtka
Post-marketingová skúsenosťProfil nežiaducich účinkov hlásených spoločnosti počas post-marketingového užívania odráža farmakológiu lieku a odpovedá nežiaducim účinkom počas klinických štúdií.
Ojedinele bola hlásená hypersensitivita.
Nežiaduce účinky súvisiace so šírením toxínu mimo miesta aplikácie boli hlásené veľmi zriedkavo (zvýšená svalová slabosť, dysfágia, aspiračná pneumónia s následkom smrti v niektorých prípadoch) (pozri časť 4.4).
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v
Prílohe V*.
4.9 PredávkovanieExcesívne dávky môžu spôsobiť vzdialenú a hlbokú nervosvalovú paralýzu. Predávkovanie môže viesť k zvýšenému riziku vstupu neurotoxínu do krvného obehu a môže zapríčiniť komplikácie spojené s účinkom perorálnej otravy botulotoxínom (napr. sťažené prehĺtanie a dysfónia).
Pokiaľ spôsobia excesívne dávky paralýzu respiračných svalov, môže byť nutná respiračná podpora. Neexistuje žiadne špecifické antidotum, nedá sa očakávať úspešnosť antitoxínu a odporúča sa celková podporná starostlivosť.
V prípade predávkovania má byť pacient sledovaný lekárom na prípadné známky a/alebo príznaky nadmernej svalovej slabosti alebo svalovej paralýzy. V prípade potreby môže byť začatá symptomatická liečba.
Príznaky predávkovania sa nemusia objaviť bezprostredne po injekcií. V prípade použitia náhodnej injekcii alebo perorálného užitia, pacient má byť sledovaný lekárskymi vyšetreniami až po dobu niekoľkých týždňov na prípadné známky a/alebo príznaky nadmernej svalovej slabosti alebo svalovej paralýzy.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: myorelaxans, ATC kód: M03AX01.
Clostridium botulinum typ A toxin - haemaglutinin komplex blokuje periférny cholinergický prenos na neuromuskulárnom spojení blokádou uvoľňovania acetylcholínu na presynaptickej membráne. Toxín účinkuje na nervovom zakončení, kde antagonizuje tie pochody, ktoré sú spustené Ca
2+ a vrcholí uvoľnením transmiteru. Neúčinkuje na postganglionálny cholinergický prenos ani na postganglionálny sympatický prenos.
Účinok toxínu zahŕňa iniciálny krok naviazania sa, čím sa toxín rýchle a dychtivo pripojí na presynaptickú nervovú membránu. Druhotne nastáva krok internalizácie, v ktorom toxín prechádza presynaptickou membránou, ale ešte nenastáva paralýza. Nakoniec toxín inhibuje uvoľnenie acetylcholínu prerušením Ca
2+ sprostredkovaného mechanizmu uvoľnenia acetylcholínu, čím zmenšuje potenciál platničiek a spôsobí paralýzu.
Obnova prenosu vzruchu sa objavuje postupne tak, ako pučia nové nervové zakončenia a tvorí sa kontakt s postsynaptickou motorickou platničkou. Tento proces trvá u experimentálnych zvierat 6-8 týždňov.
5.2 Farmakokinetické vlastnostiFarmakokinetické štúdie s botulínovým toxínom robia u zvierat problémy z dôvodu veľkej sily, použitej nepatrnej dávky, veľkej molekulárnej hmotnosti zlúčeniny a problémami s označením toxínu k dosiahnutiu dostatočne vysokej špecifickej aktivity. Štúdie používajúce toxín označený I
125 ukázali, že naviazanie na receptor je špecifické a nasýtiteľné, a že vysoká hustota receptorov pre toxín je faktor prispievajúci k vysokej sile. Odozva na dávku a dobu u opíc ukázala, že
v prípade nízkych dávok bolo oneskorenie 2-3 dni s maximálnym účinkom pozorovaným 5-6 dní po aplikácii. Trvanie pôsobenia, meraného zmenami vyrovnania očí a svalovej paralýzy kolísalo medzi 2 týždňami až 8 mesiacmi. Tento charakter je pozorovaný aj u ľudí a je prisudzovaný procesu naviazania, internalizácie a zmien na neuromuskulárnom spojení.
5.3 Predklinické údaje o bezpečnostiŠtúdie reprodukčnej toxicity u gravidných samíc potkanov a králikov, ktorým bol podaný komplex botulotoxín A - hemaglutinín, ako denná intramuskulárna injekcia v dávke 79 U/kg pre potkany a 42 U/kg pre králiky, nepoukázali na embryonálnu/fetálnú toxicitu.
Bolo pozorovaných niekoľko prípadov maternálnej toxicity spojených so stratou implantácie pri výsokých dávkach u oboch druhov zvierat. Komplex botulotoxín A - hemaglutinín nevykazál žiadnu teratogénnu aktivitu u potkanov a ani u králikov, taktiež neboli pozorované účinky na F1 generáciu u potkanov. Fertilita samcov a samíc bola znížená v dôsledku zníženého parenia ako dôsledok svalovej paralýzy pri vysokých dávkach.
V štúdiách chronickej toxicity uskutočnených na potkanoch až do 12 U/zviera neboli pozorované žiadne náznaky systémovej toxicity. Účinky reprodukčných štúdií a neklinických štúdií chronickej toxicity boli obmedzené na zmeny injikovaných svalov súvisiacich s mechanizmom účinku komplexu botulotixín A-hemaglutinín.
Po podaní komplexu botulotoxín A - hemaglutinín do oka králika nedošlo k žiadnemu podráždeniu očí.
6. FARMACEUTICKÉ INFORMÁCIE6.1 Zoznam pomocných látokAlbumini humani solutio 20 %, lactosum monohydricum.
6.2 InkompatibilityNie sú známe.
6.3 Čas použiteľnostiČas použiteľnosti baleného lieku skladovaného pri teplote 2 - 8
oC je 24 mesiacov.
Po nariedení je stabilita preukázaná počas 24 hodín pri teplote 2 - 8
oC.
Z mikrobiologického hľadiska sa má liek použiť ihneď. Ak liek nie je použitý ihneď, čas uchovávania a podmienky pred použitím sú v zodpovednosti používateľa a za normálnych okolností nemá byť dlhší ako 24 hodín pri teplote 2 - 8
oC.
6.4 Špeciálne upozornenia na uchovávanieNeotvorené injekčné liekovky sa musia uchovávať pri teplote medzi 2 – 8
oC.
Dysport sa musí uchovávať v chladničke na pracovisku, kde sa aplikujú injekcie, a nemá sa dávať pacientovi k skladovaniu doma.
Nariedený Dysport sa môže uchovávať v chladničke pri teplote 2 - 8
oC 24 hodín pred použitím.
Dysport nemá byť zmrazený.
6.5 Druh obalu a obsah balenia Vonkajší obal: papierová škatuľka, písomná informácia pre používateľa.
Vnútorný obal: sklenená injekčná liekovka typ I. s kapacitou 3 ml, 13 mm lyofilizovaný chlorobutylový uzáver utesnený 13 mm alumíniovou plombou s centrálnym otvorom, prekrytým.
Obsah liekovky: biely prášok
Veľkosť balenia: 1 alebo 2 injekčné liekovky po 500 U.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekomBezprostredne po liečbe pacienta má byť akýkoľvek zvyšok Dysportu (v injekčnej liekovke alebo injekčnej striekačke) inaktivovaný riedeným roztokom chlórnanu (1 % voľného chlóru). Potom sa majú všetky súčasti odstrániť v súlade so štandardnou nemocničnou praxou.
Rozliaty Dysport sa má utrieť nasávajúcou handrou namočenou v riedenom roztoku chlórnanu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIIpsen Pharma
65 Quai Georges Gorse
92100 Boulogne Billancourt
Francúzsko
8. REGISTRAČNÉ ČÍSLO63/0060/91-S
9. DÁTUM PRVEJ REGISTRÁCIE/ DÁTUM PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 03.10.1991
Dátum posledného predĺženia registrácie: 09.10.2006
10. DÁTUM REVÍZIE TEXTUFebruár 2014