
je potrebná. Avšak u pacientov, ktorí dostávajú dialyzačnú liečbu, možno uvážiť dlhší interval medzi dávkami (pozri časť 5.2).
Poškodenie funkcie pečene
Pozri časť 4.3.
Staršia populácia (≥65 rokov)
Nevyžaduje sa úprava dávkovania entakaponu u starších ľudí.
Pediatrická populácia
Bezpečnosť a účinnosť Comtanu u detí vo veku menej ako 18 rokov neboli doteraz stanovené. K
dispozícii nie sú žiadne údaje.
Spôsob podávania
Entakapon sa podáva perorálne a súčasne s každou dávkou levodopy/karbidopy alebo
levodopy/benserazidu.
Entakapon možno užívať s jedlom alebo nalačno (pozri časť 5.2).
4.3 Kontraindikácie
- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
- Poškodenie funkcie pečene.
- Feochromocytóm.
- Súčasné užívanie entakaponu a neselektívnych inhibítorov monoaminooxidázy (MAO-A a
MAO-B) (napr. fenelzínu, tranylcypromínu).
- Súčasné užívanie selektívneho inhibítora MAO-A + selektívneho inhibítora MAO-B a entakaponu (pozri časť 4.5).
- Neuroleptický malígny syndróm (NMS) a/alebo netraumatická rabdomyolýza v anamnéze.
4.4 Osobitné upozornenia a opatrenia pri používaní
Sekundárna rabdomyolýza pri závažných dyskinézach alebo neuroleptickom malígnom syndróme
(NMS) sa zriedka pozorovala u pacientov s Parkinsonovou chorobou.
Pre NMS, vrátane rabdomyolýzy a hypertermie, sú charakteristické motorické symptómy (rigidita, myoklónia, tras), zmeny duševného stavu (napr. agitovanosť, zmätenosť, kóma), hypertermia, autonómne poruchy (tachykardia, kolísanie krvného tlaku) a zvýšenie sérovej kreatínfosfokinázy. V jednotlivých prípadoch sa môžu vyskytnúť len niektoré z týchto symptómov a/alebo nálezov.
NMS ani rabdomyolýza sa nezaznamenali v súvislosti s liečbou entakaponom v kontrolovaných klinických skúšaniach, v ktorých sa entakapon náhle vysadil. Od uvedenia na trh sa zaznamenali ojedinelé prípady NMS, najmä po náhlom znížení dávky alebo vysadení entakaponu a iných súbežne podávaných dopamínergických liekov. Ak sa to považuje za potrebné, má sa liečba entakaponom
a inými dopamínergickými liekmi ukončiť pomaly, a ak vzniknú príznaky a/alebo symptómy napriek pomalému vysadeniu entakaponu, môže byť potrebné zvýšiť dávkovanie levodopy.
Liečba entakaponom sa má podávať opatrne pacientom s ischemickou chorobou srdca. Entakapon môže vzhľadom na svoj mechanizmus účinku ovplyvňovať metabolizmus liečiv
obsahujúcich katecholovú skupinu a potenciovať ich účinok. Preto sa má postupovať opatrne pri
podávaní entakaponu pacientom, ktorí sa liečia liekmi metabolizovanými katechol-O- metyltransferázou (COMT), napr. rimiterolom, izoprenalínom, adrenalínom, noradrenalínom, dopamínom, dobutamínom, alfa-metyldopou a apomorfínom (pozri aj časť 4.5).
Entakapon sa vždy podáva ako adjuvancium liečby levodopou. Preto sa majú zohľadniť bezpečnostné opatrenia, ktoré platia pri liečbe levodopou, aj pri liečbe entakaponom. Entakapon zvyšuje biologickú dostupnosť levodopy zo štandardných liekov levodopy/benserazidu o 5-10 % viac ako zo
štandardných liekov levodopy/karbidopy. V dôsledku toho sa môžu nežiaduce dopamínergické reakcie vyskytovať častejšie, keď sa entakapon pridáva k liečbe levodopou/benserazidom (pozri aj časť 4.8).
Aby sa zmiernili dopamínergické nežiaduce reakcie súvisiace s levodopou, je často potrebné upraviť
dávkovanie levodopy počas prvých dní až prvých týždňov od začatia liečby entakaponom v závislosti od klinického stavu pacienta (pozri časti 4.2 a 4.8).
Entakapon môže zhoršiť ortostatickú hypotenziu vyvolanú levodopou. Musí sa postupovať opatrne pri podávaní entakaponu pacientom užívajúcim iné lieky, ktoré môžu vyvolať ortostatickú hypotenziu.
V klinických skúšaniach sa nežiaduce dopamínergické účinky, napr. dyskinézy, vyskytovali častejšie u pacientov, ktorí dostávali entakapon a agonisty dopamínových receptorov (napr. bromokriptín), selegilín alebo amantadín, ako u pacientov, ktorí dostávali placebo s touto kombináciou. Dávky iných antiparkinsoník je možno potrebné upraviť, keď sa začína liečba entakaponom.
Entakapon v spojení s levodopou sa u pacientov s Parkinsonovou chorobou dával do súvislosti so somnolenciou a epizódami náhle nastupujúceho spánku, preto je potrebná opatrnosť pri vedení vozidiel alebo obsluhe strojov (pozri aj časť 4.7).
Odporúča sa sledovať telesnú hmotnosť pacientov, u ktorých sa vyskytne hnačka, aby sa predišlo prípadnému nadmernému zníženiu ich hmotnosti. Dlhodobá alebo pretrvávajúca hnačka vyskytujúca sa počas liečby entakaponom môže byť prejavom kolitídy. V prípade dlhodobo sa vyskytujúcej alebo pretrvávajúcej hnačky sa liek má vysadiť a má sa zvážiť patričná liečba a vyšetrenia.
Pacientov je potrebné pravidelne sledovať na vznik porúch kontroly impulzov. Pacientov a ich ošetrujúcich je potrebné upozorniť, že pri liečbe dopamínovými agonistami a/alebo pri inej dopamínergickej liečbe, ako je liečba Comtanom v spojení s levodopou, sa môžu vyskytnúť
v správaní prejavy porúch kontroly impulzov, ktoré zahŕňajú patologické hranie hazardných hier, zvýšené libido, hypersexualitu, kompulzívne míňanie a nakupovanie, záchvatové prejedanie a
kompulzívne prejedanie sa. V prípade vzniku uvedených príznakov sa odporúča prehodnotenie liečby.
U pacientov, u ktorých sa vyskytne progredujúca anorexia, asténia a pokles telesnej hmotnosti v pomerne krátkom čase, sa má zvážiť vyhodnotenie celkového stavu lekárom, vrátane funkcie pečene.
Tablety Comtan obsahujú sacharózu. Preto pacienti so zriedkavými dedičnými problémami
intolerancie fruktózy, glukózo-galaktózovej malabsorpcie alebo deficitu sacharázy a izomaltázy nesmú užívať tento liek.
4.5 Liekové a iné interakcie
Nepozorovali sa žiadne interakcie entakaponu s karbidopou pri odporúčanej schéme liečby. Farmakokinetické interakcie s benserazidom sa nesledovali.
V štúdiách jednorazového podania zdravým dobrovoľníkom sa nepozorovali žiadne interakcie medzi entakaponom a imipramínom alebo medzi entakaponom a moklobemidom. Podobne sa nepozorovali žiadne interakcie medzi entakaponom a selegilínom v štúdiách po opakovanom podaní pacientom s Parkinsonovou chorobou. Zatiaľ sú však len obmedzené skúsenosti s klinickým použitím entakaponu spolu s viacerými liečivami vrátane inhibítorov MAO-A, tricyklických antidepresív, inhibítorov spätného vychytávania noradrenalínu, ako je desipramín, maprotilín a venlafaxín, a liečiv metabolizovaných COMT (napr. látok s katecholovou štruktúrou: rimiterolu, izoprenalínu, adrenalínu, noradrenalínu, dopamínu, dobutamínu, alfa-metyldopy, apomorfínu a paroxetínu). Pri užívaní týchto liečiv súčasne s entakaponom je potrebná opatrnosť (pozri aj časti 4.3 a 4.4).
Entakapon možno užívať so selegilínom (selektívnym inhibítorom MAO-B), ale denná dávka selegilínu nemá byť vyššia ako 10 mg.
Entakapon môže tvoriť cheláty so železom v gastrointestinálnom trakte. Entakapon a lieky obsahujúce železo sa majú užívať s odstupom aspoň 2-3 hodín (pozri časť 4.8).
Entakapon sa viaže na väzbové miesto II ľudského albumínu, ktoré viaže aj niekoľko iných liečiv vrátane diazepamu a ibuprofénu. Štúdie klinických interakcií s diazepamom a nesteroidnými protizápalovými liečivami sa nevykonali. Na základe štúdií in vitro sa neočakáva významné vytesňovanie z väzby pri terapeutických koncentráciách liečiv.
Entakapon môže vzhľadom na svoju afinitu k cytochrómu P450 2C9 in vitro (pozri časť 5.2) prípadne ovplyvňovať liečivá, ktorých metabolizmus závisí od tohto izoenzýmu, napr. S-warfarín. V štúdii interakcií u zdravých dobrovoľníkov však entakapon nemenil plazmatické hladiny S-warfarínu, zatiaľ čo AUC R-warfarínu sa zvýšilo priemerne o 18 % [CI90 11-26 %]. Hodnoty INR sa zvýšili v priemere o 13 % [CI90 6-19 %]. Preto sa odporúča sledovanie INR, keď sa začína liečba entakaponom u pacientov, ktorí dostávajú warfarín.
4.6 Fertilita, gravidita a laktácia
Gravidita
Žiadne zjavné teratogénne alebo primárne fetotoxické účinky sa nepozorovali v štúdiách na
zvieratách, v ktorých boli hladiny expozície entakaponu podstatne vyššie, ako sú terapeutické hladiny expozície. Pretože nie sú skúsenosti s gravidnými ženami, entakapon sa nemá používať
počas gravidity.
Dojčenie
V štúdiách na zvieratách sa entakapon vylučoval do mlieka. Bezpečnosť entakaponu u dojčiat nie je
známa. Ženy nemajú dojčiť počas liečby entakaponom.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Comtan v spojení s levodopou môže mať veľký vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Entakapon môže spolu s levodopou vyvolať závraty a symptomatickú ortostatickú hypotenziu. Preto je potrebná opatrnosť pri vedení vozidiel alebo obsluhe strojov.
Pacienti liečení entakaponom v spojení s levodopou, u ktorých sa vyskytne somnolencia a/alebo epizódy náhle nastupujúceho spánku, musia byť poučení o tom, že nemajú viesť vozidlá a vykonávať činnosti, pri ktorých následkom zníženej pozornosti môžu vystaviť seba alebo iných riziku vážneho zranenia alebo usmrtenia (napr. pri obsluhe strojov), a to až dovtedy, kým takéto opakujúce sa epizódy nezmiznú (pozri aj časť 4.4).
4.8 Nežiaduce účinky
Súhrn bezpečnostného profilu
Najčastejšie nežiaduce účinky vyvolané entakaponom súvisia so zvýšenou dopamínergickou
účinnosťou a vyskytujú sa zvyčajne na začiatku liečby. Zníženie dávkovania levodopy zmierňuje závažnosť a častosť týchto účinkov. Inou dôležitou skupinou nežiaducich účinkov sú gastrointestinálne symptómy vrátane nauzey, vracania, bolesti brucha, zápchy a hnačky. Moč sa môže entakaponom sfarbiť na červenohnedo, čo je však neškodný jav.
Nežiaduce účinky vyvolané entakaponom sú zvyčajne slabé až stredne silné. V klinických skúšaniach najčastejšie nežiaduce účinky, ktoré mali za následok ukončenie liečby entakaponom, boli
gastrointestinálne symptómy (napr. hnačka, 2,5 %) a zosilnené dopamínergické nežiaduce účinky levodopy (napr. dyskinézy, 1,7 %).
Dyskinézy (27 %), nauzea (11 %), hnačka (8 %), bolesť brucha (7 %) a suchosť v ústach (4,2 %) sa zaznamenali významne častejšie pri entakapone ako pri placebe podľa zlúčených údajov z klinických skúšaní, ktorých sa zúčastnilo 406 pacientov užívajúcich skúšaný liek a 296 pacientov užívajúcich placebo.
Niektoré z nežiaducich účinkov, ako je dyskinéza, nauzea a bolesť brucha, sa môžu častejšie vyskytovať pri vyšších dávkach (1 400 až 2 000 mg denne) ako pri nižších dávkach entakaponu.
Tabuľkový prehľad nežiaducich reakciíNasledujúce nežiaduce účinky, ktoré sú uvedené v Tabuľke 1, sa zaznamenali súhrnne v klinických
skúšaniach entakaponu a po uvedení entakaponu na trh.
Tabuľka 1* Nežiaduce účinky liekuPsychické poruchyČasté: Nespavosť, halucinácie, zmätenosť, nepríjemné sny
Veľmi zriedkavé: Agitovanosť
Poruchy nervového systémuVeľmi časté: Dyskinéza
Časté: Zhoršenie Parkinsonovej choroby, závraty, dystónia, hyperkinéza
Poruchy srdca a srdcovej činnosti**Časté: Ischemické srdcové príhody iné ako infarkt myokardu (napr. angina pectoris)
Menej časté: Infarkt myokardu
Poruchy gastrointestinálneho traktuVeľmi časté: Nauzea
Časté: Hnačka, bolesť brucha, suchosť v ústach, zápcha, vracanie
Veľmi zriedkavé: Anorexia
Neznáme: Kolitída
Poruchy pečene a žlčových ciestZriedkavé: Abnormálne hodnoty testov funkcie pečene
Neznáme: Hepatitída s prevažne cholestatickými príznakmi (pozri časť
4.4)
Poruchy kože a podkožného tkanivaZriedkavé: Erytematózny alebo makulopapulárny exantém
Veľmi zriedkavé: Urtikária
Neznáme: Zmena sfarbenia kože, vlasov, brady a nechtov
Poruchy obličiek a močových ciestVeľmi časté: Zmena farby moču
Celkové poruchy a reakcie v mieste podaniaČasté: Únava, zvýšené potenie, pády
Veľmi zriedkavé: Zníženie telesnej hmotnosti
* Nežiaduce účinky sú zoradené podľa častosti ich výskytu, najčastejšie ako prvé, pri čom sa používajú nasledujúce dohodnuté kritériá: veľmi časté (≥1/10); časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100); zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000), neznáme (z dostupných údajov, pretože žiadny platný odhad sa nedá odvodiť z klinických skúšaní alebo epidemiologických štúdií).
** Hodnoty incidencie infarktu myokardu a iných ischemických srdcových príhod (0,43 %
a 1,54 %) sa získali analýzou 13 dvojito slepých štúdií s 2 082 zaradenými pacientmi s kolísaním motorických príznakov na konci účinku dávky, ktorí dostávali entakapon.
Popis vybraných nežiaducich reakcií
Entakapon v spojení s levodopou sa dával do súvislosti s ojedinelými prípadmi výraznej somnolencie
počas dňa a epizódami náhle nastupujúceho spánku.
Poruchy kontroly impulzov: Patologické hranie hazardných hier, zvýšené libido a hypersexualita, kompulzívne míňanie a nakupovanie, záchvatové prejedanie a kompulzívne prejedanie sa môžu vyskytnúť u pacientov liečených dopamínovými agonistami a/alebo pri inej dopamínergickej liečbe, napr. pri Comtane v spojení s levodopou (pozri časť 4.4).
Ojedinelé prípady NMS sa zaznamenali po náhlom znížení dávky alebo vysadení entakaponu a inej dopamínergickej liečby.
Zaznamenali sa ojedinelé prípady rabdomyolýzy.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieÚdaje po uvedení lieku na trh zahŕňajú ojedinelé prípady predávkovania, pri ktorých najvyššia hlásená denná dávka entakaponu bola 16 000 mg. K akútnym príznakom a prejavom v týchto prípadoch predávkovania patrili zmätenosť, znížená aktivita, somnolencia, hypotónia, zmena sfarbenia kože
a urtikária. Liečba akútneho predávkovania je symptomatická.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: iné dopaminergické liečivá, ATC kód: N04BX02.
Entakapon patrí do novej terapeutickej triedy, medzi inhibítory katechol-O-metyltransferázy (COMT). Je reverzibilným, špecifickým a prevažne periférne pôsobiacim inhibítorom COMT, určeným na súčasné podávanie s liekmi levodopy. Entakapon inhibíciou enzýmu COMT znižuje metabolické'
straty levodopy, ktoré vznikajú jej premenou na 3-O-metyldopu (3-OMD). To má za následok vyššiu hodnotu AUC levodopy. Množstvo levodopy dostupné pre mozog sa zvyšuje. Entakapon tak predlžuje
klinickú odpoveď na levodopu.
Entakapon inhibuje enzým COMT prevažne v periférnych tkanivách. Inhibícia COMT v erytrocytoch tesne sleduje koncentrácie entakaponu v plazme, čo zjavne poukazuje na reverzibilnú povahu inhibície COMT.
Klinické skúšaniaV dvoch dvojito slepých klinických skúšaniach fázy III sa podával entakapon alebo placebo s každou
dávkou levodopy/inhibítora dopadekarboxylázy celkovo 376 pacientom s Parkinsonovou chorobou a kolísaním motorických príznakov na konci účinku dávky. Výsledky sú uvedené v Tabuľke 2. V
klinickom skúšaní I sa stanovoval každodenný čas „ON“ (v hodinách) z údajov v domácich denníkoch
pacientov a v klinickom skúšaní II sa stanovoval podiel každodenného času „ON“.
Tabuľka 2 Každodenný čas „ON“ (priemerná hodnota ± SD)
Východisková hodnota
Klinické skúšanie I: Každodenný čas „ON“ (hod)
Entakapon (n=85) Placebo (n=86) Rozdiel
9,3±2,2 9,2±2,5
Týždeň 8-24 10,7±2,2 9,4±2,6 1 hod 20 min
(8,3 %)
CI95 % 45 min, 1 hod 56 min
Klinické skúšanie II: Podiel každodenného času „ON“ (%) Entakapon (n=103) Placebo (n=102) Rozdiel
Východisková hodnota
60,0±15,2 60,8±14,0
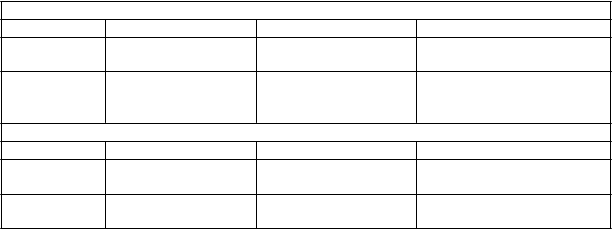 Týždeň 8-24
Týždeň 8-24 66,8±14,5 62,8±16,80 4,5 % (0 hod 35 min) CI95 % 0,93 %, 7,97 %
Došlo k zodpovedajúcemu skráteniu času „OFF“.
Percentuálna zmena oproti východiskovej hodnote času „OFF“ bola –24 % v skupine entakaponu a
0 % v skupine placeba v klinickom skúšaní I. Zodpovedajúce hodnoty v klinickom skúšaní II boli –
18 % a –5 %.
5.2 Farmakokinetické vlastnostiVšeobecná charakteristika liečivaAbsorpciaV absorpcii entakaponu sú veľké intra- a interindividuálne rozdiely.
Maximálna koncentrácia (Cmax) v plazme sa zvyčajne dosiahne asi za 1 hodinu po požití 200 mg tablety entakaponu. Látka sa vo veľkej miere metabolizuje pri prvom prechode pečeňou. Biologická dostupnosť entakaponu po perorálnom podaní je asi 35 %. Jedlo neovplyvňuje významne absorpciu entakaponu.
DistribúciaPo absorpcii z gastrointestinálneho traktu sa entakapon rýchlo distribuuje do periférnych tkanív,
distribučný objem v rovnovážnom stave (Vdss) je 20 litrov. Približne 92 % dávky sa eliminuje počas b- fázy s krátkym, 30-minútovým polčasom eliminácie. Celkový klírens entakaponu je asi 800 ml/min.
Entakapon sa vo veľkom rozsahu viaže na bielkoviny plazmy, hlavne na albumín. V ľudskej plazme predstavuje voľná frakcia asi 2,0 % pri terapeutickom rozmedzí koncentrácií. Pri terapeutických koncentráciách entakapon nevytesňuje iné látky s vysokým podielom viazaným na bielkoviny (napr. warfarín, kyselinu salicylovú, fenylbutazón alebo diazepam), ani nie je vo významnej miere vytesňovaný niektorou z týchto látok pri terapeutických alebo vyšších koncentráciách.
BiotransformáciaMalé množstvo entakaponu,
(E)-izoméru, sa premieňa na jeho
(Z)-izomér. Podiel
(E)-izoméru na
AUC entakaponu predstavuje 95 %.
(Z)-izomér a stopy ďalších metabolitov tvoria zvyšných 5 %.
Údaje zo štúdií
in vitro na preparátoch ľudských pečeňových mikrozómov ukazujú, že entakapon inhibuje cytochróm P450 2C9 (IC50 ~4 mmol). Entakapon inhiboval slabo alebo vôbec neinhiboval iné typy izoenzýmov P450 (CYP1A2, CYP2A6, CYP2D6, CYP2E1, CYP3A a CYP2C19) (pozri časť
4.5).
ElimináciaEntakapon sa eliminuje metabolickými dráhami prevažne mimo obličiek. Odhaduje sa, že asi
80-90 % dávky sa vylučuje stolicou, hoci u človeka sa to nepotvrdilo. Približne 10-20 % sa vylučuje močom. Iba stopy nezmeneného entakaponu sa nájdu v moči. Najväčšia časť (95 %) liečiva vylúčená močom je konjugovaná s kyselinou glukurónovou. Len asi 1 % metabolitov nájdených v moči vzniklo oxidáciou.
Charakteristika u pacientov
Farmakokinetické vlastnosti entakaponu sú podobné u mladých aj starších ľudí. Metabolizmus liečiva
je spomalený u pacientov s ľahkou až stredne ťažkou insuficienciou pečene (trieda A a B podľa
Childa-Pugha), čo má za následok zvýšenie plazmatickej koncentrácie entakaponu vo fáze absorpcie
aj eliminácie (pozri časť 4.3). Poškodenie funkcie obličiek neovplyvňuje farmakokinetiku entakaponu. U pacientov, ktorí dostávajú dialyzačnú liečbu, možno však uvážiť predĺženie intervalu medzi dávkami.
5.3 Predklinické údaje o bezpečnosti
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity po opakovanom podávaní, genotoxicity a karcinogénneho potenciálu neodhalili žiadne osobitné riziko pre ľudí. V štúdiách toxicity po opakovanom podávaní sa pozorovala anémia, ktorá bola najpravdepodobnejšie vyvolaná schopnosťou entakaponu tvoriť cheláty so železom. Pokiaľ ide o reprodukčnú toxicitu, zaznamenala sa znížená váha plodov a mierne spomalený vývoj kostí u králikov pri systémových hladinách expozície v terapeutickom rozmedzí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadro tablety
mikrokryštalická celulóza
manitol
sodná soľ kroskarmelózy hydrogénovaný rastlinný olej magnéziumstearát
Filmový obal tablety
hypromelóza
polysorbát 80
glycerol 85 %
sacharóza
žltý oxid železitý (E172) červený oxid železitý (E172) oxid titaničitý (E171) magnéziumstearát
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne zvláštne podmienky na uchovávanie.
6.5 Druh obalu a obsah baleniaFľašky z hnedého skla (hydrolytický typ III) s bielym poistným viečkom z polypropylénu, obsahujúce
30, 60 alebo 100 tabliet.
Biele fľašky polyetylénu s vysokou hustotou (HDPE) s bielym poistným polypropylénovým (PP)
viečkom, obsahujúce 30, 60 alebo 100 tabliet.
Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky na likvidáciu.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIOrion Corporation
Orionintie 1
FI-02200 Espoo
Fínsko
8. REGISTRAČNÉ ČÍSLAEU/1/98/081/001-003, 005-007
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 22. september 1998
Dátum posledného predĺženia registrácie: 03. september 2008
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu