
ertenznej krízy sa má cabozantinib vysadiť.
Osteonekróza
Pri cabozantinibe boli pozorované prípady osteonekrózy (osteonecrosis of the jaw, ONJ). Pred začatím liečby cabozantinibom a pravidelne počas liečby sa má vykonávať vyšetrenie ústnej dutiny. Pacienti
majú byť poučení o postupoch pri vykonávaní ústnej hygieny. Ak je to možné, pri invazívnych
dentálnych procedúrach sa má cabozantinib vysadiť aspoň 28 dní pred plánovanou operáciou. U pacientov, ktorí užívajú liečivá spájané s ONJ ako napríklad bisfosfonáty, je potrebná opatrnosť. U pacientov s ONJ prerušte užívanie cabozantinibu.
P
almárno-plantárny erytrodyzestetický syndróm
Pri cabozantinibe bol pozorovaný palmárno-plantárny erytrodyzestetický syndróm (PPES). V prípade ťažkého PPES by sa malo zvážiť prerušenie liečby cabozantinibom. Liečba s nižšou dávkou cabozantinibu by sa mala znovu začať až po zlepšení PPES na stupeň 1.
Proteinúria
Pri cabozantinibe bola pozorovaná proteinúria. Počas liečby cabozantinibom sa majú pravidelne
sledovať proteíny v moči. Ak sa u pacienta vyvinie nefrotický syndróm, cabozantinib sa musí prestať podávať.
Syndróm reverzibilnej posteriórnej leukoencefalopatie
Syndróm reverzibilnej posteriórnej leukoencefalopatie (RPLS), známy tiež ako syndróm posteriórnej
reverzibilnej encefalopatie (PRES) bol pozorovaný pri cabozantinibe. Pacientom s RPLS sa má
cabozantinib prestať podávať.
PredĺženieQTintervalu
Cabozantinib sa má používať s opatrnosťou u pacientov s predĺžením QT intervalu v anamnéze, u
pacientov užívajúcich antiarytmiká alebo u pacientov s relevantným preexistujúcim srdcovým ochorením, bradykardiou alebo výkyvmi hladín elektrolytov. Počas používania cabozantinibu sa má
zvážiť pravidelné sledovanie EKG a elektrolytov (sérového vápnika, draslíka a horčíka).
Konkomitantnú liečbu silnými inhibítormi CYP3A4, ktoré môžu zvýšiť plazmatické koncentrácie cabozantinibu, treba používať s opatrnosťou.
Induktory a inhibítory CYP3A4
Cabozantinib je substrátom CYP3A4. Súbežné podávanie cabozantinibu so silným inhibítorom
CYP3A4 ketokonazolom viedlo k zvýšeniu plazmatickej expozície cabozantinibu. Vyžaduje sa opatrnosť pri podávaní cabozantinibu spolu so silnými inhibítormi CYP3A4. Súbežné podávanie cabozantinibu so silným induktorom CYP3A4 rifampicínom viedlo k zníženiu plazmatickej expozície cabozantinibu. Preto sa treba vyhnúť dlhodobému podávaniu liečiv, ktoré sú silnými induktormi CYP3A4 (pozri časti 4.2 a 4.5).
Substráty P-glykoproteínu
Cabozantinib bol inhibítorom (IC50 = 7,0 μM), ale nie substrátom, P-glykoproteínových (P-gp) transportných aktivít v dvojsmernom testovacom systéme, ktorý používal MDCK-MDR1 bunky. Cabozantinib preto môže mať potenciál zvýšiť plazmatické koncentrácie súbežne podaných substrátov P-gp. Pri užívaní cabozantinibu musia byť pacienti upozornení na užívanie substrátov P-gp
(napr. fexofenadín, aliskirén, ambrisentan, dabigatran etexilát, digoxín, kolchicín, maravirok, posakonazol, ranolazín, saxagliptín, sitagliptín, talinolol, tolvaptan).
Inhibítory protónovej pumpy
Účinok inhibítorov protónovej pumpy na gastrointestinálnu absorpciu cabozantinibu nebol stanovený. Cabozantinib vykazuje rozpustnosť v závislosti na pH, preto môže podanie inhibítorov protónovej pumpy znížiť expozíciu pacienta cabozantinibu. Súbežné použitie s touto terapeutickou skupinou sa preto neodporúča.
4.5 Liekové a iné interakcie
Účinok inýchliekovnacabozantinib
Inhibítory a induktory CYP3A4
Podávanie silného inhibítora CYP3A4 ketokonazolu (400 mg denne po dobu 27 dní) zdravým dobrovoľníkom znížilo klírens cabozantinibu (o 29 %) a zvýšilo plazmatickú expozíciu cabozantinibu po jednorazovej dávke (AUC) o 38 %. Preto sa má k súbežnému podávaniu silných inhibítorov CYP3A4 (napr. ritonavir, itrakonazol, erytromycín, klaritromycín, grapefruitový džús)
s cabozantinibom pristupovať opatrne.
Podávanie silného induktora CYP3A4 rifampicínu (600 mg denne po dobu 31 dní) zdravým dobrovoľníkom zvýšilo klírens cabozantinibu (4,3-krát) a znížilo plazmatickú expozíciu cabozantinibu (AUC) o 77 %. Je potrebné sa vyhnúť chronickému súbežnému podávaniu induktorov CYP3A4
(napr. dexametazónu, fenytoínu, karbamazepínu, rifampicínu, fenobarbitalu alebo rastlinným
prípravkom obsahujúcim ľubovník bodkovaný [Hypericum perforatum]) s cabozantinibom.
Účinok cabozantinibu na iné lieky
Účinok cabozantinibu na farmakokinetiku antikoncepčných steroídov sa neskúmal. Keďže nie je možné zaručiť nezmenený antikoncepčný účinok, odporúča sa používať ďalšiu antikoncepčnú metódu,
ako napríklad bariérovú.
Substráty P-glykoproteínu
Cabozantinib bol inhibítorom (IC50 = 7,0 μM), ale nie substrátom, P-glykoproteínových (P-gp) transportných aktivít v dvojsmernom testovacom systéme, ktorý používal bunky MDCK-MDR1. Preto cabozantinib môže mať potenciál zvýšiť plazmatické koncentrácie súbežne podaných substrátov P-gp. Pri užívaní cabozantinibu musia byť pacienti upozornení na užívanie substrátov P-gp
(napr. fexofenadín, aliskirén, ambrisentan, dabigatran etexilát, digoxín, kolchicín, maravirok, posakonazol, ranolazín, saxagliptín, sitagliptín, talinolol, tolvaptan).
4.6 Fertilita, gravidita a laktácia
Ženyvofertilnomveku/Antikoncepciaumužovažien
Ženy vo fertilnom veku musia byť poučené, aby sa vyhli tehotenstvu, kým užívajú cabozantinib. Partnerky pacientov užívajúcich cabozantinib sa taktiež musia vyhnúť tehotenstvu. Účinné metódy
antikoncepcie musia používať pacienti aj pacientky a ich partnerky/partneri počas liečby a po dobu
aspoň 4 mesiacov po ukončení liečby. Keďže perorálnu antikoncepciu nie je možné považovať za
„účinnú metódu antikoncepcie“, je nutné ju používať spolu s ďalšou metódou, ako napríklad bariérovou (pozri časť 4.5).
Gravidita
Neboli vykonané štúdie s tehotnými ženami užívajúcimi cabozantinib. Štúdie na zvieratách ukázali
embryofetálne a teratogénne účinky (pozri časť 5.3). Potenciálne riziko pre človeka nie je známe. Cabozantinib sa nesmie používať počas tehotenstva okrem prípadov, keď klinický stav ženy vyžaduje liečbu cabozantinibom.
Laktácia
Nie je známe, či sa cabozantinib a/alebo jeho metabolity vylučujú do materského mlieka. Z dôvodu
možného poškodenia dieťaťa musí matka dojčenie prerušiť počas liečby cabozantinibom a po dobu aspoň 4 mesiacov po ukončení liečby.
Fertilita
Nie sú údaje o ľudskej fertilite. Vychádzajúc z neklinických bezpečnostných zistení, fertilita mužov aj žien môže byť zhoršená liečbou cabozantinibom (pozri časť 5.3). Muži aj ženy musia byť poučení, aby
vyhľadali odborníka a pred liečbou zvážili zachovanie fertility.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Cabozantinib má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. S cabozantinibom sa spájajú nežiaduce reakcie ako únava a slabosť. Preto sa odporúča opatrnosť pri vedení vozidiel a obsluhovaní strojov.
4.8 Nežiaduce účinky
Zhrnutie bezpečnostnéhoprofilu
Najčastejšími závažnými nežiaducimi reakciami spojenými s cabozantinibom sú pneumónia, zápal slizníc, hypokalciémia, dysfágia, dehydratácia, pľúcna embólia a hypertenzia. Najčastejšie nežiaduce
účinky všetkých stupňov (postihujúce aspoň 20 % pacientov) zahŕňajú hnačku, PPES, úbytok telesnej
hmotnosti, zníženie chuti do jedla, nauzeu, únavu, dysgeúziu (kovová chuť v ústach), zmeny zafarbenia vlasov, hypertenziu, stomatitídu, zápcha, vracanie, zápal slizníc, asténiu a dysfóniu.
Najčastejšími laboratórnymi abnormalitami bola zvýšená aspartátaminotransferáza (AST), zvýšená alanínaminotransferáza (ALT), zvýšená alkalická fosfatáza (ALP), lymfopénia, hypokalciémia, neutropénia, trombocytopénia, hypofosfatémia, hypoalbuminémia a hyperbilirubinémia.
ZhrnutienežiaducichúčinkovvtabuľkeNežiaduce reakcie sú uvedené v Tabuľke 1 podľa MedDRA tried systémových orgánových a častosti výskytu. Frekvencie sú založené na všetkých stupňoch a definované nasledovne: veľmi časté (≥1/10), časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100). V jednotlivých skupinách podľa frekvencie sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Tabuľka 1: Nežiaduce reakcie hlásené pri cabozantinibeTrieda orgánových
systémov
| Veľmi časté
| Časté
| Menej časté
|
Infekcie a nákazy
|
| abscesy (vrátane
viscerálnych, kožných, zubných), pneumónia, folikulitída, mykotické infekcie (vrátane kožnej, orálnej a genitálnej)
| aspergilóm
|
Poruchy
endokrinného systému
|
| hypotyreóza
|
|
Poruchy
metabolizmu a
výživy
| znížená chuť do jedla,
hypokalciémia, hypofosfatémia, hyperbilirubinémia, hypoalbuminémia
| dehydratácia
|
|
Psychické poruchy
|
| úzkosť, depresia, stavy
zmätenosti
| abnormálne sny,
delírium
|
Poruchy nervového
systému
| dysgeúzia, bolesti
hlavy, závraty
| periférna neuropatia,
parestézia, ageúzia, tras
| ataxia, poruchy
pozornosti, hepatálna encefalopatia, strata
vedomia, poruchy reči, tranzitórny ischemický atak, syndróm
posteriórnej reverzibilnej encefalopatie
|
Poruchy oka
|
| rozmazané videnie
| katarakta,
konjunktivitída
|
Poruchy ucha a
labyrintu
|
| bolesť ucha, tinnitus
| hypoakúzia
|
Poruchy srdca a
srdcovej činnosti
|
| atriálna fibrilácia
| angina pectoris,
supraventrikulárna tachykardia
|
Poruchy ciev
| hypertenzia
| hypotenzia, žilová
trombóza, bledosť, chladné končatiny
| arteriálna trombóza
|
T
rieda orgánových systémov
|
V
eľmi časté
|
Č
asté
|
Menej časté
|
Poruchy dýchacej
sústavy, hrudníka a mediastína
|
dysfónia,
orofaryngeálna bolesť
|
fistula mimo
gastrointestinálneho traktu
(vrátane tracheálnej, pneumomediastinálnej, tracheo-ezofageálnej), pľúcna embólia, krvácanie do dýchacích ciest (vrátane pulmonárneho, bronchiálneho, tracheálneho), pľúcna aspirácia
|
atelektázia,
faryngeálny edém, pneumonitída
|
Poruchy
gastrointestinálneho traktu
|
hnačka, nauzea,
stomatitída, zápcha,
vracanie, bolesť brucha, dysfágia, dyspepsia, glosodýnia
|
gastrointestinálna
perforácia, gastrointestinálne
krvácanie, pankreatitída,
hemoroidy, análna fisúra,
zápal konečníka, cheilitída
|
gastrointestinálna
fistula, ezofagitída
|
Poruchy pečene a
žlčových ciest
|
|
cholelitiáza
|
|
Poruchy kože a
podkožného
tkaniva
|
palmárno-plantárna
erytrodyzestézia, zmeny farby vlasov,
vyrážka, suchá
pokožka, alopécia,
erytém
|
hyperkeratóza, akné, tvorba
pľuzgierov, abnormálny
rast vlasov, exfoliácia kože, zníženie pigmentácie kože
|
kožný vred,
telangiektázia
|
Poruchy kostrovej a
svalovej sústavy a spojivového tkaniva
|
artralgia, svalové
spazmy
|
muskuloskeletálna bolesť
hrudníka, osteonekróza
čeľuste
|
rabdomyolýza
|
Poruchy obličiek a
močových ciest
|
|
proteinúria, dyzúria,
hematúria
|
akútne zlyhanie
funkcie obličiek
|
Poruchy
reprodukčného
systému a prsníkov
|
|
|
amenorea, vaginálne
krvácanie
|
Celkové poruchy a
reakcie v mieste podania
|
únava, zápal slizníc,
asténia
|
zhoršené hojenie rán,
zimnica, opuch tváre
|
cysta, bolesť v tvári,
lokalizovaný opuch
|
Laboratórne a
funkčné vyšetrenia
|
znížená telesná
hmotnosť, zvýšená hladina ALT, AST a ALP v sére, zvýšená hladina LDH v krvi, zvýšená hladina TSH v krvi, lymfopénia, neutropénia, trombocytopénia
|
zvýšená hladina kreatinín
fosfokinázy v krvi, znížený počet neutrofilov
|
skrátenie aktivovaného
parciálneho tromboplastínového času, zvýšený počet eozinofilov, zvýšený počet krvných doštičiek
|
O
pis
vybraných
nežiaducich
reakcií
Zvýšená hodnota tyreotropného hormónu (TSH) po prvej dávke bola pozorovaná u 57 % pacientov na cabozantinibe verzus 19 % pacientov na placebe (bez ohľadu na východiskové hodnoty).
Deväťdesiatdva percent pacientov v ramene s cabozantinibom predtým podstúpilo tyroidektómiu
a 89 % užívalo hormóny štítnej žľazy pred prvou dávkou.
V kontrolovanej klinickej štúdii s pacientmi s rakovinovým ochorením sa po začatí liečby cabozantinibom (s dávkou 140 mg jedenkrát denne) pozorovalo zvýšenie v porovnaní s východiskovým stavom v korigovanom QT intervale podľa Fridericia (QTcF) o 10 - 15 ms 29. deň (ale nie v 1. deň). Tento účinok nebol spojený so zmenou morfológie tvaru srdcovej krivky alebo s novým rytmom. Žiadny subjekt liečený cabozantinibom nemal QTcF >500 ms.
Hláseniepodozrenínanežiaducereakcie
Hlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v Prílohe V.
4.9 PredávkovanieNeexistuje špecifická liečba predávkovania cabozantinibom a neboli stanovené možné príznaky
predávkovania.
V prípade podozrenia na predávkovanie sa musí cabozantinib vysadiť a začať s podpornou starostlivosťou. Na zhodnotenie možných zmien vývoja sa musia monitorovať hodnoty metabolických parametrov minimálne raz týždenne alebo keď to klinický stav vyžaduje. Nežiaduce účinky spojené s predávkovaním sa majú liečiť symptomaticky.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antineoplastiká, inhibítory proteínkinázy, ATC kód: L01XE26
MechanizmusúčinkuCabozantinib je malá molekula, ktorá inhibuje viac receptorových tyrozínkináz (RTKs) zapojených do rastu tumoru a angiogenézy, patologického remodelovania kostí a metastatickej progresie rakoviny. U
cabozantinibu sa hodnotila jeho inhibičná aktivita proti rôznym kinázam a bol identifikovaný ako
inhibítor MET (receptorový proteín rastového faktora hepatocytov) a VEGF (rastový faktor
vaskulárneho endotelu) receptorov. Cabozantinib navyše inhibuje iné tyrozínkinázy vrátane RET, receptora GAS6 (AXL), receptora faktora kmeňových buniek (KIT) a FLT3 (Fms-like tyrosine kinase-3).
FarmakodynamickéúčinkyCabozantinib vykazuje na dávke závislú inhibíciu rastu tumoru, regresiu tumoru a/alebo inhibuje
metastázy v širokospektrálnych preklinických modeloch tumorov.
Účinnosť cabozantinibu sa pozorovala pri pacientoch s medulárnym karcinómom štítnej žľazy bez
mutácie (divokého typu) alebo s mutáciou RET.
KlinickéúdajeomedulárnomkarcinómeštítnejžľazyMulticentrická randomizovaná dvojito zaslepená štúdia porovnávajúca cabozantinib (N = 219) s placebom (N = 111) bola vykonaná s pacientmi s inoperabilným lokálne pokročilým alebo
metastatickým MTC (medulárnym karcinómom štítnej žľazy) a zdokumentovanou rádiograficky
preukázanou progresiou choroby počas 14 mesiacov pred zaradením do štúdie. Primárnym cieľom bolo porovnať prežívanie bez progresie (PFS) u pacientov užívajúcich cabozantinib v porovnaní s pacientmi užívajúcimi placebo. Sekundárnymi cieľmi bolo porovnanie podielu celkovej odpovede (ORR) a celkového prežívania (OS). Centralizované, zaslepené, nezávislé hodnotenie údajov zo
zobrazovacích postupov bolo použité pri hodnotení PFS a ORR. Pacienti boli liečení, až kým nedošlo k progresii choroby alebo k neprijateľnej toxicite.
Výsledky PFS analýzy, ktoré vychádzajú z hodnotenia RECIST, vykázali štatisticky signifikantný rozdiel v dobe PFS s cabozantinibom v porovnaní s placebom: medián tejto doby bol 11,2 mesiaca u pacientov v ramene s cabozantinibom v porovnaní so 4,0 mesiacmi u pacientov v ramene s placebom (stratifikovaný pomer rizík [HR] = 0,28; 95 % IS: 0,19, 0,40; p<0,0001; Obrázok 1). Výsledky PFS boli konzistentné naprieč všetkými hodnotenými podskupinami podľa východiskového stavu a demografických kritérií, vrátane podskupiny s predchádzajúcou terapiou inhibítormi tyrozínkinázy (ktorá mohla zahŕňať liečivá pôsobiace na dráhy súvisiace s anti-angiogenéziou), podskupín podľa stavu RET mutácií (vrátane subjektov so zdokumentovanou absenciou RET mutácií), podskupín podľa predchádzajúcej liečby rakovinového ochorenia alebo rádioterapie alebo podľa existencie kostných metastáz.
ORR bol 27,9 % a 0 % u pacientov v ramene s cabozantinibom a ramene s placebom (p<0,0001; Tabuľka 2). Medián trvania objektívnych odpovedí bol 14,6 mesiacov (95 % IS: 11,1; 17,5) u pacientov v ramene s cabozantinibom.
Vnútorná administratívna analýza OS, vyžadovaná pre finálnu analýzu, vykonaná so zahrnutím celkovo 75 % úmrtí ukázala trend pre predĺženie OS v ramene s cabozantinibom v porovnaní s placebom: stratifikované HR (95 %) 0,83 (0,60; 1,14); medián (mesiace) 26,0 cabozantinib vs.
20,3 placebo.
Obrázok 1: Kaplanova-Meierova krivka prežívania bez progresie Cometriq (n=219)
Cometriq (n=219)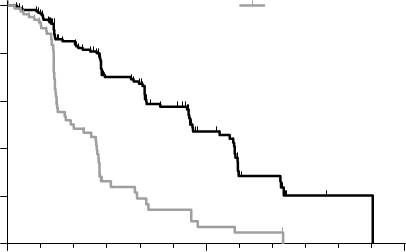 1,0 Placebo (n=111)0,80,60,4
1,0 Placebo (n=111)0,80,60,4 0,2
0,2
0,0
0 12 24
M
es
iace
Počet pacientov s rizikom
|
Mesiac
|
0
|
3
|
6
|
9
|
12
|
15
|
18
|
21
|
Cometriq
|
219
|
121
|
78
|
55
|
31
|
12
|
2
|
1
|
Placebo
|
111
|
35
|
11
|
6
|
3
|
2
|
0
|
0
|
T
abuľka 2: Zhrnutie kľúčových zistení účinnosti
|
C
abozantinib
|
Placebo
|
Medián prežitia bez progresie
|
11,2 mesiaca
|
4,0 mesiace
|
HR: 0,28 (0,19, 0,40)
p<0,0001
|
Medián celkového prežívania
|
26,0 mesiacov
|
20,3 mesiaca
|
HR: 0,83 (0,60, 1,14)
|
Miera celkovej odpovede
a
(
95 % IS)
|
27,9 %
(21,9 %, 34,5 %)
|
0 %
|
p<0,0001
|
T
rvanie odpovede; Medián
(
95 % IS)
|
14,6 mesiaca
(11,1, 17,5)
|
N/A
|
Miera kontroly ochorenia b
(95 % IS)
|
55,3 %
(48,3 %, 62,2 %)
|
13,5 %
(7,6 %, 21,6 %)
|
K
alcitonínová odpoveď
a
|
47 %
(49/104)c
|
3 %
(1/40) c
|
CE
A odpoveď
a
|
33 %
(47/143) c
|
2 %
(1/55)c
|
a Odpoveď = CR + PR
b Miera kontroly ochorenia = SD+ ORR
c Zahŕňa pacientov, u ktorých bola odpoveď hodnotiteľná
Stav mutácií RETZ 215 subjektov s dostatočnými údajmi na určenie stavu mutácie bolo 78,6 % (n=169) klasifikovaných ako pozitívnych na mutáciu RET a 21,4 % (n=46) bolo klasifikovaných ako negatívnych na mutáciu
RET. U ďalších 115 subjektov nebolo možné určiť stav mutácií
RET alebo tento stav bol nejasný.
Všetky tri podskupiny vykazovali zvýšenie PFS v ramene s cabozantinibom v porovnaní s ramenom s
placebom (HR bol v podskupine s pozitívnou RET mutáciou 0,23, v podskupine s negatívnou RET mutáciou 0,53 a v podskupine s neznámym stavom RET mutácií 0,30). Miera objektívnej odpovede meraná v týchto podskupinách bola zvyčajne konzistentná s PFS výsledkami, pričom miera reakcie nádoru bola 32 % v podskupine s pozitívnou mutáciou RET, 22 % v podskupine s negatívnou mutáciou RET a 25 % v podskupine s neznámym stavom tejto mutácie.
Ďalšie genetické analýzy ukázali, že malý podiel pacientov uchováva somatické mutácie tumoru v
HRAS,
KRAS alebo
NRAS. Títo pacienti (n=16) vykazovali signifikantné predĺženie PFS (HR 0,15) a mieru objektívnej odpovede 31 %. Pacienti s negatívnymi
RET mutáciami bez dôkazu mutácie RAS (n=33) ukázali pri užívaní cabozantinibe znížený prínos v PFS (HR 0,87) a nižšiu mieru
odpovede, 18 %, v porovnaní s podskupinami s inými mutáciami.
Vzťah medzi predĺženým PFS a signifikantným zlepšením v OS (HR 0,53, p=0,0179) sa preukázal iba v podskupine pacientov s pozitívnym stavom mutácie RET M918T (n=81/219 rameno s cabozantinibom). OS nebolo zatiaľ analyzované v podskupinách s inými RET a/alebo RAS mutáciami.
O
brázok 2. Kaplanova-Meierova analýza OS medzi subjektmi s mutáciou RET M918T
 C
ometriq (n=81)
C
ometriq (n=81)
 1,0
P
l
acebo (n=45)
0,8
0,6
0,4
1,0
P
l
acebo (n=45)
0,8
0,6
0,4
 0,2
0,2
0,0
0 12 24 36
M
es
iace
P
e
diatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s cabozantinibom v jednej alebo viacerých podskupinách pediatrickej populácie pre liečbu malígnych solídnych tumorov
(informácie o použití v pediatrickej populácii, pozri časť 4.2).
Tento liek bol registrovaný s podmienkou. To znamená, že sa očakávajú ďalšie dôkazy o prínosoch tohto lieku.
Európska agentúra pre lieky najmenej raz ročne posúdi nové informácie o tomto lieku a tento súhrn charakteristických vlastností lieku bude podľa potreby aktualizovať.
5.2 Farmakokinetické vlastnosti
Absorpcia
Po perorálnom podaní cabozantinibu sa maximálna koncentrácia cabozantinibu v plazme dosiahne 2
až 5 hodín po užití.
Podávanie opakovanej dennej dávky cabozantinibu 140 mg po dobu 19 dní viedlo k približne 4- až
5-násobnej priemernej akumulácii cabozantinibu (založené na hodnotách AUC) v porovnaní s podaním jednorazovej dávky; rovnovážny stav bol dosiahnutý približne v 15. deň.
Jedlo bohaté na tuky mierne zvýšilo hodnoty Cmax a AUC (41 % a 57 %) v porovnaní so stavom na
lačno u zdravých dobrovoľníkov, ktorým bol cabozantinib podaný v jednorazovej perorálnej dávke
140 mg. Informácie o presnom účinku jedla požitého 1 hodinu po podaní cabozantinibu nie sú k
dispozícii.
Distribúcia
Cabozantinib je in vitro v ľudskej plazme (≥ 99,7 %) vysoko viazaný na proteíny. Na základe farmakokinetického (FK) populačného modelu sa stanovil distribučný objem (V/F) približne 349 l (SE: ± 2,73 %).
Biotransformácia
Cabozantinib sa metabolizoval in vivo. V plazme boli prítomné štyri metabolity s expozíciou (AUC) vyššou ako 10 % AUC materskej látky: XL184-N-oxid, rozkladný produkt XL184-amid, hydroxysíran XL184 a rozkladný produkt 6-desmetyl-amid síran. Oba nekonjugované metabolity (XL184-N-oxid a rozkladný produkt XL184-amid), ktoré majú <1 % schopnosti inhibície cieľovej kinázy v porovnaní s materským cabozantinibom, predstavujú <10 % celkovej plazmatickej expozície spojenej s liečivom.
Cabozantinib je in vitro substrátom CYP3A4 metabolizmu, ako neutralizačná protilátka CYP3A4 inhibujúca tvorbu metabolitu XL184 N-oxidu o >80 % pri inkubácii katalyzovanej NADPH v ľudských pečeňových mikrozómoch; naproti tomu neutralizačné protilátky CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C19, CYP2D6 a CYP2E1 nemajú žiadny účinok na tvorbu metabolitov cabozantinibu. Neutralizačné protilátky CYP2C9 vykazovali minimálny účinok na tvorbu metabolitov cabozantinibu (t.j. <20 % zníženie).
Eliminácia
Koncový plazmatický eliminačný polčas cabozantinibu v štúdiách s jednorazovým podaním zdravým dobrovoľníkom bol približne 120 hodín. Priemerný klírens (CL/F) v rovnovážnom stave u pacientov
s rakovinovým ochorením bol v populačnej FK analýze odhadnutý na 4,4 l/h. Počas 48-dňového
obdobia zberu po jednorazovej dávke 14C-cabozantinibu zdravým dobrovoľníkom bolo zachytených približne 81 % celkovej podanej rádioaktivity, pričom 54 % v stolici a 27 % v moči.
Farmakokinetika u osobitných populácií pacientov
Poruchy f unkci e obl iči ek
Keďže údaje z tejto populácie nie sú k dispozícii, u pacientov s poruchami funkcie obličiek nie je
možné vylúčiť rozdiely vo FK.
Poruchy f unkci e peče ne
Keďže údaje z tejto populácie nie sú k dispozícii, u pacientov s poruchami funkcie pečene nie je
možné vylúčiť rozdiely vo FK.
Rasa
Nie sú k dispozícii žiadne údaje na určenie rozdielov vo FK podmienené rasou.
5.3 Predklinické údaje o bezpečnosti
Nežiaduce reakcie, ktoré neboli pozorované v klinických štúdiách, ale boli pozorované u zvierat pri expozíciách podobných klinickým a s možným významom pre klinické použitie, boli tieto:
V štúdiách toxicity po opakovanej dávke u potkanov a psov v trvaní až 6 mesiacov boli cieľovými orgánmi toxicity gastrointestinálny trakt, kostná dreň, lymfoidné tkanivá, obličky, tkanivá nadobličiek a reprodukčného systému. Hodnota, pri ktorej neboli pozorované žiadne nepriaznivé účinky (NOAEL)
bola pri týchto zisteniach nižšia ako hladiny klinickej expozície u človeka pri zamýšľanej terapeutickej
dávke.
V štandardnej sade genotoxických testov cabozantinib nevykazoval žiadny mutagénny alebo klastogénny potenciál. Štúdie karcinogenity sa nevykonali. Štúdie hodnotiace toxicitu metabolitov neboli dokončené.
Štúdie fertility u potkanov ukázali zníženú samčiu aj samičiu plodnosť. Navyše bola u samcov psov pozorovaná hypospermatogenéza pri hladinách expozície nižších ako hladiny klinickej expozície u človeka pri určenej terapeutickej dávke.
Štúdie embryofetálneho vývoja sa vykonali u potkanov a králikov. U potkanov spôsoboval cabozantinib postimplantačné straty, fetálny edém, rázštep podnebia/pier, dermálnu apláziu a deformovaný alebo rudimentárny chvost. U králikov cabozantinib spôsoboval zmeny fetálneho mäkkého tkaniva (zmenšená veľkosť sleziny, malé alebo chýbajúce stredné laloky pľúc) a zvýšenú fetálnu incidenciu celkových malformácií. NOAEL pri embryo-fetálnej toxicite a teratogénnych zisteniach boli nižšie ako hladiny klinickej expozície u človeka pri zamýšľanej terapeutickej dávke.
Mláďatá potkanov (porovnateľné s pediatrickou populáciou >2 roky), ktorým bol podaný cabozantinib, vykazovali zvýšené hodnoty leukocytov, zníženú hematopoézu, pubescentný/nevyzrelý samičí reprodukčný systém (bez predĺženého vaginálneho otvárania), abnormality zubov, znížený
obsah minerálov v kostiach a zníženú kostnú denzitu, pigmentáciu pečene a hyperpláziu žlčovodu. Nálezy na maternici/vaječníkoch a zníženie hematopoézy sa zdali byť prechodné, zatiaľ čo účinky na kostné parametre a pigmentáciu pečene boli trvalé. Hodnotenie mláďat potkanov (porovnateľné s pediatrickou populáciou <2 roky) nebolo vykonané.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly mikrokryštalická celulóza sodná soľ kroskarmelózy nátrium-glykolát škrobu
bezvodý koloidný oxid kremičitý
kyselina stearová
Obal kapsuly
želatína
čierny oxid železitý (E172)
oxid titaničitý (E171)
Atrament na potlač šelak
čierny oxid železitý (E172)
propylénglykol
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 ºC.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PE/PCTFE-Al blistre s fóliou na zadnej strane, zatavené do sekundárneho kartičkového obalu,
uzavretého teplom.
Blistrové karty obsahujú:
21 x 20 mg kapsula (pri dávke 60 mg/deň to je zásoba na 7 dní)
6.6 Špeciálne opatrenia na likvidáciu
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
TMC Pharma Services Ltd.
Lodge Farm Barn Elvetham Park Estate Fleet Road
Hartley Wintney
Hampshire
RG27 8AS
Spojené Kráľovstvo
8. REGISTRAČNÉ ČÍSLO <ČÍSLA> EU/1/13/890/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21. marec 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
Tento liek je predmetom ďalšieho monitorovania. To umožní rýchle získanie nových informácií o
bezpečnosti. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie. Informácie o tom, ako hlásiť nežiaduce reakcie, nájdete v časti 4.8.
1. NÁZOV LIEKUCOMETRIQ 20 mg tvrdé kapsuly
COMETRIQ 80 mg tvrdé kapsuly
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIEJedna tvrdá kapsula obsahuje cabozantinib (
S)-maleát ekvivalentný 20 mg alebo 80 mg cabozantinibu.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMATvrdá kapsula
Tvrdé kapsuly sú šedé s čiernym vytlačeným nápisom „XL184 20mg“ na tele kapsuly. Kapsula
obsahuje takmer biely až biely prášok.
Tvrdé kapsuly sú oranžové s čiernym vytlačeným nápisom „XL184 80mg“ na tele kapsuly. Kapsula
obsahuje takmer biely až biely prášok.
4. KLINICKÉ ÚDAJE4.1 Terapeutické indikácieCOMETRIQ je indikovaný na liečbu dospelých pacientov s progresívnym, inoperabilným lokálne
pokročilým alebo metastatickým medulárnym karcinómom štítnej žľazy.
U pacientov, u ktorých stav mutácie RET (Rearranged during Transfection) nie je známy alebo je negatívny, sa pred individuálnym rozhodnutím o liečbe musí zohľadniť možnosť nižšieho prínosu (pozri dôležité informácie v častiach 4.4 a 5.1).
4.2 Dávkovanie a spôsob podávaniaTerapiu liekom COMETRIQ má začať lekár skúsený s podávaním liekov proti rakovine.
DávkovanieOdporúčaná dávka lieku COMETRIQ je 140 mg jedenkrát denne, užitá ako jedna 80 mg oranžová
kapsula a tri 20 mg šedé kapsuly. Liečba má trvať, až kým pacient neprestane vykazovať klinický prínos z liečby alebo až kým sa nevyskytne neprijateľná toxicita.
Je potrebné očakávať, že väčšina pacientov liečených liekom COMETRIQ bude z dôvodu toxicity vyžadovať jednu alebo viacero úprav dávky (zníženie a/alebo prerušenie). Preto pacienti majú byť starostlivo sledovaní počas prvých ôsmich týždňov liečby (pozri časť 4.4).
Zvládanie suspektných nežiaducich reakcií si môže vyžadovať dočasné prerušenie terapie liekom COMETRIQ a/alebo zníženie jeho dávky. Ak je nevyhnutné zníženie dávky, odporúča sa najskôr ju znížiť na 100 mg denne, užitých vo forme jednej 80 mg oranžovej kapsuly a jednej 20 mg šedej kapsuly, a potom na 60 mg denne, užitých vo forme troch 20 mg šedých kapsúl.
Prerušenie dávkovania sa odporúča pri zvládaní toxicít 3. alebo vyššieho stupňa podľa CTCAE alebo nezvládateľnej toxicity 2. stupňa.
Znížiť dávku sa odporúča pri takých udalostiach, ktoré by sa, ak budú pretrvávať, mohli stať závažnými alebo nezvládateľnými.
Z dôvodu možného výskytu väčšiny udalostí na začiatku liečby je dôležité, aby lekár počas prvých ôsmych týždňov liečby pozorne hodnotil stav pacienta s cieľom stanoviť, či je potrebná úprava dávky. Udalosti, ktoré sa zvyčajne prejavia na začiatku liečby zahŕňajú hypokalciémiu, hypokaliémiu, trombocytopéniu, hypertenziu, palmárno-plantárny erytrodyzestetický syndróm (PPES), a gastrointestinálne (GI) udalosti (bolesti brucha a ústnej dutiny, zápal slizníc, zápcha, hnačka,
vracanie).
Výskyt niektorých závažných nežiaducich reakcií (ako napríklad gastrointestinálnej fistuly) môže závisieť od kumulatívnej dávky a môžu sa vyskytnúť v neskoršej fáze liečby.
Ak pacient vynechá dávku, vynechaná dávka sa nemá užiť, ak zostáva menej ako 12 hodín do ďalšej
dávky.
Konkomitantné lieky
Konkomitantné lieky, ktoré sú silnými inhibítormi CYP3A4 sa majú užívať s opatrnosťou, a chronickému užívaniu konkomitantných liekov, ktoré sú silnými induktormi CYP3A4, sa treba vyhnúť (pozri časti 4.4 a 4.5).
Treba zvážiť voľbu alternatívnych konkomitantných liekov, ktoré nemajú žiadny alebo minimálny potenciál indukovať či inhibovať CYP3A4.
St arš í pacienti
Pri použití cabozantinibu u starších osôb (≥ 65 rokov) sa neodporúča žiadna špecifická úprava dávky. Avšak u pacientov vo veku 75 rokov a starších sa pozorovala tendencia vyššieho výskytu závažných
nežiaducich udalostí (SAE).
Rasa
Skúsenosti s cabozantinibom u iných ako belošských pacientov sú malé.
Paci enti s poruc hami funkci e obl iči ek
U pacientov s poruchami funkcie obličiek sa má cabozantinib používať s opatrnosťou. Cabozantinib sa
neodporúča u pacientov so závažnými poruchami funkcie obličiek, pretože o jeho použití u pacientov so závažnou poruchou funkcie obličiek sú iba obmedzené údaje a bezpečnosť a účinnosť neboli doteraz stanovené.
Paci enti s poruc hami funkci e peče ne
Cabozantinib sa neodporúča používať u pacientov s poruchami funkcie pečene, pretože o jeho použití u pacientov s poruchami funkcie pečene sú iba obmedzené údaje a bezpečnosť a účinnosť neboli doteraz stanovené.
Pacienti so srdcovými poruchami
O pacientoch so srdcovými poruchami sú len obmedzené údaje. K dávkovaniu nie je možné dať žiadne špecifické odporúčania.
Pediatrická populácia
Bezpečnosť a účinnosť cabozantinibu u detí vo veku <18 rokov neboli doteraz stanovené. K dispozícii
nie sú žiadne údaje.
Spôsob podávania
Kapsuly sa majú prehltnúť celé a neotvorené. Pacienti majú byť poučení, aby nič nejedli po dobu aspoň 2 hodín pred a 1 hodinu po užití lieku COMETRIQ.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
4.4 Osobitné upozornenia a opatrenia pri používaní
V hlavnom klinickom skúšaní sa u pacientov liečených cabozantinibom vyskytlo zníženie dávky
u 79 % pacientov a prerušenie podávania dávky u 72 % pacientov. U 41 % pacientov bolo potrebné
dávku znížiť dvakrát. Stredný čas do prvého zníženia dávky bol 43 dní a do prvého prerušenia dávky
33 dní. Preto pacienti majú byť starostlivo sledovaní počas prvých ôsmich týždňov liečby (pozri časť
4.2).
Perforácie, fistuly a intraabdominálne abscesy
Pri používaní cabozantinibu boli pozorované závažné perforácie gastrointestinálneho traktu a fistuly,
niekedy fatálne, a intraabdominálne abscesy. Pred začatím liečby cabozantinibom je potrebné starostlivo zhodnotiť a následne pozorne sledovať zdravotný stav pacientov, ktorí v nedávnej dobe podstúpili rádioterapiu, majú zápalové ochorenie čriev (napr. Crohnovu chorobu, ulceróznu kolitídu, peritonitídu alebo divertikulitídu), majú infiltrácie tumoru do trachey, bronchov alebo pažeráka, majú komplikácie z predchádzajúceho chirurgického zákroku v GIT (najmä ak sú spojené s predĺženým alebo neúplným hojením) alebo majú komplikácie spôsobené predchádzajúcou radiačnou terapiou
v oblasti hrudníka (vrátane mediastína). Je potrebné sledovať, či sa u nich nevyskytnú príznaky perforácií a fistúl. V prípadoch nástupu mukozitídy po začiatku liečby sa musia podľa potreby vylúčiť
iné ako gastrointestinálne fistuly. Cabozantinib sa musí vysadiť u pacientov s GI perforáciou alebo
fistulou v gastrointestinálnom trakte alebo mimo neho.
Tromboembolické príhody
Pri používaní cabozantinibu boli pozorované príhody venózneho tromboembolizmu a príhody arteriálneho tromboembolizmu. Cabozantinib sa má používať s opatrnosťou u pacientov s rizikom takýchto príhod alebo u pacientov, ktorí majú takéto príhody v anamnéze. Podávanie cabozantinibu sa má prerušiť u pacientov, u ktorých došlo k akútnemu infarktu myokardu alebo inej klinicky signifikantnej arteriálnej tromboembolickej komplikácii.
Hemorágia
Pri používaní cabozantinibu sa pozorovala hemorágia. Pred začiatkom liečby cabozantinibom treba starostlivo posúdiť zdravotný stav pacientov s preukázaným postihnutím trachey a bronchov tumorom
alebo s hemoptýzou v anamnéze. Cabozantinib sa nesmie podávať pacientom so závažnou
krvácavosťou alebo nedávnou hemoptýzou.
Komplikácie s hojením rán
Pri cabozantinibe boli pozorované komplikácie s hojením rán. Ak je to možné, liečba cabozantinibom sa má prerušiť aspoň 28 dní pred plánovanou operáciou. Rozhodnutie o pokračovaní v liečbe cabozantinibom sa má urobiť na základe klinického posúdenia adekvátneho hojenia rany. Cabozantinib sa má prestať podávať pacientom s komplikáciami hojenia rany, ktoré si vyžadujú lekársky zásah.
Hypertenzia
Pri cabozantinibe bola pozorovaná hypertenzia. Všetkých pacientov treba sledovať, či sa u nich nevyskytne hypertenzia a podľa potreby ju liečiť štandardnou antihypertenznou terapiou. Ak napriek použitiu antihypertenzív hypertenzia pretrváva, dávka cabozantinibu sa má znížiť. Ak je hypertenzia závažná a pretrváva aj napriek antihypertenznej liečbe a zníženiu dávky cabozantinibu, cabozantinib sa musí vysadiť. V prípade hypertenznej krízy, sa má cabozantinib vysadiť.
Osteonekróza
Pri cabozantinibe boli pozorované prípady osteonekrózy (osteonecrosis of the jaw, ONJ). Pred začatím liečby cabozantinibom a pravidelne počas liečby sa má vykonávať vyšetrenie ústnej dutiny. Pacienti majú byť poučení o postupoch pri vykonávaní ústnej hygieny. Ak je to možné, pri invazívnych
dentálnych procedúrach sa má cabozantinib vysadiť aspoň 28 dní pred plánovanou operáciou. U pacientov, ktorí užívajú liečivá spájané s ONJ ako napríklad bisfosfonáty, je potrebná opatrnosť. U pacientov s ONJ prerušte užívanie cabozantinibu.
Palmárno-plantárny erytrodyzestetický syndróm
Pri cabozantinibe bol pozorovaný palmárno-plantárny erytrodyzestetický syndróm (PPES). V prípade ťažkého PPES by sa malo zvážiť prerušenie liečby cabozantinibom. Liečba s nižšou dávkou cabozantinibu by sa mala znovu začať až po zlepšení PPES na stupeň 1.
Proteinúria
Pri cabozantinibe bola pozorovaná proteinúria. Počas liečby cabozantinibom sa majú pravidelne sledovať proteíny v moči. Ak sa u pacienta vyvinie nefrotický syndróm, cabozantinib sa musí prestať podávať.
Syndróm reverzibilnej posteriórnej leukoencefalopatie
Syndróm reverzibilnej posteriórnej leukoencefalopatie (RPLS), známy tiež ako syndróm posteriórnej reverzibilnej encefalopatie (PRES) bol pozorovaný pri cabozantinibe. Pacientom s RPLS sa má cabozantinib prestať podávať.
PredĺženieQTintervalu
Cabozantinib sa má používať s opatrnosťou u pacientov s predĺžením QT intervalu v anamnéze, u pacientov užívajúcich antiarytmiká alebo u pacientov s relevantným preexistujúcim srdcovým ochorením, bradykardiou alebo výkyvmi hladín elektrolytov. Počas používania cabozantinibu sa má zvážiť pravidelné sledovanie EKG a elektrolytov (sérového vápnika, draslíka a horčíka). Konkomitantnú liečbu silnými inhibítormi CYP3A4, ktoré môžu zvýšiť plazmatické koncentrácie cabozantinibu, treba používať s opatrnosťou.
Induktory a inhibítory CYP3A4
Cabozantinib je substrátom CYP3A4. Súbežné podávanie cabozantinibu so silným inhibítorom
CYP3A4 ketokonazolom viedlo k zvýšeniu plazmatickej expozície cabozantinibu. Vyžaduje sa opatrnosť pri podávaní cabozantinibu spolu so silnými inhibítormi CYP3A4. Súbežné podávanie cabozantinibu so silným induktorom CYP3A4 rifampicínom viedlo k zníženiu plazmatickej expozície cabozantinibu. Preto sa treba vyhnúť dlhodobému podávaniu liečiv, ktoré sú silnými induktormi CYP3A4 (pozri časti 4.2 a 4.5).
Substráty P-glykoproteínu
Cabozantinib bol inhibítorom (IC50 = 7,0 μM), ale nie substrátom, P-glykoproteínových (P-gp) transportných aktivít v dvojsmernom testovacom systéme, ktorý používal MDCK-MDR1 bunky. Cabozantinib preto môže mať potenciál zvýšiť plazmatické koncentrácie súbežne podaných substrátov P-gp. Pri užívaní cabozantinibu musia byť pacienti upozornení na užívanie substrátov P-gp
(napr. fexofenadín, aliskirén, ambrisentan, dabigatran etexilát, digoxín, kolchicín, maravirok, posakonazol, ranolazín, saxagliptín, sitagliptín, talinolol, tolvaptan).
Inhibítory protónovej pumpy
Účinok inhibítorov protónovej pumpy na gastrointestinálnu absorpciu cabozantinibu nebol stanovený.
Cabozantinib vykazuje rozpustnosť v závislosti na pH, preto môže podanie inhibítorov protónovej pumpy znížiť expozíciu pacienta cabozantinibu. Súbežné použitie s touto terapeutickou skupinou sa
preto neodporúča.
4.5 Liekové a iné interakcie
Účinok inýchliekovnacabozantinib
Inhibítory a induktory CYP3A4
Podávanie silného inhibítora CYP3A4 ketokonazolu (400 mg denne po dobu 27 dní) zdravým
dobrovoľníkom znížilo klírens cabozantinibu (o 29 %) a zvýšilo plazmatickú expozíciu cabozantinibu po jednorazovej dávke (AUC) o 38 %. Preto sa má k súbežnému podávaniu silných inhibítorov
CYP3A4 (napr. ritonavir, itrakonazol, erytromycín, klaritromycín, grapefruitový džús)
s cabozantinibom pristupovať opatrne.
Podávanie silného induktora CYP3A4 rifampicínu (600 mg denne po dobu 31 dní) zdravým dobrovoľníkom zvýšilo klírens cabozantinibu (4,3-krát) a znížilo plazmatickú expozíciu cabozantinibu (AUC) o 77 %. Je potrebné sa vyhnúť chronickému súbežnému podávaniu induktorov CYP3A4
(napr. dexametazónu, fenytoínu, karbamazepínu, rifampicínu, fenobarbitalu alebo rastlinným
prípravkom obsahujúcim ľubovník bodkovaný [Hypericum perforatum]) s cabozantinibom.
Účinokcabozantinibunainélieky
Účinok cabozantinibu na farmakokinetiku antikoncepčných steroídov sa neskúmal. Keďže nie je možné zaručiť nezmenený antikoncepčný účinok, odporúča sa používať ďalšiu antikoncepčnú metódu,
ako napríklad bariérovú.
Substráty P-glykoproteínu
Cabozantinib bol inhibítorom (IC50 = 7,0 μM), ale nie substrátom, P-glykoproteínových (P-gp) transportných aktivít v dvojsmernom testovacom systéme, ktorý používal bunky MDCK-MDR1. Preto cabozantinib môže mať potenciál zvýšiť plazmatické koncentrácie súbežne podaných substrátov P-gp. Pri užívaní cabozantinibu musia byť pacienti upozornení na užívanie substrátov P-gp
(napr. fexofenadín, aliskirén, ambrisentan, dabigatran etexilát, digoxín, kolchicín, maravirok, posakonazol, ranolazín, saxagliptín, sitagliptín, talinolol, tolvaptan).
4.6 Fertilita, gravidita a laktácia
Ženyvofertilnomveku/Antikoncepciaumužovažien
Ženy vo fertilnom veku musia byť poučené, aby sa vyhli tehotenstvu, kým užívajú cabozantinib. Partnerky pacientov užívajúcich cabozantinib sa taktiež musia vyhnúť tehotenstvu. Účinné metódy
antikoncepcie musia používať pacienti aj pacientky a ich partnerky/partneri počas liečby a po dobu
aspoň 4 mesiacov po ukončení liečby. Keďže perorálnu antikoncepciu nie je možné považovať za
„účinnú metódu antikoncepcie“, je nutné ju používať spolu s ďalšou metódou, ako napríklad
bariérovou (pozri časť 4.5).
Gravidita
Neboli vykonané štúdie s tehotnými ženami užívajúcimi cabozantinib. Štúdie na zvieratách ukázali embryofetálne a teratogénne účinky (pozri časť 5.3). Potenciálne riziko pre človeka nie je známe. Cabozantinib sa nesmie používať počas tehotenstva okrem prípadov, keď klinický stav ženy vyžaduje liečbu cabozantinibom.
Laktácia
Nie je známe, či sa cabozantinib a/alebo jeho metabolity vylučujú do materského mlieka. Z dôvodu
možného poškodenia dieťaťa musí matka dojčenie prerušiť počas liečby cabozantinibom a po dobu aspoň 4 mesiacov po ukončení liečby.
Fertilita
Nie sú údaje o ľudskej fertilite. Vychádzajúc z neklinických bezpečnostných zistení, fertilita mužov aj žien môže byť zhoršená liečbou cabozantinibom (pozri časť 5.3). Muži aj ženy musia byť poučení, aby
vyhľadali odborníka a pred liečbou zvážili zachovanie fertility.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Cabozantinib má malý vplyv na schopnosť viesť vozidlá a obsluhovať stroje. S cabozantinibom sa spájajú nežiaduce reakcie ako únava a slabosť. Preto sa odporúča opatrnosť pri vedení vozidiel a obsluhovaní strojov.
4.8 Nežiaduce účinky
Zhrnutiebezpečnostnéhoprofilu
Najčastejšími závažnými nežiaducimi reakciami spojenými s cabozantinibom sú pneumónia, zápal slizníc, hypokalciémia, dysfágia, dehydratácia, pľúcna embólia a hypertenzia. Najčastejšie nežiaduce účinky všetkých stupňov (postihujúce aspoň 20 % pacientov) zahŕňajú hnačku, PPES, úbytok telesnej hmotnosti, zníženie chuti do jedla, nauzeu, únavu, dysgeúziu (kovová chuť v ústach), zmeny zafarbenia vlasov, hypertenziu, stomatitídu, zápcha, vracanie, zápal slizníc, asténiu, a dysfóniu.
Najčastejšími laboratórnymi abnormalitami bola zvýšená aspartátaminotransferáza (AST), zvýšená alanínaminotransferáza (ALT), zvýšená alkalická fosfatáza (ALP), lymfopénia, hypokalciémia, neutropénia, trombocytopénia, hypofosfatémia, hypoalbuminémia a hyperbilirubinémia.
ZhrnutienežiaducichúčinkovvtabuľkeNežiaduce reakcie sú uvedené v Tabuľke 1 podľa MedDRA tried systémových orgánových a častosti výskytu. Frekvencie sú založené na všetkých stupňoch a definované nasledovne: veľmi časté (≥1/10),
časté (≥1/100 až <1/10); menej časté (≥1/1 000 až <1/100). V jednotlivých skupinách podľa frekvencie sú nežiaduce reakcie uvedené v poradí klesajúcej závažnosti.
Tabuľka 1: Nežiaduce reakcie hlásené pri cabozantinibeTrieda orgánových
systémov
| Veľmi časté
| Časté
| Menej časté
|
Infekcie a nákazy'
|
| abscesy (vrátane
viscerálnych, kožných, zubných), pneumónia, folikulitída, mykotické infekcie (vrátane kožnej, orálnej a genitálnej)
| aspergilóm
|
Poruchy
endokrinného systému
|
| hypotyreóza
|
|
Poruchy
metabolizmu a
výživy
| znížená chuť do jedla,
hypokalciémia, hypofosfatémia, hyperbilirubinémia, hypoalbuminémia
| dehydratácia
|
|
Psychické poruchy
|
| úzkosť, depresia, stavy
zmätenosti
| abnormálne sny,
delírium
|
Poruchy nervového
systému
| dysgeúzia, bolesti
hlavy, závraty
| periférna neuropatia,
parestézia, ageúzia, tras
| ataxia, poruchy
pozornosti, hepatálna encefalopatia, strata
vedomia, poruchy reči,
tranzitórny ischemický atak, syndróm
posteriórnej reverzibilnej encefalopatie
|
Poruchy oka
|
| rozmazané videnie
| katarakta,
konjunktivitída
|
Poruchy ucha a
labyrintu
|
| bolesť ucha, tinnitus
| hypoakúzia
|
Poruchy srdca a
srdcovej činnosti
|
| atriálna fibrilácia
| angina pectoris,
supraventrikulárna tachykardia
|
T
rieda orgánových systémov
|
V
eľmi časté
|
Č
asté
|
Menej časté
|
Poruchy ciev
|
hypertenzia
|
hypotenzia, žilová
trombóza, bledosť, chladné končatiny
|
arteriálna trombóza
|
Poruchy dýchacej
sústavy, hrudníka a mediastína
|
dysfónia,
orofaryngeálna bolesť
|
fistula mimo
gastrointestinálneho traktu
(vrátane tracheálnej, pneumomediastinálnej,
tracheo-ezofageálnej),
pľúcna embólia, krvácanie do dýchacích ciest (vrátane pulmonárneho, bronchiálneho, tracheálneho), pľúcna aspirácia
|
atelektázia,
faryngeálny edém, pneumonitída
|
Poruchy
gastrointestinálneho traktu
|
hnačka, nauzea,
stomatitída, zápcha, vracanie, bolesť brucha, dysfágia, dyspepsia, glosodýnia
|
gastrointestinálna
perforácia, gastrointestinálne krvácanie, pankreatitída, hemoroidy, análna fisúra, zápal konečníka, cheilitída
|
gastrointestinálna
fistula, ezofagitída
|
Poruchy pečene a
žlčových ciest
|
|
cholelitiáza
|
|
Poruchy kože a
podkožného
tkaniva
|
palmárno-plantárna
erytrodyzestézia, zmeny farby vlasov, vyrážka, suchá pokožka, alopécia, erytém
|
hyperkeratóza, akné, tvorba
pľuzgierov, abnormálny
rast vlasov, exfoliácia kože, zníženie pigmentácie kože
|
kožný vred,
telangiektázia
|
Poruchy kostrovej a
svalovej sústavy a spojivového
tkaniva
|
artralgia, svalové
spazmy
|
muskuloskeletálna bolesť
hrudníka, osteonekróza
čeľuste
|
rabdomyolýza
|
Poruchy obličiek a
močových ciest
|
|
proteinúria, dyzúria,
hematúria
|
akútne zlyhanie
funkcie obličiek
|
Poruchy
reprodukčného
systému a prsníkov
|
|
|
amenorea, vaginálne
krvácanie
|
Celkové poruchy a
reakcie v mieste podania
|
únava, zápal slizníc,
asténia
|
zhoršené hojenie rán,
zimnica, opuch tváre
|
cysta, bolesť v tvári,
lokalizovaný opuch
|
Laboratórne a
funkčné vyšetrenia
|
znížená telesná
hmotnosť, zvýšená
hladina ALT, AST a ALP v sére, zvýšená hladina LDH v krvi, zvýšená hladina TSH v krvi, lymfopénia, neutropénia, trombocytopénia
|
zvýšená hladina kreatinín
fosfokinázy v krvi, znížený počet neutrofilov
|
skrátenie aktivovaného
parciálneho tromboplastínového
času, zvýšený počet eozinofilov, zvýšený počet krvných
doštičiek
|
O
pis
vybraných
nežiaducich
reakcií
Zvýšená hodnota tyreotropného hormónu (TSH) po prvej dávke bola pozorovaná u 57 % pacientov na cabozantinibe verzus 19 % pacientov na placebe (bez ohľadu na východiskové hodnoty).
Deväťdesiatdva percent pacientov v ramene s cabozantinibom predtým podstúpilo tyroidektómiu
a 89 % užívalo hormóny štítnej žľazy pred prvou dávkou.
V kontrolovanej klinickej štúdii s pacientmi s rakovinovým ochorením sa po začatí liečby cabozantinibom (s dávkou 140 mg jedenkrát denne) pozorovalo zvýšenie v porovnaní s východiskovým stavom v korigovanom QT intervale podľa Fridericia (QTcF) o 10 - 15 ms 29. deň (ale nie v 1. deň). Tento účinok nebol spojený so zmenou morfológie tvaru srdcovej krivky alebo s novým rytmom. Žiadny subjekt liečený cabozantinibom nemal QTcF >500 ms.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného v Prílohe V.
4.9 PredávkovanieNeexistuje špecifická liečba predávkovania cabozantinibom a neboli stanovené možné príznaky
predávkovania.
V prípade podozrenia na predávkovanie sa musí cabozantinib vysadiť a začať s podpornou starostlivosťou. Na zhodnotenie možných zmien vývoja sa musia monitorovať hodnoty metabolických parametrov minimálne raz týždenne alebo keď to klinický stav vyžaduje. Nežiaduce účinky spojené s predávkovaním sa majú liečiť symptomaticky.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antineoplastiká, inhibítory proteínkinázy, ATC kód: L01XE26
MechanizmusúčinkuCabozantinib je malá molekula, ktorá inhibuje viac receptorových tyrozínkináz (RTKs) zapojených do rastu tumoru a angiogenézy, patologického remodelovania kostí a metastatickej progresie rakoviny. U
cabozantinibu sa hodnotila jeho inhibičná aktivita proti rôznym kinázam a bol identifikovaný ako
inhibítor MET (receptorový proteín rastového faktora hepatocytov) a VEGF (rastový faktor vaskulárneho endotelu) receptorov. Cabozantinib navyše inhibuje iné tyrozínkinázy vrátane RET,
receptora GAS6 (AXL), receptora faktora kmeňových buniek (KIT) a FLT3 (Fms-like tyrosine
kinase-3).
FarmakodynamickéúčinkyCabozantinib vykazuje na dávke závislú inhibíciu rastu tumoru, regresiu tumoru a/alebo inhibuje
metastázy v širokospektrálnych preklinických modeloch tumorov.
Účinnosť cabozantinibu sa pozorovala pri pacientoch s medulárnym karcinómom štítnej žľazy bez
mutácie (divokého typu) alebo s mutáciou RET.
KlinickéúdajeomedulárnomkarcinómeštítnejžľazyMulticentrická randomizovaná dvojito zaslepená štúdia porovnávajúca cabozantinib (N = 219) s placebom (N = 111) bola vykonaná s pacientmi s inoperabilným lokálne pokročilým alebo metastatickým MTC (medulárnym karcinómom štítnej žľazy) a zdokumentovanou rádiograficky
preukázanou progresiou choroby počas 14 mesiacov pred zaradením do štúdie. Primárnym cieľom bolo porovnať prežívanie bez progresie (PFS) u pacientov užívajúcich cabozantinib v porovnaní s pacientmi užívajúcimi placebo. Sekundárnymi cieľmi bolo porovnanie podielu celkovej odpovede (ORR) a celkového prežívania (OS). Centralizované, zaslepené, nezávislé hodnotenie údajov zo zobrazovacích postupov bolo použité pri hodnotení PFS a ORR. Pacienti boli liečení, až kým nedošlo k progresii choroby alebo k neprijateľnej toxicite.
Výsledky PFS analýzy, ktoré vychádzajú z hodnotenia RECIST, vykázali štatisticky signifikantný rozdiel v dobe PFS s cabozantinibom v porovnaní s placebom: medián tejto doby bol 11,2 mesiaca u pacientov v ramene s cabozantinibom v porovnaní so 4,0 mesiacmi u pacientov v ramene s placebom (stratifikovaný pomer rizík [HR] = 0,28; 95 % IS: 0,19, 0,40; p<0,0001; Obrázok 1). Výsledky PFS boli konzistentné naprieč všetkými hodnotenými podskupinami podľa východiskového stavu a demografických kritérií, vrátane podskupiny s predchádzajúcou terapiou inhibítormi tyrozínkinázy (ktorá mohla zahŕňať liečivá pôsobiace na dráhy súvisiace s anti-angiogenéziou), podskupín podľa stavu RET mutácií (vrátane subjektov so zdokumentovanou absenciou RET mutácií), podskupín podľa predchádzajúcej liečby rakovinového ochorenia alebo rádioterapie alebo podľa existencie kostných metastáz.
ORR bol 27,9 % a 0 % u pacientov v ramene s cabozantinibom a ramene s placebom (p<0,0001; Tabuľka 2). Medián trvania objektívnych odpovedí bol 14,6 mesiacov (95 % IS: 11,1; 17,5) u pacientov v ramene s cabozantinibom.
Vnútorná administratívna analýza OS, vyžadovaná pre finálnu analýzu, vykonaná so zahrnutím celkovo 75 % úmrtí ukázala trend pre predĺženie OS v ramene s cabozantinibom v porovnaní s placebom: stratifikované HR (95 % ) 0,83 (0,60; 1,14); medián (mesiace) 26,0 cabozantinib vs.
20,3 placebo.
Obrázok 1: Kaplanova-Meierova krivka prežívania bez progresie Cometriq (n=219)
Cometriq (n=219)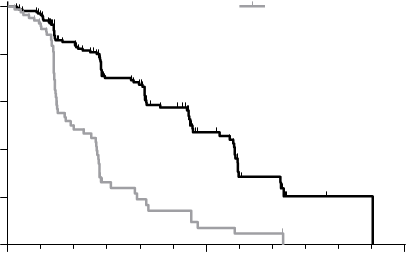 1,0 Placebo (n=111)0,80,60,4
1,0 Placebo (n=111)0,80,60,4 0,2
0,2
0,0
0 12 24
M
es
iace
Počet pacientov s rizikom
|
Mesiac
|
0
|
3
|
6
|
9
|
12
|
15
|
18
|
21
|
Cometriq
|
219
|
121
|
78
|
55
|
31
|
12
|
2
|
1
|
Placebo
|
111
|
35
|
11
|
6
|
3
|
2
|
0
|
0
|
T
abuľka 2: Zhrnutie kľúčových zistení účinnosti
|
C
abozantinib
|
Placebo
|
Medián prežitia bez progresie
|
11,2 mesiaca
|
4,0 mesiace
|
HR: 0,28 (0,19, 0,40)
p<0,0001
|
Medián celkového prežívania
|
26,0 mesiacov
|
20,3 mesiaca
|
HR: 0,83 (0,60, 1,14)
|
Miera celkovej odpovede
a
(
95 % IS)
|
27,9 %
(21,9 %, 34,5 %)
|
0 %
|
p<0,0001
|
T
rvanie odpovede; Medián
(
95 % IS)
|
14,6 mesiaca
(11,1, 17,5)
|
N/A
|
Miera kontroly ochorenia b
(95 % IS)
|
55,3 %
(48,3 %, 62,2 %)
|
13,5 %
(7,6 %, 21,6 %)
|
K
alcitonínová odpoveď
a
|
47 %
(49/104)c
|
3 %
(1/40) c
|
CE
A odpoveď
a
|
33 %
(47/143) c
|
2 %
(1/55)c
|
a Odpoveď = CR + PR
b Miera kontroly ochorenia = SD+ ORR
c Zahŕňa pacientov, u ktorých bola odpoveď hodnotiteľná
Stav mutácií RETZ 215 subjektov s dostatočnými údajmi na určenie stavu mutácie bolo 78,6 % (n=169) klasifikovaných ako pozitívnych na mutáciu RET a 21,4 % (n=46) bolo klasifikovaných ako negatívnych na mutáciu
RET. U ďalších 115 subjektov nebolo možné určiť stav mutácií
RET alebo tento stav bol nejasný.
Všetky tri podskupiny vykazovali zvýšenie PFS v ramene s cabozantinibom v porovnaní s ramenom s placebom (HR bol v podskupine s pozitívnou RET mutáciou 0,23, v podskupine s negatívnou RET mutáciou 0,53 a v podskupine s neznámym stavom RET mutácií 0,30). Miera objektívnej odpovede meraná v týchto podskupinách bola zvyčajne konzistentná s PFS výsledkami, pričom miera reakcie nádoru bola 32 % v podskupine s pozitívnou mutáciou RET, 22 % v podskupine s negatívnou mutáciou RET a 25 % v podskupine s neznámym stavom tejto mutácie.
Ďalšie genetické analýzy ukázali, že malý podiel pacientov uchováva somatické mutácie tumoru v
HRAS,
KRAS alebo
NRAS. Títo pacienti (n=16) vykazovali signifikantné predĺženie PFS (HR 0,15) a mieru objektívnej odpovede 31 %. Pacienti s negatívnymi
RET mutáciami bez dôkazu mutácie RAS (n=33) ukázali pri užívaní cabozantinibe znížený prínos v PFS (HR 0,87) a nižšiu mieru
odpovede, 18 %, v porovnaní s podskupinami s inými mutáciami.
Vzťah medzi predĺženým PFS a signifikantným zlepšením v OS (HR 0,53, p=0,0179) sa preukázal iba v podskupine pacientov s pozitívnym stavom mutácie RET M918T (n=81/219 rameno s cabozantinibom). OS nebolo zatiaľ analyzované v podskupinách s inými RET a/alebo RAS mutáciami.
0,0
0 12 24 36
M
es
iace
P
e
diatrická populácia
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s cabozantinibom v jednej alebo viacerých podskupinách pediatrickej populácie pre liečbu malígnych solídnych tumorov (informácie o použití v pediatrickej populácii, pozri časť 4.2).
Tento liek bol registrovaný s podmienkou. To znamená, že sa očakávajú ďalšie dôkazy o prínosoch tohto lieku.
Európska agentúra pre lieky najmenej raz ročne posúdi nové informácie o tomto lieku a tento súhrn
charakteristických vlastností lieku bude podľa potreby aktualizovať.
5.2 Farmakokinetické vlastnosti
Absorpcia
Po perorálnom podaní cabozantinibu sa maximálna koncentrácia cabozantinibu v plazme dosiahne 2
až 5 hodín po užití.
Podávanie opakovanej dennej dávky cabozantinibu 140 mg po dobu 19 dní viedlo k približne 4- až
5-násobnej priemernej akumulácii cabozantinibu (založené na hodnotách AUC) v porovnaní s podaním jednorazovej dávky; rovnovážny stav bol dosiahnutý približne v 15. deň.
Jedlo bohaté na tuky mierne zvýšilo hodnoty Cmax a AUC (41 % a 57 %) v porovnaní so stavom na lačno u zdravých dobrovoľníkov, ktorým bol cabozantinib podaný v jednorazovej perorálnej dávke
140 mg. Informácie o presnom účinku jedla požitého 1 hodinu po podaní cabozantinibu nie sú k
dispozícii.
Distribúcia
Cabozantinib je in vitro v ľudskej plazme (≥ 99,7 %) vysoko viazaný na proteíny. Na základe
farmakokinetického (FK) populačného modelu sa stanovil distribučný objem (V/F) približne 349 l
(SE: ± 2,73 %).
Biotransformácia
Cabozantinib sa metabolizoval in vivo. V plazme boli prítomné štyri metabolity s expozíciou (AUC)
vyššou ako 10 % AUC materskej látky: XL184-N-oxid, rozkladný produkt XL184-amid, hydroxysíran
XL184 a rozkladný produkt 6-desmetyl-amid síran. Oba nekonjugované metabolity (XL184-N-oxid a
rozkladný produkt XL184-amid), ktoré majú <1 % schopnosti inhibície cieľovej kinázy v porovnaní s
materským cabozantinibom, predstavujú <10 % celkovej plazmatickej expozície spojenej s liečivom.
Cabozantinib je in vitro substrátom CYP3A4 metabolizmu, ako neutralizačná protilátka CYP3A4 inhibujúca tvorbu metabolitu XL184 N-oxidu o >80 % pri inkubácii katalyzovanej NADPH v ľudských pečeňových mikrozómoch; naproti tomu neutralizačné protilátky CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C19, CYP2D6 a CYP2E1 nemajú žiadny účinok na tvorbu metabolitov cabozantinibu. Neutralizačné protilátky CYP2C9 vykazovali minimálny účinok na tvorbu metabolitov cabozantinibu (t.j. <20 % zníženie).
Eliminácia
Koncový plazmatický eliminačný polčas cabozantinibu v štúdiách s jednorazovým podaním zdravým dobrovoľníkom bol približne 120 hodín. Priemerný klírens (CL/F) v rovnovážnom stave u pacientov
s rakovinovým ochorením bol v populačnej FK analýze odhadnutý na 4,4 l/h. Počas 48-dňového
obdobia zberu po jednorazovej dávke 14C-cabozantinibu zdravým dobrovoľníkom bolo zachytených približne 81 % celkovej podanej rádioaktivity, pričom 54 % v stolici a 27 % v moči.
Farmakokinetika u osobitných populácií pacientov
Poruchy f unkci e obl iči ek
Keďže údaje z tejto populácie nie sú k dispozícii, u pacientov s poruchami funkcie obličiek nie je možné vylúčiť rozdiely vo FK.
Poruchy f unkci e peče ne
Keďže údaje z tejto populácie nie sú k dispozícii, u pacientov s poruchami funkcie pečene nie je
možné vylúčiť rozdiely vo FK.
Rasa
Nie sú k dispozícii žiadne údaje na určenie rozdielov vo FK podmienené rasou.
5.3 Predklinické údaje o bezpečnosti
Nežiaduce reakcie, ktoré neboli pozorované v klinických štúdiách, ale boli pozorované u zvierat pri expozíciách podobných klinickým a s možným významom pre klinické použitie, boli tieto:
V štúdiách toxicity po opakovanej dávke u potkanov a psov v trvaní až 6 mesiacov boli cieľovými orgánmi toxicity gastrointestinálny trakt, kostná dreň, lymfoidné tkanivá, obličky, tkanivá nadobličiek a reprodukčného systému. Hodnota, pri ktorej neboli pozorované žiadne nepriaznivé účinky (NOAEL)
bola pri týchto zisteniach nižšia ako hladiny klinickej expozície u človeka pri zamýšľanej terapeutickej
dávke.
V štandardnej sade genotoxických testov cabozantinib nevykazoval žiadny mutagénny alebo klastogénny potenciál. Štúdie karcinogenity sa nevykonali. Štúdie hodnotiace toxicitu metabolitov neboli dokončené.
Štúdie fertility u potkanov ukázali zníženú samčiu aj samičiu plodnosť. Navyše bola u samcov psov pozorovaná hypospermatogenéza pri hladinách expozície nižších ako hladiny klinickej expozície u človeka pri určenej terapeutickej dávke.
Štúdie embryofetálneho vývoja sa vykonali u potkanov a králikov. U potkanov spôsoboval cabozantinib postimplantačné straty, fetálny edém, rázštep podnebia/pier, dermálnu apláziu a deformovaný alebo rudimentárny chvost. U králikov cabozantinib spôsoboval zmeny fetálneho mäkkého tkaniva (zmenšená veľkosť sleziny, malé alebo chýbajúce stredné laloky pľúc) a zvýšenú fetálnu incidenciu celkových malformácií. NOAEL pri embryo-fetálnej toxicite a teratogénnych zisteniach boli nižšie ako hladiny klinickej expozície u človeka pri zamýšľanej terapeutickej dávke.
Mláďatá potkanov (porovnateľné s pediatrickou populáciou >2 roky), ktorým bol podaný cabozantinib, vykazovali zvýšené hodnoty leukocytov, zníženú hematopoézu, pubescentný/nevyzrelý samičí reprodukčný systém (bez predĺženého vaginálneho otvárania), abnormality zubov, znížený obsah minerálov v kostiach a zníženú kostnú denzitu, pigmentáciu pečene a hyperpláziu žlčovodu. Nálezy na maternici/vaječníkoch a zníženie hematopoézy sa zdali byť prechodné, zatiaľ čo účinky na kostné parametre a pigmentáciu pečene boli trvalé. Hodnotenie mláďat potkanov (porovnateľné s pediatrickou populáciou <2 roky) nebolo vykonané.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Obsah kapsuly mikrokryštalická celulóza sodná soľ kroskarmelózy nátrium-glykolát škrobu
bezvodý koloidný oxid kremičitý
kyselina stearová
Obal kapsuly
želatína
čierny oxid železitý (E172) (iba 20 mg kapsuly)
červený oxid železitý (E172) (iba 80 mg kapsuly)
oxid titaničitý (E171)
Atramentnapotlač šelak
čierny oxid železitý (E172)
propylénglykol
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
3 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 ºC.
Uchovávajte v pôvodnom obale na ochranu pred vlhkosťou.
6.5 Druh obalu a obsah balenia
PVC/PE/PCTFE-Al blistre s fóliou na zadnej strane, zatavené do sekundárneho kartičkového obalu,
uzavretého teplom.
Blistrové karty obsahujú buď:
7 x 20 mg a 7 x 80 mg kapsula (pri dávke 100 mg/deň to je zásoba na 7 dní)
21 x 20 mg a 7 x 80 mg kapsula (pri dávke 140 mg/deň to je zásoba na 7 dní)
6.6 Špeciálne opatrenia na likvidáciu
Nepoužitý liek alebo odpad vzniknutý z lieku treba vrátiť do lekárne.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCII
TMC Pharma Services Ltd. Lodge Farm Barn
Elvetham Park Estate
Fleet Road
Hartley Wintney
Hampshire
RG27 8AS
Spojené Kráľovstvo
8. REGISTRAČNÉ ČÍSLO <ČÍSLA> EU/1/13/890/002
EU/1/13/890/003
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21. marec 2014
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.