
pozri časť 4.3 a 4.5).
Pemetrexed môže mať geneticky škodlivé účinky. Pohlavne zrelým mužom sa neodporúča splodiť dieťa počas liečby a do 6 mesiacov od ukončenia liečby. Odporúča sa používanie antikoncepčných metód alebo abstinencia. Vzhľadom na možnosť ireverzibilnej infertility spôsobenej liečbou pemetrexedom sa mužom odporúča, aby vyhľadali konzultáciu o možnosti trvalého uchovania spermií pred začiatkom liečby.
Ženy v plodnom veku musia počas liečby pemetrexedom používať účinnú antikoncepčnú metódu
(pozri časť 4.6).
Prípady radiačnej pneumonitídy boli zaznamenané u pacientov liečených ožarovaním buď pred, počas alebo po ich liečbe pemetrexedom. U týchto pacientov je potrebná zvláštna pozornosť a opatrnosť pri užívaní iných rádiosenzibilizujúcich látok.
U pacientov, ktorí podstúpili rádioterapiu pred týždňami až rokmi, boli zaznamenané prípady radiačného poškodenia typu „recall fenomén“.
Tento liek obsahuje menej ako 1 mmol sodíka (23 mg) v jednej injekčnej liekovke, t.j. v podstate "bez sodíka".
4.5 Liekové a iné interakcie
Pemetrexed sa vylučuje v nezmenenej forme hlavne obličkami, a to tubulárnou sekréciou a v menšom množstve glomerulárnou filtráciou. Súbežné podávanie nefrotoxických liekov (napr. aminoglykozidy,
kľučkové diuretiká, zlúčeniny platiny, cyklosporín) môže viesť k oneskorenému klírensu pemetrexedu. Táto kombinácia sa má používať s opatrnosťou. Ak je to nevyhnutné, klírens kreatinínu má byť prísne monitorovaný.
Súbežné podávanie látok, ktoré sa vylučujú taktiež tubulárnou sekréciou (napr. probenecid, penicilín) môže viesť k oneskoreniu klírensu pemetrexedu. V prípade kombinovaného podania týchto liekov a pemetrexedu je nutné postupovať s opatrnosťou. V prípade potreby má byť klírens kreatinínu starostlivo monitorovaný.
U pacientov s normálnymi renálnymi funkciami (klírens kreatinínu ≥ 80 ml/min) môžu vysoké dávky nesteroidových antiflogistík (NSA, ako je ibuprofén > 1 600 mg/deň) a vyššia dávka kyseliny acetylsalicylovej (≥ 1,3 g denne) znížiť elimináciu a následne zvýšiť výskyt nežiaducich udalostí pemetrexedu. Preto sa pri súbežnom podávaní vyšších dávok NSA alebo vyššej dávky kyseliny acetylsalicylovej s pemetrexedom u pacientov s normálnymi renálnymi funkciami (klírens kreatinínu ≥
80 ml/min) má postupovať s opatrnosťou.
Pacienti s miernou až stredne závažnou renálnou insuficienciou (klírens kreatinínu 45 – 79 ml/min) sa majú vyvarovať súbežného podávania pemetrexedu s NSA (napr. ibuprofén) alebo vyššej dávky kyseliny acetylsalicylovej 2 dni pred, v deň a 2 dni po podaní pemetrexedu (pozri časť 4.4).
Vzhľadom na nedostatok dát ohľadom potenciálnej interakcie s NSA s dlhšími polčasmi, ako sú piroxikam alebo rofekoxib, je potrebné prerušiť ich súbežné podávanie s pemetrexedom u pacientov s miernou až stredne závažnou renálnou insuficienciou najmenej 5 dní pred, v deň a najmenej 2 dni po podaní pemetrexedu (pozri časť 4.4). Ak je potrebné súbežne podávať NSA, u týchto pacientov je potrebné dôkladne monitorovať toxicitu, najmä myelosupresiu a gastrointestinálnu toxicitu.
Pemetrexed prechádza obmedzeným pečeňovým metabolizmom. Výsledky z in vitro štúdií s ľudskými pečeňovými mikrozómami ukázali, že sa nedá predpokladať, že pemetrexed spôsobuje klinicky významnú inhibíciu metabolického klírensu liekov metabolizovaných CYP3A, CYP2D6, CYP2C9, a CYP1A2.
Interakciebežnéuvšetkýchcytotoxickýchliekov
Vzhľadom na zvýšené riziko trombózy u pacientov s rakovinou je použitie antikoagulačnej liečby časté. Vysoká intraindividuálna variabilita stavu koagulácie počas choroby a možnosť interakcie medzi perorálnymi antikoagulanciami a protinádorovou chemoterapiou vyžaduje zvýšenú frekvenciu monitorovania INR (International Normalised Ratio), pokiaľ sa rozhodneme pacienta liečiť perorálnymi antikoagulanciami.
Kontraindikované súbežné podávanie: Vakcína proti žltej zimnici: riziko fatálnej generalizovanej postvakcinačnej reakcie (pozri časť 4.3).
Neodporučené súbežné podávanie: Živé oslabené vakcíny (okrem žltej zimnice, v tomto prípade je
súbežné podávanie kontraindikované): riziko systémovej reakcie s možným fatálnym koncom. Riziko je zvýšené u jedincov, ktorí už majú pokles imunity spôsobený základným ochorením. Použite inaktivovanú vakcínu, pokiaľ je k dispozícii (poliomyelitída) (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Antikoncepciaumužovažien
Ženy v plodnom veku musia v priebehu liečby pemetrexedom používať účinnú antikoncepciu. Pemetrexed môže mať geneticky škodlivý účinok. Pohlavne zrelým mužom sa neodporúča splodiť dieťa počas liečby a do 6 mesiacov od ukončenia liečby. Odporúča sa používanie antikoncepčných metód alebo abstinencia.
Gravidita
Neexistujú údaje o použití pemetrexedu u tehotných žien, avšak je podozrenie, že pemetrexed, tak ako iné antimetabolity, pravdepodobne spôsobuje závažné vrodené chyby, keď je použitý počas gravidity.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Pemetrexed sa nemá používať v
gravidite, pokiaľ to nie je jasne nevyhnutné a po starostlivom zvážení potrieb liečby u matky a rizika pre plod (pozri časť 4.4).
Doojčenie
Nie je známe, či sa pemetrexed vylučuje do ľudského materského mlieka a nežiaduce reakcie u
dojčeného dieťaťa sa nedajú vylúčiť. Dojčenie musí byť počas liečby pemetrexedom prerušené (pozri časť 4.3).
Fertilita
Vzhľadom na možnosť ireverzibilnej infertility spôsobenej liečbou pemetrexedom sa mužom odporúča, aby vyhľadali konzultáciu o možnosti trvalého uchovania spermií pred začiatkom liečby.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Bolo však zistené, že pemetrexed môže spôsobovať únavu. Preto majú byť pacienti upozornení, aby neviedli vozidlá a neobsluhovali stroje, ak sa tento prípad u nich vyskytne.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hlásenými nežiaducimi účinkami v súvislosti s pemetrexedom, použitým či už v
monoterapii alebo v kombinácii, boli útlm kostnej drene prejavujúci sa ako anémia, neutropénia, leukopénia, trombocytopénia; a gastrointestinálna toxicita prejavujúca sa ako anorexia, nevoľnosť, vracanie, hnačka, zápcha, faryngitíta, mukozitída a stomatitída. Ďalšie nežiaduce účinky zahŕňajú renálnu toxicitu, zvýšenie koncentrácie aminotransferáz, alopéciu, únavu, dehydratáciu, vyrážku, infekciu/sepsu a neuropatiu. Medzi zriedkavé patria Stevensov-Johnsonov syndróm a toxická epidermálna nekrolýza.
Tabuľkový prehľad nežiaducichreakcií
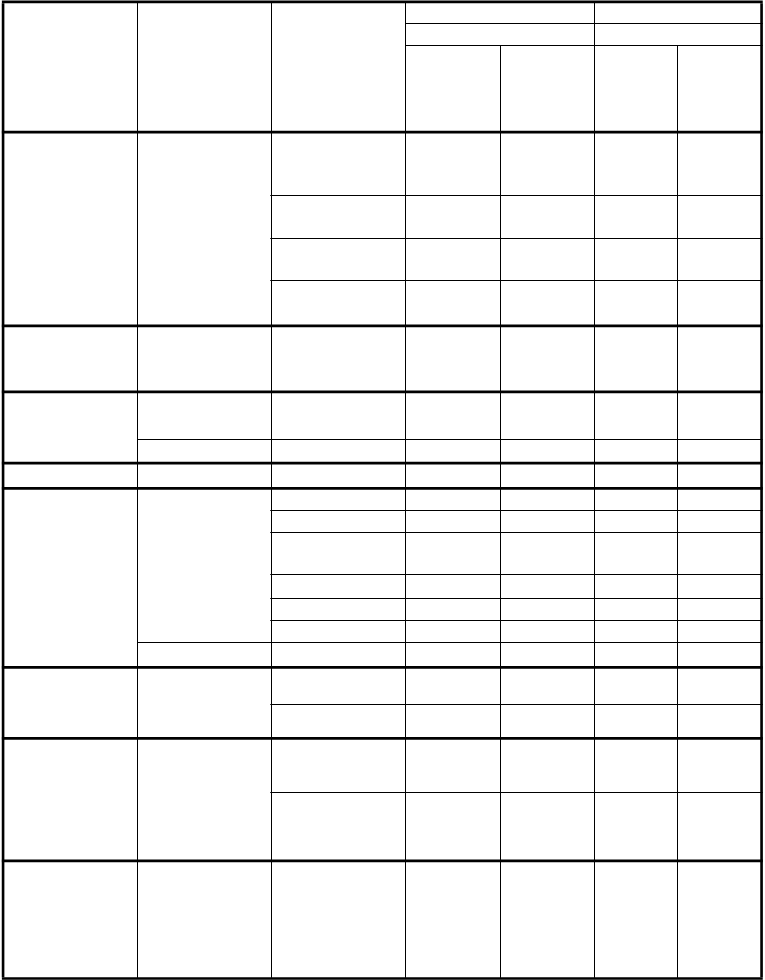
Tabuľka nižšie uvádza frekvenciu a závažnosť nežiaducich účinkov, ktoré boli zaznamenané u viac
ako 5 % zo 168 pacientov s mezoteliómom randomizovaných na liečbu s cisplatinou a pemetrexedom a zo 163 pacientov s mezoteliómom randomizovaných na liečbu s cisplatinou v monoterapii. V oboch
liečebných ramenách bola pacientom bez predošlej chemoterapie pridaná kyselina listová a vitamín
B12.
Stanovenie frekvencie: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až
<1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme (frekvencia sa
nedá odhadnúť z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
T
rieda
orgánových
F
r
ekvencia Udalosť* Pemetrexed/cisplatin Cisplatina
(
N=
168) (N=163)
systémov
Všetky stupne tox
ic
ity (%)
Toxi
ci
ta
3. a 4. stupňa (%)
Všetky stupne toxicity (%)
Toxi
ci
ta
3. a 4. stupňa (%)
Poruchy krvi a lymfatického systému
Veľmi časté Pokles neutrofilov/ granulocytov Pokles leukocytov Pokles hemoglobínu Pokles trombocytov
56,0 23,2 13,5 3,1
53,0 14,9 16,6 0,6
26,2 4,2 10,4 0,0
23,2 5,4 8,6 0,0
Poruchy metabolizmu a výživy
Časté Dehydratácia 6,5 4,2 0,6 0,6
Poruchy
nervového
Veľmi časté Neuropatia -
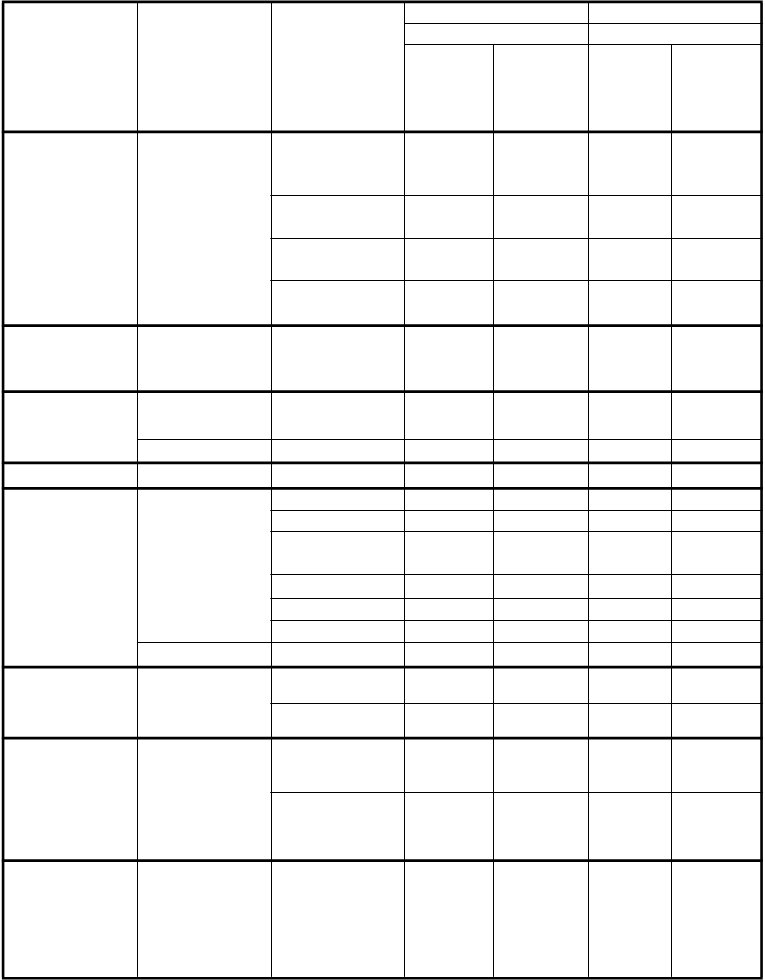
senzorická
10,1 0,0 9,8 0,6
systému
Časté Porucha chuti 7,7 0,0*** 6,1 0,0***
Poruchy oka Časté Konjunktivitída 5,4 0,0 0,6 0,0
Poruchy
gastrointestinál-
Veľmi časté Hnačka 16,7 3,6 8,0 0,0
Vracanie 56,5 10,7 49,7 4,3
neho traktu
Stomatitída/ Faryngitída
23,2 3,0 6,1 0,0
Poruchy kože a podkožného tkaniva
Nauzea 82,1 11,9 76,7 5,5
Anorexia 20,2 1,2 14,1 0,6
Zápcha 11,9 0,6 7,4 0,6
Časté Dyspepsia 5,4 0,6 0,6 0,0
Veľmi časté Vyrážka 16,1 0,6 4,9 0,0
Alopécia 11,3 0,0*** 5,5 0,0***
Poruchy obličiek a močových ciest
Veľmi časté Vzostup
kreatinínu
Znížený klírens kreatinínu*
10,7 0,6 9,8 1,2
16,1 0,6 17,8 1,8
Celkové
poruchy
a reakcie v mieste
podania
Veľmi časté Únava 47,6 10,1 42,3 9,2
* pozri „National Cancer Institute” CTC verzia 2 pre každý stupeň toxicity s výnimkou termínu „znížený klírens kreatinínu”
**, ktorý je odvodený z termínu „obličkové/urogenitálne iné”.
*** podľa “National Cancer Institute” CTC (v2.0; NCI 1998) porucha chuti a alopécia sa majú hlásiť len ako 1. alebo 2.stupeň.
Pre účely tejto tabuľky bola použitá hraničná hodnota 5 % na zaradenie všetkých udalostí, ktoré mali podľa ohlasovateľa možný vzťah s liečbou pemetrexedom a cisplatinou.
Klinicky relevantné CTC toxicity, zaznamenané u ≥ 1 % a ≤ 5 % pacientov, ktorí boli náhodne vybratí
(randomizovaní) na liečbu s cisplatinou a pemetrexedom, sú: renálne zlyhanie, infekcia, pyrexia,
febrilná neutropénia, zvýšené AST, ALT a GMT, urtikária a bolesť na hrudi. Klinicky relevantné CTC toxicity, zaznamenané u < 1 % pacientov, ktorí boli randomizovaní na liečbu s cisplatinou a pemetrexedom, sú: arytmia a motorická neuropatia.
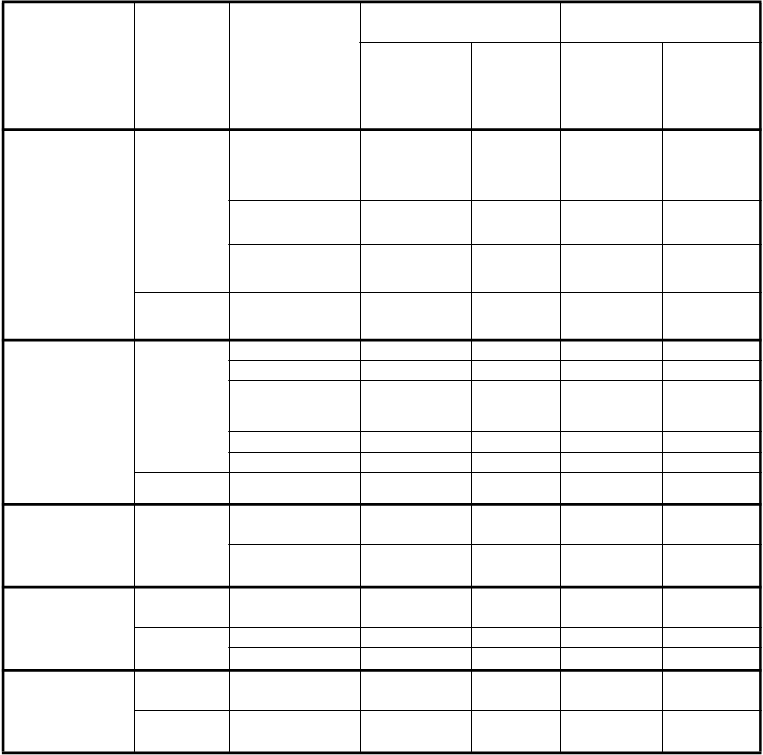
Tabuľka dole uvádza frekvenciu a závažnosť nežiaducich účinkov, ktoré boli zaznamenané u > 5 % z
265 pacientov randomizovaných na liečbu pemetrexedom v monoterapii so suplementáciou kyselinou listovou a vitamínom B12 a u 276 pacientov randomizovaných na liečbu docetaxelom v monoterapii. Všetci pacienti mali stanovenú diagnózu lokálne pokročilého alebo metastatického nemalobunkového karcinómu pľúc a predtým boli liečení chemoterapiou.
T
rieda
orgánových
F
r
ekvencia Udalosť* Pemetrexed
N=
265
Docetaxel
N=
276
systémov
V
šetky
stupne toxicity (%)
T
oxicita
3. a 4. stupňa (%)
V
šetky
stupne toxicity (%)
T
oxicita
3. a 4. stupňa (%)
Poruchy krvi a lymfatického systému
Veľmi časté
Pokles neutrofilov/ granulocytov
Pokles leukocytov Pokles
hemoglobínu
10,9 5,3 45,3 40,2
12,1 4,2 34,1 27,2
19,2 4,2 22,1 4,3
Časté Pokles trombocytov
8,3 1,9 1,1 0,4
Poruchy
gastrointestinál-
Veľmi časté
Hnačka 12,8 0,4 24,3 2,5
Vracanie 16,2 1,5 12,0 1,1
neho traktu
Stomatitída/
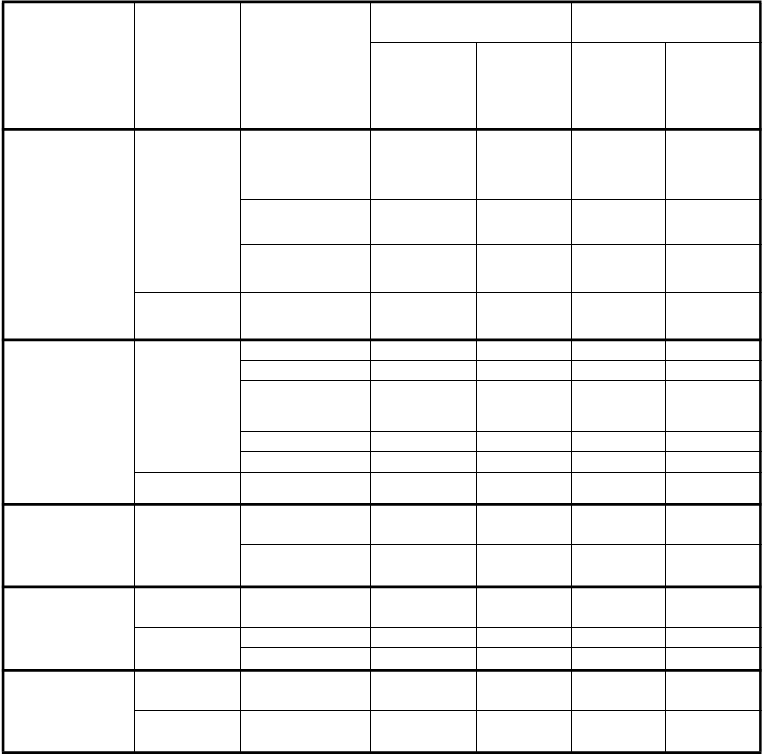
Faryngitída
14,7 1,1 17,4 1,1
Nauzea 30,9 2,6 16,7 1,8
Anorexia 21,9 1,9 23,9 2,5
Časté Zápcha 5,7 0,0 4,0 0,0
Poruchy pečene
a žlčových ciest
Časté Vzostup SGPT (ALT)
Vzostup SGOT
(AST)
7,9 1,9 1,4 0,0
6,8 1,1 0,7 0,0
Poruchy kože a podkožného
Veľmi časté
Vyrážka/ Deskvamácia
14,0 0,0 6,2 0,0
tkaniva
Časté Pruritus 6,8 0,4 1,8 0,0
Alopécia 6,4 0,4** 37,7 2,2**
Celkové
poruchy a
Veľmi časté
Únava 34,0 5,3 35,9 5,4
reakcie v mieste podania
Časté Horúčka 8,3 0,0 7,6 0,0
* pozri "National Cancer Institute" CTC verzia 2 pre každý stupeň toxicity.
** podľa “National Cancer Institute” CTC (v2.0; NCI 1998) alopécia sa má hlásiť len ako 1. alebo 2.stupeň
Pre účely tejto tabuľky bola použitá hraničná hodnota 5 % na zaradenie všetkých udalostí, ktoré mali podľa ohlasovateľa možný vzťah s liečbou pemetrexedom.
Klinicky relevantné CTC toxicity, zaznamenané u ≥ 1 % a ≤ 5 % pacientov, ktorí boli randomizovaní na liečbu s pemetrexedom, sú: infekcia bez neutropénie, febrilná neutropénia, alergická reakcia/precitlivenosť, zvýšený kreatinín, motorická neuropatia, senzorická neuropatia, erythema multiforme a abdominálna bolesť.
Klinicky relevantné CTC toxicity, zaznamenané u <1 % pacientov, ktorí boli randomizovaní na liečbu pemetrexedom, sú: supraventrikulárne arytmie.
Klinicky relevantné laboratórne toxicity 3. a 4. stupňa boli podobné pri hodnotení integrovaných výsledkov troch štúdií fázy 2 sledujúcich pemetrexed v monoterapii (n = 164) a štúdie fázy 3 s pemetrexedom v monoterapii ( popisovanej vyššie), s výnimkou neutropénie (12,8 % oproti 5,3 %, v takom poradí ) a zvýšenia alanínaminotransferázy (15,2 % oproti 1,9 %, v takom poradí). Tieto
rozdiely boli pravdepodobne spôsobené rozdielmi v populácii pacientov, pretože štúdie fázy 2 zahŕňali aj pacientov dovtedy neliečených aj ťažko predliečených pacientov s rakovinou prsníka s už existujúcimi pečeňovými metastázami a/alebo abnormálnymi pečeňovými testami pred liečbou.
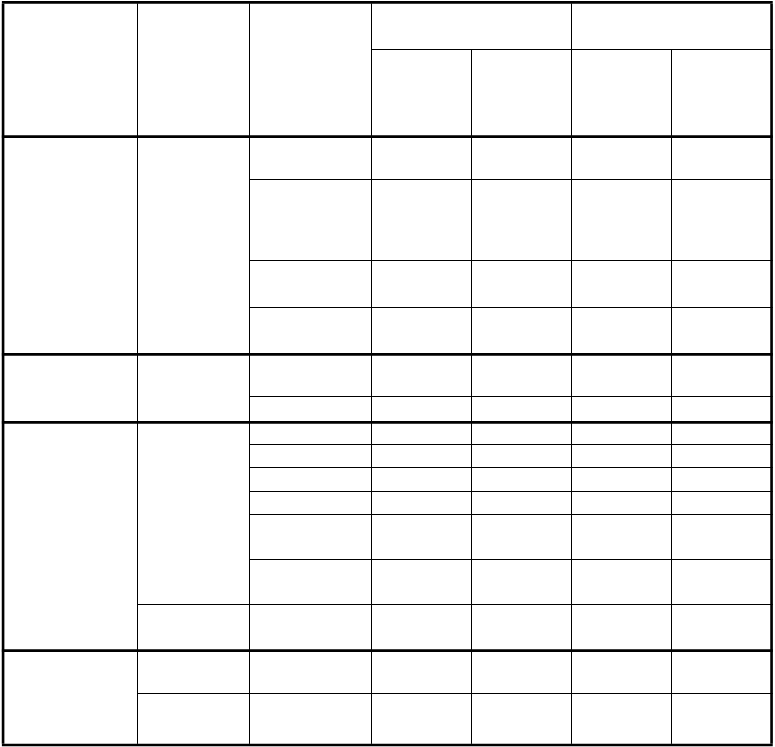
Tabuľka nižšie uvádza frekvenciu a závažnosť nežiaducich účinkov, ktoré môžu súvisieť so skúmaným liekom a ktoré boli zaznamenané u > 5 % z 839 pacientov s nemalobunkovým karcinómom pľúc (NSCLC) randomizovaných na liečbu cisplatinou a pemetrexedom a z 830
pacientov s NSCLC randomizovaných na liečbu cisplatinou a gemcitabínom. Všetci pacienti dostávali skúmanú liečbu ako inicálnu liečbu lokálne pokročilého alebo metastatického NSCLC a pacienti v
oboch liečebných skupinách boli plne suplementovaní kyselinou listovou a vitamínom B12.
T
rieda
orgánových
F
r
ekvencia Udalosť** Pemetrexed/cisplatina
(
N = 839)
G
emcitabín/cisplatina
(
N = 830)
systémov
Všetky stupne toxicity (%)
Toxi
ci
ta
3. a 4. stupňa (%)
Všetky stupne toxicity (%)
Toxi
ci
ta
3. a 4. stupňa (%)
Poruchy krvi a
lymfatického systému
Veľmi
časté
Pokles
hemoglobínu Pokles neutrofilov/ Granulocytov
Pokles leukocytov Pokles
trombocytov
33,0* 5,6* 45,7* 9,9*
29,0* 15,1* 38,4* 26,7*
17,8 4,8* 20,6 7,6*
10,1* 4,1* 26,6* 12,7*
Poruchy
nervového
Časté Neuropatia-
zmyslová
8,5* 0,0* 12,4* 0,6*
systému Poruchy gastrointestinál-
neho traktu
Veľmi časté
Porucha chuti 8,1 0,0*** 8,9 0,0*** Nauzea 56,1 7,2* 53,4 3,9* Vracanie 39,7 6,1 35,5 6,1
Anorexia 26,6 2,4* 24,2 0,7*
Zápcha 21,0 0,8 19,5 0,4
Stomatitída/ Faryngitída Hnačka bez kolostómie
Časté Dyspepsia/
Pálenie záhy
13,5 0,8 12,4 0,1
12,4 1,3 12,8 1,6
5,2 0,1 5,9 0,0
Poruchy kože a podkožného
Veľmi časté
Alopécia 11,9* 0*** 21,4* 0,5***
tkaniva
Časté Vyrážka/
Deskvamácia
6,6 0,1 8,0 0,5
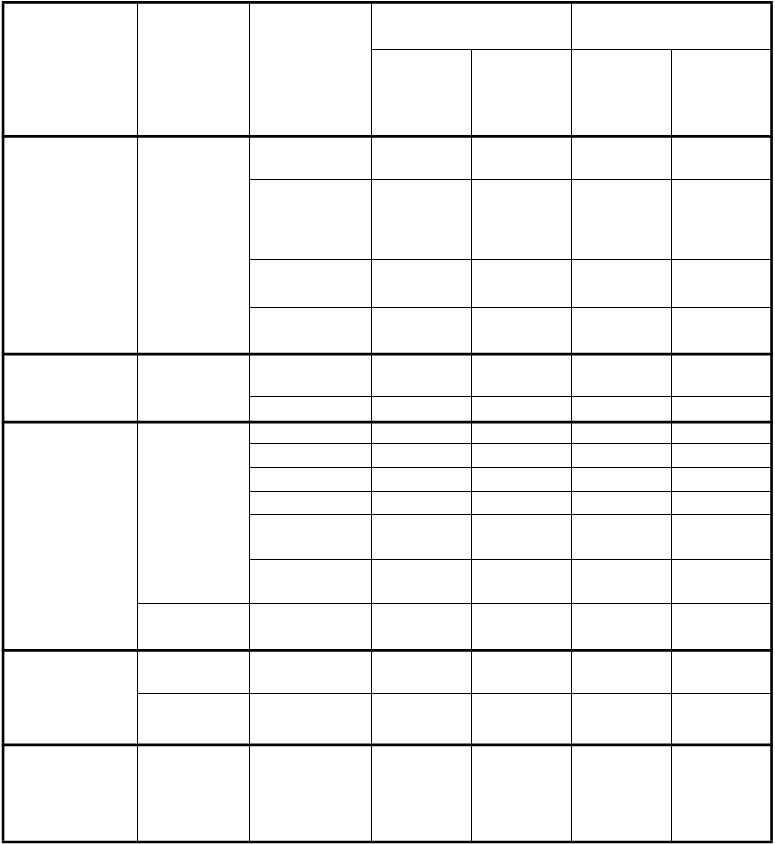
Poruchy
obličiek
a močových
ciest
Veľmi časté
Zvýšenie kreatinínu
10,1* 0,8 6,9* 0,5
Celkové poruchy a reakcie v mieste podania
Veľmi časté
Únava 42,7 6,7 44,9 4,9
* P-hodnoty <0,05 v porovnaní pemetrexedu/cisplatiny s gemcitabínom/cisplatinou, použitím Fisher Exact testu
** pozri "National Cancer Institute" CTC (v2.0; NCI 1998) pre každý stupeň toxicity.
*** podľa “National Cancer Institute” CTC (v2.0; NCI 1998) porucha chuti a alopécia sa majú hlásiť len ako 1. alebo 2. stupeň.
Pre účely tejto tabuľky bola použitá hraničná hodnota 5 % na zaradenie všetkých udalostí, ktoré mali podľa ohlasovateľa možný vzťah s liečbou pemetrexedom a cisplatinou.
Klinicky relevantná toxicita zaznamenaná u ≥ 1 % a ≤ 5 % pacientov, ktorí boli randomizovaní na liečbu s cisplatinou a pemetrexedom, zahŕňa: zvýšenie AST, zvýšenie ALT, infekciu, febrilnú neutropéniu, renálne zlyhanie, pyrexiu, dehydratáciu, konjunktivitídu a pokles klírensu kreatinínu. Klinicky relevantná toxicita zaznamenaná u <1 % pacientov, ktorí boli randomizovaní na liečbu cisplatinou a pemetrexedom, zahŕňa: zvýšenie GGT, bolesť na hrudi, arytmiu a motorickú neuropatiu. Klinicky významné prejavy toxicity s ohľadom na pohlavie boli rovnaké ako v celkovej populácii u pacientov užívajúcich pemetrexed s cisplatinou.
Nasledujúca tabuľka uvádza frekvenciu a závažnosť nežiaducich účinkov pravdepodobne súvisiacich so skúmaným liekom, ktoré boli zaznamenané v klinických štúdiách udržiavacej liečby pemetrexedom v monoterapii (Štúdia JMEN: N = 663) a v pokračovacej udržiavacej liečbe pemetrexedom (PARAMOUNT: N = 539) u viac ako 5 % z 800 pacientov randomizovaných na liečbu samotným pemetrexedom a 402 pacientov randomizovaných na liečbu placebom. Všetkým pacientom pred podaním chemoterapie na báze platiny diagnostikovali štádium IIIB alebo IV NSCLC. Pacienti v obidvoch študijných ramenách dostávali plnú náhradu kyseliny listovej a vitamínu B12.
T
rieda
orgánových
F
r
ekvencia
*
U
dalosť
** Pemetrexed***
(
N=
800)
Placebo***
(
N=
402)
systémov
Všetky stupne toxicity (%)
Toxicita 3. a 4. stupňa (%)
Všetky stupne toxicity (%)
Toxi
ci
ta
3. a 4. stupňa (%)
Poruchy krvi a
lymfatického systému
Poruchy
Veľmi časté Pokles
hemoglobínu
Časté Pokles leukocytov Pokles neutrofilov Neuropatia –
18,0 4,5 5,2 0,5
5,8 1,9 0,7 0,2
8,4 4,4 0,2 0,0
nervového
systému
Časté
zmyslová 7,4 0,6 5,0 0,2
Poruchy gastrointestinál- neho traktu
Veľmi časté Nauzea 17,3 0,8 4,0 0,2
Anorexia 12,8 1,1 3,2 0,0
Časté Vracanie 8,4 0,3 1,5 0,0
Poruchy pečene a žlčových ciest
Poruchy kože a podkožného
Mukozitída /
stomatitída
Časté ALT (SGPT)
zvýšenie
AST (SGOT)
zvýšenie
Vyrážka/
6,8 0,8 1,7 0,0
6,5 0,1 2,2 0,0
5,9 0,0 1,7 0,0


tkaniva Časté
Deskvamácia 8,1 0,1 3,7 0,0
Celkové poruchy
a reakcie v mieste podania
Veľmi časté Únava 24,1 5,3 10,9 0,7
Časté Bolesť 7,6 0,9 4,5 0,0
Edém 5,6 0,0 1,5 0,0
Poruchy obličiek Časté Poruchy
obličiek****
7,6 0,9 1,7 0,0
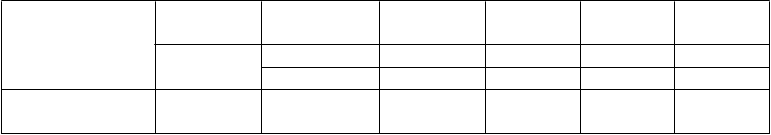
Skratky: ALT = alanínaminotransferáza, AST = aspartátaminotransferázáza; CTCAE = Comon Terminology Criteria for Adverse Event (Všeobecná terminológia nežiaducich reakcií); NCI = National Cancer Institute; SGOT = sérová glutámovooxalooctová aminotransferáza; SGPT = sérová glutámovopyrohroznová aminotransferáza
* Definícia frekvencií: Veľmi časté - ≥ 10%; Časté - > 5% a < 10%. Pre účely tejto tabuľky bola použitá 5%
hranica pre zaradenie všetkých účinkov, ktoré zaznamenávajúci považoval za súvisiace s pemetrexedom.
** Pre každý stupeň toxicity pozri NCI CTCAE Criteria (verzia 3.0; NCI 2003). Uvedené hlásené výskyty sú v súlade s CTCAE, verzia 3,0.
*** v integrovanej tabuľke nežiaducich reakcií sú spojené výsledky klinických skúšaní udržiavacej liečby pemetrexedom JMEN (N = 663) a pokračovania udržiavacej liečby pemetrexedom PARAMOUNT (N = 539).
**** Slovné spojenie zahŕňa zvýšenú hladinu kreatinínu v sére/krvi, zníženie rýchlosti glomerulárnej filtrácie,
zlyhanie obličiek a renálne/ urogenitálne - ostatné
Klinicky relevantná toxicita (podľa CTC) akéhokoľvek stupňa hlásená u ≥ 1 % a ≤ 5 % pacientov randomizovaných na pemetrexed zahŕňa: febrilnú neutropéniu, infekciu, pokles krvných doštičiek, hnačku, zápchu, alopéciu, pruritus/svrbenie, horúčky (bez neutropénie), očné opuchy (vrátane konjunktivitídy), zvýšené slzenie, závrat a motorickú neuropatiu.
Klinicky relevantná toxicita (podľa CTC) hlásená u < 1 % pacientov randomizovaných na pemetrexed zahŕňa: alergické reakcie/ hypersenzitivitu, multiformný erytém, supraventikulárnu arytmiu a pľúcnu embóliu.
Bezpečnosť sa hodnotila u pacientov, ktorí boli randomizovaní na liečbu pemetrexedom (N = 800). Výskyt nežiaducich reakcií bol vyhodnotený u pacientov, ktorí dostali udržiavaciu liečbu pemetrexedom ≤ 6 cyklov (N = 519) v porovnaní s výskytom u pacientov, ktorí dostali liečbu pemetrexedom > 6 cyklov (N = 281). Nárast nežiaducich reakcií (všetkých stupňov) sa pozoroval pri dlhodobejšej expozícii. Signifikantný nárast incidencie neutropénie stupňa 3/4, s možnou súvislosťou s liečbou podávanou v štúdii, sa pozoroval pri dlhšej expozícii pemetrexedu (≤ 6 cyklov: 3,3 %, > 6 cyklov: 6,4 %: p = 0,046). Neboli zaznamenané žiadne ďalšie štatisticky významné rozdiely medzi akýmikoľvek ďalšími individuálnymi nežiaducimi reakciami stupňa 3/4/5 pri dlhšej expozícii.
Menej často boli v priebehu klinických štúdií s pemetrexedom hlásené závažné kardiovaskulárne a cerebrovaskulárne príhody, vrátane infarktu myokardu, angíny pectoris, mozgovej príhody a prechodného ischemického ataku, obyčajne pri podaní v kombinácii s iným cytostatikom. Väčšina pacientov, u ktorých sa pozorovali tieto príhody, mala preexistujúce kardiovaskulárne rizikové faktory.
V priebehu klinických štúdií s pemetrexedom boli hlásené potenciálne závažné, zriedkavé prípady hepatitídy.
V priebehu klinických štúdií s pemetrexedom bola menej často hlásená pancytopénia.
V klinických štúdiách u pacientov liečených pemetrexedom boli menej často hlásené prípady kolitídy (vrátane intestinálneho a rektálneho krvácania, intesticinálnej perforácie, niekedy fatálnej, intestinálnej perforácie, intestinálnej nekrózy a zápalu slepého čreva).
V klinických štúdiách u pacientov liečených pemetrexedom boli menej často hlásené prípady intersticiálnej pneumonitídy s respiračnou insuficienciou, niekedy fatálne.
U pacientov liečených pemetrexedom boli menej často hlásené prípady edému.
Počas klinických štúdií s pemetrexedom bola menej často hlásená ezofagitída/radiačná ezofagitída.
Počas klinického skúšania s pemetrexedom bola často hlásená sepsa, niekedy so smrteľnými následkami.
V priebehu postmarketingového pozorovania boli u pacientov liečených pemetrexedom hlásené nasledujúce nežiaduce reakcie:
V súvislosti s pemetrexedom samotným alebo v kombinácii s inými chemoterapeutikami boli hlásené menej časté prípady akútneho renálneho zlyhania (pozri časť 4.4).
U pacientov liečených ožarovaním buď pred, počas alebo po ich liečbe pemetrexedom boli hlásené menej časté prípady radiačnej pneumonitídy (pozri časť 4.4).
U pacientov, ktorí podstúpili rádioterapiu v minulosti, boli zaznamenané zriedkavé prípady radiačného poškodenia typu „recall fenomén“ (pozri časť 4.4).
Menej často boli hlásené prípady periférnej ischémie vedúce niekedy až k nekrózam končatín. Zaznamenané boli aj zriedkavé prípady tvorby pľuzgierov vrátane Stevensovho-Johnsonovho
syndrómu a toxickej epidermálnej nekrolýzy, v niektorých prípadoch aj smrteľné.
Zriedkavo bola u pacientov liečených pemetrexedom hlásená imunitne podmienená hemolytická anémia.
Boli hlásené zriedkavé prípady anafylaktického šoku.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V*.
4.9 PredávkovanieK popísaným symptómom z predávkovania patrí neutropénia, anémia, trombocytopénia, mukozitída, senzorická polyneuropatia a vyrážka. K predpokladaným komplikáciám z predávkovania patrí útlm kostnej drene manifestujúci sa neutropéniou, trombocytopéniou a anémiou. Taktiež sa môže vyskytnúť infekcia s horúčkou alebo bez nej, hnačka, a/alebo mukozitída. V prípade podozrenia na
predávkovanie, majú mať pacienti sledovaný krvný obraz a musia dostávať podpornú liečbu podľa potreby. V liečbe predávkovania pemetrexedom sa musí vziať do úvahy podávanie kalciumfolinátu /
kyseliny folinovej.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antineoplastiká, analógy kyseliny listovej, ATC kód: L01BA04
CIAMBRA (pemetrexed) je antifolátové cytostatikum, cielené na viaceré enzymatické systémy. Pôsobí narušením rozhodujúcich metabolických procesov závislých na folátoch, ktoré sú nevyhnutné pre replikáciu buniek.
Štúdie
in vitro ukázali, že pemetrexed sa správa ako antifolát pôsobiaci na viaceré enzymatické systémy tým, že inhibuje tymidylát syntetázu (TS), dihydrofolát reduktázu (DHFR) a glycínamid ribonukleotid formyltransferázu (GARFT), ktoré sú kľúčovými enzýmami závislými na foláte pre
de
novo biosyntézu tymidínových a purínových nukletidov. Pemetrexed je transportovaný do buniek redukovaným folátovým nosičom aj membránovým folátovým väzbovým proteínovým transportným systémom .V bunke je pemetrexed rýchlo a efektívne zmenený na polyglutamátové formy enzýmom folylpolyglutamát syntetázou. Polyglutamátové formy sa zdržujú v bunkách a sú ešte účinnejšie inhibítory TS a GARFT. Polyglutamácia je proces závislý na čase a koncentrácii, ku ktorému dochádza v nádorových bunkách a v menšej miere v normálnych tkanivách. Polyglutamátové metabolity majú zvýšený intracelulárny polčas, čoho výsledkom je prolongovaný účinok lieku v malígnych bunkách.
Klinickáúčinnosť
M ez ot el i óm
EMPHACIS, multicentrická, randomizovaná, jednoducho zaslepená štúdia fázy 3 s pemetrexedom
plus cisplatina verzus cisplatina u pacientov dovtedy neliečených chemoterapiou s malígnym mezoteliómom pleury ukázala, že pacienti liečení pemetrexedom a cisplatinou mali klinické 2,8 mesačné zlepšenie mediánu prežívania v porovnaní s pacientmi liečenými iba cisplatinou.
Počas štúdie bola pridaná suplementácia nízkymi dávkami kyseliny listovej a vitamínu B12 za účelom zníženia toxicity. Primárna analýza štúdie bola vykonaná na populácii všetkých pacientov randomizovaných do liečebnej skupiny, ktorá bola liečená hodnoteným liekom (randomizovaní a liečení). Bola vykonaná analýza podskupín pacientov, ktorí dostávali suplementáciu kyselinou
listovou a vitamínom B12 počas celého priebehu liečby počas štúdie (úplne suplementovaní). Výsledky týchto analýz účinnosti sú uvedené v tabuľke:
Účinnosť pemetrexedu v kombinácii s cisplatinou oproti cisplatine u malígneho mezoteliómu pleury
R
andomizovaní a liečení
pacienti
Plne suplementovaní pacienti
P
arameter účinnosti pemetrexed/ cisplatina (N = 226)
cisplatina
(
N=
222)
pemetrexed/ cisplatina (N=168)
cisplatina
(
N=
163)
Medián celkového prežívania(mesiace) (95%CI)
12,1 (10,0-14,4)
9,3 (7,8- 10,7)
13,3 (11,4-14,9)
10,0 (8,4- 11,9)
Log Rank hodnota p* 0,020 0,051
Medián času do progresie tumoru
(mesiace) (95%CI)
5,7
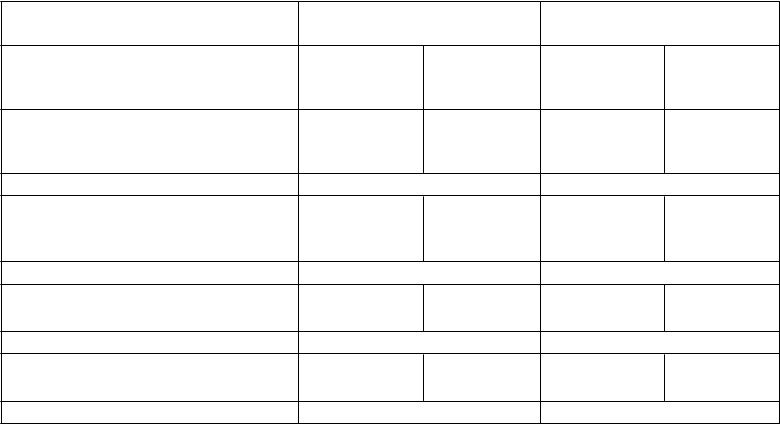
(4,9-6,5)
3,9
(2,8-4,4)
6,1
(5,3-7,0)
3,9
(2,8-4,5)
Log Rank hodnota p* 0,001 0,008
Čas do zlyhania liečby (mesiace)
(95%CI)
4,5 (3,9-4,9)
2,7 (2,1-2,9)
4,7 (4,3-5,6)
2,7 (2,2-3,1)
Log Rank hodnota p* 0,001 0,001
Pomer celkovej odpovede** (95%CI)
41,3% (34,8-48,1)
16,7% (12,0-22,2)
45,5% (37,8-53,4)
19,6% (13,8-26,6)
Fisherova presná hodnota p* <0,001 <0,001
Skratky: CI = interval spoľahlivosti
* hodnota p odkazuje na porovnanie medzi liečebnými ramenami.
**Rameno pemetrexed/cisplatina, randomizovaní a liečení (N = 225) a plne suplementovaní (N = 167)
Štatisticky signifikantné zlepšenie klinicky závažných symptómov (bolesť a dušnosť) spojených s malígnym mezoteliómom pleury v ramene pemetrexed/cisplatina (212 pacientov) oproti ramenu s cisplatinou (218 pacientov) bolo preukázané použitím škály symptómov karcinómu pľúc (Lung Cancer Symptom Scale). Taktiež boli pozorované štatisticky významné rozdiely v pľúcnych funkčných testoch. Rozdiel medzi liečebnými ramenami bol dosiahnutý zlepšením pľúcnej funkcie v ramene pemetrexed/cisplatina a zhoršením pľúcnej funkcie v čase v kontrolnom ramene.
Existujú obmedzené údaje u pacientov s malígnym mezoteliómom pleury liečených pemetrexedomv monoterapii.
Pemetrexed v dávke 500 mg/m2 bol študovaný ako liek v monoterapii u 64 chemoterapiou neliečených pacientov s malígnym mezoteliómom pleury. Celková odpoveď na liečbu bola 14,1 %.
NSCLC, l i ečba v druhej l í nii :
V multicentrickej, randomizovanej, otvorenej štúdii fázy 3 s pemetrexedom a docetaxelom u pacientov s lokálne pokročilým a metastatickým NSCLC po primárnej chemoterapii bol preukázaný medián prežívania 8,3 mesiacov u pacientov liečených pemetrexedom (ITT - populácia so zámerom byť
liečená n = 283) a 7,9 mesiacov u pacientov liečených docetaxelom (ITT - populácia so zámerom byť liečená n = 288). Predchádzajúca chemoterapia nezahŕňala pemetrexed. Analýza vplyvu histológie
NSCLC na liečebný efekt z hľadiska celkového prežitia vyšla v prospech pemetrexedu oproti
docetaxelu vo všetkých okrem prevažne skvamóznych histológií (n = 399, 9,3 verzus 8,0 mesiacov, dosiahnuté HR = 0,78; 95% CI = 0,61-1,00, p = 0,047) a v prospech docetaxelu pre skvamóznu
bunkovú histológiu karcinómu (n = 172, 6,2 verzus 7,4 mesiacov, dosiahnuté HR = 1,56; 95% CI =
1,08-2,26, p = 0,018). V rámci histologických podskupín sa nepozorovali žiadne klinicky významné rozdiely týkajúce sa bezpečnostného profilu pemetrexedu.
Obmedzené klinické údaje zo samostatnej, randomizovanej, kontrolovanej štúdie fázy 3 predpokladajú, že údaje o účinnosti (celkové prežitie, prežívanie bez progresie) pre pemetrexed sú rovnaké medzi pacientmi predtým liečenými docetaxelom (n = 41) a pacientmi, ktorí predtým nedostávali liečbu docetaxelom (n = 540).
Účinnosť pemetrexedu a docetaxelu u pacientov
s nemalobunkovým karcinómom pľúc – ITT populácia
Pemetrexed Docetaxel
Č
as prežívania (mesiace)
§ Medián (m)
§ 95 % CI pre medián
§ HR
§ 95%CIpreHR
§ hodnota p pre neinferioritu (HR)
Čas prežívania bez progresie (mesiace)
§ Medián
§ HR (95 % CI)
Čas do zlyhania liečby (TTTF – mesiace)
§ Medián
§ HR (95 % CI)
(n=283) (n= 288)
8,3 7,9 (7,0- 9,4) (6,3-9,2)
0,99 (0,82- 1,20)
0,226
(n=283) (n=288)
2,9 2,9
0.97 (0.82– 1.16)
(n=283) (n=288)
2,3 2,1
0,84 (0,71– 0,997)
O
dpoveď (n: kvalifikovaný pre odpoveď)
§ Odpoveď na liečbu (%) (95 % CI)
§ Stabilizácia ochorenia (%)
(n=264)
9,1 (5,9-13,2)

45,8
(n=274)
8,8 (5,7-12,8)
46,4
Skratky: CI = interval spoľahlivosti; HR = pomer rizika; ITT = so zámerom liečiť; n = veľkosť celej populácie.
NSCLC, l i ečba v prv ej l í ni i:
Multicentrická, randomizovaná, otvorená štúdia fázy 3 s pemetrexedom a cisplatinou verzus
gemcitabínom a cisplatinou u pacientov bez predchádzajúcej liečby chemoterapiou s lokálne pokročilým alebo metastatickým (stupeň IIIb alebo IV) nemalobunkovým karcinómom pľúc (NSCLC)
ukázala, že pemetrexed spolu s cisplatinou (ITT [Intent-To-Treat – so zámerom liečiť] populácia
n=862) splnila primárny cieľ a preukázala rovnakú klinickú účinnosť ako gemcitabín s cisplatinou (ITT n=863) v celkovom prežívaní (adjustovaný pomer rizík 0,94; 95% CI = 0,84-1,05). Všetci pacienti zahrnutí do štúdie mali výkonnostný stav podľa ECOG 0 alebo 1.
Analýza primárnej účinnosti bola založená na ITT populácii. Analýzy citlivosti hlavných cieľových parametrov účinnosti boli hodnotené na populácii kvalifikovanej protokolom (PQ). Analýzy účinnosti pre PQ populáciu boli zhodné s analýzami pre ITT populáciu a podporujú noninferioritu AC verzus GC.
Prežívanie bez progresie (PFS) a celková odpoveď na liečbu boli podobné medzi liečebnými ramenami: medián PFS bol 4,8 mesiacov pre pemetrexed s cisplatinou verzus 5,1 mesiacov pre
gemcitabín s cisplatinou (adjustovaný pomer rizík 1,04; 95% CI = 0,94-1,15) a celková odpoveď na
liečbu bola 30,6% (95% CI = 27,3- 33,9) pre pemetrexed s cisplatinou verzus 28,2% (95% CI = 25,0-
31,4) pre gemcitabín s cisplatinou. PFS údaje sa čiastočne potvrdili nezávislým preskúmaním (na preskúmanie bolo náhodne vybraných 400/1725 pacientov).
Analýza vplyvu histológie NSCLC na celkové prežitie ukázala klinicky významné rozdiely v prežívaní podľa histológie, pozri tabuľku nižšie.
Účinnosť pemetrexedu+cisplatina vs. gemcitabín+cisplatina v prvej línii nemalobunkového karcinómu pľúc – ITT populácia a histologické podskupiny.
ITT populácia a histologické podskupiny
Medián celkového prežitia v mesiacoch
(
95% CI)
P
e
m
e
t
rexed + cisplatina
G
emcitabín+
ci
sp
l
at
i
n
a
Adjustovaný
pomer rizík
(
HR)
(95% CI)
p-hodnota superiorit
y
ITTpopulácia
10,3
N=862 10,3
N=863
a
0,94
0,259
(N=1725)
Adenokarcinóm (N=847) Veľkobunkový (N=153)
Iné
(N=252)
Zo skvamóznych
buniek(N=473)
(9,8–11,2)
12,6 (10,7–13,6)
10,4 (8,6–14,1)
8,6 (6,8–10,2)
9,4 (8,4–10,2)
(9,6–10,9)
N=436 10,9 (10,2–11,9)
N=76 6,7 (5,5–9,0)
N=106 9,2 (8,1–10,6)
N=244 10,8 (9,5–12,1)
(0,84– 1,05) N=411 0,84
(0,71–0,99)
N=77 0,67 (0,48–0,96)
N=146 1,08 (0,81–1,45)
N=229 1,23 (1,00–1,51)
0,033
0,027
0,586
0,050
Skratky: CI = interval spoľahlivosti; ITT = so zámerom liečiť; n = veľkosť celej populácie.
a Štatisticky signifikantná pre noninferioritu, s celkovým intervalom spoľahlivosti pre HR výrazne
pod 1,17645 hranicou noninferiority (p<0,001).
Kaplanove Meierovej krivky celkového prežitia podľa histológie
|
ty i l i
b a b o
r
P l a v
i
v r
u
S
|
|

1.0

0.9
0.8
0.7
0.6
0.5
0.4

0.3

0.2
0.1
0.0
Adenokarcinóm

AC GC
1.0
0.9
0.8
0.7
y t i l i
b a b o
r
P l a v
i
v r
u
S
|
|

0.6

0.5
0.4


0.3




0.2
0.1

0.0
Veľkobunkový karcinóm




AC GC

0 6 12 18 24 30
0 6 12 18 24 30
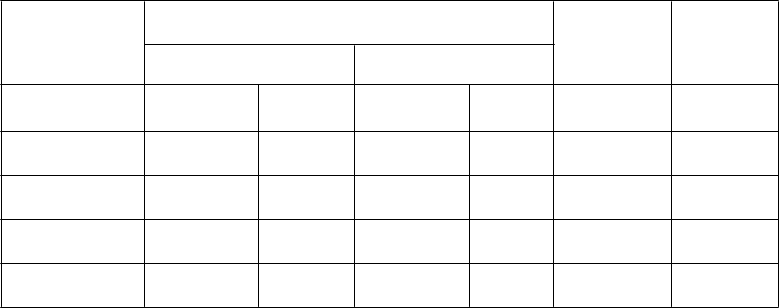

Čas prežitia (mesiace) Čas prežitia (mesiace)
Nepozorovali sa žiadne klinicky významné rozdiely týkajúce sa bezpečnostného profilu pemetrexedu s
cisplatinou v rámci histologických podskupín.
Pacienti liečení pemetrexedom a cisplatinou potrebovali menej transfúzií (16,4% verzus 28,9%, p<0,001), transfúzií červených krviniek (16,1% verzus 27,3%, p<0,001) a transfúzií krvných doštičiek
(1,8% versus 4,5%, p=0,002). Pacienti potrebovali tiež podávanie nižších dávok erytropoetínu/darbopoetínu (10,4% versus 18,1%, p<0,001), G-CSF/GM-CSF (3,1% versus 6,1%, p=0,004) a liekov s obsahom železa (4,3% versus 7,0%, p=0,021).
NSCLC, udrž iavaci a l ieč ba:
JMEN
Multicentrická randomizovaná dvojitozaslepená placebom kontrolovaná štúdia fázy 3 (JMEN) porovnávala účinnosť a bezpečnosť udržiavacej liečby pemetrexedom spolu s najlepšou možnou podpornou liečbou (BSC) (n = 441) a podávaním placeba spolu s BSC (n = 222) u pacientov s lokálne pokročilým (štádium IIIB) alebo metastázujúcim (štádium IV) nemalobunkovým karcinómom pľúc (NSCLC), u ktorých nedošlo ku progresii po 4 cykloch terapie prvej línie dvojkombináciou obsahujúcou cisplatinu alebo karboplatinu v kombinácii s gemcitabínom, paklitaxelom alebo docetaxelom. Kombinovaná liečba obsahujúca v prvej línii dvojkombináciu s pemetrexedom nebola zahrnutá. Všetci pacienti, ktorí sa zúčastnili tejto štúdie mali ECOG výkonnostný stav 0 alebo 1. Udržiavacia liečba sa pacientom podávala do progresie choroby. Účinnosť a bezpečnosť sa merali od začiatku randomizácie po dokončení (indukčnej) terapie prvej línie. Stredná hodnota počtu cyklov podaných pacientom bola 5 cyklov udržiavacej liečby pemetrexedom a 3,5 cyklu podávania placeba. Celkovo 213 pacientov (48,3 %) dokončilo ≥ 6 cyklov a 103 pacientov (23,4 %) dokončilo ≥ 10 cyklov liečby pemetrexedom.
Štúdia dosiahla svoj primárny cieľ a preukázala štatisticky významné zlepšenie PFS v skupine s pemetrexedom oproti skupine s placebom (n = 581, nezávisle hodnotená populácia, medián 4,0 mesiacov a. 2,0 mesiacov, v danom poradí) (pomer rizík = 0,60, 95 % CI = 0,49-0,73, p < 0,00001). Nezávislé hodnotenie pacientských skenov potvrdilo závery hodnotenia PFS zo strany skúšajúcich. Stredná hodnota celkovej doby prežitia (OS) pre celú populáciu (n = 663) bola v skupine s pemetrexedom 13,4 mesiacov a v skupine s placebom 10,6 mesiacov, pomer rizík = 0,79 (95 %, CI =
0,65 - 0,95, p = 0,01192).
V súhlase s inými štúdiami s pemetrexedom sa v štúdii JMEN pozoroval rozdiel účinnosti s ohľadom na histológiu NSCLC. U pacientov s NSCLC iného histologického typu ako prevažne skvamózneho
(n = 430, nezávisle hodnotená populácia) bola stredná hodnota celkovej doby prežívania bez progresie
(PFS) pri pemetrexede 4,4 mesiace a v skupine s placebom 1,8 mesiaca, pomer rizík = 0,47 (95% CI =
0,37-0,60, p = 0,00001. Stredná hodnota celkovej doby prežitia (OS) u pacientov s NSCLC iného histologického typu ako prevažne skvamózneho (n = 481) bola v skupine s pemetrexedom 15,5
mesiacov a v skupine s placebom 10,3 mesiacov (pomer rizík = 0,70 (95% CI 0,56-0,88, p = 0,002).
Stredná hodnota (OS) vrátane indukčnej fázy bola u pacientov s NSCLC iného histologického typu ako prevažne skvamózneho v skupine s pemetrexedom 18,6 mesiacov a skupine s placebom 13,6
mesiacov pomer rizík = 0,71 (95% CI = 0,56 - 0,88; p = 0,002).
U pacientov s karcinómom skvamózneho histologického typu nenaznačujú výsledky PFS ani OS
výhodu liečby pemetrexedom oproti placebu.
Medzi histologickými podskupinami sa v bezpečnostnom profile pemetrexedu nepozorovali žiadne klinicky signifikantné rozdiely.
JMEN: Kaplanova Meierova krivka doby prežívania bez progresie (PFS) a celkovej doby prežitia u pacientov s NSCLC iného histologického typu ako prevažne skvamózneho užívajúcich pemetrexed alebo placebo:
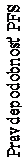

Doba prežívania bez progresie Celková doba prežitia
PFS doba (mesiace)
Čas prežitia (mesiace)
 PARAMOUNT
PARAMOUNT
Mutlicentrická randomizovaná dvojito zaslepená, placebom kontrolovaná štúdia fázy 3 (PARAMOUNT) porovnávala účinnosť a bezpečnosť pokračovacej udržiavacej liečby pemetrexedom s BSC (n = 359) oproti liečbe placebom s BSC (n = 180) u pacientov s lokálne pokročilým (v štádiu IIIB) alebo metastatickým (v štádiu IV) NSCLC iného histologického typu, ako prevažne zo skvamóznych buniek, u ktorých nedošlo k progresii ochorenia po 4 cykloch prvej línie liečby dvojkombináciou pemetrexedu s cisplatinou. Z celkového počtu 939 pacientov liečených
pemetrexedom v kombinácii s cisplatinou, bolo 539 pacientov randomizovaných na udržiavaciu liečbu pemetrexedom alebo placebom. Z randomizovaných pacientov odpovedalo na liečbu 44,9 %
úplne/čiastočne a u 51,9 % došlo ku stabilizácii ochorenia po liečbe dvojkombináciou pemetrexedu s
cisplatinou. Pacienti, ktorí boli randomizovaní na udržiavaciu liečbu, museli mať výkonnostný stav ECOG 0 alebo 1. Medián doby trvania od začiatku liečby pemetrexedom spolu s cisplatinou do začiatku udržiavacej liečby bol 2,96 mesiacov rovnako v skupine s pemetrexedom aj v skupine s placebom. Randomizovaní pacienti dostávali udržiavaciu liečbu kým trvala progresia ochorenia. Účinnosť a bezpečnosť sa merali od randomizácie po ukončenie prvej línie (indukčnej) liečby. Stredné hodnoty počtu podaných cyklov boli 4 cykly udržiavacej liečby pemetrexedom a 4 cykly placeba. Celkovo ukončilo ≥6 cyklov udržiavacej liečby pemetrexedom 169 pacientov (47,1 %), čo predstavovalo minimálne 10 úplných cyklov s pemetrexedom.
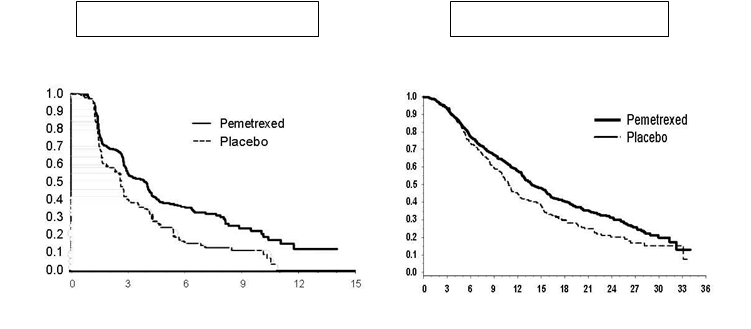
Štúdia dosiahla svoj primárny cieľ a preukázala štatisticky významné zlepšenie PFS v skupine s
pemetrexedom oproti skupine s placebom (n = 472, nezávisle hodnotená populácia, medián
3,9 mesiacov a. 2,6 mesiaca, v danom poradí) (pomer rizík = 0,64, 95 % CI = 0,51-0,81, p < 0,0002).
Nezávislé hodnotenie pacientskych skenov potvrdilo závery hodnotenia PFS skúšajúcimi.
U randomizovaných pacientov, podľa meraní od začiatku indukčnej liečby prvej línie pemetrexedom s cisplatinou, bol podľa hodnotení skúšajúcich medián PFS 6,9 mesiaca v skupine s pemetrexedom
a 5,6 mesiaca v skupine s placebom (pomer rizík = 0,59 95 % CI = 0,47-0,74).
Liečba pemetrexedom, následne po indukčnej liečbe s pemetrexedom a cisplatinou (4 cykly), bola štatisticky lepšia než liečba placebom pre OS (medián 13,9 mesiacov oproti 11,0 mesiacom, pomer rizík = 0,78; 95% CI = 0,64 – 0,96; p = 0,0195). V čase tejto konečnej analýzy prežitia bolo nažive alebo sa stratilo z pozorovania 28,7 % pacientov v ramene s pemetrexedom oproti 21,7 % v ramene s placebom. Relatívna liečebná efektivita pemetrexedu bola vnútorne konzistentná medzi podskupinami (vrátane štádia ochorenia, odpovede na indukčnú liečbu, ECOG PS, fajčiarskeho stavu, pohlavia , histológie a veku) a podobná k tej, ktorá bola pozorovaná v neupravených analýzach OS a PFS. 1- ročné a 2-ročné prežívanie u pacientov užívajúcich pemetrexed bolo 58 % a 32 % v danom poradí oproti 45 % a 21 % u pacientov s placebom. Medián OS od začiatku prvolíniovej indukčnej liečby s pemetrexedom a cisplatinou bol 16,9 mesiacov u pacientov v ramene s pemetrexedom oproti 14,0 mesiacov v ramene s placebom (pomer rizík = 0,78; 95 % CI = 0,64 – 0,96). Percento pacientov, ktorí po ukončení štúdie pokračovali v liečbe bolo 64,3 % pre pemetrexed a 71,7 % pre placebo.
P
ARA
M
O
UNT
: Kaplanova Meierova krivka doby prežívania bez progresie (PFS) a celkového prežívania (Overall Survival) OS u pacientov s NSCLC iného histologického typu ako prevažne skvamóznych buniek, pokračujúcich v udržiavacej liečbe pemetrexedom versus placebom (merané od randomizácie).
Prežívanie bez progresie Celkové prežívanie
PFS doba (mesiace)
OS doba (mesiace)
Bezpečnostné profily udržiavacej liečby pemetrexedom z dvoch klinických štúdií JMEN a
PARAMOUNT boli podobné.
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií pre pemetrexed s ohľadom na všetky vekové podskupiny detí a dospievajúcich vo všetkých schválených indikáciách (pozri časť 4.2).
5.2 Farmakokinetické vlastnostiFarmakokinetické vlastnosti pemetrexedu po podaní lieku v monoterapii boli hodnotené u 426 pacientov s rozličnými malígnymi solídnymi tumormi v dávkach od 0,2 do 838 mg/m2 podaných v infúzii počas 10 minút. Distribučný objem pemetrexedu v ustálenom stave je 9 l/m2. Štúdie
in vitro ukazujú, že približne 81 % pemetrexedu sa viaže na plazmatické proteíny. Táto väzba nebola výrazne ovplyvnená rôznymi stupňami renálneho poškodenia. Pemetrexed sa podrobuje v obmedzenej miere pečeňovému metabolizmu. Pemetrexed je primárne eliminovaný močom, pričom 70 % až 90 % dávky sa vylúči močom v nezmenenej forme v priebehu prvých 24 hodín od podania. Štúdie
in vitro naznačujú, že pemetrexed sa aktívne vylučuje pomocou OAT3 (organického aniónového transportéra
3). Celkový systémový klírens pemetrexedu je 91,8 ml/min a eliminačný polčas plazmy je 3,5 hodín, u pacientov s normálnou obličkovou funkciou (klírens kreatinínu 90 ml/min). Variabilita v klírense medzi pacientmi je mierna, a to 19,3 %. Celková systémová expozícia pemetrexedu (AUC) a maximálna plazmatická koncentrácia sa proporcionálne zvyšujú s dávkou. Farmakokinetika pemetrexedu je rovnaká aj po viacerých liečebných cykloch.
Farmakokinetické vlastnosti pemetrexedu nie sú ovplyvnené súčasným podávaním cisplatiny. Suplementácia perorálnou kyselinou listovou a intramuskulárnym vitamínom B12 neovplyvňujú farmakokinetiku pemetrexedu.
5.3 Predklinické údaje o bezpečnostiPodanie pemetrexedu gravidným myšiam viedlo k zníženiu životaschopnosti plodu, zníženiu hmotnosti plodu, nekompletnej osifikácii niektorých kostných štruktúr, k rázštepu podnebia.
Podanie pemetrexedu samcom myší viedlo k reprodukčnej toxicite charakterizovanej redukciou výskytu fertility a testikulárnou atrofiou. V 9-mesačnej štúdii s použitím intravenóznej bolusovej injekcie vykonanej na bígloch bol pozorovaný testikulárny nález (degenerácia/nekróza semenotvorného epitelu). To naznačuje, že pemetrexed môže poškodiť mužskú fertilitu. Ženská fertilita nebola skúmaná.
Pemetrexed nebol mutagénny v in vitro chromozomálnom aberačnom teste u ovariálnych buniek čínskych škrečkov, ani v Amesovom teste. V mikronukleárnom teste in vivo u myší bolo zistené, že pemetrexed je klastogénny.
Štúdie hodnotiace karcinogénny potenciál pemetrexedu neboli vykonané.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol (E421)
Kyselina chlorovodíková (na úpravu pH) Hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Pemetrexed je fyzikálne inkompatibilný s rozpúšťadlami obsahujúcimi vápnik, vrátane laktátového Ringerovho roztoku a Ringerovho roztoku. Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti6.6.
6.3 Čas použiteľnosti
Neotvorená injekčná liekovka
2 roky
Rekonštituovanéainfúzneroztoky
Chemická a fyzikálna stabilita infúzneho roztoku pemetrexedu bola preukázaná počas 24 hodín pri
2°C až 8°C alebo 15°C-25°C. Rekonštituovaný roztok sa musí použiť ihneď na prípravu infúzneho
roztoku. Z mikrobiologického hľadiska sa infúzny roztok musí použiť ihneď. Ak sa nepoužije ihneď, za čas uchovávania a podmienky pred použitím je zodpovedný užívateľ, liek sa v tomto prípade nemá uchovávať dlhšie ako 24 hodín pri teplote od 2°C do 8°C alebo 15-25°C.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne špeciálne podmienky na uchovávanie.
Podmienky na uchovávanie po rekonštitúcii / riedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Sklenená injekčná liekovka (typ I) s gumenou chlórobutylovou zátkou a hliníkovým uzáverom
s výklopným krytom. Liekovka je pokrytá priľnavým plastovým krytom. Každá 10 ml injekčná
liekovka obsahuje 100 mg pemetrexedu (ako hemipentahydrát disodnej soli pemetrexedu).
Balenie: 1 injekčná liekovka
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
1. Použite aseptickú techniku počas rekonštitúcie a pri následnom riedení pemetrexedu na podanie intravenóznej infúzie.
2. Vypočítajte dávku a počet potrebných injekčných liekoviek CIAMBRA. Každá injekčná liekovka obsahuje väčšie množstvo pemetrexedu na uľahčenie prenosu označenej dávky.
3. Rekonštituujte 100 mg injekčnú liekovku pridaním 4,2 ml 0,9 % injekčného roztoku chloridu sodného (9 mg/ml) bez použitia konzervačných prísad, čím vznikne roztok obsahujúci 25 mg/mlpemetrexedu. Pohybujte jemným krúživým pohybom každou injekčnou liekovkou až kým sa prášok úplne rozpustí. Výsledný roztok je číry a jeho farba kolíše od bezfarebnej po žltú alebo zeleno-žltú bez narušenia jeho kvality. pH pripraveného roztoku je medzi 6,6 a 7,8. Potrebné je ďalšie riedenie.
4. Príslušný objem rekonštituovaného roztoku pemetrexedu sa musí ďalej nariediť na 100 ml s 0,9 % injekčným roztokom chloridu sodného (9 mg/l) bez použitia konzervačných prísad a podať ako intravenózna infúzia počas 10 minút.
5. Infúzne roztoky s pemetrexedom pripravené podľa vyššie uvedeného návodu sú kompatibilné s polyvinylchloridovými a polyolefínovými infúznymi setmi a infúznymi vakmi.
6. Lieky na parenterálnu aplikáciu sa musia pred aplikáciou vizuálne kontrolovať na prítomnosť drobných častíc a zmenu farby. V prípade prítomnosti drobných častíc neaplikujte.
7. Roztok pemetrexedu je určený len na jedno použitie. Všetky nepoužité lieky alebo odpad vzniknutý z liekov musia byť zlikvidované v súlade s národnými požiadavkami.
Bezpečnostné opatrenia pri príprave a podávaní lieku: Tak ako u iných potenciálne toxických protinádorových liekov, sa musí s infúznymi roztokmi pemetrexedu zaobchádzať starostlivo. Odporúča sa použitie rukavíc. Ak sa roztok dostane do kontaktu s kožou, umyte kožu ihneď a
dôkladne mydlom a vodou. Ak sa roztok pemetrexedu dostane do kontaktu so sliznicami, prepláchnite sliznice dôkladne vodou. Pemetrexed nie je vezikancium. V prípade úniku pemetrexedu mimo žilu
neexistuje špecifické antidotum. Bolo popísaných pár prípadov úniku pemetrexedu mimo žilu, ktoré
hodnotiaci nepovažoval za závažné. Únik lieku mimo žilu má byť liečený miestnymi štandardnými postupmi ako u iných nevezikancií.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMenarini International Operations Luxembourg S.A.
1, Avenue de la Gare
L-1611, Luxembourg
Luxembursko
8. REGISTRAČNÉ ČÍSLOEU/1/15/1055/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.
1. NÁZOV LIEKU
CIAMBRA 500 mg prášok na prípravu infúzneho koncentrátu
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE
Každá injekčná liekovka obsahuje 500 mg pemetrexedu (ako hemipentahydrát disodnej soli
pemetrexedu).
Po rekonštitúcii (pozri časť 6.6) obsahuje každá injekčná liekovka 25 mg/ml pemetrexedu.
Pomocnálátkasoznámymúčinkom
Každá injekčná liekovka obsahuje približne 54 mg sodíka.
Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Prášok na prípravu infúzneho koncentrátu.
Biely až takmer biely lyofilizovaný prášok.
pH rekonštituovaného roztoku je medzi 6,6 a 7,8
Osmolalita rekonštituovaného roztoku je 230 - 270 mOsmol/kg.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Malígnymezoteliómpleury
CIAMBRA v kombinácii s cisplatinou je indikovaná na liečbu pacientov bez predchádzajúcej chemoterapie s neresekovateľným malígnym mezoteliómom pleury.
Nemalobunkovýkarcinómpľúc
CIAMBRA v kombinácii s cisplatinou je indikovaná ako liečba prvej línie pacientov s lokálne pokročilým alebo metastatickým nemalobunkovým karcinómom pľúc okrem prevažne skvamóznej
bunkovej histológie (pozri časť 5.1).
CIAMBRA je indikovaná v monoterapii na udržiavaciu liečbu lokálne pokročilého alebo metastázujúceho nemalobunkového karcinómu pľúc, inej ako prevažne skvamóznej bunkovej histológie u pacientov, u ktorých po chemoterapii založenej na platine nedošlo k bezprostrednej progresii ochorenia (pozri časť 5.1).
CIAMBRA je indikovaná v monoterapii na liečbu druhej línie pacientov s lokálne pokročilým alebo metastatickým nemalobunkovým karcinómom pľúc okrem prevažne skvamóznej bunkovej histológie (pozri časť 5.1).
4.2 Dávkovanie a spôsob podávania
CIAMBRA sa musí podávať len pod dohľadom lekára s kvalifikáciou pre používanie protinádorovej
chemoterapie.
Dávkovanie
CI AMBRA v kombináci i s ci spl ati nou
Odporúčaná dávka CIAMBRY je 500 mg/m2 telesného povrchu (BSA) podávaná ako intravenózna infúzia počas 10 minút v prvý deň každého 21-dňového cyklu. Odporúčaná dávka cisplatiny je
75 mg/m2 BSA, podávaná infúziou počas 2 hodín približne 30 minút po ukončení infúzie s
pemetrexedom v prvý deň každého 21-dňového cyklu. Pacientommusíbyťpodanáprimeranáantiemetickáliečbaaprimeranáhydratáciapredpodanímcisplatiny,a/aleboajpojejpodaní
(Informácie o špecifickom odporučenom dávkovaní cisplatiny - pozri tiež súhrn charakteristických
vlastností lieku pre lieky obsahujúce cisplatinu).
CIAMBRA v monoterapii
U pacientov liečených na nemalobunkový karcinóm pľúc po predchádzajúcej chemoterapii, odporúčaná dávka CIAMBRY je 500 mg/m2 BSA podávaná ako intravenózna infúzia počas 10 minút v prvý deň každého 21-dňového cyklu.
Reži m pre medi káci e
Na zníženie výskytu a závažnosti kožných reakcií sa má podať kortikosteroid deň pred podaním pemetrexedu, v deň podania a deň po podaní pemetrexedu. Kortikosteroid mábyť ekvivalentom 4 mg dexametazónu perorálne podávaného dvakrát denne (pozri časť 4.4).
Na zníženie toxicity musia pacienti liečení pemetrexedom dostávať tiež vitamínovú suplementáciu (pozri časť 4.4). Pacienti musia denne užívať perorálne kyselinu listovú alebo multivitamíny obsahujúce kyselinu listovú (od 350 do 1 000 mikrogramov). Aspoň päť dávok kyseliny listovej musí byť podaných počas 7 dní pred prvou dávkou pemetrexedu a dávkovanie musí pokračovať v priebehu celej liečby a ďalších 21 dní po poslednej dávke pemetrexedu. Pacienti musia tiež dostať intramuskulárnu injekciu vitamínu B12 (1 000 mikrogramov) v týždni pred prvou dávkou pemetrexedu a jedenkrát každé 3 cykly potom. Nasledujúce injekcie s vitamínom B12 sa môžu podávať v rovnaký deň ako pemetrexed.
Monitorovanie
Pacientom liečeným pemetrexedom je potrebné pred každou dávkou sledovať celý krvný obraz, vrátane diferenciálneho počtu bielych krviniek (WCC) a krvných doštičiek. Pred každým podaním
chemoterapie majú byť vykonané krvné biochemické testy na zhodnotenie obličkových a pečeňových
funkcií. Pred zahájením každého cyklu chemoterapie je nutné, aby pacienti mali nasledovné výsledky vyšetrení: absolútny počet neutrofilov (ANC) má byť ≥ 1500 buniek/mm3 a počet krvných doštičiek má byť ≥ 100 000 buniek/mm3.
Klírens kreatinínu má byť ≥ 45 ml/min.
Celkový bilirubín má byť ≤ 1,5 násobok hornej hranice normálnych hodnôt. Alkalická fosfatáza (AP), aspartát-aminotransferáza (AST alebo SGOT) a alanín-aminotransferáza (ALT alebo SGPT) majú byť
≤ 3 násobok hornej hranice normálnych hodnôt. V prípade postihnutia pečene nádorom sú
akceptovateľné hodnoty alkalickej fosfatázy, AST a ALT ≤ 5 násobok hornej hranice normálnych hodnôt.
Úprav a dávok
Úprava dávky na začiatku nasledujúceho cyklu sa má vykonať na základe najhlbšieho poklesu hematologických hodnôt alebo na základe maximálnej nehematologickej toxicity zistenej v
predchádzajúcom cykle liečby. Liečba môže byť odložená, aby bol dostatok času na zotavenie. Po
zotavení sa pacienti majú opätovne liečiť podľa smerníc uvedených v tabuľkách 1, 2 a 3, ktoré sa použijú v prípade podávania CIAMBRY v monoterapii alebo v kombinácii s cisplatinou.
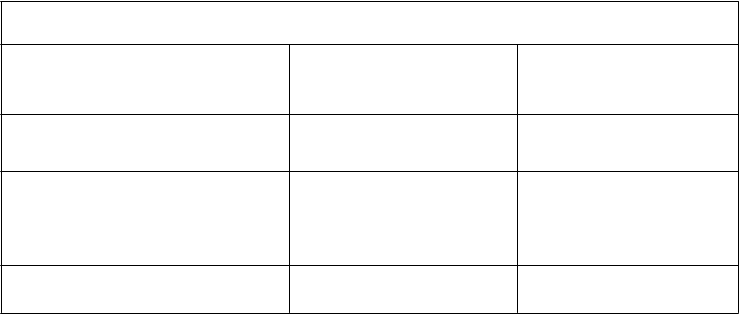
 T
abuľka 1 – Tabuľka modifikácie dávky CIAMBRY
(
v monoterapii alebo v kombinácii) a cisplatiny – Hematologická toxicita
T
abuľka 1 – Tabuľka modifikácie dávky CIAMBRY
(
v monoterapii alebo v kombinácii) a cisplatiny – Hematologická toxicita
Absolútny počet neutrofilov < 500 /mm3 a
doštičiek ≥ 50 000 /mm3 v období najhlbšieho
poklesu
Počet doštičiek v období najhlbšieho poklesu
< 50 000/mm3 bez ohľadu na absolútny počet neutrofilov v období najhlbšieho poklesu
Počet doštičiek v období najhlbšieho poklesu
< 50 000/mm3 s krvácaníma, bez ohľadu na absolútny počet neutrofilov v období
najhlbšieho poklesu
75 % predchádzajúcej dávky (CIAMBRY aj cisplatiny)
75 % predchádzajúcej dávky (CIAMBRY aj cisplatiny)
50 % predchádzajúcej dávky (CIAMBRY aj cisplatiny)
a Tieto kritériá sú v súlade s definíciou krvácania ≥CTC stupňa 2 kritérií bežnej toxicity (CTC) podľa „National
Cancer Institute” (CTC v2.0; NCI 1998).
Ak sa u pacienta vyvinie nehematologická toxicita ≥ 3. stupňa (s výnimkou neurotoxicity), CIAMBRA má byť vysadená až do úpravy parametrov na hodnoty nižšie alebo rovnaké ako boli hodnoty pred liečbou. Liečba sa zaháji podľa smerníc uvedených v tabuľke 2.
Tabuľka 2 – Tabuľka modifikácie dávky CIAMBRY
(v monoterapii alebo v kombinácii) a cisplatiny – Nehematologická toxicita a, b
D
ávka CIAMBRY (mg/m
2
)
D
ávka cisplatiny
(m
g
/m
2
)
Akákoľvek toxicita 3. alebo 4.
stupňa s výnimkou mukozitídy
Hnačka s nutnosťou hospitalizácie
(bezohľadu na stupeň) alebo hnačka
3. alebo 4. stupňa
75 % predchádzajúcej
dávky
75 % predchádzajúcej dávky
75 % predchádzajúcej
dávky
75 % predchádzajúcej dávky
Mukozitída 3. a 4. stupňa 50 % predchádzajúcej
dávky
100 % predchádzajúcej
dávky
a Kritériá bežnej toxicity (CTC) podľa „National Cancer Institute“ (CTC v2.0; NCI 1998)
b s výnimkou neurotoxicity
V prípade neurotoxicity, odporúčaná úprava dávky pre CIAMBRU a cisplatinu je uvedená v Tabuľke 3.
Pacienti majú prerušiť liečbu pri výskyte neurotoxicity 3.alebo 4. stupňa.
 Tabuľka 3 – Modifikácia dávky CIAMBRY(v monoterapii alebo v kombinácii) a cisplatiny – NeurotoxicitaStupeň CTCa Dávka CIAMBRY (mg/m2) Dávka cisplatiny (mg/m2)
Tabuľka 3 – Modifikácia dávky CIAMBRY(v monoterapii alebo v kombinácii) a cisplatiny – NeurotoxicitaStupeň CTCa Dávka CIAMBRY (mg/m2) Dávka cisplatiny (mg/m2)0–1 100 % predchádzajúcej dávky 100 % predchádzajúcej dávky
2 100 % predchádzajúcej dávky 50 % predchádzajúcej dávky
a Kritériá bežnej toxicity (CTC) podľa „National Cancer Institute“ (CTC v2.0; NCI 1998)
Liečba CIAMBROU má byť prerušená, ak sa u pacienta vyskytne akákoľvek hematologická alebo nehematologická toxicita 3. alebo 4. stupňa po 2 redukciách dávky, alebo okamžite ak sa vyskytne neurotoxicita 3. alebo 4. stupňa.
Starší ľudia V klinických štúdiách neboli zistené žiadne údaje, že by pacienti vo veku 65 rokov a viac mali vyššie riziko nežiaducich udalostí v porovnaní s pacientmi mladšími ako 65 rokov. Nie je nutné žiadne zníženie dávky, okrem prípadov, keď je toto zníženie nevyhnutné pre všetkých pacientov.
Pediatrická populácia
Použitie CIAMBRY pri liečbe malígneho mezoteliómu pleury a nemalobunkového karcinómu pľúc sa netýka pediatrickej populácie.
Pacienti s poškodením funkcie obličiek (štandardný Cockcroftov a Gaultov vzorec alebo glomerulárna filtrácia meraná metódou klírensu Tc99m-DPTA v sére)
Pemetrexed sa primárne vylučuje v nezmenenej forme obličkami. V klinických štúdiách nebola u pacientov s klírensom kreatinínu≥ 45 ml/min potrebná žiadna úprava dávky mimo úprav odporúčaných pre všetkých pacientov. Nie sú dostatočné dáta o použití pemetrexedu u pacientov s
klírensom kreatinínu pod 45 ml/min a preto sa použitie pemetrexedu u týchto pacientov neodporúča
(pozri časť 4.4).
Pacienti s poškodením funkcie pečene:
Nebol zistený žiadny vzťah medzi AST (SGOT), ALT (SGPT) alebo celkovým bilirubínom a farmakokinetikou pemetrexedu. Napriek tomu pacienti s poškodením funkcie pečene s bilirubínom >
1,5-krát ako horná hranica normy a/alebo aminotransferázami > 3,0-krát ako horná hranica
normálnych hodnôt (hepatálne metastázy neprítomné) alebo > 5,0-krát ako je horná hranica normálnych hodnôt (hepatálne metastázy prítomné) neboli doteraz špeciálne sledovaní.
Spôsobpodávania
Opatrenia pred zaobchádzaním s CIAMBROU alebo pri podaní CIAMBRY, pozri časť 6.6.
CIAMBRA sa má podávať ako intravenózna infúzia počas 10 minút v prvý deň každého 21-denného
cyklu. Pokyny na rekonštitúciu a nariedenie CIAMBRY pred podaním, pozri časť 6.6.
4.3 Kontraindikácie
Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1. Dojčenie (pozri časť 4.6).
Súbežná vakcinácia proti žltej zimnici (pozri časť 4.5).
4.4 Osobitné upozornenia a opatrenia pri používaní
Pemetrexed môže utlmiť funkciu kostnej drene čoho výsledkom je neutropénia, trombocytopénia a anémia (alebo pancytopénia) (pozri časť 4.8). Potlačenie tvorby kostnej drene predstavuje obvykle toxicitu, ktorá limituje veľkosť použitej dávky. Pacienti majú byť sledovaní z hľadiska útlmu kostnej drene počas liečby a pemetrexed nemá byť podaný pacientom, pokiaľ sa absolútny počet neutrofilov (ANC) nevráti na hodnotu ≥ 1500 buniek/mm3 a počet doštičiek na ≥ 100 000 buniek/mm3. Zníženie dávky v nasledujúcich cykloch závisí od hodnôt absolútneho počtu neutrofilov v čase najhlbšieho poklesu, počtu doštičiek a maximálnej nehematologickej toxicity vyskytujúcej sa v predchádzajúcom cykle (pozri časť 4.2).
Bolo zaznamenaných menej toxicity a redukcií stupňa 3/4 hematologickej a nehematologickej toxicity ako je neutropénia, febrilná neutropénia a infekcia s neutropéniou stupňa 3/4, keď boli pred liečbou podávané kyselina listová a vitamín B12. Preto musia byť všetci pacienti liečení pemetrexedom poučení, aby užívali profylakticky kyselinu listovú a vitamín B12 za účelom zníženia toxicity
súvisiacej s liečbou (pozri časť 4.2).
Kožné reakcie boli zaznamenané u pacientov, ktorí nedostávali pred liečbou kortikosteroidy. Podávanie dexametazónu (alebo ekvivalentného kortikosteroidu) pred liečbou pemetrexedom môže znížiť výskyt a závažnosť kožných reakcií (pozri časť 4.2).
Nebol študovaný dostatočný počet pacientov s klírensom kreatinínu pod 45 ml/min. Preto sa použitie pemetrexedu u pacientov s klírensom kreatinínu < 45 ml/min neodporúča (pozri časť 4.2).
Pacienti s miernou až stredne závažnou renálnou insuficienciou (klírens kreatinínu 45 – 79 ml/min) sa
majú vyvarovať užívania nesteroidových antiflogistík (NSA), ako je ibuprofén a kyselina acetylsalicylová (> 1,3 g denne), 2 dni pred podaním pemetrexedu, v deň a 2 dni po podaní
pemetrexedu (pozri časť 4.5). Pacienti s miernou až stredne závažnou renálnou insuficienciou, vhodní
na liečbu pemetrexedom, majú prerušiť užívanie NSA s dlhšími polčasmi vylučovania najmenej 5 dní
pred podaním pemetrexedu, v deň a najmenej 2 dni po podaní pemetrexedu (pozri časť 4.5).
V súvislosti s pemetrexedom samotným alebo v kombinácii s inými chemoterapeutikami boli hlásené závažné renálne príhody, vrátane akútneho renálneho zlyhania. Mnoho pacientov, u ktorých sa tieto príhody objavili, malo podkladové rizikové faktory pre rozvoj renálnych príhod, vrátane dehydratácie alebo pre-existujúcej hypertenzie alebo diabetes.
Vplyv prítomnosti tekutín v treťom priestore, ako je pleurálny výpotok alebo ascites, na pemetrexed nie je presne stanovený. Klinické skúšanie 2. fázy s pemetrexedom na 31 pacientoch s ohraničeným tumorom a stabilným výskytom tekutiny v treťom priestore nepreukázalo žiadny rozdiel
v plazmatických koncentráciách a klírense pemetrexedu normalizovaných podľa dávky oproti pacientom bez prítomnosti tekutín v treťom priestore. Preto sa má pred začatím liečby pemetrexedom zvážiť drenáž tekutiny z tretieho priestoru, avšak táto nemusí byť nutná.
Ako dôsledok gastrointestinálnej toxicity pemetrexedu podávaného v kombinácii s cisplatinou sa pozorovala závažná dehydratácia. Preto pacienti majú dostávať adekvátnu antiemetickú terapiu a primeranú hydratáciu pred a/alebo po podaní liečby.
Menej často boli v priebehu klinických štúdií s pemetrexedom hlásené závažné kardiovaskulárne príhody vrátane infarktu myokardu a cerebrovaskulárne príhody, zvyčajne pri podaní v kombinácii
s ďalším cytostatikom. Väčšina pacientov, u ktorých sa pozorovali tieto príhody, mala preexistujúce kardiovaskulárne rizikové faktory (pozri časť 4.8).
U pacientov s rakovinou je častý pokles imunity. Preto sa neodporúča súbežné užívanie živých oslabených vakcín (pozri časť 4.3 a 4.5).
Pemetrexed môže mať geneticky škodlivé účinky. Pohlavne zrelým mužom sa neodporúča splodiť dieťa počas liečby a do 6 mesiacov od ukončenia liečby. Odporúča sa používanie antikoncepčných metód alebo abstinencia. Vzhľadom na možnosť ireverzibilnej infertility spôsobenej liečbou pemetrexedom sa mužom odporúča, aby vyhľadali konzultáciu o možnosti trvalého uchovania spermií pred začiatkom liečby.
Ženy v plodnom veku musia počas liečby pemetrexedom používať účinnú antikoncepčnú metódu
(pozri časť 4.6).
Prípady radiačnej pneumonitídy boli zaznamenané u pacientov liečených ožarovaním buď pred, počas alebo po ich liečbe pemetrexedom. U týchto pacientov je potrebná zvláštna pozornosť a opatrnosť pri užívaní iných rádiosenzibilizujúcich látok.
U pacientov, ktorí podstúpili rádioterapiu pred týždňami až rokmi, boli zaznamenané prípady radiačného poškodenia typu „recall fenomén“.
Tento liek obsahuje 2,34 mmol sodíka (alebo 54 mg) v jednej injekčnej liekovke. Toto sa má vziať do úvahy u pacientov na diéte s kontrolovaným obsahom sodíka.
4.5 Liekové a iné interakcie
Pemetrexed sa vylučuje v nezmenenej forme hlavne obličkami, a to tubulárnou sekréciou a v menšom množstve glomerulárnou filtráciou. Súbežné podávanie nefrotoxických liekov (napr. aminoglykozidy,
kľučkové diuretiká, zlúčeniny platiny, cyklosporín) môže viesť k oneskorenému klírensu pemetrexedu. Táto kombinácia sa má používať s opatrnosťou. Ak je to nevyhnutné, klírens kreatinínu má byť prísne monitorovaný.
Súbežné podávanie látok, ktoré sa vylučujú taktiež tubulárnou sekréciou (napr. probenecid, penicilín) môže viesť k oneskoreniu klírensu pemetrexedu. V prípade kombinovaného podania týchto liekov a pemetrexedu je nutné postupovať s opatrnosťou. V prípade potreby má byť klírens kreatinínu starostlivo monitorovaný.
U pacientov s normálnymi renálnymi funkciami (klírens kreatinínu ≥ 80 ml/min) môžu vysoké dávky nesteroidových antiflogistík (NSA, ako je ibuprofén > 1600 mg/deň) a vyššia dávka kyseliny acetylsalicylovej (≥ 1,3 g denne) znížiť elimináciu a následne zvýšiť výskyt nežiaducich udalostí pemetrexedu. Preto sa pri súbežnom podávaní vyšších dávok NSA alebo vyššej dávky kyseliny acetylsalicylovej s pemetrexedom u pacientov s normálnymi renálnymi funkciami (klírens kreatinínu ≥
80 ml/min) má postupovať s opatrnosťou.
Pacienti s miernou až stredne závažnou renálnou insuficienciou (klírens kreatinínu 45 – 79 ml/min) sa majú vyvarovať súbežného podávania pemetrexedu s NSA (napr. ibuprofén) alebo vyššej dávky kyseliny acetylsalicylovej 2 dni pred, v deň a 2 dni po podaní pemetrexedu (pozri časť 4.4).
Vzhľadom na nedostatok dát ohľadom potenciálnej interakcie s NSA s dlhšími polčasmi, ako sú piroxikam alebo rofekoxib, je potrebné prerušiť ich súbežnépodávanie s pemetrexedom u pacientov s miernou až stredne závažnou renálnou insuficienciou najmenej 5 dní pred, v deň a najmenej 2 dni po podaní pemetrexedu (pozri časť 4.4). Ak je potrebné súbežne podávať NSA, u týchto pacientov je potrebné dôkladne monitorovať toxicitu, najmä myelosupresiu a gastrointestinálnu toxicitu.
Pemetrexed prechádza obmedzeným pečeňovým metabolizmom. Výsledky z in vitro štúdií s ľudskými pečeňovými mikrozómami ukázali, že sa nedá predpokladať, že pemetrexed spôsobuje klinicky významnú inhibíciu metabolického klírensu liekov metabolizovaných CYP3A, CYP2D6, CYP2C9, a CYP1A2.
Interakciebežnéuvšetkýchcytotoxickýchliekov
Vzhľadom na zvýšené riziko trombózy u pacientov s rakovinou je použitie antikoagulačnej liečby časté. Vysoká intraindividuálna variabilita stavu koagulácie počas choroby a možnosť interakcie medzi perorálnymi antikoagulanciami a protinádorovou chemoterapiou vyžaduje zvýšenú frekvenciu monitorovania INR (International Normalised Ratio), pokiaľ sa rozhodneme pacienta liečiť perorálnymi antikoagulanciami.
Kontraindikované súbežné podávanie: Vakcína proti žltej zimnici: riziko fatálnej generalizovanej
postvakcinačnej reakcie (pozri časť 4.3).
Neodporučené súbežné podávanie: Živé oslabené vakcíny (okrem žltej zimnice, v tomto prípade je súbežné podávanie kontraindikované): riziko systémovej reakcie s možným fatálnym koncom. Riziko
je zvýšené u jedincov, ktorí už majú pokles imunity spôsobený základným ochorením. Použite
inaktivovanú vakcínu, pokiaľ je k dispozícii (poliomyelitída) (pozri časť 4.4).
4.6 Fertilita, gravidita a laktácia
Antikoncepciaumužovažien
Ženy v plodnom veku musia v priebehu liečby pemetrexedom používať účinnú antikoncepciu. Pemetrexed môže mať geneticky škodlivý účinok. Pohlavne zrelým mužom sa neodporúča splodiť dieťa počas liečby a do 6 mesiacov od ukončenia liečby. Odporúča sa používanie antikoncepčných metód alebo abstinencia.
Gravidita
Neexistujú údaje o použití pemetrexedu u tehotných žien, avšak je podozrenie, že pemetrexed, tak ako iné antimetabolity, pravdepodobne spôsobuje závažné vrodené chyby, keď je použitý počas gravidity.
Štúdie na zvieratách preukázali reprodukčnú toxicitu (pozri časť 5.3). Pemetrexed sa nemá používať v
gravidite, pokiaľ to nie je jasne nevyhnutné a po starostlivom zvážení potrieb liečby u matky a rizika pre plod (pozri časť 4.4).
Dojčenie
Nie je známe, či sa pemetrexed vylučuje do ľudského materského mlieka a nežiaduce reakcie u
dojčeného dieťaťa sa nedajú vylúčiť. Dojčenie musí byť počas liečby pemetrexedom prerušené (pozri časť 4.3).
Fertilita
Vzhľadom na možnosť ireverzibilnej infertility spôsobenej liečbou pemetrexedom sa mužom odporúča, aby vyhľadali konzultáciu o možnosti trvalého uchovania spermií pred začiatkom liečby.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať stroje
Neuskutočnili sa žiadne štúdie o účinkoch na schopnosť viesť vozidlá a obsluhovať stroje. Bolo však zistené, že pemetrexed môže spôsobovať únavu. Preto majú byť pacienti upozornení, aby neviedli vozidlá a neobsluhovali stroje, ak sa tento prípad u nich vyskytne.
4.8 Nežiaduce účinky
Súhrn bezpečnostnéhoprofilu
Najčastejšie hlásenými nežiaducimi účinkami v súvislosti s pemetrexedom, použitým či už v
monoterapii alebo v kombinácii, boli útlm kostnej drene prejavujúci sa ako anémia, neutropénia, leukopénia, trombocytopénia; a gastrointestinálna toxicita prejavujúca sa ako anorexia, nevoľnosť, vracanie, hnačka, zápcha, faryngitíta, mukozitída a stomatitída. Ďalšie nežiaduce účinky zahŕňajú renálnu toxicitu, zvýšenie koncentrácie aminotransferáz, alopéciu, únavu, dehydratáciu, vyrážku, infekciu/sepsu a neuropatiu. Medzi zriedkavé patria Stevensov-Johnsonov syndróm a toxická epidermálna nekrolýza.
Tabuľkový prehľad nežiaducichreakcií
Tabuľka nižšie uvádza frekvenciu a závažnosť nežiaducich účinkov, ktoré boli zaznamenané u viac
ako 5 % zo 168 pacientov s mezoteliómom randomizovaných na liečbu s cisplatinou a pemetrexedom a zo 163 pacientov s mezoteliómom randomizovaných na liečbu s cisplatinou v monoterapii. V oboch
liečebných ramenách bola pacientom bez predošlej chemoterapie pridaná kyselina listová a vitamín
B12.
Stanovenie frekvencie: veľmi časté (≥1/10), časté (≥1/100 až <1/10), menej časté (≥1/1 000 až
<1/100), zriedkavé (≥1/10 000 až <1/1 000), veľmi zriedkavé (<1/10 000) a neznáme
(frekvencia sa nedá odhadnúť z dostupných údajov).
V rámci jednotlivých skupín frekvencií sú nežiaduce účinky usporiadané v poradí klesajúcej závažnosti.
T
rieda
orgánových
F
r
ekvencia Udalosť* Pemetrexed/cisplatina Cisplatina
(
N=
168) (N=163)
systémov
Všetky stupne tox
ic
ity (%)
Toxi
ci
ta
3. a 4.
stupňa
(
%
)
Všetky stupne toxicity (%)
Toxi
ci
ta
3. a 4.
stupňa
(
%
)
Poruchy krvi a lymfatického systému
Veľmi časté Pokles neutrofilov/ granulocytov Pokles leukocytov Pokles hemoglobínu Pokles trombocytov
56,0 23,2 13,5 3,1
53,0 14,9 16,6 0,6
26,2 4,2 10,4 0,0
23,2 5,4 8,6 0,0
Poruchy metabolizmu a výživy
Časté Dehydratácia 6,5 4,2 0,6 0,6
Poruchy
nervového
Veľmi časté Neuropatia -
senzorická
10,1 0,0 9,8 0,6
systému
Časté Porucha chuti 7,7 0,0*** 6,1 0,0***
Poruchy oka Časté Konjunktivitída 5,4 0,0 0,6 0,0
Poruchy
gastrointestinál-
Veľmi časté Hnačka 16,7 3,6 8,0 0,0
Vracanie 56,5 10,7 49,7 4,3
neho traktu
Stomatitída/ Faryngitída
23,2 3,0 6,1 0,0
Poruchy kože a podkožného tkaniva
Nauzea 82,1 11,9 76,7 5,5
Anorexia 20,2 1,2 14,1 0,6
Zápcha 11,9 0,6 7,4 0,6
Časté Dyspepsia 5,4 0,6 0,6 0,0
Veľmi časté Vyrážka 16,1 0,6 4,9 0,0
Alopécia 11,3 0,0*** 5,5 0,0***
Poruchy obličiek a močových ciest
Veľmi časté Vzostup
kreatinínu
Znížený klírens kreatinínu*
10,7 0,6 9,8 1,2
16,1 0,6 17,8 1,8
Celkové
poruchy
a reakcie v mieste podania
Veľmi časté Únava 47,6 10,1 42,3 9,2
* pozri „National Cancer Institute” CTC verzia 2 pre každý stupeň toxicity s výnimkou termínu „znížený klírens kreatinínu”
**, ktorý je odvodený z termínu „obličkové/urogenitálne iné”.
*** podľa “National Cancer Institute” CTC (v2.0; NCI 1998) porucha chuti a alopécia sa majú hlásiť len ako 1. alebo 2.stupeň.
Pre účely tejto tabuľky bola použitá hraničná hodnota 5 % na zaradenie všetkých udalostí, ktoré mali podľa ohlasovateľa možný vzťah s liečbou pemetrexedom a cisplatinou.
Klinicky relevantné CTC toxicity, zaznamenané u ≥ 1 % a ≤ 5 % pacientov, ktorí boli náhodne vybratí (randomizovaní) na liečbu s cisplatinou a pemetrexedom, sú: renálne zlyhanie, infekcia, pyrexia, febrilná neutropénia, zvýšené AST, ALT a GMT, urtikária a bolesť na hrudi. Klinicky relevantné CTC toxicity, zaznamenané u < 1 % pacientov, ktorí boli randomizovaní na liečbu s cisplatinou a pemetrexedom, sú: arytmia a motorická neuropatia.
Tabuľka dole uvádza frekvenciu a závažnosť nežiaducich účinkov, ktoré boli zaznamenané u > 5 % z
265 pacientov randomizovaných na liečbu pemetrexedom v monoterapii so suplementáciou kyselinou listovou a vitamínom B12 a u 276 pacientov randomizovaných na liečbu docetaxelom v monoterapii. Všetci pacienti mali stanovenú diagnózu lokálne pokročilého alebo metastatického nemalobunkového karcinómu pľúc a predtým boli liečení chemoterapiou.
T
rieda
orgánových
F
r
ekvenci
a
U
dalosť* Pemetrexed
N=
265
Docetaxel
N
=276
systémov
V
šetky
stupne toxicity
(
%
)
T
oxicita
3. a 4.
stupňa
(
%
)
V
šetky
stupne toxicity
(
%
)
T
oxicita
3. a 4.
stupňa
(
%
)
Poruchy krvi a lymfatického systému
Veľmi časté
Pokles neutrofilov/ granulocytov
Pokles leukocytov Pokles
hemoglobínu
10,9 5,3 45,3 40,2
12,1 4,2 34,1 27,2
19,2 4,2 22,1 4,3
Časté Pokles trombocytov
8,3 1,9 1,1 0,4
Poruchy
gastrointestinál-
Veľmi časté
Hnačka 12,8 0,4 24,3 2,5
Vracanie 16,2 1,5 12,0 1,1
neho traktu
Stomatitída/
Faryngitída
14,7 1,1 17,4 1,1
Nauzea 30,9 2,6 16,7 1,8
Anorexia 21,9 1,9 23,9 2,5
Časté Zápcha 5,7 0,0 4,0 0,0
Poruchy pečene a žlčových ciest
Časté Vzostup SGPT (ALT)
Vzostup SGOT
(AST)
7,9 1,9 1,4 0,0
6,8 1,1 0,7 0,0
Poruchy kože a podkožného
Veľmi časté
Vyrážka/ Deskvamácia
14,0 0,0 6,2 0,0
tkaniva
Časté Pruritus 6,8 0,4 1,8 0,0
Alopécia 6,4 0,4** 37,7 2,2**
Celkové
poruchy a
Veľmi časté
Únava 34,0 5,3 35,9 5,4
reakcie v mieste
podania
Časté Horúčka 8,3 0,0 7,6 0,0
* pozri "National Cancer Institute" CTC verzia 2 pre každý stupeň toxicity.
** podľa “National Cancer Institute” CTC (v2.0; NCI 1998) alopécia sa má hlásiť len ako 1. alebo 2.stupeň
Pre účely tejto tabuľky bola použitá hraničná hodnota 5 % na zaradenie všetkých udalostí, ktoré mali podľa ohlasovateľa možný vzťah s liečbou pemetrexedom.
Klinicky relevantné CTC toxicity, zaznamenané u ≥ 1 % a ≤ 5 % pacientov, ktorí boli randomizovaní na liečbu s pemetrexedom, sú: infekcia bez neutropénie, febrilná neutropénia, alergická reakcia/precitlivenosť, zvýšený kreatinín, motorická neuropatia, senzorická neuropatia, erythema multiforme a abdominálna bolesť.
Klinicky relevantné CTC toxicity, zaznamenané u <1 % pacientov, ktorí boli randomizovaní na liečbu pemetrexedom, sú: supraventrikulárne arytmie.
Klinicky relevantné laboratórne toxicity 3. a 4. stupňa boli podobné pri hodnotení integrovaných výsledkov troch štúdií fázy 2 sledujúcich pemetrexed v monoterapii (n = 164) a štúdie fázy 3 s pemetrexedom v monoterapii ( popisovanej vyššie), s výnimkou neutropénie (12,8 % oproti 5,3 %, v takom poradí) a zvýšenia alanín-aminotransferázy (15,2 % oproti 1,9 %, v takom poradí). Tieto'
rozdiely boli pravdepodobne spôsobené rozdielmi v populácii pacientov, pretože štúdie fázy 2 zahŕňali aj pacientov dovtedy neliečených aj ťažko predliečených pacientov s rakovinou prsníka s už
existujúcimi pečeňovými metastázami a/alebo abnormálnymi pečeňovými testami pred liečbou.
Tabuľka nižšie uvádza frekvenciu a závažnosť nežiaducich účinkov, ktoré môžu súvisieť so skúmaným liekom a ktoré boli zaznamenané u > 5 % z 839 pacientov s nemalobunkovým karcinómom pľúc (NSCLC) randomizovaných na liečbu cisplatinou a pemetrexedom a z 830
pacientov s NSCLC randomizovaných na liečbu cisplatinou a gemcitabínom. Všetci pacienti dostávali skúmanú liečbu ako inicálnu liečbu lokálne pokročilého alebo metastatického NSCLC a pacienti v
oboch liečebných skupinách boli plne suplementovaní kyselinou listovou a vitamínom B12.
T
rieda
orgánových
F
r
ekvencia Udalosť** Pemetrexed/cisplatina
(
N = 839)
G
emcitabín/cisplatina
(
N = 830)
systémov
Všetky stupne toxicity (%)
Toxi
ci
ta
3. a 4. stupňa (%)
Všetky stupne toxicity (%)
Toxi
ci
ta
3. a 4. stupňa (%)
Poruchy krvi a
lymfatického systému
Veľmi
časté
Pokles
hemoglobínu Pokles neutrofilov/ Granulocytov
Pokles leukocytov
Pokles trombocytov
33,0* 5,6* 45,7* 9,9*
29,0* 15,1* 38,4* 26,7*
17,8 4,8* 20,6 7,6*
10,1* 4,1* 26,6* 12,7*
Poruchy
nervového
Časté Neuropatia-
zmyslová
8,5* 0,0* 12,4* 0,6*
systému Poruchy gastrointestinál-
neho traktu
Veľmi časté
Porucha chuti 8,1 0,0*** 8,9 0,0*** Nauzea 56,1 7,2* 53,4 3,9* Vracanie 39,7 6,1 35,5 6,1
Anorexia 26,6 2,4* 24,2 0,7*
Zápcha 21,0 0,8 19,5 0,4
Stomatitída/ Faryngitída Hnačka bez kolostómie
Časté Dyspepsia/
Pálenie záhy
13,5 0,8 12,4 0,1
12,4 1,3 12,8 1,6
5,2 0,1 5,9 0,0
Poruchy kože a podkožného
Veľmi časté
Alopécia 11,9* 0*** 21,4* 0,5***
tkaniva
Časté Vyrážka/
Deskvamácia
6,6 0,1 8,0 0,5
Poruchy
obličiek
a močových
ciest
Veľmi časté
Zvýšenie kreatinínu
10,1* 0,8 6,9* 0,5
Celkové poruchy a reakcie v mieste podania
Veľmi časté
Únava 42,7 6,7 44,9 4,9
* P-hodnoty <0,05 v porovnaní pemetrexedu/cisplatiny s gemcitabínom/cisplatinou, použitím Fisher Exact testu
** pozri "National Cancer Institute" CTC (v2.0; NCI 1998) pre každý stupeň toxicity.
*** podľa “National Cancer Institute” CTC (v2.0; NCI 1998) porucha chuti a alopécia sa majú hlásiť len ako 1. alebo 2. stupeň.
Pre účely tejto tabuľky bola použitá hraničná hodnota 5 % na zaradenie všetkých udalostí, ktoré mali podľa ohlasovateľa možný vzťah s liečbou pemetrexedom a cisplatinou.
Klinicky relevantná toxicita zaznamenaná u ≥ 1 % a ≤ 5 % pacientov, ktorí boli randomizovaní na liečbu s cisplatinou a pemetrexedom, zahŕňa: zvýšenie AST, zvýšenie ALT, infekciu, febrilnú neutropéniu, renálne zlyhanie, pyrexiu, dehydratáciu, konjunktivitídu a pokles klírensu kreatinínu. Klinicky relevantná toxicita zaznamenaná u <1 % pacientov, ktorí boli randomizovaní na liečbu cisplatinou a pemetrexedom, zahŕňa: zvýšenie GGT, bolesť na hrudi, arytmiu a motorickú neuropatiu. Klinicky významné prejavy toxicity s ohľadom na pohlavie boli rovnaké ako v celkovej populácii u pacientov užívajúcich pemetrexed s cisplatinou.
Nasledujúca tabuľka uvádza frekvenciu a závažnosť nežiaducich účinkov pravdepodobne súvisiacich so skúmaným liekom, ktoré boli zaznamenané v klinických štúdiách udržiavacej liečby pemetrexedom v monoterapii (Štúdia JMEN: N = 663) a v pokračovacej udržiavacej liečbe
pemetrexedom (PARAMOUNT: N = 539) u viac ako 5 % z 800 pacientov randomizovaných na liečbu samotným pemetrexedom a 402 pacientov randomizovaných na liečbu placebom. Všetkým pacientom
pred podaním chemoterapie na báze platiny diagnostikovali štádium IIIB alebo IV NSCLC. Pacienti v obidvoch študijných ramenách dostávali plnú náhradu kyseliny listovej a vitamínu B12.
T
rieda
orgánových
F
r
ekvencia
*
U
dalosť
** Pemetrexed***
(
N=
800)
Placebo***
(
N=
402)
systémov
Všetky stupne toxicity (%)
Toxicita 3. a 4. stupňa (%)
Všetky stupne toxicity (%)
Toxi
ci
ta
3. a 4. stupňa (%)
Poruchy krvi a
lymfatického systému
Poruchy
Veľmi časté Pokles
hemoglobínu
Časté Pokles leukocytov Pokles neutrofilov Neuropatia –
18,0 4,5 5,2 0,5
5,8 1,9 0,7 0,2
8,4 4,4 0,2 0,0
nervového
systému
Časté
zmyslová 7,4 0,6 5,0 0,2
Poruchy gastrointestinál- neho traktu
Veľmi časté Nauzea 17,3 0,8 4,0 0,2
Anorexia 12,8 1,1 3,2 0,0
Časté Vracanie 8,4 0,3 1,5 0,0
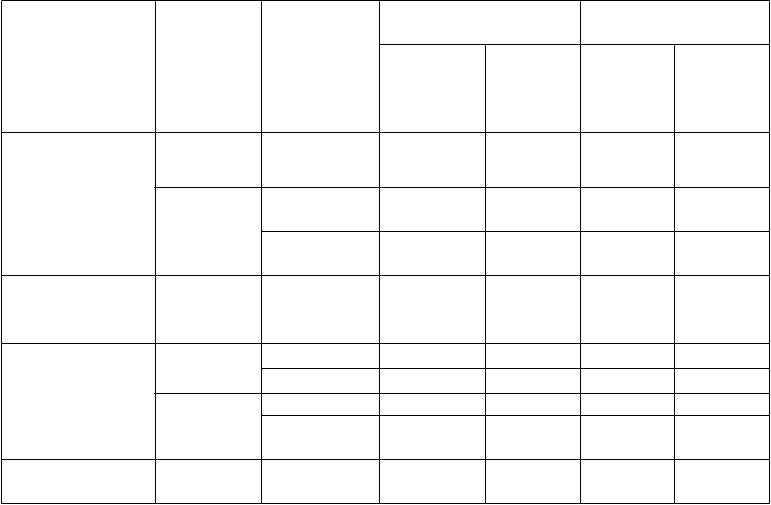
Mukozitída /
stomatitída
Poruchy pečene a Časté ALT (SGPT)
zvýšenie
6,8 0,8 1,7 0,0
6,5 0,1 2,2 0,0
žlčových ciest AST (SGOT)
zvýšenie
5,9 0,0 1,7 0,0
Poruchy kože a podkožného
tkaniva Časté
Vyrážka/
Deskvamácia 8,1 0,1 3,7 0,0
Celkové poruchy
a reakcie v mieste podania
Veľmi časté Únava 24,1 5,3 10,9 0,7
Časté Bolesť 7,6 0,9 4,5 0,0
Edém 5,6 0,0 1,5 0,0
Poruchy obličiek Časté Poruchy
obličiek****
7,6 0,9 1,7 0,0
Skratky: ALT = alanín aminotransferáza, AST = aspartát aminotransferázáza; CTCAE = Comon Terminology Criteria for Adverse Event (Všeobecná terminológia nežiaducich reakcií); NCI = National Cancer Institute; SGOT = sérová glutámovooxalooctová aminotransferáza; SGPT = sérová glutámovopyrohroznová aminotransferáza
* Definícia frekvencií: Veľmi časté - ≥ 10%; Časté - > 5% a < 10%. Pre účely tejto tabuľky bola použitá 5%
hranica pre zaradenie všetkých účinkov, ktoré zaznamenávajúci považoval za súvisiace s pemetrexedom.
** Pre každý stupeň toxicity pozri NCI CTCAE Criteria (verzia 3.0; NCI 2003). Uvedené hlásené výskyty sú v súlade s CTCAE, verzia 3,0.
*** v integrovanej tabuľke nežiaducich reakcií sú spojené výsledky klinických skúšaní udržiavacej liečby
pemetrexedom JMEN (N = 663) a pokračovania udržiavacej liečby pemetrexedom PARAMOUNT (N = 539).
**** Slovné spojenie zahŕňa zvýšenú hladinu kreatinínu v sére/krvi, zníženie rýchlosti glomerulárnej filtrácie, zlyhanie obličiek a renálne/ urogenitálne - ostatné
Klinicky relevantná toxicita (podľa CTC) akéhokoľvek stupňa hlásená u ≥ 1 % a ≤ 5 % pacientov randomizovaných na pemetrexed zahŕňa: febrilnú neutropéniu, infekciu, pokles krvných doštičiek, hnačku, zápchu, alopéciu, pruritus/svrbenie, horúčky (bez neutropénie), očné opuchy (vrátane konjunktivitídy), zvýšené slzenie, závrat a motorickú neuropatiu.
Klinicky relevantná toxicita (podľa CTC) hlásená u < 1 % pacientov randomizovaných na pemetrexed zahŕňa: alergické reakcie/ hypersenzitivitu, multiformný erytém, supraventikulárnu arytmiu a pľúcnu embóliu.
Bezpečnosť sa hodnotila u pacientov, ktorí boli randomizovaní na liečbu pemetrexedom (N = 800). Výskyt nežiaducich reakcií bol vyhodnotený u pacientov, ktorí dostali udržiavaciu liečbu pemetrexedom ≤ 6 cyklov (N = 519) v porovnaní s výskytom u pacientov, ktorí dostali liečbu pemetrexedom > 6 cyklov (N = 281). Nárast nežiaducich reakcií (všetkých stupňov) sa pozoroval pri dlhodobejšej expozícii. Signifikantný nárast incidencie neutropénie stupňa 3/4, s možnou súvislosťou s liečbou podávanou v štúdii, sa pozoroval pri dlhšej expozícii pemetrexedu (≤ 6 cyklov: 3,3 %, > 6 cyklov: 6,4 %: p = 0,046). Neboli zaznamenané žiadne ďalšie štatisticky významné rozdiely medzi akýmikoľvek ďalšími individuálnymi nežiaducimi reakciami stupňa 3/4/5 pri dlhšej expozícii.
Menej často boli v priebehu klinických štúdií s pemetrexedom hlásené závažné kardiovaskulárne a cerebrovaskulárne príhody, vrátane infarktu myokardu, angíny pectoris, mozgovej príhody a prechodného ischemického ataku, obyčajne pri podaní v kombinácii s iným cytostatikom. Väčšina pacientov, u ktorých sa pozorovali tieto príhody, mala preexistujúce kardiovaskulárne rizikové faktory.
V priebehu klinických štúdií s pemetrexedom boli hlásené potenciálne závažné, zriedkavé prípady hepatitídy.
V priebehu klinických štúdií s pemetrexedom bola menej často hlásená pancytopénia.
V klinických štúdiách u pacientov liečených pemetrexedom boli menej často hlásené prípady kolitídy (vrátane intestinálneho a rektálneho krvácania, intestinálnej perforácie, niekedy fatálnej, , intestinálnej nekrózy a zápalu slepého čreva).
V klinických štúdiách u pacientov liečených pemetrexedom boli menej často hlásené prípady intersticiálnej pneumonitídy s respiračnou insuficienciou, niekedy fatálne.
U pacientov liečených pemetrexedom boli menej často hlásené prípady edému.
Počas klinických štúdií s pemetrexedom bola menej často hlásená ezofagitída/radiačná ezofagitída. Počas klinického skúšania s pemetrexedom bola často hlásená sepsa, niekedy so smrteľnými
následkami.
V priebehu postmarketingového pozorovania boli u pacientov liečených pemetrexedom hlásené nasledujúce nežiaduce reakcie:
V súvislosti s pemetrexedom samotným alebo v kombinácii s inými chemoterapeutikami boli hlásené menej časté prípady akútneho renálneho zlyhania (pozri časť 4.4).
U pacientov liečených ožarovaním buď pred, počas alebo po ich liečbe pemetrexedom boli hlásené menej časté prípady radiačnej pneumonitídy (pozri časť 4.4).
U pacientov, ktorí podstúpili rádioterapiu v minulosti, boli zaznamenané zriedkavé prípady radiačného poškodenia typu „recall fenomén“ (pozri časť 4.4).
Menej často boli hlásené prípady periférnej ischémie vedúce niekedy až k nekrózam končatín. Zaznamenané boli aj zriedkavé prípady tvorby pľuzgierov vrátane Stevensovho-Johnsonovho
syndrómu a toxickej epidermálnej nekrolýzy, v niektorých prípadoch aj smrteľné.
Zriedkavo bola u pacientov liečených pemetrexedom hlásená imunitne podmienená hemolytická anémia.
Boli hlásené zriedkavé prípady anafylaktického šoku.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité.Umožňuje priebežné
monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie prostredníctvom národného systému hlásenia uvedeného
v
Prílohe V*.
4.9 PredávkovanieK popísaným symptómom z predávkovania patrí neutropénia, anémia, trombocytopénia, mukozitída, senzorická polyneuropatia a vyrážka. K predpokladaným komplikáciám z predávkovania patrí útlm kostnej drene manifestujúci sa neutropéniou, trombocytopéniou a anémiou. Taktiež sa môže vyskytnúť infekcia s horúčkou alebo bez nej, hnačka, a/alebo mukozitída. V prípade podozrenia na
predávkovanie, musia mať pacienti sledovaný krvný obraz a musia dostávať podpornú liečbu podľa potreby. V liečbe predávkovania pemetrexedom sa musí vziať do úvahy podávanie kalciumfolinátu /
kyseliny folinovej.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: antineoplastiká, analógy kyseliny listovej, ATC kód: L01BA04
CIAMBRA (pemetrexed) je antifolátové cytostatikum, cielené na viaceré enzymatické systémy. Pôsobí narušením rozhodujúcich metabolických procesov závislých na folátoch, ktoré sú nevyhnutné pre replikáciu buniek.
Štúdie in vitro ukázali, že pemetrexed sa správa ako antifolát pôsobiaci na viaceré enzymatické systémy tým, že inhibuje tymidylát syntetázu (TS), dihydrofolát reduktázu (DHFR) a glycínamid ribonukleotid formyltransferázu (GARFT), ktoré sú kľúčovými enzýmami závislými na foláte pre de novo biosyntézu tymidínových a purínových nukletidov. Pemetrexed je transportovaný do buniek redukovaným folátovým nosičom aj membránovým folátovým väzbovým proteínovým transportným systémom .V bunke je pemetrexed rýchlo a efektívne zmenený na polyglutamátové formy enzýmom folylpolyglutamát syntetázou. Polyglutamátové formy sa zdržujú v bunkách a sú ešte účinnejšie inhibítory TS a GARFT. Polyglutamácia je proces závislý na čase a koncentrácii, ku ktorému dochádza v nádorových bunkách a v menšej miere v normálnych tkanivách. Polyglutamátové metabolity majú zvýšený intracelulárny polčas, čoho výsledkom je prolongovaný účinok lieku v malígnych bunkách.
Klinickáúčinnosť
M ez ot el i óm
EMPHACIS, multicentrická, randomizovaná, jednoducho zaslepená štúdia fázy 3 s pemetrexedom
plus cisplatina verzus cisplatina u pacientov dovtedy neliečených chemoterapiou s malígnym mezoteliómom pleury ukázala, že pacienti liečenípemetrexedom a cisplatinou mali klinické 2,8 mesačné zlepšenie mediánu prežívania v porovnaní s pacientmi liečenými iba cisplatinou.
Počas štúdie bola pridaná suplementácia nízkymi dávkami kyseliny listovej a vitamínu B12 za účelom zníženia toxicity. Primárna analýza štúdie bola vykonaná na populácii všetkých pacientov randomizovaných do liečebnej skupiny, ktorá bola liečená hodnoteným liekom (randomizovaní a liečení). Bola vykonaná analýza podskupín pacientov, ktorí dostávali suplementáciu kyselinou
listovou a vitamínom B12 počas celého priebehu liečby počas štúdie (úplne suplementovaní). Výsledky týchto analýz účinnosti sú uvedené v tabuľke:
Účinnosť pemetrexedu v kombinácii s cisplatinou oproti cisplatine
u malígneho mezoteliómu pleury
R
andomizovaní a liečení
pacienti
Plne suplementovaní pacienti
P
arameter účinnosti pemetrexed/ cisplatina (N = 226)
cisplatina
(
N=
222)
pemetrexed/ cisplatina (N=168)
cisplatina
(
N=
163)
Medián celkového prežívania(mesiace) (95%CI)
12,1 (10,0-14,4)
9,3 (7,8- 10,7)
13,3 (11,4-14,9)
10,0 (8,4- 11,9)
Log Rank hodnota p* 0,020 0,051
Medián času do progresie tumoru
(mesiace) (95%CI)
5,7
(4,9-6,5)
3,9
(2,8-4,4)
6,1
(5,3-7,0)
3,9
(2,8-4,5)
Log Rank hodnota p* 0,001 0,008
Čas do zlyhania liečby (mesiace)
(95%CI)
4,5 (3,9-4,9)
2,7 (2,1-2,9)
4,7 (4,3-5,6)
2,7 (2,2-3,1)
Log Rank hodnota p* 0,001 0,001
Pomer celkovej odpovede** (95%CI)
41,3% (34,8-48,1)
16,7% (12,0-22,2)
45,5% (37,8-53,4)
19,6% (13,8-26,6)
Fisherova presná hodnota p* <0,001 <0,001
Skratky: CI = interval spoľahlivosti
* hodnota p odkazuje na porovnanie medzi liečebnými ramenami.
**Rameno pemetrexed/cisplatina, randomizovaní a liečení (N = 225) a plne suplementovaní (N = 167)
Štatisticky signifikantné zlepšenie klinicky závažných symptómov (bolesť a dušnosť) spojených s malígnym mezoteliómom pleury v ramene pemetrexed/cisplatina (212 pacientov) oproti ramenu scisplatinou (218 pacientov) bolo preukázané použitím škály symptómov karcinómu pľúc (Lung Cancer Symptom Scale). Taktiež boli pozorované štatisticky významné rozdiely v pľúcnych funkčných testoch. Rozdiel medzi liečebnými ramenami bol dosiahnutý zlepšením pľúcnej funkcie v ramene pemetrexed/cisplatina a zhoršením pľúcnej funkcie v čase v kontrolnom ramene.
Existujú obmedzené údaje u pacientov s malígnym mezoteliómom pleury liečených pemetrexedom v monoterapii.
Pemetrexed v dávke 500 mg/m2 bol študovaný ako liek v monoterapii u 64 chemoterapiou neliečených pacientov s malígnym mezoteliómom pleury. Celková odpoveď na liečbu bola 14,1%.
NSCLC, l i ečba v druhej l í nii :
V multicentrickej, randomizovanej, otvorenej štúdii fázy 3 s pemetrexedom a docetaxelom u pacientov
s lokálne pokročilým a metastatickým NSCLC po primárnej chemoterapii bol preukázaný medián prežívania 8,3 mesiacov u pacientov liečených pemetrexedom (ITT - populácia so zámerom byť
liečená n = 283) a 7,9 mesiacov u pacientov liečených docetaxelom (ITT - populácia so zámerom byť
liečená n = 288). Predchádzajúca chemoterapia nezahŕňala pemetrexed. Analýza vplyvu histológie NSCLC na liečebný efekt z hľadiska celkového prežitia vyšla v prospech pemetrexedu oproti docetaxelu vo všetkých okrem prevažne skvamóznych histológií (n = 399, 9,3 verzus 8,0 mesiacov, dosiahnuté HR = 0,78; 95% CI = 0,61-1,00, p = 0,047) a v prospech docetaxelu pre skvamóznu bunkovú histológiu karcinómu (n = 172, 6,2 verzus 7,4 mesiacov, dosiahnuté HR = 1,56; 95% CI =
1,08-2,26, p = 0,018). V rámci histologických podskupín sa nepozorovali žiadne klinicky významné rozdiely týkajúce sa bezpečnostného profilu pemetrexedu.
Obmedzené klinické údaje zo samostatnej, randomizovanej, kontrolovanej štúdie fázy 3 predpokladajú, že údaje o účinnosti (celkové prežitie, prežívanie bez progresie) pre pemetrexed sú rovnaké medzi pacientmi predtým liečenými docetaxelom (n = 41) a pacientmi, ktorí predtým nedostávali liečbu docetaxelom (n = 540).
Účinnosť pemetrexedu a docetaxelu u pacientov
s nemalobunkovým karcinómom pľúc – ITT populácia
Pemetrexed Docetaxel
Č
as prežívania (mesiace)
§ Medián (m)
§ 95 % CI pre medián
§ HR
§ 95%CIpreHR
§ hodnota p pre neinferioritu (HR)
Čas prežívania bez progresie (mesiace)
§ Medián
§ HR (95 % CI)
Čas do zlyhania liečby (TTTF – mesiace)
§ Medián
§ HR (95 % CI)
(n=283) (n= 288)
8,3 7,9
(7,0-9,4) (6,3-9,2)
0,99 (0,82-1,20)
0,226
(n=283) (n=288)
2,9 2,9
0,97 (0,82– 1,16)
(n=283) (n=288)
2,3 2,1
0,84 (0,71– 0,997)
O
dpoveď (n: kvalifikovaný pre odpoveď)
§ Odpoveď na liečbu (%) (95 % CI)
§ Stabilizácia ochorenia (%)
(n=264)

9,1 (5,9-13,2)
45,8
(n=274)
8,8 (5,7-12,8)
46,4
Skratky: CI = interval spoľahlivosti; HR = pomer rizika; ITT = so zámerom liečiť; n = veľkosť celej populácie.
NSCLC, l i ečba v prv ej l í ni i:
Multicentrická, randomizovaná, otvorená štúdia fázy 3 s pemetrexedom a cisplatinou verzus gemcitabínom a cisplatinou u pacientov bez predchádzajúcej liečby chemoterapiou s lokálne pokročilým alebo metastatickým (stupeň IIIb alebo IV) nemalobunkovým karcinómom pľúc (NSCLC) ukázala, že pemetrexed spolu s cisplatinou (ITT [Intent-To-Treat – so zámerom liečiť] populácia n=862) splnila primárny cieľ a preukázala rovnakú klinickú účinnosť ako gemcitabín s cisplatinou
(ITT n=863) v celkovom prežívaní (adjustovaný pomer rizík 0,94; 95% CI = 0,84-1,05). Všetci pacienti zahrnutí do štúdie mali výkonnostný stav podľa ECOG 0 alebo 1.
Analýza primárnej účinnosti bola založená na ITT populácii. Analýzy citlivosti hlavných cieľových
parametrov účinnosti boli hodnotené na populácii kvalifikovanej protokolom (PQ). Analýzy účinnosti pre PQ populáciu boli zhodné s analýzami pre ITT populáciu a podporujú noninferioritu AC verzus GC.
Prežívanie bez progresie (PFS) a celková odpoveď na liečbu boli podobné medzi liečebnými ramenami: medián PFS bol 4,8 mesiacov pre pemetrexed s cisplatinou verzus 5,1 mesiacov pre
gemcitabín s cisplatinou (adjustovaný pomer rizík 1,04; 95% CI = 0,94-1,15) a celková odpoveď na liečbu bola 30,6% (95% CI = 27,3- 33,9) pre pemetrexed s cisplatinou verzus 28,2% (95% CI = 25,0-
31,4) pre gemcitabín s cisplatinou. PFS údaje sa čiastočne potvrdili nezávislým preskúmaním (na preskúmanie bolo náhodne vybraných 400/1725 pacientov).
Analýza vplyvu histológie NSCLC na celkové prežitie ukázala klinicky významné rozdiely v
prežívaní podľa histológie, pozri tabuľku nižšie.
Účinnosť pemetrexedu+cisplatina vs. gemcitabín+cisplatina v prvej línii nemalobunkového karcinómu pľúc – ITT populácia a histologické podskupiny.
ITT populácia a histologické podskupiny
Medián celkového prežitia v mesiacoch
(
95% CI)
P
e
m
e
t
rexed + cisplatina
G
emcitabín+
ci
sp
l
at
i
n
a
Adjustovaný
pomer rizík
(
HR)
(95% CI)
p-hodnota superiority
ITT populácia
10,3
N=862 10,3
N=863
a
0,94
0,259
(N=1725)
Adenokarcinóm (N=847) Veľkobunkový (N=153)
Iné
(N=252)
Zo skvamóznych
buniek (N=473)
(9,8–11,2)
12,6 (10,7– 13,6)
10,4 (8,6–14,1)
8,6 (6,8–10,2)
9,4 (8,4–10,2)
(9,6–10,9)
N=436 10,9 (10,2– 11,9)
N=76 6,7 (5,5–9,0)
N=106 9,2 (8,1–10,6)
N=244 10,8 (9,5–12,1)
(0,84– 1,05) N=411 0,84
(0,71–0,99)
N=77 0,67 (0,48–0,96)
N=146 1,08 (0,81–1,45)
N=229 1,23 (1,00–1,51)
0,033
0,027
0,586
0,050
Skratky: CI = interval spoľahlivosti; ITT = so zámerom liečiť; n = veľkosť celej populácie. a Štatisticky signifikantná pre noninferioritu, s celkovým intervalom spoľahlivosti pre HR výrazne pod 1,17645 hranicou noninferiority (p<0,001).
Kaplanove Meierovej krivky celkového prežitia podľa histológie
|
ty i l i
b a b o
r
P l a v
i
v r
u
S
|
|

1.0
0.9
0.8
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0.0
Adenokarcinóm

AC GC
1.0
0.9
0.8

0.7
y t i l i
b a b o
r
P l a v
i
v r
u
S
|
|

0.6

0.5

0.4


0.3





0.2
0.1


0.0
Veľkobunkový karcinóm
AC GC



0 6 12 18 24 30
0 6 12 18 24 30
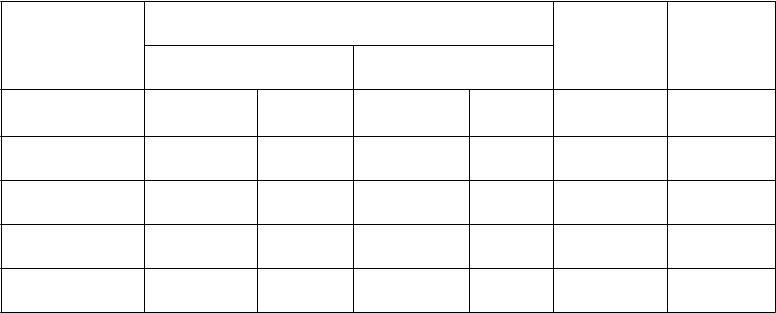

Čas prežitia (mesiace) Čas prežitia (mesiace)
Nepozorovali sa žiadne klinicky významné rozdiely týkajúce sa bezpečnostného profilu pemetrexedu
s cisplatinou v rámci histologických podskupín.
Pacienti liečení pemetrexedom a cisplatinou potrebovali menej transfúzií (16,4% verzus 28,9%, p<0,001), transfúzií červených krviniek (16,1% verzus 27,3%, p<0,001) a transfúzií krvných doštičiek (1,8% versus 4,5%, p=0,002). Pacienti potrebovali tiež podávanie nižších dávok erytropoetínu/darbopoetínu (10,4% versus 18,1%, p<0,001), G-CSF/GM-CSF (3,1% versus 6,1%, p=0,004) a liekov s obsahom železa (4,3% versus 7,0%, p=0,021).
NSCLC, udrž iavaci a l ieč ba:
JMEN
Multicentrická randomizovaná dvojitozaslepená placebom kontrolovaná štúdia fázy 3 (JMEN)
porovnávala účinnosť a bezpečnosť udržiavacej liečby pemetrexedom spolu s najlepšou možnou podpornou liečbou (BSC) (n = 441) a podávaním placeba spolu s BSC (n = 222) u pacientov s lokálne
pokročilým (štádium IIIB) alebo metastázujúcim (štádium IV) nemalobunkovým karcinómom pľúc
(NSCLC), u ktorých nedošlo ku progresii po 4 cykloch terapie prvej línie dvojkombináciou obsahujúcou cisplatinu alebo karboplatinu v kombinácii s gemcitabínom, paklitaxelom alebo docetaxelom. Kombinovaná liečba obsahujúca v prvej línii dvojkombináciu s pemetrexedom nebola zahrnutá. Všetci pacienti, ktorí sa zúčastnili tejto štúdie mali ECOG výkonnostný stav 0 alebo 1. Udržiavacia liečba sa pacientom podávala do progresie choroby. Účinnosť a bezpečnosť sa merali od začiatku randomizácie po dokončení (indukčnej) terapie prvej línie. Stredná hodnota počtu cyklov podaných pacientom bola 5 cyklov udržiavacej liečby pemetrexedom a 3,5 cyklu podávania placeba. Celkovo 213 pacientov (48,3 %) dokončilo ≥ 6 cyklov a 103 pacientov (23,4 %) dokončilo ≥ 10 cyklov liečby pemetrexedom.
Štúdia dosiahla svoj primárny cieľ a preukázala štatisticky významné zlepšenie PFS v skupine s pemetrexedom oproti skupine s placebom (n = 581, nezávisle hodnotená populácia, medián 4,0 mesiacov a 2,0 mesiacov, danom poradí) (pomer rizík = 0,60, 95 % CI = 0,49-0,73, p < 0,00001). Nezávislé hodnotenie pacientských skenov potvrdilo závery hodnotenia PFS zo strany skúšajúcich. Stredná hodnota celkovej doby prežitia (OS) pre celú populáciu (n = 663) bola v skupine s pemetrexedom 13,4 mesiacov a v skupine s placebom 10,6 mesiacov, pomer rizík = 0,79 (95 %, CI =
0,65 - 0,95, p = 0,01192).
V súhlase s inými štúdiami s pemetrexedom sa v štúdii JMEN pozoroval rozdiel účinnosti s ohľadom na histológiu NSCLC. U pacientov s NSCLC iného histologického typu ako prevažne skvamózneho
(n = 430, nezávisle hodnotená populácia) bola stredná hodnota celkovej doby prežívania bez progresie
(PFS) pri pemetrexede 4,4 mesiace a v skupine s placebom 1,8 mesiaca, pomer rizík = 0,47 (95% CI =
0,37-0,60, p = 0,00001. Stredná hodnota celkovej doby prežitia (OS) u pacientov s NSCLC iného histologického typu ako prevažne skvamózneho (n = 481) bola v skupine s pemetrexedom 15,5 mesiacov a v skupine s placebom 10,3 mesiacov (pomer rizík = 0,70 (95% CI 0,56-0,88, p = 0,002). Stredná hodnota (OS) vrátane indukčnej fázy bola u pacientov s NSCLC iného histologického typu ako prevažne skvamózneho v skupine s pemetrexedom 18,6 mesiacov a skupine s placebom 13,6 mesiacov pomer rizík = 0,71 (95% CI = 0,56 - 0,88; p = 0,002).
U pacientov s karcinómom skvamózneho histologického typu nenaznačujú výsledky PFS ani OS
výhodu liečby pemetrexedom oproti placebu.
Medzi histologickými podskupinami sa v bezpečnostnom profile pemetrexedu nepozorovali žiadne klinicky signifikantné rozdiely.
JMEN: Kaplanova Meierova krivka doby prežívania bez progresie (PFS) a celkovej doby prežitia u pacientov s NSCLC iného histologického typu ako prevažne skvamózneho užívajúcich pemetrexed alebo placebo:

Doba prežívania bez progresie Celková doba prežitia
PFS doba (mesiace)
Čas prežitia (mesiace)

 PARAMOUNT
PARAMOUNT
Mutlicentrická randomizovaná dvojito zaslepená, placebom kontrolovaná štúdia fázy 3 (PARAMOUNT) porovnávala účinnosť a bezpečnosť pokračovacej udržiavacej liečby pemetrexedom s BSC (n = 359) oproti liečbe placebom s BSC (n = 180) u pacientov s lokálne pokročilým (v štádiu IIIB) alebo metastatickým (v štádiu IV) NSCLC iného histologického typu, ako prevažne zo skvamóznych buniek, u ktorých nedošlo k progresii ochorenia po 4 cykloch prvej línie liečby dvojkombináciou pemetrexedu s cisplatinou. Z celkového počtu 939 pacientov liečených
pemetrexedom v kombinácii s cisplatinou, bolo 539 pacientov randomizovaných na udržiavaciu liečbu pemetrexedom alebo placebom. Z randomizovaných pacientov odpovedalo na liečbu 44,9 %
úplne/čiastočne a u 51,9 % došlo ku stabilizácii ochorenia po liečbe dvojkombináciou pemetrexedu s
cisplatinou. Pacienti, ktorí boli randomizovaní na udržiavaciu liečbu, museli mať výkonnostný stav ECOG 0 alebo 1. Medián doby trvania od začiatku liečby pemetrexedom spolu s cisplatinou do začiatku udržiavacej liečby bol 2,96 mesiacov rovnako v skupine s pemetrexedom aj v skupine s placebom. Randomizovaní pacienti dostávali udržiavaciu liečbu kým trvala progresia ochorenia. Účinnosť a bezpečnosť sa merali od randomizácie po ukončenie prvej línie (indukčnej) liečby. Stredné hodnoty počtu podaných cyklov boli 4 cykly udržiavacej liečby pemetrexedom a 4 cykly placeba. Celkovo ukončilo ≥6 cyklov udržiavacej liečby pemetrexedom 169 pacientov (47,1 %), čo predstavovalo minimálne 10 úplných cyklov s pemetrexedom.
Štúdia dosiahla svoj primárny cieľ a preukázala štatisticky významné zlepšenie PFS v skupine s
pemetrexedom oproti skupine s placebom (n = 472, nezávisle hodnotená populácia, medián
3,9 mesiacov a 2,6 mesiaca, v danom poradí) (pomer rizík = 0,64, 95 % CI = 0,51-0,81, p < 0,0002).
Nezávislé hodnotenie pacientskych skenov potvrdilo závery hodnotenia PFS skúšajúcimi.
U randomizovaných pacientov, podľa meraní od začiatku indukčnej liečby prvej línie pemetrexedom s cisplatinou, bol podľa hodnotení skúšajúcich medián PFS 6,9 mesiaca v skupine s pemetrexedom
a 5,6 mesiaca v skupine s placebom (pomer rizík = 0,59 95 % CI = 0,47-0,74).
Liečba pemetrexedom, následne po indukčnej liečbe s pemetrexedom a cisplatinou (4 cykly), bola štatisticky lepšia než liečba placebom pre OS (medián 13,9 mesiacov oproti 11,0 mesiacom, pomer rizík = 0,78; 95 % CI = 0,64 – 0,96; p = 0,0195). V čase tejto konečnej analýzy prežitia bolo nažive alebo sa stratilo z pozorovania 28,7 % pacientov v ramene s pemetrexedom oproti 21,7 % v ramene s placebom. Relatívna liečebná efektivita pemetrexedu bola vnútorne konzistentná medzi podskupinami (vrátane štádia ochorenia, odpovede na indukčnú liečbu, ECOG PS, fajčiarskeho stavu, pohlavia , histológie a veku) a podobná k tej, ktorá bola pozorovaná v neupravených analýzach OS a PFS. 1- ročné a 2-ročné prežívanie u pacientov užívajúcich pemetrexed bolo 58 % a 32 % v danom poradí oproti 45 % a 21 % u pacientov s placebom. Medián OS od začiatku prvolíniovej indukčnej liečby s pemetrexedom a cisplatinou bol 16,9 mesiacov u pacientov v ramene s pemetrexedom oproti 14,0 mesiacov v ramene s placebom (pomer rizík = 0,78; 95 % CI = 0,64 – 0,96). Percento pacientov, ktorí po ukončení štúdie pokračovali v liečbe bolo 64,3 % pre pemetrexed a 71,7 % pre placebo.
P
ARA
M
O
UNT
: Kaplanova Meierova krivka doby prežívania bez progresie (PFS) a celkového prežívania (Overall Survival) OS u pacientov s NSCLC iného histologického typu ako prevažne skvamóznych buniek, pokračujúcich v udržiavacej liečbe pemetrexedom versus placebom (merané od randomizácie).
Prežívanie bez progresie Celkové prežívanie
PFS doba (mesiace)
OS doba (mesiace)

Bezpečnostné profily udržiavacej liečby pemetrexedom z dvoch klinických štúdií JMEN a
PARAMOUNT boli podobné.
Európska lieková agentúra udelila výnimku z povinnosti predložiť výsledky štúdií pre pemetrexed s ohľadom na všetky vekové podskupiny detí a dospievajúcich vo všetkých schválených indikáciách (pozri časť 4.2).
5.2 Farmakokinetické vlastnostiFarmakokinetické vlastnosti pemetrexedu po podaní lieku v monoterapii boli hodnotené u 426 pacientov s rozličnými malígnymi solídnymi tumormi v dávkach od 0,2 do 838 mg/m2 podaných v infúzii počas 10 minút. Distribučný objem pemetrexedu v ustálenom stave je 9 l/m2. Štúdie
in vitro ukazujú, že približne 81 % pemetrexedu sa viaže na plazmatické proteíny. Táto väzba nebola výrazne ovplyvnená rôznymi stupňami renálneho poškodenia. Pemetrexed sa podrobuje v obmedzenej miere pečeňovému metabolizmu. Pemetrexed je primárne eliminovaný močom, pričom 70 % až 90 % dávky sa vylúči močom v nezmenenej forme v priebehu prvých 24 hodín od podania. Štúdie
in vitro naznačujú, že pemetrexed sa aktívne vylučuje pomocou OAT3 (organického aniónového transportéra
3). Celkový systémový klírens pemetrexedu je 91,8 ml/min a eliminačný polčas plazmy je 3,5 hodín, u pacientov s normálnou obličkovou funkciou (klírens kreatinínu 90 ml/min). Variabilita v klírense medzi pacientmi je mierna, a to 19,3 %. Celková systémová expozícia pemetrexedu (AUC) a maximálna plazmatická koncentrácia sa proporcionálne zvyšujú s dávkou. Farmakokinetika pemetrexedu je rovnaká aj po viacerých liečebných cykloch.
Farmakokinetické vlastnosti pemetrexedu nie sú ovplyvnené súčasným podávaním cisplatiny. Suplementácia perorálnou kyselinou listovou a intramuskulárnym vitamínom B12 neovplyvňujú farmakokinetiku pemetrexedu.
5.3 Predklinické údaje o bezpečnostiPodanie pemetrexedu gravidným myšiam viedlo k zníženiu životaschopnosti plodu, zníženiu hmotnosti plodu, nekompletnej osifikácii niektorých kostných štruktúr, k rázštepu podnebia.
Podanie pemetrexedu samcom myší viedlo k reprodukčnej toxicite charakterizovanej redukciou výskytu fertility a testikulárnou atrofiou. V 9-mesačnej štúdii s použitím intravenóznej bolusovej injekcie vykonanej na bígloch bol pozorovaný testikulárny nález (degenerácia/nekróza semenotvorného epitelu). To naznačuje, že pemetrexed môže poškodiť mužskú fertilitu. Ženská fertilita nebola skúmaná.
Pemetrexed nebol mutagénny v in vitro chromozomálnom aberačnom teste u ovariálnych buniek čínskych škrečkov, ani v Amesovom teste. V mikronukleárnom teste in vivo u myší bolo zistené, že pemetrexed je klastogénny.
Štúdie hodnotiace karcinogénny potenciál pemetrexedu neboli vykonané.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Manitol (E 421)
Kyselina chlorovodíková (na úpravu pH)
Hydroxid sodný (na úpravu pH)
6.2 Inkompatibility
Pemetrexed je fyzikálne inkompatibilný s rozpúšťadlami obsahujúcimi vápnik, vrátane laktátového Ringerovho roztoku a Ringerovho roztoku. Tento liek sa nesmie miešať s inými liekmi okrem tých, ktoré sú uvedené v časti 6.6.
6.3 Čas použiteľnosti
Neotvorená injekčná liekovka
2 roky
Rekonštituovanéainfúzneroztoky
Chemická a fyzikálna stabilita infúzneho roztoku pemetrexedu bola preukázaná počas 24 hodín pri
2°C až 8°C alebo 15°C-25°C. Rekonštituovaný roztok sa musí použiť ihneď na prípravu infúzneho
roztoku. Z mikrobiologického hľadiska sa infúzny roztok musí použiť ihneď. Ak sa nepoužije ihneď, za čas uchovávania a podmienky pred použitím je zodpovedný užívateľ, liek sa v tomto prípade nemá uchovávať dlhšie ako 24 hodín pri teplote od 2°C do 8°C alebo 15-25°C.
6.4 Špeciálne upozornenia na uchovávanie
Tento liek nevyžaduje žiadne špeciálne podmienky na uchovávanie. Podmienky na uchovávanie po rekonštitúcii/riedení lieku, pozri časť 6.3.
6.5 Druh obalu a obsah balenia
Sklenená injekčná liekovka (typ I) s gumenou chlórobutylovou zátkou a hliníkovým uzáverom
s výklopným krytom. Liekovka je pokrytá priľnavým plastovým krytom. Každá 50 ml injekčná
liekovka obsahuje 500 mg pemetrexedu (ako hemipentahydrát disodnej soli pemetrexedu).
Balenie: 1 injekčná liekovka
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
1. Použite aseptickú techniku počas rekonštitúcie a pri následnom riedení pemetrexedu na podanie intravenóznej infúzie.
2. Vypočítajte dávku a počet potrebných injekčných liekoviek CIAMBRA. Každá injekčná liekovka obsahuje väčšie množstvo pemetrexedu na uľahčenie prenosu označenej dávky.
3. Rekonštituujte 100 mg injekčnú liekovku pridaním 4,2 ml 0,9 % injekčného roztoku chloridu sodného (9 mg/ml) bez použitia konzervačných prísad, čím vznikne roztok obsahujúci 25 mg/mlpemetrexedu. Pohybujte jemným krúživým pohybom každou injekčnou liekovkou až kým sa prášok úplne rozpustí. Výsledný roztok je číry a jeho farba kolíše od bezfarebnej po žltú alebo zeleno-žltú bez narušenia jeho kvality. pH pripraveného roztoku je medzi 6,6 a 7,8. Potrebné je ďalšie riedenie.
4. Príslušný objem rekonštituovaného roztoku pemetrexedu sa musí ďalej nariediť na 100 ml s 0,9 % injekčným roztokom chloridu sodného (9 mg/l) bez použitia konzervačných prísad a podať ako intravenózna infúzia počas 10 minút.
5. Infúzne roztoky s pemetrexedom pripravené podľa vyššie uvedeného návodu sú kompatibilné s polyvinylchloridovými a polyolefínovými infúznymi setmi a infúznymi vakmi.
6. Lieky na parenterálnu aplikáciu sa musia pred aplikáciou vizuálne kontrolovať na prítomnosť drobných častíc a zmenu farby. V prípade prítomnosti drobných častíc neaplikujte.
7. Roztok pemetrexedu je určený len na jedno použitie. Všetky nepoužité lieky alebo odpad vzniknutý z liekov musia byť zlikvidované v súlade s národnými požiadavkami.
Bezpečnostné opatrenia pri príprave a podávaní lieku: Tak ako u iných potenciálne toxických protinádorových liekov, sa musí s infúznymi roztokmi pemetrexedu zaobchádzať starostlivo. Odporúča sa použitie rukavíc. Ak sa roztok dostane do kontaktu s kožou, umyte kožu ihneď a
dôkladne mydlom a vodou. Ak sa roztok pemetrexedu dostane do kontaktu so sliznicami, prepláchnite sliznice dôkladne vodou. Pemetrexed nie je vezikancium. V prípade úniku pemetrexedu mimo žilu neexistuje špecifické antidotum. Bolo popísaných pár prípadov úniku pemetrexedu mimo žilu, ktoré hodnotiaci nepovažoval za závažné. Únik lieku mimo žilu má byť liečený miestnymi štandardnými postupmi ako u iných nevezikancií.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIMenarini International Operations Luxembourg S.A.
1, Avenue de la Gare L-1611, Luxembourg Luxembursko
8. REGISTRAČNÉ ČÍSLOEU/1/15/1055/002
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.