
žité pri hypotonických roztokoch.
Tonicita Chloridu sodného 0,9 % IMUNA ENVIBAG: izotonický roztok.
Rýchlosť a objem infúzie závisia od veku, hmotnosti, klinického stavu (napr. popáleniny, chirurgické zákroky, poranenia hlavy, infekcie) a súbežnú liečbu musí stanoviť odborný lekár so skúsenosťami
s podávaním intravenóznych roztokov u detí (pozri časti 4.4 a 4.8).
Pediatrická populáciaPri klinických stavoch ako nedostatočná perfúzia tkanív/šok, hypovolémia je odporúčané 10 – 20 ml/kg telesnej hmotnosti, Po zhodnotení stavu a fyziologickej odozvy pediatrického pacienta je možné aplikáciu zopakovať. Maximálna odporúčaná dávka je 60 ml/kg telesnej hmotnosti.
U predčasne narodených novorodencov a novorodencov s nezrelou funkciou obličiek môže dochádzať k nadbytočnému zadržiavaniu sodíka v sére. Preto sa u týchto novorodencov opakované infúzie chloridu sodného majú podávať až po stanovení hladiny sodíka v sére.
Pri každom podaní sa musia pozorne sledovať koncentrácie elektrolytov v sére. Rýchlosť infúzie závisí od klinického stavu pacienta.
Spôsob podávaniaNa intravenózne použitie.
4.3 Kontraindikácie- Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.

- Hyperhydratácia, edematózne stavy, renálne zlyhávanie (oligúria až anúria), srdcová dekompenzácia, ťažký stupeň hypertenzie, metabolická acidóza (všeobecné obmedzenia
infúznej terapie).
- Roztok je kontraindikovaný u pacientov s hypernatriémiou alebo hyperchlorémiou.
- Musia sa vziať do úvahy aj kontraindikácie spojené s pridaným liekom.
4.4 Osobitné upozornenia a opatrenia pri používaníPodávajte kontinuálne, za kontroly prietoku. Ďalšie lieky pridávajte len za prísne aseptických podmienok, starostlivo premiešajte a ihneď podávajte. Lieky môžu byť inkompatibilné.
Pri liečbe dehydratácie, hypovolémie je nevyhnutné sledovať základné parametre vnútorného prostredia, predovšetkým iónogramu a korigovať prípadné odchýlky. V závažnejších prípadoch je nevyhnutná kombinácia s roztokmi koloidov a vyvážená suplementácia ostatných iónov. Pri korekcii porúch natriémie (predovšetkým chronických foriem) zmeny natriémie nemajú presiahnuť 10 mmol/l v priebehu 24 hodín. Pri rýchlejších zmenách hrozí nebezpečenstvo edému mozgu. Opatrne je potrebné postupovať pri podávaní roztoku predčasne narodeným novorodencom a starším pacientom.
Chlorid sodný sa musí používať opatrne u pacientov s hypertenziou, zlyhaním srdca, periférnym alebo pľúcnym edémom, poruchou funkcie obličiek, preeklampsiou, aldosteronizmom alebo u pacientov, ktorých ochorenie alebo liečba (napr. kortikosteroidmi) majú vplyv na zadržiavanie sodíka.
s neosmotickým uvoľňovaním vazopresínu (vrátane SIADH) musia podávať pod špecifickým dohľadom kvôli riziku iatrogénnej hyponatriémie (pozri nižšie).
Hyponatriémia
Pacienti s neosmotickým uvoľňovaním vazopresínu (napr. akútne ochorenie, bolesť, pooperačný stres, infekcie, popáleniny a choroby CNS), pacienti so srdcovými, pečeňovými a obličkovými ochoreniami a pacienti, ktorí sú vystavení agonistom vazopresínu (pozri časť 4.5), sú po infúzii hypotonických tekutín vystavení mimoriadnemu riziku akútnej hyponatriémie.
Akútna hyponatriémia môže viesť k akútnej hyponatriémickej encefalopatii (edém mozgu) charakterizovanej bolesťami hlavy, nauzeou, záchvatmi, letargiou a vracaním. Pacienti s edémom mozgu majú osobitné riziko závažného, nezvratného a život ohrozujúceho poškodenia mozgu.
Deti, ženy vo fertilnom veku a pacienti so zníženou compliance mozgu (napr. meningitída, intrakraniálne krvácanie, cerebrálna kontúzia a opuch mozgu) majú mimoriadne riziko závažného a život ohrozujúceho opuchu mozgu spôsobeného akútnou hyponatriémiou.
Pridanie iného lieku alebo použitie nesprávnej techniky podania môže vyvolať febrilné reakcie spôsobené možným zavedením pyrogénov. V prípade nežiaducej reakcie sa musí infúzia okamžite zastaviť.
Liek nesmie byť po prvom odbere znova použitý.
Liek nesmie byť používaný po uplynutí času použiteľnosti vyznačenom na obale.
Pediatrická populácia
U detí je mimoriadne riziko závažného a život ohrozujúceho opuchu mozgu spôsobeného akútnou
hyponatriémiou (pozri vyššie „Hyponatriémia“).
4.5 Liekové a iné interakcie
Neuskutočnili sa žiadne interakčné štúdie.
Nie je k dispozícii veľký počet štúdií, ktoré by hodnotili bezpečnosť súbežného podávania fyziologického roztoku a iných liekov. Fyziologický roztok sa používa ako hlavné rozpúšťadlo
a vehikulum parenterálne podávaných liekov. Pri použití roztoku ako rozpúšťadla/riedidla
kompatibilných elektrolytových koncentrátov alebo liekov, treba vziať do úvahy vlastnosti pridávaných liekov.
Súbežné používanie liekov s obsahom tolvaptánu a liekov s obsahom chloridu sodného môže spôsobiť rýchle zvýšenie hladiny sodíka v krvi. V prípade použitia lieku s obsahom tolvaptanu a infúzneho roztoku chloridu sodného je potrebné zvoliť vhodné dávkovanie a pravidelné monitorovanie vnútorného prostredia pre bezpečné použitie oboch liekov.
Súbežné použitie liekov s obsahom lítia a liekov s obsahom chloridu sodného môže znížiť liečebný účinok lítia. Pri liečbe lítiom je potrebné vyhnúť sa príliš vysokému a nízkemu príjmu sodíka
a monitorovať hladinu lítia v sére.
Lieky, ktoré spôsobujúzvýšenýúčinokvazopresínu
Nižšie uvedené lieky zvyšujú účinok vazopresínu, čo vedie k zníženiu renálneho vylučovania vody
bez elektrolytov a môže to zvýšiť riziko iatrogénnej hyponatriémie po nevhodne vyváženej liečbe i.v. roztokmi (pozri časti 4.2, 4.4 a 4.8).
- K liekom stimulujúcim vylučovanie vazopresínu patria:
chlórpropamid, klofibrát, karbamazepín, vinkristín, selektívne inhibítory spätného
vychytávania sérotonínu, 3,4-metyléndioxy-N-metamfetamín, ifosfamid, antipsychotiká, narkotiká.
- K liekom zvyšujúcim účinok vazopresínu patria:
chlórpropamid, NSAID, cyklofosfamid.
- K analógom vazopresínu patria:
dezmopresín, oxytocín, vazopresín, terlipresín.
Ďalšie lieky zvyšujúce riziko hyponatriémie zahŕňajú aj diuretiká vo všeobecnosti a antiepileptiká, ako je oxkarbazepín.
4.6. Fertilita, gravidita a laktáciaGraviditaChlorid sodný 0,9 % IMUNA ENVIBAG sa má podávať so zvláštnou opatrnosťou u tehotných žien
počas pôrodu hlavne s ohľadom na sérový sodík, ak sa podáva v kombinácii s oxytocínom (pozri časti
4.4, 4.5 a 4.8).
DojčeniePoužívanie roztoku chloridu sodného nie je kontraindikované počas dojčenia. Liek sa môže podávať
dojčiacim ženám za prísnej lekárskej kontroly.
FertilitaLiek neovplyvňuje fertilitu.
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeChlorid sodný 0,9 % IMUNA ENVIBAG nemá žiadny vplyv na schopnosť viesť vozidlá a obsluhovať
stroje.
4.8 Nežiaduce účinkyV nasledovnej tabuľke sú zhrnuté nežiaduce účinky rozdelené do tried podľa databázy MedDRA
s uvedenou frekvenciou:
Veľmi časté (³ 1/10); časté (³ 1/100 až < 1/10); menej časté (³ 1/1 000 až < 1/100); zriedkavé
(³ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000); neznáme (z dostupných údajov).
Trieda orgánových
systémov podľa databázy
MedDRA
| Frekvencia
výskytu
| Nežiaduci účinok
|
Poruchy metabolizmu a výživy
| neznáme
| hyperhydratácia, hypernatriémia, hyperchlorémia
s acidózou, iatrogénna hyponatriémia*
|
Poruchy nervového systému
| neznáme
| akútna hyponatriemická encefalopatia*
|
Poruchy ciev
| neznáme
| kardiálna dekompenzácia s preťažením obehu,
vznik edémov (vrátane edému pľúc a mozgu), ascites
|
Celkové poruchy
a reakcie v mieste podania
| neznáme
| erytém, iritácia žilovej steny, infekcia v mieste
podania, flebitída alebo tromboflebitída šíriaca sa od miesta aplikácie, reakcie pri extravaskulárnom podaní: opuch, bolesť
|
* Iatrogénna hyponatriémia môže spôsobiť ireverzibilné poškodenie mozgu a smrť v dôsledku rozvoja akútnej hyponatriemickej encefalopatie (pozri časti 4.2, 4.4, 4.5).
Pri výskyte nežiaducej reakcie treba prerušiť podávanie infúzie a za kontinuálneho monitorovania korigovať vnútorné prostredie. Pokiaľ sa objaví nežiaduci účinok spôsobený liekom pridaným
do infúzie, je potrebné infúziu prerušiť a liečbu prehodnotiť.
Nežiaduce reakcie môžu súvisieť s technikou podávania a zahŕňajú febrilnú reakciu.
Deficit zásad pri hyperchloremickej acidóze je popisovaný pri veľkoobjemovej resuscitácii s použitím roztoku chloridu sodného.
Hlásenie podozrení na nežiaduce reakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovaniePri odborne vedenej terapii, kedy sa priebežne sledujú základné parametre vnútorného prostredia
sa predávkovanie neočakáva.
Predávkovanie roztokom chloridu sodného je vysoko nepravdepodobné. Príznaky akútneho predávkovania sa prejavujú ako intoxikácia chloridom sodným (hypernatriémia, hyperchlorémia).
Chronické predávkovanie chloridom sodným je rizikový faktor pre vznik hypertenzie a kardiovaskulárnych ochorení.
Celkové nežiaduce účinky nadmerného množstva sodíka v tele zahŕňajú nauzeu, vracanie, hnačku, kŕče v oblasti brucha, smäd, zníženú tvorbu slín a sĺz, potenie, horúčku, tachykardiu, hypertenziu, zlyhanie obličiek, periférny a pľúcny edém, zastavenie dýchania, bolesť hlavy, závrat, nepokoj, podráždenosť, slabosť, svalové fascikulácie a rigiditu, kŕče, kómu a smrť.
Predávkovanie roztokom chloridu sodného môže spôsobiť hypernatriémiu, hyperchlorémiu, hyperhydratáciu, hyperosmolaritu séra a vyžaduje špecializovanú liečbu.
Nadbytok chloridov môže spôsobiť stratu bikarbonátov a zvýšenie acidity (hyperchloremická
metabolická acidóza).
Prvá pomoc,antidotáOkamžité prerušenie podávania, podanie diuretík s následným monitorovaním elektrolytov séra až
do upravenia elektrolytov a acidobázickej nerovnováhy.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina
: Náhrady krvi a perfúzne roztoky, roztoky ovplyvňujúce rovnováhu
elektrolytov, ATC kód: B05BB01
Mechanizmus účinkuIzotonický roztok chloridu sodného má význam ako zdroj vody a elektrolytov. Má rovnakú osmolaritu
ako plazma. Aplikácia tohto roztoku primárne vyvolá doplnenie intersticiálneho priestoru, ktorý tvorí približne 2/3 celkového extracelulárneho priestoru. Iba 1/3 podaného objemu zostáva
v intravaskulárnom priestore. Hemodynamický účinok roztoku má preto iba krátke trvanie.
Sodík je hlavný katión extracelulárnej tekutiny a hrá úlohu v kontrole distribúcie vody, tekutín,
elektrolytovej rovnováhy a osmotického tlaku telesných tekutín. Prispieva k udržiavaniu správnej
acidobázickej rovnováhy. Chloridy, hlavné extracelulárne anióny, majú priamu súvislosť
s dostupnosťou sodíkových katiónov pri udržiavaní acidobázickej rovnováhy a izotonicity.
Farmakodynamické účinky
Farmakodynamické vlastnosti tohto roztoku zodpovedajú vlastnostiam sodíkových a chloridových
iónov pri udržiavaní rovnováhy tekutiny a elektrolytov. Ióny, ako sodík, prechádzajú prostredníctvom sodíkovo-draslíkovej pumpy bunkovou membránou. Sodík zohráva dôležitú úlohu v neurotransmisii,
v elektrofyziológii srdca a tiež v renálnom metabolizme.
5.2 Farmakokinetické vlastnosti
Absorpcia
Izotonický roztok chloridu sodného (fyziologický roztok) je aplikovaný infúziou priamo
do systémovej cirkulácie – biologická dostupnosť účinných látok je preto úplná (100 %). Po
intravenóznom podaní zostáva v krvnom riečisku iba niekoľko desiatok minút, ľahko uniká extravaskulárne.
Distribúcia
Distribuuje sa do celého tela. Úplne disociované ióny sa v organizme distribuujú podľa
koncentračných gradientov v extracelulárnej tekutine, voľná voda sa distribuuje podľa koncentračného spádu vo všetkých kompartmentoch.
Eliminácia
Iónová rovnováha závisí na ich vylučovaní obličkami a podlieha hlavne mineralokortikoidnej
regulácii. Prebytočný sodík sa vylučuje obličkami. Vylučovanie chloridov je sprevádzané tiež stratami vodíkových iónov (H+) zo zažívacieho traktu, sodíkových iónov (Na+) potením alebo draslíkových iónov (K+) diuretikami.
5.3 Predklinické údaje o bezpečnosti'
Predklinické údaje získané na základe obvyklých farmakologických štúdií bezpečnosti, toxicity
po opakovanom podávaní, genotoxicity, karcinogénneho potenciálu, reprodukčnej toxicity a vývinu neodhalili žiadne osobitné riziko pre ľudí.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
voda na injekcie
6.2 Inkompatibility
Pri miešaní s inými liekmi je potrebné zohľadniť možné inkompatibility.
Fyziologický roztok sa používa ako hlavné rozpúšťadlo a vehikulum parenterálne podávaných liekov. Za zistenie inkompatibility pridaného lieku s roztokom Chlorid sodný 0,9 % IMUNA ENVIBAG je
zodpovedný lekár. Lekár musí skontrolovať prípadnú zmenu zafarbenia roztoku a/alebo prípadnú
zrazeninu, nerozpustené komplexy alebo vytvorenie kryštálikov. Musí si preštudovať návod
na použitie pridaného lieku.
Pred pridaním lieku je potrebné overiť, či je liek rozpustný a stabilný vo vode v rozmedzí pH .
Po pridaní kompatibilného lieku do roztoku Chlorid sodný 0,9 % IMUNA ENVIBAG, sa tento roztok
musí použiť okamžite.
Lieky, ktorých inkompatibilita je známa, sa nesmú používať.
6.3 Čas použiteľnosti
V neporušenom obale: 2 roky
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte pri teplote do 25 °C.
Neuchovávajte v mrazničke.
Uchovávajte v škatuli na ochranu pred svetlom.
Len na jednorazové použitie.
Nepoužitý roztok zlikvidujte.
Čiastočne použité vaky už viackrát nepripájajte.
Ak je vak zabalený v ochrannej fólii, vyberte ho z nej až tesne pred použitím.
Vak udržiava sterilitu lieku.
6.5 Druh obalu a obsah balenia
Polypropylénový vak s infúznym a injekčným portom alebo s dvoma portmi Luer Lock. Veľkosti balenia:
1 x 100 ml, 1 x 250 ml, 1 x 500 ml, 1 x 1 000 ml (jednotlivo)
40 x 100 ml, 18 x 250 ml, 10 x 500 ml, 10 x 1 000 ml (v škatuli) Na trh nemusia byť uvedené všetky veľkosti balenia.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Len na lekársky predpis. Dávkovanie podľa pokynov lekára.
Použite, len ak je roztok číry, bez viditeľných častíc a obal je nepoškodený. Podajte okamžite
po napojení na infúzny set.
Nepoužívajte plastové vaky v sériových napojeniach. Takéto použitie môže viesť k vzduchovej embólii spôsobenej natiahnutím zvyšného vzduchu z hlavného vaku pred ukončením podávania tekutiny z vedľajšieho vaku. Stlačenie intravenózneho roztoku v pružnom plastovom obale za účelom zvýšenia rýchlosti prietoku môže zapríčiniť vzduchovú embóliu, ak pred podaním nie je reziduálny objem vzduchu z vaku úplne vyprázdnený.
Roztok sa musí podávať aseptickou metódou pomocou sterilného zariadenia. Aby sa predišlo vniknutiu vzduchu do systému, zariadenie sa musí naplniť roztokom.
Ďalšie lieky sa môžu pridať cez venóznu linku pred podávaním infúzie alebo počas neho.
Keď sa pridáva do roztoku ďalší liek, pred parenterálnym podaním skontrolujte izotonicitu. Musí sa zaistiť dôkladné a starostlivé aseptické premiešanie všetkých ďalších pridaných liekov. Roztoky obsahujúce aj ďalšie pridané lieky sa musia použiť okamžite a nesmú sa uchovávať.
Len na jednorazové použitie.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
Čiastočne použité vaky už viackrát nepripájajte.
Ak je vak zabalený v ochrannej fólii, vyberte ho z nej až tesne pred použitím.
Vak udržiava sterilitu lieku.
NÁV
O
D NA MANIPULÁCIU S VAKOM

Obrázok 1: Vak
1. KONTROLA PRED PODANÍM
a) Skontrolujte, či nedochádza k unikaniu tekutiny z vaku. Ak je celistvosť vaku narušená, vak s roztokom zlikvidujte, pretože môže byť narušená jeho sterilita.
b) Skontrolujte, či roztok opticky spĺňa charakteristiky uvedené v súhrne charakteristických vlastností lieku. Pokiaľ nie, roztok zlikvidujte. Na prípravu a podávanie používajte sterilný
materiál.
2. PRÍPRAVA NA PODÁVANIE
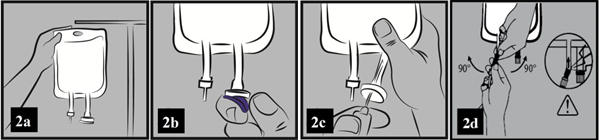
a) Zaveste vak na stojan alebo ho položte na vodorovnú plochu (obrázok 2a).
b) Odlomte modrý plastový kryt z výstupného (infúzneho) portu (obrázok 2b).
c) Gumená zátka portu je sterilná, preto ju netreba dezinfikovať. Do infúzneho portu pripojte
hrubú perforačnú ihlu infúzneho setu (obrázok 2c).
d) Ďalej postupujte podľa návodu priloženého k infúznemu setu (naplnenie setu a podávanie
roztoku).
e) Ak použijete vak s konektorom typu Luer, odstráňte uzáver a pripojte skrutkovací konektor typu Luer k skrutkovaciemu konektoru typu Luer na vaku a dotiahnite. Oboma rukami rozlomte zlomiteľný kolík v spodnej časti portu a samotný port ohnite aj s tubou doprava a doľava v 90° uhle aspoň 2-krát. Skontrolujte, či sa kolík úplne oddelil a tekutina voľne preteká. Počas aplikácie zostane kolík v tube vaku (obrázok 2d).
3. PRIDANIE LIEKU DO ROZTOKU
a) Odlomte priesvitný kryt z injekčného portu. Gumená zátka portu je sterilná, preto ju netreba dezinfikovať (obrázok 3a).
(0,70 mm) (obrázok 3b).

c) Obsah vaku dôkladne premiešajte (obrázok 3c).
Upozornenie: Riaďte sa pokynmi na likvidáciu vakov v zdravotníctve (obsah pridaného lieku). Maximálne množstvo ďalšieho lieku, ktoré sa môže do vaku doplniť:
100 ml vak
| max. 70 ml
|
250 ml vak
| max. 75 ml
|
500 ml vak
| max. 115 ml
|
1 000 ml vak
| max. 130 ml
|
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIIMUNA PHARM, a.s.
Jarková 269/17
082 22 Šarišské Michaľany
Slovenská republika
imuna@imuna.sk pharmacovigilance@imuna.sk Tel.: +421 907 781 259
8. REGISTRAČNÉ ČÍSLO76/0181/16-S
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 21. marca 2017
10. DÁTUM REVÍZIE TEXTU08/2022