
ému žiareniu je potrebná opatrnosť a to nosením ochranného odevu a/alebo použitím opaľovacieho krému z dôvodu potenciálneho rizika fototoxických reakcií v súvislosti
s liečbou vandetanibom.
Hnačka
Hnačka je príznakom ochorenia, ako aj známy nežiaduci účinok vandentanibu. Na liečbu hnačky sa odporúčajú bežné antidiaroiká. Častejšie sa majú sledovať QTc a sérové elektrolyty. Ak sa vyvinie závažná hnačka (CTCAE 3.-4. stupňa), podávanie vandetanibu sa má zastaviť, až kým sa príznaky hnačky nezlepšia. Po zlepšení sa môže liečba začať opätovne v zníženej dávke (pozri časti 4.2 a 4.8).
Hemorágia
Opatrnosť s užívaním vandetanibu je potrebná u pacientov s metastázami mozgu, pretože bola hlásená intrakraniálna hemorágia.
Zlyhanie srdca
U pacientov užívajúcich vandetanib bolo pozorované zlyhanie srdca. U pacientov so zlyhaním srdca môže byť nevyhnutné dočasné alebo trvalé prerušenie liečby. Zlyhanie nemusí byť reverzibilné po
vysadení vandetanibu. Niektoré prípady boli fatálne.
Hypertenzia
U pacientov liečených vandetanibom sa pozorovala hypertenzia vrátane hypertenznej krízy. Pacientov je potrebné sledovať kvôli hypertenzii a v prípade potreby hypertenziu liečiť. Ak nie je možné vysoký
krvný tlak zvládnuť vhodnou liečbou, vandetanib sa nemá znovu nasadiť, kým nie je krvný tlak kontrolovaný liekmi. Môže byť nevyhnutné zníženie dávky (pozri časť 4.8).
Porucha funkcie obličiek
Vandetanib sa neodporúča pre používanie u pacientov so stredne závažnou alebo závažnou poruchou funkcie obličiek, pretože existujú len obmedzené údaje a bezpečnosť a účinnosť neboli stanovené
(pozri časť 4.2, 5.1 a 5.2).
Porucha funkcie pečene
Vandetanib sa neodporúča pre používanie u pacientov s poruchou funkcie pečene (sérový bilirubín vyšší ako 1,5-násobok horného limitu normálnej hodnoty), pretože u pacientov s poruchou funkcie
pečene sú k dispozícii obmedzené údaje a bezpečnosť a účinnosť sa nestanovili. Farmakokinetické
údaje od dobrovoľníkov naznačujú, že u pacientov s miernou, stredne závažnou alebo závažnou poruchou funkcie pečene sa nevyžaduje žiadna zmena počiatočnej dávky (pozri časti 4.2 a 5.2).
Zvýšenie alanínaminotransferázy
U pacientov liečených vandetanibom sa často pozorovalo zvýšenie alanínaminotransferázy. Väčšina zvýšení ustúpila pri pokračovaní liečby, ostatné zvyčajne ustúpili po 1-2-týždňovom prerušení liečby.
Odporúča sa pravidelné sledovanie alanínaminotransferázy.
Intersticiálna pľúcna choroba
Intersticiálna pľúcna choroba (interstitial lung disease – ILD) sa pozorovala u pacientov užívajúcich vandetanib a niektoré prípady boli fatálne. Ak sa u pacienta zistia respiračné symptómy, ako je dyspnoe, kašeľ a horúčka, liečba vandetanibom sa má prerušiť a začať okamžité vyšetrenie. Ak sa potvrdí ILD, vandetanib sa má natrvalo vysadiť a pacienta je potrebné primerane liečiť.
Induktory CYP3A4
Súbežnému používaniu vandetanibu so silnými induktormi CYP3A4 (ako je rifampicín, ľubovník bodkovaný, karbamazepín, fenobarbital) sa treba vyhýbať (pozri časť 4.5).
CTN menej ako 500 pg/ml
Prínos vandetanibu u pacientov s CTN menej ako 500 pg/ml nebol stanovený, preto sa má použitie u pacientov s CTN < 500 pg/ml starostlivo zvážiť vzhľadom na riziká súvisiace s liečbou vandetanibom.
Pohotovostná karta pacienta
Všetci lekári predpisujúci Caprelsu sa musia oboznámiť s informáciami pre lekárov
a so smernicami, ktoré sa týkajú liečby. Lekár musí prediskutovať riziká liečby Caprelsou
s pacientom. Pacientovi bude poskytnutá Pohotovostná karta pacienta pri každom predpise.
4.5 Liekové a iné interakcie
Farmakokinetické interakcie
Vplyv vandetanibu na iné lieky
Údaje in vitro naznačujú, že vandetanib je stredne silný induktor CYP3A4. Keďže sa neuskutočnili žiadne klinické interakčné štúdie, je potrebná opatrnosť pri kombinácii vandetanibu so substrátmi
CYP3A4, najmä estrogestagénmi, imunosupresívami ako cyklosporín alebo takrolimus, alebo
antineoplastickými látkami, ako je docetaxel a bortezomib.
Vandetanib je slabý inhibítor efluxnej pumpy P-glykoproteínu (P-gp). Súbežné podávanie vandetanibu a liekov vylučovaných prostredníctvom P-gp, ako je dabigatran alebo digoxín, môže viesť k zvýšeným plazmatickým koncentráciám týchto liekov. Pacienti užívajúci dabigatran alebo digoxín a vandetanib môžu vyžadovať zvýšený klinický a biologický dozor a primeranú úpravu dávky, ak je potrebné.
Vandetanib je inhibítor transportéru organických katiónov 2 (OCT2). Z toho dôvodu môže mať vandetanib potenciál znižovať elimináciu liekov, o ktorých je známe, že sú vylučované prostredníctvom OCT2 a zvyšovať expozíciu pacienta na tieto lieky. Metformín je substrát OCT2 a pacienti, ktorí užívajú vandetanib a metformín (alebo iný substrát OCT2) môžu vyžadovať dôkladnejšie sledovanie a možnú úpravu dávky metformínu.
Účinok inhibítorov protónovej pumpy na gastrointestinálnu absorpciu vandetanibu nebol stanovený. Vandetanib preukazuje rozpustnosť závislú od pH; preto súbežné podávanie vandetanibu s inhibítormi protónovej pumpy môže znížiť expozíciu pacienta vandetanibu. Súčasné užívanie s touto
terapeutickou triedou liekov sa preto neodporúča .
Vplyv iných liekov na vandetanib
V klinickej štúdii uskutočnenej u zdravých dobrovoľníkov súbežné podávanie vandetanibu
(jednorazová dávka 300 mg) s itrakonazolom (opakované dávky 200 mg jedenkrát denne), silným inhibítorom CYP3A4, zvyšuje plazmatickú expozíciu vandetanibu približne o 9%. Keďže dávka itrakonazolu bola nižšia ako minimálna odporúčaná dávka na inhibíciu CYP3A4, (t.j. 400 mg jedenkrát denne), pri kombinácii itrakonazolu a iných silných inhibítorov CYP3A4 (napr. ketokonazolu, ritonaviru a klaritromycínu) s vandetanibom je potrebná opatrnosť.
V klinickej štúdii uskutočnenej so zdravými mužmi sa expozícia vandetanibu znížila o 40%, keď sa podával spolu so silným induktorom CYP3A4, rifampicínom. Preto sa treba vyhýbať podávaniu vandetanibu s rifampicínom a inými silnými induktormi CYP3A4 (napr. karbamazepínom, fenobarbitalom a ľubovníkom bodkovaným) (pozri časť 4.4).
Farmakodynamické interakcie
Biliárna exkrécia nezmeneného vandetanibu je jednou z ciest vylučovania pre vandetanib. Vandetanib
nie je substrátom viacliekového rezistentného proteínu 2 (MRP2), p-glykoproteínu (Pgp) ani proteínu rezistencie rakoviny prsníka (BCRP).
Lieky, o ktorých je známe, že predlžujú QTc interval
Preukázalo sa, že vandetanib predlžuje QTc interval na EKG; mimoriadne boli hlásené torsades de pointes. Preto súbežné používanie vandetanibu s liekmi, o ktorých je známe, že tiež predlžujú QTc interval a/alebo indukujú torsades de pointes je buď kontraindikovaná, alebo sa v závislosti od existujúcej alternatívnej terapie neodporúča.
• Kontraindikované kombinácie (pozri časť 4.3): Cisaprid, erytromycín intravenózne (IV), toremifén, mizolastín, moxifloxacín, arzén, antiarytmiká triedy IA a III.
• Neodporúčané kombinácie: Metadon, haloperidol, amisulprid, chlorpromazín, sulpirid, zuklopentixol, halofantrín, pentamidín a lumefantrín.
Ak nie je k dispozícii žiadna vhodná alternatívna liečba, neodporúčané kombinácie s vandetanibom sa môžu urobiť s prídavným EKG za sledovania QTc intervalu zhodnotením elektrolytov a kontrolou objavenia sa alebo zhoršenia hnačky.
Výsledky farmakodynamickej a farmakokinetickej interakčnej štúdie naznačili, že súbežné podávanie ondansetrónu u zdravých pacientov má pravdepodobné malý vplyv na farmakokinetiku vandetanibu, má však malý aditívny účinok na predĺženie QTc intervalu približne o 10 ms. Preto sa súbežné užívanie vandetanibu a ondansetronu neodporúča. Ak sa ondansetrón podáva s vandetanibom vyžaduje sa starostlivé sledovanie sérových elektrolytov a je potrebné agresívne zvládnutie všetkých abnormalít.
Antagonisty vitamínu K
Z dôvodu zvýšeného trombotického rizika u pacientov s karcinómom je používanie antikoagulačnej
terapie časté. S ohľadom na vysokú interindividuálnu variabilitu odpovede na antikoaguláciu a na možnosť interakcie medzi antagonistami vitamínu K a chemoterapiou sa odporúča zvýšená frekvencia
sledovania INR (International Normalised Ratio), ak sa rozhodne o liečbe pacienta s antagonistami
vitamínu K.
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku
Ženy vo fertilnom veku majú používať účinnú antikoncepciu počas liečby a najmenej 4 mesiace po poslednej dávke.
Gravidita
Je iba obmedzené množstvo údajov o použití vandetanibu počas gravidity. Ako sa očakáva z jeho farmakologického pôsobenia, preukázalo sa, že vandetanib má významné účinky na všetky štádiá
reprodukcie u samíc potkanov (pozri časť 5.3).
Ak sa vandetanib používa počas gravidity alebo ak pacientka otehotnie počas užívania vandetanibu, má byť oboznámená s potenciálnymi abnormalitami plodu alebo stratou tehotenstva. Liečba
u gravidných žien má pokračovať len v prípade, že potenciálny prínos pre matku prevýši riziko pre plod.
Dojčenie
Nie sú k dispozícii žiadne údaje o použití vandetanibu u dojčiacich žien. Vandetanib a/alebo jeho metabolity sa vylučujú do mlieka u potkanov a zistili sa v plazme mláďat po podaní dávky laktujúcim
potkanom (pozri časť 5.3).
Dojčenie je počas liečby vandetanibom kontraindikované.
FertilitaU potkanov nemal vandetanib žiadny vplyv na fertilitu samcov, ale poškodil fertilitu samíc (pozri
časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie na stanovenie účinkov vandetanibu na schopnosť viesť vozidlá
a obsluhovať stroje. Zaznamenala sa však únava a rozmazané videnie a tí pacienti, u ktorých sa tieto symptómy vyskytnú, majú byť opatrní pri vedení vozidla alebo obsluhe strojov.
4.8 Nežiaduce účinkyCelkový súhrn nežiaducich liekových reakciíNajčastejšie zaznamenané nežiaduce liekové reakcie boli hnačka, vyrážka, nauzea, hypertenzia
a bolesť hlavy.
Nežiaduce liekové reakcie počas klinických skúšaníNasledujúce nežiaduce reakcie boli identifikované v klinických štúdiách u pacientov užívajúcich vandetanib ako liečbu MTC. Ich frekvencia je uvedená v tabuľke 1 nežiaduce liekové reakcie pomocou klasifikácie frekvencie Rady pre medzinárodné organizácie lekárskych vied (CIOMS III) (Council for International Organizations of Medical Sciences) a potom vymenovaná podľa tried orgánových systémov (TOS) MedDRA a v uprednostňovanom termíne a podľa klasifikácie frekvencie. Frekvencie výskytu nežiaducich účinkov sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000) a neznáme (nemôžu sa odhadovať z dostupných údajov). Táto časť zahŕňa len údaje pochádzajúce z ukončených štúdií, u ktorých je známa expozícia pacienta.
Tabuľka 1 Nežiaduce liekové reakcie a trieda orgánových systémov
|
Trieda orgánových systémov
| Veľmi časté
| Časté
| Menej časté
|
Infekcie a nákazy
| Nazofaryngitída,
bronchitída, infekcie horného dýchacieho
traktu, infekcie
močových ciest
| Pneumónia, sepsa,
chrípka, cystitída, sinusitída, laryngitída,
folikulitída, furunkuly,
plesňové infekcie, pyelonefritída
| Apendicitída,
stafylokokové infekcie,
divertikulitída,
celulitída, absces brušnej steny
|
Poruchy
endokrinného systému
|
| Hypotyreóza
|
|
Poruchy metabolizmu
a výživy
| Znížená chuť do jedla,
hypokalciémia
| Hypokaliémia,
hyperkalciémia, hyperglykémia,
dehydratácia,
hyponatriémia
| Podvýživa
|
Psychické poruchy
| Insomnia, depresia
| Úzkosť
|
|
Poruchy nervového
systému
| Bolesť hlavy, parestézia,
dyzestézia, závraty
| Triaška, letargia, strata
vedomia, poruchy rovnováhy,
dysgeúzia
| Kŕče, klonus, edém
mozgu
|
Poruchy oka
| Rozmazané videnie,
štrukturálne zmeny rohovky (vrátane
depozitov rohovky
| Porucha videnia, vidina
svätožiary, fotopsia, glaukóm, konjunktivitída,
suché oko, keratopatia
| Sivý zákal, poruchy
akomodácie
|
|
a očný zákal)
|
|
|
Poruchy srdca a
srdcovej činnosti
|
Predĺženie QTc intervalu
na EKG(*) (**)
|
|
Zlyhanie srdca,
akútne zlyhanie srdca,
rýchlosť a poruchy
srdcového rytmu, poruchy srdcového vedenia, komorová arytmia a zástava srdca
|
Poruchy ciev
|
Hypertenzia
|
Hypertenzná kríza,
ischemické cerebrovaskulárne ochorenia
|
|
Poruchy dýchacej
sústavy, hrudníka a mediastína
|
|
Epistaxa, hemoptýza,
pneumónia
|
Respiračné
zlyhanie, aspiračná pneumónia
|
Poruchy
gastrointestinálneho traktu
|
Bolesť brucha, hnačka,
nauzea, vracanie, dyspepsia
|
Kolitída, sucho v ústach,
stomatitída, dysfágia, zápcha, gastritída,
krvácanie do zažívacieho
traktu
|
Pankreatitída,
peritonitída, ileus, perforácia čreva,
inkontinencia stolice
|
Poruchy pečene
a žlčových ciest
|
|
Cholelitiáza
|
|
Poruchy kože a
podkožného tkaniva
|
Fotosenzitívna reakcia,
vyrážka a iné kožné reakcie (vrátane akné,
suchej kože, dermatitídy,
pruritu), poruchy nechtov
|
Syndróm palmárno-
plantárnej erytrodyzestézie, alopécia
|
Bulózna dermatitída
|
Poruchy obličiek a
m
očových ciest
|
Proteinúria, nefrolitiáza
|
Dyzúria, hematúria,
zlyhanie obličiek, polakizúria, naliehavosť
močenia
|
Chromatúria, anúria
|
Celkové poruchy a
reakcie v mieste podania
|
Asténia, únava, bolesť
edém
|
Pyrexia
|
Zhoršené hojenie
|
Laboratórne a
funkčné vyšetrenia
|
Predĺženie QT intervalu
na EKG
|
Zvýšenie sérovej ALT a
AST, zníženie telesnej hmotnosti, zvýšenie
kreatinínu v krvi
|
Zvýšenie
hemoglobínu, zvýšenie sérovej
amylázy
|
*13,4% pacientov liečených vandetanibom mali QTc (Bazettov) ≥500 ms v porovnaní s 1% placebom
liečených pacientov. QTcF prolongácia > 20 ms bola u viac než 91% pacientov, > 60 ms u 35%,
> 100 ms u 1,7% pacientov. Osem percent pacientov malo zníženú dávku z dôvodu predĺženia QTc intervalu.
** zahŕňa dva prípady úmrtia pacientov s QTc > 550 ms (jeden z dôvodu sepsy a druhý z dôvodu srdcového zlyhania).
Udalosti ako sú
torsades de pointes, Stevensov-Johnsonov syndróm, multiformný erytém, intersticiálna pľúcna choroba (niekedy fatálna) a PRES (RLPS)sa vyskytovali u pacientov liečených monoterapiou vandetanibom. Očakáva sa, že tieto nežiaduce reakcie budú menej časté u pacientov užívajúcich vandetanib na liečbu MTC.
Očné udalosti ako je rozmazané videnie sú časté u pacientov, ktorí dostávajú vandetanib na liečbu MTC. Plánované vyšetrenia pomocou štrbinovej lampy odhalili korneálne opacity (vortex keratopatie) u liečených pacientov; bežné vyšetrenia pomocou štrbinovej lampy sa však u pacientov užívajúcich vandetanib nevyžadujú.
U pacientov liečených vandentanibom vzrástli priemerné hladiny hemoglobínu o 0,5-1,5 g/dl v porovnaní s východiskovou hodnotou v rôznych časoch expozície.
4.9 Predávkovanie
Špecifická liečba v prípade predávkovania vandetanibom nie je dispozícii a možné symptómy predávkovania sa nestanovili. Po viacnásobných dávkach 300 mg alebo vyšších v štúdiách so zdravými dobrovoľníkmi a s pacientmi sa pozorovalo zvýšenie frekvencie a závažnosti niektorých nežiaducich reakcií, ako je vyrážka, hnačka a hypertenzia. Okrem toho je potrebné vziať do úvahy možné predĺženie QTc intervalu a torsades de pointes.
Nežiaduce reakcie súvisiace s predávkovaním sa majú liečiť symptomaticky; predovšetkým treba liečiť vhodnou liečbou závažnú hnačku. V prípade predávkovania sa musí prerušiť podávanie ďalších dávok a je potrebné prijať vhodné opatrenia na zabezpečenie, aby sa nevyskytovali nežiaduce udalosti, t.j. EKG v priebehu 24 hodín na určenie predĺženia QTc intervalu. Nežiaduce účinky súvisiace s predávkovaním môžu byť predĺžené z dôvodu dlhého polčasu vandentanibu (pozri časť 5.2).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antineoplastické látky, inhibítory proteínkinázy, ATC kód: L01XE12
Spôsob účinku
Vandetanib je silný inhibítor receptoru 2 pre vaskulárny endotelový rastový faktor (vascular endothelial growth factor receptor-2 - VEGFR-2, tiež známeho ako receptor obsahujúci kinázovú vloženú doménu (kinase insert domain containing receptor - [KDR]), receptor epidermálneho rastového faktora (epidermal growth factor receptor - EGFR) a RET tyrozín kinázy . Vandetanib je tiež submikromolárny inhibítor vaskulárneho endotelového receptora-3 tyrozínkinázy.
Vandetanib inhibuje migráciu, proliferáciu, prežívanie endotelových buniek stimulovaných VEGF
a tvorbu nových krvných ciev v in vitro modeloch angiogenézy. Okrem toho vandetanib inhibuje EGF
receptor tyrozínkinázy stimulovaný epidermálnym rastovým faktorom (epidermal growth factor - EGF) v nádorových bunkách a endotelových bunkách. Vandetanib inhibuje EGFR-dependentnú proliferáciu buniek a prežívanie buniek in vitro. Vandetanib tiež inhibuje obe formy RET, divokého typu aj väčšinu mutovaných, aktivovaných foriem RET a významne inhibuje proliferáciu bunkových línií MTC in vitro.
Podávanie vandetanibu in vivo znížilo angiogenézu indukovanú nádorovými bunkami, permeabilitu ciev nádoru a hustotu mikrociev nádoru a inhibovalo rast nádoru a metastázy u ľudských modelov xenoimplantátov nádorov u atymických myší. Vandetanib tiež inhibuje rast xenoimplantátov nádorov MTC in vivo.
Presný mechanizmus účinku vandetanibu u lokálne pokročilého a metastatického MTC nie je známy. Klinické údaje týkajúce sa MTC
Na posúdenie bezpečnosti a účinnosti 300 mg vandetanibu oproti placebu sa uskutočnila randomizovaná, dvojito zaslepená, placebom kontrolovaná štúdia (štúdia 58). Táto štúdia zahŕňala
331 pacientov s neresekovateľným lokálne pokročilým alebo metastázujúcim MTC. Boli zahrnutí len
pacienti s CTN ≥ 500 pg/ml (obvyklé jednotky) alebo ≥ 146,3 pmol/l (medzinárodné štandardné jednotky). Spomedzi pacientov zaradených do štúdie malo 10 pacientov užívajúcich vandetanib
a 4 pacienti užívajúci placebo (4% všetkých pacientov) skóre výkonnostného stavu podľa svetovej zdravotníckej organizácie (WHO PS) ≥ 2 a 28 (12,1%) pacientov užívajúcich vandetanib a 10 (10,1%) užívajúcich placebo malo srdcovú poruchu. Srdcová porucha bola definovaná ako pacienti
s predchádzajúcou kardiovaskulárnou anomáliou.
Primárny cieľ tejto štúdie bol určený na stanovenie zlepšenia prežívania bez progresie (progression- free survival - PFS) pri vandetanibe v porovnaní s placebom. Sekundárne koncové ukazovatele boli hodnotenie celkovej miery objektívnej odpovede (objective response rate - ORR), miera kontroly ochorenia (disease control rate -DCR), čiastočná odpoveď (partial response - PR) alebo kompletná odpoveď (complete response - CR) alebo stabilizácia ochorenia (stable disease - SD) trvajúca minimálne 24 týždňov, trvanie odpovede (duration of response - DOR), čas do zhoršenia bolesti na základe stupnice najhoršej bolesti podľa Krátkeho inventára bolesti (Brief Pain Inventory – BPI)
a celkové prežívanie (ovreall survivall - OS). Primárny koncový ukazovateľ PFS, ORR a DCR
vychádzali z centralizovaného, nezávislého zaslepeného posúdenia zobrazovacích údajov. Biochemická odpoveď s vandetanibom v porovnaní s placebom meraná CTN a CEA sa tiež hodnotila ako sekundárny koncový ukazovateľ.
Pacienti boli liečení vandetanibom alebo placebom, až kým nedosiahli objektívnu progresiu ochorenia. Po objektívnej progresii ochorenia na základe posúdenia skúšajúceho pacienti prerušili liečbu
v zaslepenej štúdii a dostali možnosť užívať nezaslepený vandetanib. Dvadsaťosem z 231 pacientov
(12,1%) užívajúcich vandetanib a 3 z 99 (3,0%) užívajúcich placebo vysadili liečbu z dôvodu nežiaducej udalosti. Štrnásť z 28 pacientov (50%), ktorí skončili s užívaním vandetanibu z dôvodu nežiaducej udalosti, ukončilo liečbu bez zníženia dávky. Päť zo 6 pacientov (83%) so stredne ťažkou poruchou funkcie obličiek, ktorí sa liečili vandetanibom mali zníženú dávku na 200 mg, 1 pacient vyžadoval ďalšie zníženie na 100 mg.
Výsledok primárnej analýzy PFS preukázal štatisticky významné zlepšenie v PFS pre pacientov randomizovaných pre vandetanib v porovnaní s placebom (pomer rizika (HR – hazard ratio) = 0,46;
95% interval spoľahlivosti (CI – confidence interval) = 0,31-0,69; p = 0,0001).
Medián PFS pre pacientov randomizovaných na vandetanib sa nedosiahol; na základe štatistického modelu údajov pozorovaných až do 43. percentilu sa však predpovedá medián PFS 30,5 mesiacov
s 95% intervalom spoľahlivosti 25,5 až 36,5 mesiacov. Medián PFS pre pacientov randomizovaných pre placebo bol 19,3 mesiacov. Po 12 mesiacoch bol podiel pacientov, ktorí prežili a boli bez progresie
192 (83%) u pacientov randomizovaných na vandetanib a 63 (63%) pre pacientov randomizovaných
na placebo. V ramene s vandetanibom progredovalo celkovo 73 (32%) pacientov; 64 (28%) progresiou podľa kritérií hodnotenia odpovede solídnych tumorov (RECIST) a 9 (4%) úmrtím bez progresie ochorenia. Zvyšných 158 pacientov (68%) bolo cenzurovaných v analýze PFS. V ramene splacebom progredovalo celkovo 51 (51%) pacientov; 46 (46%) progresiou RECIST a 5 (5%) úmrtím bez progresie ochorenia. Zvyšných 49 pacientov (49%) bolo cenzurovaných v analýze PFS.
Obr. 1. Kaplanova Meierova krivka PFS
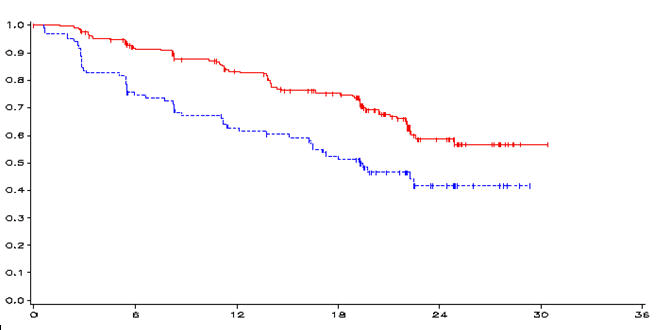
mesiace
|
0
|
6
|
12
|
18
|
24
|
30
|
36
|
n-vandetanib
|
231
|
196
|
169
|
140
|
40
|
1
|
0
|
n-placebo
|
100
|
71
|
57
|
45
|
13
|
0
|
0
|
vandetanib 300 mg,----------placebo, y-os=PFS, x-os=čas v mesiacoch, n-vandetanib=počet
pacientov v riziku-vandetanib, n-placebo=počet pacientov v riziku-placebo
HR = 0,46, 95% CI (0,36-0,69), p=0,0001
PFS
| N
| Median PFS
| HRa
| 95% CI
| p-hodnota
|
Vandetanib 300 mg 73/231 Nedosiahnutý
(32%) (predpokladaný
30,5 mesiacov) 0,46 0,31; 0,69 0,0001
Placebo 51/100 19,3 mesiacov
(51%)
|
V čase primárnej analýzy PFS zomrelo 48 (15%) pacientov a medzi liečenými skupinami sa nezistil
žiadny významný rozdiel v celkovom prežívaní (HR = 0,89; = 99,98% CI = 0,28 – 2,85; p = 0,712). V čase tejto analýzy zomrelo 32 pacientov (14%) v skupine liečenej vandetanibom a 16 pacientov
(16%) užívajúcich placebo.
Väčšina (95% pacientov) mali metastázy. Štrnásť pacientov liečených s vandetanibom a 3 s placebom mali iba neresektabilné, lokálne pokročilé ochorenie. K dispozícii sú obmedzené klinické skúsenosti
s vandetanibom u pacientov s neoperovateľným lokálne pokročilým ochorením a bez metastáz.
Štatisticky významné výhody sa pozorovali pre vandetanib pre sekundárne koncové ukazovatele miery odpovede, miery kontroly ochorenia a biochemickej odpovede.
 Tabuľka 2: Súhrn kľúčových nálezov účinnosti v štúdii 58
Tabuľka 2: Súhrn kľúčových nálezov účinnosti v štúdii 58ORRa
|
|
N
|
Miera odpovede
| ORb
|
95 % CI
|
p-hodnota
|
| Vandetanib 300 mg
| 104/231
| 45%
|
|
|
|
|
|
|
| 5,48
| 2,99; 10,79
| < 0,0001
|
| Placebo
| 13/100
| 13%
|
|
|
|
DCRa
|
|
N
|
Miera odpovede
| ORb
|
95% CI
|
p-hodnota
|
| Vandetanib 300 mg
| 200/231
| 87%
|
|
|
|
|
|
|
| 2,64
| 1,48; 4,69
| 0,001
|
| Placebo
| 71/100
| 71%
|
|
|
|
 CTN Odpoveď N Miera odpovede ORb 95% CI p-hodnota
CTN Odpoveď N Miera odpovede ORb 95% CI p-hodnota
Vandetanib 300 mg
|
160/231
|
69%
|
72,9
|
26,2; 303,2
|
< 0,0001
|
Placebo
|
3/100
|
3%
|
|
|
|
CE
A Odpoveď
|
N
|
M
iera odpovede
|
O
R
b
|
9
5 % CI
|
p
-hodnota
|
Vandetanib 300 mg
|
119/231
|
52%
|
|
|
|
|
|
|
52,0
|
16,0; 320,3
|
< 0,0001
|
Placebo
|
2/100
|
2%
|
|
|
|
a Miera celkovej odpovede = kompletná + čiastočná odpoveď. Miera kontroly ochorenia = miera odpovede + stabilné ochorenie
24 týždňov. Analýza so zámerom liečiť (ITT) zahŕňala pacientov, ktorí dostali nezaslepený vandetanib pred progresiou podľa centrálneho čítania.
b OR = pomer pravdepodobnosti. Hodnota > 1 v prospech vandetanibu. Analýza sa uskutočnila pomocou modelu logistickej regresie s liečbou ako jediným faktorom.
N = počet udalostí/počet randomizovaných pacientov;
Štatisticky významná výhoda sa preukázala pre vandetanib pre sekundárny cieľ čas do zhoršenia bolesti (získaný ako zložený cieľ pri použití najhoršieho skóre bolesti z BPI a pacientom zaznamenané použitie opioidných analgetík)(vandetanib 49%, placebo 57% HR 0,61, 97,5% CI 0,43-0,87, p<0,006:
8 vs. 3 mesiace). Nepozorovali sa žiadne štatisticky významné rozdiely pre výskumný cieľový parameter hnačky (hlásené ako frekvencia stolice).
Stav RET mutácie v štúdii 58V štúdii 58 sa testovanie RET mutácie uskutočnilo použitím polymerázovej reťazovej reakcie (PCR)
na základe (Amplification Refractory Mutation System – ARMS) testu na M918T mutáciu, a priamym sekvenovaním DNA pre mutácie v exónoch 10, 11, 13, 14, 15 a 16 (miesto mutácie M918T) na
všetkých sporadických pacientoch, u ktorých bola DNA k dispozícii (297/298).
Avšak RET stav sa nemohol testovať u veľkej časti pacientov (najmä z dôvodu nedostupných výsledkov priameho sekvenovania DNA) a rýchlosť odpovede bola o niečo nižšia u pacientov
s neznámym stavom RET v porovnaní s pacientami s pozitívnym stavom RET mutácie: 51,8% vs .
35,9%, v uvedenom poradí. V slepom porovnaní vandetanib vs. placebo boli známi iba 2 pacienti, ktorí dostali vandetanib a mali RET negatívny stav vo všetkých 6 exónoch a nepreukázali žiadne
odpovede.
Na základe absencie mutácie M918T sa v kľúčovej štúdii 58 vykonala post-hoc analýza podskupiny s RET negatívnym stavom. Ak ARMS testom bola potvrdená mutácia M918T v nádore, alebo RET mutácia v nejakom sekvenovanom exóne, pacient sa považoval, že má RET mutáciu. V skutočnosti sa u 79 pacientov identifikovala absencia mutácie M918T a nezistila sa žiadna RET mutácia na niektorom z ďalších 6 testovaných exónov, ale u 71 z týchto pacientov sekvenovanie 6 exónov bolo neúplné. U pacientov so sporadickým MTC je mutácia M918T najčastejšie pozorovaná mutácia, ale
nemožno vylúčiť, že niektorí pacienti testovaní na mutáciu M918T RET negatívne môžu byť pozitívni pre mutáciu na ďalších exónoch.
Výsledky podľa RET stavu (pozitívny, neznámy a RET mutačne M918T negatívny ), sú uvedené v tabuľke 3.
 Tabuľka 3: Prehľad výsledkov účinnosti v segmente pacientov podľa stavu RET mutácie
Tabuľka 3: Prehľad výsledkov účinnosti v segmente pacientov podľa stavu RET mutácie
Patienti s dokumentovanou
RET mutáciou
(n=187)
Patienti bez mutácie
M918T
a bez ďalších netestovaných alebo
negatívnych mutácií
(n=79)*

Objektívna rýchlosť

odpovede
52% 35%

(rameno s vandetanibom)
Cieľový parameter účinnosti
PFS HR (95%) interval

spoľahlivosti
0,45 (0,26; 0,78) 0,57 (0.29; 1,13)

* u väčšiny pacientov sa získal stav RET mutácie v čase diagnózy a mohol sa od tej doby zmeniť.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s vandetanibom u jednej alebo viacero vekových podskupín detí a dospievajúcich s dedičným karcinómom štítnej žľazy, pozri časť 4.2 pre informáciu o pediatrickom použití.
Tento liek bol registrovaný s podmienkou. To znamená, že sa očakávajú ďalšie dôkazy o prínosoch tohto lieku.
Európska agentúra pre lieky najmenej raz ročne posúdi nové informácie o lieku a tento súhrn
charakteristických vlastností podľa potreby aktualizuje.
5.2 Farmakokinetické vlastnostiAbsorpciaPo perorálnom podaní vandetanibu je absorpcia pomalá a maximálne plazmatické koncentrácie sa zvyčajne dosahujú s mediánom 6 hodín, rozmedzie 4-10 hodín, po podaní dávky. Vandetanib sa kumuluje približne 8-násobne po viacnásobnom podaní, pričom rovnovážny stav sa dosahuje od približne 2 mesiacov.
DistribúciaVandetanib sa viaže na ľudský sérový albumín a alfa-1-kyslý glykoproteín s väzbou na proteíny
in vitro približne 90%. V plazmatických vzorkách
ex vivo od pacientov s kolorektálnym karcinómom po
expozícii 300 mg jedenkrát denne v rovnovážnom stave bolo priemerné percento väzby na proteíny
93,7% (rozmedzie 92,2 až 95,7%). Farmakokinetika vandetanibu pri dávke 300 mg u MTC pacientov sa vyznačuje distribučným objemom približne 7 450 l.
BiotransformáciaPo perorálnom podaní 14C-vandetanibu sa v plazme, moči a stolici zistil nezmenený vandetanib
a metabolity vandetanib N-oxid a N-dezmetyl-vandetanib. Glukuronidový konjugát sa pozoroval ako menej významný metabolit len v exkrementoch. N-dezmetyl-vandetanib sa tvorí predovšetkým pôsobením CYP3A4 a vandetanib-N-oxid monooxygenázovými enzýmami (FM01 a FM03) obsahujúcimi flavín. N-dezmetyl-vandetanib a vandetanib-N-oxid cirkulujú v koncentráciách ~11%
a 1,4% koncentrácií vandetanibu.
ElimináciaFarmakokinetika vandentanibu pri dávke 300 mg u pacientov s MTC sa vyznačujú klírens ~13,2 l/h, a plazmatickým polčasom približne 19 dní. V priebehu 21-dňového obdobia odberu vzoriek po jednorazovej dávke 14C-vandetanibu, ~69 % sa vylúčilo a to 44% v stolici a 25% v moči. Vylučovanie dávky bolo pomalé a ďalšie vylučovanie sa očakáva na základe plazmatického polčasu aj dlhšie ako
21 dní.
Osobitné skupiny pacientovPorucha funkcie obličiekFarmakokinetická štúdia s jednorazovou dávkou u dobrovoľníkov ukázala, že expozícia vandetanibu je zvýšená (až 1,5 ,1,6 a 2-násobne) u osôb s miernou,stredne závažnou a ťažkou poruchou funkcie obličiek v uvedenom poradí, v porovnaní s osobami s normálnou funkciou obličiek (pozri
časti 4.2, 4.4 a 4.5).
Porucha funkcie pečene
Farmakokinetická štúdia s jednorazovou dávkou u dobrovoľníkov naznačila, že porucha pečene neovplyvňuje expozíciu vandetanibu. Údaje u pacientov s poruchou funkcie pečene (sérový bilirubín vyšší ako 1,5-násobok horného limitu normálnej hodnoty) sú obmedzené (pozri časti 4.2 a 4.4).
Vplyv jedla
Expozícia vandentanibu nie je ovplyvnená jedlom.
5.3 Predklinické údaje o bezpečnosti
Vandetanib nepreukázal mutagénny ani klastogénny potenciál.
V štúdiách toxicity po opakovanom podaní trvajúcich až do 9 mesiacov účinky zahŕňali emézu, zníženie telesnej hmotnosti a hnačku u psov a dyspláziu rastových platničiek u mladých psov
a potkanov v otvorených rastových platničkách. U potkanov sa zaznamenali účinky na zuby, obličky
a kožu. Tieto nálezy, ktoré sa vyskytovali v klinicky významných plazmatických koncentráciách, boli väčšinou reverzibilné v priebehu 4 týždňov po skončení podávania dávky a je ich možné pripísať
inhibícii receptora vaskulárneho endotelového rastového faktora (VEGFR) alebo EGFR.
Účinky pozorované v iných štúdiách zahŕňali inhibíciu ľudského génu „ether-a-go-go“ závislého génu (hERG) a predĺženie QTc intervalu u psov. Zvýšenie systolického a diastolického krvného tlaku sa pozoroval u potkanov a psov. Preukázalo sa, že u myší vandetanib oneskoril hojenie rán, nezabraňoval mu však. Tiež sa preukázalo, že vandetanib má fototoxický potenciál v hodnotení cytotoxicity in vitro. Vo zvieracom modeli hojenia rán u myší, ktoré dostávali vandetanib, sa znížila odolnosť kože voči prasknutiu v porovnaní s kontrolami. To naznačuje, že vandetanib spomaľuje hojenie rán, ale nebráni hojeniu. Vhodný interval medzi vysadením vandetanibu a následným elektívnym chirurgickým zákrokom potrebným na zabránenie rizikám poruchy hojenia rán sa nestanovil. V klinických štúdiách podstúpil malý počet pacientov chirurgický zákrok počas užívania vandetanibu a komplikácie pri hojení rán sa nezaznamenali.
Reprodukčná toxikológia
Vandetanib nemal žiadny vplyv na fertilitu samcov potkanov. V štúdii fertility samíc sa zaznamenala tendencia k zvýšenej nepravidelnosti estrálneho cyklu, mierne zníženie výskytu gravidity a zvýšenie implantačnej straty. V štúdii toxicity po opakovanom podaní u potkanov sa zaznamenalo zníženie počtu žltých teliesok v ováriách potkanov, ktorí dostávali vandetanib po dobu 1 mesiaca.
U potkanov bola zjavná embryofetálna toxicita ako fetálna strata, oneskorený fetálny vývoj, anomálie srdcových ciev a skorá osifikácia niektorých kostí lebky. V pre- a postnatálnej vývojovej štúdii
u potkanov pri dávkach produkujúcich toxicitu u matky počas gestácie a/alebo laktácie vandetanib zvýšil stratu pred narodením a znížil postnatálny rast mláďat. Vandetanib sa vylúčil do mlieka
u potkanov a zistil sa v plazme mláďat po podaní dávky laktujúcim potkanom.
Karcinogenita
Štúdie karcinogenity s vandetanibom sa neuskutočnili.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadrotablety
Dihydrát hydrogenfosforečnanu vápenatého
Mikrokryštalická celulóza
Krospovidón (typ A) Povidón (K 29-32) Magnéziumstearát
Filmový obal
Hypromelóza
Makrogol (300)
Oxid titaničitý (E171)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti4 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote neprevyšujúcej 30°C.
6.5 Druh obalu a obsah baleniaPVC/PVDC/Al blistre uzatvorené hliníkovou fóliou, pričom každý obsahuje 30 filmom obalených tabliet.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAstraZeneca AB
S-151 85 Södertälje
Švédsko
8. REGISTRAČNÉ ČÍSLO9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu
1
. NÁZOV LIEKU
Caprelsa 300 mg filmom obalené tablety
2. KVALITATÍVNE A KVANTITATÍVNE ZLOŽENIE Každá filmom obalená tableta obsahuje 300 mg vandetanibu. Úplný zoznam pomocných látok, pozri časť 6.1.
3. LIEKOVÁ FORMA
Filmom obalená (tableta)
Oválne, dvojito vypuklé, biele filmom obalené tablety s potlačou „Z300“ na jednej strane.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikácie
Caprelsa je indikovaná na liečbu agresívneho a symptomatického medulárneho karcinómu štítnej žľazy (MTC) u pacientov s neresekovateľným lokálne pokročilým alebo metastázujúcim ochorením.
U pacientov, u ktorých stav RET(Rearranged during transfection) mutácie nie je známy, alebo je negatívny, je potrebné vziať do úvahy menší úžitok predtým, než sa rozhodne o individuálnej liečbe (pozri dôležité informácie v častiach 4.4 a 5.1).
4.2 Dávkovanie a spôsob podávania
Liečbu má začať a monitorovať lekár so skúsenosťami v liečbe MTC a v používaní protirakovinových liekov a tiež skúsený v hodnotení elektrokardiogramu (EKG).
Na jeden predpis je povolená len jedna dávka. Na ďalšiu dávku je potrebný nový predpis. Dávkovanie
Odporúčaná dávka je jedna 300 mg tableta jedenkrát denne užívaná s jedlom alebo bez jedla približne
v rovnakom čase.
Pri vynechaní dávky sa má dávka užiť hneď, ako si pacient na to spomenie. Ak do nasledujúcej dávky je menej ako 12 hodín, pacient nemá užívať vynechanú dávku. Pacienti nemajú užívať dvojnásobnú dávku (dve dávky súčasne), aby nahradili zabudnutú dávku.
Pacienti liečení s Caprelsou musia dostať pohotovostnú kartu pacienta a musia byť informovaní o rizikách Caprelsy (pozri tiež písomnú informáciu pre používateľov).
Trvanie
Vandetanib sa môže podávať, pokiaľ je liečba prospešná pre pacientov s MTC.
Úpravy dávky
Pred začiatkom liečby sa má starostlivo zmerať QTc interval. V prípade nežiaducich udalostí bežných terminologických kritérií (common terminology criteria for adverse events CTCAE) 3. stupňa, alebo
vyššej toxicity, alebo predĺženého QTc intervalu na EKG sa má dávkovanie vandetanibu aspoň
dočasne prerušiť a znovu pokračovať so zníženou dávkou po ústupe toxicity alebo zlepšení na CTCAE
1. stupňa (pozri časť 4.4). Denná dávka 300 mg sa môže znížiť na 200 mg (dve 100 mg tablety),
a potom na 100 mg, ak je to potrebné. Pacienta je potrebné primerane sledovať. Nežiaduce reakcie vrátane predĺženého QTc intervalu nemusia odznieť rýchlo vzhľadom na polčas 19 dní (pozri
časť 4.4).
Osobitné skupiny pacientov
Deti a dospievajúci
Bezpečnosť a účinnosť u detí neboli stanovené. Preto vandetanib nie je indikovaný pre používanie u pediatrických pacientov.
Starší pacienti
U starších pacientov nie je potrebná žiadna úprava počiatočnej dávky. S používaním vandetanibu u pacientov s MTC vo veku nad 75 rokov sú k dispozícii obmedzené klinické údaje.
Porucha funkcie obličiek
Farmakokinetická štúdia u dobrovoľníkov s miernou, stredne závažnou a závažnou poruchou funkcie obličiek preukázala, že po jednej dávke vandetanibu sa jeho expozícia zvýšila 1.5, 1.6 a 2-násobne
v uvedenom poradí u pacientov s miernou, stredne závažnou (klírens kreatinínu ≥ 30 až <50ml/min)
a závažnou (klírens pod 30 ml/min) poruchou funkcie obličiek na začiatku štúdie (pozri časť 5.2). Klinické údaje naznačujú, že nie je potrebná žiadna zmena v počiatočnej dávke u pacientov s miernou poruchou funkcie obličiek. U pacientov so stredne závažnou poruchou funkcie obličiek sú obmedzené údaje s 300 mg dávkou: túto dávku bolo potrebné znížiť na 200 mg u 5 zo 6 pacientov Počiatočná dávka sa má znížiť na 200 mg u pacientov so stredne závažnou poruchou funkcie obličiek; avšak bezpečnosť a účinnosť 200 mg dávky nebola stanovená (pozri časť 4.4). Vandetanib sa neodporúča
pre použitie u pacientov so závažnou poruchou funkcie obličiek, pretože existujú len obmedzené údaje u pacientov so závažnou poruchou funkcie obličiek, a bezpečnosť a účinnosť neboli stanovené.
Porucha funkcie pečene
Vandetanib sa neodporúča používať u pacientov s poruchou funkcie pečene (sérový bilirubín vyšší ako
1,5-násobok horného limitu normálnej hodnoty), pretože u pacientov s poruchou funkcie pečene sú k dispozícii obmedzené údaje a bezpečnosť a účinnosť sa nepreukázala (pozri časť 4.4).
Farmakokinetické údaje od dobrovoľníkov naznačujú, že u pacientov s miernou, stredne závažnou alebo závažnou poruchou funkcie pečene sa nevyžaduje žiadna zmena počiatočnej dávky (pozri časť 5.2).
Spôsob podania
Pre pacientov, ktorí majú ťažkosti s prehĺtaním, sa môžu tablety vandetanibu rozpustiť v pol pohári nesýtenej pitnej vody. Iné tekutiny sa nemajú používať. Tableta sa má vložiť do vody, nedrviť, miešať až do rozptýlenia (približne 10 minút) a výsledná disperzia sa má okamžite prehltnúť. Všetky zvyšky
v pohári sa majú zmiešať s polovicou pohára vody a prehltnúť. Tekutina sa môže podávať aj nazogastrickou alebo gastrostomickou sondou.
4.3 Kontraindikácie
• Precitlivenosť na liečivo alebo na ktorúkoľvek z pomocných látok.
• Kongenitálny syndróm dlhého QTc.
• Pacienti s intervalom QTc nad 480 msec.
• Súčasné užívanie vandetanibu s nasledovnými liekmi, o ktorých je známe, že tiež predlžujú QTc interval a/alebo indukujú torsades de pointes: Arzén, cisaprid, erytromycín intravenózne (IV), toremifén, mizolastín, moxifloxacín, antiarytmiká triedy IA a III (pozri časť 4.5).
• Dojčenie (pozri časť 4.6).
4.4 Osobitné upozornenia a opatrenia pri používaní
S ohľadom na hroziace riziká je dôležité limitovať liečbu vandetanibom len na pacientov, ktorí ju skutočne potrebujú, t.j. so symptomaticko- agresívnym priebehom ochorenia. Ani symptomatické
a ani progresívne ochorenie samostatne nie je dostatočné na potrebu liečby vandetanibom. Miera zmien hladín biomarkerov ako kalcitonín (CTN) a/alebo karcinoembryonálny antigén (CEA) ako aj miera zmeny objemu tumoru počas čakania pod dohľadom môže pomôcť identifikovať nielen pacientov, ktorí potrebujú liečbu, ale aj optimálny čas na začatie liečby vandetanibom.
Predĺženie QTc a torsades de pointesVandetanib v dávke 300 mg sa spájal so značnou a od koncentrácie závislou prolongáciou QTc
(priemer 28 msec, medián 35 msec). Prvá prolongácia QTc sa objavovala najčastejšie počas prvých
3 mesiacov liečby, ale možnosť prvého objavenia sa bola aj po tomto čase. Polčas vandetanibu
(19 dní) robí túto prolongáciu QTc intervalu obzvlášť problematickou (pozri časť 4.8). Pri dávke
300 mg denne sa pri MTC pozorovalo potvrdené predĺženie QTc nad 500 msec na EKG a to u 11%
pacientov v štúdii fázy III. Zdá sa, že predĺženie QTc na EKG je závislé od dávky.
Torsades de pointes a ventrikulárna tachykardia boli mimoriadne hlásené u pacientov užívajúcich 300 mg
vandentanibu denne. Riziko
torsades môže byť zvýšené u pacientov s dysbalanciou elektrolytov (pozri
časť 4.8).
Liečba vandetanibom sa nesmie začať u pacientov, u ktorých EKG QTc interval je dlhší ako 480 ms. Vandetanib sa nemá sa podávať pacientom, ktorí majú v anamnéze
torsades de pointes, pokiaľ sa neupravia všetky rizikové faktory, ktoré prispievajú k
torsades. Vandentanib sa neskúmal u pacientov s ventrikulárnymi arytmiami, ani s nedávnym infarktom myokardu.

Na začiatku liečby, 1, 3, 6 a 12 týždňov po začatí liečby a potom každé 3 mesiace po dobu najmenej jedného roka sa má sledovať EKG a hladiny sérového draslíka, vápnika a horčíka a tyreotropného hormónu (TSH). Tento plán sa má vzťahovať na obdobie po znížení dávky a po prerušení dávky po dobu viac ako dva týždne kvôli predĺženiu QTc. Počas tohto obdobia a v prípade klinickej indikácie aj neskôr sa majú uskutočniť EKG a krvné vyšetrenia. Je potrebné pokračovať v častom sledovaní QTc intervalu na EKG.
Hladina sérového draslíka, sérového horčíka a sérového vápnika sa má udržiavať v rámci normálneho rozmedzia, aby sa znížilo riziko predĺženia QTc intervalu na EKG. Prídavné monitorovanie QTc, elektrolytov a renálnych funkcií sa zvlášť vyžaduje v prípade hnačky, zvýšenia dehydratácie z hnačky, elektrolytovej dysbalancie a/alebo oslabených renálnych funkcií. Ak sa QTc výrazne zvýši, ale zostáva pod 500 ms, odporúča sa poradiť s kardiológom.
Podávanie vandetanibu s látkami, o ktorých je známe, že predlžujú EKG QTc interval je kontraindikované alebo sa neodporúča (pozri časť 4.3 a 4.5).
Súbežné použitie vandentanibu s ondansetronom sa neodporúča, (pozri časť 4.5).
U pacientov, u ktorých sa vyvinula jedna hodnota QTc intervalu ≥ 500 ms, sa má prerušiť užívanie vandetanibu. Podávanie dávky sa môže opätovne začať v zníženej dávke po potvrdenom obnovení QTc intervalu na úroveň pred liečbou a urobila sa korekcia nerovnováhy elektrolytov.
Syndróm posteriórnej reverzibilnej encefalopatie, PRES (Syndróm reverzibilnej posteriórnejleukoencefalopatie-RPLS)PRES je syndróm subkortikálneho vazogénneho edému diagnostikovaného pomocou MRI mozgu,
ktorý sa zriedkavo pozoroval pri liečbe vandetanibom v kombinácii s chemoterapiou. PRES sa tiež pozoroval u pacientov užívajúcich vandetanib v monoterapii. Na tento syndróm je potrebné myslieť u každého pacienta, u ktorého sa objavia záchvaty, bolesť hlavy, poruchy zraku, zmätenosť alebo
zmenené mentálne funkcie. MRI mozgu sa má urobiť u každého pacienta so záchvatmi, zmätenosťou alebo zmenenými mentálnymi funkciami.
Stav RET mutácie (Rearranged during transfection)Pacienti bez RET mutácie môžu mať znížený prospech z liečby vandetanibom a pomerprínos/riziko pre túto skupinu pacientov sa preto môže líšiť od skupiny s RET mutáciou.Predtým, než sa individuálne rozhodne o liečbe u pacientov, u ktorých by stav RET mutácie
m
ohol byť
negatívny, je potrebné vziať do úvahy nižší prínos a použitie vandetanibu sa mástarostlivo zvážiť s ohľadom na riziká súvisiace s liečbou. A preto sa odporúča testovanie naRET mutáciu. Pre stanovenie stavu RET mutácie, ak je to možné, sa radšej majú získať vzorkytkaniva v čase začatia liečby, ako v čase diagnózy (pozri časti 4.1 a 5.1).
Ko
ž
né reakcie
U pacientov, ktorí užívali vandetanib, sa pozorovala vyrážka a iné kožné reakcie (vrátane fotosenzitívnych reakcií a syndrómu palmárno-plantárnej erytrodyzestézie).
Mierne až stredne závažné kožné reakcie sa dajú zvládnuť symptomatickou liečbou alebo znížením dávky, prípadne prerušením podávania. Závažnejšie kožné reakcie (ako je Stevensov-Johnsonov
syndróm) si môžu vyžadovať podanie systémových glukokortikoidov a permanentné vysadenie vandetanibu.
Pri vystavení slnečnému žiareniu je potrebná opatrnosť a to nosením ochranného odevu a/alebo použitím opaľovacieho krému z dôvodu potenciálneho rizika fototoxických reakcií v súvislosti
s liečbou vandetanibom.
Hnačka
Hnačka je príznakom ochorenia, ako aj známy nežiaduci účinok vandentanibu. Na liečbu hnačky sa odporúčajú bežné antidiaroiká. Častejšie sa majú sledovať QTc a sérové elektrolyty. Ak sa vyvinie závažná hnačka (CTCAE 3.-4. stupňa), podávanie vandetanibu sa má zastaviť, až kým sa príznaky hnačky nezlepšia. Po zlepšení sa môže liečba začať opätovne v zníženej dávke (pozri časti 4.2 a 4.8).
Hemorágia
Opatrnosť s užívaním vandetanibu je potrebná u pacientov s metastázami mozgu, pretože bola hlásená intrakraniálna hemorágia.
Zlyhanie srdca
U pacientov užívajúcich vandetanib bolo pozorované zlyhanie srdca. U pacientov so zlyhaním srdca môže byť nevyhnutné dočasné alebo trvalé prerušenie liečby. Zlyhanie nemusí byť reverzibilné po
vysadení vandetanibu. Niektoré prípady boli fatálne.
Hypertenzia
U pacientov liečených vandetanibom sa pozorovala hypertenzia vrátane hypertenznej krízy. Pacientov je potrebné sledovať kvôli hypertenzii a v prípade potreby hypertenziu liečiť. Ak nie je možné vysoký
krvný tlak zvládnuť vhodnou liečbou, vandetanib sa nemá znovu nasadiť, kým nie je krvný tlak kontrolovaný liekmi. Môže byť nevyhnutné zníženie dávky (pozri časť 4.8).
Porucha funkcie obličiek
Vandetanib sa neodporúča pre používanie u pacientov so stredne závažnou alebo závažnou poruchou funkcie obličiek, pretože existujú len obmedzené údaje a bezpečnosť a účinnosť neboli stanovené
(pozri časť 4.2, 5.1 a 5.2).
Porucha funkcie pečene
Vandetanib sa neodporúča pre používanie u pacientov s poruchou funkcie pečene (sérový bilirubín vyšší ako 1,5-násobok horného limitu normálnej hodnoty), pretože u pacientov s poruchou funkcie
pečene sú k dispozícii obmedzené údaje a bezpečnosť a účinnosť sa nestanovili. Farmakokinetické
údaje od dobrovoľníkov naznačujú, že u pacientov s miernou, stredne závažnou alebo závažnou poruchou funkcie pečene sa nevyžaduje žiadna zmena počiatočnej dávky (pozri časti 4.2 a 5.2).
Zvýšenie alanínaminotransferázy
U pacientov liečených vandetanibom sa často pozorovalo zvýšenie alanínaminotransferázy. Väčšina zvýšení ustúpila pri pokračovaní liečby, ostatné zvyčajne ustúpili po 1-2-týždňovom prerušení liečby.
Odporúča sa pravidelné sledovanie alanínaminotransferázy.
Intersticiálna pľúcna choroba
Intersticiálna pľúcna choroba (interstitial lung disease – ILD) sa pozorovala u pacientov užívajúcich vandetanib a niektoré prípady boli fatálne. Ak sa u pacienta zistia respiračné symptómy, ako je dyspnoe, kašeľ a horúčka, liečba vandetanibom sa má prerušiť a začať okamžité vyšetrenie. Ak sa potvrdí ILD, vandetanib sa má natrvalo vysadiť a pacienta je potrebné primerane liečiť.
Induktory CYP3A4
Súbežnému používaniu vandetanibu so silnými induktormi CYP3A4 (ako je rifampicín, ľubovník bodkovaný, karbamazepín, fenobarbital) sa treba vyhýbať (pozri časť 4.5).
CTN menej ako 500 pg/ml
Prínos vandetanibu u pacientov s CTN menej ako 500 pg/ml nebol stanovený, preto sa má použitie u pacientov s CTN < 500 pg/ml starostlivo zvážiť vzhľadom na riziká súvisiace s liečbou vandetanibom.
Pohotovostná karta pacienta
Všetci lekári predpisujúci Caprelsu sa musia oboznámiť s informáciami pre lekárov
a so smernicami, ktoré sa týkajú liečby. Lekár musí prediskutovať riziká liečby Caprelsou
s pacientom. Pacientovi bude poskytnutá Pohotovostná karta pacienta pri každom predpise.
4.5 Liekové a iné interakcie
Farmakokinetické interakcie
Vplyv vandetanibu na iné lieky
Údaje in vitro naznačujú, že vandetanib je stredne silný induktor CYP3A4. Keďže sa neuskutočnili žiadne klinické interakčné štúdie, je potrebná opatrnosť pri kombinácii vandetanibu so substrátmi
CYP3A4, najmä estrogestagénmi, imunosupresívami ako cyklosporín alebo takrolimus, alebo
antineoplastickými látkami, ako je docetaxel a bortezomib.
Vandetanib je slabý inhibítor efluxnej pumpy P-glykoproteínu (P-gp). Súbežné podávanie vandetanibu a liekov vylučovaných prostredníctvom P-gp, ako je dabigatran alebo digoxín, môže viesť k zvýšeným plazmatickým koncentráciám týchto liekov. Pacienti užívajúci dabigatran alebo digoxín a vandetanib môžu vyžadovať zvýšený klinický a biologický dozor a primeranú úpravu dávky, ak je potrebné.
Vandetanib je inhibítor transportéru organických katiónov 2 (OCT2). Z toho dôvodu môže mať vandetanib potenciál znižovať elimináciu liekov, o ktorých je známe, že sú vylučované prostredníctvom OCT2 a zvyšovať expozíciu pacienta na tieto lieky. Metformín je substrát OCT2 a pacienti, ktorí užívajú vandetanib a metformín (alebo iný substrát OCT2) môžu vyžadovať dôkladnejšie sledovanie a možnú úpravu dávky metformínu.
Účinok inhibítorov protónovej pumpy na gastrointestinálnu absorpciu vandetanibu nebol stanovený. Vandetanib preukazuje rozpustnosť závislú od pH; preto súbežné podávanie vandetanibu s inhibítormi protónovej pumpy môže znížiť expozíciu pacienta vandetanibu. Súčasné užívanie s touto
terapeutickou triedou liekov sa preto neodporúča .
Vplyv iných liekov na vandetanib
V klinickej štúdii uskutočnenej u zdravých dobrovoľníkov súbežné podávanie vandetanibu
(jednorazová dávka 300 mg) s itrakonazolom (opakované dávky 200 mg jedenkrát denne), silným inhibítorom CYP3A4, zvyšuje plazmatickú expozíciu vandetanibu približne o 9%. Keďže dávka itrakonazolu bola nižšia ako minimálna odporúčaná dávka na inhibíciu CYP3A4, (t.j. 400 mg jedenkrát denne), pri kombinácii itrakonazolu a iných silných inhibítorov CYP3A4 (napr. ketokonazolu, ritonaviru a klaritromycínu) s vandetanibom je potrebná opatrnosť.
V klinickej štúdii uskutočnenej so zdravými mužmi sa expozícia vandetanibu znížila o 40%, keď sa podával spolu so silným induktorom CYP3A4, rifampicínom. Preto sa treba vyhýbať podávaniu vandetanibu s rifampicínom a inými silnými induktormi CYP3A4 (napr. karbamazepínom, fenobarbitalom a ľubovníkom bodkovaným) (pozri časť 4.4).
Farmakodynamické interakcie
Biliárna exkrécia nezmeneného vandetanibu je jednou z ciest vylučovania pre vandetanib. Vandetanib
nie je substrátom viacliekového rezistentného proteínu 2 (MRP2), p-glykoproteínu (Pgp) ani proteínu rezistencie rakoviny prsníka (BCRP).
Lieky, o ktorých je známe, že predlžujú QTc interval
Preukázalo sa, že vandetanib predlžuje QTc interval na EKG; mimoriadne boli hlásené torsades de pointes. Preto súbežné používanie vandetanibu s liekmi, o ktorých je známe, že tiež predlžujú QTc interval a/alebo indukujú torsades de pointes je buď kontraindikovaná, alebo sa v závislosti od existujúcej alternatívnej terapie neodporúča.
• Kontraindikované kombinácie (pozri časť 4.3): Cisaprid, erytromycín intravenózne (IV), toremifén, mizolastín, moxifloxacín, arzén, antiarytmiká triedy IA a III.
• Neodporúčané kombinácie: Metadon, haloperidol, amisulprid, chlorpromazín, sulpirid, zuklopentixol, halofantrín, pentamidín a lumefantrín.
Ak nie je k dispozícii žiadna vhodná alternatívna liečba, neodporúčané kombinácie s vandetanibom sa môžu urobiť s prídavným EKG za sledovania QTc intervalu zhodnotením elektrolytov a kontrolou objavenia sa alebo zhoršenia hnačky.
Výsledky farmakodynamickej a farmakokinetickej interakčnej štúdie naznačili, že súbežné podávanie ondansetrónu u zdravých pacientov má pravdepodobné malý vplyv na farmakokinetiku vandetanibu, má však malý aditívny účinok na predĺženie QTc intervalu približne o 10 ms. Preto sa súbežné užívanie vandetanibu a ondansetronu neodporúča. Ak sa ondansetrón podáva s vandetanibom vyžaduje sa starostlivé sledovanie sérových elektrolytov a je potrebné agresívne zvládnutie všetkých abnormalít.
Antagonisty vitamínu K
Z dôvodu zvýšeného trombotického rizika u pacientov s karcinómom je používanie antikoagulačnej
terapie časté. S ohľadom na vysokú interindividuálnu variabilitu odpovede na antikoaguláciu a na možnosť interakcie medzi antagonistami vitamínu K a chemoterapiou sa odporúča zvýšená frekvencia
sledovania INR (International Normalised Ratio), ak sa rozhodne o liečbe pacienta s antagonistami
vitamínu K.
4.6 Fertilita, gravidita a laktácia
Ženy vo fertilnom veku
Ženy vo fertilnom veku majú používať účinnú antikoncepciu počas liečby a najmenej 4 mesiace po poslednej dávke.
Gravidita
Je iba obmedzené množstvo údajov o použití vandetanibu počas gravidity. Ako sa očakáva z jeho farmakologického pôsobenia, preukázalo sa, že vandetanib má významné účinky na všetky štádiá
reprodukcie u samíc potkanov (pozri časť 5.3).
Ak sa vandetanib používa počas gravidity alebo ak pacientka otehotnie počas užívania vandetanibu, má byť oboznámená s potenciálnymi abnormalitami plodu alebo stratou tehotenstva. Liečba
u gravidných žien má pokračovať len v prípade, že potenciálny prínos pre matku prevýši riziko pre plod.
Dojčenie
Nie sú k dispozícii žiadne údaje o použití vandetanibu u dojčiacich žien. Vandetanib a/alebo jeho metabolity sa vylučujú do mlieka u potkanov a zistili sa v plazme mláďat po podaní dávky laktujúcim
potkanom (pozri časť 5.3).
Dojčenie je počas liečby vandetanibom kontraindikované.
FertilitaU potkanov nemal vandetanib žiadny vplyv na fertilitu samcov, ale poškodil fertilitu samíc (pozri
časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeNeuskutočnili sa žiadne štúdie na stanovenie účinkov vandetanibu na schopnosť viesť vozidlá
a obsluhovať stroje. Zaznamenala sa však únava a rozmazané videnie a tí pacienti, u ktorých sa tieto symptómy vyskytnú, majú byť opatrní pri vedení vozidla alebo obsluhe strojov.
4.9 Nežiaduce účinkyCelkový súhrn nežiaducich liekových reakciíNajčastejšie zaznamenané nežiaduce liekové reakcie boli hnačka, vyrážka, nauzea, hypertenzia
a bolesť hlavy.
Nežiaduce liekové reakcie počas klinických skúšaníNasledujúce nežiaduce reakcie boli identifikované v klinických štúdiách u pacientov užívajúcich vandetanib ako liečbu MTC. Ich frekvencia je uvedená v tabuľke 1 nežiaduce liekové reakcie pomocou klasifikácie frekvencie Rady pre medzinárodné organizácie lekárskych vied (CIOMS III) (Council for International Organizations of Medical Sciences) a potom vymenovaná podľa tried orgánových systémov (TOS) MedDRA a v uprednostňovanom termíne a podľa klasifikácie frekvencie. Frekvencie výskytu nežiaducich účinkov sú definované nasledovne: veľmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); menej časté (≥ 1/1 000 až < 1/100); zriedkavé (≥ 1/10 000 až < 1/1 000); veľmi zriedkavé (< 1/10 000) a neznáme (nemôžu sa odhadovať z dostupných údajov). Táto časť zahŕňa len údaje pochádzajúce z ukončených štúdií, u ktorých je známa expozícia pacienta.'
Tabuľka 1 Nežiaduce liekové reakcie a trieda orgánových systémov
|
Trieda orgánových systémov
| Veľmi časté
| Časté
| Menej časté
|
Infekcie a nákazy
| Nazofaryngitída,
bronchitída, infekcie horného dýchacieho
traktu, infekcie
močových ciest
| Pneumónia, sepsa,
chrípka, cystitída, sinusitída, laryngitída,
folikulitída, furunkuly,
plesňové infekcie, pyelonefritída
| Apendicitída,
stafylokokové infekcie,
divertikulitída,
celulitída, absces brušnej steny
|
Poruchy
endokrinného systému
|
| Hypotyreóza
|
|
Poruchy metabolizmu
a výživy
| Znížená chuť do jedla,
hypokalciémia
| Hypokaliémia,
hyperkalciémia, hyperglykémia,
dehydratácia,
hyponatriémia
| Podvýživa
|
Psychické poruchy
| Insomnia, depresia
| Úzkosť
|
|
Poruchy nervového
systému
| Bolesť hlavy, parestézia,
dyzestézia, závraty
| Triaška, letargia, strata
vedomia, poruchy rovnováhy,
dysgeúzia
| Kŕče, klonus, edém
mozgu
|
Poruchy oka
| Rozmazané videnie,
štrukturálne zmeny rohovky (vrátane
depozitov rohovky
| Porucha videnia, vidina
svätožiary, fotopsia, glaukóm, konjunktivitída,
suché oko, keratopatia
| Sivý zákal, poruchy
akomodácie
|
|
a očný zákal)
|
|
|
Poruchy srdca a
srdcovej činnosti
|
Predĺženie QTc intervalu
na EKG(*) (**)
|
|
Zlyhanie srdca,
akútne zlyhanie srdca,
rýchlosť a poruchy
srdcového rytmu, poruchy srdcového vedenia, komorová arytmia a zástava srdca
|
Poruchy ciev
|
Hypertenzia
|
Hypertenzná kríza,
ischemické cerebrovaskulárne ochorenia
|
|
Poruchy dýchacej
sústavy, hrudníka a mediastína
|
|
Epistaxa, hemoptýza,
pneumónia
|
Respiračné
zlyhanie, aspiračná pneumónia
|
Poruchy
gastrointestinálneho traktu
|
Bolesť brucha, hnačka,
nauzea, vracanie, dyspepsia
|
Kolitída, sucho v ústach,
stomatitída, dysfágia, zápcha, gastritída,
krvácanie do zažívacieho
traktu
|
Pankreatitída,
peritonitída, ileus, perforácia čreva,
inkontinencia stolice
|
Poruchy pečene
a žlčových ciest
|
|
Cholelitiáza
|
|
Poruchy kože a
podkožného tkaniva
|
Fotosenzitívna reakcia,
vyrážka a iné kožné reakcie (vrátane akné,
suchej kože, dermatitídy,
pruritu), poruchy nechtov
|
Syndróm palmárno-
plantárnej erytrodyzestézie, alopécia
|
Bulózna dermatitída
|
Poruchy obličiek a
m
očových ciest
|
Proteinúria, nefrolitiáza
|
Dyzúria, hematúria,
zlyhanie obličiek, polakizúria, naliehavosť
močenia
|
Chromatúria, anúria
|
Celkové poruchy a
reakcie v mieste podania
|
Asténia, únava, bolesť
edém
|
Pyrexia
|
Zhoršené hojenie
|
Laboratórne a
funkčné vyšetrenia
|
Predĺženie QT intervalu
na EKG
|
Zvýšenie sérovej ALT a
AST, zníženie telesnej hmotnosti, zvýšenie
kreatinínu v krvi
|
Zvýšenie
hemoglobínu, zvýšenie sérovej
amylázy
|
*13,4% pacientov liečených vandetanibom mali QTc (Bazettov) ≥500 ms v porovnaní s 1% placebom
liečených pacientov. QTcF prolongácia > 20 ms bola u viac než 91% pacientov, > 60 ms u 35%,
> 100 ms u 1,7% pacientov. Osem percent pacientov malo zníženú dávku z dôvodu predĺženia QTc intervalu.
** zahŕňa dva prípady úmrtia pacientov s QTc > 550 ms (jeden z dôvodu sepsy a druhý z dôvodu srdcového zlyhania).
Udalosti ako sú
torsades de pointes, Stevensov-Johnsonov syndróm, multiformný erytém, intersticiálna pľúcna choroba (niekedy fatálna) a PRES (RLPS)sa vyskytovali u pacientov liečených monoterapiou vandetanibom. Očakáva sa, že tieto nežiaduce reakcie budú menej časté u pacientov užívajúcich vandetanib na liečbu MTC.
Očné udalosti ako je rozmazané videnie sú časté u pacientov, ktorí dostávajú vandetanib na liečbu MTC. Plánované vyšetrenia pomocou štrbinovej lampy odhalili korneálne opacity (vortex keratopatie) u liečených pacientov; bežné vyšetrenia pomocou štrbinovej lampy sa však u pacientov užívajúcich vandetanib nevyžadujú.
U pacientov liečených vandentanibom vzrástli priemerné hladiny hemoglobínu o 0,5-1,5 g/dl v porovnaní s východiskovou hodnotou v rôznych časoch expozície.
4.9 Predávkovanie
Špecifická liečba v prípade predávkovania vandetanibom nie je dispozícii a možné symptómy predávkovania sa nestanovili. Po viacnásobných dávkach 300 mg alebo vyšších v štúdiách so zdravými dobrovoľníkmi a s pacientmi sa pozorovalo zvýšenie frekvencie a závažnosti niektorých nežiaducich reakcií, ako je vyrážka, hnačka a hypertenzia. Okrem toho je potrebné vziať do úvahy možné predĺženie QTc intervalu a torsades de pointes.
Nežiaduce reakcie súvisiace s predávkovaním sa majú liečiť symptomaticky; predovšetkým treba liečiť vhodnou liečbou závažnú hnačku. V prípade predávkovania sa musí prerušiť podávanie ďalších dávok a je potrebné prijať vhodné opatrenia na zabezpečenie, aby sa nevyskytovali nežiaduce udalosti, t.j. EKG v priebehu 24 hodín na určenie predĺženia QTc intervalu. Nežiaduce účinky súvisiace s predávkovaním môžu byť predĺžené z dôvodu dlhého polčasu vandentanibu (pozri časť 5.2).
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: antineoplastické látky, inhibítory proteínkinázy, ATC kód: L01XE12
Spôsob účinku
Vandetanib je silný inhibítor receptoru 2 pre vaskulárny endotelový rastový faktor (vascular endothelial growth factor receptor-2 - VEGFR-2, tiež známeho ako receptor obsahujúci kinázovú vloženú doménu (kinase insert domain containing receptor - [KDR]), receptor epidermálneho rastového faktora (epidermal growth factor receptor - EGFR) a RET tyrozín kinázy . Vandetanib je tiež submikromolárny inhibítor vaskulárneho endotelového receptora-3 tyrozínkinázy.
Vandetanib inhibuje migráciu, proliferáciu, prežívanie endotelových buniek stimulovaných VEGF
a tvorbu nových krvných ciev v in vitro modeloch angiogenézy. Okrem toho vandetanib inhibuje EGF
receptor tyrozínkinázy stimulovaný epidermálnym rastovým faktorom (epidermal growth factor - EGF) v nádorových bunkách a endotelových bunkách. Vandetanib inhibuje EGFR-dependentnú proliferáciu buniek a prežívanie buniek in vitro. Vandetanib tiež inhibuje obe formy RET, divokého typu aj väčšinu mutovaných, aktivovaných foriem RET a významne inhibuje proliferáciu bunkových línií MTC in vitro.
Podávanie vandetanibu in vivo znížilo angiogenézu indukovanú nádorovými bunkami, permeabilitu ciev nádoru a hustotu mikrociev nádoru a inhibovalo rast nádoru a metastázy u ľudských modelov xenoimplantátov nádorov u atymických myší. Vandetanib tiež inhibuje rast xenoimplantátov nádorov MTC in vivo.
Presný mechanizmus účinku vandetanibu u lokálne pokročilého a metastatického MTC nie je známy. Klinické údaje týkajúce sa MTC
Na posúdenie bezpečnosti a účinnosti 300 mg vandetanibu oproti placebu sa uskutočnila randomizovaná, dvojito zaslepená, placebom kontrolovaná štúdia (štúdia 58). Táto štúdia zahŕňala
331 pacientov s neresekovateľným lokálne pokročilým alebo metastázujúcim MTC. Boli zahrnutí len
pacienti s CTN ≥ 500 pg/ml (obvyklé jednotky) alebo ≥ 146,3 pmol/l (medzinárodné štandardné jednotky). Spomedzi pacientov zaradených do štúdie malo 10 pacientov užívajúcich vandetanib
a 4 pacienti užívajúci placebo (4% všetkých pacientov) skóre výkonnostného stavu podľa svetovej zdravotníckej organizácie (WHO PS) ≥ 2 a 28 (12,1%) pacientov užívajúcich vandetanib a 10 (10,1%) užívajúcich placebo malo srdcovú poruchu. Srdcová porucha bola definovaná ako pacienti
s predchádzajúcou kardiovaskulárnou anomáliou.
Primárny cieľ tejto štúdie bol určený na stanovenie zlepšenia prežívania bez progresie (progression- free survival - PFS) pri vandetanibe v porovnaní s placebom. Sekundárne koncové ukazovatele boli hodnotenie celkovej miery objektívnej odpovede (objective response rate - ORR), miera kontroly ochorenia (disease control rate -DCR), čiastočná odpoveď (partial response - PR) alebo kompletná odpoveď (complete response - CR) alebo stabilizácia ochorenia (stable disease - SD) trvajúca minimálne 24 týždňov, trvanie odpovede (duration of response - DOR), čas do zhoršenia bolesti na základe stupnice najhoršej bolesti podľa Krátkeho inventára bolesti (Brief Pain Inventory – BPI)
a celkové prežívanie (ovreall survivall - OS). Primárny koncový ukazovateľ PFS, ORR a DCR
vychádzali z centralizovaného, nezávislého zaslepeného posúdenia zobrazovacích údajov. Biochemická odpoveď s vandetanibom v porovnaní s placebom meraná CTN a CEA sa tiež hodnotila ako sekundárny koncový ukazovateľ.
Pacienti boli liečení vandetanibom alebo placebom, až kým nedosiahli objektívnu progresiu ochorenia. Po objektívnej progresii ochorenia na základe posúdenia skúšajúceho pacienti prerušili liečbu
v zaslepenej štúdii a dostali možnosť užívať nezaslepený vandetanib. Dvadsaťosem z 231 pacientov
(12,1%) užívajúcich vandetanib a 3 z 99 (3,0%) užívajúcich placebo vysadili liečbu z dôvodu nežiaducej udalosti. Štrnásť z 28 pacientov (50%), ktorí skončili s užívaním vandetanibu z dôvodu nežiaducej udalosti, ukončilo liečbu bez zníženia dávky. Päť zo 6 pacientov (83%) so stredne ťažkou poruchou funkcie obličiek, ktorí sa liečili vandetanibom mali zníženú dávku na 200 mg, 1 pacient vyžadoval ďalšie zníženie na 100 mg.
Výsledok primárnej analýzy PFS preukázal štatisticky významné zlepšenie v PFS pre pacientov randomizovaných pre vandetanib v porovnaní s placebom (pomer rizika (HR – hazard ratio) = 0,46;
95% interval spoľahlivosti (CI – confidence interval) = 0,31-0,69; p = 0,0001).
Medián PFS pre pacientov randomizovaných na vandetanib sa nedosiahol; na základe štatistického modelu údajov pozorovaných až do 43. percentilu sa však predpovedá medián PFS 30,5 mesiacov
s 95% intervalom spoľahlivosti 25,5 až 36,5 mesiacov. Medián PFS pre pacientov randomizovaných pre placebo bol 19,3 mesiacov. Po 12 mesiacoch bol podiel pacientov, ktorí prežili a boli bez progresie
192 (83%) u pacientov randomizovaných na vandetanib a 63 (63%) pre pacientov randomizovaných
na placebo. V ramene s vandetanibom progredovalo celkovo 73 (32%) pacientov; 64 (28%) progresiou podľa kritérií hodnotenia odpovede solídnych tumorov (RECIST) a 9 (4%) úmrtím bez progresie ochorenia. Zvyšných 158 pacientov (68%) bolo cenzurovaných v analýze PFS. V ramene splacebom progredovalo celkovo 51 (51%) pacientov; 46 (46%) progresiou RECIST a 5 (5%) úmrtím bez progresie ochorenia. Zvyšných 49 pacientov (49%) bolo cenzurovaných v analýze PFS.
Obr. 1. Kaplanova Meierova krivka PFS

mesiace
|
0
|
6
|
12
|
18
|
24
|
30
|
36
|
n-vandetanib
|
231
|
196
|
169
|
140
|
40
|
1
|
0
|
n-placebo
|
100
|
71
|
57
|
45
|
13
|
0
|
0
|
vandetanib 300 mg,----------placebo, y-os=PFS, x-os=čas v mesiacoch, n-vandetanib=počet
pacientov v riziku-vandetanib, n-placebo=počet pacientov v riziku-placebo
HR = 0,46, 95% CI (0,36-0,69), p=0,0001
PFS
| N
| Median PFS
| HRa
| 95% CI
| p-hodnota
|
Vandetanib 300 mg 73/231 Nedosiahnutý
(32%) (predpokladaný
30,5 mesiacov) 0,46 0,31; 0,69 0,0001
Placebo 51/100 19,3 mesiacov
(51%)
|
V čase primárnej analýzy PFS zomrelo 48 (15%) pacientov a medzi liečenými skupinami sa nezistil
žiadny významný rozdiel v celkovom prežívaní (HR = 0,89; = 99,98% CI = 0,28 – 2,85; p = 0,712). V čase tejto analýzy zomrelo 32 pacientov (14%) v skupine liečenej vandetanibom a 16 pacientov
(16%) užívajúcich placebo.
Väčšina (95% pacientov) mali metastázy. Štrnásť pacientov liečených s vandetanibom a 3 s placebom mali iba neresektabilné, lokálne pokročilé ochorenie. K dispozícii sú obmedzené klinické skúsenosti
s vandetanibom u pacientov s neoperovateľným lokálne pokročilým ochorením a bez metastáz.
Štatisticky významné výhody sa pozorovali pre vandetanib pre sekundárne koncové ukazovatele miery odpovede, miery kontroly ochorenia a biochemickej odpovede.
Tabuľka 2: Súhrn kľúčových nálezov účinnosti v štúdii 58ORRa
|
|
N
|
Miera odpovede
| ORb
|
95 % CI
|
p-hodnota
|
| Vandetanib 300 mg
| 104/231
| 45%
|
|
|
|
|
|
|
| 5,48
| 2,99; 10,79
| < 0,0001
|
| Placebo
| 13/100
| 13%
|
|
|
|
DCRa
|
|
N
|
Miera odpovede
| ORb
|
95% CI
|
p-hodnota
|
| Vandetanib 300 mg
| 200/231
| 87%
|
|
|
|
|
|
|
| 2,64
| 1,48; 4,69
| 0,001
|
| Placebo
| 71/100
| 71%
|
|
|
|
 CTN Odpoveď N Miera odpovede ORb 95% CI p-hodnota
CTN Odpoveď N Miera odpovede ORb 95% CI p-hodnota
Vandetanib 300 mg
|
160/231
|
69%
|
72,9
|
26,2; 303,2
|
< 0,0001
|
Placebo
|
3/100
|
3%
|
|
|
|
CE
A Odpoveď
|
N
|
M
iera odpovede
|
O
R
b
|
9
5 % CI
|
p
-hodnota
|
Vandetanib 300 mg
|
119/231
|
52%
|
|
|
|
|
|
|
52,0
|
16,0; 320,3
|
< 0,0001
|
Placebo
|
2/100
|
2%
|
|
|
|
a Miera celkovej odpovede = kompletná + čiastočná odpoveď. Miera kontroly ochorenia = miera odpovede + stabilné ochorenie
24 týždňov. Analýza so zámerom liečiť (ITT) zahŕňala pacientov, ktorí dostali nezaslepený vandetanib pred progresiou podľa centrálneho čítania.
b OR = pomer pravdepodobnosti. Hodnota > 1 v prospech vandetanibu. Analýza sa uskutočnila pomocou modelu logistickej regresie s liečbou ako jediným faktorom.
N = počet udalostí/počet randomizovaných pacientov;
Štatisticky významná výhoda sa preukázala pre vandetanib pre sekundárny cieľ čas do zhoršenia bolesti (získaný ako zložený cieľ pri použití najhoršieho skóre bolesti z BPI a pacientom zaznamenané použitie opioidných analgetík)(vandetanib 49%, placebo 57% HR 0,61, 97,5% CI 0,43-0,87, p<0,006:
8 vs. 3 mesiace). Nepozorovali sa žiadne štatisticky významné rozdiely pre výskumný cieľový parameter hnačky (hlásené ako frekvencia stolice).
Stav RET mutácie v štúdii 58V štúdii 58 sa testovanie RET mutácie uskutočnilo použitím polymerázovej reťazovej reakcie (PCR)
na základe (Amplification Refractory Mutation System – ARMS) testu na M918T mutáciu, a priamym sekvenovaním DNA pre mutácie v exónoch 10, 11, 13, 14, 15 a 16 (miesto mutácie M918T) na
všetkých sporadických pacientoch, u ktorých bola DNA k dispozícii (297/298).
Avšak RET stav sa nemohol testovať u veľkej časti pacientov (najmä z dôvodu nedostupných výsledkov priameho sekvenovania DNA) a rýchlosť odpovede bola o niečo nižšia u pacientov
s neznámym stavom RET v porovnaní s pacientami s pozitívnym stavom RET mutácie: 51,8% vs .
35,9%, v uvedenom poradí. V slepom porovnaní vandetanib vs. placebo boli známi iba 2 pacienti, ktorí dostali vandetanib a mali RET negatívny stav vo všetkých 6 exónoch a nepreukázali žiadne
odpovede.
Na základe absencie mutácie M918T sa v kľúčovej štúdii 58 vykonala post-hoc analýza podskupiny s RET negatívnym stavom. Ak ARMS testom bola potvrdená mutácia M918T v nádore, alebo RET mutácia v nejakom sekvenovanom exóne, pacient sa považoval, že má RET mutáciu. V skutočnosti sa u 79 pacientov identifikovala absencia mutácie M918T a nezistila sa žiadna RET mutácia na niektorom z ďalších 6 testovaných exónov, ale u 71 z týchto pacientov sekvenovanie 6 exónov bolo neúplné. U pacientov so sporadickým MTC je mutácia M918T najčastejšie pozorovaná mutácia, ale
nemožno vylúčiť, že niektorí pacienti testovaní na mutáciu M918T RET negatívne môžu byť pozitívni pre mutáciu na ďalších exónoch.
Výsledky podľa RET stavu (pozitívny, neznámy a RET mutačne M918T negatívny ), sú uvedené v tabuľke 3.
 Tabuľka 3: Prehľad výsledkov účinnosti v segmente pacientov podľa stavu RET mutácie
Tabuľka 3: Prehľad výsledkov účinnosti v segmente pacientov podľa stavu RET mutácie
Patienti s dokumentovanou
RET mutáciou
(n=187)
Patienti bez mutácie
M918T
a bez ďalších netestovaných alebo
negatívnych mutácií
(n=79)*

Objektívna rýchlosť

odpovede
52% 35%

(rameno s vandetanibom)
Cieľový parameter účinnosti
PFS HR (95%) interval

spoľahlivosti
0,45 (0,26; 0,78) 0,57 (0.29; 1,13)

* u väčšiny pacientov sa získal stav RET mutácie v čase diagnózy a mohol sa od tej doby zmeniť.
Európska agentúra pre lieky udelila odklad z povinnosti predložiť výsledky štúdií s vandetanibom u jednej alebo viacero vekových podskupín detí a dospievajúcich s dedičným karcinómom štítnej žľazy, pozri časť 4.2 pre informáciu o pediatrickom použití.
Tento liek bol registrovaný s podmienkou. To znamená, že sa očakávajú ďalšie dôkazy o prínosoch tohto lieku.
Európska agentúra pre lieky najmenej raz ročne posúdi nové informácie o lieku a tento súhrn
charakteristických vlastností podľa potreby aktualizuje.
5.2 Farmakokinetické vlastnostiAbsorpciaPo perorálnom podaní vandetanibu je absorpcia pomalá a maximálne plazmatické koncentrácie sa zvyčajne dosahujú s mediánom 6 hodín, rozmedzie 4-10 hodín, po podaní dávky. Vandetanib sa kumuluje približne 8-násobne po viacnásobnom podaní, pričom rovnovážny stav sa dosahuje od približne 2 mesiacov.
DistribúciaVandetanib sa viaže na ľudský sérový albumín a alfa-1-kyslý glykoproteín s väzbou na proteíny
in vitro približne 90%. V plazmatických vzorkách
ex vivo od pacientov s kolorektálnym karcinómom po
expozícii 300 mg jedenkrát denne v rovnovážnom stave bolo priemerné percento väzby na proteíny
93,7% (rozmedzie 92,2 až 95,7%). Farmakokinetika vandetanibu pri dávke 300 mg u MTC pacientov sa vyznačuje distribučným objemom približne 7 450 l.
BiotransformáciaPo perorálnom podaní 14C-vandetanibu sa v plazme, moči a stolici zistil nezmenený vandetanib
a metabolity vandetanib N-oxid a N-dezmetyl-vandetanib. Glukuronidový konjugát sa pozoroval ako menej významný metabolit len v exkrementoch. N-dezmetyl-vandetanib sa tvorí predovšetkým pôsobením CYP3A4 a vandetanib-N-oxid monooxygenázovými enzýmami (FM01 a FM03) obsahujúcimi flavín. N-dezmetyl-vandetanib a vandetanib-N-oxid cirkulujú v koncentráciách ~11%
a 1,4% koncentrácií vandetanibu.
ElimináciaFarmakokinetika vandentanibu pri dávke 300 mg u pacientov s MTC sa vyznačujú klírens ~13,2 l/h, a plazmatickým polčasom približne 19 dní. V priebehu 21-dňového obdobia odberu vzoriek po jednorazovej dávke 14C-vandetanibu, ~69 % sa vylúčilo a to 44% v stolici a 25% v moči. Vylučovanie dávky bolo pomalé a ďalšie vylučovanie sa očakáva na základe plazmatického polčasu aj dlhšie ako
21 dní.
Osobitné skupiny pacientovPorucha funkcie obličiekFarmakokinetická štúdia s jednorazovou dávkou u dobrovoľníkov ukázala, že expozícia vandetanibu je zvýšená (až 1,5 ,1,6 a 2-násobne) u osôb s miernou,stredne závažnou a ťažkou poruchou funkcie obličiek v uvedenom poradí, v porovnaní s osobami s normálnou funkciou obličiek (pozri
časti 4.2, 4.4 a 4.5).
Porucha funkcie pečene
Farmakokinetická štúdia s jednorazovou dávkou u dobrovoľníkov naznačila, že porucha pečene neovplyvňuje expozíciu vandetanibu. Údaje u pacientov s poruchou funkcie pečene (sérový bilirubín vyšší ako 1,5-násobok horného limitu normálnej hodnoty) sú obmedzené (pozri časti 4.2 a 4.4).
Vplyv jedla
Expozícia vandentanibu nie je ovplyvnená jedlom.
5.3 Predklinické údaje o bezpečnosti
Vandetanib nepreukázal mutagénny ani klastogénny potenciál.
V štúdiách toxicity po opakovanom podaní trvajúcich až do 9 mesiacov účinky zahŕňali emézu, zníženie telesnej hmotnosti a hnačku u psov a dyspláziu rastových platničiek u mladých psov
a potkanov v otvorených rastových platničkách. U potkanov sa zaznamenali účinky na zuby, obličky
a kožu. Tieto nálezy, ktoré sa vyskytovali v klinicky významných plazmatických koncentráciách, boli väčšinou reverzibilné v priebehu 4 týždňov po skončení podávania dávky a je ich možné pripísať
inhibícii receptora vaskulárneho endotelového rastového faktora (VEGFR) alebo EGFR.
Účinky pozorované v iných štúdiách zahŕňali inhibíciu ľudského génu „ether-a-go-go“ závislého génu (hERG) a predĺženie QTc intervalu u psov. Zvýšenie systolického a diastolického krvného tlaku sa pozoroval u potkanov a psov. Preukázalo sa, že u myší vandetanib oneskoril hojenie rán, nezabraňoval mu však. Tiež sa preukázalo, že vandetanib má fototoxický potenciál v hodnotení cytotoxicity in vitro. Vo zvieracom modeli hojenia rán u myší, ktoré dostávali vandetanib, sa znížila odolnosť kože voči prasknutiu v porovnaní s kontrolami. To naznačuje, že vandetanib spomaľuje hojenie rán, ale nebráni hojeniu. Vhodný interval medzi vysadením vandetanibu a následným elektívnym chirurgickým zákrokom potrebným na zabránenie rizikám poruchy hojenia rán sa nestanovil. V klinických štúdiách podstúpil malý počet pacientov chirurgický zákrok počas užívania vandetanibu a komplikácie pri hojení rán sa nezaznamenali.
Reprodukčná toxikológia
Vandetanib nemal žiadny vplyv na fertilitu samcov potkanov. V štúdii fertility samíc sa zaznamenala tendencia k zvýšenej nepravidelnosti estrálneho cyklu, mierne zníženie výskytu gravidity a zvýšenie implantačnej straty. V štúdii toxicity po opakovanom podaní u potkanov sa zaznamenalo zníženie počtu žltých teliesok v ováriách potkanov, ktorí dostávali vandetanib po dobu 1 mesiaca.
U potkanov bola zjavná embryofetálna toxicita ako fetálna strata, oneskorený fetálny vývoj, anomálie srdcových ciev a skorá osifikácia niektorých kostí lebky. V pre- a postnatálnej vývojovej štúdii
u potkanov pri dávkach produkujúcich toxicitu u matky počas gestácie a/alebo laktácie vandetanib zvýšil stratu pred narodením a znížil postnatálny rast mláďat. Vandetanib sa vylúčil do mlieka
u potkanov a zistil sa v plazme mláďat po podaní dávky laktujúcim potkanom.
Karcinogenita
Štúdie karcinogenity s vandetanibom sa neuskutočnili.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Jadrotablety
Dihydrát hydrogenfosforečnanu vápenatého
Mikrokryštalická celulóza
Krospovidón (typ A) Povidón (K 29-32) Magnéziumstearát
Filmový obal
Hypromelóza
Makrogol (300)
Oxid titaničitý (E171)
6.2 InkompatibilityNeaplikovateľné.
6.3 Čas použiteľnosti4 roky.
6.4 Špeciálne upozornenia na uchovávanieUchovávajte pri teplote neprevyšujúcej 30°C.
6.5 Druh obalu a obsah baleniaPVC/PVDC/Al blistre uzatvorené hliníkovou fóliou, pričom každý obsahuje 30 filmom obalených tabliet.
6.6 Špeciálne opatrenia na likvidáciuŽiadne zvláštne požiadavky.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAstraZeneca AB
S-151 85 Södertälje
Švédsko
8. REGISTRAČNÉ ČÍSLO9. DÁTUM PRVEJ REGISTRÁCIE/ PREDĹŽENIA REGISTRÁCIE10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu