
, pozri časť 6.6.
Je bezpodmienečne nutné, aby sa injekcia nepodávala intraarteriálne alebo intravenózne.
Tak ako aj pri iných liekoch podávaných podkožnou injekciou, miesta vpichu sa majú pravidelne meniť.
4.3 KontraindikácieLiek CAMCEVI je kontraindikovaný u žien a u pediatrických pacientov.
Precitlivenosť na liečivo, na iné agonisty GnRH alebo na ktorúkoľvek z pomocných látok uvedených v časti 6.1.
U pacientov, ktorí v minulosti podstúpili orchiektómiu (tak ako iné agonisty GnRH, ani leuprorelín
nespôsobuje ďalší pokles hladiny testosterónu v sére v prípade chirurgickej kastrácie).
Ako monoterapia u pacientov s karcinómom prostaty s tlakom na miechu alebo preukázanými
metastázami v chrbtici (pozri tiež časť 4.4).
4.4 Osobitné upozornenia a opatrenia pri používaníAndrogénovádeprivačnáliečbamôžepredlžovaťintervalQTPred začiatkom liečby leuprorelínom má lekár zvážiť pomer prínosu a rizika, vrátane rizika Torsade de pointes, u pacientov s rizikovými faktormi predĺženia intervalu QT v anamnéze a u pacientov súbežne užívajúcich lieky, ktoré môžu predlžovať interval QT (pozri časť 4.5). Malo by sa zvážiť pravidelné monitorovanie EKG a koncentrácie elektrolytov.
Kardiovaskulárne ochoreniaU mužov bolo v súvislosti s používaním agonistov GnRH hlásené zvýšené riziko vzniku infarktu myokardu, náhlej srdcovej smrti a mŕtvice. Na základe hlásenej miery pravdepodobnosti sa riziko výskytu zdá byť nízke a pri rozhodovaní o liečbe pacientov s karcinómom prostaty sa má hodnotiť dôkladne súčasne s kardiovaskulárnymi rizikovými faktormi. U pacientov užívajúcich agonisty GnRH sa majú sledovať príznaky a prejavy naznačujúce rozvoj kardiovaskulárnych ochorení a pacienti majú byť liečení v súlade so súčasnými klinickými odporúčaniami.
PrechodnézvýšenietestosterónuLeuprorelín, rovnako ako iné agonisty GnRH, spôsobuje počas prvého týždňa liečby prechodné zvýšenie sérových koncentrácií testosterónu, dihydrotestosterónu a kyslej fosfatázy. Pacienti môžu pociťovať zhoršenie existujúcich príznakov alebo výskyt nových príznakov, vrátane bolesti v kostiach, neuropatie, hematúrie či obštrukcie močovodu alebo vývodu močového mechúra (pozri časť 4.8).
Tieto príznaky zvyčajne ustupujú s pokračujúcou liečbou.
Má sa zvážiť dodatočné podávanie príslušného antiandrogénu 3 dni pred začiatkom liečby leuprorelínom a počas prvých dvoch až troch týždňov liečby. Bolo hlásené, že takýto postup predchádza následkom úvodného zvýšenia hladiny sérového testosterónu.
Liečba leuprorelínom po chirurgickej kastrácii nevedie u mužských pacientov k ďalšiemu zníženiu
hladiny sérového testosterónu.
Denzita kostíU mužov po orchiektómii alebo u mužov liečených agonistami GnRH bolo v lekárskej literatúre popísané rednutie kostí (pozri časť 4.8).
Antiandrogénová liečba významne zvyšuje riziko fraktúr z dôvodu osteoporózy. Sú dostupné len obmedzené údaje týkajúce sa tohto problému. Fraktúry z dôvodu osteoporózy boli pozorované u 5 % pacientov po 22 mesiacoch farmakologickej androgénovej deprivačnej liečby a u 4 % pacientov po 5 až 10 rokoch liečby. Riziko fraktúr z dôvodu osteoporózy je zvyčajne vyššie ako riziko patologických fraktúr.
Okrem dlhotrvajúceho nedostatku testosterónu vplývajú na rozvoj osteoporózy aj vyšší vek, fajčenie, konzumácia alkoholických nápojov, obezita a nedostatočná fyzická aktivita.
Apoplexia hypofýzyPočas sledovania lieku po jeho uvedení na trh bola po podaní agonistov GnRH v zriedkavých prípadoch hlásená apoplexia hypofýzy (klinický syndróm súvisiaci s infarktom hypofýzy), vyskytujúca sa prevažne v priebehu 2 týždňov a v niektorých prípadoch počas prvej hodiny. V týchto prípadoch sa apoplexia hypofýzy prejavila ako prudké bolesti hlavy, vracanie, poruchy videnia, oftalmoplégia, zmeny psychického stavu a v niektorých prípadoch kardiovaskulárny kolaps. V takom prípade sa vyžaduje neodkladná lekárska starostlivosť.
Hyperglykémia a diabetesU mužov, ktorí dostávali agonisty GnRH, bola hlásená hyperglykémia a zvýšené riziko vzniku diabetu. Hyperglykémia môže byť prejavom rozvoja diabetu mellitus alebo zhoršenia kontroly glykémie u pacientov s diabetom. U pacientov liečených agonistami GnRH sa majú pravidelne sledovať hladiny glukózy a/alebo glykozylovaného hemoglobínu (HbA1c) v krvi a má sa postupovať v súlade so súčasnými odporúčaniami pre liečbu hyperglykémie alebo diabetu.
KŕčeU pacientov liečených leuprorelínom, u ktorých sa v minulosti vyskytovali aj nevyskytovali predispozičné faktory, bol po uvedení lieku na trh zaznamenaný výskyt kŕčov (pozri časť 4.8). Pri výskyte kŕčov sa má postupovať podľa aktuálnej klinickej praxe.
Idiopatická intrakraniálna hypertenzia:U pacientov liečených leuprorelínom bola hlásená idiopatická intrakraniálna hypertenzia (pseudotumor cerebri). Pacientov treba upozorniť na prejavy a príznaky idiopatickej intrakraniálnej hypertenzie, vrátane závažnej alebo opakujúcej sa bolesti hlavy, porúch zraku a tinitu. Ak sa idiopatická intrakraniálna hypertenzia vyskytne, má sa zvážiť ukončenie liečby leuprorelínom.
Iné udalostiPri liečbe agonistami GnRH boli pozorované prípady obštrukcie močovodu a kompresie miechy, ktoré sa môžu podieľať na paralýze s fatálnymi komplikáciami alebo bez nich. Ak sa objavia komplikácie, ako kompresia miechy alebo porucha funkcie obličiek, má sa začať štandardná liečba týchto komplikácií.
Pacienti s vertebrálnymi metastázami a/alebo metastázami v mozgu rovnako ako pacienti s
obštrukciou močových ciest majú byť počas prvých týždňov liečby dôkladne sledovaní.
4.5 Liekové a iné interakcieNeuskutočnili sa žiadne farmakokinetické štúdie interakcií s inými liekmi. Neexistujú žiadne hlásenia
o interakcii leuprorelínu s inými liekmi.
Nakoľko androgénová deprivačná liečba môže predlžovať interval QT, má sa dôkladne zvážiť súbežné používanie leuprorelínu s liekmi, o ktorých je známe, že predlžujú interval QT, alebo liekmi, ktoré môžu vyvolať Torsade de pointes, ako antiarytmiká triedy IA (napr. chinidín, disopyramid) alebo
triedy III (napr. amiodarón, sotalol, dofetilid, ibutilid), metadón, moxifloxacín, antipsychotiká a ďalšie
(pozri časť 4.4).
4.6 Fertilita, gravidita a laktáciaLiek CAMCEVI je kontraindikovaný u žien.
Na základe poznatkov zo štúdií na zvieratách a mechanizmu účinku môže leuprorelín narušiť plodnosť samcov s reprodukčným potenciálom (pozri časť 5.3).
4.7 Ovplyvnenie schopnosti viesť vozidlá a obsluhovať strojeLieky obsahujúce leuprorelín majú mierny vplyv na schopnosť viesť vozidlá a obsluhovať stroje. Podávanie tohto lieku môže spôsobiť únavu, závraty a poruchy videnia (pozri časť 4.8). Pacientov treba upozorniť, aby neviedli vozidlá ani neobsluhovali stroje, ak sa u nich tieto nežiaduce reakcie objavia.
4.8 Nežiaduce účinkySúhrn bezpečnostnéhoprofiluNežiaduce reakcie pozorované u liekov obsahujúcich leuprorelín sú väčšinou spôsobené špecifickým
farmakologickým pôsobením leuprorelínu, najmä zvyšovaním a znižovaním hladiny určitých hormónov. Najčastejšie hlásené nežiaduce reakcie sú návaly tepla, nevoľnosť, únava, malátnosť a dočasné lokálne podráždenie v mieste vpichu. Mierne alebo stredne silné návaly tepla sa vyskytujú približne u 58 % pacientov.
TabuľkovýzoznamnežiaducichreakciíPočas klinických skúšaní s liekmi obsahujúcimi leuprorelín na injekčné podanie boli u pacientov s pokročilým karcinómom prostaty hlásené nasledujúce nežiaduce účinky. Nežiaduce účinky sú klasifikované podľa frekvencie výskytu ako veľmi časté (≥ 1/10), časté (≥ 1/100, < 1/10), menej časté (≥ 1/1 000, < 1/100), zriedkavé (≥ 1/10 000, < 1/1 000) a veľmi zriedkavé (< 1/10 000), neznáme (z dostupných údajov).
Infekcie a nákazy
|
| časté
| zápal sliznice nosohltana
| menej časté
| infekcia močovej sústavy, lokálne infekcie kože
| Poruchy krvi a lymfatického
systému
|
| časté
| hematologické zmeny, anémia
| Poruchy metabolizmu a výživy
|
| menej časté
| zhoršenie diabetu mellitus
| Psychické poruchy
|
|
|
|
Tabuľka 1: Nežiaduce účinky hlásené v súvislosti s liekmi obsahujúcimi leuprorelín na injekčné podanie
menej časté abnormálne sny, depresia, zníženie pohlavnej túžby
Poruchy nervového systémumenej časté závrat, bolesť hlavy, hypoestézia, nespavosť, poruchy vnímania chuti, poruchy čuchu, vertigo
zriedkavé abnormálne mimovoľné pohyby
neznáme idiopatická intrakraniálna hypertenzia (pseudotumor
cerebri) (pozri časť 4.4)
Poruchy srdcamenej časté predĺženie intervalu QT (pozri časti 4.4 a 4.5), infarkt
myokardu (pozri časť 4.4)
Poruchy cievveľmi časté návaly tepla
menej časté hypertenzia, hypotenzia zriedkavé synkopa, kolaps
Poruchy dýchacej sústavy,hrudníka a mediastínamenej časté výtok z nosa, dyspnoe neznáme intersticiálne ochorenie pľúc
Poruchy gastrointestinálnehotraktučasté nevoľnosť, hnačka, gastroenteritída/kolitída menej časté zápcha, sucho v ústach, dyspepsia, vracanie zriedkavé flatulencia, eruktácia
Poruchy kože a podkožnéhotkanivaveľmi časté podliatiny, erytém
časté pruritus, nočné potenie
menej časté lepkavosť kože, zvýšené potenie zriedkavé alopécia, kožné vyrážky
Poruchy kostrovej a svalovejsústavy a spojivového tkanivačasté artralgia, bolesť končatín, myalgia, zimnica, slabosť menej časté bolesť chrbta, svalové kŕče
Poruchy obličiek a močovýchciestčasté znížená frekvencia močenia, ťažkosti s močením,
dyzúria, noktúria, oligúria
menej časté spazmus močového mechúra, hematúria, zvýšená frekvencia močenia, retencia moču
Poruchy reprodukčnéhosystému a prsníkovčasté citlivosť prsníkov, atrofia semenníkov, bolesť v semenníkoch, neplodnosť, hypertrofia prsníkov, erektilná dysfunkcia, zmenšená veľkosť penisu
menej časté gynekomastia, impotencia, poruchy semenníkov zriedkavé bolesť v prsníkoch
Celkové poruchy a reakcie v mieste podaniaveľmi časté únava, pálenie v mieste vpichu, parestézia v mieste vpichu
časté malátnosť, bolesť v mieste vpichu, hematóm v mieste vpichu, štípanie v mieste vpichu
menej časté svrbenie v mieste vpichu, zatvrdnutie v mieste vpichu,
letargia, bolesť, pyrexia
zriedkavé ulcerácia v mieste vpichu
veľmi zriedkavé nekróza v mieste vpichu
Laboratórne a funkčné vyšetrenia
|
|
časté
| zvýšená hladina kreatinínfosfokinázy v krvi, predĺžený
čas koagulácie
|
menej časté
| zvýšená hladina alanínaminotransferázy, zvýšená hladina
triglyceridov v krvi, predĺžený protrombínový čas, zvýšená hmotnosť
|
PopisvybranýchnežiaducichreakciíĎalšie nežiaduce účinky zvyčajne hlásené v spojitosti s podávaním leuprorelínu zahŕňajú periférny edém, embóliu pľúc, palpitácie, bolesť svalov, zmeny citlivosti kože, svalovú slabosť, triašku, vyrážku, amnéziu a poruchy videnia. Pri dlhodobom podávaní liekov tejto skupiny bola pozorovaná atrofia svalov. Po podaní krátkodobo alebo dlhodobo účinných agonistov GnRH bol zriedkavo pozorovaný infarkt v mieste adenom hypofýzy. Zriedkavo boli hlásené prípady trombocytopénie a leukopénie. Boli pozorované zmeny glukózovej tolerancie.
Po podaní analógov agonistov GnRH boli hlásené kŕče (pozri časť 4.4).
Lokálne nežiaduce účinky hlásené po podaní injekcie liekov obsahujúcich leuprorelín sú podobné lokálnym nežiaducim účinkom vyskytujúcim sa pri podobných podkožne podávaných liekov. Zvyčajne sú tieto lokálne nežiaduce účinky po podaní podkožnej injekcie mierne a majú krátke trvanie.
Anafylaktické/anafylaktoidné reakcie boli hlásené zriedkavo po podaní analógov agonistov GnRH.
Zmeny hustoty kostíV lekárskej literatúre sú hlásené prípady zníženej hustoty kostí u mužov po orchiektómii alebo u
mužov, ktorí boli liečení analógom GnRH. Je možné predpokladať, že dlhodobá liečba leuprorelínom môže vykazovať nárast príznakov osteoporózy. Podrobnejšie informácie týkajúce sa zvýšeného rizika fraktúr z dôvodu osteoporózy sú uvedené v časti 4.4.
Exacerbácia prejavov a príznakov ochoreniaLiečba leuprorelínom môže počas prvých niekoľko týždňov spôsobiť exacerbáciu prejavov a príznakov
ochorenia. Ak dôjde k zhoršeniu stavu, ako napríklad metastáz v chrbtici a/alebo obštrukcii močovej sústavy či hematúrii, môžu nastať neurologické komplikácie, akými sú slabosť a/alebo parestézia dolných končatín alebo zhoršenie príznakov močovej sústavy.
Kl i ni cké s kúse nosti týk aj úce s a lokál nej kožnej znášanl i vostí l i eku CAM CEVI V hlavnej štúdii FP01C-13-001 bola hodnotená lokálna kožná znášanlivosť lieku CAMCEVI z hľadiska
štyroch aspektov: svrbenie, erytém, pálenie a štípanie. Zo 137 subjektov, ktorým boli podávané podkožne injekcie lieku CAMCEVI, nevykazovala väčšina subjektov po podaní injekcie žiadne alebo len mierne podráždenie kože. Hlásené lokalizované príhody boli prevažne mierne až stredne závažné a odzneli.
HláseniepodozrenínanežiaducereakcieHlásenie podozrení na nežiaduce reakcie po registrácii lieku je dôležité. Umožňuje priebežné

monitorovanie pomeru prínosu a rizika lieku. Od zdravotníckych pracovníkov sa vyžaduje, aby hlásili akékoľvek podozrenia na nežiaduce reakcie na národné centrum hlásenia uvedené v
Prílohe V.4.9 PredávkovanieLeuprorelín nemá potenciál k abúzu a úmyselné predávkovanie je nepravdepodobné.
Z klinickej praxe neboli hlásené žiadne prípady abúzu alebo predávkovania leuprorelínom, ak však dôjde k nadmernej expozícii, odporúča sa pacienta sledovať a začať podpornú symptomatickú liečbu.
5. FARMAKOLOGICKÉ VLASTNOSTI5.1 Farmakodynamické vlastnostiFarmakoterapeutická skupina: endokrinná liečba, analógy hormónu uvoľňujúceho gonadotropín; ATC
kód: L02AE02
Mechanizmus účinkuLeuprorelín mesilát je syntetický nonapeptidový agonista prirodzene sa vyskytujúceho hormónu
GnRH, ktorý u mužov inhibuje hypofyzárnu sekréciu gonadotropínu a potláča tvorbu steroidov
v semenníkov, ak sa podáva trvale. Tento účinok je po prerušení liečby reverzibilný. Hoci má agonista väčší účinok ako prirodzený hormón, čas obnovenia hladín testosterónu môže byť u jednotlivých
pacientov rôzny.
Farmakodynamické účinkyPodávanie leuprorelínu vyvoláva počiatočné zvýšenie hladiny cirkulujúceho luteinizačného hormónu
(LH) a folikulostimulačného hormónu (FSH), čo u mužov vedie k prechodnému zvýšeniu hladiny
gonádových steroidov, testosterónu a dihydrotestosterónu. Trvalé podávanie leuprorelínu vedie k
zníženiu hladiny LH a FSH. U mužov sa hladina testosterónu zníži pod hladinu kastračného prahu (≤
50 ng/dl).
Po prvej dávke leuprorelínu sa priemerná sérová koncentrácia testosterónu prechodne zvýšila, potom v priebehu 3–4 týždňov klesla pod hladinu kastračného prahu (≤ 50 ng/dl) a pri 6-mesačnom podávaní lieku sa udržiavala pod hladinou kastračného prahu (obrázok 1 nižšie).
Dlhodobé skúšania preukázali, že pokračovanie v liečbe udržuje hladinu testosterónu pod kastračným prahom po dobu až 7 rokov a pravdepodobne už natrvalo.
Počas programu klinických skúšaní nebola priamo meraná veľkosť nádoru, bola však pozorovaná nepriama prospešná odpoveď nádoru, čo dokazuje 97 % pokles priemernej hladiny PSA pri podávaní leuprorelínu.
Vo fáze III randomizovaného klinického skúšania zahŕňajúceho 970 pacientov s lokálne pokročilým karcinómom prostaty (najmä pacientov s ochorením klinického štádia T2c až T4 a niekoľko pacientov s patologickým ochorením regionálnych uzlín klinického štádia T1c až T2b), z ktorých 483 bolo zaradených do skupiny s krátkodobou androgénovou deprivačnou liečbou (6 mesiacov) v kombinácii s rádioterapiou a 487 do skupiny s dlhodobou liečbou (3 roky), bola pri analýze non-inferiority porovnávaná krátkodobá konkomitantná a adjuvantná hormonálna liečba agonistami GnRH (triptorelínom alebo goserelínom) oproti dlhodobej liečbe. Celková päťročná mortalita bola 19,0 % vo
skupine s krátkodobou liečbou a 15,2 % vo skupine s dlhodobou liečbou. Pozorovaný pomer rizík 1,42 s horným jednostranným 95,71 % intervalom spoľahlivosti 1,79 alebo obojstranným 95,71 % intervalom spoľahlivosti 1,09; 1,85 (p = 0,65 pre non-inferioritu) ukazuje, že kombinácia rádioterapie so šesťmesačnou androgénnou depriváciou má za následok kratšie prežívanie v porovnaní s rádioterapiou spolu s androgénnou depriváciou trvajúcou 3 roky. Celkové prežívanie po 5 rokoch dlhodobej liečby je 84,8 % a prežívanie po krátkodobej liečbe je 81,0 %. Celková kvalita života hodnotená pri použití dotazníka kvality života QLQ-C30 sa významne nelíšila medzi týmito dvoma skupinami (P = 0,37). Vo výsledkoch prevládajú údaje populácie pacientov s lokálne pokročilými nádormi.
Dôkazy pre indikáciu u vysoko rizikového lokalizovaného karcinómu prostaty sú založené na publikovaných štúdiách rádioterapie kombinovanej s analógmi GnRH, vrátane leuprorelínu. Boli analyzované klinické dáta z piatich publikovaných štúdií (EORTC 22863, RTOG 85-31, RTOG 92-02, RTOG 8610 a D’Amico et al., JAMA, 2004), ktoré všetky preukazujú prínos kombinácie analógu GnRH a rádioterapie. Pre indikácie lokálne pokročilého karcinómu prostaty a vysoko rizikového
lokalizovaného karcinómu prostaty nebolo možné v publikovaných štúdiách jasne rozlíšiť príslušné skúšané skupiny.
Klinické údaje ukazujú, že rádioterapia a následná 3-ročná androgénna deprivácia sú vhodnejšie ako rádioterapia s následnou 6-mesačnou androgénnou depriváciou. Podľa štandardných liečebných postupov je pre pacientov s ochorením klinického štádia T3–T4 liečených rádioterapiou odporúčaná dĺžka liečby formou androgénnej deprivácie 2–3 roky.
Kl i ni ck á účinnosť a bez pečnosť CAMCEVIMulticentrická jednoramenná otvorená 48-týždňová štúdia fázy 3 skúmajúca leuprorelín
zahŕňala 137 pacientov mužského pohlavia s vysokorizikovým lokalizovaným a lokálne pokročilým karcinómom prostaty, ktorý vyžadoval androgénovú deprivačnú liečbu. Účinnosť
lieku (dve dávky podané s odstupom 24 týždňov) sa hodnotila podľa percenta subjektov,
u ktorých bola koncentrácia testosterónu v sére znížená na hladinu kastračného prahu, účinku na
hladinu LH v sére ako meradla pro kontrolu hladiny testosterónu a účinku na hladinu PSA v
sére. Percento pacientov s hladinou testosterónu v sére pod kastračným prahom (≤ 50 ng/dl) do
28. dňa, bolo 98,5 % (135 zo 137 pacientov; randomizovaných podľa pôvodného liečebného
zámeru) a 99,2% (123 zo 124 subjektov; liečených podľa protokolu), (obrázok 1).
Obrázok 1:
Priemerná koncentrácia testosterónu v sére pri liečbe s CAMCEVI v priebehu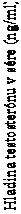 času (n = 124; populácia liečená podľa protokolu)
času (n = 124; populácia liečená podľa protokolu)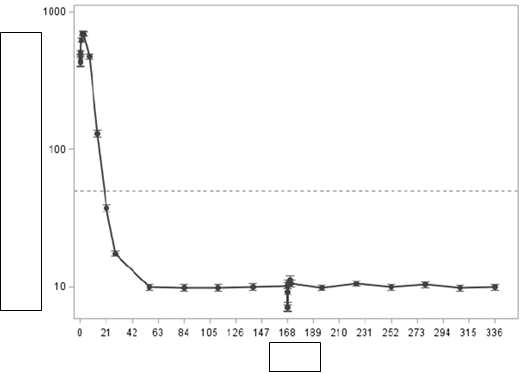
Dni
Prerušovaná čiara označuje kastračnú hladinu (50 ng/dl) testosterónu v sére.
Po podaní prvej injekcie došlo k významnému znížení priemernej hladiny LH v sére a tento účinok trval až do konca štúdie (pokles oproti východiskovému stavu o 98 % [336. deň]).
V tejto štúdii nebola priamo meraná veľkosť nádoru, ale u leuprorelínu možno predpokladať nepriamu prospešnú odpoveď nádoru, ako ukazuje významné zníženie priemerné hladiny PSA v priebehu času
po podaní injekcie tohto lieku (priemerná hodnota 70 ng/ml vo východiskovom stave sa 168. deň znížila na priemernú minimálnu hodnotu 2,6 ng/ml [populácia liečená podľa protokolu].
Pediatrická populácia
Európska agentúra pre lieky udelila výnimku z povinnosti predložiť výsledky štúdií s referenčným liekom obsahujúcim leuprorelín vo všetkých podskupinách pediatrickej populácie pre karcinóm prostaty (informácie o použití v pediatrickej populácii, pozri časť 4.2).'
5.2 Farmakokinetické vlastnostiAbsorpciaPo podaní prvej a druhej dávky leuprorelínu bolo pozorované počiatočné rýchle zvýšenie koncentrácie
leuprorelínu v sére, po ktorom počas prvých 3 dní po podaní dávky nasledovalo rýchle zníženie: po počiatočnej fáze „prudkého zvýšenia“, charakterizovaného priemernou koncentráciou leuprorelínu v
sére 99,7 ng/ml približne po 3,7 hodinách a 93,7 ng/ml po 3,8 hodinách po podaní dávky, bola
priemerná hladina leuprorelínu v sére počas každého 24-týždňového dávkovacieho intervalu i naďalej pomerne nemenná, pričom dochádzalo k nepretržitému uvoľňovaniu leuprorelínu aj tretí deň po
podaní dávky pri zachovaní stabilnej koncentrácie v sére (fáza „plató“) až do 24. týždňa (približne 6-
mesačného) dávkovacieho intervalu (priemerná koncentrácia: 0,37 až 2,97 ng/ml). Nič nenasvedčuje tomu, že by pri opakovanom podávaní leuprorelínu v 24-týždňových intervaloch dochádzalo
k nadmernému hromadeniu lieku v tele.
Po počiatočnom prudkom zvýšení koncentrácie leuprorelínu po podaní CAMCEVI nasleduje rýchle zníženie na ustálenú hladinu.
Na obrázku 2 (štúdia FP01C-13-001; II. časť) je znázornený farmakokinetický/farmakodynamický (podľa hladiny testosterónu v sére) profil leuprorelínu oproti hladine testosterónu v sére pozorovaný po podaní počiatočnej injekcie CAMCEVI (prvá dávka) a v 24. týždni (druhá dávka).
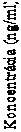 Obrázok 2
Obrázok 2:
Farmakokinetická/farmakodynamická odpoveď na CAMCEVIleuprorelín
testosterón
ČAS (deň)
DistribúciaPriemerný ustálený distribučný objem leuprorelínu po podaní intravenózneho bolusu bol u zdravých
mužských dobrovoľníkov 27 litrov. Väzba na proteíny ľudskej plazmy
in vitro sa pohybovala od 43 %
do 49 %.
MetabolizmusNeboli vykonané žiadne štúdie metabolizmu leuprorelínu.
Eliminácia
U zdravých mužských dobrovoľníkov vykázal 1 mg leuprorelínu podaný ako intravenózny bolus priemerný systémový klírens 8,34 l/h, pričom konečný polčas eliminácie bol na základe dvojkompartmentového modelu približne 3 hodiny.
Neboli vykonané žiadne štúdie exkrécie leuprorelínu.
5.3 Predklinické údaje o bezpečnosti
Predklinické štúdie s leuprorelínom odhalili u oboch pohlaví účinky na reprodukčný systém, ktoré sa na základe známych farmakologických vlastností očakávali. Ukázalo sa, že tieto účinky sú
reverzibilné po ukončení liečby a náležitom období regenerácie. Leuprorelín nevykazoval teratogenitu. U králikov bola v súlade s farmakologickými účinkami leuprorelínu na reprodukčný systém pozorovaná embryotoxicita/letalita.
V súlade s agonistickými účinkami leuprorelínu na GnRH bola u adenohypofýzy potkanov
pozorovaná hyperplázia a adenóm.
Štúdie karcinogenity sa vykonali u potkanov a myší počas 24 mesiacov. U potkanov bol po podkožnom podaní dávok od 0,6 do 4 mg/kg/deň pozorovaný vyšší výskyt apoplexie hypofýzy v závislosti od dávky. Takýto účinok nebol pozorovaný u myší.
V sérii testov in vitro a in vivo nevykazoval leuprorelín mutagénny potenciál.
6. FARMACEUTICKÉ INFORMÁCIE
6.1 Zoznam pomocných látok
Poly(D,L-laktid) N-metylpyrolidón
6.2 Inkompatibility
Neaplikovateľné.
6.3 Čas použiteľnosti
2 roky.
6.4 Špeciálne upozornenia na uchovávanie
Uchovávajte v chladničke (2 ºC – 8 ºC).
Uchovávajte v pôvodnom obale na ochranu pred svetlom.
6.5 Druh obalu a obsah balenia
Jedno balenie obsahuje: 1 naplnenú injekčnú striekačku (z cyklického olefínového kopolyméru, uzavretou brómbutylovým elastomérovým sivým krytom, s piestom a okrajom na uchopenie prstami),
1 ihlu (o veľkosti 1,2 x 16 mm) a 1 chránič ihly Point-Lok.
6.6 Špeciálne opatrenia na likvidáciu a iné zaobchádzanie s liekom
Pred podaním injekcie postupujte podľa pokynov pre správnu prípravu lieku CAMCEVI.
Dôležité: Pred použitím nechajte CAMCEVI dosiahnuť izbovú teplotu (15 °C až 25 °C). Počas
podania sa odporúča použiť rukavice.
CAMCEVI obsahuje:
• Jeden blister obsahujúci:
· jednu sterilnú naplnenú injekčnú striekačku;
· jednu sterilnú ihlu.
• Jeden chránič ihly Point-Lok (nesterilný).
Zostavená naplnená injekčná striekačka, vrátane chrániča ihly Point-Lok:
okraj na uchopenie prstami
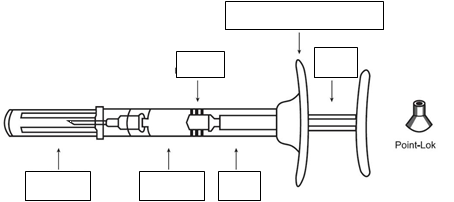
zátka
piest

ihla a kryt liek valec
1. krok – Príprava lieku:Nechajte dosiahnuť izbovú teplotu a skontrolujteobsah· Vyberte CAMCEVI z chladničky.
· Pred použitím nechajte liek CAMCEVI dosiahnuť izbovú teplotu (15 °C až 25 °C), čo môže trvať približne 15 až 20 minút.
· Otvorte škatuľu a vyberte naplnenú injekčnú striekačku s liekom CAMCEVI (A) a ihlu
s nasadeným krytom (B) z blistra a položte
ich na rovnú, čistú a suchú plochu. Skontrolujte celý obsah balenia. Injekčnú striekačku nepoužívajte, ak je ktorákoľvek jej časť poškodená.
· Položte chránič ihly Point-Lok dodaný
s liekom CAMCEVI na pevnú rovnú plochu.
· Skontrolujte čas použiteľnosti na injekčnej striekačke. Po uplynutí času použiteľnosti striekačku nepoužívajte.
· Pred použitím liek vizuálne skontrolujte.
Naplnená injekčná striekačka má obsahovať
takmer bielu až svetložltú viskóznu a
opalizujúcu suspenziu. Injekčnú striekačku nepoužívajte, ak spozorujete, že sú v striekačke cudzorodé častice.
2. krok – Zostavenie injekčnej striekačky:
N
asaďte ihlu · Odstráňte zo striekačky sivý uzáver (A).
· Odskrutkujte priehľadný uzáver zo spodnej
strany ihly (B).
· Nasaďte ihlu (B) na koniec striekačky (A) tak, že ju zatlačíte a potom ňou budete otáčať, dokiaľ nebude pevne nasadená. Ihlu príliš neuťahujte, aby nedošlo k znehodnoteniu závitu a možnému poškodeniu striekačky a úniku lieku. Pokiaľ po príliš silným
utiahnutím ihly dôjde k poškodeniu striekačky, naplnenú injekčnú striekačku s liekom CAMCEVI zlikvidujte.
3. krok – Podanie injekcie:
P
r
i
pravte si miesto vpichu
 P
odajte liek
P
odajte liek
· Vyberte miesto vpichu v hornej alebo strednej
časti brucha, kde je dostatočne mäkké alebo voľné podkožné tkanivo, ktoré nebolo nedávno použité ako miesto vpichu. Miesto vpichu sa má pravidelne meniť.
· Miesto vpichu očistite alkoholovým
tampónom.
NEAPLIKUJTE injekciu do miest so svalovým alebo väzivovým podkožným tkanivom alebo do miest, kde môže dochádzať k treniu alebo stláčaniu kože (napr. opaskom alebo sťahovacou gumou).
· Odstráňte modrý kryt z ihly (B). V mieste vpichu vytvorte jednou rukou kožnú riasu. Zasuňte do nej ihlu pod uhlom 90°, potom

kožnú riasu uvoľnite.
· Pomaly a plynule stláčajte piest a vstreknite celý obsah striekačky pod kožu. Potom ihlu vytiahnete pod rovnakým uhlom 90° ako
počas jej vsunutia.
Je bezpodmienečne nutné, aby sa injekcia
nepodávala intraarteriálne alebo intravenózne.
4. krok – Likvidácia ihly a naplnenej injekčnej striekačky
C
hránič ihly · Nevyťahujte ihlu zo striekačky. Použite priložený chránič ihly Point-Lok, aby nedošlo k poraneniu ihlou.
· Bezprostredne po jej použití zasuňte opatrne nezakrytú ihlu do otvoru v hornej časti chrániča ihly Point-Lok.

· Zasunujte ihlu do otvoru, dokiaľ nebude pevne zasunutá v chrániči ihly Point-Lok. Takto sa celý hrot ihly zakryje a ihla v chrániči pevne uzatvorí.
· Po použití umiestnite použitú striekačku so zakrytou
ihlou do vhodnej nádoby na ostré predmety.
Všetok nepoužitý liek alebo odpad vzniknutý z lieku sa má zlikvidovať v súlade s národnými požiadavkami.
7. DRŽITEĽ ROZHODNUTIA O REGISTRÁCIIAccord Healthcare S.L.U. World Trade Center,
Moll de Barcelona, s/n, Edifici Est 6ª planta,
08039, Barcelona,
Španielsko
8. REGISTRAČNÉ ČÍSLO (ČÍSLA)
EU/1/22/1647/001
9. DÁTUM PRVEJ REGISTRÁCIE/PREDĹŽENIA REGISTRÁCIEDátum prvej registrácie: 24. mája 2022
10. DÁTUM REVÍZIE TEXTUPodrobné informácie o tomto lieku sú dostupné na internetovej stránke Európskej agentúry pre lieky
http://www.ema.europa.eu.